Уже есть полная победа над вич

Ученые всего мира проводят апробацию нового лекарства против вируса иммунодефицита человека. Новые исследования дают возможность утверждать, что уже на протяжении 3-4 год будет создано действенное лекарство от ВИЧ.
На теперешнее время проходит апробация генетического препарата от ВИЧ на животных.
Научные разработки лекарства от ВИЧ

Уже длительное время ведутся разработки лекарства, которое помогло бы победить бич ХХ века — ВИЧ. Эти заболевания входят в список десяти самых опасных болезней, ведь несут угрозу не только жизни инфицированного человека, но и всему человечеству. По официальным данным, установленным ВОЗ, ВИЧ заражено более 60 миллионов жителей планеты, из них около миллиона ежегодно умирает, и еще два миллиона заражается. Но, по мнению медиков, такие данные не соответствуют реальности, ведь по их мнению число зараженных синдромом иммунодефицита намного больше.
Ученые установили, что главной причиной заражения ВИЧ является неумение иммунной системы человека распознать опасный вирус. Поэтому решили именно на генетическом уровне бороться с вирусом. Новое лекарство должно закрыть возможность попасть в клетки организма человека на генетическом уровне. Апробации нового лекарства от ВИЧ уже ведутся на животных в исследовательских лабораториях большинства развитых стан мира. Исследователи обещают, что к 2023 году такое лекарство станет доступным для больных инфицированных ВИЧ.
Исследования российских и зарубежных врачей в борьбе с ВИЧ

Российские научные исследования тоже не остаются вдали от данной проблемы. Уже более 40 лет ведутся разработки лекарства от ВИЧ. До нынешнего времени полностью остановить распространение болезни не удалось. Врачи, как причину этого, называют неэффективность противовирусных препаратов на основе химических веществ, что использовали врачи.
Ученые создали синтетический белок, который должен помочь иммунной системе выявить вирус на стадии попадания в организм человека и разрушить его. Но пока выявлено, что такой метод дает результативность в 70-80%. По другой разработке, вместо белка в диффузор клетки внедряется глутатион, который блокирует ВИЧ еще до его попадания в клетки организма.
Особенностью такой технологии является борьба с вирусом иммунодефицита еще до поражения клеточных тканей. На практике апробация новых лекарств проходят на стволовых клетках человека. Они в пробирке инфицируются, а потом с помощью генетических препаратов блокируются. Врачи решили объединить эти способы борьбы с ВИЧ, чтобы иметь 100% положительный результат.
Теории, что выдвигают причины появления ВИЧ

Причины появления смертельного недуга не установлены до сих пор. Некоторые конспирологи считают, что ВИЧ было создано как биологическое оружие и впервые испытано на африканцах. Но эти сведения так и не нашли подтверждения.
Ученые — исследователи вируса выдвинули несколько теорий, которые бы могли раскрыть занавес тайны его появления и распространения. Согласно одной из них, вирус иммунодефицита людям передали обезьяны. Эту гипотезу выдвинул американский ученый Б. Корбет, который считал, что впервые человек заразился ВИЧ в 30-е годы ХХ века через кровь шимпанзе или гориллы. Во время исследования крови человекообразных обезьян было обнаружено вирус, который имел сходство с ВИЧ. Еще одно исследование подтверждает эту версию, но оно связывает заболевание вирусом иммунодефицита и его распространение с врачебной ошибкой. Английский ученый Хупеор считает, что ВИЧ был создан врачами, которые разработали лекарство от полиомиелита. В 50-е годы основой для создания вакцины от болезни стали клетки печени шимпанзе, именно они и стали возбудителями ВИЧ.
Другие исследователи считают, что СПИД имеет более древний возраст и был известен несколько веков до даты указанной Корбетом. Еще в начале ХХ века венгерский врач выявил у пациента редкий вид опухоли, которая была названа как саркома Капоши.
Несмотря на версии, относительно периода появления вируса, ученные сходятся в одном — болезнь появилась на Африканском континенте.
Спустя 10 лет генетики и вирусологи снова сообщили о том, что одного из ВИЧ-положительных пациентов удалось вылечить. Лайф разбирался, что стоит за этим заявлением и есть ли будущее у такого лечения.
Пациент номер один
История с победой над ВИЧ началась с диагноза американца Тимоти Брауна, проходившего обучение в Германии в середине 90-х. Спустя 10 лет антиретровирусной терапии Браун решился на крайне сложную и дорогую операцию. Её суть заключалась в том, что от донора ВИЧ-инфицированному пациенту, у которого к тому же обнаружили онкологию, "пересаживался" костный мозг с клетками, устойчивыми к вирусу.

Незначительная часть людей рождается с мутацией в гене CCR5, которая позволяет создать невидимую броню для смертельного вируса. После операции в 2007 году и пересадки от донора с мутацией CCR5 Delta 32 "берлинскому пациенту" перестали делать антиретровирусную терапию, и вирус в его организме больше не обнаруживался. При этом Браун перенёс повторную трансплантацию — к ней пришлось прибегнуть после того, как онкология вернулась.
Спасительная мутация долгое время считалась научной выдумкой. В 2013-м обсуждалось агрессивное лечение маленькой девочки, которая родилась с ВИЧ-инфекцией. Считалось, что антиретровирусная терапия в течение 18 месяцев сработала, ведь некоторые анализы действительно давали отрицательный результат. Однако через два года вирус вернулся, и учёные вновь заговорили о том, что вылечить смертельный вирус невозможно. Но Тимоти Браун спокойно живёт без болезни очень долгое время — американцу, пережившему трансплантацию "защиты от ВИЧ", сейчас 53 года.
Пациент номер два
Спорная ситуация вокруг лечения ВИЧ сохранялась вплоть до того момента, пока газета New York Times не сообщила о "лондонском пациенте" — втором человеке, который смог полностью победить смертельную болезнь. Медики не стали изобретать велосипед и пересадили второму добровольцу такой же костный мозг, как и в первом случае. Донором "лондонского пациента" стал человек с мутацией гена CCR5 Delta 32, излечившей Тимоти Брауна от ВИЧ 12 лет назад.
Сообщается, что пересадка костного мозга была проведена ещё в мае 2016 года, а с сентября 2017 года пациент полностью прекратил принимать антиретровирусные препараты. На протяжении более полутора лет пациент находился без терапии, и регулярные анализы не выявили инфицированных клеток. Вирусолог Антон Репин в разговоре с Лайфом отметил, что для достоверности результатов необходимо сравнить динамику болезни с первым в истории науки случаем излечения.
Важно понимать, что даже при таких мутациях человек всё равно может быть носителем вируса, однако сам не будет им болеть.
Результаты могут быть ошибочными сразу по нескольким причинам. Главная — неправильные анализы. Для точности нужно привлечь несколько независимых команд к изучению результатов. Если у всех будет один результат, то это уже другой разговор
Врут или победили?
Осенью 2018 года вирусологи из Университета Мельбурна в Австралии заявили, что комбинация двух противовирусных препаратов помогла организму обезьян избавиться от вируса иммунодефицита, "засевшего" в иммунных клетках. Кроме того, вирусологи заявили, что им удалось предотвратить возвращение болезни. Однако до тестирования препаратов GS-9620 и PGT121 на людях дело, похоже, так и не дошло.

Учёные из Университетского колледжа Лондона заявляют, что им удалось добиться стабильной 18-месячной ремиссии у другого пациента мужского пола. Отмечается, что в 2012 году у анонимного пациента, живущего с ВИЧ более 15 лет, диагностировали лимфому Ходжкина, для лечения которой врачи провели пересадку стволовых клеток от донора с двумя копиями гена-мутанта CCR5 Delta 32. Пациент быстро восстановился после трансплантации и спустя 16 месяцев перестал принимать антиретровирусные препараты. Повторные анализы подтвердили, что РНК вируса в его крови не обнаруживается уже полтора года.
Комментируя такие результаты, учёные отметили, что, скорее всего, "берлинский пациент", на котором испробовали метод пересадки костного мозга, не был аномалией. Однако лечить по такому методу массово пока не получится. Генетик Татьяна Кравцова в беседе с Лайфом отметила, что у такой терапии существует целый ряд проблем.
Главное — это поиск донора. Носителей мутировавших генов по всему миру всего несколько сотен. К тому же нет никаких гарантий, что трансплантация пройдёт успешно. Проводить каждую — всё равно что дирижировать оркестром в тысячу человек
Всего, как сообщает New York Times, в программе особой терапии ВИЧ участвует не менее 40 человек. Исследователи отмечают, что об окончательных результатах говорить рано — прошло слишком мало времени, чтобы делать однозначные выводы. Но даже в том случае, если повторное комбинированное лечение окажется эффективным, массовой терапии ожидать не стоит. В первую очередь — из-за стоимости лечения и нехватки доноров. Стоимость трансплантации костного мозга, по разным данным, составляет около 200 тыс. евро, а число доноров с двумя копиями мутировавшего гена CCR5 больше не становится.
Генетики и вирусологи отмечают, что именно из-за этого любое лечение ВИЧ пока носит экспериментальный характер. Для массовости и полного выздоровления больных придётся придумать более простой и дешёвый способ.

1. Кто же эти счастливчики, которых вылечили от ВИЧ?
В этом гайде мы разберем все три случая подробно.
Попадая в кровь, вирус иммунодефицита человека (ВИЧ) стремится проникнуть в лимфоциты (подробнее об этих процессах читайте в нашем большом гайде здесь). Для того чтобы это сделать, ему необходимо связаться с белковыми рецепторами на поверхности лимфоцита.
В этом процессе важную роль играет ген CCR5, который синтезирует белок-рецептор. Если свойства этого белка меняются, то ВИЧ не сможет попасть в клетку.
Ученым известна природная мутация CCR5 delta 32. Если говорить точнее, то это подвид мутации, который называется делецией. При ней в гене-мутанте отсутствует некоторые участки. Мутация приводит к нарушению синтеза белка CCR5 и либо сильно тормозит развитие ВИЧ в организме человека, при гетерозиготном наследовании мутации (когда носитель гена только один из родителей), либо делает человека практически неуязвимым для вируса, в случае гомозиготного наследования мутации (носители гена – мать и отец одновременно).
3. Получается, ВИЧ можно вылечить с помощью генетической мутации? Как так?
Во всех трех случаях исцеления от ВИЧ речь идет фактически о побочном эффекте от сложной процедуры, применяемой при заболеваниях крови – трансплантации костного мозга (часто это происходит при лечении разновидностей рака). Если донор будет с мутацией CCR5 delta 32, то этот ген можно передать пациенту и таким образом сделать его невосприимчивым к вирусу.
В настоящее время чаще всего используют не пересадку самого костного мозга, а трансплантацию стволовых клеток периферической крови – с тем же эффектом.
Найти донора для данной процедуры сложно: группа крови здесь не имеет никакого значения, главное, – это тканевая совместимость.
Да, причем до этого он долго и тяжело боролся с ВИЧ и раком одновременно. Это мрачное сочетание ему и помогло.
Пациента зовут Тимоти Рэй Браун. Когда у него диагностировали рак – острый миелоидный лейкоз, – американцу было 40 лет. За 10 лет до этого у него обнаружили ВИЧ. К моменту диагностики рака Браун уже более четырех лет принимал антиретровирусную терапию. Она позволяет сдерживать вирус в крови и жить нормально.
Первоначальное лечение острого миелоидного лейкоза состояло из двух курсов индукционной химиотерапии (она нацелена на выведение больного в ремиссию) и одного курса консолидационной химиотерапии (она должна закрепить ремиссию и провести профилактику рецидивов).
В течение первого индукционного курса у Брауна развились тяжелые печеночные токсические эффекты и почечная недостаточность. Так что антиретровирусную терапию ВИЧ пришлось отменить. Это привело к росту вирусной нагрузки до 6.9×106 копий на миллилитр крови.
После первой химиотерапии Браун вновь начал принимать препараты от ВИЧ и уже через три месяца снизил присутствие вируса в крови до минимальных значений. Но через семь месяцев произошел рецидив лейкоза, так что пациенту пересадили стволовые клетки периферической крови.
Острый миелоидный лейкоз вернулся через 332 дня после первой трансплантации. В связи с этим был проведен еще один курс терапии, облучение всего тела и вторая трансплантация. Вторая трансплантация привела к полной ремиссии рака. Берлинский пациент уже более 10 лет не принимает антиретровирусную терапию и в его крови не обнаруживается РНК ВИЧ.
5. А что мы знаем о Лондонском пациенте?
Мы не знаем его имени. Зато знаем, что ВИЧ-инфекцию у него нашли в 2003 году. Пациент использовал антиретровирусную терапию с 2012 года и таким образом удерживал вирус в крови на неопределяемом уровне.
Но в 2012 году ему тоже диагностировали рак – Ходжкинскую лимфому. В 2016-м дополнительно к химиотерапии пациенту пересадили стволовые клетки периферической крови (они, как и в случае Берлинского пациента, содержали мутировавшую версию гена CCR5 delta 32).
На данный момент уже в течение 18 месяцев в крови у Лондонского пациента не обнаруживается РНК ВИЧ.
6. Говорят, есть еще Дюссельдорфский пациент. Он тоже вылечился?
Врачи не уверены. Речь о 49-летнем человеке с ВИЧ (имя его тоже неизвестно). Он перенес пересадку стволовых клеток периферической крови в феврале 2013 года после достижения полной ремиссии острого миелоидного лейкоза. Пациент принимал антиретровирусную терапию до 18 ноября 2018 года, когда по решению пациента и врачей ее прием был прекращен.
На данный момент в крови пациента на протяжении 3 месяцев не определяется РНК ВИЧ. Поскольку срок небольшой, громких заявлений врачебная группа Дюссельдорфского пациента пока не делает.
7. Вы хотите сказать, больные раком и ВИЧ могут излечиться и от того, и от другого?
Очевидно, шансы есть, и эту схему лечения можно успешно применять. Случаи Лондонского и Дюссельдорфского пациента наконец-то доказали, что Берлинский пациент выздоровел не случайно. Добиться ремиссии ВИЧ-инфекции даже при проведении трансплантации костного мозга без предварительного полного облучения организма и с применением облегченной химиотерапии возможно. И это отличная новость для пациентов с ВИЧ и онкологическими заболеваниями крови.
8. А можно вылечиться от ВИЧ, если у больного нет рака крови?
Говорить о том, что в ближайшее время от ВИЧ можно будет излечить любого, – очень рано.
На данный момент лечение (точнее, подавление) ВИЧ антиретровирусными препаратами намного безопаснее и позволяет жить ВИЧ-положительным людям столько же, сколько и здоровым.
Так или иначе, изучение случаев длительной ремиссии ВИЧ-инфекции после трансплантации костного мозга позволит ученым вплотную приступить к разработке генной терапии, которая в перспективе станет лекарством от этого вируса. Главное, найти безопасный способ модифицировать клетки таким образом, чтобы собственные лимфоциты человека получили чужую мутацию гена CCR5 delta 32.
![]()
Ну, очевидно, что пересадка костного мозга, - это слишком радикальный подход. Лучше внести мутацию точечно, с помощью методов генной терапии подобных CRISPR-CAS9. Тем более, если известна мишень.
А разве можно внести мутацию в ДНК уже сформированного человека? CRISPR-CAS9 вроде к эмбрионам применяют.
Причем не только пересадка но пересадка костного мозга с мутацией ccr5. А таких людей среди доноров не очень много
Не совсем так, вич бывает двух видов и механизмы проникновения отличаются. Но если у тебя гомозиготная (тоесть ген АА) мутация гена ccr5 возможно это делает тебя полностью не восприимчивым к вич-1. В России 21% у которых есть мутация в Аа ccr5
А как они подсчитали проценты то?
Блин, а я татаро-хохол, так себе перспективы
я бы, даже будь с мутацией ccr5 в гомозиготе, не рискнул тыкать во все попало без презерватива. Есть другие штаммы вич которые цепляются к соседним генам.
Да у нас такие кадры есть:
В Новокузнецке 35-летний местный житель около года проживал вместе со своей дамой сердца, после чего пара рассталась. Через некоторое время новокузнечанин почувствовал себя плохо и обратился в больницу, где ему поставили страшный диагноз: ВИЧ.
Мужчина, предположив, что заразить его могла его бывшая возлюбленная, прямо спросил у неё об этом в социальных сетях. Женщина призналась, что заражена этим вирусом с 2010 года и состоит на учёте в специализированном медицинском учреждении. И сознательно не сообщала бывшему возлюбленному о своём диагнозе.
Да-да, этот момент хотелось бы поподобнее. Где можно сдать тест на наличие этой мутации?
Мутация в гене ccr5, отсутствуют рецепторы к которым крепится вич. Думаю в центрах где можно расшифровать геном, можно сделать
Несколько фильмов про зомби так же начинались.
Люди ничему не учатся
Это напоминает анекдот:
Учёные придумали лекарство от всех болезней. Чтобы оно подействовало, нужно одно условие: вы должны болеть ВСЕМИ болезнями)

Подожду комментарии шарящих людей
Прочитал про кондиционирование пациента и чёт сразу вспомнилось:
"Морфогенетическое кондиционирование (ориг. Morphogenic Engine) — процесс, разработанный доктором Рудольфом Вернике, который позволяет людям, находящимся на грани полного безумия, контролировать разумный нано-рой через состояние осознанного сна."
Реально, но только для богатых
Интересно, а "российский" пациент появится? Или это удел "развитых" стран?
Может с начало победим насморк и простуду?
Вот когда от этого будут таблетки, которые лечат за 1 час. Вот это будет достижение.
Органика с такой скоростью не лечится.
Будь ты машиной, оно бы всё работало мгновенно.
Новость №1003: Лекарство от старых клеток примирило иммунитет мышей с силиконовым имплантатом

![]()
Как я перестала бояться и полюбила доказательную медицину
Начну издалека. С того, как в принципе построено обучение в российском медицинском вузе (актуально на 2011 год выпуска, но не думаю, что с тех пор программа значимо изменилась).
Первые три курса — по большей части теория: биология, латынь, анатомия, физиология, гистология, химия и прочие далекие от клиники дисциплины. Наукой заниматься можно по личной инициативе, прибившись к какому-нибудь добренькому преподавателю. Системности в этом никакой нет: тебя используют как рабочие руки, позволяя задавать вопросы по ходу дела. Так на первом курсе я охотилась на паразитов в попах у первоклассников, на втором — умудрилась облиться серной кислотой. Хорошее было времечко!
Потом начались циклы обучения на клинических кафедрах, и нас начали подпускать к больным. Но и за эти три года понимание о принципах принятия врачебных решений не пришло. Все болезни мы изучали по схеме: симптомы-причины-диагностика-лечение-профилактика, превращая свои головы в филиалы Википедии.
Никто не объяснял, по какому принципу в реальной практике назначаются те или иные анализы или лекарства. Это казалось чем-то незыблемым: делай, как написано в учебнике, и все будет в порядке.
С третьего по шестой курс я упарывалась по науке. Сейчас специально проверила, чтобы обозначить масштаб — 2 патента, 4 рационализаторских предложения, медаль (!) российской академии наук, парочка ВАКовских публикаций и еще два десятка — менее престижных.
Доказательная медицина? Нет, не слышала. Я писала научные статьи вообще без понимания, насколько они качественные. При этом не было никаких иллюзий насчет практической пользы всей этой деятельности: я ни разу не видела примеров, когда результаты чьих-либо научных изысканий внедрялись бы в жизнь за пределами самого исследования. Как только кто-то защищал кандидатскую, вся кипучая активность по большей части сворачивалась, новые приборы убирались в шкафы вместе со свеженапечатанными методичками.
Нет, вру. На шестом курсе нам рассказывали про трансляционную медицину (эрзац докмеда) — в виде короткого 6-часового курса, который благополучно проспали большинство студентов. А еще один хороший кардиолог как-то разрешил полистать клинические рекомендации по лечению инфаркта. Правда, плохо объяснил, как они соотносятся с практикой и что значат все эти А, В, С и D напротив каждой рекомендации.
Как вы поняли, 6 лет основной учебы, год интернатуры и год аспирантуры не прошли даром. Но никакой системности медицинского мышления не подарили.
Парадоксальным образом меня на это сподвигла дальнейшая журналистская деятельность с необходимостью отвечать за базар подтверждать свои слова ссылками на источник. В какой-то момент стало понятно, что ссылки есть разные, а исследования могут противоречить друг другу.
В какой-то момент пришло понимание, что нравится, когда все логично: на каждый тезис должна быть ссылка. Ты как бы снимаешь с себя ответственность за сказанное, потому что твое экспертное мнение в сравнении с консенсусом сообщества ученых не значит вообще ничего. То есть, рассуждать можно, но ровно до того момента, пока рассуждения не переходят в конкретные медицинские рекомендации. А здесь начинается магия: оказывается, у науки заготовлены тысячи ответов, просто они спрятаны внутри миллиона исследований, и их нужно разыскать и вытащить на поверхность. Такой бесконечный челночный бег: от читателя к ученым и обратно.
Это опьянило: вдруг оказалось, что ловить на ошибках можно не только себя, но и всяких там именитых профессоров или горлопанистых производителей чудо-приборов и лекарств. Я начала присматриваться к тем, кого невозможно было подловить, и узнала о существовании Никиты Зорина, Василия Власова, Ахмеда Рустамова, Алексея Водовозова, Антона Родионова, Артемия Охотина, Никиты Жукова, Ярослава Ашихмина, Ольги Добровидовой, Даши Саркисян, Федора Катасонова, Сергея Бутрия, Бена Голдакра, Петра Талантова, Елены Мотовой, Роксаны Мухарямовой, Джулии Беллуз и других замечательных людей. Часть из них к тому же написали книги, и когда я их прочла, паззл сложился окончательно.
Выглядит как ну очень окольный путь, зато с оглядкой на него можно сделать следующие выводы:
1. Если ваш врач старше 30, а диплом получал в России — не факт, что он осведомлен о докмеде больше вашего.
2. Научная деятельность в анамнезе ≠ навык критического мышления.
4. Просто разобраться и успокоиться — путь для слабых духом. Тьма сгущается быстрее, чем врачи, журналисты и обыватели переходят на светлую сторону силы. Поэтому знание надо нести дальше, без снобизма и лени сея его вокруг любым удобным способом.
5. Нельзя сотворять себе кумиров, потому что лучшие из нас порой ошибаются. Тут все опять как у джедаев: ни гнева, ни ненависти, ни любви.
6. Ну и главное: приверженность к доказательной медицине не заменяет человеку мозг. Но это тема для отдельного разговора.
Широкая распространенность ВИЧ вызывает серьезную тревогу у работников здравоохранения. В мире примерно каждый сотый инфицирован. СПИД, вызванный вирусом иммунодефицита человека, уже давно не болезнь наркоманов – сейчас все чаще возбудитель находят у людей, ведущих вполне обычный образ жизни. Поэтому одним из главных вопросов, который волнует не только врачей, но, пожалуй, практически каждого жителя нашей планеты – когда найдут лекарство от ВИЧ-инфекции?
Характеристика вируса
Вирус иммунодефицита человека относится к категории РНК-содержащих – то есть его генетический материал содержится в двух цепочках рибонуклеиновой кислоты. Примечателен тем, что поражает, в основном, лимфоидную ткань, а именно – Т-лимфоциты, являющиеся основой клеточного иммунитета. Существует 4 его разновидности, больше всего распространены 1 и 2, передавшиеся человеку от двух разных видов обезьян. Наиболее распространен и вирулентен первый тип.
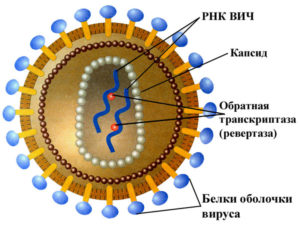
Чтобы создать лекарство против ВИЧ, человечеству необходимо было понять его строение. Сейчас известно – он состоит из ядра, представленного РНК и специальными энзимами, капсида с суперкапсидом – оболочек из липопротеидов, фосфолипидов. Большое значение имеют ферменты ядра: ревертаза (используется, когда патоген начинает размножаться в организме человека, нужна для синтеза ДНК), интеграза (для внедрения генетической информации вируса в хромосому хозяина), протеаза (делит белки на аминокислоты).
Размножается, как любой вирус, только в организме человека.
Процесс состоит из нескольких этапов:
- Сближение и слияние с человеческой клеткой.
- Сбрасывание оболочки (капсида).
- Превращение РНК вируса в ДНК при помощи ревертазы.
- Внедрение чужеродной ДНК в хромосому клетки.
- Синтез вирусных РНК (при этом используются ресурсы пораженной клетки).
- Сборка вирусных тел, их выход из клетки с последующим распространением.
Поражаются Т-лимфоциты, снижается их количество. Это ослабляет иммунную систему, развивается синдром приобретенного иммунодефицита.
Сейчас наука ставит перед собой важный вопрос – возможно ли вылечить СПИД?
По каким причинам сложно создавать лекарство
Ученые, изучающие проблемы ВИЧ – инфекционисты, микробиологи, генетики – направляют свои усилия на создание лекарства. О том, что человечество скоро ждет победа над ВИЧ еще рано. В СМИ часто мелькает информация – “найдено новое лекарство от ВИЧ”, но действительно эффективных препаратов, навсегда излечивающих от болезни, по-прежнему нет.
Основная причина того, почему до сих пор не создано средство от СПИДа – возбудитель способен многократно мутировать у каждого пациента, повышая устойчивость к используемым препаратам. Другими причинами являются: способность персистировать в клетках крови, механизм антигенной мимикрии – способность создавать белки, подобные человеческим, благодаря чему не распознается иммунитетом как чужеродный агент, а также непереносимость фармакотерапии, встречающаяся у части больных.
Перспективы лечения – снижение вирусной нагрузки, поддержание работы иммунной системы. Это называется антиретровирусной терапией. Такое лечение лишь замедляет прогрессирование заболевания – о полном избавлении от патогена пока речи нет. Становится ясно – повлиять можно лишь на течение болезни, то есть чем раньше начать фармакотерапию, тем меньше вреда будет нанесено иммунной системе. Противовирусные таблетки необходимо принимать пожизненно. Также ведется работа над созданием вакцины. Для этого изучается феномен людей, которые обладают иммунитетом к этому вирусу.
Ученые научились лечить ВИЧ у животных – пока только у мышей. Путем модернизации их генома (удаляя из каждой клетки вирусную ДНК) достигнуто полное выздоровление. Неизвестно, сколько лет пройдет, прежде чем подобная технология будет применяться у людей. Также нельзя точно сказать, в каком году ликвидируют эту болезнь, есть ли другие лекарства от ВИЧ-инфекции. Перспективы полного избавления от ВИЧ у человека пока далеки от реальности – ученые не могут найти причину того, почему он так стремительно мутирует.
Существует ли лекарство от ВИЧ

При лечении врачи ставят перед собой определенные цели: продление срока жизни с улучшением ее качества, минимизация осложнений, снижение вероятности передачи возбудителя от данного пациента его партнеру. Эти цели реализуются через принципы: оптимальная психологическая обстановка, своевременное начало терапии, предотвращение и ранняя диагностика вторичных патологий, их устранение.
Впервые ученые изобрели лекарство от ВИЧ в 1986 – это был азидотимидин. Когда при помощи него никто не излечился от ВИЧ, стало ясно – можно только отсрочить прогрессирование болезни. Пока нельзя сказать точно, существует ли лекарство от ВИЧ. Правда ли, что ученые нашли лекарство и вирус ВИЧ в скором времени победят? К сожалению, нет. Результаты будут хорошими тогда, когда появится возможность вылечить болезнь полностью. Последние исследования утверждают – ВИЧ можно победить, но они проводились пока только на животных. На вопрос “излечим ли СПИД в наше время?” можно ответить, что, когда развивается СПИД – помочь гораздо сложнее, процесс уже необратим, можно лишь замедлить его развитие.
В интернете можно встретить громкие заголовки “вся правда о препаратах против ВИЧ”, которые заставляют население сомневаться, лечится ли в наше время СПИД, вызванный ВИЧ, есть ли смысл принимать препараты. Конечно, полностью выздороветь невозможно, но можно повысить качество жизни, предотвратить осложнения, если начать принимать антиретровирусные как можно раньше. Остается надеяться, что скоро специалисты найдут вещества, которые убивают ВИЧ.
История препаратов от ВИЧ-инфекции

Есть ли надежда, что найдут лекарство? Ученые уже давно работают над этим вопросом.
Первое было создано в 1986 – ингибитор ревертазы зидовудин. Вначале препарат казался достаточно эффективным, но потом выяснилось – к нему быстро развивается устойчивость. Это стало стимулом для проведения новых исследований.
Следующим прорывом в лечении стало создание ВААРТ – высокоактивной антиретровирусной терапии. Это произошло в 1996 году. Фармакотерапия стала комплексной, была подтверждена эффективность комбинации препаратов – ингибиторов ревертазы, протеазы, интегразы. Позднее появились блокаторы рецепторов и слияния. В начале 2000-х годов проведены исследования, доказывающие эффективность этой терапии для предотвращения перинатальной передачи патогена плоду от инфицированной матери, созданы безопасные комбинации медикаментов.
Конечно, даже ВААРТ не способна полностью избавить организм от возбудителя. Однако, было достигнуто снижение вирусной нагрузки на организм, увеличилась продолжительность жизни пациентов. К сожалению, появились и определенные сложности – выяснилось, что ВААРТ имеет много побочных эффектов. К ним относят диарею и запоры, чувство тошноты и рвота, лекарственный гепатит и цирроз печени, аллергические реакции, анемия, нарушение функции почек, ожирение, поражение периферической нервной системы. Пациенты, узнав об этом, склонны отказываться от лечения. Важно информировать больных, что многие побочные действия прекращаются спустя 1-2 месяца от начала терапии. Над этим ведется работа, ведь лечение назначается практически пожизненно, и новые медикаменты хорошо переносятся.
Современная наука работает не только в направлении изобретения новых медикаментов. Также ведутся работы по созданию вакцины от вируса иммунодефицита человека.
Современные лекарства, применяемые в медицине
Современные таблетки от ВИЧ объединены в комплекс, который называется высокоактивной антиретровирусной терапией. В нее входят следующие группы препаратов:
1. Ингибиторы ферментов и процессов:
- Ревертазы – невирапин, ифавиренц, абакавир, ламивудин. Блокируют синтез вирусной ДНК, а следовательно, размножение патогена.
- Интегразы – ралтегравир, элвитегравир. Предотвращают встраивание чужеродной ДНК в генетическую информацию клетки-хозяина.
- Протеазы – саквинавир, индинавир, ритонавир. Блокируют заключительный этап размножения патогена.
- Слияния – энфувиртид. Блокируют проникновение возбудителя в клетку.
2. Антагонисты рецепторов CCR5 – маравирок. Блокируют проникновение возбудителя в клетку.
Цены на медикаменты достаточно высоки. Их стоимость для одного пациента зависит от применяемой схемы, входящих в нее препаратов и составляет от 11 до 380 тыс.руб ежегодно. В России лечение пациентов с ВИЧ осуществляется за счет государственного бюджета.
Результатом многочисленных исследований стало изобретение Ledgin (новый блокатор интегразы) в 2010 году. Этот современная разработка – настоящий прорыв, ведь вещество не только препятствует встраиванию вирусной ДНК в клетку-мишень, но и заставляет патоген локализоваться на тех участках, где размножение невозможно, то есть эффект сохраняется после прекращения приема. Это позволит пациентам делать перерывы в терапии.
Препараты в стадии разработки и тестирования
Ученые долго искали способ, как вылечиться от ВИЧ-инфекции. И вот в 2017 появилось сообщение об испытании новых лекарств от СПИДа. Как
показали последние исследования, появилась надежда победить ВИЧ навсегда. Ответ на вопрос “излечим ли ВИЧ полностью?” появится, когда пройдут испытания новые методы, тогда можно будет сказать, найдено ли средство от СПИДа.
Теперь подробнее о новых методах лечения.
Это медикаменты, препятствующие образованию внешней оболочки вируса, тем самым, не давая размножаться. Пока испытания проведены только на лабораторных животных.
GS–CA1 – новейший препарат, который препятствует сборке капсида. Связывается с наименее подверженным мутации фрагментом, а также эффективен в предотвращении проникновения возбудителя в клетку, блокируя распад капсида и транспорт чужеродной РНК в клетку-мишень.
Моноклональные антитела – иммуноглобулины, выработанные одной плазматической клеткой к определенному антигену.
Как известно, вирус иммунодефицита человека тропен к Т-лимфоцитам. Он “узнает” их по белку CD4, расположенному на поверхности клетки. Моноклональные антитела – препараты, которые связывают молекулу этого белка, делая клетку “неузнаваемой” для патогена. Особенно поможет такой метод больным уже развившейся резистентностью к “старым препаратам”, длительно принимающим ВААРТ. Представитель группы – имализумаб. Характеризуется хорошей переносимостью.
PRO-140 – новый препарат, в отличие от имализумаба, действует на ко-рецепторы CCR5, помогающие вирусу проникнуть в клетку-мишень. Может быть компонентом ВААРТ или применяться в качестве монотерапии.

Разработка медикаментов ведется не только в направлении открытия новых молекул. Изучаются свойства давно открытых веществ. Создаются другие способы введения веществ, проходят испытания пролонгированные формы, делающие прием лекарств более удобным. Это также важно – ведь ВААРТ назначается пожизненно.
Важным аспектом является профилактика ВИЧ-инфекции у контактных лиц. Один из препаратов, который планируют использовать с этой целью – Карботегравир. По механизму действия он не является принципиально новым — это ингибитор протеазы. Инъекционная пролонгированная форма позволит применять его 1 раз в 28 дней.
Также для профилактики и лечения создают новые комбинированные медикаменты. Именно сочетание веществ в одной таблетке облегчает прием и повышает приверженность больного к терапии – психологически принимать одну-две пилюли легче. Таким препаратом является Трувада, состоящий из ингибиторов обратной транскриптазы тенофовира и эмтрицитарабина (нуклеозидный). Принимается один раз в сутки.
Эти молекулы относятся к уже известным классам препаратов от вируса иммунодефицита человека.
GS-9131 – новый блокатор обратной транскриптазы. Пока испытан только на культуре клеток. Активен даже при мутациях вируса.
GS-PI1 – высокоэффективный ингибитор протеазы. Возможно использование без других препаратов (усилителей фармакокинетики), поэтому снижается вероятность поражения печени, нежелательных негативных эффектов. Уже тестируется на животных.
MK-8591 – нуклеозидный ингибитор ревертазы. Имеет тройной механизм действия – блокирует фермент, затрудняет и предотвращает “коррекцию” неверно скопированных участков ДНК, пристраивая к цепочке “лишний” нуклеозид. Обладает очень выраженным длительным эффектом (до полугода), достигаются значительные концентрации в слизистой влагалища и прямой кишке, позволяющие использовать его для профилактики заражения здоровых партнеров пациента. Уже исследуется на человеке.
Работа над вакциной
Для многих людей, страдающих ВИЧ, важно, чтобы от болезни не пострадали их близкие. С самого открытия вируса иммунодефицита человека ученые предпринимают попытки создать вакцину. Ни одна еще не запущена в производство.
Сам принцип работы вакцины состоит во введении ослабленного возбудителя или его компонентов в организм, помогая иммунной системе выработать специфические антитела.
Есть несколько вакцин, которые проходят испытания – HVTN702, VRCO1 (антитела, практически идентичные синтезируемым в организме), Ad26 (создана из антигенов различных типов вируса), PENNVAX-GP (комплексная, содержащая 4 антигенных компонента, вызывающая не только образование антител, но и клеточный иммунный ответ).
Препарат “Гаммора” против ВИЧ
Еще недавно казалось – не существует веществ, которые полностью лечат ВИЧ. Но наука не стоит на месте – в Израиле ученые изобрели новое лекарство против СПИДа и ВИЧ, точнее, нашли белок, помогающий бороться с этой болезнью. Это “Гаммора”.
Его действие принципиально отличается от привычных антиретровирусных препаратов. Препарат Gammora уничтожает клетки, содержащие патоген. При этом здоровые ткани не страдают. Действующим веществом является белок, нарушающий передачу чужеродной ДНК в клетку-мишень. Обычно вирус передает одну копию своей генетической информации, но при применении данного препарата количество копий увеличивается, запускается процесс “самоубийства” клетки – апоптоз. Вместе с пораженной клеткой погибает вирус.
Купить данный медикамент нельзя, но, скорее всего, он будет продаваться в Израиле в ближайшие годы.
Случаи полного излечения

При кажущейся неутешительной ситуации в отношении ВИЧ-инфекции, редко, но встречаются люди, излечившиеся от этой болезни.
Известно несколько случаев:
- История Тимоти Рэя – первый человек, который полностью вылечился от ВИЧ. Этот пациент из Берлина заразился в 1995 году. Так как Рэй сразу начал принимать антиретровирусную терапию, болезнь не переходила в СПИД. Но в 2006 у него был диагностирован лейкоз. Понадобилась трансплантация клеток костного мозга. Уже тогда науке была известна роль белка CCR5 в проникновении ВИЧ в клетку-мишень, поэтому лечащий врач решил найти донора с мутацией этого рецептора. После трансплантации было подтверждено отсутствие вирусных тел в организме данного больного – полное излечение от ВИЧ.
- Эффект группы Visconti – исследование, подтверждающее эффективность как можно более раннего начала антиретровирусной терапии. Люди этой группы (около 20 чел.) начали принимать медикаменты спустя 2 месяца после заражения. Даже после прекращения лечения концентрация патогена осталась низкой, а болезнь течет бессимптомно. Примечательно, что генетически эти пациенты не принадлежат к группе “элитных контроллеров” – людей, чей организм способен длительно бороться с вирусом или не подвержен его действию.
- Девочка из Миссисипи – еще один пример эффективности раннего начала лечения. Мать девочки была ВИЧ-положительной, сразу после родов ребенку начали вводить ВААРТ. Первые три года жизни вирус в ее крови не обнаруживался. По неизвестным причинам, когда девочке было 4 года, возбудитель был найден в ее крови.
- Двое мужчин из Бостона – также подверглись трансплантации костного мозга из-за опухолевого заболевания лимфоидного аппарата. Но возбудитель появился в крови после отмены противовирусных препаратов.
Читайте также:


