Escherichia coli and salmonella typhimurium
Если вы собираетесь работать с продуктами, для получения медицинской книжки вам нужно провериться на кишечные инфекции. В кале в этом случае ищут возбудителей заболеваний из так называемой дизгруппы: шигеллу, сальмонеллу и патогенные кишечные палочки.

Дизентерия (шигеллёз)
Бактерия под названием шигелла вызывает дизентерию (шигеллёз). Заразиться можно через еду, например, сырые овощи. Основные симптомы этого заболевания в остром периоде:
- диарея (понос) с кровью или слизью,
- спазмы в животе,
- тошнота или рвота,
- температура выше 38˚C.
Шигеллёз проходит сам — нужно только пить побольше и желательно растворы для пероральной регидратации, которые продаются в любой аптеке. Для снятия боли и снижения температуры можно принимать парацетамол. Противодиарейные препараты вроде лоперамида могут ухудшить ситуацию. Только в редких тяжёлых случаях назначаются антибиотики.
Заражение шигеллой происходит фекально-оральным путём. И если человек не помыл руки после туалета и прикоснулся к продуктам, потребитель этих продуктов также заражается кишечной инфекцией.
Может ли человек оставаться заразным вне острого периода? После последнего эпизода диареи врачи советуют не выходить на работу ещё 48 часов, так как риск передачи инфекции в это время велик. В некоторых случаях бактерии могут жить в организме ещё 3–4 недели после выздоровления.
Сальмонеллёз
Сальмонелла может вызывать как брюшной тиф, так и сальмонеллёз. Правда, причиной этих двух заболеваний становятся разные серотипы бактерии. Симптомы сальмонеллёза мало отличаются от признаков других кишечных инфекций:
Жар обычно проходит через 48–72 часа, а диарея — через 4–10 дней.
Заразиться можно при употреблении куриного мяса, яиц и молока и при контакте с рептилиями, например, черепахами. Лечения инфекции как такового нет, кроме постоянного замещения жидкости. Если пациенты до 50 лет принимают антибиотики, то это, во-первых, не ускоряет выздоровление, а во-вторых, может повысить риск бессимптомного носительства сальмонеллы. Но чаще после острого периода заразными остаются пожилые люди и те, у кого есть проблемы с желчевыводящими путями или, например, камни в желчном пузыре.
Обычно бактерии находятся в организме не больше 4–5 недель после выздоровления, но у некоторых людей сальмонеллы могут жить годы. В таком случае достаточно плохо помыть руки после туалета и начать готовить какое-то блюдо, чтобы еда стала опасной.

Инфекции, вызванные кишечной палочкой
Кишечная палочка (E. coli) в норме живёт в желудочно-кишечном тракте. Но существуют разные её штаммы и те, которые вызывают заболевания, называются патогенными. Зачастую именно патогенная кишечная палочка становится причиной бактериальной диареи. Самый распространённый из этих штаммов — EHEC O157, его можно легко обнаружить с помощью анализов, которые проводятся практически в любой лаборатории.
Набор симптомов при заражении патогенной кишечной палочкой довольно типичный:
- спазмы в желудке,
- диарея (часто с кровью),
- рвота,
- если есть жар, то меньше 38,5˚C.
Через 5–7 дней пациенту становится лучше. Противодиарейные препараты применять не рекомендуется, так как они увеличивают риск осложнений, то же делают антибиотики, поэтому обычно используются лишь растворы для пероральной дегидратации.
Кроме как через мясо, кишечная палочка проникает в организм фекально-оральным путём. Поэтому люди, прикасающиеся на работе к еде, которую потом кто-то другой будет есть, должны подтвердить, что у них нет патогенных штаммов кишечной палочки. Даже если у вас нет диареи с кровью, это не значит, что вы не носитель патогенного штамма E. coli. Если перечисленные симптомы у вас были, то несколько недель, а то и месяцев после выздоровления вы можете быть заразны.
Чтобы провериться на кишечные инфекции, приезжайте к нам на сдачу анализов или на приём к терапевту. Узнайте больше по телефону: +7 (495) 308-39-92.
Несмотря на программы вакцинирования животных, инфекционные заболевания наносят серьезный экономический ущерб. Особую опасность представляют колибактериозы и сальмонеллезы у кур в условиях птицефабрик, когда птица содержится в скученном состоянии, что облегчает передачу возбудителя между особями [1]. Контроль над этими инфекциями требует комплексного подхода, включающего вакцинирование, оптимизацию кормления и содержания, профилактические мероприятия. Разработанный ранее метод генотипирования патогенных штаммов микроорганизмов, наносящих большой экономический ущерб животноводству, был использован на двух видах бактерий – кишечная палочка и сальмонелла. Генотипирование методом двойного расщепления и избирательного мечения (ДРИМ) позволяет получить своеобразный штрих-код для каждого бактериального штамма. Сопоставление генотипов патогена, выделенных из разных особей, позволяет говорить о перезаражении, если генотипы идентичны. С другой стороны, если генотипы не совпадают, то особи заразились из разных источников. Генотипирование в настоящее время становится важным элементом в системе профилактических мероприятий, направленных на недопущение распространения патогенов [2; 3].
Метод генотипирования ДРИМ основан на одновременном использовании двух эндонуклеаз рестрикции для расщепления геномной ДНК бактерии и мечении фрагментов ДНК с помощью ДНК-полимеразы [4]. Первая эндонуклеаза расщепляет ДНК с образованием 3′-усеченных концов, которые могут включить метку биотинилированный дезоксицитозинтрифосфат (Bio-dCTP) в реакции достройки. При подборе этого фермента уделяют внимание количеству сайтов расщепления, которое должно быть в пределах 15-30. Это позволяет получить ограниченное число меченых биотином фрагментов ДНК. Наряду с первым ферментом, в реакции ДРИМ присутствует вторая эндонуклеаза рестрикции, необходимая при укорочении фрагментов ДНК для их использования при разделении по длине в обычном агарозном геле. Особенностью второго фермента является способность продуцировать фрагменты ДНК с тупыми либо 3′-выступающими концами, которые не могут включать биотиновую метку [5; 6].
Предварительный поиск in silico в базе данных секвенированных геномов патогенных микроорганизмов позволил подобрать комбинацию ферментов, подходящих одновременно для разных видов микроорганизмов – Escherichia coli и Salmonella enterica. Для генотипирования были предложены в качестве первого фермента XbaI и в качестве второго – PstI. Данные ферменты позволили получить 20-40 фрагментов ДНК, распределение которых на фильтре было оптимальным с точки зрения достижения высокой дискриминации бактериальных штаммов и легкости учета фрагментов ДНК.
Бактериальные культуры выращивались из материала, полученного от больных и павших кур по стандартными микробиологичесим методикам. Для выделения геномной ДНК было достаточно 1 мл жидкой культуры. ДНК выделяли по общепринятым методам с использованием фенольно-хлороформенной экстракции.
По результатам генотипирования изоляты №1 и №2 (Salmonella typhimurium) были идентичными. Бактерии выращивались из одной особи (сердце и двенадцатиперстная кишка, соответственно). Изоляты №3 и №4 (Salmonella enteritidis), выделенные из сердца и печени одной яичной курицы также были идентичными, но существенно отличались от изолятов №1/№2.
У E.coli была выявлена группа (кластер) идентичных изолятов: №10, 11, 12, и 13. Изоляты №10 и №11 выделялись из сердца и желчного пузыря одной курицы второго птичника, а изолят №12 – из сердца другой особи, содержавшейся на первом птичнике. Изолят №13 соответствовал микроорганизму, выделенному из печени еще одной особи в пределах второго птичника. Учитывая большое генетическое разнообразие штаммов кишечной палочки, случайное совпадение генетических профилей маловероятно. Скорее всего, можно говорить о передаче одного и того же штамма возбудителя между двумя птичниками (на примере изолятов второго птичника №10, №11, №13 и первого птичника №12) и между особями в пределах одного птичника (изоляты №10/№11 и №13).
Помимо одного кластера с идентичными изолятами E.coli, все остальные 9 изолятов являлись генетически уникальными штаммами, значительно отличающимися друг от друга и от указанного выше кластера.
В пределах одного птичника у разных особей выделяются совершенно разные генотипы E.coli (например, изоляты №14 и №15), что говорит о циркулировании одновременно разных штаммов на птичнике. Такая же картина наблюдалась на другой птицефабрике (изоляты №16 и №17).
В целом, выявлено значительное генетическое разнообразие бактериальных штаммов, зарегистрирован только один случай вероятного перезаражения птиц как внутри птичника, так и между двух птичников, что проявилось в виде 4-х идентичных изолятов. Полученные данные о распространении патогенов нужно учитывать при планировании ветеринарно-санитарных мероприятий на птицефабриках с целью разрыва эпизоотической цепи и снижения вероятности передачи возбудителя между курами.
Библиографический список
- Добрина М. Н. Нужен постоянный контроль сальмонеллеза // Животноводство России. 2011. № 3. С. 11–13.
- Тапальский Д.В., Осипов В.А., Жаворонок С.В. Фенотипическое и молекулярно-генетическое типирование сальмонелл: реалии и перспективы // Журнал микробиологии, эпидемиологии и иммунобиологии. 2005. № 6. С. 88–93.
- Жебрун А.Б., Мукомолов С.Л., Нарвская О.В. Генотипирование и молекулярное маркирование бактерий и вирусов в эпидемиологическом надзоре за актуальными инфекциями // Журнал микробиологии, эпидемиологии и иммунобиологии. 2011. № 4. С. 28–36.
- Terletski V., Schwarz S., Carnwath J., and Niemann H. Typing of Salmonella enterica subsp. enterica serovars Choleraesuis, Typhimurium, Dublin and laboratory strains of Escherichia coli using subtracted restriction fingerprinting (SRF) // Microbiol. Res. 2003. V. 158. P. 135–142.
- Terletskiy V., Kuhn G., Francioli P., Blanc D. Application and evaluation of double digest selective label (DDSL) typing technique for Pseudomonas aeruginosa hospital isolates // J. Microbiol. Methods. 2008. V. 72. No. 3. P. 283–287.
- Terletskiy V., Tyshchenko V., Martinez-Ballesteros I. et al. Validation of Double Digest Selective Label database for sequenced prokaryotic genomes // Bioinformatics. 2010. V. 26. No. 3. P. 417–418.
Бактерия сальмонелла тифимуриум известна в медицине как Salmonella enterica serovar typhimurium. Она является грамотрицательной, палочковидной бактерией со жгутиками (фиолетовыми волосковидными структурами), с помощью которых этот микроорганизм передвигается.
Названная бактерия - основная причина пищевого отравления (сальмонеллеза) у людей. Инфицирована ею бывает чаще всего свинина, мясо домашней птицы, яйца. Домашние животные ее тоже могут передавать.
Как сальмонеллы классифицируются?
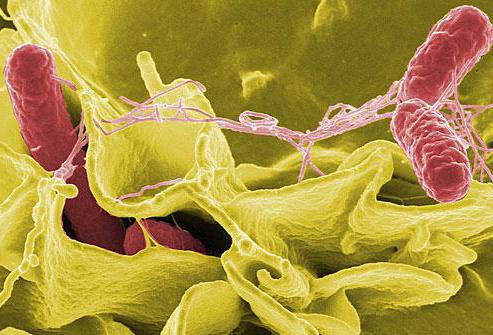
Итак, нас интересует сальмонелла тифимуриум - возбудитель такого опасного недуга как сальмонеллез. Вид salmonella enterica имеет в своем составе 6 подвидов:
Подвид salmonella enterica enterica включает следующие серогруппы:
- A (paratyphi A).
- B (derby, typhimurium, agona, heidelberg).
- С (cholerae suis, newport, muenchen, virchowinfantis).
- D (dublin, enteritidis, rostock, sendai, typhi).
- E (anatum).
Сальмонелла тифимуриум (S. typhimurium)

Вид enterica считается патогенным для человека и животных, а также птиц, но наиболее значимы для человека лишь несколько из них. И большинство случаев сальмонеллеза приходится на S. typhimurium.
Многие штаммы сальмонелл устойчивы к современным антибиотикам, и поэтому распространяются по всему миру. Так, внутрибольничный сальмонеллез - серьёзная проблема в настоящее время. А в 80 % случаев возбудитель нозокомиального (внутрибольничного) сальмонеллеза - это S. typhimurium.
Факторы патогенности
Течение и опасность упомянутого заболевания обуславливают следующие факторы патогенности:
- Жгутиками обеспечивается быстрое передвижение микроорганизма.
- Капсулой бактерия защищается от фагоцитов. А из-за неполноценности фагоцитоза развивается сепсис.
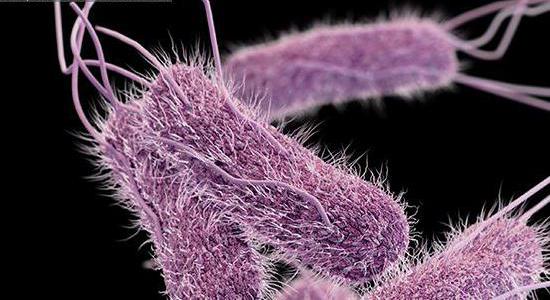
- Особенность инвазии делает ее проникновение беспрепятственным в глубоколежащие ткани.
- По причине хорошей адгезии (крепления), обеспечивающейся фибриллами, пектинами, ЛП-сахаридным комплексом, бактерия удерживается в организме.
- Экзотоксины (продукты ее жизнедеятельности) формируют диарею с дальнейшим обезвоживанием, быструю сосудистую проницаемость.
- Эндотоксин выделяется на фоне разрушающего фагоцитоза. Это липополисахаридный комплекс, который формирует интоксикацию. Агрегация тромбоцитов в мелких капиллярах приводит к воспалению, наблюдается ДВС-синдром. А секреция Na и Cl приводит к сокращению гладкой мускулатуры и усилению перистальтики кишечника.
Насколько устойчивы бактерии?
Сальмонеллы тифимуриум имеют устойчивость к различным факторам внешней среды:
- Три месяца они сохраняются при комнатной температуре предметами обихода.
- Четыре года хранятся в сухих испражнениях животных.
- Пять месяцев - в воде, полгода - в молочных продуктах и мясе, на яичной скорлупе - до месяца.
- Гибель наступает только при 100°С. В мясных продуктах устойчивость к высокой температуре возрастает (полкило мяса необходимо кипятить на протяжении двух часов, только после этого оно будет безопасно). При помощи соления и копчения сальмонеллу не убить.
- Данный возбудитель выдерживает понижение температуры до -80°С.
- Он устойчив к ультрафиолету.
- Дезинфицирующее средство требуется выдерживать 20 минут, чтобы уничтожить бактерию.
Вспышки заболеваемости сальмонеллезом наблюдается в летнее время, чаще диагностируется у маленьких детей из-за несовершенства их иммунной системы.
Патология передается алиментарным путем, также контактным и контактно-бытовым. Кстати, важно при употреблении яиц обращать внимание на вид белка и желтка. При замутнении, кровоизлиянии, тухлом запахе, яйцо, вероятнее всего, заражено. Его нужно выбросить, посуду залить хлором, руки также им обработать. Мыло в этих случаях не помогает.
Зимние вспышки, высокая летальность и контактно-бытовой механизм передачи происходят по причинам антибиотикоустойчивости и из-за того, что продовольственное обеспечение централизовано.
Инкубационный период
Инкубационный период длится от шести часов до восьми суток, но чаще всего первые симптомы появляются уже в первые сутки-двое после употребление в пищу зараженного продукта.
Болезнь начинается остро, характеризуется слабостью, вялостью, умеренными болями в животе (область эпигастрия и пупка). Живот болезнен при пальпации, слышно урчание и заметно вздутие.

Сальмонелла тифимуриум - лабораторная диагностика
На постановку диагноза влияют следующие показатели:
- повышено СОЭ;
- лейкоциты со сдвигом влево;
Возбудитель обнаруживается из биологических сред (испражнений, крови, мочи, поражённых органов) и подозрительных продуктов бактериологическим методом. Окончательный результат, как правило, готов к пятому дню.
При заражении сальмонеллой тифимуриум, симптомы следующие:
Лечение
Данный недуг может иметь летальный исход в младенческом возрасте, у пожилых людей, а также у лиц со сниженным иммунитетом. Этим и опасна сальмонелла тифимуриум.
Терапия должна проходить под строгим наблюдением врача, а в тяжелых случаях применяют реанимационные меры. Из сорбентов для дезинтоксикации организма целесообразно использование следующих препаратов:

Активные в отношении сальмонелл salmonella enterica антибиотики

Сальмонелла энтерика (или сальмонелла кишечная, лат. Salmonella enterica) — вид бактерий из рода сальмонеллы. Общепринятое сокращение S. enterica. Все патогенные в отношении человека сальмонеллы относятся к этому виду.
Вид salmonella enterica в род сальмонеллы (лат. Salmonella), семейство энтеробактерии (лат. Enterobacteriaceae), порядок энтеробактерии (лат. Enterobacteriales), класс гамма-протеобактерии (лат. γ proteobacteria), тип протеобактерии (лат. Proteobacteria), царство Бактерии.
Многие серотипы Salmonella enterica — возбудители заболеваний человека, в том числе, брюшного тифа, паратифа, сальмонеллеза. Сальмонеллы вида Salmonella bongori не патогенны для человека. Вид Salmonella enterica включает в свой состав 7 подвидов (каждый из которых имеет множество серотипов):
- (I) enterica
- (II) salamae
- (IIIa) arizonae
- (IIIb) diarizonae
- (IV) houtenae
- (VI) indica
- VII
Подвид Salmonella enterica enterica включает следующие серогруппы:
- A (в данной серогруппе наиболее известен серотип paratyphi A)
![]()
- B (серотипы: typhimurium, agona, derby, heidelberg, paratyphi Bи др.)
- С (серотипы: cholerae suis, infantis, newport, muenchen, virchow, paratyphi C и др.)
- D (серотипы: dublin, enteritidis, moscow, rostock, sendai, typhi и др.)
- E (серотипы: anatum, london и др.)
Большинство сальмонелл вида enterica патогенны как для человека, так и для животных и птиц, но в эпидемиологическом отношении наиболее значимы для человека лишь несколько из них. 90 % случаев сальмонеллёзов приходится на S. typhimurium, S. enteritidis, S. panama, S. infantis, S. newport, S. agona, S. derby и S. london. Более 50 % случаев всех заболеваний, связанных с заражением сальмонеллой в США, приходится на серотипы S. typhimurium и S. enteritidis, причем количество заболевших сальмонеллезом, в том числе в развитых странах, в последние годы возрастает. Это связано с появлением штаммов сальмонелл S. typhimurium и S. enteritidis, устойчивых к современным антибиотикам, и распространением этих штаммов по всему миру. Внутрибольничный (нозокомиальный) сальмонеллёз является одной из серьёзных проблем современного здравоохранения. В 80 % случаев возбудителем нозокомиального сальмонеллёза является S. typhimurium.
Одним из опасных заболеваний, вызываемых сальмонеллами, является брюшной тиф. Возбудитель брюшного тифа — Salmonella enterica enterica серотип typhi (очень часто называется без указания вида и подвида: salmonella typhi). Брюшной тиф поражает только человека. Salmonella typhi — короткая подвижная, бактерия, факультативный внутриклеточный паразит, хорошо растущий при наличии кислорода, хотя может расти и в его отсутствии. Оптимальная температура роста — 37° С, но может расти в диапазоне температур от 4 до 40°С. Хорошей средой для размножения S. typhi является молоко. Salmonella typhi сохраняет жизнеспособность и вне тела человека: в сточных водах — в течение недели, в испражнениях — от 1 до 2 месяцев.
Инкубационный период около 2-х недель. Заражение брюшным тифом происходит при попадании Salmonella typhi в человеческий организм через рот. Инфицирующая доза - 10 3 –10 7 бактерий. S. typhi вначале проникают в слизистую оболочку тонкой кишки, где поражают лимфоидные скопления. С током лимфы S. typhi поступают в кровь, где в большом количестве разрушаются. Высвобождающийся эндотоксин вызывает проявление симптомов болезни. Выжившие в крови S. typhi оседают в желчном пузыре, костном мозге, селезенке. Сыпь на животе содержат большое количество Salmonella typhi. В процессе дальнейшего развития заболевания S. typhi через желчные протоки возвращаются в кишечник, где активно размножаются.
У больных с иммунодефицитами или имеющих пониженную кислотность желудочного сока, выше риск заражения и заболевание с большей вероятностью будет проходить в тяжёлой форме. Вне зависимости от применяемого лечения смертность достигает 4 %. От 1 до 4 % выздоровевших больных остаются носителями S. typhi в кишечнике или желчном пузыре в течение нескольких месяцев или лет.
Salmonella typhi обладает высокой устойчивостью к различным антибиотикам. В частности, ее резистентность к левомицетину достигает 100 %, к ампициллину — 85%.
Согласно официальным данным, число зарегистрированных случаев заболеваний брюшным тифом в Российской Федерации за 2009 и 2010 годы, в том числе среди детей и подростков до 17 лет включительно, следующая:
| | Всего | от 0 до 17 лет | ||
| год: | 2009 | 2010 | 2009 | 2010 |
| Российская Федерация | 44 | 49 | 5 | 3 |
| Центральный ФО | 15 | 12 | 1 | 0 |
| г. Москва | 7 | 8 | 0 | 0 |
| Северо-Западный ФО | 17 | 24 | 1 | 1 |
| г. Санкт-Петербург | 13 | 20 | 0 | 1 |
Возбудители паратифов A, B и C — сальмонеллы вида enterica подвида enterica серотипов, соответственно, paratyphi A, B и C (очень часто называются без указания вида и подвида: Salmonella paratyphi A, B или C). Salmonella paratyphi B иногда называется также Salmonella schottmuelleri, а Salmonella paratyphi C — Salmonella hirschfeldii. Сальмонеллы S. paratyphi A и S. paratyphi B поражают только человека.
Паратифы А и В близки по клиническим проявлениям и эпидемиологии брюшному тифу, отличаясь более острым началом, менее тяжелым течением и меньшей продолжительностью. Паратиф С, как самостоятельное заболевание, встречается редко, чаще всего он бывает у пациентов, ослабленных другими болезнями и обычно протекает виде пищевого отравления.
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении сальмонелл Salmonella enterica: рифаксимин, фуразолидон, нифуроксазид, ципрофлоксацин. Нифурател активен в отношении Salmonella typhi, Salmonella typhimurium, Salmonella enteritidis.
1. селективное обогащение (накопление):
· жидкая среда Кесслера с поплавком (с лактозой): культивирование – (36±1)°С, для E.coli используют температуру (43±1)°С в течение 24-48 ч. Проверяется сбраживание лактозы и образование газа. На среде Кесслера кишечная палочка дает обесцвечивание и помутнение среды связи с подкислением среды, и образование газа в поплавке.
· жидкая элективная среда Кода: культивирование – 37°С 18-24 ч. Проверяется сбраживание лактозы и образование газа. Признаком роста лактозоположительных энтеробактерий (БГКП, E. coli) является изменение цвета среды с темно-зеленого до ярко-желтого.
2. плотные дифференциально-диагностические среды:
· среда Эндо: культивировать – (37±1)°С в течение 18-20 ч. На среде Эндо Е.соli колонии имеют круглую форму, ровный, четко очерченный край, матовую поверхность, малиново-красный темно-красный цвет, который зависит от способности культуры расщеплять лактозу с образованием кислоты, с металлическим блеском. Колонии от бледно-розового до темно-красного цвета с нечетким металлическим блеском. Диаметр колоний 1,5-2,5 или 2,0-3,0 мм.
· среда Левина: культивировать – (37±1)°С в течение 24-48 ч. Колонии кишечной палочки темно-синего (темно-фиолетового) цвета с зеленым металлическим блеском (или без него) диаметром 1,5-2,0 мм, в остальном они не отличаются от колоний кишечной палочки на среде Эндо.
· скошенный РПА (МПА): культивировать – 37°С 18-20 ч. На поверхности агара кишечная палочка образует влажный, блестящий налет сероватого цвета, слегка опалесцирующий в проходящем свете.
3. морфология клеток:
4. биохимические тесты:
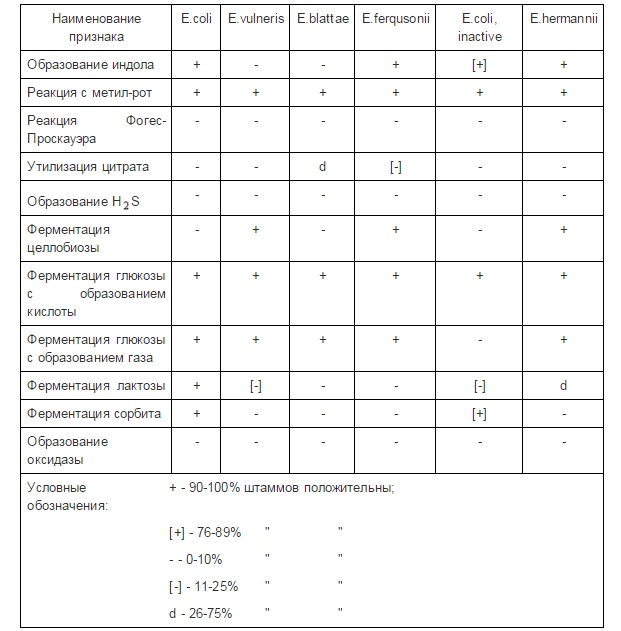
E. coli образует индол.
Оксидазоотрицательные бактерии пересевают на поверхность МПА (РПА) или среды, приготовленной из ПА. Посевы инкубируют до появления видимого роста при температуре (36±1)°С. У оксидазоотрицательных грамотрицательных культур (палочки размером 1,1×1,5×2 6 мкм), выросших в пересевах по 7.3, определяют возможность образования индола, ацетоина, сероводорода, утилизации цитрата, интенсивность ферментации углеводов с образованием кислоты, ферментацию сорбита, глюкозы и лактозы.
· способность образовывать индол: культуру высевают в пробирку с бульоном Хоттингера или МПБ (РПБ) с триптофаном. Под пробку в пробирку помещают полоску индикаторной бумажки. Посевы инкубируют при температуре (36±1)°С в течение 24 ч. Если за время инкубирования посевов в среде накапливается индол, то желтый цвет индикаторной бумажки меняется на цвет от сиренево-розового до интенсивного малинового. Образование индола можно определить с помощью реактивов Эрлиха и Ковача. Для этого к 5 см 24-часовой культуры добавляют 1 мл одного из реактивов. Образование красного слоя на поверхности культуральной жидкости указывает на положительную реакцию. E.coli образует индол.
E. coli не образует ацетоин.
· способность образовывать ацетоин (реакция Фогес-Проскауэра): культуру высевают в пробирки со средой Кларка. Посевы инкубируют при температуре (36±1)°С в течение 48 ч. После инкубирования посевов к 1 мл отобранной культуральной жидкости прибавляют 0,6 мл раствора 1-нафтола и 0,2 мл раствора гидроокиси калия. После прибавления каждого реактива пробирку встряхивают. Проявление розового окрашивания через 15-60 мин. указывает на положительную реакцию. E.coli не образует ацетоин.
E. coli не утилизирует цитрат.
· способность утилизировать цитрат: культуру высевают в пробирки со средой Козера или на поверхность среды Симмонса. Посевы инкубируют при температуре (36±1)°С в течение 24-48 ч. Изменение оливково-зеленого цвета сред на васильковый, синий указывает на положительную реакцию.
E.coli интенсивно ферментирует углеводы (реакция с метил-рот положительная).
· определение интенсивности ферментации углеводов с образованием кислоты (реакция с метил-рот): культуру высевают в пробирки с глюкозо-фосфатным бульоном или средой Кларка или используют посевы после отбора 1 мл культуральной жидкости для проведения реакции Фогес-Проскауэра. Посевы инкубируют при температуре (36±1)°С в течение 48 ч. К 5 мл культуральной жидкости прибавляют 5-10 капель реактива Кларка. Появление через 1 мин. красного цвета культуральной жидкости указывает на ферментацию углеводов до рН ниже 5,0.
E.coli ферментирует глюкозу, лактозу и сорбит.
· определение ферментации сорбита, глюкозы и лактозы: культуру высевают в среды Гисса с сорбитом или глюкозой, или лактозой. Посевы инкубируют при температуре (36±1)°С в течение 24 ч, а на среде Гисса с лактозой при температуре (44±1)°С в течение 24 ч. При ферментации глюкозы образуется газ. Ферментацию глюкозы можно учитывать в засеянных косяках ТСА или среды Клиглера по изменению цвета столбика среды и образованию в нем газа. Ферментацию лактозы учитывают по изменению цвета скошенной поверхности среды Клиглера. Ферментацию сорбита учитывают по изменению цвета среды. У культур типичных для Е.соli по всем изученным признакам, но не ферментирующим сорбит, изучают возможность ферментации целлобиозы на среде Гисса с целлобиозой, при температуре (36±1)°С в течение 24 ч.
Е.соli не образует сероводород.
· определение образования сероводорода: образование сероводорода учитывают в посевах на среду Клиглера или ТСА после инкубирования посевов при температуре (36±1)°С в течение 24 ч. Почернение в столбике среды указывает на образование сероводорода.
Идентификация Salmonella
Salmonella грамотрицательные палочки с закругленными концами.
1. первичное неселективное накопление (обогащение):
· ЗПВ (забуференная пептонная вода): навеску продукта засевают в среду. Соотношение продукта и ЗПВ 1:9. Рост проявляется в помутнении среды. Культивирование – (36±1)ºС 18±2 ч.
· магниевая среда (хлормагниевая): Засевают непосредственно продукт. Культивирование – (36±1)ºС 24-48 ч.
2. селективное обогащение:
· жидкая элективная среда Кода: культивировать. Признаком роста лактозоотрицательных энтеробактерий (сальмонелл) является помутнение среды без изменения цвета.
· магниевая среда (хлормагниевая): засевают культуру, полученную после предварительной инкубации. Культивирование – (36±1)ºС 24-48 ч.
· селенитовая среда (селенитовый бульон Лейфсона): засевают культуру, полученную после предварительной инкубации. Культивирование – 35ºС 18-24 ч.
· среда Раппапорта-Вассилиадиса с соей (RVS-бульон): засевают культуру, полученную после предварительной инкубации. Культивирование – (41,5±1)ºС 24±3 ч. Рост проявляется диффузным помутнением среды.
· тетратионатная среда Мюллер-Кауфман (МКТ-бульон): засевают культуру, полученную после предварительной инкубации. Культивирование – (43±1)ºС 24-48 ч. или (37±1)ºС 24±3 ч.
3. плотные дифференциально-диагностические среды:
· питательная среда Эндо: низкоселективная среда. Культивирование – (37±1)ºС 18-20 ч. На среде сальмонеллы круглые бесцветные или слегка розоватые, прозрачные. Образование полупрозрачных бесцветных или бледно-розовых колоний свидетельствует о принадлежности микроорганизмов, давших рост на накопительных питательных средах, к лактозоотрицательным энтеробактериям, в том числе сальмонелл.
· среда Плоскирева (или бактоагар Плоскирева): среднеселективная среда. Культивирование – (37±1)ºС 18-20 ч. На средах колонии сальмонелл бесцветные прозрачные, но более плотные, чем на среде Эндо. Бесцветные, нежные, гладкие, круглые диаметром 1,0-2,0 мм.
· среда ВСА (висмут-сульфит агар): высокоселективная среда. Культивирование – (37±1)ºС 24-48 ч. На ВСА колонии сальмонеллы имеют черный цвет с характерным сероватым металлическим блеском в виде ободка, а также зеленоватого цвета с темным центром и темно-зеленым ободком и с пигментированием (потемнением) среды под колониями.
· среда Левина: низкоселективная среда. Культивирование – (37±1)ºС 24-48 ч. На среде колонии сальмонеллы прозрачные, слабо-розовые или розовато-фиолетовые.
· ксилоза-лизин-дезоксихолатный агар (XLD-агар): культивирование – (37±1)ºС 24-48 ч. Колонии сальмонелл имеют черный центр и слегка прозрачную зону красноватого цвета, что принадлежит цвету индикатора. Бактерии рода сальмонелл сероводородотрицательные образуют на среде розовые колонии с темным розовым центром. Лактозоположительные бактерии рода сальмонелла на среде дают желтые колонии с почернением или без него. Круглые, блестящие, бесцветные с черным центром или без него, диаметром 1,0-3,0 мм.
· бриллиантовый зеленый агар: культивирование – (37±1)ºС 48 ч. На среде сальмонеллы образуют красноватые или розовые, почти белые колонии (их цвет зависит от штамма и срока культивирования). Лактозо- и сахарозоположительные сальмонеллы образуют зеленоватые колонии, окруженные яркой желто-зеленой зоной.
· сальмонелла-шигелла агар (SS-агар): культивировать 37°С 18-20 ч. Колонии бесцветные, диаметром 1-2 мм.
· среда Плоскирева: культивировать 37°С 18-20 ч. Колонии малинового цвета, круглые, выпуклые, гладкие диаметром 1,5-2,5 мм.
· скошенный РПА или ПА: Культивирование – (36±1)ºС 24 ч. Рост прозрачный по штриху.
4. морфология клеток:
· сальмонеллы грамотрицательные палочки с закругленными концами.
5. биохимические тесты:
Salmonella ферментирует глюкозу с образованием или без образования газа, не ферментирует лактозу и сахарозу.
· способность ферментировать сахара (лактозу, глюкозу и сахарозу): на трехсахарном агаре (ТСА, TSI-агар), среде Олькеницкого (3 сахара с мочевиной) среде Клиглера (2 сахара): Посев осуществляется петлей на скошенную поверхность и уколом в столбик с помощью бактериальной иглы. Культивирование – (36±1)ºС 24 ч. Пожелтение скошенной части среды указывает на ферментацию лактозы или сахарозы, или обоих сахаров. Красная или неизменившая цвета среда говорит о лактозо- и сахарозоотрицательных сальмонеллах. Пожелтение столбика среды указывает на ферментацию глюкозы. Красный или неизменившийся цвет – глюкоза отрицательная. Столбик с разрывом агара или пузырьками газа – образование газа. Отсутствие разрывов и пузырьков – газ не образуется. Агар Клиглера – по скошенной поверхности учитываю только ферментацию лактозы.
Salmonella образует сероводород.
· способность образовывать сероводород: Посев осуществляется петлей на скошенную поверхность и уколом в столбик ТСА, среду Олькеницкого, Клиглера с помощью бактериальной иглы. Культивирование – (36±1)ºС 24 ч. Почернение среды в столбике указывает на образование сероводорода.
Salmonella не расщепляет мочевину.
· способность расщеплять мочевину: культуру со скошенного РПА (ПА) пересевают штрихом на поверхность агара с мочевиной (агар Кристенсена с мочевиной). Культивирование – (36±1)ºС 24 ч. При положительной реакции – расщеплении мочевины с выделением аммония цвет среды фенолового красного меняется от розового до светло-вишневого. Для уреазоположительных бактерий реакция часто становится видимой после 2 ч. инкубации.
Salmonella не образует ацетоин (реакция Фогес-Проскауэра отрицательная).
· способность образовывать ацетоин: реакция Фогес-Проскауэра. Культуру со скошенного РПА (ПА) пересевают в МПБ (РМБ) с глюкозой или суспендируют петлей в стерильной пробирке с 3 мл VP среды. Культивирование – (36±1)ºС 48 ч. После культивирования к 1 мл отобранной культуральной жидкости прибавляют 0,6 мл раствора α-нафтола и 0,2 мл раствора гидроокиси калия концентрации 400 г/л. Или прибавляют две капли раствора креатина, три капли спиртового раствора 1-нафтола и две капли раствора гидроокиси калия, перемешивают содержимое пробирки после прибавления каждого реактива. После прибавления каждого реактива пробирку встряхивают. Появление розового или светло-красного окрашивания через 15 мин. указывает на положительную реакцию.
Salmonella не образует индол.
· способность образовывать индол: культуру со скошенного РПА (ПА) пересевают в бульон Хоттингера или в МПБ (РПБ) с L-триптофаном, или в 5 мл триптон/триптофановой среды. Культивирование – (36±1)ºС 24 ч. После инкубирования, к посеву прибавляют по 1 мл реактива Эрлиха и Ковача. Образование красного слоя указывает на положительную реакцию.
Salmonella не сбраживает сахарозу, но сбраживает манит. При сбраживании маннита цвет среды изменяется, образуется или не образуется газ.
· способность сбраживать манит и сахарозу: культуру со скошенного РПА (ПА) пересевают с среды Гисса с маннитом и сахарозой. Культивирование – (36±1)ºС 24 ч.
Большинство штаммов Salmonella подвижны.
· способность двигаться: культуру со скошенного РПА (ПА) пересевают уколом с помощью бактериальной иглы в полужидкий МПА. Культивирование – (36±1)ºС 24 ч. При росте подвижных культур отмечается диффузный рост по всему столбику агара, при росте неподвижных – вдоль места укола.
Salmonella paratyphi не образует L-лизиндекарбоксилазу, остальные образуют.
· образование L-лизиндекарбоксилазы: инокулируют снизу жидкую L-лизиндекарбоксилазную среду. Культивирование – (37±1)ºС 24±3 ч. Помутнение и пурпурный цвет среды указывает на положительную реакцию. Желтый цвет – на отрицательную.
Salmonella, кроме Salmonella arizonae не обладают β-галактозидазой.
· наличие β-галактозидазы: суспендируют петлей суточную культуру со скошенного РПА (ПА) в 0,25 мл физраствора, прибавляют одну каплю толуола и встряхивают пробирку. Помещают ее на водяную баню при температуре 37ºС и оставляют примерно на 5 мин. Затем добавляют0,25 мл реактива для определения β-галактозидазы и перемешивают. Оставляют пробирку на водяной бане при 37ºС в течение (24±3) ч, наблюдая за изменением цвета через определенные промежутки времени. Желтый цвет указывает на положительную реакцию. Изменение цвета обнаруживается примерно через 20 мин.
Читайте также:



