Идентификация возбудителей колибактериоза и сальмонеллезов

Колибактериоз (colibacteriosis) (колиинфекция, эшерихиоз) — острая инфекционная болезнь, характеризующаяся профузным поносом, признаками тяжелой интоксикации и обезвоживанием организма.
Заболевание распространено во многих странах мира и многих регионах нашей страны.
Возбудитель. Энтеропатогенные штаммы Е. coli, которые представляют собой довольно толстую, грамотрицательную палочку, спор не образует. Имеются подвижные и неподвижные варианты. Возбудитель — аэроб или факультативный анаэроб. В процессе роста эшерихии образуют колицин, термолабильный и термостабильный экзотоксин, гемолизин, нейротоксин, фибринолизин и др., которые являются ведущими патогенетическими факторами. Эшерихии имеют сложную антигенную структуру: соматический О-антигены, поверхностный К-антигены и жгутиковый Н-антигены.
У собак чаще выделяют энтеропатогенные серовары Е. coli серогрупп 0,86, 02, 026, 055, 078, 0125, 0111 и 020. К-антигенный состав и токсигенные свойства их изучены недостаточно. От собак выделяют до 50% гемолитических штаммов эшерихий.
Устойчивость. В фекалиях и слизи эшерихии сохраняются до 30 дней, в воде и почве — до нескольких месяцев. Нагревание до 74-76 °С убивает их за 30 секунд.
Эпизоотологические данные. К колибактериозу восприимчив новорожденный молодняк всех видов сельскохозяйственных животных, собак, пушных зверей и кроликов. Щенки заболевают в 1-5-дневном реже — в 6-10-дневном возрасте.
Источником возбудителя являются больные, переболевшие колибактериозом животные и взрослые — носители патогенных эшерихий. Возбудитель во внешнюю среду из организма животных выделяется с фекалиями, иногда с мочой. Факторами передачи возбудителя могут быть контаминированные возбудителем предметы ухода за животными, корма, вода и подстилка. Заражение щенят чаще происходит алиментарным путем, особенно при несоблюдении правил гигиены, при употреблении молозива, молока, воды, контаминированных возбудителями. Возможен внутриутробный и аэрогенный путь заражения.Болезнь носит очаговый характер и протекает энзоотически. Большую роль в ее возникновении играют также такие предрасполагающие факторы, как неполноценное и недоброкачественное кормление, сопутствующие заболевания, нарушение условий содержания, ветеринарно-санитарных и зоогигиенических правил. Заболевание может встречаться в любое время года.
Патогенез. Возбудитель, проникнув в организм, внедряется в слизистую оболочку тонкого отдела кишечника, размножается, образует эндотоксины, которые повреждают клетки слизистой кишечника и воздействует на нервную систему. Нарушается функция кишечника, сопровождающаяся диареей, что приводит к обезвоживанию, ацидозу и гибели животного.
Течение и симптомы. Инкубационный период короткий: от нескольких часов до суток. У щенков болезнь проявляется в энтеритной и реже — септической формах.
При энтеритной форме болезни щенки пищат, беспокоятся, волосяной покров у них взъерошен, матового цвета, загрязнен фекалиями. Фекалии жидкие с пузырьками газа, желто-зеленого и бело-желтоватого цвета, часто с примесью слизи. Через 1-2 дня щенки становятся вялыми и холодными на ощупь, через 1-5 суток погибают. У щенков старшего возраста болезнь протекает с теми же признаками, но за более длительный период. Реже наблюдают септическую форму, при которой поражается щенки в возрасте 3-5 дней. У больных щенков отмечают признаки менингоэнцефалита, они возбуждены и угнетены, координация движений у них нарушена, развивается парез конечностей и судороги.
У беременных животных иногда отмечают аборты или рождение мертвых щенков.
Патологоанатомические изменения. Изменения наблюдаются в основном в желудочно-кишечном тракте. Регистрируют признаки катарального или катарально-геморрагического воспаления кишечника. Мезентериальные лимфатические узлы отечны, гиперемированы с кровоизлияниями. Часто содержимое кишечника желто-белого или серого цвета с примесью крови и желчи. Селезенка, печень, почки часто увеличены, темно-красного цвета, полнокровны. Сосуды головного мозга инъецированы с кровоизлияниями, возможны скопления гнойного экссудата или розоватой жидкости в желудочках мозга.
Диагноз на колибактериоз ставят на основании анализа эпизоотических, клинических, патологоанатомических данных и результатов бактериологического исследования. Для исследования в лабораторию направляют свежие трупы или головной мозг, трубчатую кость, селезенку, часть печени с желчным пузырем, отрезок пораженного тонкого отдела кишечника и лимфоузлы. Бактериологическое исследование основано на выделении и идентификации эшерихий, определение в РА серологической группы и патогенности культуры для белых мышей. Диагноз считают установленным при выделении культур эшерихий из селезенки, костного или головного мозга без определения их серогруппы и патогенности, а также при получении из двух и более органов патогенных для белых мышей культур, отнесенных по РА к энтеропатогенным серогруппам.
Дифференциальный диагноз. Колибактериоз необходимо дифференцировать от стрептококкоза, сальмонеллеза, респираторной инфекции, отравлений путем проведения бактериологических и вирусологических исследований.
Лечение колибактериоза у животных.
Лечение собак проводят комплексно с использованием поливалентной антитоксической сыворотки против сальмонеллеза и колибактериоза сельскохозяйственных животных и птиц, этиотропных средств, препаратов, нормализующих процессы пищеварения, предотвращающих обезвоживание, интоксикацию, а также стимулирующих иммунологическую реактивность организма. Активными антимикробными препаратами при колибактериозе являются антибиотики, но после предварительного определения чувствительности к ним возбудителя болезни в сочетании с сульфаниламидными и нитрофурановыми препаратами. Левомицетин назначают 3-4 раза в день в дозе 0,01-0,02 на 1 кг массы; тетрациклин —3-4 раза в день в день в дозе 20-30 мг на 1 кг массы; неомицин — 5-10 мг на 1 кг массы три раза в день. Внутрь рекомендуют фталазол 0,1-0,5 г 3-4 раза в день; сульгин — в тех же дозах 2 раза в день; фуразолидон — по 30 мг на 1 кг массы 2 раза в день, иммодиум по 1 капсуле 2 раза в день. При пневмонии применяют норсульфазол, сульфадимезин или этазол — по 0,25-0,5 г внутрь 3-4 раза в сутки. В-активин внутримышечно по 1 мг на 1 кг массы 1 раз в сутки до выздоровления.
При сердечной недостаточности вводят растворы кофеина, камфорное масло.
Для устранений явлений токсикоза и восстановления в организме водно-солевого обмена инъецируют в брюшную полость или под кожу глюкозо-солевые растворы. Применяют также витамины A, D, C. Можно применять бактериофаг, АБК и ПАБК.
Иммунитет. Молодняк, переболевший колибактериозом, приобретает невосприимчивость к последующему заражению.
Профилактика и меры борьбы. Профилактика колибактериоза основана на проведении комплекса организационно-хозяйственных, зоотехнических, ветеринарно-санитарных и противоэпизоотических мероприятий, направленных на повышение резистентности организма матерей и их потомства, обеспечение гигиены родов и предотвращения заражения новорожденных щенят.
Важным условием получения здорового молодняка является полноценное кормление и правильное содержание беременных маток и новорожденных животных.
При появлении колибактериоза всех больных щенят изолируют и лечат. Осуществляют дезинфекцию вольеров, домиков, инвентаря, подстилки 2-3%-ными растворами натрия гидроокиси или формальдегида. Проводят систематически дератизацию и дезинсекцию.
Цель – формирование практических умений проводить лабораторную диагностику колибактериоза и сальмонеллезов, формирование знаний о сущности и технике проведения бактериологических и серологических методов исследований, умений выделять биологические особенности возбудителей, работая с лабораторным оборудованием, делать заключение по изученному материалу, навыков работы с источниками информации, сопоставление биологических особенностей разных видов сальмонелл и эшерихий.
План
1. Патологический материал для лабораторного исследования кишечных инфекций.
2. Бактериологические методы диагностики колибактериоза и сальмонеллеза.
3. Серологические методы типизации энтеробактерий.
Теоретический материал
Диагностику колибактериоза определяют по клиническим, патологоанатомическим и эпизоотологическим данным, с обязательным подтверждением лабораторным исследованием.
Бактериологическое исследование. Для бактериологического исследования в лабораторию направляют патологический материал: для прижизненной диагностики – фекалии от больных животных, которые берут из прямой кишки в стеклянные пробирки стеклянной палочкой; для посмертной диагностики - свежий труп или трубчатую кость, отрезок кишечника перевязанного с двух концов, кусок печени, селезенки, почку, брыжеечные лимфоузлы. При вскрытии трупа в лаборатории помимо указанного материала исследуют также кровь из сердца и головной мозг. Если в лабораторию не представляется в кротчайший срок доставить материал. Его консервируют: фекалии - раствором стерильного глицерина с NaCl, кусочки внутренних органов в 30%-ном водном растворе глицерина или 10%-ном растворе NaCl.
В лаборатории проводят комплексное исследование поступившего материала.
При микроскопии мазков из органов и крови обнаруживают палочки с закругленными краями, расположенные одиночно, по Граму окрашиваются отрицательно.
Для выделения культур эшерихий используют МПА, МПБ, а также среды специального назначения: Эндо, Левина, Симонса, Кларка и др.
На МПА через 18…20ч вырастают влажные круглые колонии с ровными краями и гладкой поверхностью. В жидкой среде рост эшерихий проявляется равномерным помутнением с образованием осадка. Некоторые штаммы обладают гемолитическими свойствами.
На среде Эндо образует три типа колоний:
1) малиновые с металлическим блеском;
2) малиновые с розовым блеском;
На среде Левина дает рост в виде колоний темнофиолетового цвета.
На среде Симсона не растут: цвет ее не изменяется. На среде Кларка: розово-красное окрашивание учитывают как положительный результат, желтое как отрицательный. Глюкозу и лактозу сбраживает с образованием кислоты и газа. Обесцвечивают метиленовую синь в молоке, молоко свертывает, образует индол. Реакция с метилротом положительная, проба Фогеса-Проскауэра отрицательная. Основываясь на морфологических и культурально - биохимических свойствах, проводят межвидовую дифференциацию. Выделенную культуру типируют в РА, используя типоспецифические агглютинирующие коли-сыворотки.
Биопроба. Выделенные культуры проверяют на патогенность, заражая внутрибрюшинно белых мышей.
Диагноз на колибактериоз считают установленным, если культуру возбудителя изолируют из селезенки, трубчатой кости или из головного мозга. Болезнь также подтверждается, если выделенная культура эшерихий из других органов вызывает гибель белых мышей. В большинстве случаев E.coli , выделенные из трупа или фекалий больных коли-инфекций животных, патогенны для мышей.
Кроме бактериологического исследования, диагноз устанавливают ускоренными методами. В этих целях применяют иммунохимический метод, путем постановки РДП или РИФ. При этом с помощью реакции иммунофлюоресценции можно ставить диагноз через 2-4 часа.
Помимо общепринятого микробиологического исследования существуют также дополнительные методы диагностики. Например, люминесцентно-серологический метод используют как ориентировочный для определения патогенных серотипов E.coli при массовых вспышках желудочно-кишечных заболеваний. Этот метод позволяет за короткий срок получить предварительные результаты.
Колибактериоз следует дифференцировать от диареи незаразного происхождения, сальмонеллеза, стрептококкоза, пастереллёза, некоторых вирусных инфекций.
Бактериологическая прижизненная диагностика сальмонеллезов основана на исследовании крови в первые четыре дня заболевания (для выделения гемокультуры) и фекалий. Начиная с 14-го дня болезни, посылают сыворотку крови для серологического исследования и установления титра специфических антител.
Посмертно в лабораторию направляют паренхиматозные органы или части их (печень с желчным пузырем), мезентеральные лимфатические узлы.
Полученный материал засевают в МПБ, на МПА, дифференциальные и элективные среды – Эндо, Плоскирева или висмут-сульфитный агар. При подозрении на хроническое течение болезни дополнительно высевают материал на одну из сред накопления (селенитовую, Мюллера).
При подтверждении диагноза тушки истощенных птиц, а также внутренние органы, имеющие патологоанатомические изменения, направляют на утилизацию. При поражении только внутренних органов тушки используют после проваривания для переработки на консервы, а внутренние органы утилизируют. Перо и пух дезинфицируют.
Яйца от неблагополучных по сальмонеллезу кур, индеек направляют на пищевые предприятия для приготовления хлебобулочных, кондитерских изделий, выпекаемых при высокой температуре.
Теоретический материал по теме занятия студенты конспектируют в тетрадь и выполняют практические задания.
Практическое задание 1: Составьте схему проведения лабораторного исследования на сальмонеллез и колибактериоз (эшерихиоз).
Этапы выполнения задания:
1 Отберите патологический материал для бактериологического исследования.
2 Определите последовательность и технику выполнения бактериологических методов диагностики.
3 Определите порядок серологического типирования выделенных из биоматериала микробных культур.
4 Схемы исследований зарисуйте в тетрадь.
Практическое задание 2: Определите морфологические и тинкториальные свойства микробной культуры.
Этапы выполнения задания:
1 Приготовьте мазки-препараты из смыва агаровой культуры E. сoli, зафиксируйте их.
2 Окрасьте мазки-препараты по методу Грама.
3 Микроскопируйте окрашенные препараты, зарисуйте и опишите морфологические особенности возбудителя в тетрадь, отчитайтесь преподавателю.
Практическое задание 3: Определите культуральные свойства микробных культур.
Этапы выполнения задания:
1 Опишите характер роста микробной культуры на среде МПБ.
2 Опишите характер роста микробной культуры на среде МПА.
3 Опишите характер роста микробной культуры на дифференциальных средах.
4 Проанализируйте культуральные свойства изученной микробной культуры и сделайте заключение о соответствии ее сальмонеллам или кишечной палочки.
Практическое задание 4: Проведите типизацию микробной культуры.
Этапы выполнения задания:
1 Проведите учет сахаролитических свойств микробных культур.
2 Проведите учет протеолитических свойств микробных культур.
3 Анализируйте полученные результаты, определите вид микроорганизма, отчитайтесь преподавателю.
Практическое задание 5: Проведите посев фекалий на дифференциально-диагностическую среду.
Этапы выполнения задания:
1 Приготовьте взвесь фекалий животных, оставьте их отстояться.
2 Проведите посев надосадочной жидкости фекальной взвеси бактериологической петлей частыми штрихами на агар Эндо.
3 На следующем занятии проведите учет и оценку роста микроорганизмов на агаре Эндо, отчитайтесь преподавателю, пояснив, что дает посев штрихом.
Практическое задание 6: Проведите контроль биологических препаратов, применяемых при кишечных инфекциях.
Этапы выполнения задания:
1 Определите назначение биологического препарата (диагностические, профилактические, лечебные), способ применения.
2 Определите пригодность препарата к использованию, обратите внимание на срок годности препарата, целостность упаковки, соответствие содержимого ампулы (флакона и др.) описанию в наставлении к препарату.
3 Полученные результаты внесите в таблицу рабочей тетради, проанализируйте и сделайте заключение по каждому препарату.
Вопросы и задания для контроля знаний. 1 Перечислите патологический материал, направляемый для бактериологического исследования на эшерихиоз, и требования к нему. 2 Назовите питательные среды, используемые для выделения и дифференциации кишечной палочки. 3 Поясните порядок бактериологического исследования различных видов биоматериала на наличие возбудителя эшерихиоза. 4, Каково практическое использование знаний об антигенной структуре кишечной палочки? 5 В чем заключается серологическая типизация энтеропатогенных штаммов эшерихий по адгезивным и соматическим О-антигенам. 6 По каким признакам дифференцируют кишечную палочку от сальмонелл? 7 Какими штаммами кишечной палочки вызывается отечная болезнь поросят? 8 В каких случаях считается установленным бактериологический диагноз на колибактериоз? 9 Дайте характеристику биопрепаратам, применяемым для диагностики, лечения и профилактики колибактериоза (эшерихиозов) и сальмонеллезов. 10 Какой биоматериал направляют для бактериологического исследования на сальмонеллез? 11 Какие питательные среды используют для выделения и дифференциации сальмонелл? 12 Поясните порядок бактериологического исследования различных видов биоматериала на наличие сальмонелл. 13 Какова антигенная структура сальмонелл, её практическое использование? 14 Каким методом определяют серогруппу сальмонелл? 15 По каким признакам дифференцируют сальмонеллы от эшерихий?

Учебник предназначен для студентов, аспирантов и преподавателей высших медицинских учебных заведений, университетов, микробиологов всех специальностей и практических врачей.
5-е издание, исправленное и дополненное
Книга: Медицинская микробиология, иммунология и вирусология
Сальмонеллезы
Сальмонеллы являются не только основными возбудителями пищевых токсикоинфекций, но и часто причиной своеобразных диарей – сальмонеллезов.
Ключевые признаки рода Salmonella следующие: короткие грамотрицательные палочки с закругленными концами, длиной 1,5 – 4,0 мкм, в большинстве случаев подвижные (перитрихи), спор и капсул не имеют, образуют при ферментации глюкозы (и ряда других углеводов) кислоту и газ (за исключением S. typhi и некоторых других серотипов), имеют лизин– и орнитиндекарбоксилазы, не имеют фенилаланиндезаминазы, образуют H2S (некоторые не образуют), дают положительную реакцию с MR, растут на голодном агаре с цитратом (кроме S. typhi), не ферментируют лактозу (кроме S. arizonae и S. diarizonae), не образуют индола, не имеют уреазы и дают отрицательную реакцию Фогеса – Проскауэра. Содержание Г + Ц в ДНК составлят 50 – 52 мол %. Культуральные свойства такие же, как у возбудителей тифа и паратифов А и В.
Классификация. Род Salmonella включает единственный вид S. enteritica (ранее – S. choleraesuis) с семью основными подвидами: S. choleraesuis, S. salamae, S. arizonae, S. diarizonae, S. houtenae, S. bongori, S. indica, которые различаются по ряду биохимических признаков (табл. 35).
Серологическая классификация сальмонелл по Уайту и Кауффманну.
У сальмонелл имеются О-, Н– и К-антигены. Обнаружено 65 различных О-антигенов. Они обозначаются арабскими цифрами от 1 до 67. По О-антигену сальмонеллы разделены на 50 серологических групп (A – Z, 51 – 65). Некоторые О-антигены встречаются у сальмонелл двух групп (О6, О8); антигены О1 и О12 – у представителей многих серогрупп, но представители каждой серогруппы имеют один главный, общий для всех О-антиген, по которому они и разделяются на серогруппы (в табл. 35 эти антигены выделены жирным шрифтом). Специфичность О-антигенов определяется полисахаридом ЛПС. У всех сальмонелл полисахариды обладают общим внутренним ядром, к которому прикрепляются О-специфические боковые цепи, состоящие из повторяющегося набора олигосахаров. Различия в связях и композициях этих сахаров обеспечивают химическую основу серологической специфичности. Например, специфичность О2-антигена определяется сахаром паратозой, О4 – абеквозой, О9 – тивелозой и т. д.
Дифференциация подвидов S. enteritica

Примечание. (+) – признак положительный; ( – ) – признак отсутствует; (?) – ферментация поздняя и нерегулярная; (?) – неизвестно.
У сальмонелл различают два типа Н-антигенов: I фаза и II фаза. Обнаружено более 80 вариантов Н-антигенов I фазы. Они обозначаются строчными латинскими буквами (a – z) и арабскими цифрами (z1– z59). Н-антигены I фазы встречаются только у определенных серотипов, иначе говоря, по Н-антигенам серогруппы разделяют на серотипы. Нантигены II фазы имеют в своем составе общие компоненты, они обозначаются арабскими цифрами и встречаются у разных серовариантов. Обнаружено 9 Н-антигенов II фазы.
К-антигены сальмонелл представлены разными вариантами: Vi– (S. typhi, S. paratyphi C, S. dublin), M-, 5-антигены. О значении Vi-антигена сказано выше.
Современная серологическая классификация сальмонелл насчитывает уже свыше 2200 серовариантов. В табл. 36 перечислены сальмонеллы, которые чаще всего вызывают заболевания людей и животных.
Для серологической идентификации сальмонелл выпускают диагностические адсорбированные моно– и поливалентные О– и Н-сыворотки, содержащие агглютинины к О– и Н-антигенам тех серотипов сальмонелл, которые чаще всего вызывают заболевания людей и животных.
Бо?льшая часть сальмонелл (около 98 %) чувствительна к сальмонеллезному фагу О1. Кроме того, разработана схема фаготипирования наиболее частого возбудителя сальмонеллезов – S. typhimurium, она позволяет дифференцировать более 120 его фаготипов.
Резистентность. Устойчивость сальмонелл по отношению к некоторым физическим и химическим факторам довольно высока. Нагревание при температуре 70 °C выдерживают в течение 30 мин. Устойчивость к высокой температуре повышается, когда сальмонеллы находятся в пищевых продуктах, особенно в мясе. При варке в течение 2,5 ч мясо, зараженное сальмонеллами и заложенное в холодную воду, становится стерильным в кусках весом не более 400,0 г при толщине кусков 6 см; а при закладке в кипяток стерильность за тот же срок варки достигается лишь в кусках весом до 200,0 г, при толщине их 5,0 – 5,5 см. Соление и копчение мяса оказывают относительно слабое действие на сальмонеллы. При содержании NaCl 12 – 20 % в соленом и копченом мясе сальмонеллы выживают при комнатной температуре до 1,5 – 2 мес. Обычные химические дезинфектанты убивают сальмонеллы за 10 – 15 мин.
Факторы патогенности. У сальмонелл имеются факторы адгезии и колонизации, факторы инвазии; они имеют эндотоксин и, наконец, они, по крайней мере S. typhimurium и некоторые другие серотипы, могут синтезировать два типа экзотоксинов:
а) термолабильные и термостабильные энтеротоксины типа LT и ST;
б) шигаподобные цитотоксины.
Особенностью токсинов является внутриклеточная локализация и выделение после разрушения бактериальных клеток. LT сальмонелл имеет структурное и функциональное сходство с LT энтеротоксигенных E. coli и с холерогеном. Его м. м. 110 кД, он устойчив в диапазоне рН 2,0 – 10,0. Токсинообразование у сальмонелл сочетается с наличием у них двух факторов кожной проницаемости:
а) быстродействующего – продуцируется многими штаммами сальмонелл, термостабилен (при 100 °C сохраняется в течение 4 ч), действует в течение 1 – 2 ч;
б) замедленного – термолабилен (разрушается при 75 °C в течение 30 мин), вызывает эффект (уплотнение кожи кролика) через 18 – 24 ч после введения.
Молекулярные механизмы диареи, вызываемой LT и ST сальмонелл, по-видимому, также связаны с нарушением функции аденилат– и гуанилатциклазных систем энтероцитов. Цитотоксин, продуцируемый сальмонеллами, термолабилен, его цитотоксическое действие проявляется в угнетении синтеза белка энтероцитами. Обнаружено, что отдельные штаммы сальмонелл могут одновременно синтезировать LT, ST и цитотоксин, другие – только цитотоксин.
Вирулентность сальмонелл зависит также от обнаруженной у них плазмиды с м. м. 60 МД, утрата ее значительно снижает вирулентность бактерий. Предполагается, что появление эпидемических клонов сальмонелл связано с приобретением ими плазмид вирулентности и R-плазмид.
Особенности эпидемиологии. Из числа известных сальмонелл лишь S. typhi и S. paratyphi A вызывают заболевание только у человека – брюшной тиф и паратиф А. Все остальные сальмонеллы патогенны также для животных. Первичным источником сальмонелл являются животные: крупный рогатый скот, свиньи, водоплавающие птицы, куры, синантропные грызуны и большое число других животных. Заболевания животных, вызываемые сальмонеллами, подразделяются на 3 основные группы: первичные сальмонеллезы, вторичные сальмонеллезы и энтерит крупного рогатого скота. Первичные сальмонеллезы (паратиф телят, тиф поросят, тиф кур, дизентерия цыплят и т. д.) вызываются определенными возбудителями и протекают с характерной клиникой. Вторичные сальмонеллезы возникают при условиях, когда организм животного в результате каких-то причин (нередко различных болезней) резко ослаблен; они не связаны с конкретными типами сальмонелл у определенных животных, вызываются различными их серотипами, но чаще всего – S. typhimurium.
Сокращенная схема серологической классификации сальмонелл
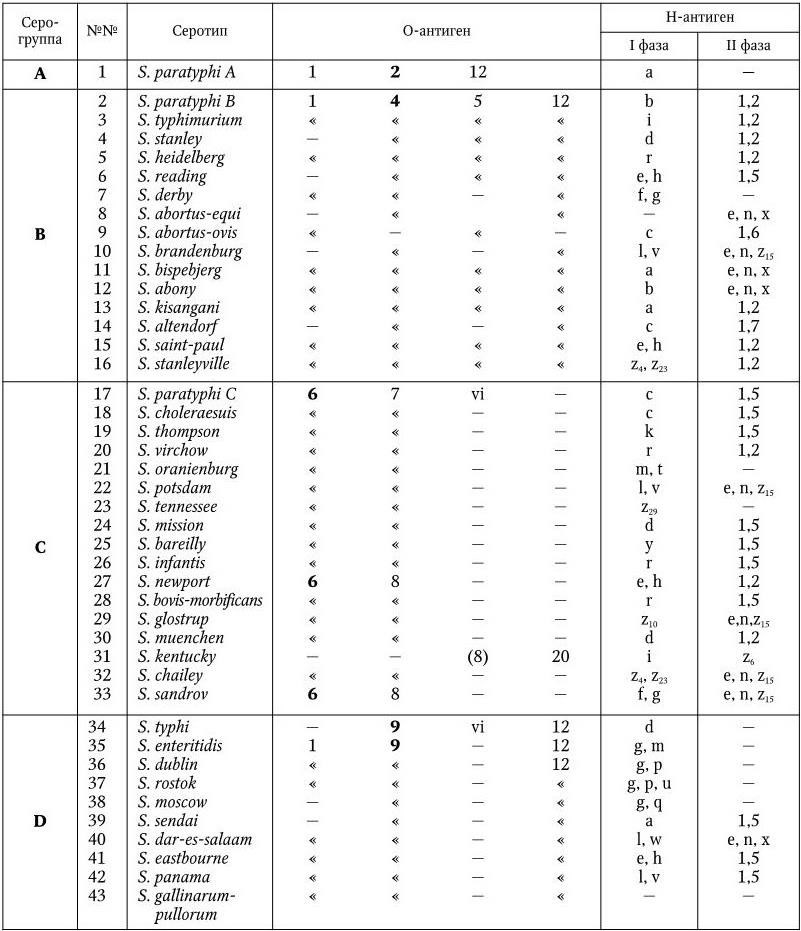

Энтерит крупного рогатого скота характеризуется определенной клинической картиной и в этом отношении сходен с первичным сальмонеллезом. Однако энтерит в данном случае является вторичным проявлением, первичную же роль играют различные предрасполагающие обстоятельства. Возбудителями его чаще всего бывают S. enteritidis и S. typhimurium.
Наиболее опасными источниками пищевых токсикоинфекций являются животные, страдающие вторичным сальмонеллезом и энтеритом крупного рогатого скота. Большую роль в эпидемиологии сальмонеллезов играют водоплавающие птицы и их яйца, а также куры, их яйца и другие птицепродукты. Сальмонеллы могут попасть в яйцо непосредственно во время его развития, но могут легко проникнуть и через неповрежденную скорлупу. Вспышки токсикоинфекций чаще всего связаны с употреблением мяса, инфицированного сальмонеллами, – до 70 – 75 %, в том числе до 30 % мяса скота вынужденного забоя. Вынужденному забою часто подвергают животных, находящихся в агональном состоянии. У ослабленных животных сальмонеллы легко проникают из кишечника в кровь, а через нее – в мышцы, обусловливая прижизненное инфицирование мяса. На долю яиц и птицепродуктов приходится более 10 %, на долю молока и молочных продуктов – около 10 %, и на долю рыбопродуктов – около 3 – 5 % всех вспышек сальмонеллезов.
Современная эпидемиология сальмонеллезов характеризуется постоянным ростом заболеваемости людей и животных и увеличением числа серотипов сальмонелл, вызывающих эти заболевания. С 1984 по 1988 г. в Англии число случаев сальмонеллезов возросло в 6 раз. Однако специалисты ВОЗ полагают, что истинное число случаев сальмонеллезов остается неизвестным. По их мнению, выявляется не более 5 – 10 % инфицированных лиц. Одной из основных причин роста заболеваемости сальмонеллезом является инфицирование пищевых продуктов при их производстве в результате широкого распространения сальмонелл на объектах внешней среды и на обрабатывающих предприятиях, куда поступают животные, у которых сальмонеллез протекает в скрытой форме. Одной из главных причин широкой циркуляции сальмонелл среди животных является применение корма, содержащего переработанные побочные продукты животного происхождения и очень часто зараженного сальмонеллами.
Несмотря на постоянное увеличение числа серотипов сальмонелл, выделяемых от людей и животных, по-прежнему до 98 % всех случаев сальмонеллезов обусловлено сальмонеллами групп A, B, C, D и E, в первую очередь S. typhimurium и S. enteritidis (до 70 – 80 % случаев заболеваний).
Другой немаловажной особенностью современной эпидемиологии сальмонеллезов является установление роли человека как источника заражения сальмонеллами. Заражение человека от больного или бактерионосителя возможно не только через пищу, в которой сальмонеллы находят хорошие условия для размножения, но и контактно-бытовым путем. Этот способ заражения приводит к широкому распространению бессимптомного бактерионосительства.
Крупная водная эпидемия сальмонеллезной инфекции в 1965 г. в Риверсайде (США), обусловленная S. typhimurium (заболело около 16 тыс. человек), показала, что заражение сальмонеллами возможно не только через пищу, но и через воду.
К особенностям эпидемиологии сальмонеллезов за последние годы следует отнести также повышение этиологической роли S. enteritidis, активизацию пищевого пути передачи возбудителей инфекции с преобладанием роли птицы и птицепродуктов, увеличение числа групповых заболеваний, в том числе внутрибольничных, рост заболеваемости среди детей до 14 лет (более 60 % всех случаев заболеваний).
Особенности патогенеза и клиники. Сальмонеллезы могут протекать с различной клинической картиной: в виде пищевой токсикоинфекции, сальмонеллезной диареи и генерализованной (тифозной) формы, – все зависит от величины заражающей дозы, степени вирулентности возбудителей и иммунного статуса организма. Массивное обсеменение сальмонеллами пищевого продукта обусловливает пищевую токсикоинфекцию, при которой основные симптомы связаны с поступлением возбудителя в кровь в большом количестве, его распадом и высвобождением эндотоксина. В основе сальмонеллезной диареи лежит колонизация сальмонеллами энтероцитов. После прикрепления к гликокаликсу тонкого кишечника сальмонеллы внедряются между ворсинками и, прикрепляясь к плазмолемме энтероцитов, колонизируют ее, повреждают микроворсинки, вызывают слущивание энтероцитов и умеренное воспаление слизистой оболочки. Освобождающийся энтеротоксин вызывает диарею, а цитотоксин – гибель клеток. Сальмонеллы размножаются на плазмолемме, но не в энтероцитах, а происходит их инвазия через эпителий в подлежащие ткани слизистой оболочки, они транспортируются через нее в макрофагах, поступают в лимфу и кровь, вызывая бактериемию и генерализацию инфекционного процесса.
Постинфекционный иммунитет изучен недостаточно. Судя по тому, что сальмонеллезом болеют главным образом дети, постинфекционный иммунитет достаточно напряженный, но является, по-видимому, типоспецифическим.
Лабораторная диагностика. Основной метод диагностики сальмонеллезной инфекции – бактериологический. Материалом для исследования служат испражнения, рвотные массы, кровь, промывные воды желудка, моча, послужившие причиной отравления продукты. Особенности бактериологической диагностики сальмонеллезов:
1) использование сред обогащения (селенитовой, магниевой), в особенности при исследовании испражнений;
2) для обнаружения сальмонелл пробы следует брать из последней, более жидкой, части испражнений (верхнего отдела тонкого кишечника);
3) соблюдать соотношение 1: 5 (одна часть испражнений на 5 частей среды);
4) в связи с тем, что S. arizonae и S. diarizonae ферментируют лактозу, использовать в качестве дифференциально-диагностической не только среду Эндо, но и висмут-сульфит-агар, на котором колонии сальмонелл приобретают черный (некоторые – зеленоватый) цвет;
5) для посева крови использовать среду Рапопорт;
6) использование для предварительной идентификации колоний О1-сальмонеллезного фага, к которому чувствительны до 98 % сальмонелл;
7) для окончательной идентификации выделенных культур вначале используют поливалентные адсорбированные О– и Н-сыворотки, а затем – соответствующие моновалентные О– и Н-сыворотки.
Для быстрого обнаружения сальмонелл могут быть использованы поливалентные иммунофлуоресцентные сыворотки. Для выявления антител в сыворотке крови больных и переболевших используется РПГА с применением поливалентных эритроцитарных диагностикумов, содержащих полисахаридные антигены серогрупп A, B, C, D и E.
Лечение. В случае пищевой токсикоинфекции – промывание желудка, применение антибактериальных препаратов, общеукрепляющих средств. При сальмонеллезных диареях – восстановление нормального водно-солевого обмена, антибиотикотерапия.
Специфическая профилактика не применяется, хотя предложены различные вакцины из убитых и живых (мутантных) штаммов S. typhimurium.
Читайте также:


