Плазмокоагулирующий стафилококк что это такое и чем
Плазмокоагулаза вызывает свертывание плазмы крови. Стафилококки, продуцирующие этот фермент, покрываются фибриновым чехлом, защищающим их от фагоцитоза. Большие концентрации коагу-лазы, циркулирующие в организме больного, приводят к понижению свертываемости крови, нарушению гемодинамики, прогрессирующему кислородному голоданию тканей.
Плазмокоагулазу выявляют путем внесения выделенной культуры в пробирку с цитратной плазмы кролика. У кролика из сердца берут 8 мл крови, вносят в пробирку с 2 мл 5% лимонно-кислого натрия и ставят в холодильник. После полной осадки форменных элементов плазму отсасывают в стерильную пробирку. Она может храниться в холодильнике 8-10 дней. Перед использованием ее разводят 1:5 (1 мл плазмы и 4 мл изотонического раствора хлорида натрия) и разливают в аглютинацийни стерильные пробирки по 0,5 мл. Полную петлю культуры стафилококков эмульгируют в плазме и помещают в термостат на 3 часа, затем оставляют при комнатной температуре на 18-20 часов. Предварительный учет свертывания плазмы проводят через 3 ч, окончательный - на второй день. Очень удобно пользоваться стандартной сухой цитратной плазмы кролика. Перед употреблением в ампулу добавляют 1 мл изотонического раствора хлорида натрия и после полного растворения ее разводят 1:5. Плазма человека малопригодна для постановки реакции плазмокоагуляции, поскольку в ней могут быть консерванты, лекарственные вещества, антитела, которые могут подавлять образование плазмокоагулаза.
Если выделена культура вызывает гемолиз, коагулирует плазму и дает положительную лецитовителазну реакцию, уже на третий день можно выдать результат на наличие S. aureus. Если культура обладает только плазмокоагулаза или только вителазну активность, для окончательного установления вида стафилококка необходимо определить дополнительные критерии патогенности: ферментацию маннита в анаэробных условиях, ДНК-азную активность, продукцию лизоцима, фосфатазы, а также определить чувствительность к новобиоцин.
57) методы определения чувствительности к антибиотикам( скажу честно, это инет-батюшка) ( я еще у Малышевой спрошу)
• Методы определения минимальных ингибирующих и бактерицидных концентраций, т. е. минимального уровня антибиотика, который позволяет предотвратить видимый рост микробов в питательной среде или пол ностью ее стерилизует. Это количественные методы, которые позволяют рассчитать дозу препарата, так как концентрация антибиотика в крови должна быть значительно выше минимальной ингибирующей концентрации для возбудителя инфекции. Введение адекватных доз препарата необходимо для эффективного лечения и профилактики формирования устойчивых микробов.
Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы, соответствующих микроорганизмов. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам (например, полимиксин, ристомицин). Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность микроорганизмов методом серийных разведений.
Определение чувствительности бактерий к антибиотикам методом серийных разведений. Данным методом определяют минимальную концентрацию антибиотика, ингибирующую рост исследуемой культуры бактерий. Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика (мкг/мл или ЕД/мл) в специальном растворителе или буферном растворе. Из него готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащей 106-107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры. Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий, под влиянием содержащейся в ней минимальной ингибирующей концентрации (МИК) антибиотика.
Последнее изменение этой страницы: 2017-01-19; Нарушение авторского права страницы
В природе существуют микроорганизмы, способные вырабатывать токсины, нарушающие жизнедеятельность клеток живого организма, разрушительно влиять на кожу, подкожную клетчатку, соединительную ткань, вызывать болезненные поражения и даже смерть. Представителем таких вредителей являются стафилококки.
Об особенностях стафилококковой инфекции
Этой бактерии насчитывают около 50 разновидностей. Все они обладают различными степенями агрессивности и активности, устойчивы в окружающей среде, имеют высокую сопротивляемость к действию антибиотиков.
Стафилококки всегда можно обнаружить на теле человека:
Сепсисом, токсическим шоком, пневмонией, гнойными кожными болезнями, абсцессами различной локализации, поражением опорно-двигательного аппарата, глазными инфекциями, менингитом, поражением опорно-двигательного аппарата (артритом, остеомиелитом), перитонитом, пищевыми отравлениями, расстройствами центральной нервной системы, общей интоксикацией организма, осложнениями после воспалительных заболеваний и хирургических операций – таким еще далеко не полным перечнем опасных заболеваний человечество обязано стафилококкам.
Коагулазонегативный стафилококк: его особенности, вредное воздействие на человеческий организм
При специальном исследовании покровов тела здорового человека обнаруживается большая группа бактерий, которые не представляют никакой опасности для здоровья подавляющего большинства людей. В большинстве случаев инфицирование организма не происходит. Это свидетельствует о том, что наличие этих вирусов в микрофлоре кожи – показатель ее нормального состояния. Условная патогенность данного вида инфекции говорит о том, что такие стафилококки могут действовать негативным образом на здоровье человека, или животного только при определенных условиях.
В зависимости от способности продуцирования коагулазы, (фермента, вызывающего свертывание плазмы крови) такие стафилококки подразделяют на коагулаза-положительные (коагулазопозитивные) и коагулаза-отрицательные (коагулазонегативные).
Из 5 известных медицине видов коагулазопозитивных стафилококков особую опасность для людей представляют 3 вида стафилококков: эпидермальный, сапрофитный и золотистый – самый частый возбудитель заболеваний гнойно-воспалительного характера.
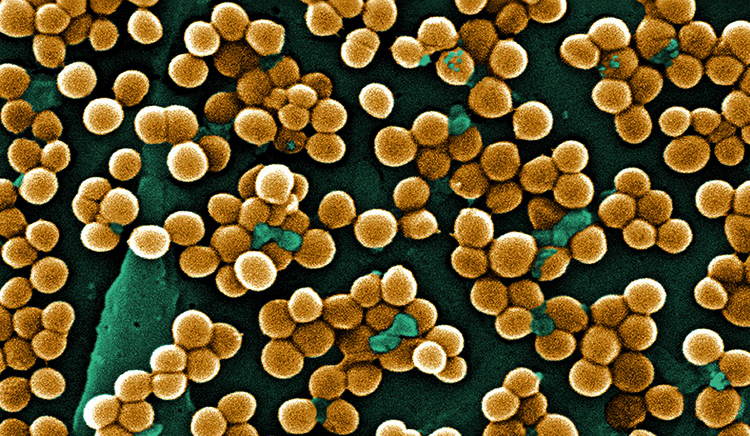
К так называемым госпитальным штаммам, которые циркулируют в стационарных лечебных учреждениях, относят группу коагулаза-отрицательных (коагулазонегативных) стафилококков. Лабораторными исследованиями установлено: из 20 известных разновидностей коагулазонегативных стафилококков только несколько способны вызывать серьезные отклонения в здоровье человека.
Особенность их заключается в высокой вирулентности (наличие возможности вызывать при благоприятных условиях инфекционный процесс) и устойчивости к действию антимикробных препаратов. К коагулазанегативным, менее патогенным, чем коагулазо-положительные стафилококки, относятся такие представители стафилококков, как эпидермальный, сапрофитный, Staphylococcus caprae и др.

Механизм действия стафилококков
Инфекция, попадая внутрь, ослабляет организм. Вырабатывается большое количество токсинов (ядов), которые:
- Отравляют клетки организма.
- Нарушают их нормальную деятельность.
- Вызывают развитие заболеваний, особенно если иммунная система ослаблена.
Нередко стафилококковая инфекция присоединяется как осложнение других болезней. Ей особо подвержены ослабленные пациенты:
- Те, кто прошел длительную антибактериальную терапию.
- Онкологические больные.
- Дети.
- Люди преклонного возраста.
Об опасности инфицирования коагулазонегативным стафилококком
В разнообразия инфекций коагулазаотрицательного стафилококка можно выделить характерные общие черты:
- Вялое течение с длительным латентным периодом (исключение с быстрым развитием бактериемии только у пациентов с нейропенией).
- Больничные инфекции – источники этого возбудителя (кроме инфекционного эндокардита и инфекций мочевых путей, вызванных Staphylococcus saprophyticus).
- Почти все инфекции этого возбудителя устойчивы к большинству антибиотиков, в том числе и к представителям пенициллина и цефалоспорина.
- Они зачастую связаны с имплантированием медицинских устройств и приспособлений. Этим вирусом легко инфицируются венозные катетеры, артериовенозные шунты для гемодиализа, ликворотводящие шунты, катетеры для перитонеального диализа, протезы суставов, сосудистые трансплантаты и протезированные клапаны.
Особенности возбудителя
Коагулазонегативного стафилококка чаще всего высевают из крови госпитализированных больных. Этот вид паразитирует в больничных палатах, хирургических залах, местах, где чистоте и дезинфекции уделяется особое внимание. Почему так происходит? Следует отметить, что возбудитель – основной компонент здоровой микрофлоры кожи. Медицинские приспособления для имплантации обсеменяются больничными штаммами от вполне здоровых представителей медицинского персонала или самих больных.
Объяснение в том, что всему причина – ослабленный иммунитет пациента больничной палаты. Напрашивается вывод, что, несмотря на малую вирулентность этих бактерий, они свободно паразитируют в местах большого скопления больных людей, легко воспринимающих инфекции по причине ослабленного иммунитета.
У пациентов с хорошим иммунитетом вызванные инфекции протекают легко. При нейтропении у больного активно развивается бактериемия с тяжелой интоксикацией, которая может привести даже к летальному исходу.
Диагностика инфекций коагулазонегативных стафилококков
Важнейшим фактором риска этой инфекции являются установленные на длительный срок инородные тела (катетеры, шунты и т.п.). Поскольку бактерии способны прикрепляться к самым разным материалам, ими могут быть обсеменены практически любые инородные тела. Это относится и к медицинским приспособлениям, которые имплантируют больным.
Установить правильно диагноз наличия инфекции коагулазонегативных стафилококков лабораторным способом с анализа первой пробы бывает затруднительно.
Во-первых, в анализе крови может присутствовать загрязненная проба, а не бактериемия. Для выявления действительной картины используются исследование нескольких проб, делаются повторные посевы, анализируются клинические признаки инфекции, принимается во внимание установлено ли больному медицинское устройство.
Во-вторых, следует отметить, что недопустимо терять время на получение повторных посевов больным с нейтропенией. Промедление для них подобно смерти – необходимо оказывать экстренную помощь.
Лечение инфекции
Для излечения этих инфекций, связанных с имплантированным медицинским устройством, часто бывает достаточно удалить это устройство. Иногда возможность удаления невозможна в целях жизнеобеспечения больного, тогда предпринимается курс лечения антибиотиками.
Лечение в стационаре для таких пациентов продляется по срокам госпитализации (до 6 недель), требует дополнительного применения антибиотиков, поэтому и обходится существенно дороже по стоимости.
Еще один аспект проблемы состоит в том, что часто используемые для лечения антибиотики (например, ванкомицин) влекут быстрое распространение микроорганизмов, устойчивых к их действию. Врачи вынуждены для эффективности лечения использовать сложные схемы и сочетания препаратов.
Не стоит отказываться от использования народных средств в борьбе с такими инфекциями. Ведь укрепление иммунитета – верный путь защиты от болезней, вызываемых и этими бактериями.
Арсенал народной аптеки специалисты рекомендуют пополнить растениями, способствующими активизации защитных сил организма, скорейшему восстановлению иммунитета. С эвкалиптом, листьями подорожника, кипреем, женьшенем, лимонником, расторопшей и другими иммуномодуляторами, включенными в рацион не только лечения, но и питания, не стоит тревожиться за состояние своего иммунитета.

Владельцы патента RU 2332461:
Изобретение относится к биотехнологии и может быть использовано в микробиологической лабораторной диагностике инфекционных заболеваний. Способ предусматривает внесение 12-часовой культуры стафилококка в плазму, разведенную изотоническим раствором хлорида натрия. Полученную микробную взвесь инкубируют при температуре 37°С в течение 5 часов. Регистрируют электрическое сопротивление микробной взвеси с 3-го до 5-го часа инкубирования. Причем при показателях сопротивления раствора 64-84 кОм делают заключение о патогенности стафилококка по наличию плазмокоагулирующей активности. Изобретение позволяет сократить сроки проведения исследований и повысить точность анализа.
Изобретение относится к области медицины, а именно к микробиологической лабораторной диагностике инфекционных заболеваний.
Плазмокоагулирующая активность является одним из основных признаков патогенности стафилококков (Staphylococcus aureus). До настоящего времени в периодической и патентной литературе не описано объективных методов регистрации плазмокоагулирующей активности бактерий, позволяющих с помощью приборов зарегистрировать коагуляцию плазмы микроорганизмами.
В микробиологической практике способность бактерий вызывать коагуляцию плазмы определяют визуально в течение 18 часов культивирования бактерий (Лабинская А.С. Микробиология с техникой микробиологических исследований. М., Медицина. - 1978. - С.167). Данный способ выявления фермента плазмокоагулазы у патогенных стафилококков выбран в качестве прототипа. Способ заключается в следующем: в две пробирки наливают по 0,5 мл плазмы, разбавленной 1:5 изотоническим раствором хлорида натрия, затем в каждую пробирку вносят по 1 петле 18-20-часовой культуры стафилококка. Одну пробирку (опытную) засевают исследуемой культурой бактерий, вторую (первый контроль) - заведомо патогенным, плазмокоагулирующим штаммом стафилококка. Засеянные пробирки выдерживают в течение 3 ч. Если за указанное время коагуляции плазмы в опытной пробирке не происходит, пробирки оставляют при комнатной температуре еще на 18 ч. Если и через это время свертывания плазмы не произойдет, исследуемая культура является коагулазоотрицательной. Одновременно в термостат ставят несколько пробирок с плазмой (второй контроль), в которые не вносят бактерии. Если в одной из пробирок второго контроля наступает коагуляция плазмы, обусловленная микробным загрязнением, результат опыта не учитывают.
Одним из существенных недостатков прототипа является субъективное определение изменения вязкости раствора в опытной пробирке по сравнению с контрольными. Окончательный учет наличия плазмокоагулирующей активности бактерий проводят через 18 часов, и в течение этого времени сотрудник лаборатории периодически (через каждые 10-20 мин) просматривает пробирки с посевами исследуемых культур для выявления плазмокоагулирующей активности бактерий. Если сотрудник лаборатории вовремя не просмотрел пробирки (в момент коагуляции плазмы), то процесс идет в обратном направлении, то есть из желеобразного состояния раствор приобретает жидкую консистенцию. В данном случае лаборатория может дать ложноотрицательный результат лабораторного исследования на наличие фермента плазмокоагулазы.
Задачей настоящего изобретения является разработка нового, объективного, экономичного экспресс-способа определения плазмокоагулирующей активности стафилококков.
Технический результат - простой, не требующий больших материальных затрат определения патогенных стафилококков по плазмокоагулирующей активности, позволяющий сократить сроки проведения исследований, повысить точность проведения лабораторного анализа и создающий возможность автоматизации в процессе регистрации плазмокоагулирующей активности стафилококка, основанный на определении показателей электрического сопротивления микробной взвеси в растворе плазмы. Использован известный способ определения электрического сопротивления растворов по новому назначению, а именно для выявления патогенных стафилококков по плазмокоагулирующей активности.
Технический результат достигается тем, что способ определения патогенных стафилококков по плазмокоагулирующей активности предусматривает внесение 12-часовой культуры стафилококка в плазму, разведенную изотоническим раствором хлорида натрия, инкубирование микробной взвеси при температуре 37°С в течение 5 часов, регистрацию электрического сопротивления микробной взвеси с 3-го до 5-го часа инкубирования, причем при показателях сопротивления раствора 64-84 кОм делают заключение о патогенности стафилококка по наличию плазмокоагулирующей активности.
Сущность изобретения достигается тем, что использован объективный способ регистрации плазмокоагулирующей активности бактерий по показателям электрического сопротивления раствора, позволяющий автоматизировать процесс выявления патогенных штаммов стафилококков (S.aureus) по плазмокоагулирующей активности, в результате этого освобождается от работы сотрудник лаборатории, регистрирующий плазмокоагулирующую активность бактерий, экономится расход питательных сред и создается возможность объективно с высокой точностью за 5 часов проводить значительно большее количество лабораторных анализов по определению плазмокоагулирующей активности микробных взвесей.
Предлагаемый способ осуществляют следующим образом.
Используют 12-ти часовую культуру стафилококка. Микробную взвесь в количестве 0,1 мл, содержащую 10 7 КОЕ/мл, вносят в пробирку с 0,3 мл плазмы, разбавленной 1:5 изотоническим раствором хлорида натрия. В пробирки с микробной взвесью вводят стальные электроды, соединенные с пишущим устройством, регистрирующим электрическое сопротивление раствора в пределе 2000 кОм. Микробную взвесь инкубируют при 37°С в течение 5 часов. При показаниях электрического сопротивления раствора от 64 до 84 кОм за период с 3-го до 5-го часа инкубирования микробной взвеси делают заключение о патогенности стафилококка по наличию плазмокоагулирующей активности.
Предложенный способ определения патогенных стафилококков (S. aureus) по плазмокоагулирующей активности (по сравнению с прототипом) позволяет экономить расход питательных сред, сокращает время проведения лабораторных исследований, дает объективные результаты исследований и создает возможность автоматизировать процесс определения плазмокоагулирующей активности микробной взвеси.
Примеры конкретного выполнения предлагаемого способа
Для определения плазмокоагулирующей активности с помощью предложенного способа взята 12-часовая культура стафилококка, выделенного от больного. Концентрацию микробной взвеси готовили по стандартной методике (МУК 4.2.1890-04). Использовали стандарт 0,5 по МакФарланду. Микробную взвесь в количестве 0,1 мл, содержащую 10 7 КОЕ/мл, внесли в пробирку с 0,3 мл плазмы, разбавленной 1:5 изотоническим раствором хлорида натрия. В пробирку с микробной взвесью поместили два стальных электрода, соединили их с пишущим устройством, регистрирующим сопротивление раствора в пределе 2000 кОм. Микробную взвесь инкубировали при 37°С в течение 5 часов. Через 3 часа 15 мин визуально установлена коагуляция плазмы. Одновременно зарегистрированы показания самопишущего устройства, регистрирующего электрическое сопротивление раствора. Показания регистрирующего устройства - 64 кОм. Выделенную культуру бактерий отнесли к плазмокоагулирующей.
Для определения плазмокоагулирующей активности с помощью предложенного способа взята 12-часовая культура выделенного стафилококка. Концентрацию микробной взвеси определяли по МакФарланду, используя стандарт 0,5. Микробную взвесь в количестве 0,1 мл, содержащую 10 7 КОЕ/мл, внесли в пробирку с 0,3 мл плазмы, разбавленной 1:5 изотоническим раствором хлорида натрия. В пробирку с микробной взвесью поместили два стальных электрода и определяли электрическое сопротивление раствора в пределе 2000 кОм, используя цифровой мультиметр М-832. Микробную взвесь инкубировали при 37°С в течение 5 часов. Через 3 часа 50 мин визуально установлена коагуляция плазмы. Одновременно зарегистрированы показания электрического сопротивления раствора 74 кОм. Выделенную культуру бактерий отнесли к плазмокоагулирующей.
Для определения плазмокоагулирующей активности с помощью предложенного способа взята 12-часовая культура выделенного стафилококка. Концентрацию микробной взвеси определяли по МакФарланду, используя стандарт 0,5. Микробную взвесь в количестве 0,1 мл, содержащую 10 7 КОЕ/мл, внесли в пробирку с 0,3 мл плазмы, разбавленной 1:5 изотоническим раствором хлорида натрия. В пробирку с микробной взвесью поместили два стальных электрода, соединили их с пишущим устройством, регистрирующим сопротивление раствора в пределе 2000 кОм. Взвесь бактерий инкубировали при 37°С в течение 5 часов. Через 3 часа 40 мин визуально установлена в растворе коагуляция плазмы. Одновременно зарегистрированы показания самопишущего устройства, регистрирующего электрическое сопротивление раствора, которое составило 84 кОм. Выделенную культуру бактерий отнесли к плазмокоагулирующей.
Предложенный способ определения патогенных стафилококков по плазмокоагулирующей активности не требует больших материальных затрат, легко воспроизводим, сокращает сроки проведения исследований, создает возможность автоматизировать процесс выявления патогенных стафилококков по плазмокоагулирующей активности и дает объективные данные лабораторных исследований, позволяющих выявлять патогенные штаммы стафилококков по плазмокоагулирующую активности с точностью 100%.
Способ определения патогенных стафилококков по плазмокоагулирующей активности, предусматривающий внесение 12-часовой культуры стафилококка в плазму, разведенную изотоническим раствором хлорида натрия, инкубирование микробной взвеси при температуре 37°С в течение 5 ч, регистрацию электрического сопротивления микробной взвеси с 3-го до 5-го часа инкубирования, причем при показателях сопротивления раствора 64-84 кОм делают заключение о патогенности стафилококка по наличию плазмокоагулирующей активности.
Стафилококки

[Рис. 1] Золотистый стафилококк

[Рис. 2] Золотистый стафилококк
Организм здорового человека обладает значительной устойчивостью к стафилококкам. После перенесенной стафилококковой инфекции в крови появляются антитоксины. Обнаружение антитоксина свидетельствует о напряженности иммунитета к стафилококкам. Наличие в крови человека а-антитоксина в титре больше 2 ME указывает на недавно перенесенное заболевание стафилококковой этиологии.
При контакте с широко распространенными в окружающей среде стафилококками, а также в результате перенесенных заболеваний индуцируется гуморальный иммунный ответ, в результате которого образуются антитела на антигены микробных клеток, токсины и ферменты. Клеточный иммунный ответ проявляется в подавлении фагоцитоза. Устойчивость к фагоцитозу у вирулентных штаммов S. aureus, возможно, связана с их способностью образовывать капсулу in vivo, а также с продукцией коагулазы, образующей вокруг бактерий фибрин. Белок А препятствует фагоцитозу, связываясь с Fc-участками IgG. В ряде случаев наблюдается специфическая сенсибилизация организмов. Определенное значение при стафилококковых инфекциях имеют секреторные IgA, обеспечивающие местный иммунитет слизистых оболочек. Экология и эпидемиология. Стафилококки широко распространены в природе. Они обнаруживаются на коже и слизистых оболочках человека, встречаются у животных. Каждый вид стафилококка подразделяется на экологические варианты (эковары). Вид S. aureus включает 6 эковаров: А, В, С, D, Е и F. Основными хозяевами этих эковаров являются соответственно человек, свинья, домашняя птица, крупный рогатый скот, овцы, зайцы, собаки и голуби. Резервуаром золотистого стафилококка служат здоровые носители и больные с различными стафилококковыми поражениями. Наибольшую опасность в смысле распространения стафилококков представляют бактерионосители, у которых патогенные стафилококки обнаруживают на слизистой верхних дыхательных путей, особенно передних отделов носовых ходов, а также больные люди с кожными поражениями. Стафилококки достаточно резистентны к факторам окружающей среды. Они хорошо переносят высушивание, длительное время остаются жизнеспособными в пыли.
Стафилококковые инфекции
Род Staphylococcus включает шаровидные неподвижные аспорогенные грамположительные факультативно-анаэробные бактерии, принадлежащие к семейству Mисrососсасеае. В определителе бактерий Д.Берги приведены дифференциальные признаки 29 видов стафилококков. Они делятся на две группы - коагулазоположительные и коагулазоотрицательные. К первой группе относятся S. aureus, S. intermedius и S. hyicus. их роль в инфекционной патологии равнозначна. Чаще различные заболевания у людей и животных вызывает S.aureus, реже - S. hyicus. S. intermedius патогенный только для животных. На протяжении многих лет коагулазоотрицательные стафилококки считали непатогенными. Но теперь эта точка зрения изменилась. В связи с ухудшением экологической ситуации в большинстве стран и связанным с ней снижением естественного иммунитета участились случаи гнойно-септических поражений тканей и органов, вызванных коагулазоотрицательные видами, которые встречаются на коже и слизистых оболочках человека (S. epidermidis, S.auricularis , S.capitis, S.cohnii, S.haemolyticus, S.hominis, S.lentus, S.saprophyticus, S.schleiferi, S.simulans, S.wameri, S.xylosus ma in.).
Среди эпидемиологов, микробиологов и клиницистов довольно распространенное убеждение, что сегодня непатогенных стафилококков не существует. Все учащаются случаи выделения из крови, тканей и органов культур стафилококков без каких-либо маркеров патогенности. Однако, при элиминации их из организма исчезают все симптомы заболевания. Все это необходимо учитывать при проведении лабораторной диагностики стафилококковых инфекций. К сожалению, в рутинных бактериологических лабораториях нашей страны пока возможна идентификация лишь S. aureus, S. epidermidis и S.saprophyticus.
Стафилококки чаще поражают кожу, ее придатки и подкожную клетчатку. Они вызывают фурункулы, карбункулы, панариции, паронихии, абсцессы, флегмоны, маститы, лимфадениты, нагноения ран, в том числе операционных. У детей стафилококки являются возбудителями стафилодермий, эпидемических пухирчаток, импетиго. их выделяют при плевритах, бронхитах, пневмониях, перитонитах. Они могут вызвать ангины, тонзиллиты, гаймориты, отиты, конъюнктивиты, несколько реже - менингиты, абсцессы мозга, миокардиты, эндокардиты, артриты, инфекции сосудистых протезов. Очень опасные пищевые токсикоинфекции, энтероколиты, холециститы, циститы, пиелит, пиелонефрит. При проникновении в кровь или костный мозг вызывают сепсис, остеомиелит, синдром токсического шока. Однако все заболевания стафилококковой этиологии не рассматриваются как острозаразное.
При стафилококковых инфекциях исследуют гной, кровь (при сепсисе), выделения слизистых оболочек, мокроты, воспалительный экссудат, ликвор, раневое содержание, плевральный выпот, желчь, мочу. В случае подозрения на токсикоинфекцию - рвотные массы, промывные воды желудка, испражнения, остатки пищи (особенно творог, молоко, пирожные, торты, кремы, мороженое и др.).. При санитарно-бактериологическом контроле исследуют смывы с рук, столов и других предметов. В бактерионосителей материал забирают тампоном отдельно из глотки и носовых ходов.
Из открытых гнойных поражений материал берут стерильным ватным тампоном после удаления раневого налета, в котором может быть сапрофитная микрофлора из воздуха, кожи и т.д.. При закрытых нарыва делают пункцию шприцем. Слизь из рото-и носоглотки берут стерильным тампоном. Мокроту и мочу забирают в стерильные пробирки, банки. Кровь (10 мл), взятую из локтевой вены, и ликвор - при пункции спинномозгового канала, с соблюдением асептики сеют у постели больного в 100 мл сахарного бульона. Кровь рекомендуют быстро (к ее свертыванию) вносить прямо из шприца во флакон с бульоном, тщательно перемешать, предотвращая образование сгустка. Пробы крови нельзя замораживать. В 25% случаев при стафилококковом сепсисе количество бактерий в крови (КОЕ) может быть меньше 1 / мл. При подозрении на такое положение необходимо сеять 25-30 мл крови.
Почти со всех исследуемых материалов (навоз, раневой содержание, экссудат, мокроты, осадок мочи и т.д.) с помощью бактериологической петли изготавливают мазки, окрашивают по Граму и микроскопируют. Только из крови и смывов мазки не делают так в них малое количество микроорганизмов. В типичных случаях стафилококки имеют шарообразную форму, фиолетовый цвет, располагаются несимметричными гроздьями, но встречаются и одинокие клетки, пары или тетради.
В последнее время в связи с широким использованием антибиотиков морфология стафилококков изменилась и типового их расположения в мазках из гноя часто не наблюдают. В связи с этим отличить стафилококки от стрептококков по их морфологии и взаимным расположением часто практически невозможно. Поэтому нужно делать посев, выделять чистую культуру и идентифицировать ее.

[Рис. 3] Золотистый стафилококк в чаше Петри
Материал от больных и бактерионосителей засевают немедленно или не позднее 3-4 ч после взятия при условии хранения его на холоде.В первый день петлей, шпателем или непосредственно тампоном делают посевы на кровяной агар и элективные для стафилококков среды (желтково-солевой (ЖСА) или молочно-желтково-солевой агар (МЖСА). Чашки с посевами инкубируют при 37 ° С в течение 48 часов , или сутки в термостате и дополнительно 24 ч при комнатной температуре при хорошем освещении. Если в исследуемом материале бактерий мало (данные микроскопии) - занял для обогащения делают еще в тиогликолевой среду.На второй день производят высев из сахарного бульона на указанные элективные среды, исследуют массивность роста и характер колоний после посевов других материалов. На кровяном агаре стафилококки образуют непрозрачные, слегка выпуклые колонии средних размеров с гладкой, блестящей, словно полированной поверхностью, четко очерченным краем, маслянистой консистенции. Патогенные штаммы образуют вокруг колоний прозрачные зоны гемолиза. На элективные-дифференциальных средах, как правило, вырастают только колонии стафилококков. В частности, на желтково-солевом агаре они образуют колонии с зоной помутнения вокруг них и характерным радужным венчиком по периферии (лецитовителазна реакция). На молочно-желтково-солевом агаре выявляют наличие пигмента, который может быть золотистым, палевым, белым, желтым, оранжевым и др..
Из всех типов колоний изготовляют мазки, окрашивают по Граму и микроскопируют, проявляя типичные грамположительные стафилококки. Не менее двух типичных или подозрительных в отношении стафилококков колоний пересевают на скошенный агар. В первую очередь отсеивают колонии с гемолизом и те, которые дали положительную лецитовителазную реакцию. При отсутствии таких колоний исследуют не менее двух пигментированных колоний, при микроскопии которых выявили типичные стафилококки. Пробирки с посевами помещают в термостат при 37 ° С на 18-20 час.
В последующие дни проводят идентификацию выделенных чистых культур, для чего проверяют их морфологические и тинкториальные свойства (окраска по Граму), плазмокоагулюючу активность и другие свойственные стафилококков тесты.
Плазмокоагулазу выявляют путем внесения выделенной культуры в пробирку с цитратной плазмы кролика. Ее можно приготовить в любой лаборатории. У кролика из сердца берут 8 мл крови, вносят в пробирку с 2 мл 5% лимонно-кислого натрия и ставят в холодильник. После полной осадки форменных элементов плазму отсасывают в стерильную пробирку. Она может храниться в холодильнике 8-10 дней. Перед использованием ее разводят 1:5 (1 мл плазмы и 4 мл изотонического раствора хлорида натрия) и разливают в аглютинацийни стерильные пробирки по 0,5 мл. Полную петлю культуры стафилококков эмульгируют в плазме и помещают в термостат на 3 часа, затем оставляют при комнатной температуре на 18-20 часов. Предварительный учет свертывания плазмы проводят через 3 ч, окончательный - на второй день. Очень удобно пользоваться стандартной сухой цитратной плазмы кролика. Перед употреблением в ампулу добавляют 1 мл изотонического раствора хлорида натрия и после полного растворения ее разводят 1:5. Плазма человека малопригодна для постановки реакции плазмокоагуляции, поскольку в ней могут быть консерванты, лекарственные вещества, антитела, которые могут подавлять образование плазмокоагулаза.
Если выделена культура вызывает гемолиз, коагулирует плазму и дает положительную лецитовителазну реакцию, уже на третий день можно выдать результат на наличие S. aureus. Если культура обладает только плазмокоагулаза или только вителазну активность, для окончательного установления вида стафилококка необходимо определить дополнительные критерии патогенности: ферментацию маннита в анаэробных условиях, ДНК-азную активность, продукцию лизоцима, фосфатазы, а также определить чувствительность к новобиоцин.
Исследование на бактерионосительство среди медицинского персонала проводится дважды в год. При плановых бактериологических обследованиях обязательно исследуют слизь из носа. Исследования слизи из ротоглогки проводят выборочно, при наличии воспалительных процессов в зеве. Материал берут из передних отделов носа стерильным ватным тампоном и им же сеют на ЖСА не позднее, чем через 2 ч после взятия. Выделение и идентификацию S.aureus проводят так же, как и при исследовании других материалов.
При определении массивности обсеменения стафилококками слизистой носа тампон с исследуемым слизью вносят в пробирку с 0,5 мл стерильного изотонического раствора хлорида натрия, прополаскивают его в жидкости встряхиванием в течение 10 мин, отжимают о стенки и удаляют. Жидкость многократно перемешивают пипеткой. Отдельно пипеткой наносят 0,1 мл смыва на чашку с ЖСА и тщательно растирают шпателем. Чашки с посевами инкубируют при 37 ° С в течение 48 ч, после чего подсчитывают количество колоний. Если с 50 колонийS.aureus, выросшие, две отнесены к одному и тому же фаготип, правомерно считать, что и все остальные колонии, идентичные по морфологии и пигментом, относятся к S. aureus аналогичного фаготип.
Пример для расчета: после посева 0,1 мл смыва выросло 50 колоний S.aureus. Так, в 0,5 мл будет 50 * 5 = 250 колоний или 2,5 * 10В2.Массивность стафилококкового обсеменения, которое выражается числом 102 микробных клеток, является умеренной, при ней возбудитель в окружающую среду не выделяется. При выделении> 10в3 бактериальных клеток уровень обсемененности определяют как высокий, при котором возбудитель выделяется во внешнюю среду не только при кашле и чихании, а при спокойном дыхании. При таких обстоятельствах нужно обязательно проводить санацию бактерионосителей.
Профилактика заболеваний, вызываемых стафилококками, включает несколько направлений. К ним относятся меры борьбы с источником инфекции, которыми являются люди, страдающие гнойно-воспалительными процессами и бактерионосители, при лечении которых возникают определенные трудности. Особенно важно в комплексе профилактических мероприятий предупреждение стафилококковых заболеваний в лечебных учреждениях. Это прежде всего организация режима работы отделений больниц. Отделения, в которых находятся больные с открытыми гнойно-воспалительными процессами, должны обслуживаться отдельным персоналом. Для предупреждения возникновения стафилококковых заболеваний у лиц, подвергающихся риску травматизма или инфицирования, рекомендуется использовать метод иммунизации сорбированным анатоксином или введение иммуноглобулина.
Особая проблема - профилактика стафилококковых заболеваний у новорожденных. У них еще до настоящего времени стафилококк является одним из главных возбудителей инфекции. В данном случае в профилактику включают иммунизацию рожениц стафилококковым анатоксином, а также проведение количественного и качественного анализа обсемененности молока родильниц с целью более строго подхода к переводу новорожденного на вскармливание кипяченым грудным молоком. В норме в женском молоке содержится три класса иммуноглобулинов - IgG, IgM и IgA, которые разрушаются при кипячении.
Для лечения стафилококковых инфекций применяют антибиотики, выбор которых определяется чувствительностью выделенной культуры к определенным препаратам. Из них наибольшее значение имеют р-лактамные препараты (оксициллин, метициллин и др.). В последние годы появились метициллиноустойчивые штаммы. Их устойчивость в отличие от других штаммов не контролируется R-плазмидами, а объясняется хромосомными мутациями. Для лечения таких больных применяют ванкомицин и фторхинолоны.Кроме того, для лечения стафилококковых инфекций используют цефалоспорины 1 и 2 поколении, реже тетрациклины. При сепсисе наряду с антибиотиками вводят противостафилококковый Ig. Для лечения хронических стафилококковых инфекций (хронический сепсис, фурункулез и др.) используют анатоксин, аутовакцину, стимулирующие синтез антитоксических и антимикробных антител.
Читайте также:


