Амилоидный белок при болезни альцгеймера

Kollmer et al. / Nature Communications, 2019
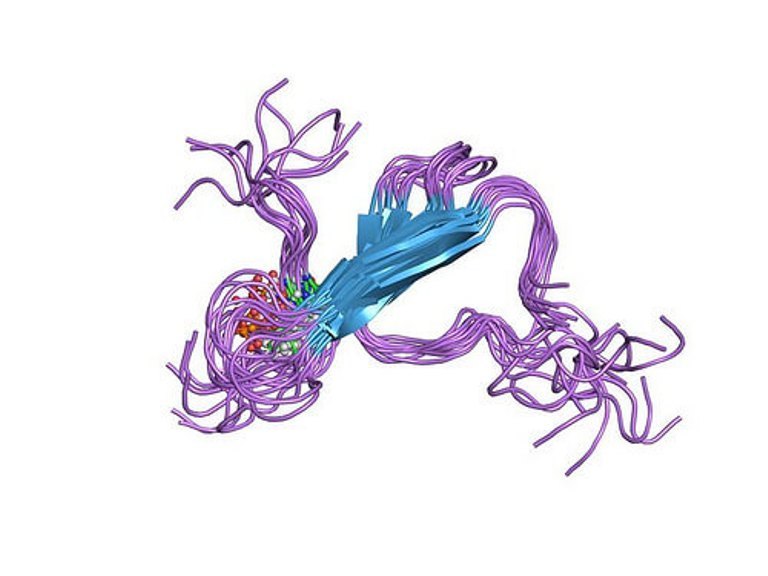
Нити бета-амилоида из мозга пациентов с болезнью Альцгеймера оказались непохожи на нити, которые он образует в лабораторных условиях. Об этом сегодня в журнале Nature Communications рассказала группа ученых, рассмотревшая белковые агрегаты в электронный микроскоп. В отличие от лабораторного аналога, амилоид из мозга пациентов закручен не в левую, а в правую сторону, и принимает не так много разных форм. Это означает, что модели, с помощью которых до сих пор искали лекарство от болезни, могут не вполне соответствовать действительности.
На молекулярном уровне болезнь Альцгеймера вызвана агрегацией двух белков: бета-амилоида и тау-белка. Но если агрегаты тау встречаются и при других заболеваниях (например, в мозге больных Паркинсоном), то скопления бета-амилоида характерны в основном именно для болезни Альцгеймера. Считается, что именно эти белки приводят к гибели нервных клеток, однако чаще всего их агрегацию изучают in vitro.
Мариус Кольмер (Marius Kollmer) и его коллеги из Австралии, Германии и США решили охарактеризовать агрегаты бета-амилоида в реальной ткани мозга. Для этого они взяли образцы тканей мягких оболочек мозга трех пациентов, которые скончались от болезни Альцгеймера.

Нити бета-амилоида из мозга пациентов (верхний ряд) и образованные в лабораторных условиях (нижний ряд)
Kollmer et al. / Nature Communications (2019)
Также ученые обнаружили с помощью криоэлектронной микроскопии, что подавляющее большинство нитей, которые они выделили из мозга пациентов, относятся к трем типам структуры в зависимости от толщины нити и частоты перекручиваний спирали. Три типа в равной степени встречались во всех трех образцах, поэтому их нельзя назвать пациент-специфичными. В то же время в предыдущих исследованиях in vitro бета-амилоид принимал множество разных форм. Вероятно, это означает, что в реальной ткани спектр возможных структур амилоида сильно ограничен или зависит от конкретного подтипа болезни.
Авторы новой работы осторожно замечают, что их данные не позволяют однозначно сказать, что амилоид образует абсолютно разные структуры in vivo и in vitro, но указывают на то, что лабораторные модели не всегда аккуратно отражают реальность. Фактически это означает, что, разрабатывая средства для борьбы с бета-амилоидными агрегатами ученые до сих пор не очень хорошо представляли себе, как выглядит их мишень.
Раньше ученые уже предлагали считать болезнь Альцгеймера не единым заболеванием, а группой болезней, на основании структуры бета-амилоида. Также высказывалось предположение, что его агрегация служит для защиты мозга от инфекций.
Неожиданные результаты, полученные Исследовательским институтом Скриппса (Scripps Research Institute) и ModGene, LLC, могут полностью поменять представления ученых о болезни Альцгеймера – одном из самых распространенных нейродегенеративных заболеваний человека – указывая на печень вместо мозга как на источник амилоидных пептидов, откладывающихся в виде мозговых бляшек при этом разрушительном заболевании. Это открытие предлагает относительно простой подход к лечению и профилактике болезни Альцгеймера.
Чтобы определить гены, оказывающие влияние на количество накапливающегося в мозге амилоидного белка, ученые использовали модель болезни Альцгеймера, воспроизведенную на мышах. Они установили три гена, защищающие от отложения и накопления амилоида в мозге животных. Мозг мышей защищало снижение экспрессии каждого из этих генов в клетках печени. Один из них кодирует пресенилин (presenilin) – клеточный мембранный белок, который, как считается, вносит вклад в развитие болезни Альцгеймера.
По оценкам этим нейродегенеративным заболеванием страдают 5.1 миллиона американцев, включая почти половину людей в возрасте 85 лет и старше. Если наука не найдет способа предотвратить его развитие и эффективных методов лечения, к 2050 году количество пациентов в возрасте 65 лет и старше будет варьировать от 11 до 16 миллионов. В дополнении к человеческим страданиям, это огромное экономическое бремя. Новый доклад Ассоциации Альцгеймера США (Alzheimer's Association) показывает, что при отсутствии методов положительного воздействия на болезнь совокупные расходы на уход за пациентами с Альцгеймера в период с 2010 до 2050 года составят $20 триллионов.
В поисках решения загадки болезни Альцгеймера Сатклифф и его сотрудники в последние несколько лет сосредоточили свое внимание на естественно существующих различиях в предрасположенности к неврологическим заболеваниям у различных линий мышей, создав обширную базу данных по активности генов в различных тканях.
Эти данные дают карты экспрессии признаков, которые могут быть наложены на карты генов-модификаторов заболевания.
Как и в случае почти всех научных открытий, исследование Сатклиффа основывается на более ранних данных. Несколько лет назад ученые Западного резервного университета Кейза (Case Western Reserve) картировали три гена, модифицирующие накопление патологического бета-амилоида в мозге трансгенных мышей с моделью болезни Альцгеймера, в больших участках хромосом, каждый из которых содержит сотни генов. Использовав кроссы линий мышей В6 и D2, они изучили более 500 их потомков.
Основываясь на результатах этого исследования, Сатклифф применил свои базы данных генной экспрессии к мышиной модели болезни Альцгеймера, ища различия в экспрессии генов, которые коррелировали с различиями в предрасположенности к развитию заболевания, в линиях В6 и D2. Эта интенсивная работа включала в себя создание компьютерных программ, которые идентифицировали каждое генетическое отличие геномов В6 и D2, и проведение математического анализа их корреляции (известного как регрессионный анализ). Корреляции проводились между генотипическими различиями (В6 и D2) и количеством матричной РНК, вырабатываемой на основе более чем 25000 генов в определенной ткани у 40 рекомбинантных инбредных линий мышей. Эти корреляции были рассчитаны для 10 видов тканей, одной из которых была печень.
Охота на гены выявила хороших кандидатов на роль каждого из трех генов-модификаторов, открытых учеными из Case Western, и один из этих кандидатов – ген мыши, соответствующий гену человека, одна из вариаций которого предрасполагает к раннему началу болезни Альцгеймера – представлял для ученых особый интерес.
Это открытие позволило предположить, что значительные концентрации бета-амилоида могут брать свое начало в печени, циркулировать в крови и попадать в мозг. Если это верно, блокирование выработки бета-амилоида в печени может защитить мозг.
Мышам вводили иматиниб (imatinib) (коммерческое название Гливек (Gleevec), утвержденный FDA противораковый препарат), относительно новое лекарственное средство, одобренное в настоящее время для лечения хронической миелоидной лейкемии и опухолей желудочно-кишечного тракта. Препарат резко снижает синтез бета-амилоида в клетках нейробластомы, трансфицированных белком-предшественником амилоида (amyloid precursor protein, APP), а также в бесклеточных экстрактах, полученных из трансфицированных клеток. Важно отметить, что Гливек плохо проникает через гематоэнцефалический барьер как у мышей, так и у человека.
Мышам вводили Гливек дважды в день в течение семи дней. Затем были забраны плазма и мозговая ткань и измерено количество бета-амилоида в крови и мозге. Результат: препарат резко сократил количество бета-амилоида не только в крови, но и в мозге, куда он не мог проникнуть. Таким образом, значительная часть амилоида мозга должна была быть синтезирована вне его, и иматиниб является кандидатом на роль препарата для профилактики и лечения болезни Альцгеймера.
Что касается будущего этого исследования, Сатклифф надеется найти партнера и инвесторов для проведения клинических испытаний и разработки новых препаратов.
В Москве с лекцией выступил один из ведущих специалистов по болезни болезни Альцгеймера Дитер Вилльбольд. Профессор занимается разработками в терапии старческого слабоумия в Университете Дюссельдорфа им. Генриха Гейне и в Институте сложных Систем (Юлих, Германия ). В интервью “ КП ” эксперт рассказал о самых передовых разработках и о том, кому стоит опасаться пока еще неизлечимой болезни.
Каковы ранние симптомы заболевания и как их распознать
“В суматохе жизни мы часто что-то забываем, например, телефон или документы выйдя из дому. Но это, не значит, что мы больны болезнью Альцгеймера” - успокаивает профессор Вилльбольд, - “Для постановки такого диагноза требуется проведение специальных тестов и исследований. Только после этого можно говорить о каком-либо заболевании”.
Методы диагностики
“В настоящее время существуют специальные биомаркеры - белки бета-амилоид, тау -протеин, по уровню которых в плазме крови или спинномозговой жидкости можно судить о наличии болезни Альцгеймера. По изменению уровня этих белков в крови и спинномозговой жидкости с течением времени можно судить о прогрессировании заболевания и, наоборот, относительном выздоровлении. Определение тау-протеина и фосфорилированного протеина используется для оценки степени нейродегенерации, то есть гибели нервных клеток. Также используются биомаркеры, которые отражают процессы воспаления и повреждения синапсов. Существуют также современные методы визуализации, такие как МРТ (магнитно-резонансная томография), ПЭТ (позитронно-эмиссионная томография). Однако, эти методы предполагают облучение пациента и являются дорогостоящими, поэтому используются реже ”, - отметил Дитер Вилльбольд.
D-пептид или метод профессора Вилльбольда
Применение D-пептида разрушает клубочки белков, из которых состоят амилоидные бляшки. Это устраняет их токсический эффект и восстанавливает связь нервных клеток друг с другом в головном мозге. Наши исследования свидетельствовали о том, что применение D-пептида на мышах улучшает память, ориентацию в пространстве и концентрацию внимания, то есть те функции, которые страдают при болезни Альцгеймера. Препарат уже прошел первую фазу испытаний на здоровых добровольцах. Чтобы доказать окончательную эффективность и безопасность нашего метода, необходимо испытать препарат на пациентах с болезнью Альцгеймера.
Кому грозит болезнь Альцгеймера и как ее предотвратить
“На сегодняшний день нет доказательств того, что физическая активность, ведение здорового образа жизни, как например, отказ от курения способны предотвратить развитие болезни Альцгеймера. Это конечно не значит, что таких методов не существует, но на данный момент ученым еще не удалось их выявить,” - отметил профессор Вилльбольд.
“Если говорить о возможных факторах риска болезни Альцгеймера, то в первую очередь это определенные мутации в генах. Такие пациенты в большей степени предрасположены к раннему началу заболевания. И эти мутации передаются по наследству. То есть, при семейной болезни Альцгеймера риск заболеть для родственников первой степени (то есть детей - Прим. ред.) выше в несколько раз. Доказательством роли генных мутаций в развитии этого заболевания служит более высокий риск у лиц с синдромом Дауна (трисомией 21-хромосомы). Дело в том, что в 21-й паре хромосом и располагается ген, способствующий синтезу белка амилоида. Поэтому у больных с синдромом Дауна процесс отложения этого белка значительно ускоряется к 35-40 годам, что приводит к раннему развитию заболевания”.
Досье "КП"
Болезнь Альцгеймера - это хроническое заболевание, приводящее к гибели клеток головного мозга, что на поздних стадиях полностью лишает пациента самостоятельности.
Это заболевание было впервые открыто и описано в 1906 году немецким ученым Алоисом Альцгеймером – немецким психиатром и патологом. Основным симптомом заболевания является потеря памяти, трудность в запоминании недавно происшедших событий, что в конечном итоге приводит к смерти. В настоящее время не найдено средств, способных излечить от этого заболевания или хотя бы временно облегчить его симптомы.
В 2015 году диагноз болезни Альцгеймера был поставлен 29,8 млн человек во всем мире.
В основе развития болезни лежит развитие сенильных или амилоидных бляшек в головном мозге. Существует мнение, что скопление белка амилоида в тканях головного мозга механически сдавливает нейроны, тем самым нарушая их функцию по передаче нервного импульса, а также может оказывать токсическое действие и приводить к дегенерации с дальнейшей гибелью клеток.
Экология потребления. Здоровье: Хотя болезнь Альцгеймера активно исследуют на протяжении многих лет, механизмы ее возникновения остаются неясными.
Хотя болезнь Альцгеймера активно исследуют на протяжении многих лет, механизмы ее возникновения остаются неясными.
Обычно появление основных симптомов болезни связывали с отложениями в головном мозге белка бета-амилоида – так называемыми амилоидными бляшками.
Авторы нового исследования полагают, что ключевую роль играют другие образования, которые обнаруживаются в мозге больных – нейрофибриллярные клубки, состоящие из тау-белка. Хотя пока среди ученых нет единства по поводу сравнительного вклада бета-амилоида и тау-белка в развитие болезни, полученные результаты, возможно, помогут разработке новых препаратов для ее лечения.
Скопления амилоидных бляшек при болезни Альцгеймера были открыты уже довольно давно. Они обнаруживались как при посмертном исследовании мозговой ткани, так и у живых больных – при помощи позитронно-эмиссионной томографии. Для этого в организм вводят радиоактивный изотоп, который образует соединение с интересующим веществом (в данном случае – с бета-амилоидом). Когда скопления целевого вещества оказываются “помечены”, их распределение в организме отслеживают по гамма-квантам, возникающим при позитронном распаде.
Но тут же возникала загадка: медикам было известно немало случаев, когда у пациентов, мозг которых был полон амилоидных бляшек, не было никаких признаков болезни Альцгеймера. Число таких людей в некоторых исследованиях достигало 30 %. Данный факт заставил ученых подозревать, что другая аномальная белковая структура – нейрофибриллярные клубки из тау-белка может быть фактором, важным для развития болезни.
Обычно тау-белок в организме участвует в образовании микротрубочек – важного элемента цитоплазматической структуры клеток. Но у пациентов с болезнью Альцгеймера, а также после черепно-мозговых травм обнаруживаются скопления тау-белка, к молекулам которого присоединено большое количество фосфатных групп. Из-за них белок переходит в нерастворимую форму, и его клубок остается прикрепленным к нейронам головного мозга.
Влияние нейрофибриллярных клубков на здоровье до конца не изучено. До недавнего времени единственным методом исследования, доступным в данном случае, было измерение уровня тау-белка в ткани головного мозга после смерти больного или же у живого пациента в спинномозговой жидкости. Позитронно-эмиссионная томография не могла помочь, так как не располагала радиоизотопами, которые подходили бы для того, чтобы пометить тау-белок в организме.
Теперь эта проблема решена и соответствующие препараты найдены.
Поэтому невролог Бо Ансес (Beau M. Ances) и его коллеги из Университета Вашингтона в Сент-Луисе смогли впервые провести исследование распределения нейрофибриллярных клубков в головном мозге у живых пациентов. Одновременно они использовали и радиопрепарат для отображения бета-амилоида. Таким образом, ученые получили картину одновременного распределения в мозге двух связанных с болезнью Альцгеймера белков.
В исследовании участвовали десять пациентов с легкой степенью болезни Альцгеймера и 36 здоровых. Как показали ученые, чем больше у человека отложений тау-белка в височной доле мозга, тем сильнее у него проявляются нарушения памяти и внимания, характерные для болезни Альцгеймера.
Аналогичного соотношения для бета-амилоида не обнаружилось. Исследователи пришли к выводу, что позитронно-эмиссионную томографию, направленную на обнаружение амилоида, можно использовать для выявления самых ранних стадий болезни Альцгеймера. Тогда как тот же метод, но с использованием веществ, нацеленных на тау-белок, будет эффективен при выявлении перехода от ранних, несимптоматических стадий к легкой степени болезни Альцгеймера.
Бо Ансес подозревает, что решающим в развитии болезни становится совместное влияние на нервную ткань скоплений амилоида и тау-белка. Пока в мозге накапливаются только амилоидные бляшки, он еще в состоянии частично компенсировать их воздействие, но появление нейрофибриллярных клубков становится ключевым фактором, и симптомы болезни начинают нарастать.
Одновременно ученые проверили содержание тау-белка в спинномозговой жидкости участников исследования и обнаружили корреляцию его уровня с количеством тау-белка в височной доли головного мозга. Следовательно, анализ спинномозговой жидкости может служить методом диагностики.
Пока удалось отметить связь уровня тау-белка с симптомами болезни Альцгеймера в один момент времени. Как отмечает, комментируя результаты данного исследования, невропатолог Педро Роза-Нето из Университета Макгилла в Монреале, в будущем еще предстоит определить, существует ли связь изменения содержания тау-белка в мозге с нарастанием симптомов с течением времени. Бо Ансес говорит, что подобные исследования уже ведутся, и выражает надежду, что со временем исследователи смогут определять стратегию лечения болезни Альцгеймера, основываясь на том, какова биохимическая ситуация в мозге пациента в конкретный момент. опубликовано econet.ru
Понравилась статья? Напишите свое мнение в комментариях.
Подпишитесь на наш ФБ:
8 июня статья с таким названием под авторством Anthony L. Komaroff вышла в JAMA. Статья - Viewpoint - на наш взгляд, очень интересная, поэтому спешим поделиться с вами ее переводом.
Новая модель патогенеза болезни Альцгеймера бросает вызов старой. Новые модели не всегда вытесняют старые, бывает, что они их дополняют.
Старая модель:
Амилоид-β, Tau и APOE
Патогенез болезни Альцгеймера оставался тайной в течение 80 лет. Однако в последние 30 лет, были обнаружены 3 ключевые молекулы: амилоид-β (Аβ), обнаруженный в бляшках; тау-белок, обнаруженный в нейрофибриллярных клубках, и аполипопротеин Е (АРОЕ) (1). У людей, носителей двух копий аллели АРОЕ*Е4, вероятность развития заболевания выше в 10 раз, чем у тех, у кого копий аллели нет.
Сторонники старой модели постулируют, что продукция амилоида-β стимулирует образование нейрофибриллярных клубков тау-белка и нейровоспаление, а Аβ, тау-белок и воспаление, каждый в свою очередь, приводит к деструкции нейронов и синапсов.
Остается, однако, непонятным, как Аβ, тау-белок и АРОЕ взаимодействуют для возникновения патологии, и является ли нейровоспаление причиной патогенеза или лишь его отражением.
Нейровоспаление
Сегодня уже мало кто сомневается, что при болезни Альцгеймера имеет место нейровоспаление. Множество компонентов воспаления могут повреждать нейроны и синапсы: цитокины и хемокины, активные формы кислорода, активация классического и альтернативного пути комплемента, активация циклооксигеназы 2 (ЦОГ 2). Кроме того, регуляция биомаркеров воспаления регулируется более выраженно в тех областях головного мозга, которые наиболее поражаются при болезни Альцгеймера: фронтальный и височный неокортекс и лимбическая система.
Коротко говоря, нейровоспаление связано с нейродегенерацией, которую мы наблюдаем при болезни Альцгеймера и недавние исследования показывают, что оно может предшествовать нейродегенерации.
Но что запускает воспаление? Нейровоспаление может начинаться в ответ на образование амилоида-β, а также в ответ на нейродегенерацию.
Новая модель, однако, предполагает еще один триггер нейровоспаления: инфекции головного мозга, и инфекции в любой части организма, которые активируют иммунную систему в мозге. Эта гипотеза может переориентировать направление будущих исследований и практических решений. Но каковы доказательства?
Новая модель заболевания
Инфекция запускает нейровоспаление, а затем болезнь Альцгеймера
Инфицирование нейротропными микроорганизмами, в частности, агентами, способными вызывать неэрадицируемые инфекции, такими как вирусы герпеса, теоретически может запускать хроническое нейровоспаление. Несколько вариантов генов, которые нарушают иммунный ответ на инфекцию, по-видимому, чаще встречаются у людей с поздним началом болезни Альцгеймера и могут способствовать вялотекущей возвратной реактивации латентной инфекции. Однако на людях доказать это трудно.
Вирусы герпеса 1 и 2 типа и болезнь Альцгеймера
Множественные сообщения связывают вирус простого герпеса типа 1 (ВПГ-1) с болезнью Альцгеймера. ДНК ВПГ-1 чаще могут обнаруживаться в мозге людей с болезнью Альцгеймера, чем у здоровых и контролей (2). Вирусная ДНК наиболее близко была к амилоидным бляшкам.
Как может вирус герпеса типа 1 быть связан с амилоидом-β, тау-белком и аполипопротеином Е?
In vitro ВПГ-1-инфекция нейрональных и глиальных клеток может нарушать аутофагию (деградацию клеточного белка), что в свою очередь приводит к накоплению как амилоида-β, так и тау-белка. А применение ацикловира снижало накопление и того, и другого (3).
In vivo инфицирование вирусом герпеса 1 типа мышей приводит к образованию скоплений амилоида-β и когнитивному дефициту, но патологические изменения не патогномоничны для болезни Альцгеймера.
Некоторые исследователи обнаружили, что вирусная ДНК чаще встречается в мозге людей носителей аллели АРОЕ*Е4. Это звучит убедительно: несколько исследований предполагают, что носители АРОЕ*Е4 имеют больший риск развития вызванной ВПГ-1 лихорадки на губах и вызванной ВПГ-2 генитальных очагов. Таким образом, у носителей этой аллели могут быть трудности с контролированием инфекций ВПГ-1 и ВПГ-2 и у них возможно большая вероятность развития болезни Альцгеймера.
Некоторые эпидемиологические данные также связывают вирусы герпеса 1 и 2 типа с болезнью Альцгеймера. В одном из исследований выявили более 8000 людей 50 лет и старше с впервые диагностированными ВПГ-1 и ВПГ-2 инфекциями и сопоставили их с 3 контрольными группами без такого анамнеза, и наблюдали за участниками исследования в течение 10 лет (6).
8362 человека, у которых были вирусы ВПГ-1 и ВПГ-2 ранее в жизни, по сравнению с 25062 без них, имели больший относительный риск возникновения деменции позже в пожилом возрасте. Еще более провокационно то, что среди 7215 людей, чьи симптомные герпетические инфекции лечили противовирусными препаратами, частота последующей деменции была ниже, чем у 1147 людей, не леченых противовирусными, со значимой взаимосвязью доза-эффект (6).
Это было неконтролируемое обсервационное исследование в единственном сообществе с относительно коротким периодом последующего наблюдения. Более того, заявленное 91% относительное уменьшение частоты деменции настолько велико, что верится в него с трудом. Тем не менее, важно посмотреть, можно ли воспроизвести это открытие.
Вирусы герпеса типа 6А и 6В
Вирусы герпеса типа 6А и 6В, а также типа 7 связывали с болезнью Альцгеймера. До 2018 года несколько маленьких исследований обнаружили взаимосвязь, другие, однако, нет.
В 2018 году исследователи изучали мозг более 1000 пациентов с болезнью Альцгеймера, прогрессирующим надъядерным параличом и здоровых стареющих. Другие частые нейродегенеративные заболевания включены не были. Команда искала ДНК и мессенджерную РНК (мРНК) 515 известных вирусов человека в посмертных образцах энторинальной коры и гиппокампа, причем не имея заранее гипотезы того, что они могут найти (7).
Им удалось обнаружить более высокие уровни вирусной ДНК и мРНК (индикатор активной инфекции) вирусов герпеса типа 6, 7 и 1 у людей с болезнью Альцгеймера, по сравнению с пациентами с ПНП или здоровым старением.
Нагрузка ДНК и мРНК вируса 6А положительно коррелировала с баллами по клинической шкале деменции и с плотностью Аβ-бляшек и обратно коррелировала с количеством нейронов, по подсчетам этих авторов.
Однако, два последующих сообщения пришли к другим результатам. Другая группа анализировала такой же большой пул данных и не обнаружила, что у пациентов с болезнью Альцгеймера было больше ДНК и м-РНК ВГЧ-6, и7 и ВПГ-1 (8). И еще одна группа ученых тоже не нашла связи между вирусами герпеса 6 А и 6В и болезнью Альцгеймера (9).
Эти противоречивые результаты говорят о том, что необходимо стандартизированный и высокочувствительный метод оценки и стандартизированная процедура забора образцов, чтобы было возможно оценить роль инфицирования мозга при болезни Альцгеймера.
На данный момент остается непонятным, имеют ли отношение вирусы герпеса тиа 6А, 6В и 7 к патогенезу болезни Альцгеймера.
Другие микроорганизмы
Несколько других микроорганизмов также связывали с болезнью Альцгеймера, включая вирус varicella zoster, вирус гепатита С, Helicobacter pylori, Porphyromonas gingivalis, Chlamydia pneumoniae и грибковые микроорганизмы. Такой количество самых разных микроорганизмов, естественно вызывает скептицизм, по поводу того, что какой-то из них может быть этиологическим агентом. Однако эти утверждения согласуются с моделью, в которой в сердце патогенеза находится нейровоспаление, вызванное каким-либо из множества микробов.
Как связать амилоид-β и инфекцию
Амилоид-β образуется из большего по размеру амилоидного белка-предшественника (АБП). Затем маленькие молекулы амилоида-β образуют растворимые полимеры, которые в итоге собираются вместе и формируют фибриллы и фибриллярные бляшки. Нейровоспаление индуцирует образование амилоида-β, который в свою очередь вызывает нейровоспаление, и в результате получается порочный круг.
Однако меньшие, растворимые формы (олигомеры) амилоидаβ являются не только потенциальными противомикробными агентами, но также и нейротоксичны. Таким образом молекулы эти дают как преимущества, так и патологические эффекты.
Зачем тогда эволюционно было сохранять такую нейротоксичную молекулу как амилоид-β?. Возможно, это связано с тем, что патологические эффекты амилоида обычно становятся выраженными только после 60 лет. Это уже после окончания детородного возраста у женщин и сильно больше ожидаемой продолжительности жизни вплоть до 20 века. Таким образом, в течение большей часть истории человечества, патологические эффекты амилоида имели крайне небольшое влияние на естественный отбор.
Выводы
Старая модель заболевания остается валидной: амилоид-β, тау-белок и АРОЕ играют важную роль в патогенезе болезни Альцгеймера, и нейровоспаление также присутствует.
В новой модели есть противоречия:
1) является ли нейровоспаление причиной или последствием амилоидоза, накопления тау-белка и последующей нейродегенерации, наблюдаемой при болезни Альцгеймера и
2) может ли, по крайней мере, в каких-то случаях, инфекция запускать нейровоспаление.
Новая модель заболевания интересная, но не доказанная. Возможно, следующие исследования покажут, что терапия, направленная на нейровоспаления (или, менее вероятно, терапия, направленная на специфические инфекционные агенты) может предотвратить или даже обратить болезнь Альцгеймера. Если это возможно, новая модель заболевания дополнит старую.
- 3245
- 2,7
- 0
- 5
Если предположение исследователей верно, то амилоидный белок Aβ приобретает очень драматичный ореол: будучи предназначен для защиты нервных клеток от инфекции, при определённых условиях он сам становится хуже любой заразы.
![]()
Антон Чугунов
![]()
Антон Чугунов![]()
Андрей Панов
- Амилоиды
- Иммунология
- Нейробиология
- Нейродегенерация
Болезнь Альцгеймера — основную форму старческого слабоумия — связывают с небольшим белком Aβ (β-амилоидом), нерастворимые отложения которого в нервной ткани оказывают разрушительный эффект на высшую нервную деятельность. β-Амилоид образуется вследствие ферментативного расщепления гликопротеина APP, в норме всегда присутствующего в мембранах нейронов и других клеток. Нормальная физиологическая роль ни этого белка, ни его метаболита Aβ до недавнего времени была неизвестна. Исследователи из Массачусетского госпиталя нашли возможную функцию белка Aβ в норме. Обнаружено, что синтетические аналоги Aβ и препараты височной доли мозговой ткани альцгеймеровских больных обладают мощной антимикробной активностью, а животные с нарушенным синтезом Aβ страдают сниженным иммунитетом. Всё это позволяет предположить, что белок Aβ — часть системы врождённого иммунитета в нервной системе человека.

Рисунок 1. Августа Д., пациентка Алоиса Альцгеймера (в честь которого БА получила своё название), 1901 г.
Рисунок 2. Интеллектуальная активность, в том числе увлечение игрой в шахматы, и регулярное общение коррелируют со сниженным риском развития болезни Альцгеймера, по данным эпидемиологических исследований, однако причинно-следственная связь пока не доказана
Схожесть некоторых физико-химических и биологических свойств β-амилоида и пептида LL-37 подтолкнула учёных изучить антимикробную активность Aβ, которой никто ранее не занимался. Результаты превзошли ожидания: синтетические аналоги Aβ40 и Aβ42 ингибировали развитие восьми из 15 исследованных микроорганизмов с активностью, равной или даже превышающей активность LL-37. Среди микроорганизмов, ингибируемых амилоидом, — грибок Candida albicans, кишечная палочка E. coli, три разновидности стафилококка, внутриклеточная паразитическая бактерия листерия и другие.
Кроме того, оказалось, что трансгенные мыши с инактивированным геном одной из секретаз, генерирующих белок Aβ, сильнее подвержены влиянию различных патогенов; то же самое можно сказать и про людей, в ходе клинических испытаний получавших препарат, снижающий уровень Aβ42. Кстати, уменьшение концентрации хорошо изученного АМП LL-37 тоже увеличивает заболеваемость, но и чрезмерно высокая его доза не хороша, потому что приводит к отложению бляшек, подобных атеросклеротическим. Склонность к образованию фибрилл, подобных амилоидным, есть и у других АМП: хорошо известный антимикробный белок лактоферрин образует нерастворимые агрегаты при желатинозной дистрофии роговицы.

Рисунок 3. Чарлтон Хестон и Рональд Рейган на встрече в Белом Доме, 1981 год. Оба к концу жизни заболели болезнью Альцгеймера.
Читайте также:




