Прионовые белки эффекты оказывающие влияние на нервную систему
С появлением Интернета и свободных СМИ, люди стали узнавать всё больше о смертельных заболеваниях — инфекционных, вирусных, онкологических и наследственных. Но мало кто слышал о фатальных прионных болезнях. Несмотря на клинические испытания, на данный момент не существует ни одного доказанного универсального лечения этой группы заболеваний. Невролог Ричард Джонсон из Университета Джона Хопкинса говорит, что если прионы пациента превратились в патологические, он умирает, и мы не можем этого избежать.
Прионные заболевания — они же называются трансмиссивными губчатыми энцефалопатиями — представляют собой семейство редких прогрессирующих нейродегенеративных заболеваний, которые поражают как людей, так и животных. Их отличают:
- длительный инкубационный период;
- характерные губчатые разрыхления мозговой ткани, связанные с потерей нейронов;
- неспособность иммунной системы отреагировать на заражение, инициируя воспалительный процесс.
Прионные болезни поражают как людей, так и животных, быстро прогрессируют и всегда приводят к летальному исходу.
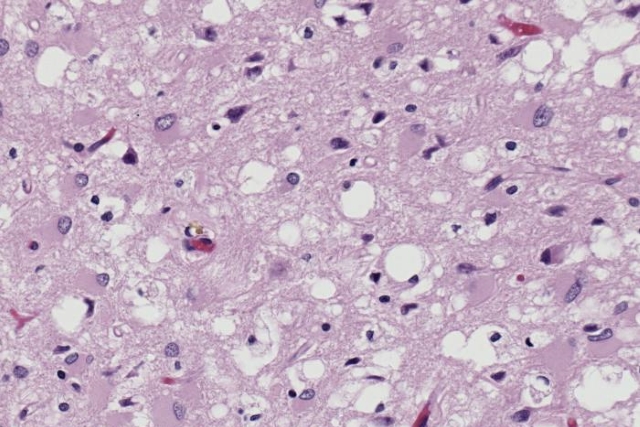
Возбудитель болезни — прионы — тип белков с аномальной третичной структурой, не содержащий нуклеиновых кислот. Сам термин относится к патологическим патогенным агентам, которые способны вызывать аномальное сворачивание специфических нормальных клеточных белков, которые называются как раз прионными белками, встречающихся чаще всего в мозге. Функции этих нормальных прионных белков до сих пор полностью не изучены.
Болезнь Крейтцфельдта – Якоба — БКЯ, псевдосклероз спастический, синдром кортико-стриоспинальной дегенерации, трансмиссивная спонгиоформная энцефалопатия, коровье бешенство.
Это прогрессирующее дистрофическое заболевание коры большого мозга, базальных ганглиев и спинного мозга. Считается основным проявлением губчатой энцефалопатии (прионной болезни). Излечение невозможно. БКЯ поражает людей всех национальностей и рас, мужчин и женщин, взрослых и детей.
Прионные белки — нормальные белки, которые присутствуют у каждого человека. Но есть определённые группы людей, у которых присутствует генетическая мутация, предрасполагающая их к синтезу патогенного прионного белка. Прионные болезни также могут передаваться путём прямого заражения, передача может произойти и в ходе хирургических манипуляций, использования человеческого гормона роста или употреблении заражённого мяса. Такой вид заражения называется ятрогенным и он остаётся в процентном меньшинстве относительно иных форм БКЯ.
Процентное соотношение ятрогенных случаев болезни Крейтцфельдта – Якоба в исследовании National CJD Research & Surveillance Unit у 177 пациентов.
- Гормон роста (соматотропин) — 53,1% (94 случая).
- Твердая мозговая оболочка (в том числе поедание) — 38,9% (69 случаев).
- Гонадотропный гормон — 2,25% (4 случая).
- Нейрохирургический инструментарий — 2,25% (4 случая).
- Пересадка роговицы — 1,69% (3 случая).
- Электроды для стереоэлектроэнцефалографии — 1,12% (2 случая).
- Пересадка печени — 0,56% (1 случай).
Есть случаи заражения, которые не классифицируются ни по одной из двух вышеупомянутых причин, в таком случае они считаются спорадическими, то есть возникшими спонтанно и самостийно, по независящим от генетики или внешних факторов обстоятельствам.
Доктор Ойбек Тургунхужаев, руководитель направления нейрореабилитации Междисциплинарного центра реабилитации (Москва), говорит, что окончательный диагноз человеку с подозрением на какое-либо прионное заболевание основывается на оценке клинических признаков и симптомов и ряде вспомогательных исследований. Долгое время единственным методом подтверждения диагноза была электроэнцефалография. Но поскольку общая чувствительность этого метода ограничена, полезность этого исследования была поставлена под сомнение.
Прионные заболевания неизлечимы, они неизбежно фатальны. Кроме этого, проблема заключается в том, что для постановки достоверного диагноза необходимо проводить вскрытие. Любое вскрытие — это риск для патологоанатома, так как были случаи ятрогенного заражения специалистов от умерших пациентов.
По приказу Роспотребнадзора, о том, что человек заболел прионной болезнью необходимо извещать в течение двух часов. При этом установление такого диагноза ведет за собой, по российским инструкциям, утилизацию всего оборудования, с которым пациент был в контакте. Именно поэтому, когда Медуза рассказывала случай одной из больных БКЯ, все клиники говорили о том, что у них нет оборудования для наблюдениях таких пациентов. На самом деле — это просто способ не потерять миллионы рублей, утилизируя даже аппарат МРТ. Если бы речь шла о сотнях поставленных диагнозов прионной болезни (например, в США регистрируется 300 случаев ежегодно, возможно, их больше), тогда речь шла бы о потери миллиардов рублей для российских больниц и бюджета. Именно поэтому официально диагноз не ставится, врачи не хотят об этом говорить, так как никакого официального распоряжения не существует, что диагноз ставить нельзя. В итоге выходит, что заболевание есть, смерти есть, а причины для родственников и умирающих людей — нет.
Им никто не скажет, что скорее всего родственники уже заразились. Никто не скажет, что нельзя пробовать сырой фарш или есть сырое мясо, тем более мозги. Также как из-за того, что диагноз не ставится, можно случайно пересадить орган больного прионной болезнью, тем самым заразив другого человека. Также это может произойти через хирургический инструмент (такие случае были, об этом ниже).
Когда мы просили хоть кого-то рассказать нам о прионных болезнях, практически никто не готов был говорить открыто. Так мы анонимно поговорили с врачом-неврологом одной из крупнейших московских больниц. «С прионами две проблемы. Во-первых, для постановки достоверного диагноза необходимо проводить вскрытие. Хотя формально (по российским руководствам, например) проводить вскрытие можно, хотя и в особенных условиях. Любое вскрытие — это, естественно, дополнительный риск для патологоанатомов, потому что были описаны случаи заражения патологоанатомов от умерших пациентов. никто не хочет переводить на них риск.
Во-вторых, так как прионные инфекции — это тяжело протекающие, неизлечимые заболевания (хотя и с довольно сложным путем передачи), в нашей стране чертовски сложные законы для регистрации и ведения таких пациентов; о случаях обязаны сообщать в случае выявления чуть ли не в течение двух часов, после постановки диагноза необходимо проводить уничтожение части в том числе дорогостоящего оборудования, которое, как может оказаться по факту, даже рядом не лежало с пациентом, нужно переоформлять документы и так далее.
Болезнь Крейтцфельда – Якоба (БКЯ) является одной из разновидностей прионных болезней. Это быстро прогрессирующее, фатальное нейродегенеративное заболевание, которое, как полагают, вызвано аномальной изоформой прионного белка. БКЯ встречается во всем мире, и согласно статистике, во всем мире заболевает 1 из миллиона человек.
Прионные болезни не идут по одному и тому же сценарию, у людей, страдающих одним и тем же прионным поражением могут разниться эпидемиология и патогенез. Болезнь Крейтцфельда-Якоба делят на несколько типов.
Спорадическая Болезнь Крейтцфельда-Якоба (сБКЯ) — наиболее распространенный вид трансмиссивных губчатых энцефалопатий человека, на долю которого приходится около 85% случаев зарегистрированных заболеваний прионной природы. СБКЯ имеет очень быстрое течение болезни — средняя продолжительность жизни после проявления признаков составляет всего шесть месяцев. Более 90% пациентов умирают в течение года после появления симптомов. Пик заболеваемости приходится на пожилых людей возрастом 60–70 лет, в других возрастных группах случается куда реже. Одной из гипотез происхождения сБКЯ является мнение, что это спонтанное нейродегенеративное заболевание, возникающее в результате соматической мутации гена PRNP или случайного структурного изменения в белке PrP, вызывающее образование PrPSc2. Эпидемиологические исследования не выявили связи спорадической формы БКЯ с экологическими факторами.
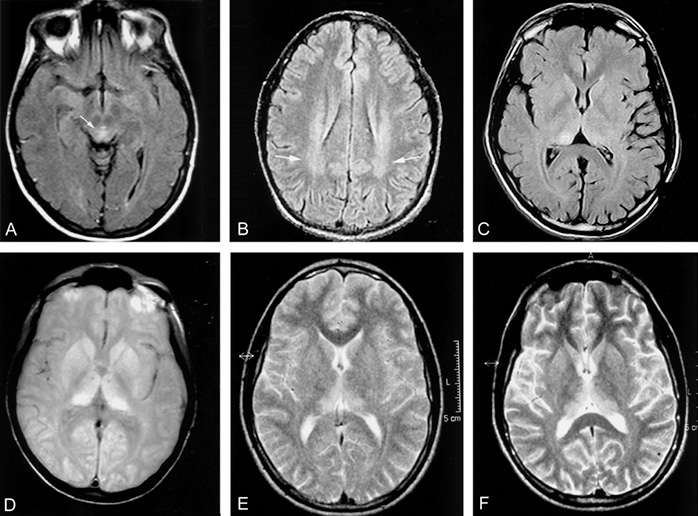
Первые симптомы сБКЯ обычно неспецифические: головная боль, недомогание, кашель, головокружение и изменение поведения, настроения или провалы в памяти. Для подтверждения диагноза должно пройти время, чтобы появились и иные основания полагать прионную природу. Классическими клиническими признаками с БКЯ являются:
- быстрое снижение когнитивных способностей;
- атаксия (нарушение согласованности движения различных мышц);
- миоклонус (быстрые внезапные сокращения отдельных мышц), оканчивающиеся акинетическим мутизмом (торможение всех двигательных функций, кроме фиксирующих движений глазных яблок).
Окончательный диагноз зависит от оценки клинических проявлений и результатов лабораторных тестов.
Акинетический мутизм — состояние при котором пациенты перестают двигаться и следить глазами за целью, за исключением реакции глаз на раздражители или длительной фиксации взгляда, их мышцы самостоятельно или под воздействием внешних факторов периодически быстро сокращаются. Пациенты страдают недержанием, не издают никаких звуков или только нечленораздельные шумы. Если глотание сохраняется, пациенты могут прожить в этом состоянии в течение нескольких недель, даже годы при иных благоприятных факторов, получая питание внутривенно или через трубку. При спорадической форме БКЯ, пациенты доходят до этого состояния в течение первых недель заболевания. Всамых стремительных сценариях, 10% пациентов доходят до этого состояния за год.
Долгое время самым информативным способом постановки диагноза было проведение диффузионно-тензорной МРТ. Этот способ является наиболее доступным, относительно неинвазивным и действенен при ранних изменениях в коре головного мозга. СБКЯ можно обнаружить через маркеры в назальных слизистых оболочках, спинномозговой жидкости, моче или крови, но эти тесты часто дают ложноположительные результаты — белок 14.3.3 не является специфичным без появления сопутствующей клинической картины. Протеинограмма является новым оптимальным методом диагностирования сБКЯ, так как она самая чувствительная из всех вышеназванных.
Белки 14-3-3 — семейство регуляторных молекул, встречающихся у всех эукариот. Они связываются со множеством других белков, регулируя их функции и тем самым влияя на множество процессов, в том числе регулировку клеточного цикла, контроль метаболизма, апоптоз, контроль транскрипции генов. Они были обнаружены более 40 лет назад при систематической классификации белков нервной ткани, где их содержание превышает 1% от всех белков. К настоящему времени описано более 300 различных белков-мишеней, способных взаимодействовать с 14-3-3.
Протеинограмма — исследование, изучающее количественное соотношение разновидностей белка в крови. В понятие общего белка входят все возможные белки, несмотря на их различия в строении и функциях.
Наследственная форма болезни Крейтцфельда – Якоба и также связанная с генетическими мутациями фатальная семейная бессонница составляют всего 10% от всех случаев прионных болезней. Множество исследований указывает на то, что общий путь в патогенезе заболевания может быть общим как для спорадических, так и для наследственных форм прионного заболевания, за исключением того, что в первом случае превращение белка происходит без участия каких-либо факторов, а не предопределено наличием мутации в генах.
Фенотип — совокупность характеристик, присущих на определённой стадии развития болезни. Фенотип формируется на основе генотипа.
Полиморфизм — способность некоторых организмов существовать в состояниях с различной внутренней структурой или в разных внешних формах.
При наследственном прионном заболевании, фенотип заболевания будет определяться комбинированным эффектом патогенных мутаций, полиморфизма кодонов 129 и типа PrPSc. Полиморфизм кодона 129 играет двойную роль в прогнозировании исхода заболевания. Главным в понимании патогенеза прионной болезни является детальное и точное знание процессов и условий in vivo для образования PrPSc, которые неизбежно приводят к развитию и выражению заболевания. Эти знания позволят разработать рациональную и эффективную стратегию терапевтического вмешательства.
Новый вариант болезни Крейтцфельда – Якоба (nvCJD) был впервые идентифицирован в 1996 году. Последующие исследования подтвердили гипотезу, что эта форма связана с бычьей губчатой энцефалопатией. Скорее всего, пациенты употребляли в пищу мясо, содержащее патологические прионы мозга коров.
В отличии от спорадической формы, болезнь не имеет четкого возраста заражения. У пациентов с нБКЯ часто выявляют и психиатрические симптомы, потому порой она ошибочно диагностируется как психическое, а не неврологическое расстройство. Истинная причина психиатрических симптомов кроется в когнитивных нарушениях, постоянных болях в конечностях, нарушениях адекватности ощущений (парестезия или дизестезия), расстройствах речи или зрения.
В течение 6–8 месяцев развиваются пороки управления мышечной системой, но в некоторых случаях развитие болезни может длиться и более 18 месяцев. Потому этот диагноз достаточно трудно поставить при появлении первых признаков заболевания. Если у пациента возникают неконтролируемые движения, возрастает вероятность грамотного диагностирования нБКЯ. В отличие от спорадической формы, где характерны внезапные мышечные спазмы при напряжении (миоклонус), в случае с новой формой возможны и дистония (синдром, при котором происходит постоянное спазматическое сокращение мышц), и хорея (синдром, характеризующийся беспорядочными, отрывистыми, нерегулярными движениями).
Летальная стадия новой формы похожа на летальную стадию спорадической формы болезни Крейтцфельда-Якоба, она проходит с прогрессирующей потерей контроля над мышцами, часто приводящей к состоянию акинетического мутизма.
В отличие от более распространенных слабоумных состояний, которые обычно развиваются годами, быстро прогрессирующие деменции могут развиваться в течение нескольких месяцев, недель или даже дней и приводить к смерти. На спорадическую форму БКЯ приходится 46,9 % всех зарегистрированных случаев быстро прогрессирующей деменции, на генетическую форму прионных заболеваний — 13,6%. 39% всех случаев составляют лобно-височная деменция (FTD), кортикобазальная дегенерация (CBD), болезнь Альцгеймера (AD), деменция с тельцами Леви (DLB) и прогрессивный паралич.
Как правило, спорадическая форма БКЯ представлена совокупностью деменции и нейродегенеративных или психиатрические симптомов. У таких больных распространены пирамидная, мозжечковая и фокальная кортикальная дисфункция. У трети пациентов деменции предшествуют жалобы на усталость, головную боль, нарушение сна, недомогание, потерю веса, боль, депрессию или изменения в поведении.
Неврологические симптомы, включая атаксию, дизестезию, слабоумие или мышечные расстройства (хорея, миоклонус или дистония) появляются позже. Большинство случаев быстро прогрессирующей деменции без других сопутствующих симптомов случается у пожилых людей из-за метаболических нарушений или острых инфекций (пневмонии или инфекции мочевыводящих путей). Потому перед прохождением лабораторных тестов врачи первостепенно указывают быстро прогрессирующую деменцию без явного диагноза. Окончательный вердикт будет зависеть от полученных результатов анализов и обследований, заболевания будут отличаться в зависимости от клинической картины. ЭЭГ может помочь исключить судорожную активность головного мозга и обратиться к диагностике других состояний, таких как БКЯ.
Быстро прогрессирующая деменция представляют собой одну из самых сложных неврологических проблем. Дифференциальная диагностика широко используется для подтверждения окончательных диагнозов, которые могут относиться к нейродегенеративным, аутоиммунным, инфекционным и опухолевым заболеваниям. Даже при таком тщательном подходе к обследованию пациентов, небольшой процент случаев диагностируются уже после смерти.
Фатальная семейная бессонница — это редкое прионное заболевание, которое в буквальном смысле лишает сна и приводит к снижению всех нейро-двигательных и психических функций. Можно выделить две формы этой болезни: генетическую и спорадическую.
Генетическая форма связана с мутацией, приводящей к превращению белка PrP в прионный белок. Спорадическая же появляется спонтанно, без каких-либо предпосылок. Это заболевание отличается от других прионных заболеваний областью поражения — превращение прионных белков в патологические преимущественно происходит в одном отделе головного мозга — таламусе, который, в том числе, отвечает и за сон.
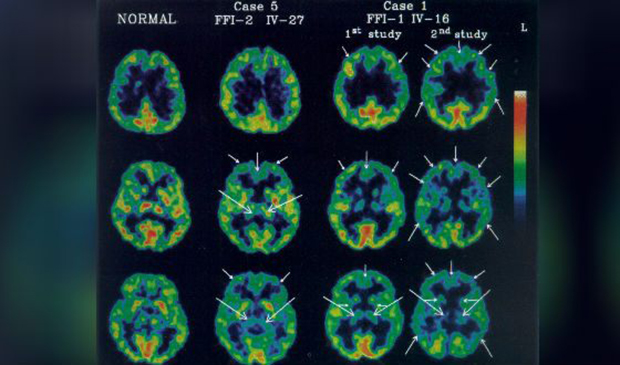
Диагноз фатальной семейной бессонницы в генетической форме подтверждается генетическим тестированием. В случае со спорадическими случаями, могут обнаружить нарушения в структуре сна и аномалии в таламусе полисомнография и позитронно-эмиссионная томография (ПЭТ). Средняя продолжительность жизни с начала первых симптомов заболевания — 3 года, лечения не существует.
Синдром Герстманна-Штраусслера-Шейнкера — это редкая генетическая форма трансмиссивной губчатой энцефалопатии, которая впервые была описана австрийскими неврологами в 1936 году. Синдром чаще всего проявляется в возрасте 40–50 лет, и вызван мутациями генов прионного белка PRNP на 20 хромосоме.
Клиническая картина синдром схожа со спорадической формой БКЯ, но он отличается продолжительностью и медленно прогрессирующей деменцией наряду с иными симптомами. Синдром Герстманна-Штраусслера-Шейнкера может длиться как нескольких месяцев так и несколько лет, средняя продолжительность жизни — 5 лет. Диагностировать заболевание можно даже на ранних стадиях посредством проведения магнитно-резонансной томографии. На МРТ будут наблюдаться губчатые изменения в коре и разрастание глиальных клеток.
Глиальные клетки или нейроглия — совокупность вспомогательных клеток нервной ткани. Составляет около 40 % объёма ЦНС. Количество глиальных клеток в мозге примерно равно количеству нейронов.
Глиальные клетки имеют общие функции и, частично, происхождение (исключение — микроглия). Они составляют специфическое микроокружение для нейронов, обеспечивая условия для генерации и передачи нервных импульсов, а также осуществляя часть метаболических процессов самого нейрона.
Обнаруживать прионную болезнь достаточно трудозатратно, учитывая то, что если диагноз подтвержден, пациенту уже ничем не помочь, а больницы теряют миллионы рублей. И самое жуткое, что все люди на Земле в группе риска. Прионы не пощадят никого. Поэтому не пробуйте фарш, после того, как его посолили. Не ешьте потроха и мозги коров и свиней, и посещайте врача вовремя. В конце концов, МРТ врать не будет.
Прионы — одна из самых больших загадок в биологии и медицине. Возможно, когда-то именно эти неживые вещества, ведущие себя подобно микроорганизмам, привели к исчезновению неандертальцев. Сегодня же они являются объектом огромного интереса со стороны врачей и ученых. MedAboutMe рассказывает о нюансах прионных инфекций и медленных смертельных болезнях, которые они вызывают.
XX век — столетие прионов

Хотя сами прионы были открыты сравнительно недавно, свою историю в медицине прионные инфекции ведут с XVIII века. Первые упоминания об овечьей почесухе (скрепи) в Англии датируются 1732 годом. Явление было столь распространено, что его даже обсуждали в Британском парламенте. В 1899 году ученые доказали инфекционную природу заболевания: то есть тот факт, что необычное поведение овец, которые в результате умирали в судорогах, заразно и передается через повреждения на коже и пищу. Среди характерных признаков скрепи были очень длительный инкубационный период и специфические поражения тканей и органов.
В 1986 году в Великобритании разразилась эпидемия трансмиссивной губчатой энцефалопатии рогатого скота. Источником инфекции стала мясо-костная мука, которой выкармливали телят. Изначально при ее производстве сырье (кости, остатки туш животных) обрабатывалось при температуре до 130°С, но в конце 1970-х годов производители изменили технологию и снизили температуру обработки до 110°С. Это и привело к массовому заражению коровьим бешенством. Попутно оказалось, что многие другие виды млекопитающих, которым перепадала мясо-костная мука или части зараженных коров, также болеют губчатой энцефалопатией.
В марте 1996 года англичане сообщили о первых 10 жертвах прионов среди людей. Через месяц стало известно о пострадавших во Франции, а на данный момент число жертв губчатой энцефалопатии среди людей превысило 200 человек только на территории Европы. Число стран, где были зафиксированы случаи коровьего бешенства у животных, к 2006 году достигло 40.
Прионы — форма белковой псевдожизни

Итак, прионы — это группа белков, имеющих определенную трехмерную конфигурацию, которая считается аномальной. При встрече с аналогичным белком нормальной конфигурации прион запускает процесс его превращения в такую же аномальную структуру. Как и легендарный царь Мидас, превращавший в мертвое золото все, к чему он прикасался, прионы трансформируют нормальный белок в себе подобный, способный разносить инфекцию дальше. То есть, стоит подхватить прионную инфекцию, как в организме запускается цепная реакция, медленно, но верно разрушающая ткани мозга (прионы проходят сквозь гематоэнцефалический барьер).
- нормальную — PrPC,
- прионную — PrPSc.
За производство прионной формы белка отвечает тот же ген, но имеющий одну или несколько из почти 40 мутаций, известных на сегодняшний день. Постепенно трансформируя подходящие белки, прионы образуют амилоиды — агрегаты белковой природы, сходные с амилоидными бляшками, формирующимися при болезни Альцгеймера. И это приводит к аналогичным последствиям — разрушению нервных клеток. Поэтому прионные инфекции относят к нейродегенеративным заболеваниям.
Среди ученых до сих пор не утихают споры на тему, являются ли прионы формой жизни. С одной стороны, они размножаются: был один прион, нашел подходящий белок — стало два приона. С другой стороны, у них нет ДНК (или РНК) — переносчика наследственной информации, как у вирусов, бактерий, грибков и других инфекций.
Для кого опасны прионы?

Прионы опасны для всех форм жизни, у которых есть белок PrP. Прионные болезни уже обнаружены, кроме человека, у овец, коз, коров, норок, оленей, лосей, мулов, кошек (и домашних, и диких), антилоп, страусов и даже у дрожжей. К счастью для всего живого на Земле, прионные инфекции в большинстве своем видоспецифичны. Это значит, что PrP белки разных видов незначительно отличаются друг от друга, поэтому в большинстве случаев у человека нет шансов умереть, скажем, от прионов страуса или дрожжевого грибка.
Но из каждого правила есть исключения. Прионы, губительные для коров, вызывают у человека один из вариантов болезни Крейтцфельдта-Якоба. А подхватить коровий прион можно, съев зараженное мясо. Правда, не каждый человек, употребивший бифштекс коровы, которая скончалась от губчатой энцефалопатии рогатого скота, заболеет. Для заражения необходима комбинация факторов, в число которых входит генетическая предрасположенность к таким инфекциям.
Сегодня выделяют следующие разновидности прионных болезней человека:
Упоминавшаяся выше болезнь гвинейских аборигенов, сегодня практически полностью искорененная в силу отказа племен от каннибализма.
- Синдром Герстмана-Штраусслера-Шейнкера.
Крайне редкое, наследственное заболевание с инкубационным периодом от 5 до 30 лет.
- Фатальная семейная бессонница (FFI).
Тоже очень редкое и передающееся по наследству заболевание, в результате которого человек погибает от необратимых повреждений мозга на фоне бессонницы.
- Болезнь Крейтцфельдта-Якоба (CJD).
Она же — коровье бешенство или трансмиссивная спонгиоформная энцефалопатия и др. Эта болезнь существует в нескольких модификациях. Выделяют спорадическую (sCJD), наследственную (fCJD) и ятрогенную (iCJD) формы. А с 1955 года, после вспышки коровьего бешества в Великобритании — новый вариант nvCJD.
Статистика, собранная в отношении болезни Крейтцфельдта-Якоба, показывает, что только в 1-5% случаев человек может получить прионную инфекцию путем заражения извне, например, при пересадке органов и тканей. В 10-15% случаев заражение является наследственным заболеванием. И, наконец, в 85% случаев причина внезапного развития болезни остается неизвестной. Чаще всего, она поражает людей в возрасте от 40 до 69 лет.
Уничтожить прионы: миссия невыполнима

Ученые давно бьются над проблемой ранней диагностики прионных заболеваний, но пока их поиски не увенчались особым успехом. В биологических жидкостях, то есть в крови и моче, прионы присутствуют в столь малых концентрациях, что определить их довольно сложно. Самый точный метод их выявления — анализ образцов тканей мозга, но его можно провести только посмертно. О ранней и массовой диагностике, таким образом, пока речи не идет.
Лекарств против прионов не существует. Они настолько просты, что близки к совершенству в плане противостояния любых угроз. Это всего лишь хорошо упакованный белок. Его невозможно уничтожить кислотой, УФ-излучением, ферментами, разрушающими другие белки, и даже ионизирующая радиация бессильна против прионных частиц — настолько они малы.
Можно ли защитить здоровье человека?
Меры профилактики: запрет на мясо и лекарства

Раз пока не получается справиться с прионами, остается одно: строгие меры профилактики. Если страна-поставщик мясной продукции объявляет о том, что на ее территории выявлены случаи коровьего бешенства, в подавляющем большинстве случае другие страны отказываются закупать у нее мясо до решения проблемы со вспышкой прионных инфекций.
Особое внимание уделяется использованию различных органов и тканей крупного рогатого скота для производства лекарств, косметических средств и медицинских изделий. Безопасных частей зараженного животного не существует. Это, кстати, привело к тому, что в Великобритании по итогам эпидемии было запрещено производство и использование большого числа лекарств, производимых из тканей и органов коров. И в России под запрет попали некоторые препараты (кортикотропин, лактин и питуитрин для инъекций и др.). Некоторые лекарственные средства (актовегин, солкосерил) запрещены в одних странах (США) и разрешены в других (Россия).
Справится ли человечество с прионами — покажет время. А пока банальный совет: не покупайте мясо, чистота которого не подтверждена санитарными сертификатами. Прионные инфекции встречаются крайне редко, и жить с ними можно очень долго, но исход у них один.
- 14209
- 11,7
- 21
- 7
Путь прионов
![]()
Вероника Балахонова
![]()
Антон Чугунов![]()
Андрей Панов

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Биологическая сущность прионов
Рисунок 1. Метафора нейродегенеративного поражения мозга — это губка, в которую превращается нервная ткань в результате массовой гибели нейронов.
И тогда происходит удивительное событие: нормальные молекулы белка, контактируя с патологическими, сами превращаются в них, изменяя свою пространственную структуру (механизм трансформации остаётся загадкой и по сей день) [1]. Таким образом прион, как самый настоящий инфекционный агент, заражает нормальные молекулы, запуская цепную реакцию, разрушительную для клетки.
Некоторые сведения о прионах
Условия возникновения заболеваний
Условия возникновения прионовых болезней уникальны. Они могут формироваться по трём сценариям: как инфекционные, спорадические и наследственные поражения. В последнем варианте главную роль играет генетическая предрасположенность [2].
В последнее десятилетие интерес к этой теме возобновился в связи с возможностью развития диагностики и эффективной терапии [5]. Появилось множество различных объяснений для возрастных нейродегенеративных болезней, — например, окислительная модификация ДНК, липидов и/или белков; соматические мутации; измененный врождённый иммунитет; экзогенные токсины; несоответствия ДНК—РНК; нарушение работы шаперонов; отсутствие одного из аллелей гена [5]. Альтернативным комплексным разъяснением служит то, что различные группы белков могут формировать прионы. Несмотря на то, что небольшое количество прионов может быть удалено посредством путей белковой деградации, их чрезмерное накопление с течением времени позволяет прионам самостоятельно распространяться в организме (рис. 2), что приводит к нарушению деятельности центральной нервной системы [5].

Группы риска прионных заболеваний
Вот кого прионные заболевания могут настичь с наибольшей вероятностью:
- работники пищевой промышленности;
- ветеринары;
- патологоанатомы;
- хирурги;
- пациенты трансплантолога;
- каннибалы;
- лица, в семье которых были замечены синдромы Герстманна—Штрейслера—Шейнклера или фатальной инсомнии.
Лабораторная диагностика и лечение
Диагностика базируется на внутримозговом заражении мышат или хомяков, у которых медленно (до 150 дней) развивается соответствующее заболевание, если пациент был болен [2]. Часто проводится гистологическое исследование головного мозга погибших животных [2].
К сожалению, до настоящего времени еще не разработаны эффективные методы лечения прионовых болезней, хотя попытки предотвратить конформационный переход нормального белка в аномальный производятся. Поэтому самым надёжным способом предупреждения развития инфекционных форм является профилактика [2].
Перспективы
По-видимому, интерес к прионам не угаснет до тех пор, пока предположения на их счёт полностью не подтвердятся и не будут найдены эффективные способы лечения прионных заболеваний. В статье [6] говорится о необходимости современного исследования, которое требует тщательного рассмотрения чужеродных прионов в экстраневрональных тканях.
В качестве модельных объектов авторы использовали мышей: две линии, которые трансгенно экспрессировали овечий прионный белок, и одну линию, которая экспрессировала человеческий прионный белок (рис. 3). Задачей было сравнить эффективность межвидовой передачи инфекции посредством тканей мозга и селезёнки. Внутримозговое заражение чужеродным прионным белком выражалось в отсутствии или небольшом количестве инфекционного агента в мозгах этих мышей. Однако инфекционные чужеродные прионы обнаруживались в селезёнке на более ранних этапах заражения в сравнении с моментом, когда были использованы нейротропные прионы, тем самым определяя, что лимфатическая ткань может быть более пермиссивной к распространению чужеродных прионов по сравнению с мозгом.
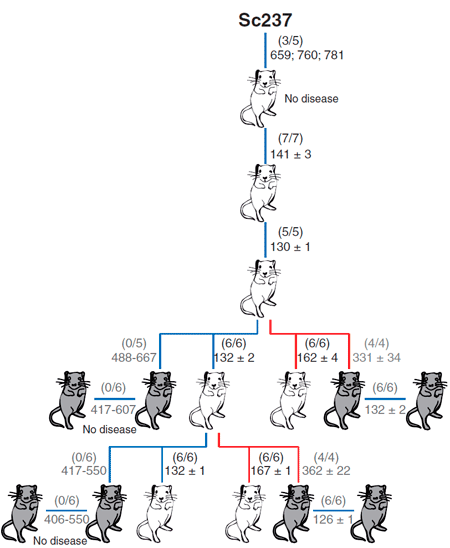
Рисунок 3. Способность приона хомяков Sc237 заражать и передаваться при введении в мозг или селезенку трансгенным мышам, имеющим прионный белок PrP овцы (tg338; белые мыши) или человека (tg7; серые мыши). Число заболевших/инъецированных мышей показано в скобках; ниже приведено среднее время жизни (в днях).
Чем вызвана эта предпочтительная репликация прионов в лимфатических тканях, пока неизвестно. Однако полученные данные показывают, что человек может быть более чувствительным к чужеродным прионам, чем предполагалось ранее на основании присутствия прионов в мозгу, и по этой причине бессимптомный переносчик прионной болезни может быть не распознан. Это ещё раз подтверждает, что такая могущественная биомолекула как прион таит в себе немало загадок, раскрытие которых, возможно, поможет в понимании ряда неразрешимых проблем человечества.
Читайте также:





