Анастомоз между культей желудка и тощей кишкой при резекции желудка по Billroth II.
Добавил пользователь Morpheus Обновлено: 21.01.2026
Кислотообразующая функция культи желудка изучена у 34 пациентов с пептическими язвами и различной длительностью анамнеза постгастрорезекционных расстройств. Выявленные различия уровня кислотообразования у пациентов с разной длительностью анамнеза постгастрорезекционного синдрома (ПГРС) подтверждают предположение о снижении роли соляной кислоты в рецидивировании пептических язв желудка с увеличением времени, прошедшего после резекции желудка.
Ключевые слова: пептические язвы культи желудка, кислотообразующая функция культи желудка.
Acid-production function of gastric remnant in patients with peptic ulcers after gastric resection according to Billroth II
Korochanskaya Natal’a Vsevolodovna - MD, prof. City Hospital Nr. 2, Kuban state medical university, Krasnodar, Russia
Durleshter Vladimir Moiseevich - MD, prof. City Hospital Nr. 2, Kuban state medical university, Krasnodar, Russia
Bulozhenko Natal’a Anatol’evna - MD City Hospital Nr. 2, Krasnodar, Russia
The gastric remnant acid-formation function was studied in 34 patients with peptic ulcers and different duration in anamnesis of post-gastroresection disturbances. The distinctions of acid production in patients with different duration in anamnesis of post-gastroresection syndrome (PGRS) were revealed. It has corroborated the hypothesis about the decreasing hydrochloric acid role in relapse of gastric peptic ulcers with the increasing of time interval after the gastric resection.
Key words: peptic ulcers of gastric remnant, acid production function of gastric remnant.
Постгастрорезекционные пептические язвы (ПЯ) желудочно-кишечного соустья и тощей кишки после оперативных вмешательств на желудке занимают одно из ведущих мест среди болезней оперированного желудка. Согласно сводным данным отечественных и зарубежных авторов, частота возникновения рецидива язвы после операций на желудке составляет от 0,5 до 25 % 5.
Несмотря на более чем вековую историю существования проблемы ПЯ оперированного желудка, это осложнение, по образному выражению терапевта Е.И. Майзеля (1931), «как тень следует за операцией по поводу дуоденальной язвы». ПЯ оперированного желудка плохо поддается медикаментозной терапии и в 79-85 % случаев имеет осложненное течение 10. Большинство больных с этой патологией нуждаются в оперативном лечении. Рецидивные ПЯ развиваются обычно в тощей кишке в месте ее соустья с желудком или вблизи анастомоза либо в двенадцатиперстной кишке (ДПК).
В литературе широко представлены различные теории и воззрения относительно природы язв оперированного желудка. В историческом аспекте первоначально была широко распространена механическая теория ульцерогенеза. Предполагалось, что язва образуется при грубых манипуляциях на кишечной стенке, её травматизации зажимами, клеммами, нерассасывающимся шовным материалом [12, 13]. Однако язвы «шовного происхождения» никакого отношения к истинным ПЯ оперированного желудка не имеют. Вместе с тем результаты морфологических исследований биоптатов позволяют заключить о трофических изменениях слизистой оболочки (СО) культи, вызванных деваскуляризацией и денервацией малой кривизны во время первичной резекции. Механические факторы, как и трофические нарушения, следует отнести не к основным, а к дополнительным факторам изъязвления СО оперированного желудка [7].
Ведущая роль в возникновении пострезекционных рецидивных язв большинством авторов отводится сохранившейся способности культи желудка продуцировать соляную кислоту [10, 14, 15]. Основной причиной сохранённой кислотопродуцирующей функции оперированного желудка является неадекватно выполненная резекция этого органа без ваготомии («экономной резекции») или неполная ваготомия [8, 15].
Ряд авторов [8, 16] полагают, что язвенное поражение оперированного желудка возникает вследствие непрерывного (в том числе и в межпищеварительный период) кислотообразования, которое может быть обусловлено такими причинами, как:
· оставленная в культе ДПК часть слизистой антрального отдела (АО) желудка («синдром оставленного антрума»);
· повышенный тонус блуждающего нерва;
· эндокринные заболевания, приводящие к гипергастринемии: синдром Золлингера - Эллисона; аденома паращитовидных желёз - первичный гиперпаратиреоидизм; синдромы мультифокальной эндокринной неоплазии - синдромы Вернера, Симпла, Шимке, встречающиеся крайне редко.
Особое внимание в патогенезе послеоперационной ПЯ отводится рефлюксу кишечного содержимого в желудок через зияющий анастомоз. Гастростаз различного генеза (в том числе и при спаечном процессе органов брюшной полости, вызванном первичной резекцией) способствует ульцерогенезу за счет увеличения времени воздействия (постоянной экспозиции) соляной кислоты на область гастроэнтероанастомоза (ГЭА) [14].
Многочисленными исследованиями отечественных и зарубежных учёных убедительно доказана роль Helicobacter pylori (НР) в патогенезе не только язвенной болезни (ЯБ) и хронического гастрита, но и ПЯ оперированного желудка [17, 18].
Причиной возникновения ПЯ после резекции желудка (РЖ) может быть наличие гастринпродуцирующих пилорических желез в культе желудка, благодаря их дистопии вдоль малой кривизны, которая встречается у 10 % язвенных больных [19].
Большинство авторов единодушны во мнении, что в основе развития пострезекционных ПЯ лежит совокупность этиопатогенетических факторов [5, 7]. Эти факторы вызывают нарушение физиологического соотношения между механизмами защиты и механизмами агрессии, что и приводит к возникновению ПЯ.
Цель исследования - оценить секреторную функцию культи желудка у пациентов с ПЯ, перенесших РЖ по Бильрот-II.
Материал и методы исследования. Кислотообразующая функция культи желудка была изучена у 34 пациентов с ПЯ и различной длительностью анамнеза постгастрорезекционного синдрома (ПГРС). По срокам, прошедшим после РЖ, все больные были разделены на две группы: I группу составили лица, наблюдаемые в сроки от 1-го месяца до 3-х лет после перенесенной РЖ (10 человек), во II группу вошли пациенты с длительностью ПГРС более 3-х лет (24 человека).
Секреторную функцию желудка изучали по методике, модифицированной Г.Г. Коротько и соавт. [20]. Исследование проводили утром, натощак, после 12-14-часового голодания, не менее чем через 24 часа после отмены антисекреторных препаратов. Изучали базальную и стимулированную секреторную функцию культи желудка. Для оценки базальной секреции в течение часа собирали четыре пятнадцатиминутные порции и определяли объем, кислотность и протеолитическую активность. Полученные данные характеризуют спонтанную желудочную секрецию.
При изучении стимулированной секреции в качестве стимуляторов максимальной секреции использовали гистамина дихлоргидрат (п/к, 0,024 мг/кг). В каждой порции секрета измеряли объем (мл), кислотность (ммоль/л), концентрацию пепсина (мг/мл). Определение кислотности желудочного сока производили методом его титрования 0,1 Н раствором едкого натрия из микробюретки, используя индикаторы: диметиламидобензонейтральрот, фенолфталеин. Концентрацию пепсина определяли по методу Н.П. Пятницкого (1968), применяя эталон свиного кристаллического пепсина.
Проводили также интрагастральную рН-метрию. Исследование делали натощак, не ранее 24 часов после отмены антисекреторных препаратов, по стандартной методике Е.Ю. Линара [21] на отечественном приборе «Гастроскан-24» с использованием 2-датчиковых зондов и компьютерной обработки информации. В оболочке зонда проведена трубка, оканчивающаяся на 2 см выше проксимального датчика и используемая для введения в желудок раствора соды и фармакологических препаратов. Через усилитель и аналого-цифровой преобразователь рН-зонд подключается к персональному компьютеру, снабженному специальной программой. Точность установки зонда контролировали рентгенологически.
Первые 30 минут регистрировали показатели базальной секреции. Для фармакотестирования использовали регуляторы секреции: при высоких значениях рН в фундальном отделе - введение максимальных стимуляторов (гистамин - 0,024 мг/кг п/к); при низких значениях рН (рН < 4) - блокаторов секреции (атропин - 0,5 мл 0,1 %-го раствора п/к ). Щелочной тест (время нейтрализации - 10 мл 2 %-го раствора соды) проводился после оценки базального кислотообразования и введения стимулятора или блокатора секреции.
Результаты и обсуждение. Были выявлены достоверные различия в показателях базальной и максимальной продукции соляной кислоты у пациентов с разной длительностью анамнеза после РЖ, что свидетельствует о прогрессировании атрофических изменений в культе желудка и снижении роли кислотного фактора в патогенезе рецидивных ПЯ (табл. 1).
Анастомоз между культей желудка и тощей кишкой при резекции желудка по Billroth II.
Клиника факультетской хирургии №1 лечебного факультета Первого Московского государственного медицинского университета им. И.М. Сеченова
Кафедра факультетской хирургии №1 Первого Московского медицинского института им. И.М. Сеченова
Существует ли оптимальный вариант гастроэнтероанастомоза после дистальной субтотальной резекции желудка?
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2012;(8): 83‑86
Крылов Н.Н., Мухаммед М.Х. Существует ли оптимальный вариант гастроэнтероанастомоза после дистальной субтотальной резекции желудка? Хирургия. Журнал им. Н.И. Пирогова. 2012;(8):83‑86.
Krylov NN, Mukhammed MKh. Is there an optimal variant of the gastroenteroanastomosis after the distal subtotal gastric resection? Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2012;(8):83‑86. (In Russ.).
Несмотря на снижение заболеваемости в течение последних десятилетий, рак желудка остается одним из самых распространенных видов злокачественных опухолей, приводя к гибели около 500 тыс. человек ежегодно. Подводя итоги напряженной работы онкологов за последние 2-3 десятилетия, можно утверждать, что результаты лучевой и химиотерапии при этом заболевании остаются скромными, а комбинированные и комплексные методы лечения существенно не сказались на выживаемости при раке желудка, поэтому до настоящего времени все еще нет единого мнения о значении адъювантных методов в лечении этой категории больных. Следовательно, хирургический метод и поныне остается единственным и основополагающим, дающим шанс на полное выздоровление.
В ходе дистальной резекции желудка хирург решает две важные проблемы: первая - удаление опухоли вместе с локорегионарными метастазами и вторая - проведение реконструктивно-восстановительного этапа (формирование анастомоза между культей желудка и тонкой кишкой). Методика радикальной операции сегодня стандартизирована и включает субтотальную резекцию желудка (или гастрэктомию) с обязательным проведением лимфаденэктомии в объеме не менее D2. В то же время вариантов гастроэнтероанастомоза за 130 лет существования хирургической гастроэнтерологии после первой успешной резекции желудка [20] в 1881 г. T. Billroth описано более 100 и количество их постоянно растет. Кроме того, если первый этап операции в конечном счете предопределяет вероятность выздоровления от основного заболевания («количество жизни» больного), то от восстановительного этапа вмешательства, по мнению большинства хирургов, зависят вероятность развития и степень выраженности различных проявлений болезни оперированного желудка («качество жизни» пациента).
Какая из проблем наиболее важна? Как соотносятся приоритеты? Несомненно, основными требованиями к онкологической операции являются обеспечение радикальности и абластичности, уменьшение послеоперационной летальности. При этом способ наложения соустья в ранге факторов, предопределяющих окончательное мнение в пользу того или иного решения, уходит на второй план, а обеспечение приемлемых послеоперационных функциональных результатов имеет вторичный, подчиненный характер. Однако следует помнить о том, что достижение именно этих, второстепенных, целей может улучшить не только непосредственные, но и отдаленные результаты лечения.
Хотя вариантов соустья культи желудка и тонкой кишки существует множество, на практике выбор не столь очевиден. Чаще всего различные раритетные и экзотические способы формирования анастомоза между культей желудка и тонкой кишкой остаются на страницах истории хирургии и в памяти их изобретателей. Фактически практикующие врачи, как правило, выбирают между прямым гастродуоденоанастомозом по Бильрот-I (Б-I), позадиободочным терминолатеральным гастроеюноанастомозом на короткой приводящей петле - анастомозом по Гофмейстеру-Финстереру (Г-Ф), впередиободочным терминолатеральным соустьем на длинной петле тощей кишки с межкишечным анастомозом (по Бальфуру) и позадиободочным гастроеюнальным анастомозом по типу конец в бок на Ру-петле длиной 35-50 см (по Ру). Последние три метода объединяет принцип выключения двенадцатиперстной кишки из непосредственного пассажа пищевого комка (а значит, и выключения этапа дуоденального пищеварения), что характерно для всех вариантов анастомоза по Бильрот-II.
Выбор одного варианта решения («decision making») из нескольких неочевидных сам по себе является проблемой. Почему хирург принимает то или иное решение? Какие доводы перевешивают мнения оппонентов в каждом конкретном наблюдении?
В основе принятия привычного решения, стандартизированного подхода, часто лежит традиция. Так, например, в странах, где рак желудка является социальной проблемой и опыт хирургических центров значителен (Япония, Китай, Корея), чаще всего накладывают анастомоз по Бильрот-I, в то же время в странах Западной Европы, где рак желудка оперируют реже, отдают предпочтение методике Ру, в России во многих клиниках считают приоритетным вариант Г-Ф или Бальфура.
В связи с этим полезно обобщить сведения, отражающие как преимущества, так и проблемные «узкие места» каждого из наиболее известных и широко используемых методов формирования гастроэнтероанастомоза.
Очевидным достоинством прямого гастродуоденоанастомоза по Б-I является сохранение этапа дуоденального пищеварения (возможность полноценной обработки пищевого комка желчью и панкреатическим соком), при котором в некоторой степени могут сохраняться механизмы обратной связи и, вероятно, аутокринная и паракринная стимуляция, регулирующие желудочное пищеварение. Сфинктерный аппарат двенадцатиперстной кишки, по-видимому, частично компенсирует утраченный привратник, что находит отражение в невысокой частоте и интенсивности заброса желчи в культю желудка. Это подтверждается относительно небольшой частотой щелочного рефлюкс-гастрита (обычно указывают от 20 до 60%).
Вместе с тем удовлетворительные условия для раннего восстановления моторики благодаря физиологическому действию химуса на слизистую двенадцатиперстной кишки проявляются невысокой частотой и выраженностью послеоперационного гастростаза. При наложении анастомоза по Б-I a priori отсутствуют анатомические условия для развития острого и хронического синдрома приводящей петли. Стандартная методика резекции по Б-I считается технически более простой, занимает меньше времени (накладывают только один анастомоз), поэтому ее считают более предпочтительной у больных пожилого и старческого возраста («Для них нет ничего более важного, чем время». Св. Бернард). Несостоятельность швов анастомоза в стандартных условиях наблюдают нечасто (0,5-1,5%). К достоинствам этого варианта соустья относят и невысокие показатели летальности (0,2-3,0%), в среднем около 1-2% [9, 10].
Кроме того, формирование этого варианта анастомоза переходит в иную, более высокую категорию сложности, если у больного в анамнезе была язвенная болезнь двенадцатиперстной кишки, которая привела к рубцовой деформации луковицы и стенозированию ее просвета. В этих условиях появляются очевидные сложности с мобилизацией верхнегоризонтального и нисходящего отделов двенадцатиперстной кишки. При этом линия пересечения луковицы должна быть смещена значительно дистальнее - в постстенотическую часть бульбодуоденального перехода. Это затрудняет наложение задней губы гастродуоденоанастомоза и может создавать избыточное его натяжение, а значит, и увеличит риск несостоятельности швов.
Главным препятствием в выборе метода Б-I являются особенности анатомического распространения и гистологического строения опухоли. Поздняя стадия неоплазии и распространение ее с привратника на верхнегоризонтальную ветвь двенадцатиперстной кишки, низкодифференцированный рак с эндофитным подслизистым ростом являются очевидным препятствием к наложению гастродуоденоанастомоза, так как хирург будет стремиться гарантированно обеспечить отсутствие опухолевых клеток в дистальном крае резекции, а это может приводить к дальнейшему увеличению натяжения между краями анастомоза, что провоцирует вероятное развитие его несостоятельности [19, 20].
Именно эти описанные выше условия и сформировали в России предубеждение, при котором, выполняя резекцию желудка по Б-I по поводу рака, хирург, как правило, ограничивает объем иссечения органа для того, чтобы без натяжения произвести гастродуоденостомию, таким образом, операция заведомо оказывается нерадикальной [2].
Весомыми противопоказаниями к выполнению субтотальной резекции желудка по Б-I считают сопутствующие заболевания, при которых показано шунтирование двенадцатиперстной кишки: органический дуоденостаз, дивертикулы нисходящего и нижнегоризонтального ее отделов, хронический рецидивирующий панкреатит и аномалии развития поджелудочной железы (кольцевидная поджелудочная).
Обсуждая преимущества резекции желудка по Б-II с анастомозом по Г-Ф, прежде всего указывают на возможность формирования такого соустья даже при предельно субтотальном объеме резекции (т.е. при очень малом объеме оставшейся культи желудка), поскольку натяжения между культей желудка и анастомозируемой петлей тощей кишки, как правило, не возникает. Этот вариант гастроэнтероанастомоза позволяет избежать коллизий при выявлении выраженной рубцово-язвенной деформации луковицы двенадцатиперстной кишки [8, 21, 22].
Недостатки этого вида анастомоза очевидны: исключение пассажа пищи через двенадцатиперстную кишку, нерегулируемый рефлюкс кишечного содержимого из приводящей петли в культю желудка способствуют развитию постгастрорезекционных синдромов (рефлюкс-гастрита, рефлюкс-эзофагита, демпинг-синдрома соответственно у 75-100, 20-50 и 20-30% больных).
Чрезмерно высокое формирование «шпоры Финстерера» (высокая фиксация приводящей петли на вновь сформированной малой кривизне культи желудка под очень острым углом) или избыточная мобильность приводящей части тонкой кишки может провоцировать развитие синдрома приводящей петли у 6-12% больных. В этом случае появляется угроза развития несостоятельности швов культи двенадцатиперстной кишки с последующими витальными осложнениями.
В целом при этом варианте анастомоза тяжелые и среднетяжелые послеоперационные осложнения возникают почти в 2 раза чаще, чем после резекции по Б-I. По-видимому, именно этим обстоятельством обусловливаются в среднем на 25-30% более длительные сроки пребывания пациентов в стационаре и соответственно средняя стоимость лечения больных на 20-30% больше, чем при анастомозе по Б-I [15, 18].
При реконструкции по Ру продолжительность операции заведомо увеличивается, поскольку в ходе ее необходимо ушить культю двенадцатиперстной кишки и наложить два анастомоза - гастроэнтероанастомоз (между культей желудка и Ру-петлей) и межкишечный анастомоз [14] (между Ру-петлей и приводящей частью тощей кишки). Однако при этом варианте анастомоза не лимитируются размеры культи желудка, редко развиваются демпинг-синдром и особенно рефлюкс-гастрит и рефлюкс-эзофагит (от 0 до 10% наблюдений).
Этот вариант операции считают целесообразной альтернативой операции по Б-I при распространении опухоли на луковицу двенадцатиперстной кишки и/или головку поджелудочной железы, а также при инфильтративном раке с переходом на тело желудка, когда необходимо расширить объем резекции до предельно субтотальной (более 80-85% объема желудка). Утверждают, что Ру-анастомоз характеризуется меньшей угрозой рецидива опухоли в культе и меньшей частотой несостоятельности швов гастроэнтероанастомоза. При анастомозе по Ру крайне редко встречается несостоятельность швов культи двенадцатиперстной кишки, что, по-видимому, обусловлено отсутствием высокой гипертензии в приводящей петле [6, 16].
В то же время специфическим для этого варианта анастомоза считают развитие стаза культи желудка (5-15% больных) и в отключенной по Ру петле тонкой кишки, в основе которого могут быть как механические (перекрут Ру-петли, формирование на ней «двустволки», стриктура межкишечного анастомоза), так и функциональные (синдром избыточного бактериального роста в Ру-петле) причины. Кроме того, при формировании петли, выключенной по Ру, происходит ее разобщение с водителем ритма двенадцатиперстной кишки, поэтому становится возможным возникновение стойкой электрической дизритмии Ру-петли. Однако в настоящее время очевидно, что частота синдрома Ру значительно уменьшается по мере увеличения объема резекции желудка [5, 13].
К недостаткам анастомоза по Ру относят и более высокую частоту развития холелитиаза (15-20% больных) в отдаленные сроки после операции. При выявлении холедохолитиаза после резекции по Ру возникает также очевидная сложность эндоскопических манипуляций на большом сосочке двенадцатиперстной кишки, ограничивающих возможность выполнения эндоскопической папиллотомии и экстракции камней из общего желчного протока (чем больше длина Ру-петли, тем менее вероятна эндоскопическая операция) [17].
В отличие от реконструкций по Ру и Г-Ф, при которых рассекают брыжейку поперечной ободочной кишки и фиксируют гастроэнтероанастомоз в окне мезоколон, при операции по Бальфуру анастомоз располагается впереди ободочной кишки [1, 11, 12]. Это означает отсутствие риска повреждения сосудистой сети поперечной ободочной кишки и при первичной операции, и при повторной операции по поводу местного рецидива опухоли. Кроме того, при его возникновении легче осуществить мобилизацию культи желудка. Дополнительным преимуществом этой модификации анастомоза считают тот факт, что при развитии местного рецидива рака менее вероятно сдавление гастроэнтероанастомоза увеличенными лимфоузлами извне, что наблюдают как при операции по Б-I в области головки поджелудочной железы, так и в окне брыжейки поперечной ободочной кишки при анастомозах по Г-Ф и Ру [3-5, 7].
Следует подчеркнуть, что межкишечный анастомоз при способе Бальфура уменьшает частоту (30-75%) и выраженность энтерогастрального рефлюкса по сравнению с таковыми при использовании метода Г-Ф, но не предупреждает его полностью.
Итак, можно утверждать, что в целом ряде наблюдений распространение опухоли желудка само по себе, как и анатомические особенности двенадцатиперстной кишки, ограничивают возможности заранее намеченного плана операции в пользу другого, более адекватного и безопасного. Важно, чтобы излюбленные приемы хирурга, применяемые в типичных ситуациях, не стали догмой, не превратились в «вериги», связывающие руки при поиске выхода из трудных, нестандартных положений.
Таким образом, ни один из наиболее широко употребляемых в мире вариантов гастроэнтероанастомоза не лишен недостатков; выбор метода резекции желудка при раке не может быть конкурирующим и должен входить в компетенцию хирурга, при этом необходимо обязательно учитывать особенности послеоперационной реабилитации больных.
При модификации по Б-I принципиально возможно реализовать основные принципы онкологического радикализма - адекватный объем резекции и лимфаденэктомия.
Гарантии безрецидивного течения рака желудка не существует; возможность и необходимость повторного вмешательства вполне реальна и должна быть учтена уже при первичной операции; наиболее благоприятные технические условия для повторной операции имеются при выполнении первичной операции по Бальфуру (впередиободочное расположение длинной кишечной петли).
Единственный вариант гастроэнтероанастомоза, который может предупредить энтерогастральный желчный рефлюкс, - это анастомоз на Ру-петле.
Окончательное решение о способе анастомозирования культи желудка и тонкой кишки следует принимать после мобилизации желудка и двенадцатиперстной кишки и оценки анатомических соотношений с учетом личного опыта хирургической деятельности и традиций клиники.
Резекция желудка по Бильрот 2: техника операции, осложнения
Резекция желудка по Бильрот 2 в лечении онкологии и язвы: показания к операции. Преимущества и недостатки операционных пособий Бильрот 1 и 2. Осложнения после резекции по Бильрот 2. Оказываем качественную помощь в лечении самых сложных заболеваний.
Резекция желудка по Бильрот 2 — операция абдоминальной хирургии, которая проводится для лечения онкологических заболеваний и осложненной язвенной болезни. Суть операции заключается в удалении значительной части органа и создании соустья между культей и тощей кишкой. Методика обладает рядом недостатков и используется при невозможности применения другого хирургического пособия.
Резекция Бильрот-1, 2: история
Первую резекцию желудка с созданием гастроэнтероанастомоза провел в 1881 году выдающийся австрийский врач Теодор Бильрот. Показанием для оперативного вмешательства было онкологическое заболевание (рак желудка). В ходе процедуры использовалась уникальное на тот момент хирургическое пособие с созданием гастродуоденоанастомоза по типу конец в конец. В дальнейшем данную технику стали называть Бильрот 1.
В 1885 году Теодор Бильрот предложил второй способ создания соустья между культей и ниже расположенными отделами пищеварительного тракта — гастроеюнальный анастомоз по типу бок в бок. Соустье соединяло культю желудка и петлю тощей кишки . Часть тонкого кишечника, расположенная выше анастомоза и включающая двенадцатиперстную кишку, ушивалась. Данный вариант хирургического пособия получил название Бильрот 2.
Резекция по Бильрот 2 обладает объективными недостатками, о которыми рассказывается в соответствующем разделе статьи. Недостатки метода заставили хирургов искать другие варианты создания соустья. Сегодня существует множество модификаций техники Бильрот 2, среди которых наибольшее распространение получил метод Гофмейстера-Финстерера и резекция по Ру.
Показания к операции
Бильрот 1, 2 — операции абдоминальной хирургии, в рамках которых проводится удаление дистальной части желудка с последующим созданием соустья между культей и расположенными ниже отделами тонкой кишки.
Показанием к удалению части желудка является:
- Онкологическое заболевание.
- Доброкачественная опухоль.
- Язвенная болезнь с осложнениями.
Технику резекции желудка по Бильрот также используют при лечении тяжелых травм брюшной полости . В бариатрии (хирургия ожирения) хирургические пособия по Бильрот не применяются. Для лечения ожирения и сопутствующих ему заболеваний эндокринной и сердечно-сосудистой системы используется особая техника — продольная резекция, она же рукавная гастропластика.
Продольная резекция не нарушает естественный пассаж пищи по желудочно-кишечному тракту и лишена всех недостатков, свойственных рассматриваемым в этой статье методикам.
Виды резекции желудка
В зависимости от локализации патологического очага, а также целей и задача операции, хирургом производится дистальная , антральная, проксимальная, субтотальная, тотальная или продольная резекция желудка .
Дистальная резекция — классическая операция абдоминальной хирургии, во время которой врач удаляет от 60 % до 75 % дистальной части желудка . Проксимальный кардиальный отдел остается и используется для создания соустья. Дистальная гастрэктомия применяется при доброкачественных опухолевых процессах и в лечении онкологических заболеваний.
Антральная резекция — вариант операции, при которой хирургом удаляется только антральный отдел органа, то есть примерно одна треть желудка. Применяется антральная гастрэктомия , главным образом, при лечении язвенной болезни и доброкачественных заболеваний.
Проксимальная резекция — удаление верхней части органа, граничащей с пищеводом. Используется проксимальная гастрэктомия при опухолевых процессах в кардиальной части желудка.
Субтотальная резекция — масштабная операция, во время которой удаляется более 80 % органа. Применяется субтотальная гастрэктомия при лечении онкологических заболеваний. По статистике, не менее 60 % пациентов со злокачественным новообразованием нуждаются в субтотальной резекции, поскольку только она позволяет минимизировать риск распространения опухоли в лимфатические узлы и соседние органы.
Тотальная резекция — удаление всего органа. Применяется тотальная гастрэктомия при онкологических заболеваниях.
Продольная резекция — удаление части органа по большой кривизне с полным сохранением малой кривизны , кардиальной части и привратника. Этот вариант оперативного вмешательства применяется при лечении ожирения и ассоциированных с ожирением хронических заболеваний. Целью хирургического лечения является уменьшение объема органа для сокращения потребления пищи .
Бильрот 1, 2: техника операции
Резекция части органа — первый этап оперативного вмешательства . На втором этапе гастрэктомии хирург восстанавливает целостность пищеварительного тракта за счет создания соединения (анастомоза) между культей и тонкой кишкой. Бильрот 1 и 2 — различные оперативные пособия (техники), применяемые при формировании анастомоза.
Резекция желудка по Бильрот 1 — операция, при которой анастомоз соединяет желудок с двенадцатиперстной кишкой и создается по типу конец в конец. Что это означает?
Хирург ушивает культю со стороны малой кривизны , оставляя открытым небольшой участок в области большой кривизны. Открытый терминальный участок (конец) культи желудка соединяется мышечным швом с концом двенадцатиперстной кишки . Так формируется гастродуоденоанастомоз по Бильрот 1.
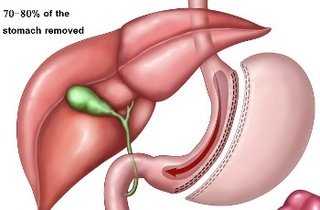
Резекция желудка по Бильрот 2 — операция, при которой анастомоз соединяет культю желудка с тощей кишкой. Двенадцатиперстная кишка ушивается и выключается из пассажа пищи , что является главным недостатком методики и служит причиной для развития послеоперационных осложнений.
Петлю тощей кишки выводят в верхний этаж брюшной полости через отверстие в брыжейке ободочной кишки . В боковой части кишки создается отверстие, которое подшивается к боковой части культи желудка по большой кривизне. По малой кривизне желудочная стенка ушивается наглухо. Формируется гастроеюноанастомоз, желудок и кишечник соединяются по принципу бок в бок.
Техника Гофмейстера-Финстерера. Данное хирургическое пособие является модификацией операции Бильрот 2. Принципиальное отличие резекции желудка по Гофмейстеру-Финстереру в том, что концевой отдел культи желудка подшивается к боковому отверстию в стенке тощей кишки , то есть формируется соустье по принципу конец в бок. Расположенная над анастомозом часть кишечника подшивается к культе со стороны малой кривизны . Двенадцатиперстная кишка ушивается и выключается из пассажа пищевого комка.
Метод Гофмейстера-Финстерера позволяет значительно снизить риск развития послеоперационных осложнений, свойственных резекции желудка по Бильрот-2 . Но часть тощей и двенадцатиперстной кишки по-прежнему выключена из процесса пищеварения, что может приводить к развитию осложнений. Для устранения этого недостатка предложена операция по Ру.
Резекция по Ру. Особенность хирургического пособия по Ру в том, что анастомоз между тощей кишкой и культей формируется по принципу конец в конец. Для этого тонкий кишечник в верхнем отделе рассекается на две части.
Дистальный конец тощей кишки с помощью мышечных швов соединяется с культей. Формируется гастроеюнальный анастомоз, соединяющий культю с кишечником. Проксимальный конец тощей кишки , который анатомически соединен с дистальным отделом двенадцатиперстной кишки , подшивается к кишечнику ниже анастомоза. Проксимальный отдел культи двенадцатиперстной кишки ушивается.
Такой принцип реконструкции верхних отделов желудочно-кишечного тракта позволяет избежать заброса желудочного содержимого через соустье в двенадцатиперстную кишку. Нет риска застоя и гниения фрагментов пищевого комка в 12-перстной кишке, нет риска несостоятельности швов 12- перстной кишки , дуоденогастрального рефлюкса и других послеоперационных осложнений операции по Бильрот 2.
Сравнение операций: преимущества и недостатки
Резекция по Бильрот 1 — абдоминальная операция с минимальным, насколько это возможно в данной ситуации, изменением физиологии и анатомии верхних отделов желудочно-кишечного тракта. Если говорить простыми словами, это лучшая из рассмотренных методик. Ее преимущества:
- Сохраняется естественный пассаж пищевого комка через 12-перстную кишку.
- Анастомоз конец в конец позволяет в максимальном объеме сохранить резервуарную функцию культи желудка .
- Нет прямого контакта желудочного сока с эпителием тощей кишки , что минимизирует риск развития пептической язвы анастомоза.
- Значительно ниже риск развития демпинг-синдрома. Риск развития тяжелой формы демпинг-синдрома, фактически, отсутствует.
- Нет риска развития синдрома приводящей петли .
В случае с резекцией желудка по Бильрот 2 по всем рассмотренным выше пяти пунктам видим обратную картину. Недостатки данного хирургического пособия:
- Пищевой комок поступает сразу в тощую кишку, что не физиологично.
- Резервуарная функция культи желудка снижена, пища быстрее попадает в кишечник.
- Желудочное содержимое контактирует со слизистой тощей кишки , что повышает риск развития пептической язвы соустья.
- Высок риск демпинг-синдрома (развивается у 20-50 % пациентов), в том числе в тяжелой форме.
- Высок риск синдрома приводящей петли .
Техника Бильрот-2 несовершенна. Она используется, когда создать гастродуоденоанастомоз по Бильрот 1 невозможно из-за риска чрезмерного натяжения 12- перстной кишки (чревато несостоятельностью мышечных швов ). Если есть возможность использовать модифицированную технику Гофмейстера-Финстерера или операцию по Ру, выбирается одно из этих хирургических пособий. Если это невозможно, выполняется операция по Бильрот 2.
Осложнения после Бильрот 2
Демпинг-синдром. Одним из наиболее распространенных осложнений резекции желудка по Бильрот 2 является демпинг-синдрома. По статистике встречается у 20-50 % пациентов, перенесших операцию.
Развивается демпинг-синдром из-за слишком быстрого поступления пищевого комка в тощую кишку. Не переваренная пища обладает неблагоприятными для кишечника механическими, осмотическими и химическими свойствами. Раздражение слизистой оболочки тощей кишки сопровождается резким усилением кровообращения в сосудах кишечника, что в свою очередь приводит к гиповолемии (снижение объема циркулирующей крови) и ухудшению кровообращения в ЦНС.
Проявляется демпинг-синдром приступами с ухудшением самочувствия, головокружением, одышкой, тахикардией и другими симптомами. Начинается приступ через 10-20 минут после еды. Провоцируют его, как правило, молочные продукты и простые углеводы. При тяжелой форме синдрома в роли провоцирующего фактора выступает любая пища.
Легкая и средняя форма демпинг-синдрома лечится консервативно, с помощью диеты и медикаментозной терапии, направленной на замедление эвакуации пищевого комка и ускорение переваривания пищевого комка в желудке.
При тяжелой форме проводится реконструктивная операция с созданием гастродуоденоанастомоза по Бильрот 1 или гастроеюноанастомоза по Ру. Операция также показана больным с демпинг-синдромом средней тяжести при неэффективности консервативного лечения.
Синдром приводящей петли . Причиной осложнения становится дуоденогастральный рефлюкс, то есть заброс содержимого культи двенадцатиперстной кишки через соустье в культю желудка. Во время приступа самочувствие пациента резко ухудшается, появляется отрыжка, изжога, сильная тошнота. На пике приступа возникает рвота, которая приносит мгновенное облегчение. Рвотные массы содержат большие количества желчи.
Синдром приводящей петли часто сопровождается дуоденостазом (застой содержимого в просвете культи двенадцатиперстной кишки ), нарушением функции печени, желтухой, воспалением поджелудочной железы. Пациенту следует незамедлительно обратиться к лечащему врачу при появлении первых признаков этого осложнения.
Лечение легкой и средней формы данного осложнения строится на консервативных методах. Хирургическое лечение с реконструкцией гастроеюнального анастомоза в энтероэнтероанастомоз по Брауну. Реконструктивная операция также показана при средней степени выраженности синдрома приводящей петли , если консервативное лечение неэффективно.
Пептическая язва анастомоза. Слизистая оболочка тощей кишки неустойчива к агрессивному желудочному соку. Непосредственный контакт содержимого желудка с кишечным эпителием, который имеет место после операции по Бильрот 2, приводит к развитию воспаления с появлением эрозий и язв в области анастомоза.
Данное осложнение лечится консервативно. Проводится медикаментозная терапия в сочетании с диетой, направленные на уменьшение кислотности желудочного сока. При неэффективности консервативной терапии ставится вопрос о хирургическом лечении с применением ваготомии или реконструктивной операции.
Атрофический гастрит. В развитии воспаления слизистой оболочки желудка присутствует несколько патогенетических факторов. Дистальная гастрэктомия проводится с удалением антрального отдела, в котором синтезируется гастрин, гормон, влияющий на желудочную секрецию.
У многих пациентов после резекции по Бильрот 2 в той или иной степени присутствует дуоденогастральный, билиарный и кишечный рефлюкс. Содержимое кишечника, которое в норме не попадает в желудок, провоцирует атрофические и воспалительные изменения в слизистой.
Проявляется атрофический гастрит тяжестью в эпигастрии, умеренно выраженной тошнотой, ухудшением аппетита, изжогой, отрыжкой. Пациенты постепенно теряют вес. Ухудшается общее самочувствие, из-за нарушения синтеза внутреннего фактора Кастла развивается анемия.
Лечение атрофического гастрита консервативное. Важно соблюдать лечебную диету с частым дробным питанием. Пациентам назначаются анаболические препараты, для профилактики анемии и астении — инъекции витаминов группы B. При сниженной кислотности показан прием желудочного сока, пищеварительных ферментов, при повышенной — блокаторы H2-рецепторов.
Больше информации об операциях абдоминальной и бариатрической хирургии вы можете получить на консультации врача клиники «Центр снижения веса». Филиалы медицинского центра расположены в Санкт-Петербурге и Сестрорецке.
Резекции желудка по Бильрот 1 и Бильрот 2. Операция гастрэктомия
Пациенты с раком имеют подавленную иммунную систему и более восприимчивы к инфекциям.
12 марта 2020 г. 8:26
Новое исследование раскрывает механизм формирования структуры ДНК
Исследователи представили структуру и механизм белков, которые экспрессируются при различных формах рака и связаны с плохим прогнозом пациента.
9 марта 2020 г. 12:07
Тетродотоксин, содержащийся в рыбе фугу, может использоваться для облегчения боли при раке
В низких дозах тетродотоксин заменяет опиоиды для облегчения боли, связанной с раком.
5 марта 2020 г. 14:24
Новая техника визуализации раскрывает 3D силы клеточных кластеров
Новый метод картирования сил, которые кластеры клеток оказывают на микроокружение, может помочь в изучении развития тканей и метастазирования рака.
Резекция желудка - это хирургический метод лечения заболеваний желудка и двенадцатиперстной кишки. Принцип резекции состоит в удалении части желудка с последующим восстановлением целостности пищеварительного тракта благодаря желудочно-кишечному анастомозу (соединению).
Способ резекции зависит от расположения патологического процесса, вида заболевания (рак желудка, язва), размеров иссекаемого участка органа.
Операцию выполняют двумя основными способами: Бильрот І и Бильрот ІІ.
Резекция желудка в клинике Ассута - это верный способ выбора варианта лечения.
Преимущества обращения в госпиталь очевидны:
- Высокий профессионализм медицинского состава - операцию проводят лучшие эксперты по заявленному профилю.
- Возможность выбрать лечащего врача - существенный бонус, практикуемый частным медицинским комплексом Assuta.
- Передовое оборудование, которое клиника закупает одной из первых в мире.
Позвоните нам, чтобы узнать подробности. Мы гарантируем официальное заключение договора, доступные цены на лечение.
Резекция желудка по Бильрот 1
Резекции желудка по Бильрот 1 - это циркулярное иссечение антрального и пилорического отделов желудка, наложение анастомоза между культей желудка и двенадцатиперстной кишкой по типу «конец в конец». В настоящее время хирурги Израиля применяют этот способ с модификацией Габерера II.
Преимущества резекции желудка по Бильрот 1:
- Не изменяется нормальная анатомия и функции пищеварительной системы, поскольку производится анастомоз культи желудка с двенадцатиперстной кишкой. Это благоприятствует перевариванию пищи, попадающей из желудка в кишку, смешиваясь с панкреатическим, дуоденальным и желчным секретами. При резекции по Бильрот 2 процесс смешивания происходит в тощей кишке. Но в связи с отсутствием привратника при резекции по Бильрот 1 переход пищи из желудка в двенадцатиперстную кишку, а затем в тощую осуществляется быстро. Поэтому смешивание фактически выполняется в тощей кишке. В таком случае различия носят скорее теоретический характер.
- Технически резекцию желудка по Бильрот 1 выполнять легче. Помимо этого, всё хирургическое вмешательство проводится в верхней части брюшной полости.
- Значительно реже развивается демпинг-синдром после этой операции.
- Данный вид хирургического вмешательства не увеличивает вероятность развития внутренних грыж или синдрома приводящей петли.
Недостатки резекции желудка по Бильрот 1:
- Этот вид операций чаще провоцирует появление язв анастомоза, язвы двенадцатиперстной кишки.
- Не во всех случаях удается в достаточной мере мобилизовать 12-перстную кишку для формирования анастомоза с желудком, чтобы не было натяжения линии шва. Это вызывает дуоденальные язвы, выраженную рубцовую деформацию и сужение просвета кишки, язвы проксимального отдела желудка. В некоторых ситуациях требуется также мобилизация селезенки и культи желудка, что ведет к усложнению хирургического вмешательства и неоправданному повышению ее риска.
- Резекция желудка по Бильрот 1 не проводится при диагнозе рак желудка.
Резекции желудка по Бильрот
Резекции желудка по Бильрот 2 отличается тем, что культю органа зашивают с наложением заднего или переднего гастроэнтероанастомоза. Бильрот 2 также имеет много модификаций по методикам подшивания тощей кишки к культе желудка, закрытия культи желудка и т.д.
Существует больше показаний для резекции по Бильрот 2: язвы желудка проксимальной, дистальной и средней трети, пептические язвы.
Преимущества резекции желудка по Бильрот 2:
- Осуществляется обширная резекция органа без натяжения гастроеюнальных швов.
- При язве двенадцатиперстной кишки реже возникают после операции пептические язвы анастомоза.
- При дуоденальной язве с грубыми патологическими изменениями двенадцатиперстной кишки легче производится ушивание культи, чем анастомоз с желудком.
- При нерезектабельной дуоденальной язве после выполнения резекции «на выключение» по Finsterer-Bancroft-Plenk только с помощью резекции по Бильрот 2 удается восстановить проходимость пищеварительной системы.
Недостатки резекции желудка по Бильрот 2:
- Повышается риск развития демпинг-синдрома.
- Возможными, хотя и редкими осложнениями являются синдром приводящей петли и внутренняя грыжа.
Операция резекция желудка: показания, виды обследований, техники![резекция по бильрот 2]()
К резекции желудка существуют абсолютные показания:
- ;
- подозрение на малигнизацию язвы;
- стеноз привратника;
- повторные желудочно-кишечные кровотечения.
Относительные показания к резекции желудка — перфорация язвы, длительно незаживающий язвенный дефект.
Перед оперативным лечением в клинике Ассута проводится ряд обследований: эзофагогастродуоденоскопия с биопсией, рентгеноконтрастное исследование, УЗИ, компьютерная томография, анализы крови на онкомаркеры, МРТ, сцинтиграфия.
Для профилактики метастазирования и стабилизации опухолевого роста применяется предоперационная химиотерапия и лучевая терапия.
Техника резекции желудка при раке желудка и язвенной болезни имеет свои отличия. Если диагноз - язвенная болезнь, то удаляются 2/3 — 3/4 тела желудка с пилорическим отделом. При раке желудка проводится более обширная операция, с удалением большого и малого сальника, регионарных лимфатических узлов.
Во время оперативного вмешательства производится срочная биопсия, по результатам гистологического исследования хирурги могут принять решение о расширенной операции.
При расположении опухоли в кардиальном отделе желудка с распространением злокачественного процесса на пищевод, хирурги клиники Ассута выполняют проксимальную резекцию желудка. Резецируется кардиальный отдел органа с частью пищевода. Целостность пищеварительной трубки восстанавливается путём сшивания культи пищевода с культей желудка.
Операция длится 120-240 минут. Обезболивание - общая анестезия. Госпитализация - 10 - 14 суток.
Следующими этапами комплексного лечения в Израиле будут лучевая терапия и химиотерапия.
При запущенных стадиях рака желудка резекция не проводится. Назначается паллиативное лечение - химиотерапия, радиотерапия, иммунотерапия.
Операция гастрэктомия в клинике Ассута
Данное хирургическое вмешательство является самым распространенным и эффективным методом лечения злокачественных опухолей желудка.
Тотальное удаление органа выполняется при опухоли желудка больших размеров, при локализации злокачественного процесса в средней трети органа, при распространённом процессе, при рецидиве рака. К более редким показаниям относят желудочные кровотечения, язвенную болезнь, опухоли доброкачественного характера и ряд других заболеваний.
Операция гастрэктомия: почему медицина Израиля
Гастрэктомия является тяжелой и серьезной операцией с рядом рисков. По статистике, в раннем послеоперационном периоде смертность среди пациентов составляет десять процентов. Применение современных технологий и проведение операций опытными высококвалифированными хирургами улучшают прогноз. Клиника Ассута может предложить:
- услуги специалистов высочайшего уровня со знанием современных методик выполнения гастрэктомии;
- новейшее диагностическое и лечебное оборудование;
- технологии, минимально травмирующие организм, что сокращает период выздоровления.
Операция гастрэктомия подразделяется на 3 типа:
- Дистальная субтотальная гастрэктомия, при которой удаляют часть желудка прилежащего к кишечнику, и, возможно, сегмент двенадцатиперстной кишки.
- Проксимальная субтотальная гастрэктомия предполагает удаление малой кривизны желудка, малого и большого сальника, желудочно-поджелудочной связки с группой регионарных лимфоузлов.
- Тотальная гастрэктомия представляет собой операцию, в ходе которой полностью удаляется желудок. Пищевод сшивают с тонким кишечником.
Подготовка к операции гастрэктомии
Диагностический спектр может включать следующие процедуры:
- Лабораторные исследования (анализы крови, кала на скрытую кровь).
- Эндоскопическая диагностика посредством гибкого зонда.
- Компьютерная томография или ПЭТ-КТ.
- Рентгенологическое обследование желудочно-кишечного тракта с применением бариевой взвеси.
В процесс подготовки входят рекомендации по специальной диете, по приему лекарственных препаратов.
Противопоказания к гастрэктомии: отдалённые метастазы рака, тяжёлое состояние пациента, связанное с сердечной, почечной или дыхательной недостаточностью, нарушение свёртывания крови.
Гастрэктомия: ход операции![гастрэктомия ход операции]()
Во время данного хирургического вмешательства пациент находится под действием общей анестезии. Операция проводится абдоминальным или комбинированным доступом.
При распространении рака желудка на пищевод хирурги клиники Ассута применяют комбинированный доступ: левосторонняя боковая торакотомия в сочетании с лапаротомией.
При инфильтративном росте опухоли, недифференцированных опухолях, тотальном поражении желудка, раке с регионарным метастазированием используется лапаротомия - абдоминальный доступ.
Гастрэктомия выполняется с соблюдением правил абластики. На начальном этапе производится ревизия органов брюшной полости. При расположении злокачественной опухоли в верхнем и среднем отделах желудка с инвазией на пищевод, вскрывается левая плевральная полость и пересекается диафрагма. Удаление желудка выполняется единым блоком малым и большим сальниками, жировой клетчаткой, связочным аппаратом, регионарными лимфоузлами, частью пищевода. После отсечения двенадцатиперстной кишки проводится анастомоз между культей пищевода и тощей кишкой.
Также применяется лапароскопический подход при проведении гастрэктомии. Он значительно меньше травмирует организм пациента. К недостаткам можно отнести сложность при удалении лимфатических узлов около сосудов и жизненно важных органов.
Эндоскопическая гастрэктомия с помощью системы робота да Винчи обеспечивает высокую точность, позволяя оперировать в труднодоступных участках.
Послеоперационный период
Среди возможных осложнений отмечают:
- тромбоз;
- кровотечения;
- инфекции;
- сохранение очагов злокачественного образования;
- повреждения соседних сосудов;
- дефицит питательных веществ;
- неспособность принимать нормальное количество пищи;
- малокровие;
- демпинг - синдром (состояние, при котором прием пищи может вызывать рвоту, тошноту, диарею и потливость).
После операции гастрэктомия пациент может нуждаться в следующем уходе и медицинской поддержке:
- При неспособности принимать адекватное количество жидкости введение производится внутривенно.
- Назогастральную трубку вводят через нос в желудок (сохраненную его часть) с целью отвести выделяющиеся пищеварительные соки, пока не начнет нормально функционировать кишечник.
- Катетер для кормления вводят в тонкий кишечник до перехода на обычное питание.
- Возможна необходимость во внутривенном введении антибиотиков, в катетеризации мочевого пузыря, в применении кислородной маски.
Питание после операции гастрэктомии
В рацион питания необходимо будет внести следующие изменения:
- Сократить размер порций.
- Увеличить частоту приема пищи до 5-6 раз в день, тщательно пережевывая и принимая со слабыми растворами лимонной кислоты. Трех- и четырехразовое питание приводит к малокровию и нарушению функций кишечника.
- Воздерживаться от приема большого количества жирной пищи.
- Для обеспечения здорового питания понадобиться прием биологически активных добавок.
Пациентам, которые перенесли эктирпацию желудка (спустя 1-1,5 после операции) рекомендуют гипонатриевую (с малым количеством соли) диету, которая будет содержать большое количество белков, ограниченное - жиров и очень малое количество легко усваиваемых углеводов. Следует лимитировать механические и химические раздражители слизистой оболочки желудочно-кишечного тракта: пряности, маринады, шоколад, соления, алкоголь, консервы, газированные, горячие и холодные напитки. В основном рацион должен состоять из вареной пищи или приготовленной на пару.
Рекомендуем к прочтению
Клиника Ассута в Израиле
Преимущества, особенности и ведущие направления крупнейшего частного медицинского центра в Израиле - Ассуты.
Лапароскопическое шунтирование желудка в клинике Ассута - суть оперативного вмешательства и показания, подходы к операции и ее преимущества.
Отделение общей хирургии
Одно из лучших в мире хирургических отделений находится в клинике Ассута. Новейшее оборудование, квалифицированность врачей дает возможность вылечить множество заболеваний.
Онкологическая хирургия в Ассуте. Сколько стоит онкологическая операция?
Онкохирургия в Израиле - характеристика основных видов оперативных вмешательств, подходов, техник, стоимость. Подготовка, ход и восстановление после онкологической операции в Ассуте.
Лечение рака пищевода в Израиле
Лечение рака пищевода в Израиле - характеристика основных способов терапии. Оперативные вмешательства, химиотерапия, внешняя лучевая терапия и брахитерапия, таргентная терапия (герцептин).
Читайте также:
- Ведение родов при первичной слабости родовых сил. Акушерский наркоз. Электроаналгезия.
- Вирулентность. Что такое вирулентность? Критерии вирулентности. Летальная доза ( DL, LD ). Инфицирующая доза ( ID ).
- Методика проведения ЭКГ с физической нагрузкой
- Центральный прозопарез. Изолированное ядерное поражение лицевого нерва
- Прогноз при хроническом гайморите и заболевании легких.