Антитела против IgE. Иммунологические механизмы при астме
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Е.Г. Асирян
Витебский государственный ордена Дружбы народов медицинский университет, Витебск, Республика Беларусь
Актуальность. В настоящее время для подтверждения наличия аллергии используется ряд лабораторных методов, однако сохраняются трудности в подтверждении диагноза аллергической бронхиальной астмы (АБА).
Цель исследования: определение иммунологических критериев АБА.
Материал и методы. Обследованы 160 детей в возрасте от 6 до 18 лет, в т.ч. 130 пациентов с АБА и 30 детей контрольной группы. Определяли относительный и абсолютный уровни CD19+, CD19+CD23++ В-лимфоцитов, CD23+IgE+-эозинофилов.
Результаты. Уровень В-лимфоцитов, несущих CD19+CD23++-рецептор, служит высокоинформативным диагностическим критерием для пациентов с АБА. При абсолютных значениях уровня В-лимфоцитов, несущих CD19+CD23++-рецептор, 23,23 кл/мкл, и относительном уровне ≥5,40% можно с высокой степенью достоверности говорить о наличии у пациента АБА. Для подтверждения диагноза АБА следует определять уровень эозинофилов, несущих CD23+IgE+-рецептор. При абсолютном значении уровня этих клеток ≥73,01 кл/мкл и относительном уровне ≥35,10% можно с высокой степенью достоверности говорить о наличии у пациента АБА.
Заключение. Для подтверждения диагноза АБА следует определять уровни CD19+CD23++ В-лимфоцитов и CD23+IgE+-эозинофилов.
Введение
Диагноз бронхиальной астмы (БА) устанавливается на основании данных анамнеза жизни и заболевания пациента, анализа клинической картины. Для подтверждения наличия заболевания также проводится ряд лабораторных и инструментальных исследований [1, 2].
Существует ряд лабораторных методов для подтверждения наличия аллергии, у каждого из которых есть свои преимущества и недостатки [2, 3].
В настоящее время для диагностики аллергических заболеваний, в т.ч. и БА, широко используется определение общего IgE методом иммуноферментного анализа [4]. Недостатком данного метода является невысокая диагностическая специфичность, т.к. 30% пациентов с атопическими заболеваниями имеют уровень общего IgE в пределах нормы. Следует помнить, что повышение IgE ассоциируется не только с аллергическими заболеваниями, но и с паразитарными инвазиями [5].
Определение уровня эозинофилов не специфично для БА, т.к. рост этого показателя наблюдается при всех аллергических заболеваниях и паразитарных инвазиях. При проведении ROC-анализа характеристическая кривая располагается ближе к диагонали, которая соединяет левый нижний и правый верхний углы. При этом значение AUC для уровня эозинофилов равно 0,61, для общего IgE - 0,67. Эти показатели говорят о невысокой информативности указанных в диагностике именно БА, а не атопического статуса в целом [5, 6].
При проведении аллергологического обследования для диагностики БА также применяется метод постановки кожных скарификационных проб [7, 8]. При получении положительного результата мы подтверждаем наличие сенсибилизации к тому или иному аллергену, но не можем подтвердить диагноз БА. Следует помнить, что при проведении указанных проб существует вероятность получения как ложноотрицательных, так и ложноположительных результатов. В детском возрасте отмечается низкая чувствительность кожных покровов, что обусловливает невысокую информативность кожных тестов [9, 10].
Один из лабораторных методов, наиболее широко используемых для диагностики аллергии, - это определение аллергенспецифических IgE к аллергенам [11]. Однако обнаружение IgE-антител к определенному аллергену не говорит об ответственности именно этого аллергена за клиническую симптоматику заболевания. Для выставления окончательного диагноза необходимо сопоставить клиническую картину с результатами лабораторных и инструментальных исследований. Даже в том случае, когда в сыворотке крови отсутствуют IgE-антитела к исследуемым аллергенам, нельзя полностью исключать IgE-зависимый механизм заболевания. Местный синтез IgE и сенсибилизация тучных клеток возможны и в отсутствие специфического IgE в сыворотке крови [12].
Цель исследования: определение иммунологических критериев АБА.
Методы
В ходе проведенной работы были обследованы 130 детей в возрасте от 6 до 18 лет, находившихся на лечении в аллергологическом отделении УЗ ВОДКЦ. Все дети наблюдались по поводу аллергической БА. Диагноз заболевания устанавливался и подтверждался в стационаре на основании международных рекомендаций, был обоснован данными анамнеза и клиническими проявлениями заболевания. Определяли относительный и абсолютный уровни CD19+, CD19+CD23++ В-лимфоцитов, CD23+IgE+-эозинофилов.
Контрольную группу составили 30 детей обоих полов в возрасте 6-18 лет, поступивших в травматологическое отделение УЗ ВОДКЦ по поводу плановых оперативных вмешательств.
Фенотипирование клеток проводили на проточном цитометре Cytomics FC 500 (Beckman Coulter Inc., США) с использованием моноклональных антител производства ОДО «НИКП РЕСАН», Беларусь. Для лизиса эритроцитов использовали лизирующий раствор OptiLyse С.
Статистическую обработку данных проводили с использованием стандартного пакета прикладных программ «Statistica 6.0». Для принятия решения о виде распределения количественного признака использовали критерий Шапиро-Уилка. Для описания признака, распределение которого отличается от нормального, использовали медиану и интерквартильный интервал. Использовались непараметрические методы статистического исследования: критерий Манна-Уитни (для анализа различий в двух независимых группах по количественному признаку). Различия считали достоверными при р
Оценку информационной значимости пороговых величин изучаемых показателей иммунного статуса у детей с БА с целью выявления диагностических критериев заболевания определяли при помощи ROC-анализа (Receiver Operator Characteristic) с построением характеристических кривых зависимости чувствительности значений величины от вероятности ложноположительных результатов и с измерением площади под кривыми (Area Under Curve - AUC). Качество модели считали отличным при AUC=0,9-1,0; очень хорошим при AUC=0,8-0,9; хорошим при AUC=0,7-0,8; средним при AUC=0,6-0,7; неудовлетворительным при AUC=0,5-0,6 [13].
Результаты
Уровень лейкоцитов, а также относительное и абсолютное количество лимфоцитов у детей с БА не имели статистически значимых отличий от показателей пациентов контрольной группы (р>0,05). Относительный уровень CD19+ В-лимфоцитов в группе детей, страдающих БА, составил 14,20% [12,70; 16,40], тогда как в контрольной группе этот показатель находился на уровне 13,20% [12,20; 14,60], при этом в обеих группах результаты находились в пределах референтных значений (9-16%) и статистически значимо не отличались друг от друга (р>0,05). Абсолютный уровень CD19+ В-лимфоцитов у детей с БА также не имел достоверных отличий от контрольной группы (р>0,05). Количество СD19+CD23++ В-лимфоцитов, т.е. В-лимфоцитов с высокой плотностью распределения рецептора CD23 на мембране клеток, в группе детей с БА составило 31,90% [11,60; 51,90], что достоверно выше их количества у детей контрольной группы, где этот показатель был равен 3,45% [2,30; 4,20] (р <0,001). Абсолютный уровень СD19+CD23++ В-лимфоцитов у детей с БА значительно превышал уровень у детей контрольной группы, при этом показатели статистически значимо отличались друг от друга (р<0,001; табл. 1).
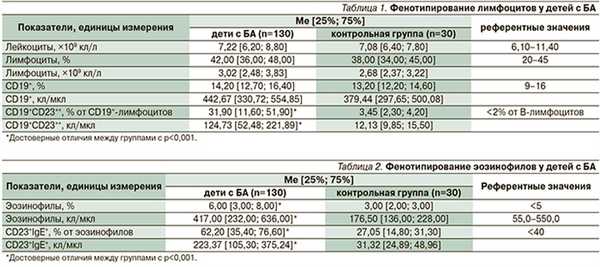
В развитии воспалительного процесса при БА принимают участие различные клетки, однако эозинофилы - одни из основных его участников, выполняющие важную роль в патогенезе аллергических заболеваний. Относительный уровень эозинофилов у детей с БА составил 6,00% [3,00; 8,00], абсолютный показатель - 417,00 кл/мкл [232,00; 636,00]. Полученные результаты были достоверно выше таковых детей контрольной группы, где относительный уровень был равен 3,00% [2,00; 3,00], а абсолютное значение - 176,50 кл/мкл [136,00; 228,00] (р<0,001). Относительный уровень эозинофилов, несущих на своей поверхности CD23+IgE+-рецептор, составил 62,20% [35,40; 76,60], абсолютный показатель был равен 223,37 кл/мкл [105,30; 375,24]. Полученные результаты достоверно выше показателей детей контрольной группы, где относительный уровень был равен 27,05% [14,80; 31,30] (р<0,001), абсолютный - 31,32 кл/мкл [24,89; 48,96] (р<0,001; табл. 2).
В ходе работы изучаемые показатели иммунного статуса детей с БА проанализировали на возможность их использования для диагностики этого заболевания либо его подтверждения, уточнения формы. По результатам ROC-анализа получили характеристическую кривую зависимости уровня В-лимфоцитов, несущих CD19+CD23++-рецептор, от наличия БА. В качестве положительного результата в проведенном исследовании рассматривали наличие заболевания. Оптимальной «точкой разделения» для В-лимфоцитов, несущих CD19+CD23++-рецептор, является величина 23,23 кл/мкл. В этой точке чувствительность равна 86,20%, специфичность - 95%. AUC составляет 0,93, что свидетельствует о высокой диагностической эффективности сформированной модели. При значениях В-лимфоцитов, несущих CD19+CD23++-рецептор, ≥23,23 кл/мкл мы можем с высокой степенью достоверности говорить о наличии у пациента аллергической БА. На рис. 1 приведена ROC-кривая по данным абсолютного уровня В-лимфоцитов, несущих CD19+CD23++-рецептор.
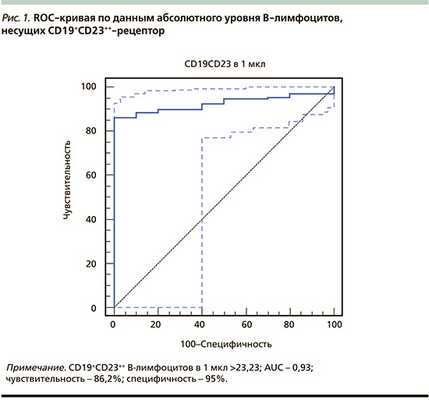
Оптимальной «точкой разделения» для относительного уровня В-лимфоцитов, несущих CD19+CD23++-рецептор, является величина 5,40%. В этой точке чувствительность равна 86,92%, специфичность - 94%. AUC составляет 0,91, что свидетельствует о высокой диагностической эффективности сформированной модели. При значениях В-лимфоцитов, несущих CD19+CD23++-рецептор, ≥5,40% от уровня В-лимфоцитов мы можем с высокой степенью достоверности говорить о наличии у пациента аллергической БА. На рис. 2 представлена ROC-кривая по данным относительного (%) уровня В-лимфоцитов, несущих CD19+CD23++-рецептор.
По результатам ROC-анализа мы получали характеристическую кривую зависимости уровня эозинофилов, несущих CD23+IgE+-рецептор, от наличия БА. Выбор оптимальной «точки разделения» - значение уровня исследуемых показателей, обеспечивающее максимальные значения чувствительности и специфичности, проводили по точке перегиба кривой (максимально удаленная точка от линии равновероятного прогноза, для которого показатели чувствительности и специфичности равны 50%). Оптимальной «точкой разделения» для эозинофилов, несущих CD23+IgE+-рецептор, является величина 73,01 кл/мкл.
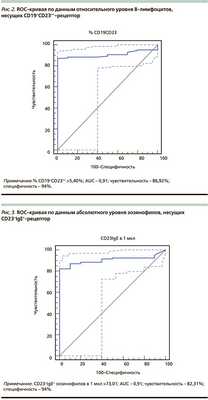
В этой точке чувствительность равна 82,31%, специфичность составила 94%. AUC составляет 0,91, что свидетельствует о высокой диагностической эффективности сформированной модели. При значениях эозинофилов, несущих CD23+IgE+-рецептор, ≥73,01 кл/мкл можно с высокой степенью достоверности говорить о наличии у пациента аллергической БА. На рис. 3 приведена ROC-кривая по данным абсолютного уровня эозинофилов, несущих CD23+IgE+-рецептор [14].
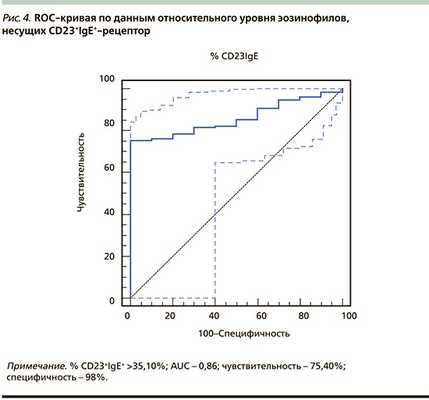
Оптимальной «точкой разделения» для относительного уровня эозинофилов, несущих CD23+IgE+-рецептор, является величина 35,10%. В этой точке чувствительность равна 75,40%, специфичность - 98%. AUC составляет 0,86, что свидетельствует о высокой диагностической эффективности сформированной модели. При значениях эозинофилов, несущих CD23+IgE+-рецептор, ≥35,10% можно с высокой степенью достоверности говорить о наличии у пациента аллергической БА. На рис. 4 представлена ROC-кривая по данным относительного (%) уровня эозинофилов, несущих CD23+IgE+-рецептор [14].
В настоящее время нет идеального единого теста для постановки диагноза БА. При совпадении клинико-анамнестических данных с результатами дополнительных методов обследования диагноз обоснован, что позволяет в ряде случаев выявлять этиологический фактор, а также устанавливать отдельные звенья патогенеза заболевания. Поскольку дисфункция иммунной системы служит основой развития БА, определение иммунологических критериев заболевания обоснованно и необходимо.
При изучении патогенеза аллергической БА, роли отдельных клеток в развитии заболевания установлено, что количество СD19+CD23++ В-лимфоцитов и CD23+IgE+ эозинофилов при этом заболевании статистически значимо выше по сравнению со здоровыми пациентами. В результате проведенного исследования полученные данные демонстрируют: показатели иммунного статуса, предлагаемые для диагностики заболевания, имеют высокую специфичность и чувствительность. Использование высокоинформативных показателей для подтверждения диагноза актуально не только в спорных вопросах диагностики, но и для выбора адекватной терапии заболевания, разработки методов профилактики и для реабилитации пациентов с этой патологией.
Выводы
- Уровень В-лимфоцитов, несущих CD19+CD23++-рецептор, служит высокоинформативным диагностическим критерием для постановки диагноза аллергической БА. При абсолютных значениях В-лимфоцитов, несущих CD19+CD23++-рецептор, 23,23 кл/мкл и относительном уровне ≥5,40% можно с высокой степенью достоверности говорить о наличии у пациента аллергической БА.
- Диагностическую ценность в характеристиках эозинофилов представляет определение уровня эозинофилов, несущих CD23+IgE+-рецептор. При абсолютном значении этих клеток, равном ≥73,01 кл/мкл, и относительном значении ≥35,10% можно с высокой степенью достоверности говорить о наличии у пациента эозинофильного фенотипа аллергической БА.
Литература
1. Новикова В.И., Новиков П.Д., Титова Н.Д. Гетерогенность аллергии при бронхиальной астме у детей. Вестник ВГМУ. 2014;13(4):110-16.
2. Global Initiative for asthma - NHLBI/WHO Workshop Report. National Heart Lung Blood Institute, updated 2016.
3. Чучалин А.Г. Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика». 5-е изд., перераб. и доп. М., 2017. 160 с.
4. Sánchez-García S., Habernau Mena А., Quirce S.Biomarkers in inflammometry pediatric asthma: utility in daily clinical practice. Eur Clin Respir J. 2017;4(1):43-8. Doi: 10.1080/20018525.2017.1356160.
5. Дранник Г.Н. Клиническая иммунология и аллергология. М.: Медицинское информационное агентство, 2013. 646 с.
6. Громов И.А., Намазова Л.С., Семикина Е.Л., Вознесенская Н.И. Способ диагностики атопической формы бронхиальной астмы у детей. Пат. РФ № 2339951. Опубл. 27.11.2008.
7. Сыров В.В. Реальные возможности современной диагностики аллергии (на правах обзора). Аллергология и иммунология в педиатрии. 2015;4(43):17-29.
8. Cardona V., Demoly P., Dreborg S., et al. Current practice of allergy diagnosis and the potential impact of regulation in Europe. Allergy. 2018;73(2):323-27. Doi: 10.1111/all.13306.
9. Новиков Д.К., Новиков П.Д. Клиническая иммунопатология: руководство. М.: Медицинская литература, 2009. 464 с.
10. Schou Nielsen J., Meteran H., Ulrik C.S., et al. Natural history of skin prick test reactivity: A 20-year prospective study of a random population sample of children and adolescents. Ann Allergy Asthma Immunol. 2017;119(2):184-88. Doi: 10.1016/j.anai.2017.05.001.
12. Чучалин А.Г. Бронхиальная астма: новые перспективы в терапии. Терапевтический архив. 2012;84(3):5-11.
13. Жильцов И.В., Семенов В.М., Зенькова С.К. Основы медицинской статистики. Дизайн биомедицинских исследований: практическое руководство. Витебск: ВГМУ, 2014. 154 с.
14. Асирян Е.Г., Новиков П.Д. Способ диагностики атопической бронхиальной астмы у детей: пат. № 22597 Респ. Беларусь: МПК G 01N 33/53; заявитель Витеб. гос. мед. ун-т. № а20170035; заявл. 10.04.2017.
Об авторах / Для корреспонденции
Современные иммунобиологические препараты в лечении бронхиальной астмы: эффективность анти-IgE-терапии с помощью моноклональных антител (омализумаб) в лечении атопической бронхиальной астмы
Бронхиальная астма — хроническое воспалительное заболевание дыхательных путей, сопровождающееся их гиперреактивностью, которое проявляется повторными эпизодами одышки, затруднения дыхания, чувства сдавления в груди и кашля, возникающими преимущественно ночью или ранним утром.
Бронхиальная астма является серьезной проблемой глобального здравоохранения. От этого хронического расстройства дыхательной системы страдают 5-10 % людей всех возрастов. По данным ВОЗ, в мире насчитывается почти 235 миллионов человек с диагнозом бронхиальная астма, а согласно подсчетам «Глобальных отчетов об астме» (за 2014 год) — 334 миллиона.
Цель. Анализ и оценка эффективности препаратов моноклональных антител в терапии атопической бронхиальной астмы.
Материалы иметоды. Были использованы данные клинических исследований, материалы отечественных и зарубежных статей.
Результаты иобсуждения. Астматические дыхательные пути вызывают дисрегуляцию иммунных реакций как патологический ответ на безвредный в других отношениях аллерген. Нарушения регуляции иммунной системы, наблюдаемые при астме, опосредованы обеими клетками врожденной и адаптивной иммунной системы. На первом этапе дендритные клетки, расположенные ниже эпителия дыхательных путей, при контакте с аллергенами из просвета дыхательных путей, перерабатывают их в более мелкие пептиды, которые затем представляются наивным Т-клеткам в региональных лимфатических узлах. Здесь, в присутствии интерлейкина-4 (IL-4), антигены активируют Т-хелперные клетки и индуцируют их дифференцировку в Т-хелперные клетки типа 2 (Th2), которые мигрируют в слизистую оболочку дыхательных путей, где высвобождают большое количество классических цитокинов, таких как IL-4, IL-9 и IL-13, IL-3, IL-5 и гранулоцитарный макрофагальный колониестимулирующий фактор (GM-CSF). Эти медиаторы оказывают последующее воздействие на другие иммунные клетки, например, IL-3 дифференцирует тучные клетки слизистой оболочки, которые присутствуют в эпителии бронхов или под ним в месте воспаления, в то время как GM-CSF совместно с IL-3 и IL-5 благоприятствует пополнению, созреванию и выживанию эозинофилов, которые являются преобладающим типом клеток вокруг бронхиальной астмы. Затем эозинофилы высвобождают катионные белки, ответственные за цитотоксическое действие на эпителиальные клетки, наблюдаемые при астме. В В-клетках рекомбинация иммуноглобулинов с переключением на продукции классов IgE. Антитела IgE связываются с высокоаффинным рецептором IgE, экспрессируемым на тучных клетках. После повторного заражения аллергеном, IgE перекрестно связывает IgE-рецептор с высокой аффинностью, связанный с клеточной поверхностью тучных клеток, и активирует последующее высвобождение предварительно образованных бронхоспазматических провоспалительных медиаторов, таких как гистамин, лейкотриены, цитокины или хемокины
В настоящее время терапия астмы включает применение следующих лекарственных препаратов:
- для подавления аллергического воспаления — глюкокортикоиды, антилейкотриеновые препараты и стабилизаторы мембран тучных клеток;
- для предупреждения и снятия бронхоспазма — B2-адреномиметики, М-холиноблокаторы и спазмолитики миотропного действия (метилксантины).
Несмотря на значительные успехи в лечении бронхиальной астмы, достигнутые благодаря использованию ингаляционных глюкокортикостероидов (ИГКС) и комбинаций ИГКС с длительно действующими B2-агонистами (ДДБА), эпидемиологические и клинические исследования показывают, что контроль болезни остается неудовлетворительным.
Последние терапевтические стратегии были сосредоточены на нейтрализации отдельных эффекторных молекул, таких как IgE (омализумаб) и IL-9 (MEDI-528), или на блокаде рецепторов, например, мутированной формой IL-4 (питракинра), которая связывается с IL-4Rα цепь и блокирует связывание IL-4 и IL-13.
Омализумаб является в настоящее время единственным иммунобиологическим препаратом, рекомендованным для лечения среднетяжелой и тяжелой атопической бронхиальной астмы у взрослых и детей старше 12 лет, симптомы которой не удается адекватно контролировать ингаляционными глюкокортикостероидами.
Омализумаб представляет собой препарат рекомбинантных гуманизированных моноклональных антител к Fc-фрагменту IgE, который предотвращает связывание IgE с его высокоаффинным рецептором на тучных клетках и базофилах. Таким образом, омализумаб не взаимодействует с уже фиксированными на мембранах тучных клеток иммуноглобулинами (в противном случае это могло бы вызвать развитие анафилактической реакции). Уменьшение количества связанных IgE на мембранах эффекторных клеток снижает высвобождение медиаторов при контакте с аллергеном. Кроме того, омализумаб уменьшает экспрессию FcêR1 на базофилах и тучных клетках, снижая их способность связывать IgE.
Взаимодействие омализумаба со свободно циркулирующими IgE приводит к снижению их уровня в крови на 99 %. Через 3 мес. от начала лечения у пациентов высвобождение гистамина базофилами снижается на 90 %, доказано снижение экспрессии рецепторов FcR1 на мембранах базофилов, моноцитов и дендритных клеток уже на 7-й день лечения. Анти-IgE-терапия влияет как на раннюю, так и на позднюю фазу аллерген индуцированного иммунного ответа.
Проведено большое количество контролируемых рандомизированных исследований, показавших эффективность омализумаба у больных атопической бронхиальной астмой. Основными показателями эффективности анти-IgE-терапии практически во всех исследованиях были снижение частоты обострений бронхиальной астмы, снижение потребности в экстренной медицинской помощи и госпитализациях, уменьшение дозы системных и ингаляционных глюкокортикостероидов, улучшение качества жизни пациентов. Существенно, что все многочисленные исследования солидарны в своих позитивных оценках этого нового вида базисной терапии бронхиальной астмы. Три больших рандомизированных плацебоконтролируемых исследования, включавшие в общей сложности 1318 пациентов, показали значительное снижение частоты обострений бронхиальной астмы, потребности в госпитализациях и использовании ИГКС у больных на фоне лечения омализумабом. В последующем метаанализе было выявлено особое преимущество анти-IgE-терапии для пациентов с высоким риском фатальной астмы. Согласно данным, ежегодное количество обострений у больных снижалось на 38 % (р
Похожие статьи
Особенности терапии бронхиальной астмы в сочетании.
Бронхиальная астма (БА) — наиболее распространенное хроническое заболевание нижних дыхательных путей неинфекционного
Недостаточно изученными остаются и вопросы индивидуализации терапии БА в сочетании с АР с учетом фармакоэкономических аспектов.
Комплаенс и контроль бронхиальной астмы | Статья в журнале.
31. Оптимизация лечебно-профилактической помощи больным бронхиальной астмой, проживающим
37. Пути оптимизации контроля над бронхиальной астмой в общей врачебной практике
41. Терапия бронхиальной астмы в сочетании с аллергическим ринитом в общей.
Лечим аллергические заболевания: реальные методы терапии.
Аллергенспецифическую иммунотерапию проводят на фоне базисной терапии
Что бы предупредить быстрое всасывание аллергена, больному рекомендуют избегать физических
Бронхиальная астма — хроническое заболевание, в основе которого лежит аллергическое.
Аллергический ринит и бронхиальная астма: частота.
Проводятся исследования по изучению сезонной изменчивости бронхиальных клеток, верхних нижних дыхательных путей и мокроты у больных АР
Изучаются вопросы развития аллергии и астмы у младенцев и маленьких детей до возраста 7 лет с атопическим дерматитом, причем.
Клинико-функциональные аспекты течения бронхиальной астмы.
Бронхиальная астма (БА) — хроническое персистирующее воспалительное заболевание дыхательных путей с участием клеток (тучных, эозинофилов, Т-лимфоцитов), медиаторов аллергии и воспаления, сопровождающееся гиперреактивностью и вариабельной обструкцией.
Клеточные и микробиологические показатели слизистой оболочки.
В динамике обследованы и изучены цитологический состав и микробиологические показатели слизистой оболочки верхних дыхательных путей (ВДП) в ходе лечения пациентов с реккурентными респираторными инфекциями (ПРРИ) и с бронхиальной астмой (БА).
Перспективы использования антиоксидантов в терапии.
Назначение данного препарата больным БА с гиперчувствительностью к пыльце деревьев
16. Оптимизация лечебно-профилактической помощи больным бронхиальной астмой
41. Пути оптимизации контроля над бронхиальной астмой в общей врачебной практике.
Трудно поддающаяся лечению бронхиальная астма.
В данной статье приведены результаты исследования клинико-функциональных особенностей и качества жизни у пациентов с трудно-поддающейся лечению бронхиальной астмой. Ключевые слова: трудно поддающаяся лечению бронхиальная астма.
Опыт использования будесонида у пациентов с бронхиальной.
Эффективность лечения бронхиальной астмы и ХОБЛ во многом зависит от того, насколько оптимально подобран ингалятор.
Результаты: в процессе лечения у всех больных отмечалась положительная динамика на фоне ежедневной ингаляции будесонида.
Моноклональные антитела против IgE (Ксолар) - новый препарат для достижения контроля бронхиальной астмы. Отбор пациентов и особенности лечения
Недавно в российской клинической практике стал доступен инновационный препарат для биологической терапии бронхиальной астмы (БА) омализумаб (Ксолар). Препарат представляет собой рекомбинантные гуманизированные моноклональные антитела против иммуноглобулина (Ig) E. Подкожное введение Ксолара снижает плазменные уровни IgE до неопределяемых величин и ингибирует ранний и поздний бронхоспастический ответ на аллергенную провокацию. У пациентов с хронической тяжелой IgE-опосредованной БА, нуждающихся в терапии высокими дозами ингаляционных или пероральных глюкокортикостероидов, лечение Ксоларом снижает частоту обострений БА, уменьшает степень тяжести заболевания и позволяет при стероидозависимой БА снизить поддерживающую дозу глюкокортикостероидов или полностью отменить их. Препарат характеризуется хорошим профилем безопасности. Внедрение Ксолара (омализумаба) в российскую клиническую практику позволит значительно повысить качество лечебной помощи больным с неконтролируемой атопической БА среднетяжелого и тяжелого течения.
- КЛЮЧЕВЫЕ СЛОВА: Ксолар, бронхиальная астма, омализумаб, bronchial asthma, monoclonal IgG1 antibodies, omalizumab, Xolair
Омализумаб (препарат Ксолар) относится к принципиально новому классу препаратов, используемых в лечении пациентов с неконтролируемой бронхиальной астмой (БА) аллергической природы. Препарат представляет собой рекомбинантные гуманизированные моноклональные антитела, относящиеся к группе иммуноглобулинов (Ig) G1, которые избирательно связываются с циркулирующим IgЕ - важнейшим медиатором аллергических реакций у пациентов с атопической (аллергической) формой БА. IgG1-каппа-антитело содержит человеческую структурную основу с определяющим комплементарность участком мышиного исходного антитела, который связывается с IgE. Омализумаб связывается с IgE и предупреждает его связывание с Fc-эпсилон-R1-рецептором, имеющим высокое сродство к IgE, снижая таким образом количество свободного IgE, способного запустить аллергический каскад.
В июне 2003 г. омализумаб был одобрен Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (US Food and Drug Administration, FDA) для лечения пациентов с аллергической астмой (IgE-опосредованной) среднетяжелого и тяжелого течения при невозможности достижения контроля ингаляционными глюкокортикостероидами (ИГКС) и комбинированными препаратами, содержащими ИГКС и ингаляционные длительно действующие бета-2-агонисты (ДДБА). Омализумаб является первым, наиболее изученным и до настоящего времени единственным препаратом этого класса в лечении пациентов с БА. Его применение разрешено у взрослых и детей с 6 лет во многих странах мира, в том числе и в России. В 2011 г. в России был расширен способ дозирования препарата: верхняя граница исходного уровня IgE у пациента была изменена со значения 700 МЕ/мл до 1300-1500 МЕ/мл. Теперь диапазон использования препарата (уровень IgE) варьирует от > 30 МЕ/мл до 1300-1500 МЕ/мл [1].
Внедрение Ксолара (омализумаба) в практику российского здравоохранения позволило назначать препарат в условиях реальной клинической практики. Применение инновационного препарата довольно остро ставит вопрос о показаниях к его назначению, прежде всего, при неконтролируемой БА. В последние два десятилетия в лечении БА наблюдается значительный прогресс, тем не менее достижение контроля заболевания остается актуальной проблемой. Внедрение современной высокоэффективной базисной терапии привело к существенному улучшению качества медицинской помощи. Однако, по данным целого ряда наблюдательных исследований, у подавляющего большинства пациентов симптомы тяжелой БА не контролируются. Так, в исследовании INSPIRE (International Asthma Patient Insight Research - Международное исследование отношения пациентов к бронхиальной астме), включившем 3415 пациентов с БА в 11 странах мира, как минимум треть пациентов с тяжелым течением БА не достигали контроля заболевания при использовании наиболее эффективного стандартного лечения комбинированными препаратами [2]. Несмотря на проводимое лечение, 74% пациентов вынуждены ежедневно использовать препараты скорой помощи (бета-2-агонисты короткого действия). Важно понимать, что неконтролируемое течение БА сопряжено с высоким риском обострения БА и даже летального исхода.
Под термином «тяжелая бронхиальная астма» понимают БА, которую не удается контролировать, несмотря на проводимую терапию высокими дозами лекарственных средств разных классов, в том числе комбинированными препаратами. Чтобы за этим формальным определением врачи могли узнать своих пациентов, напомним основные отличительные черты фенотипа больного тяжелой атопической БА.
Возможность достижения контроля тяжелой атопической БА очень часто осложняется не только течением самой БА, но и наличием ассоциированных с атопией сопутствующих заболеваний: аллергического ринита, синуситов, дерматита, каждое из которых приносит большие страдания пациентам.
Основными триггерами, не позволяющими достигать контроля заболевания, являются аллергены. Установлена прямая корреляционная связь между уровнем IgE и риском развития БА. В опубликованных данных клинических исследований ENFUMOSA (European Network For Understanding Mechanisms Of Severe Asthma - Европейская сеть по изучению механизмов тяжелой астмы) [3] и TENOR (Epidemiology and Natural History of Asthma: Outcomes and Treatment Regimens - Эпидемиология и течение бронхиальной астмы: исходы и схемы терапии) [4, 5] аллергия к различным аэроаллергенам была выявлена более чем у 50% и 90% пациентов с БА соответственно.
Было показано, что у пациентов, умерших от тяжелого астматического приступа, плотность рецепторов к IgE в подслизистом слое бронхов достоверно выше по сравнению с пациентами, умершими от других причин 8.
Омализумаб связывается с IgE и предотвращает его взаимодействие с высокоаффинным Fc-эпсилон-R1-рецептором, при этом происходит снижение количества свободного IgE, который является пусковым фактором для каскада аллергических реакций. Ксолар подавляет как раннюю, так и поздние фазы астматического ответа у пациентов. Общий уровень IgE (связанного и несвязанного) в сыворотке крови повышался после первой дозы препарата вследствие образования комплекса «омализумаб - IgE», характеризующегося более медленной скоростью выведения по сравнению со свободным IgE. На 16-й неделе после введения первой дозы омализумаба средний уровень общего IgE в сыворотке был в 5 раз выше по сравнению с таковым до лечения. После отмены Ксолара обусловленное его действием увеличение общего IgE и уменьшение свободного IgE были обратимыми. После полного выведения препарата из организма не наблюдалось увеличения концентрации IgE в сыворотке крови. При применении в рекомендуемых дозах среднее уменьшение свободного IgE в сыворотке составляло более 96%.
Кроме того, было обнаружено, что у пациентов с атопической астмой при лечении омализумабом снижается уровень циркулирующих эозинофилов и их количество в мокроте, полученной в результате стимуляции бронхов. Было также показано, что терапия Ксоларом снижает количество эозинофилов в мокроте и количество Fc-эпсилон-R1+-клеток в верхних дыхательных путях больных с аллергической астмой [10] и достоверно снижает число эозинофилов в подслизистом слое бронхов [11]. В исследовании O. Noga и соавт. наблюдалось более значительное увеличение апоптоза эозинофилов (относительно исходного показателя) к 12-й неделе терапии в группе, принимавшей омализумаб, по сравнению с группой плацебо [12]. В исследовании E.L. van Rensen и соавт. отмечено значительно более выраженное снижение количества эозинофилов (относительно исходного уровня) к 12-й неделе в группе, принимавшей омализумаб, по сравнению с группой плацебо [13].
Таким образом, Ксолар можно рассматривать как препарат, обладающим антиаллергическим и противовоспалительным действием.
Исследования последних лет изучают способность препарата влиять на процессы ремоделирования дыхательных путей [14, 15].
Клиническая эффективность препарата Ксолар изучена в исследовании INNOVATE (Investigation of Omalizumab in Severe Asthma Treatment - Исследование омализумаба в лечении тяжелой бронхиальной астмы). В ходе этого рандомизированного, плацебоконтролируемого, двойного слепого исследования, в котором принимали участие только больные с тяжелой персистирующей атопической БА, не контролируемой несмотря на медикаментозное лечение (IV ступень терапии согласно рекомендациям GINA (Global Initiative for Asthma - Глобальная инициатива по борьбе с бронхиальной астмой)), оценивали эффективность, безопасность и переносимость Ксолара в течение 28 недель лечения [16]. При анализе эффективности учитывались данные 419 пациентов с персистирующей атопической БА, не контролируемой несмотря на лечение высоким дозами глюкокортикостероидов и ДДБА в сочетании с другими препаратами для контроля БА (при необходимости). В дополнение к проводимому лечению пациенты получали либо Ксолар в виде подкожных инъекций, либо плацебо. Дозу Ксолара для каждого пациента определяли согласно таблице расчета доз на основании исходного уровня IgE и массы тела.
- Исследование INNOVATE продемонстрировало, что у пациентов с неконтролируемой тяжелой персистирующей атопической БА добавление Ксолара к лечению (IV ступень терапии согласно рекомендациям GINA) приводит к следующим результатам:
- сокращению числа клинически значимых обострений БА на 26%;
- сокращению числа тяжелых обострений на 50%;
- значительному (на 44%) снижению числа экстренных обращений за медицинской помощью (число госпитализаций, включая госпитализацию в реанимационные отделения, незапланированных визитов к врачу) по сравнению с плацебо.
Статья опубликована при финансовой поддержке ООО «Новартис Фарма» (Россия) в соответствии с внутренними политиками общества и действующим законодательством Российской Федерации. ООО «Новартис Фарма», его работники либо представители не принимали участия в написании настоящей статьи, не несут ответственности за содержание статьи, а также не несут ответственности за любые возможные относящиеся к данной статье договоренности либо финансовые соглашения с любыми третьими лицами. Мнение ООО «Новартис Фарма» может отличаться от мнения авторов статьи и редакции.
Омализумаб в терапии тяжелой бронхиальной астмы
В настоящее время применение анти-IgE-терапии (омализумаба) является единственным фенотипспецифическим лечением тяжелой IgE-обусловленной аллергической бронхиальной астмы (БА). В статье проанализированы механизм действия и результаты клинических исследований эффективности и безопасности омализумаба у больных БА. Рассмотрены показания к назначению препарата, его место в современной ступенчатой терапии БА и перспективы применения.
- КЛЮЧЕВЫЕ СЛОВА: Ксолар, иммуноглобулин E, омализумаб, severe bronchial asthma, phenotypes of severe asthma, immunoglobulin E, omalizumab
Рис. 1. Распространенность положительных кожных проб с аллергенами у больных тяжелой и легкой/среднетяжелой хорошо контролируемой БА, по результатам исследования ENFUMOSA
Таблица 4. Результаты систематического обзора восьми рандомизированных плацебоконтролируемых клинических исследований эффективности омализумаба в терапии БА (рандомизировано 3264 пациента, включено в анализ данных 1835 - омализумаб и 1429 - плацебо)
Рис. 5. Изменение пропорции больных БА, получавших терапию системными (пероральными) ГКС, на фоне лечения омализумабом в течение двух лет (n - общее число больных)
Рис. 6. Динамика снижения средней суточной дозы перорального ГКС (в мг по преднизолону) у пациентов с БА в результате терапии омализумабом на протяжении двух лет (n - число больных, получавших пероральные ГКС)
Распространенность бронхиальной астмы (БА) высока среди всех возрастных групп. По данным эпидемиологических исследований, заболевание встречается у 1-18% лиц в зависимости от региона мира [1].
Большинство пациентов, страдающих БА, хорошо отвечают на традиционную терапию и при соблюдении оптимальной приверженности и правильной техники ингаляции достигают и поддерживают контроль заболевания. Однако у 5-10% больных [2] отмечается тяжелая БА. Как правило, такие пациенты рефрактерны к традиционной терапии, у них высокая частота обострений, незапланированных визитов к врачу, число обращений за неотложной медицинской помощью и госпитализаций. Именно тяжелая, так называемая трудная, БА поглощает 50% всех экономических затрат, предназначенных для заболевания в целом.
Совсем недавно были опубликованы международные рекомендации, разработанные совместно экспертами ERS (European Respiratory Society - Европейское респираторное общество) и ATS (American Thoracic Society - Американское торакальное общество) и посвященные определению, диагностике и лечению тяжелой БА [3]. Эти рекомендации составлены экспертами с позиции GRADE (Grading of Recommendations Assessment, Development and Evaluation [4]) - качества доказательств и силы рекомендаций. Определение тяжелой БА, предлагаемое в указанных рекомендациях, представлено в табл. 1. Как видим, данное определение во многом основывается на предыдущих определениях ATS, ERS, Всемирной организации здравоохранения, но отличается, в частности, тем, что из него исключена «нелеченая тяжелая БА», а также конкретизированы и упрощены критерии отсутствия контроля.
Таким образом, тяжелой считается астма, контроль которой достигается только на максимально высоком уровне терапии, то есть на 4-й или 5-й ступени терапии БА по GINA (табл. 2), или не достигается, несмотря на максимально возможный уровень терапии. Эксперты подчеркивают, что важным условием верификации тяжелой БА является исключение альтернативных диагнозов, низкой приверженности назначенной терапии и неправильной техники ингаляции.
Тяжелая БА, как, впрочем, и любая БА, неоднородна. Среди пациентов с тяжелой БА можно выделить больных:
Общий и специфический IgE. Болезни и состояния, сопровождающиеся изменением содержания общего IgE Показания к назначению, правила подготовки к сдаче исследования, расшифровка результатов анализа и показатели нормы.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Иммуноглобулин Е (IgE) - класс иммуноглобулинов, обнаруживаемый в норме в незначительных количествах в сыворотке крови и секретах. Впервые IgE был изолирован в 1960-х годах из сывороток больных атопией и множественной миеломой. В 1968 г. ВОЗ выделила IgE как самостоятельный класс иммуноглобулинов. Согласно ВОЗ 1 МЕ/мл (МЕ - международная единица) соответствует 2,4 нг. Обычно концентрация IgE выражается в МЕ/мл или кЕ/л (кЕ - килоединица).
В норме IgE составляет менее 0,001% от всех иммуноглобулинов сыворотки крови (см. табл.1).
Таблица 1: Содержание IgE в сыворотке крови здоровых людей
| Возрастные группы | IgE (кЕ/л) |
|---|---|
| До 1 года | 0 - 15 |
| 1 год-6 лет | 0 - 60 |
| 6 -10 лет | 0 - 90 |
| 10 -16 лет | 0 - 200 |
| Взрослые | 0 - 100 |
Структура IgE подобна структуре других иммуноглобулинов и состоит из двух тяжёлых и двух лёгких полипептидных цепей. Они сгруппированы в комплексы, называемые доменами. Каждый домен содержит приблизительно 110 аминокислот. IgE имеет пять таких доменов в отличие от IgG, который имеет только четыре домена. По физико-химическим свойствам IgE - гликопротеин с молекулярной массой примерно 190000 дальтон, состоящий на 12% из углеводов. IgE имеет самую короткую продолжительность существования (время полувыведения из сыворотки крови 2 - 3 суток), самую высокую скорость катаболизма и наименьшую скорость синтеза из всех иммуноглобулинов (2,3 мкг/кг в сутки). IgE синтезируется главным образом плазматическими клетками, локализующимися в слизистых оболочках. Основная биологическая роль IgE - уникальная способность связываться с поверхностью тучных клеток и базофилов человека. На поверхности одного базофила присутствует примерно 40000 - 100000 рецепторов, которые связывают от 5000 до 40000 молекул IgE.
Дегрануляция тучных клеток и базофилов происходит, когда две связанные с мембраной клеток молекулы IgE соединяются с антигеном, что, в свою очередь, «включает» последовательные события, ведущие к выбросу медиаторов воспаления.
Помимо участия в аллергических реакциях I (немедленного) типа, IgE принимает участие в защитном противогельминтном иммунитете, что обусловлено существованием перекрёстного связывания между IgE и антигеном гельминтов. Последний проникает через мембрану слизистой и садится на тучные клетки, вызывая их дегрануляцию. Медиаторы воспаления повышают проницаемость капилляров и слизистой, в результате чего IgG и лейкоциты выходят из кровотока. К гельминтам покрытым IgG присоединяются эозинофилы, которые выбрасывают содержимое своих гранул и таким образом убивают гельминтов.
IgE можно обнаружить в организме человека уже на 11-й неделе внутриутробного развития. Содержание IgE в сыворотке крови возрастает постепенно с момента рождения человека до подросткового возраста. В пожилом возрасте уровень IgE может снижаться.
В практике клинико-диагностических лабораторий определение общего и специфического IgE проводится с целью их использования в качестве самостоятельных диагностических показателей. В табл. 2 перечислены основные болезни и состояния, сопровождающиеся изменением содержания общего IgE сыворотки крови.
Таблица 2: Болезни и состояния, сопровождающиеся изменением содержания общего IgE сыворотки крови
| Болезни и состояния | Возможные причины |
| I. Повышенное содержание IgE | |
|---|---|
| Аллергические болезни, обусловленные IgE антителами: а) Атопические болезни · Аллергический ринит · Атопическая бронхиальная астма · Атопический дерматит · Аллергическая гастроэнтеропатия б) Анафилактические болезни · Системная анафилаксия · Крапивница - ангионевротический отек | Множественные аллергены: · пыльцевые · пылевые · эпидермальные · пищевые · лекарственные препараты · химические вещества · металлы · чужеродный белок |
| Аллергический бронхопульмональный аспергиллез | Неизвестны |
| Гельминтозы | IgE антитела, связанные с защитным иммунитетом |
| Гипер-IgE синдром (синдром Джоба) | Дефект Т-супрессоров |
| Селективный IgA дефицит | Дефект Т-супрессоров |
| Синдром Вискотт-Олдриджа | Неизвестны |
| Тимусная аплазия (синдром Ди-Джорджи) | Неизвестны |
| IgE - миелома | Неоплазия IgE-продуцирующих плазматических клеток |
| Реакция "трансплантат против хозяина" | Дефект Т-супрессоров |
| II. Сниженное содержание общего IgE | |
| Атаксия - телеангиэктазия | Дефекты Т-клеток |
Ниже приведены в качестве примеров диапазоны содержания общего IgE сыворотки крови (у взрослых) при некоторых патологических состояниях (табл. 3). Однако, несмотря на первоначально кажущуюся простоту использования определения общего и специфического IgE для диагностики, существуют некоторые сложности в интерпретации результатов. Их перечень приведён ниже.
Таблица 3: Значения общего IgE при некоторых патологических состояниях
| Патологические состояния | Содержание IgE (кЕ/л) |
|---|---|
| Аллергический ринит | 120 - 1000 кЕ/л |
| Атопическая бронхиальная астма | 120 - 1200 кЕ/л |
| Атопический дерматит | 80 - 14000 кЕ/л |
| Аллергический бронхолегочный аспергиллез: - ремиссия - обострение | 80 - 1000 кЕ/л 1000 - 8000 кЕ/л |
| Гипер - IgE синдром | 1000 - 14000 кЕ/л |
| IgE - миелома | 15000 кЕ/л и выше |
Особенности интерпретации и диагностические ограничения общего IgE
- Примерно 30% больных атопическими заболеваниями имеют уровень общего IgE в пределах значений нормы.
- Некоторые больные бронхиальной астмой могут иметь повышенную чувствительность только к одному аллергену (антигену), в результате чего общий IgE может быть в пределах нормы, в то время как кожная проба и специфический IgE будут положительными.
- Концентрация общего IgE в сыворотке крови также повышается при неатопических состояниях (особенно при глистной инвазии, некоторых формах иммунодефицитов и бронхопульмональном аспергиллезе) с последующей нормализацией после соответствующего лечения.
- Хроническая рецидивирующая крапивница и ангионевротический отёк не являются обязательными показаниями для определения общего IgE, так как обычно имеют неиммунную природу.
- Границы нормы, определённые для европейцев, не могут быть применены для представителей зон, эндемичных по гельминтозам.
Особенности интерпретации и диагностические ограничения специфического IgE
- Доступность определения специфического IgE не должна преувеличивать его диагностическую роль в обследовании больных с аллергией.
- Обнаружение аллергенспецифического IgE (к какому-либо аллергену или антигену) не доказывает, что именно этот аллерген ответственен за клиническую симптоматику; окончательное заключение и интерпретация лабораторных данных должны быть сделаны только после сопоставления с клинической картиной и данными развёрнутого аллергологического анамнеза.
- Отсутствие специфического IgE в сыворотке периферической крови не исключает возможности участия IgE-зависимого механизма, так как местный синтез IgE и сенсибилизация тучных клеток может происходить и в отсутствие специфического IgE в кровотоке (например, аллергический ринит).
- Антитела других классов, специфичные для данного аллергена, особенно класса IgG (IgG4), могут быть причиной ложноотрицательных результатов.
- Исключительно высокие концентрации общего IgE, например, у отдельных больных атопическим дерматитом, могут за счёт неспецифического связывания с аллергеном давать ложноположительные результаты.
- Идентичные результаты для разных аллергенов не означают их одинакового клинического значения, так как способность к связыванию с IgE у разных аллергенов может быть различной.
В заключении, учитывая всё выше изложенное, а также существующие сложности в постановке и интерпретации кожных проб, перечислим основные показания и противопоказания к назначению специфического аллергологического обследования in vitro - определения специфического IgE (табл. 4).
Таблица 4: Показания и противопоказания к определению специфического IgE
| Показания | |
|---|---|
| 1 | Дифференциальная диагностика между IgE-зависимым и не-IgE-зависимым механизмами аллергических реакций |
| 2 | Больные, у которых невозможно выявить аллерген анамнестически, при помощи дневника и т. д. |
| 3 | Больные с недостаточным эффектом специфической гипосенсибилизации, назначенной по результатам кожных проб |
| 4 | Дермографизм и распространённый дерматит |
| 5 | Больные детского и пожилого возраста с гипореактивностью кожи |
| 6 | Гиперреактивность кожи |
| 7 | Больные, которым невозможно отменить симптоматическую терапию препаратами, влияющими на результаты кожных проб |
| 8 | Отрицательное отношение больного к кожным пробам |
| 9 | В анамнезе системные аллергические реакции на кожные пробы |
| 10 | Несоответствие результатов кожных проб данным анамнеза и клинической картине |
| 11 | IgE-зависимая пищевая аллергия |
| 12 | Необходимость количественной оценки чувствительности и специфичности аллергена |
| 13 | Общий IgE сыворотки крови более 100 кЕ/л |
| Обследование нецелесообразно: | |
| 1 | При атопических заболеваниях в случаях удовлетворительных результатов специфической терапии по данным кожных проб |
| 2 | У больных с не-IgE-зависимым механизмом аллергических реакции |
- Мачарадзе Д.Ш. Современные клинические аспекты оценки уровней общего и специфических IgE // Педиатрия. 2017; 96 (2): 121-127.
- Рыбникова Е.А., Продеус А.П., Федоскова Т.Г. Современные подходы к лабораторной диагностике аллергии — в помощь практикующему врачу // РМЖ. Медицинское обозрение. - №1 от 26.04.2021. - С. 43-49. DOI: 10.32364/2587-6821-2021-5-1-43-49
Читайте также:
