Изменение ЭКГ на фоне ТЭЛА. Дифференциация ЭКГ при ТЭЛА
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Тромбоэмболия легочной артерии (ТЭЛА) является грозным состоянием, характеризующимся высокой летальностью. Наиболее частой причиной ТЭЛА (до 50%) считается тромбофлебит глубоких вен нижних конечностей, особенно при распространении процесса на подвздошно-бедренный сегмент. При этом ТЭЛА нередко носит рецидивирующий характер.
Цель исследования: изучение динамики ЭКГ-симптомов ТЭЛА, возникающих на фоне илеофеморального тромбоза, по данным холтеровского мониторирования (ХМ) ЭКГ.
Материалы и методы. Обследовано 9 больных (5 женщин, 4 мужчин в возрасте от 42 до 67 лет), находившихся в блоке интенсивной терапии кардиологического отделения БСМП г. Воронежа в 2002-2003 г.г. Диагноз ТЭЛА устанавливался на основании клинических, ЭКГ и рентгенологических данных, эхокардиографии, анализа крови на D-димер. Илеофеморальный тромбоз подтверждался ультразвуковым исследованием сосудов нижних конечностей. ЭКГ-симптоматика ТЭЛА в данной группе было следующей. У 2 больных отмечался классический синдром МакГина-Уайта (SIQIII) в сочетании с отрицательным T в отведениях III, aVF,V1-V2, небольшим отклонением ЭОС вправо и смещением переходной зоны влево. У 5 больных синдром SIQIII отсутствовал, отмечались лишь отрицательные Т в правых грудных отведениях, сочетавшиеся в одном случае с неполной блокадой правой ножки пучка Гиса и в двух случаях - с небольшим смещением переходной зоны влево. В двух наблюдениях патогномоничных ЭКГ-симптомов не было. ХМ ЭКГ проводилось в течение 20-24 часов с использованием мониторов «Кардиотехника-4000» («Инкарт», Санкт-Петербург» на 4-6 день заболевания, применялись отведения: Y, V2, V6. Все больные получали антикоагулянтную (фраксипарин), антиагрегантную (аспирин, трентал) терапию, легочные вазодилататоры, антибиотики.
Выводы. 1) Тромбоэмболия легочной артерии на фоне илеофеморального тромбоза часто протекает с рецидивами микроэмболий. 2) Холтеровское мониторирование ЭКГ позволяет выявить больных с высоким риском рецидивирования тромбоэмболии. 3) При неявной ЭКГ-картине тромбоэмболии легочной артерии холтеровское мониторирование ЭКГ позволяет уточнить диагноз.
Российский Научно-Практический
рецензируемый журнал
ISSN 1561-8641
Cлучай ТЭЛА у пациента с генетической коагулопатией

Тромбоэмболия лёгочной артерии (ТЭЛА) — заболевание с высокой летальностью, что обусловлено в числе прочего многообразием симптоматики. Полиморфизм клинической картины ТЭЛА приводит к частым ошибкам в диагностике. Ситуация осложняется и тем, что с данной патологией может столкнуться врач любой специальности: терапевт, гинеколог, хирург, травматолог, онколог, что подчёркивает важность детального изучения принципов диагностики и лечения ТЭЛА практическими врачами. Однако несмотря на многообразие клинических симптомов манифестации ТЭЛА, доминирующим симптомокомплексом является одышка. В связи с жалобами респираторного характера пациенты чаще всего сначала обращаются к терапевту.
Представлен клинический случай рецидивирующей тромбоэмболии лёгочной артерии у молодого пациента с наследственной тромбофилией. Рассмотрены особенности клинической симптоматики ТЭЛА и сложности диагностического пути в терапевтической практике. Проанализированы причины поздней диагностики ТЭЛА.
Жалобы
Впервые пациент отметил появление сухого кашля и одышки смешанного характера при занятии горнолыжным спортом.
Анамнез
Симптомы заболевания появились в апреле 2014 года во время спортивных нагрузок. Связав симптомы с охлаждением, пациент обратился к терапевту по месту жительства. Без дополнительных обследований был установлен диагноз ОРИ, пациент получал лечение н естероидными противовоспалительными препаратами ( НПВС) без значительного эффекта.
При повторном обращении к терапевту в связи с кашлем и одышкой через месяц был установлен диагноз "бронхиальная астма", назначено лечение ингаляционными бронходилятаторами (Форадил, Вентолин по требованию) амбулаторно. Спирометрия (исследование функции внешнего дыхания) в тот период не проводилась, диагноз был установлен клинически.
В течение следующих двух месяцев на фоне лечения нарастала одышка, кашель сохранялся. Пациент самостоятельно прекратил применение ингаляционных препаратов из-за отсутствия положительного эффекта. В этот период начал испытывать ограничения в физических нагрузках прежней интенсивности, однако за медицинской помощью не обращался.
27.08.2014 пациент обратился в частный медицинский центр в связи с усилением интенсивности вышеуказанных жалоб, значимым снижением толерантности к физической нагрузке (ТФН). Проведено исследование функции внешнего дыхания, выявлена умеренная обструкция бронхов:
- объём форсированного выдоха за первую секунду 76 % (норма — более 85 %);
- индекс Тиффно — индекс наличия или отсутствия нарушений бронхиальной проходимости — 80 % (норма).
При проведении пробы с бронхолитиком значимой динамики не получено. По результатам посева мокроты (27.08.14) обнаружен обильный рост условно-патогенных микроорганизмов Neisseria subflava, Streptococcus viridans и умеренный рост Serratia marcescens.
По результатам обследования установлен диагноз "хронический обструктивный бронхит этиологии Serratia marcescens”. Назначено:
- антибактериальная терапия цефалоспорином перорально;
- ингаляции фиксированной комбинацией ингаляционного кортикостероида (иГКС) и бета-агониста продлённого действия (БАПД) симбикорт 160/4,5 мкг;
- бронхолитик короткого действия Беродуал 2 раза в день.
В течение августа-сентября 2014 года пациент отметил критическое снижение ТФН: возникновение одышки при минимальной физической нагрузке и значительную общую слабость.
В октябре 2014 года пациент вновь обратился к участковому терапевту, где был установлен диагноз "Вегето-сосудистая дистония по гипертензивному типу. Бронхиальная астма лёгкого течения, обострение". Рекомендовано продолжить приём иГКС и БАПД, к лечению добавлен приём бета-адреноблокаторов. Впервые с момента первичного обращения пациенту было назначено проведение электрокардиографии (ЭКГ) и эхокардиографии (ЭХОКГ) в плановом порядке.
- увеличение размера правого желудочка до 37 мм.;
- трикуспидальная регургитация (обратное движение крови из правого желудочка в правое предсердие) III степени;
- систолическое давление в правом желудочке 103 мм рт ст. при норме 25 мм рт. ст.;
- объём, систолическая и диастолическая функции левого желудочка не были нарушены;
- фракция выброса (объём крови, выталкиваемой левым желудочком в момент его сокращения в просвет аорты) 71 %, что является нормой.
Хронических заболеваний пациент не отмечал. Туберкулёз, вирусные гепатиты не переносил. Операции не переносил. Получал травмы:
- 1999 г. — вывих правого локтевого сустава;
- 2001 г. — перелом правого лучезапястного сустава;
- 2003 г. — разрыв передней крестообразной связки правого коленного сустава;
- 2012 г. — перелом проксимальной фланги I пальца правой кисти.
Обследование
- Общее состояние удовлетворительное,
- Тахипноэ (учащённое поверхностное дыхание) до 24 в минуту и тахикардия в покое до 97 ударов в минуту.
- Артериальное давление 110/70 мм рт.ст.
- Дыхание везикулярное (норма), хрипов нет.
- Тоны сердца приглушены. Акцент второго тона над лёгочной артерий. Второй тон образуется во время расслабления сердца после короткой паузы.
- Живот мягкий, безболезненный. Симптом Пастернацкого отрицателен симметрично, то есть при лёгком поколачивании в поясничной области пациент не чувствует боли. Положительный симптом Пастернацкого является признаком болезни почек.
В стационаре проведена компьютерная томография органов грудной клетки с контрастированием лёгочной артерии и её ветвей для исключения ТЭЛА.
- Выявлен участок снижения пневматизации (воздушности) в прикорневой зоне правого лёгкого по типу матового стекла, чётко ограниченный от нормальной ткани междольковым интерстицием (промежутком). Размер участка 44 х 20 х 24 мм.
- В 1 и 2 сегментах левого лёгкого и во 2 сегменте правого лёгкого — участки снижения пневматизации ткани по типу матового стекла большего диаметра, но меньшей интенсивности.
- В просвете ветвей лёгочной артерии — множественные пристеночные и обтурирующие (которые закупоривают ветви артерии) дефекты контрастирования.
- Справа дефекты в сегментарных артериях 1, 2, 3, 4 и 8 сегментов, а также в субсегментарных артериях 10 сегмента, обтурация (закупорка) субсегментарных артерий 10 сегмента.
- Слева дефекты в сегментарных артериях 1, 2, 3, 6, 9 и 10 сегментов
У пациента выявлен повышенный уровень D-димера (показателя тромбообразования): 1865 нг/мл (норма — до 500 нг/мл).
При компрессионной ультрасонографии вен нижних конечностей данных за тромбоз поверхностных и глубоких вен не получено.
- Синусовый ритм с частотой сердечных сокращений (ЧСС) 100 в минуту.
- Отклонение электрической оси сердца вправо (один из критериев патологии сердца).
- Признаки перегрузки правого желудочка.
Диагноз
- Внегоспитальная двухсторонняя инфарктная пневмония справа верхней и средней доли, слева верхней доли на фоне тромбоэмболии в мелкие и средние ветви лёгочной артерии из невыявленного источника.
- Дыхательная недостаточность II степени.
Лечение
С учётом стабильности гемодинамики и отсутствия признаков высокого риска тромболизис (растворение тромбов в сосудах) пациенту не проводился, что не противоречит действующим рекомендациям.
- Антикоагулянтная терапия (способствует более медленному свёртыванию крови и препятствует образованию тромбов): гепарин в дозе 1000 МЕ/час с последующим переходом на антикоагулянты непрямого действия — варфарин.
- Чтобы восстановить параметры сердца и для профилактики прогрессирования лёгочной гипертензии, назначена небольшая доза ингибитора ангиотензинпревращающего фермента (эналаприл 2,5 мг/сутки).
30.10.14 после проведённого лечения на контрольных томограммах сохраняются дефекты в нижнедолевых ветвях обоих лёгких протяжённостью 15 мм, слева они распространяются в сегментарные ветви 9 и 10 сегментов. Справа сохраняются дефекты сегментарных ветвей 1 и 2 сегментов.
В паренхиме (ткани) лёгких очаговые и инфильтративные изменения не определяются. По настоянию родственников пациент с незначительной положительной динамикой был переведён в пульмонологическое отделение ГКБ № 33 г. Екатеринбурга. В рамках этой госпитализации пациенту была проведена тромболитическая терапия стрептокиназой, а также замена варфарина на ривароксабан.
После выписки из ГКБ № 33 пациент был направлен в Новосибирск для решения вопроса о хирургическом лечении в условиях научно-исследовательского института (НИИ) патологии кровообращения имени Мешалкина.
13.01.15 при перфузионно-вентиляционной синциографии лёгких (ПВСЛ) выявлены сегментарные дефекты перфузии ( сниженный захват радиофармпрепарата миокардом) в бассейнах левой и правой лёгочной артерии, дефекты вентиляции не выявлены.
27.01.15 проведена тромбэндартерэктомия (удаление атеросклеротических бляшек и восстановление проходимости сосудов) из ветвей лёгочной артерии.
Пациент продолжает регулярный приём ривароксабана 20 мг 1 раз в сутки. Для коррекции лёгочной гипертензии принимал силденафил 20 мг 3 раза в сутки в течение 1 месяца, затем илопрост (Вентавис) 5 мг 6 раз в сутки под контролем артериального давления в течение 1 месяца (отмена по экономическим причинам).
17.02.15 при исследовании маркеров тромбофилии в МАУ "Клинико-диагностический центр" выявлен полиморфизм (многообразие) гена ингибитора активатора плазминогена I (PAI I) — 4G/4G, гена рецепторов тромбоцитов ITGA2 (C/T) и ITGB3 (С/С). То есть патология пациента связана с генетической мутацией, которая передалась ему от одного из родителей.
22.07.15 при контрольной оценке состояния внутрисердечной гемодинамики на ЭХОКГ выявлена значимая положительная динамика в виде уменьшения размеров правых камер сердца, снижения давления в лёгочной артерии до 41 мм рт. ст., нормализации формы потока в лёгочных артериях.
Клинически состояние пациента также улучшилось: уменьшилась одышка и слабость, пациент вернулся к умеренной физической активности и к труду (сидячая работа за компьютером). Качество жизни и прогноз этого пациента улучшились благодаря предпринятым усилиям врачей после постановки диагноза.
Заключение
Длительный период от момента первичного обращения (апрель 2014) до постановки диагноза (октябрь 2014) повлияли на течение заболевания и произошедшие изменения внутрисердечной и пульмональной гемодинамики, а также на прогноз для жизни молодого пациента.
"Маски" ТЭЛА разнообразны. Низкая настороженность врачей в отношении этого заболевания в данном клиническом случае была обусловлена, по всей видимости, отсутствием традиционных факторов риска: курения, ожирения, сахарного диабета, варикозной болезни или тромбофлебита, малоподвижности.
В сложных клинических случаях у пациентов молодого возраста без явных факторов риска венозных тромбоэмболий, своевременное проведение таких доступных неинвазивных методов диагностики как ЭКГ и ЭХОКГ позволит заподозрить ТЭЛА.
Изменение ЭКГ на фоне ТЭЛА. Дифференциация ЭКГ при ТЭЛА

Диагностика и лечение тромбоэмболии легочной артерии на догоспитальном этапе
Тромбоэмболия легочных артерий (ТЭЛА) представляет собой синдром, обусловленный эмболией легочной артерии или ее ветвей тромбом и характеризующийся резкими кардиореспираторными расстройствами, при эмболии мелких ветвей — симптомом образования геморрагических инфарктов легкого.
Наиболее частой причиной и источником эмболизации ветвей легочной артерии являются тромбы из глубоких вен нижних конечностей при флеботромбозе (около 90% случаев), значительно реже — из правых отделов сердца при сердечной недостаточности и перерастяжении правого желудочка. Наибольшую угрозу в отношении ТЭЛА представляют флотирующие тромбы, свободно располагающиеся в просвете сосуда и соединенные с венозной стенкой только дистальным отделом.
Различают наследственные и приобретенные факторы риска ТЭЛА. Среди наследственных факторов одним из наиболее распространенных является генетическая мутация фактора V свертывания крови (фактор V Лейдена), встречающийся у 3% населения и увеличивающий риск тромбоза в несколько раз и др. О врожденной предрасположенности к патологическому тромбообразованию могут свидетельствовать развитие необъяснимого тромбоза и/или тромбоэмболии в возрасте до 40 лет, наличие подобных состояний у родственников пациента, рецидивирование тромбоза глубоких вен или ТЭЛА при отсутствии вторичных факторов риска.
Кроме того, в основе рецидивирующей ТЭЛА может лежать антифосфолипидный синдром — первичный или вторичный. Патологические механизмы тромбообразования могут быть следствием применения оральных контрацептивов, заместительной гормональной терапии, беременности, наличия злокачественных болезней и лейкозов, выраженной дегидратации (например, при бесконтрольном применении мочегонных или слабительных средств).
Развитие ТЭЛА часто сопровождают застойная сердечная недостаточность, мерцательная аритмия, а также вынужденная иммобилизация (послеоперационный постельный режим, переломы костей, парализованная конечность), особенно у пожилых, тучных пациентов, а также при наличии варикозного расширения вен.
Патогномоничных для ТЭЛА клинических признаков не существует, предварительный диагноз на догоспитальном этапе может ставиться на основании совокупности анамнестических данных, результатов объективного обследования и электрокардиографических симптомов. Внезапное появление одышки, тахикардии, гипотонии и боли в грудной клетке у пациента с факторами риска тромбоэмболии и клиническими признаками тромбоза глубоких вен заставляет проявлять настороженность в отношении ТЭЛА.
Окончательную верификацию диагноза проводят в стационаре. Иногда при рентгенологическом исследовании выявляют высокое стояние купола диафрагмы, дисковидный ателектаз, полнокровие одного из корней легких или «обрубленный» корень, обеднение легочного рисунка над ишемизированной зоной легкого, периферическую треугольную тень воспаления или плевральный выпот. Однако у большинства пациентов какие-либо рентгенологические изменения отсутствуют. При эхокардиографии в пользу ТЭЛА свидетельствуют дилатация правого желудочка и гипокинезия его стенки, аномальное движение межжелудочковой перегородки, трикуспидальная регургитация, дилатация легочной артерии, значительное уменьшение степени спадения нижней полой вены на вдохе, наличие тромбов в полостях сердца и главных легочных артериях.
Об эндогенном фибринолизе, наблюдаемом у больных с венозным тромбозом, свидетельствует обнаружение в крови повышенного уровня Д-димеров. Нормальный уровень этого показателя позволяет со значительной долей вероятности отказаться от версии о наличии у больного тромбоза глубоких вен и ТЭЛА; чувствительность метода составляет 99%, специфичность — только около 50%. Диагноз ТЭЛА подтверждают с помощью перфузионной сцинтиграфии легких (метод выбора позволяет обнаружить характерные треугольные участки снижения перфузии легких), а также рентгеноконтрастной ангиографии легких (ангиопульмонографии), выявляющей зоны редуцированного кровотока.
Классификация ТЭЛА
Европейское кардиологическое общество предлагает различать массивную, субмассивную и немассивную ТЭЛА . Клинически различают острое, подострое и рецидивирующее течение ТЭЛА. Основные направления терапии ТЭЛА на догоспитальном этапе включают купирование болевого синдрома, профилактику тромбоза в легочных артериях и повторных эпизодов ТЭЛА, улучшение микроциркуляции (антикоагулянтная терапия), коррекцию правожелудочковой недостаточности, артериальной гипотензии, гипоксии (кислородотерапия), купирование бронхоспазма.
При выраженном болевом синдроме, а также для разгрузки малого круга кровообращения и уменьшения одышки используют наркотические анальгетики, оптимально — морфин в/в дробно. 1 мл 1% раствора разводят изотоническим раствором натрия хлорида до 20 мл (1 мл полученного раствора содержит 0,5 мг активного вещества) и вводят 2—5 мг каждые 5—15 мин до устранения болевого синдрома и одышки либо до появления побочных эффектов (гипотензия, угнетение дыхания, рвота).
Для решения вопроса о возможности использования наркотических анальгетиков следует:
• убедиться, что болевой синдром — это не проявление «острого живота», а изменения ЭКГ — не специфическая реакция на «катастрофу» в брюшной полости;
• выяснить, имеются ли в анамнезе хронические заболевания органов дыхания, в частности бронхиальная астма, и уточнить дату последнего обострения бронхообструктивного синдрома;
установить, имеются ли в настоящее время признаки дыхательной недостаточности, как они проявляются, какова степень их выраженности;
• выяснить, имеется ли у больного в анамнезе судорожный синдром, когда был последний припадок.
При развитии инфарктной пневмонии, когда боль в грудной клетке связана с дыханием, кашлем, положением тела, целесообразнее использовать ненаркотические анальгетики (например, внутривенное введение 2 мл 50% раствора анальгина).
Для решения вопроса о возможности назначения анальгина необходимо убедиться в отсутствии анамнестических указаний на выраженные нарушения функции почек или печени, заболеваний крови (гранулоцитопения), повышенной чувствительности к препарату.
Выживаемость пациентов при инфаркте легкого напрямую зависит от возможности раннего применения антикоагулянтов. Целесообразно применение прямых антикоагулянтов — гепарина в/в струйно в дозе 10 тыс. — 20 тыс. МЕ или низкомолекулярных гепаринов. Гепарин не лизирует тромб, но приостанавливает тромботический процесс и препятствует нарастанию тромба дистальнее и проксимальнее эмбола.
Ослабляя сосудосуживающее и бронхоспатическое действие тромбоцитарного серотонина и гистамина, гепарин уменьшает спазм легочных артериол и бронхиол. Гепарин, благоприятно влияющий на течение флеботромбоза, используется для профилактитки рецидивов ТЭЛА.
Для решения вопроса о возможности назначения гепарина следует:
исключить геморрагический инсульт в анамнезе, операции на головном и спинном мозге;
• убедиться в отсутствии опухоли и язвенной болезни желудка и двенадцатиперстной кишки, инфекционного эндокардита, тяжелого поражения печени и почек;
• исключить подозрение на острый панкреатит, расслаивающую аневризму аорты, острый перикардит с шумом трения перикарда, прослушивающимся в течение нескольких дней(!) (опасность развития гемоперикарда);
• установить отсутствие физикальных признаков или анамнестических указаний на патологию свертывающей системы крови (геморрагические диатезы, болезни крови);
выяснить, нет ли у больного повышенной чувствительности к гепарину;
• при необходимости добиться снижения и стабилизации повышенного артериального давления на уровне менее 200/120 мм рт. ст.
При осложнении течения заболевания правожелудочковой недостаточностью, гипотензией или шоком показана терапия прессорными аминами.
Для улучшения микроциркуляции дополнительно используют реополиглюкин — 400 мл вводят внутривенно капельно со скоростью до 1 мл в мин; препарат не только увеличивает объем циркулирующей крови и повышает артериальное давление, но и обладает антиагрегационным действием. Осложнений обычно не наблюдается, достаточно редко отмечаются аллергические реакции на реополиглюкин.
Для решения вопроса о возможности назначения реополиглюкина следует:
• убедиться в отсутствии органического поражения почек с олигурией и анурией;
• уточнить, нет ли в анамнезе нарушений коагуляции и гемостаза;
• оценить необходимость введения препарата при тяжелой сердечной недостаточности (относительное противопоказание).
При сохраняющемся шоке переходят к терапии прессорными аминами. Допамин в дозе 1—5 мкг/кг в 1 мин оказывает преимущественно вазодилатирующее действие, 5-15 мкг/кг в 1 мин — вазодилатирующее и положительное инотропное (хронотропное) действие, 15-25 мкг/кг в 1 мин — положительное инотропное, хронотропное и периферическое сосудосуживающее действие. Начальная доза препарата составляет 5 мкг/кг в 1 мин с постепенным ее увеличением до оптимальной.
Добутамин, в отличие от допамина, не вызывает вазодилатацию, но обладает мощным положительным инотропным эффектом с менее выраженным хронотропным действием. Препарат назначают в дозе 2,5 мкг/кг в 1 мин, увеличивая ее каждые 15-30 мин на 2,5 мкг/кг в 1 мин до получения эффекта, побочного действия или достижения дозы 15 мкг/кг в 1 мин.
Норэпинефрин в качестве монотерапии применяют при невозможности использовать другие прессорные амины. Препарат назначают в дозе, не превышающей 16 мкг/кг в 1 мин.
При ТЭЛА показана длительная кислородотерапия.
При развитии бронхоспазма и стабильном АД (САД не ниже 100 мм рт. ст.) показано в/в медленное (струйное либо капельное) введение 10 мл 2,4% раствора эуфиллина. Эуфиллин снижает давление в легочной артерии, обладает антиагрегантными свойствами, оказывает бронходилатирующее действие. Следует помнить о возможности развития побочных эффектов (чаще они возникают при быстром введении препарата).
Для решения вопроса о возможности назначения эуфиллина следует: бедиться в отсутствии эпилепсии, тяжелой артериальной гипотензии, пароксизмальной тахикардии, инфаркта миокарда и повышенной чувствительности к препарату.
Часто встречающиеся ошибки терапии
При инфаркте легкого у больных с ТЭЛА нецелесообразно применение кровоостанавливающих средств, поскольку кровохарканье появляется на фоне тромбоза или тромбоэмболии.
Тромбоэмболия легочной артерии
ТЭЛА — окклюзия ствола или основных ветвей легочной артерии частичками тромба, сформировавшимися в венах большого круга кровообращения или правых камерах сердца и занесенными в легочную артерию с током крови. [3]
Пользователи протокола: врачи общей практики, терапевты, кардиологи, ангиохирурги, кардиохирурги, интервенционные кардиологи, врачи функциональной диагностики, онкологи.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Основные (обязательные) диагностические обследования, проводимые на амбулаторном уровне (после выписки из стационара):
Дополнительные диагностические обследования, проводимые на амбулаторном уровне (после выписки из стационара):
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: не предусмотрено
• рентгенография органов грудной клетки (прямая и боковая проекции).
• определение количественного Д-димера в плазме крови.
Клиника ТЭЛА включает широкий диапазон состояний: от почти бессимптомного течения до внезапной смерти. В качестве классических вариантов течения заболевания в клинике ТЭЛА выделяют пять клинических синдромов.
• боль в правом подреберье.
Оценка клинической вероятности развития ТЭЛА основывается на жалобах, анамнезе и клинике (Таблица 2).
• неспецифические изменения в легких при аускультации (притупление перкуторного звука, усиление голосового дрожания, влажные хрипы, крепитация, шум трения плевры);
Интерпретация результатов зависит от референсных значений лаборатории. Увеличение концентрации D-димера более 500 мкг/л свидетельствует о спонтанной активации фибринолитической системы крови в ответ на тромбообразование в венозной системе. Чувствительность уровня D-димера составляет 96-99 %, отрицательная предсказательная ценность близка к идеалу —99,6 % и специфичность —около 50 %.
Низкочувствительную технологию определения D-димера можно использовать для обследования пациентов с низкой клинической вероятностью, в то время, как высокочувствительная технология определения D-димера позволяет диагностировать ТЭЛА у пациентов как с низкой, так и средней вероятностью.
Повышение уровня D-димера возможно также при остром инфаркте миокарда, септическом состоянии, при оперативном вмешательстве, злокачественном новообразовании и системных заболеваниях. В целях стратификации риска тяжести течения необходимо определением тропонина и proBNP.
Инструментальные исследования
Обнаружение тромба при проведении КТ, максимум сегментарного уровня. Для достоверного исключения диагноза ТЭЛА отрицательный результат ОДКТ должен быть подтвержден и отрицательным результатом КУСГ. Если отрицательный результат МДКТ противоречит высокой клинической вероятности ТЭЛА, назначение специфического лечения следует отложить до получения результатов дополнительных диагностических тестов.
Однодетекторная спиральная компьютерная томография имеет чувствительность 70 % и специфичность 90 %, а мультидетекторная спиральная компьютерная томография —чувствительность 83 % и специфичность 96 %.
В пользу присутствия ТЭЛА свидетельствуют: расширение правых отделов сердца, выбухание межжелудочковой перегородки в сторону левых отделов, парадоксальное движение межжелудочковой перегородки в диастолу, непосредственная локация тромба в легочной артерии, выраженная регургитация на трикуспидальном клапане, признак 60/60(ускорение времени ПЖ-выброса < 60 мс при наличии трикуспидальной недостаточности и градиента давления ≤ 60 мм рт.ст.).
С сердечно-легочной патологией в анамнезе: чувствительность — 80 %, специфичность —21 %.
Вентиляционно-перфузионная сцинтиграфия легких — точный метод исключения ТЭЛА. При внутривенном введении микросфер альбумина, меченных 99mTc, и вдыхании ксенона-133 или аэрозоля с 99mTc определяется дефект перфузии и проводится сравнение с наличием дефекта вентиляции.
Интерпретация результатов: отсутствие ТЭЛА (норма), низкая, средняя и высокая вероятность ТЭЛА. При этом нормальный результат полностью исключает развитие ТЭЛА; недиагностические данные вентиляционно-перфузионной сцинтиграфии легких, низкая клиническая вероятность также исключают возможность развития ТЭЛА.
Позитивный результат вентиляционно-перфузионной сцинтиграфии легких подтверждает ТЭЛА, однако требует дополнительных методов исследования при низкой клинической вероятности.
Ангиопульмонография - золотой стандарт диагностики ТЭЛА.
− Дефект наполнения в просвете сосуда — наиболее характерный ангиографический признак ТЭЛА. Дефекты могут иметь цилиндрическую форму и большой диаметр, что свидетельствует о первичном формировании их в илиокавальном сегменте;
− Полная обструкция сосуда («ампутация» сосуда, обрыв его контрастирования). При массивной ТЭЛА этот симптом на уровне долевых артерий наблюдается в 5 % случаев, чаще (в 45 %) его обнаруживают на уровне долевых артерий, дистальнее тромбоэмбола, расположенного в главной легочной артерии;
− Уменьшение числа контрастированных периферических ветвей (симптом мертвого, или подрезанного, дерева);
− Отсутствие или задержка венозной фазы контрастирования.
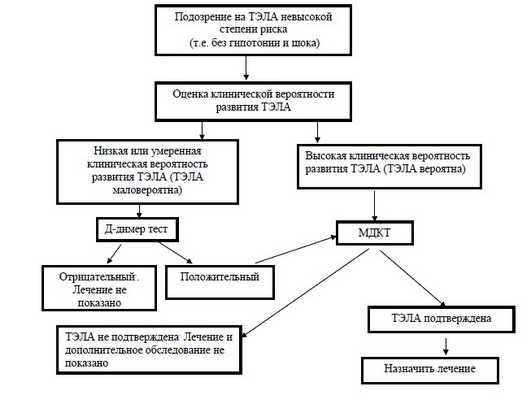
Рисунок 1. Алгоритм диагностики ТЭЛА невысокой степени риска смерти
Критерии диагностики ТЭЛА у пациентов без гипотонии и шока (невысокая степень риска смерти) в соответствии с клинической вероятностью представлены в таблице 3.
Таблица 3. Критерии диагностики ТЭЛА у пациентов без гипотонии и шока (невысокая степень риска смерти)
Тромбоэмболия легочной артерии ( ТЭЛА )
Тромбоэмболия легочной артерии - окклюзия легочной артерии или ее ветвей тромботическими массами, приводящая к жизнеугрожающим нарушениям легочной и системной гемодинамики. Классическими признаками ТЭЛА служат боли за грудиной, удушье, цианоз лица и шеи, коллапс, тахикардия. Для подтверждения диагноза тромбоэмболии легочной артерии и дифференциальной диагностики с другими схожими по симптоматике состояниями проводится ЭКГ, рентгенография легких, ЭхоКГ, сцинтиграфия легких, ангиопульмонография. Лечение ТЭЛА предполагает проведение тромболитической и инфузионной терапии, ингаляций кислорода; при неэффективности - тромбоэмболэктомии из легочной артерии.
МКБ-10

Общие сведения
Тромбоэмболия легочной артерии (ТЭЛА) — внезапная закупорка ветвей или ствола легочной артерии тромбом (эмболом), образовавшимся в правом желудочке или предсердии сердца, венозном русле большого круга кровообращения и принесенным с током крови. В результате ТЭЛА прекращается кровоснабжение легочной ткани. Развитие ТЭЛА происходит часто стремительно и может привести к гибели больного.
От ТЭЛА умирает 0,1% населения земного шара ежегодно. Около 90% больным, умершим от ТЭЛА, во время не был установлен правильный диагноз, и не было проведено необходимое лечение. Среди причин смерти населения от сердечно-сосудистой заболеваний ТЭЛА стоит на третьем месте после ИБС и инсульта. ТЭЛА может приводить к летальному исходу при некардиологической патологии, возникая после операций, полученных травм, родов. При своевременном оптимальном лечении ТЭЛА наблюдается высокий показатель снижения уровня смертности до 2 - 8%.
Причины ТЭЛА
Наиболее частыми причинами развития ТЭЛА служат:
- тромбоз глубоких вен (ТГВ) голени (в 70 - 90% случаев), часто сопровождающийся тромбофлебитом. Может иметь место тромбоз одновременно глубоких и поверхностных вен голени
- тромбоз нижней полой вены и ее притоков
- сердечно-сосудистые заболевания, предрасполагающие к появлению тромбов и эмболий в легочной артерии (ИБС, активная фаза ревматизма с наличием митрального стеноза и мерцательной аритмии, гипертоническая болезнь, инфекционный эндокардит, кардиомиопатии и неревматические миокардиты)
- септический генерализованный процесс
- онкологические заболевания (чаще рак поджелудочной железы, желудка, легких)
- тромбофилия (повышенное внутрисосудистое тромбообразование при нарушении системы регуляции гемостаза)
- антифосфолипидный синдром — образование антител к фосфолипидам тромбоцитов, клеток эндотелия и нервной ткани (аутоиммунные реакции); проявляется повышенной склонностью к тромбозам различных локализаций.
Факторы риска
Факторы риска тромбозов вен и ТЭЛА - это:
- длительное состояние обездвиженности (постельный режим, частые и продолжительные авиаперелеты, поездки, парез конечностей), хроническая сердечно-сосудистая и дыхательная недостаточность, сопровождаются замедлением тока крови и венозным застоем.
- прием большого количества диуретиков (массовая потеря воды приводит к дегидратации, повышению гематокрита и вязкости крови);
- злокачественные новообразования - некоторые виды гемобластозов, истинная полицитемия (большое содержание в крови эритроцитов и тромбоцитов приводит к их гиперагрегации и образованию тромбов);
- длительный прием некоторых лекарственных препаратов (оральные контрацептивы, заместительная гормональная терапия) повышает свертываемость крови;
- варикозная болезнь (при варикозном расширении вен нижних конечностей создаются условия для застоя венозной крови и образования тромбов);
- нарушения обмена веществ, гемостаза (гиперлипидпротеинемия, ожирение, сахарный диабет, тромбофилия);
- хирургические операции и внутрисосудистые инвазивные процедуры (например, центральный катетер в крупной вене);
- артериальная гипертензия, застойная сердечная недостаточность, инсульты, инфаркты;
- травмы спинного мозга, переломы крупных костей;
- химиотерапия;
- беременность, роды, послеродовый период;
- курение, пожилой возраст и др.
В зависимости от локализации тромбоэмболического процесса различают следующие варианты ТЭЛА:
- массивная (тромб локализуется в главном стволе или основных ветвях легочной артерии)
- эмболия сегментарных или долевых ветвей легочной артерии
- эмболия мелких ветвей легочной артерии (чаще двусторонняя)
В зависимости от объема отключенного артериального кровотока при ТЭЛА выделяют формы:
- малую (поражены менее 25% легочных сосудов) - сопровождается одышкой, правый желудочек функционирует нормально
- субмассивную (субмаксимальную - объем пораженных сосудов легких от 30 до 50%), при которой у пациента отмечается одышка, нормальное артериальное давление, правожелудочковая недостаточность мало выражена
- массивную (объем отключенного легочного кровотока более 50%) - наблюдается потеря сознания, гипотония, тахикардия, кардиогенный шок, легочная гипертензия, острая правожелудочковая недостаточность
- смертельную (объем отключенного кровотока в легких более 75%).
ТЭЛА может протекать в тяжелой, среднетяжелой или легкой форме.
Клиническое течение ТЭЛА может быть:
- острейшим (молниеносным), когда наблюдается моментальная и полная закупорка тромбом главного ствола или обеих основных ветвей легочной артерии. Развивается острая дыхательная недостаточность, остановка дыхания, коллапс, фибрилляция желудочков. Летальный исход наступает за несколько минут, инфаркт легких не успевает развиться.
- острым, при котором отмечается быстро нарастающая обтурация основных ветвей легочной артерии и части долевых или сегментарных. Начинается внезапно, бурно прогрессирует, развиваются симптомы дыхательной, сердечной и церебральной недостаточности. Продолжается максимально 3 - 5 дней, осложняется развитием инфаркта легких.
- подострым (затяжным) с тромбозом крупных и средних ветвей легочной артерии и развитием множественных инфарктов легких. Продолжается несколько недель, медленно прогрессирует, сопровождаясь нарастанием дыхательной и правожелудочковой недостаточности. Могут возникать повторные тромбоэмболии с обострением симптомов, при которых нередко наступает смертельный исход.
- хроническим (рецидивирующим), сопровождающимся рецидивирующими тромбозами долевых, сегментарных ветвей легочной артерии. Проявляется повторными инфарктами легких или повторными плевритами (чаще двусторонними), а также постепенно нарастающей гипертензией малого круга кровообращения и развитием правожелудочковой недостаточности. Часто развивается в послеоперационном периоде, на фоне уже имеющихся онкологических заболеваний, сердечно-сосудистых патологий.
Симптомы ТЭЛА
Симптоматика ТЭЛА зависит от количества и размера тромбированных легочных артерий, скорости развития тромбоэмболии, степени возникших нарушений кровоснабжения легочной ткани, исходного состояния пациента. При ТЭЛА наблюдается широкий диапазон клинических состояний: от практически бессимптомного течения до внезапной смерти.
Клинические проявления ТЭЛА неспецифические, они могут наблюдаться при других легочных и сердечно-сосудистых заболеваниях, их главным отличием служит резкое, внезапное начало при отсутствии других видимых причин данного состояния (сердечно-сосудистой недостаточности, инфаркта миокарда, пневмонии и др.). Для ТЭЛА в классическом варианте характерен ряд синдромов:
1. Сердечно - сосудистый:
- острая сосудистая недостаточность. Отмечается падение артериального давления (коллапс, циркуляторный шок), тахикардия. Частота сердечных сокращений может достигать более 100 уд. в минуту.
- острая коронарная недостаточность (у 15-25% больных). Проявляется внезапными сильными болями за грудиной различного характера, продолжительностью от нескольких минут до нескольких часов, мерцательной аритмией, экстрасистолией.
- острое легочное сердце. Обусловлено массивной или субмассивной ТЭЛА; проявляется тахикардией, набуханием (пульсацией) шейных вен, положительным венным пульсом. Отеки при остром легочном сердце не развиваются.
- острая цереброваскулярная недостаточность. Возникают общемозговые или очаговые нарушения, церебральная гипоксия, при тяжелой форме - отек мозга, мозговые кровоизлияния. Проявляется головокружением, шумом в ушах, глубоким обмороком с судорогами, рвотой, брадикардией или коматозным состоянием. Могут наблюдаться психомоторное возбуждение, гемипарезы, полиневриты, менингиальные симптомы.
2. Легочно-плевральный:
- острая дыхательная недостаточность проявляется одышкой (от ощущения нехватки воздуха до очень выраженных проявлений). Число дыханий более 30-40 в минуту, отмечается цианоз, кожные покровы пепельно-серые, бледные.
- умеренный бронхоспастический синдром сопровождается сухими свистящими хрипами.
- инфаркт легкого, инфарктная пневмония развивается на 1 - 3 сутки после ТЭЛА. Появляются жалобы на одышку, кашель, боли в грудной клетке со стороны поражения, усиливающиеся при дыхании; кровохарканье, повышение температуры тела. Становятся слышны мелкопузырчатые влажные хрипы, шум трения плевры. У пациентов с тяжелой сердечной недостаточностью наблюдаются значительные выпоты в плевральную полость.
3. Лихорадочный синдром - субфебрильная, фебрильная температура тела. Связан с воспалительными процессами в легких и плевре. Длительность лихорадки составляет от 2 до 12 дней.
4. Абдоминальный синдром обусловлен острым, болезненным набуханием печени (в сочетании с парезом кишечника, раздражением брюшины, икотой). Проявляется острой болью в правом подреберье, отрыжкой, рвотой.
5. Иммунологический синдром (пульмонит, рецидивирующий плеврит, уртикароподобная сыпь на коже, эозинофилия, появление в крови циркулирующих иммунных комплексов) развивается на 2-3 неделе заболевания.
Осложнения
Острая ТЭЛА может служить причиной остановки сердца и внезапной смерти. При срабатывании компенсаторных механизмов пациент сразу не погибает, но при отсутствии лечения очень быстро прогрессируют вторичные гемодинамические нарушения. Имеющиеся у пациента кардиоваскулярные заболевания значительно снижают компенсаторные возможности сердечно-сосудистой системы и ухудшают прогноз.
В диагностике ТЭЛА главная задача - установить местонахождение тромбов в легочных сосудах, оценить степень поражения и выраженность нарушений гемодинамики, выявить источник тромбоэмболии для предупреждения рецидивов.
Сложность диагностики ТЭЛА диктует необходимость нахождения таких пациентов в специально оборудованных сосудистых отделениях, владеющих максимально широкими возможностями для проведения специальных исследований и лечения. Всем пациентам с подозрением на ТЭЛА проводят следующие обследования:
- тщательный сбор анамнеза, оценку факторов риска ТГВ/ТЭЛА и клинической симптоматики
- общий и биохимический анализы крови, мочи, исследование газового состава крови, коагулограмму и исследование Д-димера в плазме крови (метод диагностики венозных тромбов)
- ЭКГ в динамике (для исключения инфаркта миокарда, перикардита, сердечной недостаточности)
- рентгенографию легких (для исключения пневмоторакса, первичной пневмонии, опухолей, переломов ребер, плеврита)
- эхокардиографию (для выявления повышенного давления в легочной артерии, перегрузок правых отделов сердца, тромбов в полостях сердца)
- сцинтиграфию легких (нарушение перфузии крови через легочную ткань говорит об уменьшении или отсутствии кровотока вследствие ТЭЛА)
- ангиопульмонографию (для точного определения локализации и размеров тромба)
- УЗДГ вен нижних конечностей, контрастную флебографию (для выявления источника тромбоэмболии)

КТ-ангиография легочных артерий. Протяженный пристеночный тромб в просвете основного ствола левой легочной артерии
Лечение ТЭЛА
Пациентов с тромбоэмболией помещают в реанимационное отделение. В неотложном состоянии пациенту проводятся реанимационные мероприятия в полном объеме. Дальнейшее лечение ТЭЛА направлено на нормализацию легочного кровообращения, профилактику хронической легочной гипертензии.
С целью предупреждения рецидивов ТЭЛА необходимо соблюдение строгого постельного режима. Для поддержания оксигенации проводится постоянная ингаляция кислорода. Осуществляется массивная инфузионная терапия для снижения вязкости крови и поддержания АД.
В раннем периоде показано назначение тромболитической терапии с целью максимально быстрого растворения тромба и восстановления кровотока в легочной артерии. В дальнейшем для предупреждения рецидивов ТЭЛА проводится гепаринотерапия. При явлениях инфаркт-пневмонии назначается антибактериальная терапия.
В случаях развития массивной ТЭЛА и неэффективности тромболизиса сосудистыми хирургами проводится хирургическая тромбоэмболэктомия (удаление тромба). Как альтернативу эмболэктомии используют катетерную фрагментацию тромбоэмбола. При рецидивирующих ТЭЛА практикуется постановка специального фильтра в ветви легочной артерии, нижнюю полую вену.
Прогноз и профилактика
При раннем оказании полного объема помощи пациентам прогноз для жизни благоприятный. При выраженных сердечно-сосудистых и дыхательных нарушениях на фоне обширной ТЭЛА летальность превышает 30%. Половина рецидивов ТЭЛА развивается у пациентов, не получавших антикоагулянты. Своевременная, правильно проведенная антикоагулянтная терапия вдвое снижает риск рецидивов ТЭЛА. Для предупреждения тромбоэмболии необходимы ранняя диагностика и лечение тромбофлебита, назначение непрямых антикоагулянтов пациентам из групп риска.
Читайте также:
- Показания для дренирования псевдокисты поджелудочной железы в тощую кишку
- Биодоступность и распределение лекарств. Подбор дозы лекарств
- Болезни Симмондса и Шиена. Поражение глаз при болезни Симмондса и болезни Шиена
- Шланговые противогазы для рабочих. Требования к противогазам на производстве
- Рекомендации по анализу рентгенограммы грудины в боковой проекции
