Аплазия кроветворной ткани. Абберации клеток костного мозга при острой лучевой болезни
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.

Аплазия костного мозга (или аплазия кроветворения) - это синдромы недостаточности костного мозга, которые включают группу расстройств, при которых резко подавляется функция кроветворения, которую выполняет костный мозг. Следствием данного нарушения является развитие панцитопении (наблюдается дефицит всех кровяных клеток: лейкоцитов, эритроцитов, а также тромбоцитов). Глубокая панцитопения является опасным для жизни состоянием.
Код по МКБ-10
Эпидемиология
Аплазия костного мозга встречается у людей с частотой 2,0/1 000 000 людей ежегодно. Данный показатель меняется в зависимости от страны, поэтому может быть разброс в пределах 0,6-3,0+/1 000 000 людей за ежегодно.
Причины аплазии костного мозга
Среди причин аплазии костного мозга выделяют такие:
- Химио- и лучевая терапия.
- Аутоиммунные нарушения.
- Экологически вредные условия труда.
- Различные вирусные инфекции.
- Контакт с гербицидами и инсектицидами.
- Некоторые лекарства, к примеру, препараты, лечащие ревматоидный артрит, или антибиотики.
- Ночная гемоглобинурия.
- Гемолитическая анемия.
- Болезни соединительной ткани.
- Беременность - костный мозг поражается вследствие извращенной реакции иммунной системы.
Факторы риска
Среди факторов риска аплазии костного мозга выделяются описанные ниже.
- химические соединения: цитостатики - они способствуют прекращению деления клеток, их обычно используют для терапии опухолей. Определённая дозировка таких препаратов может повредить костный мозг, нарушив образование кровяных клеток; иммунодепрессанты - подавляют иммунную систему организма, их используют, когда наблюдается избыточная активация иммунитета, при которой повреждаются собственные здоровые ткани. Если отменить их приём, кроветворение зачастую восстанавливается;
- вещества, которые воздействуют на организм, если у больного имеется к ним индивидуальная гиперчувствительность. Это антибиотики (антибактериальные лекарства), бензин, ртуть, различные красители, хлорамфеникол, а также препараты золота. Такие вещества способны вызвать и обратимое, и необратимое разрушение функции костного мозга. Они могут попасть в организм через кожный покров, при дыхании аэрозольным способом, перорально - вместе с водой и едой;
- облучение ионными частицами (радиация) - к примеру, если нарушены правила техники безопасности на АЭС или в медучреждениях, где проводится лечение опухолей при помощи лучевой терапии;
- вирусные инфекции - такие, как грипп, вирус гепатита и пр.
Патогенез
Патогенез аплазии костного мозга пока не изучен полностью. В наши дни рассматривается несколько различных механизмов его развития:
- Костный мозг поражается через полипотентную стволовую клетку;
- Кроветворный процесс подавляется из-за воздействия на него гуморальных или клеточных иммунных механизмов;
- Компоненты микроокружения начинают функционировать неправильно;
- Развитие дефицита факторов, которые способствуют кроветворному процессу.
- Мутации в генах, вызывающие наследственные синдромы недостаточности костного мозга.
При данном заболевании содержание компонентов (это витамин B12, железо, а также протопорфирин), которые непосредственно участвуют кроветворении, не уменьшается, но в то же время кроветворная ткань не может их использовать.
Симптомы аплазии костного мозга
Аплазия костного мозга проявляется в зависимости от того, какой клеточный элемент крови был поражён:
- Если наблюдается понижение уровня эритроцитов, появляется одышка и общая слабость и другие симптомы анемии;
- Если понижается уровень лейкоцитов, возникает лихорадка и повышается восприимчивость организма к инфекциям;
- Если снижен уровень тромбоцитов, появляется склонность к развитию геморрагического синдрома, возникновению петехий, а также к кровотечениям.
При парциальной красноклеточной аплазии костного мозга наблюдаются резкое снижение выработки эритроцитов, глубокая ретикулоцитопения, а также изолированная нормохромная анемия.
Существует врождённая и приобретённая формы данного заболевания. Вторая проявляется под видом приобретённого первичного эритробластофтиза, а также синдрома, возникающего при иных заболеваниях (это может быть рак лёгких, гепатит, лейкоз, инфекционный мононуклеоз или пневмония, а также серповидноклеточная анемия, паротит или язвенный колит и пр.).
Осложнения и последствия
Среди осложнений аплазии костного мозга:
- Анемическая кома, при которой происходит потеря сознания, развитие коматозного состояния. Отсутствует реакция на любые внешние раздражители, так как кислород не поступает в головной мозг в нужных количествах - это происходит из-за того, что уровень эритроцитов в крови быстро и значительно уменьшается;
- Начинаются разнообразные кровотечения (геморрагические осложнения). Наихудшим вариантом в этом случае является геморрагический инсульт (некоторая часть головного мозга пропитывается кровью и вследствие этого погибает);
- Инфекции - микроорганизмы (разнообразные грибки, бактерии или вирусы) становятся причиной возникновения инфекционных болезней;
- Нарушение функционального состояния некоторых внутренних органов (таких, как почки или сердце), особенно при сопуствующей хронической патологии.
Диагностика аплазии костного мозга
При диагностике аплазии костного мозга проводится изучение анамнеза болезни, а также жалоб пациента: насколько давно появились симптомы заболевания, и с чем больной связывает их появление.
Далее выясняется анамнез жизни:
- Наличие у пациента сопутствующих хронических болезней.
- Наличие наследственных болезней.
- Есть ли у больного вредные привычки.
- Уточняется, проводился ли недавно длительный приём каких-либо лекарств.
- Наличие у пациента опухолей.
- Был ли контакт с различными токсическими элементами.
- Оказывалось ли на больного воздействие лучевого облучения или иных радиационных факторов.
После этого проводится физикальный осмотр. Определяется цвет кожи (при аплазии костного мозга наблюдается бледность), определяется частота пульса (чаще всего он учащён) и показатели АД (оно пониженное). Обследуются слизистые оболочки и кожные покровы на предмет наличия кровоизлияний и гнойных пузырьков и пр.
Анализы
В процессе диагностики заболевания проводятся и некоторые лабораторные исследования.
Выполняется анализ крови - если у пациента аплазия костного мозга, будет выявлено понижение уровня гемоглобина, а также количества эритроцитов. Цветовой показатель кровипри этом остаётся в норме. Уменьшается число тромбоцитов с лейкоцитами, а помимо этого нарушается правильное соотношение лейкоцитов, потому как уменьшается содержание гранулоцитов.
Проводится также анализ мочи, чтобы определить наличие эритроцитов в моче - это является признаком геморрагического синдрома, либо наличие лейкоцитов и микроорганизмов, что является симптомом развития в организме инфекционных осложнений.
Проводится также и биохимический анализ крови. Благодаря нему выясняются показатели глюкозы, холестерина, мочевой кислоты (чтобы выявить сопутствующее поражение каких-либо органов), креатинина, а также электролитов (натрия, калия и кальция).
Инструментальная диагностика
При инструментальной диагностике проводятся следующие процедуры.
С целью обследования костного мозга выполняется пункция (прокалывание, при котором извлекается внутреннее содержимое) какой-либо кости, обычно таковой является грудина или тазобедренная кость. С помощью микроскопического обследования определяется замещения кроветворной ткани на рубцовую либо жировую.
Трепанобиопсия, при которой обследуется костный мозг, а также его соотношение с находящимися рядом тканями. Во время данной процедуры используется специальный аппарат, который называется трепан - с его помощью из подвздошной кости берётся столбик костного мозга вместе с надкостницей, а также костью.
Электрокардиография, которая позволяет выявить проблемы с питанием сердечной мышцы, сердечным ритмом.
Какие анализы необходимы?
Дифференциальная диагностика
Дифференциальная диагностика проводится с такими заболеваниями:
- ; (а также у детей транзиторная эритробластопения); ; ;
- Острый, а также волосатоклеточный лейкоз; ; ;
- Развившаяся вследствие гипопитуитаризма, гипотиреоза или болезней печени анемия.
К кому обратиться?
Лечение аплазии костного мозга
Устранить болезнь при помощи этиотропного лечения (воздействовав на его причину) почти невозможно. Может помочь устранение провоцирующего фактора (например, отмена принимаемого лекарственного препарата, выезд из зоны радиации и пр.), но в этом случае лишь снижается скорость гибели костного мозга, а вот стабильное кроветворение этим способом восстановить не удаётся.
Иммуносупрессивное лечение проводится, если нельзя провести трансплантацию (нет подходящего больному донора). В этом случае используются лекарства из групп циклоспорина А либо антилимфоцитарного глобулина. Иногда их применяют совместно.
Применение ГМ-КСФ (лекарства, которые стимулируют выработку лейкоцитов). Это лечение используют, если количество лейкоцитов падает до уровня менее 2х109 г/л. Также в этом случае могут применяться кортикостероидные лекарственные средства.
Применяются анаболические стероиды, которые стимулируют образование белка.
В процессе лечения аплазии костного мозга применяются такие методы:
Выполняется переливание отмытыми эритроцитами (это донорские эритроциты, которые освобождают от белков) - этот метод уменьшает выраженность и количество негативных реакций на процедуру переливания. Делают такое переливание только, если существует угроза жизни больного. Таковыми являются следующие состояния:
- пациент впадает в анемическую кому;
- анемия тяжёлой степени тяжести (в этом случае показатель уровня гемоглобина падает ниже отметки 70 г/л).
Переливание донорских тромбоцитов осуществляют, если у пациента наблюдаются кровотечения и явно выраженное уменьшение числа тромбоцитов.
Кровоостанавливающую терапию проводят в зависимости от области, в которой началось кровотечение.
При возникновении инфекционных осложнений проводятся таки методы терапии:
- антибактериальное лечение. Его выполняют после того, как взяты мазки из носоглотки, а также моча и кровь на посев, чтобы определить, какой микроорганизм стал причиной возникновения инфекции, а также выявить его чувствительность к антибиотикам;
- обязательно выполняется системное противогрибковое лечение;
- местная обработка антисептиком участков, которые могут стать входными воротами инфекции (это те места, через которые бактерии, грибки или вирусы попадают в организм). Под такими процедурами обычно подразумевают полоскание рта с использованием по очереди разных лекарств.
Лекарства
При аплазии костного мозга обязательно используется медикаментозное лечение. Чаще всего применяют препараты, относящиеся к 3 лекарственным группам: это цитостатики (6-меркаптопурил, циклофосфан, метотрексат, циклоспорин А, а также имуран), иммунодепрессанты (дексаметазон, а также метилпреднизолон) и антибиотики (макролиды, цефалоспорины, хлорхинолоны, а также азалиды). Иногда могут применяться лекарства, корректирующие нарушения кишечной микрофлоры и проблемы с АД, ферментные лекарства и пр.
Метилпреднизолон прописывают внутрь. При пересадке органов - в дозировке не более 0,007 г/сут.
Побочные эффекты лекарственного препарата: вода, а также натрий могут задерживаться в организме, повышается АД, может наблюдаться потеря калия, остеопороз, мышечная слабость, лекарственный гастрит; может снижаться сопротивляемость разным инфекциям; подавление деятельности надпочечников, некоторые психические расстройства, проблемы с менструальным циклом.
Лекарство противопоказано при тяжёлой стадии гипертонической болезни; при 3 стадии недостаточности кровообращения, а кроме этого при беременности и остром эндокардите, а также нефритах, различных психозах, остеопорозе, язвах 12перстной кишки или желудка; после недавней операции; при активной стадии туберкулёза, сифилисе; людям пожилого возраста, а также детям младше 12 лет.
Метилпреднизолон с осторожностью назначают при наличии сахарного диабета, только если имеются абсолютные показания либо для лечения у пациентов с резистентностью к инсулину, с высокими титрами антиинсулиновых антител. При туберкулёзе или инфекционных болезнях использовать лекарство можно, лишь комбинируя его с антибиотиками либо препаратами, лечащими туберкулёз.
Имуран - в первый день разрешено применять дозу не более 5 мг на 1 кг веса человека в сутки (необходимо употребить в 2-3 приёма), но дозировка в целом зависит от режима иммуносупрессии. Размер поддерживающей дозы - 1-4 мг/кг веса в сутки. Её устанавливают в зависимости от толерантности организма пациента и его клинического состояния. Исследования указывают, что лечение с применением Имурана нужно проводить длительным курсом, даже применяя маленькие дозы.
При передозировке могут появиться язвы в горле, кровотечения и синяки, а также инфекции. Такие признаки более характерны при хронической передозировке.
Побочные эффекты - после пересадки костного мозга при лечении азатиоприном в сочетании с другими иммуносупрессорами у пациентов часто наблюдаются бактериальные, грибковые или вирусные инфекции. Среди прочих побочных реакций - аритмия, признаки менингизма, головные боли, поражение губ и ротовой полости, парестезии и пр.
Циклоспорин А применяют внутривенно - суточная доза разделяется на 2 приёма и вводится за 2-6 ч. Для начальной суточной дозы достаточно 3-5 мг/кг. Внутривенное применение является оптимальным в процессе лечения пациентов, которым была совершена трансплантация костного мозга. Перед пересадкой (4-12 час. однократно перед операцией) пациенту дают внутрь дозу 10-15 мг/кг, и далее такую же суточную дозу применяют последующие 1-2 нед. Позже дозу снижают до обычной поддерживающей (примерно 2-6 мг/кг).
Симптомами передозировки являются сонливость, сильная рвота, тахикардия, головные боли, развитие тяжёлой почечной недостаточности.
При приёме Циклоспорина необходимо следовать следующим мерам предосторожности. Терапию должны проводить в стационаре врачами, которые обладают большим опытом в лечении пациентов иммунодепрессантами. Нужно помнить, что вследствие приёма Циклоспорина предрасположенность к развитию злокачественных лимфопролиферативных опухолей возрастает. Именно поэтому нужно перед началом приёма решить, оправдывает ли положительный эффект от его лечения все сопряжённые с этим риски. При беременности препарат разрешается использовать лишь ввиду строгих показаний. Так как существует риск появления анафилактоидных реакций в результате внутривенного приёма, следует в целях профилактики принимать антигистаминные препараты, а также максимально быстро перевести пациента на пероральный способ введения лекарства.
Витамины
Если у больного наблюдаются кровотечения, помимо гемотерапии следует принимать 10% раствор хлористого кальция (внутрь), а также витамин К (в сутки по 15-20 мг). Кроме того, назначается аскорбиновая кислота в больших количествах (0,5-1 г/сут.) и витамин Р (в дозировке 0,15-0,3 г/сут.). Рекомендовано принимать фолиевую кислоту в больших дозах (максимум 200 мг/сут.), а также витамин В6, желательно в форме инъекций (по 50 мг пиридоксина ежедневно).
Физиотерапевтическое лечение
Чтобы активизировать работу костного мозга, применяется физиотерапевтическое лечение - диатермия трубчатых костей в области голеней либо грудины. Процедуру нужно проводить каждый день в течение 20 мин. Следует отметить, что этот вариант возможен только, если отсутствует выраженная кровоточивость.
Оперативное лечение
Пересадку костного мозга проводят в случае тяжёлой стадии аплазии. Результативность подобной операции повышается, если пациент находится в молодом возрасте, а также ему было выполнено малое количество переливаний элементов донорской крови (не больше 10-ти).
При таком лечении проводится извлечение у донора костного мозга и дальнейшая его пересадка реципиенту. Прежде, чем взвесь стволовых клеток будет введена, их обрабатывают при помощи цитостатиков.
После проведения пересадки пациенту предстоит длительный курс иммуносупрессивного лечения, которое необходимо для предотвращения возможного отторжения трансплантата организмом, а также предотвращения иных негативных иммунных реакций.
Лучевая болезнь
Лучевая болезнь - комплекс общих и местных реактивных изменений, обусловленных воздействием повышенных доз ионизирующего излучения на клетки, ткани и среды организма. Лучевая болезнь протекает с явлениями геморрагического диатеза, неврологической симптоматикой, гемодинамическими нарушениями, склонностью к инфекционным осложнениям, желудочно-кишечными и кожными поражениями. Диагностика основывается на результатах дозиметрического контроля, характерных изменениях в гемограмме, биохимических анализах крови, миелограмме. В острой стадии лучевой болезни проводится дезинтоксикация, гемотрансфузии, антибиотикотерапия, симптоматическая терапия.



Общие сведения
Лучевая болезнь - общее заболевание, вызываемое влиянием на организм радиоактивного излучения в диапазоне, превышающем предельно допустимые дозы. Протекает с поражением кроветворной, нервной, пищеварительной, кожной, эндокринной и других систем. В течение жизни человек постоянно подвергается воздействию малых доз ионизирующего излучения, исходящего как от внешних (естественных и техногенных), так и внутренних источников, проникающих в организм при дыхании, потреблении воды и пищи и накапливающихся в тканях. Т. о., при нормальном радиационном фоне с учетом вышеназванных факторов суммарная доза ионизирующего излучения обычно не превышает 1-3 мЗв (мГр)/год и считается безопасной для населения. Согласно заключению Международной комиссии по радиологической защите, при превышении порога облучения более 1,5 Зв/год или однократном получении дозы 0,5 Зв может развиться лучевая болезнь.

Причины лучевой болезни
Лучевые поражения могут возникать вследствие однократного (либо кратковременного) облучения высокой интенсивности или длительного воздействия низких доз радиации. Высокоинтенсивное поражающее воздействие характерно для техногенных катастроф в атомной энергетике, испытаний или применения ядерного оружия, проведения тотального облучения в онкологии, гематологии, ревматологии и пр. Хроническая лучевая болезнь может развиваться у медицинского персонала отделений лучевой диагностики и терапии (рентгенологов, радиологов), больных, подвергающихся частым рентгенологическим и радионуклидным исследованиям.
Поражающими факторами могут выступать альфа- и бета-частицы, гамма-лучи, нейтроны, рентгеновские лучи; возможно одновременное воздействие различных видов лучевой энергии - так называемое смешанное облучение. При этом поток нейтронов, рентгеновское и гамма-излучение способны вызывать лучевую болезнь при внешнем воздействии, тогда как альфа- и бета-частицы вызывают поражение только при попадании внутрь организма через дыхательный или пищеварительный тракт, поврежденную кожу и слизистые оболочки.
Лучевая болезнь является результатом повреждающего воздействия, происходящего на молекулярном и клеточном уровне. В результате сложных биохимических процессов в крови появляются продукты патологического жирового, углеводного, азотистого, водно-солевого обмена, вызывающие лучевую токсемию. Поражающие эффекты, прежде всего, затрагивают активно делящиеся клетки костного мозга, лимфоидной ткани, желез внутренней секреции, эпителий кишечника и кожи, нейроны. Это обуславливает развитие костномозгового, кишечного, токсемического, геморрагического, церебрального и других синдромов, составляющих патогенез лучевой болезни.
Особенность лучевого поражения заключается в отсутствии в момент непосредственного воздействия тепловых, болевых и иных ощущений, наличии латентного периода, предшествующего развитию развернутой картины лучевой болезни.

Классификация
В основу классификации лучевой болезни положены критерии времени поражения и дозы поглощенной радиации. При однократном массивном воздействии ионизирующего излучения развивается острая лучевая болезнь, при длительном, повторяющемся в относительно малых дозах - хроническая лучевая болезнь. Степень тяжести и клиническая форма острого лучевого поражения определяются дозой облучения:
Лучевая травма возникает при одномоментном/кратковременном облучении дозой менее 1 Гр; патологические изменения носят обратимый характер.
Костномозговая форма (типичная) развивается при одномоментном/кратковременном облучении дозой 1-6 Гр. Летальность составляет 50%. Имеет четыре степени:
- 1 (легкая) - 1-2 Гр
- 2 (средняя) - 2-4 Гр
- 3 (тяжелая) - 4-6 Гр
- 4 (крайне тяжелая, переходная) - 6-10 Гр
Желудочно-кишечная форма является результатом одномоментного/кратковременного облучения дозой 10-20 Гр. Протекает с тяжелым энтеритом, кровотечениями из ЖКТ, лихорадкой, инфекционно-септическими осложнениями.
Сосудистая (токсемическая) форма манифестирует при одномоментном/кратковременном облучение дозой 20-80 Гр. Характеризуется тяжелой интоксикацией и гемодинамическими нарушениями.
Церебральная форма развивается при одномоментном/кратковременном облучении дозой свыше 80 Гр. Летальный исход наступает на 1-3 сутки после облучения от отека мозга.
Течение типичной (костномозговой) формы острой лучевой болезни проходит IV фазы:
- I - фаза первичной общей реактивности - развивается в первые минуты и часы после лучевого воздействия. Сопровождается недомоганием, тошнотой, рвотой, артериальной гипотонией и др.
- II - латентная фаза - первичная реакция сменяется мнимым клиническим благополучием с улучшением субъективного состояния. Начинается с 3-4 суток и продолжается до 1 месяца.
- III - фаза развернутых симптомов лучевой болезни; протекает с геморрагическим, анемическим, кишечным, инфекционным и др. синдромами.
- IV - фаза восстановления.
Хроническая лучевая болезнь в своем развитии проходит 3 периода: формирования, восстановления и последствий (исходов, осложнений). Период формирования патологических изменений длится 1-3 года. В эту фазу развивается характерный для лучевого поражения клинический синдром, тяжесть которого может варьировать от легкой до крайне тяжелой степени. Период восстановления обычно начинается спустя 1-3 года после значительного уменьшения интенсивности или полного прекращения лучевого воздействия. Исходом хронической лучевой болезни может являться выздоровление, неполное восстановление, стабилизация полученных изменений или их прогрессирование.
Симптомы лучевой болезни
Острая лучевая болезнь
В типичных случаях лучевая болезнь протекает в костномозговой форме. В первые минуты и часы после получения высокой дозы радиации, в I фазу лучевой болезни, у пострадавшего возникает слабость, сонливость, тошнота и рвота, сухость или горечь во рту, головная боль. При одномоментном облучении в дозе свыше 10 Гр возможно развитие лихорадки, поноса, артериальной гипотонии с потерей сознания. Из местных проявлений может отмечаться преходящая кожная эритема с синюшным оттенком. Со стороны периферической крови ранние изменения характеризуются реактивным лейкоцитозом, который на вторые сутки сменяется лейкопенией и лимфопенией. В миелограмме определяется отсутствие молодых клеточных форм.
В фазу кажущегося клинического благополучия признаки первичной реакции исчезают, и самочувствие пострадавшего улучшается. Однако при объективной диагностике определяется лабильность АД и пульса, снижение рефлексов, нарушение координации, появление медленных ритмов по данным ЭЭГ. Через 12-17 суток после лучевого поражения начинается и прогрессирует облысение. В крови нарастает лейкопения, тромбоцитопения, ретикулоцитопения. Вторая фаза острой лучевой болезни может продолжаться от 2-х до 4-х недель. При дозе облучения свыше 10 Гр первая фаза может сразу же перейти в третью.
В фазе выраженной клинической симптоматики острой лучевой болезни развиваются интоксикационный, геморрагический, анемический, инфекционный, кожный, кишечный, неврологический синдромы. С началом третьей фазы лучевой болезни наступает ухудшение состояния пострадавшего. При этом вновь усиливаются слабость, лихорадка, артериальная гипотензия. На фоне глубокой тромбоцитопении развиваются геморрагические проявления, включающие кровоточивость десен, носовые кровотечения, желудочно-кишечные кровотечения, кровоизлияния в ЦНС и пр. Следствием поражения слизистых оболочек служит возникновение язвенно-некротического гингивита, стоматита, фарингита, гастроэнтерита. Инфекционные осложнения при лучевой болезни чаще всего включают ангины, пневмонии, легочные абсцессы.
При высокодозном облучении развивается лучевой дерматит. В этом случае на коже шеи, локтевых сгибов, подмышечной и паховой области формируется первичная эритема, которая сменяется отеком кожи с образованием пузырей. В благоприятных случаях лучевой дерматит разрешается с образованием пигментации, рубцов и уплотнения подкожной клетчатки. При заинтересованности сосудов возникают лучевые язвы, некрозы кожи. Выпадение волос носит распространенный характер: отмечается эпиляция волос на голове, груди, лобке, потеря ресниц и бровей. При острой лучевой болезни происходит глубокое угнетение функции желез внутренней секреции, главным образом, щитовидной железы, гонад, надпочечников. В отдаленном периоде лучевой болезни отмечено учащение развития рака щитовидной железы.
Поражение ЖКТ может протекать в форме лучевого эзофагита, гастрита, энтерита, колита, гепатита. При этом наблюдается тошнота, рвота, боли в различных отделах живота, диарея, тенезмы, примесь крови в кале, желтуха. Неврологический синдром, сопутствующий течению лучевой болезни, проявляется нарастающей адинамией, менингеальной симптоматикой, спутанностью сознания, снижением мышечного тонуса, повышением сухожильных рефлексов.
В фазу восстановления постепенно улучшается самочувствие, и частично нормализуются нарушенные функции, однако длительное время у пациентов сохраняется анемия и астеновегетативный синдром. Осложнения и остаточные поражения острой лучевой болезни могут включать развитие катаракты, цирроза печени, бесплодия, неврозов, лейкемии, злокачественных опухолей различных локализаций.

Хроническая лучевая болезнь
При хронической форме лучевой болезни патологические эффекты разворачиваются медленнее. Ведущими являются неврологические, сердчно-сосудистые, эндокринные, желудочно-кишечные, обменные, гематологические нарушения.
Легкая степень хронической лучевой болезни характеризуется неспецифическими и функционально обратимыми изменениями. Больные ощущают слабость, снижение работоспособности, головные боли, нарушения сна, неустойчивость эмоционального фона. В числе постоянных признаков - снижение аппетита, диспепсический синдром, хронический гастрит с пониженной секрецией, дискинезии желчевыводящих путей. Эндокринная дисфункция при лучевой болезни выражается в снижение либидо, нарушениях менструального цикла у женщин, импотенции у мужчин. Гематологические изменения неустойчивы и не резко выражены. Течение легкой степени хронической лучевой болезни благоприятно, возможно выздоровление без последствий.
При средней степени лучевого поражения отмечаются более выраженные вегетативно-сосудистые расстройства и астенические проявления. Отмечаются головокружения, повышенная эмоциональная лабильность и возбудимость, ослабление памяти, возможны приступы потери сознания. Присоединяются трофические нарушения: алопеция, дерматиты, деформации ногтей. Сердечно-сосудистые нарушения представлены стойкой артериальной гипотензией, пароксизмальной тахикардией. Для II степени тяжести хронической лучевой болезни характерны геморрагические явления: множественные петехии и экхимозы, рецидивирующие носовые и десневые кровотечения. Типичными гематологическими изменениями выступают лейкопения, тромбоцитопения; в костном мозге - гипоплазия всех кроветворных ростков. Все изменения носят стойкий характер.
Тяжелая степень лучевой болезни характеризуется дистрофическими изменениями в тканях и органах, которые не компенсируются регенерационными возможностями организма. Клинические симптомы носят прогрессирующее развитие, дополнительно присоединяются интоксикационный синдром и инфекционные осложнения, в т. ч. сепсис. Имеют место резкая астенизация, упорные головные боли, бессонница, множественные кровоизлияния и повторные кровотечения, расшатывание и выпадение зубов, язвенно-некротические изменения слизистых, тотальное облысение. Изменения со стороны периферической крови, биохимических показателей, костного мозга носят глубоко выраженный характер. При IV, крайне тяжелой степени хронической лучевой болезни, прогрессирование патологических сдвигов происходит неуклонно и быстро, приводя к неминуемому смертельному исходу.
Диагностика лучевой болезни
Развитие лучевой болезни можно предположить на основании картины первичной реакции, хронологии развития клинических симптомов. Облегчает диагностику установление факта лучевого поражающего воздействия и данные дозиметрического контроля.
Степень тяжести и стадийность поражения можно определить по изменению картины периферической крови. При лучевой болезни отмечается нарастание лейкопении, анемии, тромбоцитопении, ретикулоцитопении, повышение СОЭ. При анализе биохимических показателей в крови обнаруживается гипопротеинемия, гипоальбуминемия, электролитные нарушения. В миелограмме выявляются признаки выраженного угнетения кроветворения. При благоприятном течении лучевой болезни в фазе восстановления начинается обратное развитие гематологических изменений.
Вспомогательное значение имеют другие лабораторно-диагностические данные (микроскопия соскобов язв кожи и слизистых, посев крови на стерильность), инструментальные исследования (ЭЭГ, электрокардиография, УЗИ органов брюшной полости, малого таза, щитовидной железы и др.), консультации узкопрофильных специалистов (гематолога, невролога, гастроэнтеролога, эндокринолога и др.).
Лечение лучевой болезни
При острой лучевой болезни больного госпитализируют в стерильный бокс, обеспечивая асептические условия и постельный режим. Первоочередные меры включают ПХО ран, деконтаминацию (промывание желудка, постановку клизмы, обработку кожи), введение противорвотных средств, устранение коллапса. При внутреннем облучении показано введение препаратов, нейтрализующих известные радиоактивные вещества. В первые сутки после появления признаков лучевой болезни проводится мощная дезинтоксикационная терапия (инфузии солевых, плазмозамещающих и солевых растворов), форсированный диурез. При явлениях некротической энтеропатии назначается голод, парентеральное питание, обработка слизистой полости рта антисептиками.
В целях борьбы с геморрагическим синдромом проводятся гемотрансфузии тромбоцитарной и эритроцитарной массы. При развитии ДВС-синдрома осуществляется переливание свежезамороженной плазмы, плазмаферез. В целях профилактики инфекционных осложнений назначается антибиотикотерапия. Тяжелая форма лучевой болезни, сопровождаемая аплазией костного мозга, является показанием к его трансплантации. При хронической лучевой болезни терапия носит, главным образом, симптоматический характер.
Прогноз и профилактика
Прогноз лучевой болезни напрямую связан с массивностью полученной дозы радиации и временем поражающего воздействия. Больные, пережившие критический срок в 12 недель после облучения, имеют шансы на благоприятный прогноз. Однако даже при нелетальном лучевом поражении у пострадавших впоследствии могут возникать гемобластозы, злокачественные новообразования различной локализации, а у потомства выявляться различные генетические аномалии.
В целях предупреждения лучевой болезни лица, находящиеся в зоне радиоизлучения, должны использовать средств индивидуальной радиационной защиты и контроля, препараты-радиопротекторы, снижающие радиочувствительность организма. Лица, контактирующие с источниками ионизирующего излучения, должны проходить периодические медицинские осмотры с обязательным контролем гемограммы.
Методика проведение миелограммы (исследования красного костного мозга)

Для исследования красного костного мозга производят пункцию грудины или подвздошной кости, из пунктата готовят мазки для цитологического анализа. При аспирации костного мозга всегда происходит попадание крови, тем больше, чем больше получено аспирата. Пунктат обычно оказывается разведённым периферической кровью не более чем в 2,5 раз. Признаки большей степени разведения костного мозга периферической кровью следующие:
- Бедность пунктата клеточными элементами.
- Отсутствие мегакариоцитов.
- Резкое увеличение лейко-, эритробластического соотношения (при соотношении 20:1 и выше исследование пунктата не проводят).
- Снижение индекса созревания нейтрофилов до 0,4-0,2.
- Приближение относительного содержания сегментоядерных нейтрофилов и/или лимфоцитов к таковому в периферической крови.
При исследовании красного костного мозга подсчитывают процентное содержание костномозговых элементов, а также определяют абсолютное содержание миелокариоцитов и мегакариоцитов.
- Миелокариоциты. Уменьшение содержания миелокариоцитов наблюдают при гипопластических процессах различной этиологии, воздействии на организм человека ионизирующего излучения, некоторых химических веществ и лекарств и др. Особенно резко количество ядерных элементов снижается при апластических процессах. При развитии миелофиброза, миелосклероза костномозговой пунктат скуден и количество ядерных элементов в нём также снижено. При наличии между костномозговыми элементами синцитиальной связи (в частности, при миеломной болезни) костномозговой пунктат получают с трудом, поэтому содержание ядерных элементов в пунктате может не соответствовать истинному количеству миелокариоцитов в костном мозге. Высокое содержание миелокариоцитов наблюдают при лейкозах, витамин В12-дефицитных анемиях, гемолитических и постгеморрагических анемиях, то есть при заболеваниях, сопровождающихся гиперплазией костного мозга.
- Мегакариоциты и мегакариобласты выявляют в небольших количествах, они располагаются по периферии препарата, определение их процентного отношения в миелограмме не отражает истинного положения, поэтому их не подсчитывают. Обычно проводят лишь ориентировочную, cубъективную оценку относительного сдвига в направлении более молодых или зрелых форм. Увеличение количества мегакариоцитов и мегакариобластов могут вызывать миелопролиферативные процессы и метастазы злокачественных новообразований в костный мозг (особенно при раке желудка). Содержание мегакариоцитов возрастает также при идиопатической аутоиммунной тромбоцитопении, лучевой болезни в период восстановления, хроническом миелолейкозе. Уменьшение количества мегакариоцитов и мегакариобластов (тромбоцитопении) могут вызывать гипопластические и апластические процессы, в частности, при лучевой болезни, иммунные и аутоиммунные процессы, метастазы злокачественных новообразований (редко). Содержание мегакариоцитов снижается также при острых лейкозах, В12-дефицитных анемиях, миеломной болезни, системной красной волчанки.
- Бластные клетки: увеличение их количества с появлением полиморфных уродливых форм на фоне клеточного или гиперклеточного красного костного мозга характерно для острых и хронических лейкозов.
- Мегалобласты и мегалоциты разных генераций, крупные нейтрофильные миелоциты, метамиелоциты, гиперсегментированные нейтрофилы характерны для витамин В12-дефицитной и фолиеводефицитной анемий.
- Миелоидные элементы: увеличение количества их зрелых и незрелых форм (реактивный костный мозг) вызывают интоксикации, острое воспаление, гнойные инфекции, шок, острая кровопотеря, туберкулёз, злокачественные новообразования. Промиелоцитарно-миелоцитарный костный мозг с уменьшением количества зрелых гранулоцитов на фоне клеточной или гиперклеточной реакции может вызвать миелотоксические и иммунные процессы. Резкое уменьшение содержания гранулоцитов на фоне снижения миелокариоцитов характерно для агранулоцитоза.
- Эозинофилия костного мозга возможна при аллергии, глистных инвазиях, злокачественных новообразованиях, острых и хронических миелоидных лейкозах, инфекционных заболеваниях.
- Моноцитоидные клетки: увеличение их количества выявляют при острых и хронических моноцитарных лейкозах, инфекционном мононуклеозе, хронических инфекциях, злокачественных новообразованиях.
- Атипичные мононуклеары: увеличение их количества на фоне уменьшения зрелых миелокариоцитов могут вызывать вирусные инфекции (инфекционный мононуклеоз, аденовирус, грипп, вирусный гепатит, краснуха, корь и др.).
- Лимфоидные элементы: увеличение их количества, появление голоядерных форм (тени Гумпрехта) при повышении клеточности красного костного мозга могут вызывать лимфопролиферативные заболевания (хронический лимфолейкоз, макроглобулинемия Вальденстрёма, лимфосаркомы).
- Плазматические клетки: увеличение их количества с появлением полиморфизма, двуядерных клеток, изменение окраски цитоплазмы могут вызывать плазмоцитомы (плазмобластомы, а также реактивные состояния).
- Эритрокариоциты: увеличение их количества без нарушения созревания наблюдают при эритремии. Увеличение содержания эритрокариоцитов и уменьшение лейкоэритросоотношения могут вызывать постгеморрагические анемии и большинство гемолитических анемий. Уменьшение содержания эритрокариоцитов при снижении общего количества миелокариоцитов и небольшого (относительного) увеличения бластных клеток, лимфоцитов, плазмоцитов вызывают гипоапластические процессы.
- Раковые клетки и их комплексы выявляют при метастазах злокачественных опухолей.
Для оценки миелограммы важно не столько определение количества костномозговых элементов и их процентного содержания, сколько их взаимное соотношение. Судить о составе миелограммы следует по специально рассчитанным костномозговым индексам, характеризующим эти соотношения.
Миелофиброз ( Агногенная миелоидная метаплазия , Сублейкемический миелоз )
Миелофиброз - это хроническое гематологическое заболевание, характеризующееся опухолевой пролиферацией гемопоэтических стволовых клеток и фиброзом костного мозга. Основные клинические проявления включают симптомы опухолевой интоксикации и анемического синдрома (прогрессирующую слабость, бледность кожи и слизистых оболочек, потерю веса), а также увеличение селезенки (спленомегалию). Диагноз устанавливается на основании молекулярно-генетических исследований, изучения гистологической картины костного мозга. Лечение проводится с помощью химиотерапевтических препаратов. Хирургические методы лечения подразумевают трансплантацию костного мозга и удаление селезенки.
МКБ-10


Миелофиброз (агногенная миелоидная метаплазия, сублейкемический миелоз) - злокачественное заболевание, при котором происходит постепенное замещение костного мозга опухолевыми стволовыми клетками и разрастающейся соединительной тканью. Впервые эту патологию описал немецкий врач Г. Хойк в 1879 году. А в 1951 году американским гематологом Уильямом Дамешеком миелофиброз был выделен в самостоятельную нозологическую единицу. При неблагоприятном течении миелофиброз способен трансформироваться в более тяжелую болезнь ‒ острый лейкоз. Распространенность миелофиброза составляет от 0,3 до 0,7 случаев на 100 тыс. населения. Пик заболеваемости приходится на возраст от 50 до 70 лет, но встречаются и молодые пациенты. Чаще страдают мужчины.

Причины миелофиброза
Существует первичный и вторичный сублейкемический миелоз. Точная причина первичного миелофиброза до сих пор не установлена. Наибольшей популярностью среди специалистов в области гематологии пользуется теория влияния генетической мутации. У большинства пациентов выявляются мутации гена тирозинкиназы (JAK2V617F), кальретикулина (CALR), тромбопоэтина (MPL), регулирующих экспрессию белков JAK-STAT сигнального пути. Гены локализуются в локусе хромосомы del3p24.
В качестве этиологического фактора изучается действие большой дозы радиоактивного излучения. Также рассматривается роль персистирующих вирусных инфекций (вируса простого герпеса, Эпштейна-Барра, цитомегаловируса), длительного приема оральных контрацептивов, миелосупрессивных лекарственных препаратов, контакта с различными органическими и неорганическими соединениями (бензолом, мышьяком). Вторичный миелофиброз развивается как исход других хронических миелопролиферативных заболеваний - истинной полицитемии, эссенциальной тромбоцитемии, хронического миелолейкоза.
В результате повышенной экспрессии сигнальных белков в одной из стволовых костномозговых клеток запускается активная пролиферация (опухолевая трансформация). Этот процесс сопровождается вторичным воспалением с выделением цитокинов и факторов роста. Факторы роста фибробластов и эндотелия сосудов индуцируют выработку стромальными клетками костного мозга большого количества коллагена и разрастание соединительной ткани (собственно фиброз). Постепенно нормальная ткань костного мозга замещается опухолью и соединительной тканью.
При массивном поражении опухолью костного мозга клетки крови, не достигнув стадии полного созревания, попадают в системный кровоток. Это приводит к образованию очагов экстрамедуллярного (внекостномозгового) кроветворения, главным образом в печени и селезенке. Распад опухоли ведет к высвобождению мочевой кислоты, которая откладывается в тканях суставов и почечных канальцах.
Симптомы миелофиброза
Длительное время пациент чувствует себя удовлетворительно. Через несколько лет от начала заболевания постепенно появляется опухолевая интоксикация в виде общей слабости, повышения температуры до субфебрильных цифр, потливости, усиливающейся по ночам. У больного снижается аппетит, он стремительно теряет в весе. Присоединяется анемический синдром (бледность кожных покровов, головокружение, учащение сердцебиения). Характерны носовые, десневые кровотечения, геморрагические высыпания на коже. Возникают боли в суставах, кожный зуд, боли в костях.
Пациент ощущает тяжесть и боли в левом подреберье вследствие выраженного увеличения селезенки. На фоне спленомегалии развивается синдром гиперспленизма, который заключается в массивном разрушении клеток крови (в основном эритроцитов) в синусоидах селезенки. В этом случае встречаются признаки гемолиза (желтушность кожи, слизистых оболочек, потемнение мочи).
Редкие симптомы связаны с необычной локализацией очагов экстрамедуллярного кроветворения - в легких (кашель, затруднение дыхания, кровохарканье), желудочно-кишечном тракте (боли в животе, кровавая диарея). При расположении очагов в центральной и периферической нервной системе наблюдаются эпилептические судороги, нарушения чувствительности, слабость движений в конечностях, вплоть до полного паралича.
Осложнения
При миелофиброзе часто образуются тромбы, которые приводят к острому нарушению мозгового кровообращения, инфаркту миокарда, тромбоэмболии легочной артерии. Стойкое снижение уровня лейкоцитов нередко сопряжено с различными инфекциями, приобретающими тяжелое течение. Наиболее неблагоприятным осложнением считается трансформация миелофиброза в миелолейкоз (бластный криз), трудно поддающийся терапии. К нетипичным осложнениям следует отнести патологические переломы из-за деструкции трубчатых костей и портальную гипертензию, причиной которой служит длительная обструкция микротромбами внутрипеченочных вен.
Диагностика
Курацией пациентов с миелофиброзом занимаются врачи-гематологи. При общем осмотре обращает на себя внимание изменение цвета кожных покровов, слизистых (бледность или желтушность), спленомегалия при пальпации и перкуссии селезенки, иногда достигающей гигантских размеров (до лобкового симфиза). Дополнительные методы диагностики включают:
- Общие лабораторные исследования. В начале заболевания в общем анализе крови выявляется увеличение эритроцитов, тромбоцитов, лейкоцитов, со временем сменяющееся на низкие показатели. Часто в периферической крови присутствуют незрелые формы эритроцитов, лейкоцитов (миелоциты, промиелоциты). В биохимическом анализе крови наблюдаются повышенные концентрации лактатдегидрогеназы (ЛДГ), ионизированного кальция. Отмечаются изменения коагулограммы - ускорение свертывания крови, уменьшение активированного частичного тромбопластинового времени, торможение процессов фибринолиза. В анализе мочи обнаруживаются уробилин, гемоглобин, ураты (соли мочевой кислоты).
- Исследование костного мозга. Образец костного мозга получают с помощью трепанобиопсии. Гистологическая картина зависит от фазы заболевания. Для ранней (префибротической фазы) характерны гиперплазия всех ростков кроветворения (гранулоцитарного, мегакариоцитарного, эритроидного) с незрелостью клеток. В позднюю (фибротическую) фазу определяется большое количество коллагеновых и ретикулярных волокон (фиброз), замещающих гемопоэтическую ткань, выраженная клеточная атипия. Высокий уровень бластных клеток (более 20%) свидетельствует о трансформации миелофиброза в острый лейкоз.
- Молекулярно-генетические тесты. Диагностика мутации генов JAK2V617F, CALR, MPL осуществляется методом FISH. Для идентификации аллельной нагрузки мутации проводится полимеразная цепная реакция real-time. Также выполняется HLA-типирование для решения вопроса о возможности трансплантации костного мозга.
- Цитогенетические и цитохимические анализы. При цитогенетическом исследовании (кариотипировании) клеток костного мозга находят аномалии 1, 3, 6 хромосом (транслокация, трисомия, комплексные нарушения). При анализе химического состава (цитохимии) нейтрофилов активность щелочной фосфатазы оказывается в 3 раза выше нормы.
Для достоверной постановки диагноза гематологическим сообществом разработаны специальные критерии. Большие критерии включают повышенную клеточность костного мозга с ретикулярным и коллагеновым фиброзом, наличие мутаций генов JAK2V617F, MPL, CALR. К малым критериям относятся анемия, спленомегалия, лейкоэритробластоз (присутствие в крови незрелых форм лейкоцитов, эритроцитов), а также повышение лактатдегидрогеназы. Диагноз считается подтвержденным, если имеются 2 больших критерия или 1 большой и 3 малых критерия.
Миелофиброз следует дифференцировать в первую очередь с гематологическими заболеваниями, такими как аутоиммунные гемолитические анемии, гемобластозы (лейкозы, лимфомы). Сочетание спленомегалии с симптомами интоксикации (слабостью, субфебрилитетом, ночной потливостью) требует исключения туберкулеза, подострого инфекционного эндокардита.

Незрелые формы эритроцитов (черная стрелка) и гранулоцитов (контурная стрелка) в периферической крови
Лечение миелофиброза
После постановки диагноза пациент должен быть госпитализирован в гематологический стационар. Для принятия решения о выборе тактики лечения необходимо определить степень риска, а именно - вероятность бластной трансформации и ориентировочную продолжительность жизни. С этой целью была создана «Международная шкала оценки риска и прогноза» (DIPSS). Она учитывает возраст пациента, количество форменных элементов крови, выраженность симптомов опухолевой интоксикации. Каждый признак соответствует одному баллу. Различают низкий, первый и второй промежуточный, высокий риски, при которых проводится дифференцированная терапия:
Миелофиброз - это тяжелое заболевание с неблагоприятным прогнозом. С момента постановки диагноза средняя продолжительность жизни составляет около 5 лет. При манифестации в более молодом возрасте миелофиброз имеет менее агрессивное течение, что сопряжено с лучшим ответом на терапию и большей выживаемостью больных. Эффективных методов профилактики не разработано ввиду неизвестности этиологического фактора. Предупреждение развития вторичного миелофиброза заключается в своевременной диагностике и лечении патологий, на фоне которых он возникает - истинной полицитемии и эссенциальной тромбоцитемии.
2. Патофизиологические основы лечения сублейкемического миелоза. Патофизиология крови. Экстремальные состояния/ Под ред. А.И. Воробьева и Н.А. Горбуновой - 2004.
3. Критерии диагностики и современные методы лечения первичного миелофиброза/ Абдулкадыров К. М., Шуваев В. А., Мартынкевич И. С.// Вестник гематологии. - 2013 - №9(3).
4. Клинические рекомендации по диагностике и терапии Ph-негативных миелопролиферативных заболеваний (истинная полицитемия, эссенциальная тромбоцитопения, первичный миелофиброз. - 2014.
Апластическая анемия ( Гипопластическая анемия )
Апластическая анемия - угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.



Апластическая (гипопластическая) анемия - тяжелое расстройство гемопоэза (чаще всех его звеньев), сопровождающееся развитием анемического, геморрагического синдромов и инфекционных осложнений. Развивается в среднем у 2 человек на 1 млн. населения в год. Приблизительно с одинаковой частотой патология поражает мужчин и женщин. Возрастные пики заболеваемости приходятся на возраст 10-25 и старше 50 лет. При данной патологии в костном мозге чаще нарушается образование всех трех типов клеточных элементов крови (эритроцитов, лейкоцитов и тромбоцитов), иногда - только одних эритроцитов; в зависимости от этого различают истинную и парциальную апластическую анемию. В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.

Причины
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
- Прием миелотоксических препаратов. Достоверно установлена связь анемии с приемом некоторых противоопухолевых, противосудорожных, антибактериальных, антитиреоидных, противомалярийных препаратов, транквилизаторов, препаратов золота и др., обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное - через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
- Контакт с химическими и физическими агентами. Супрессию костного мозга может вызывать взаимодействие с органическими растворителями, соединениями мышьяка, бензольными соединениями, пестицидами, облучение всего тела. В некоторых случаях недостаточность гемопоэза является временной и обратимой - главными факторами здесь являются концентрация/доза вещества и время контакта. супрессию костного мозга.
- Вирусные инфекции. Из вирусных агентов наибольшее значение уделяется возбудителям гепатитов В, С и D. В этом случае гипопластическая анемия обычно развивается в течение полугода после перенесенного вирусного гепатита. При изучении патогенеза было замечено, что репликация вируса происходит в мононуклеарах крови и костного мозга, а также в иммунных клетках. Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму - постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Также описаны случаи панцитопении, вызванные инфицированием туберкулезом, интоксикацией, лучевой болезнью, лимфопролиферативными заболеваниями (тимомой, лимфомой, хроническим лимфобластным лейкозом), беременностью. Почти в половине наблюдений причину анемии выявить не удается - такие случаи относят к идиопатической форме.
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией - снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии - низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Симптомы апластической анемии
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов - стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия - при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.

Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений - кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
- Исследования крови. Для гемограммы при гипопластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Оценка биохимических показателей (печеночных проб, нефрологического комплекса, сывороточного железа, билирубина) информативна для исключения других анемий.
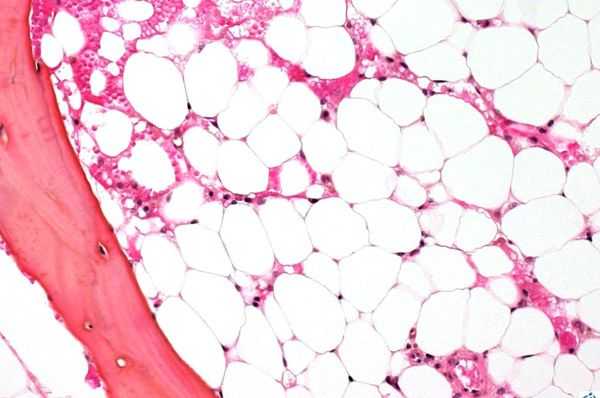
- Исследованиепунктата костного мозга. В миелограмме обнаруживается уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности. В трепанобиоптате определяется замещение красного костного мозга жировым (желтым).
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.

Лечение апластической анемии
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
- Иммуносупрессиная терапия. При умеренной цитопении назначается фармакотерапия, включающая комбинацию антитимоцитарного иммуноглобулина и циклоспорина А. Поддерживающая терапия проводится анаболическими стероидами или их сочетанием с циклоспоринами.
- Гемотрансфузии. В комплексе с курсом иммуносупрессивной терапии при низких показателях красной крови показано проведение заместительной гемотрансфузионной терапии (переливание тромбоцитов и эритроцитарной массы), плазмафереза. Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
- Трансплантация КМ и СК. Наиболее благоприятные прогнозы на долгосрочную выживаемость оказывает выполнение аллогенной трансплантации костного мозга. Однако ввиду сложности подбора иммунологически совместимого донора процедура используется ограниченно. В качестве экспериментальных подходов рассматриваются аутологичные трансплантации, пересадка стволовых клеток периферической крови. Больным с нетяжелой формой анемии может быть показано проведение спленэктомии, эндоваскулярной окклюзии селезеночной артерии.
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75-90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
2. Комплексная программа диагностики апластической анемии с определением прогностически значимых патогенетических особенностей заболевания. Методические рекомендации. - 2015.
4. Апластическая анемия: современные представления о патогенезе и терапии/ Айсариева Б. К., Раймжанов А. Р., Айтбаев К.// Молодой ученый. - 2011 - №9.
Читайте также:
- Болезни вертебрального происхождения. Виды спондилогенных заболеваний
- Обучение глазных хирургов. Техника освоения витреоретинальных оперативных вмешательств
- Птоз века: причины, симптомы и лечение
- Добавочный центр оссификации лодыжки голеностопного сустава на рентгенограмме
- Различия устойчивости к кислороду. Удаление активных радикалов при отравлении кислородом
