Артерии нижней конечностей плода. Формирование артерий нижней конечности
Добавил пользователь Валентин П. Обновлено: 21.01.2026
ФГБУ "НЦАГиП им. акад. В.И Кулакова" Минздрава России, Москва
ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России, Москва, Россия
Институт хирургии им. А.В. Вишневского, Москва
Роль синдрома обратной артериальной перфузии близнецов в развитии плода-акардиуса
Монохориальная многоплодная беременность имеет более высокий риск развития акушерских осложнений, в том числе за счет развития фето-фетального синдрома и синдрома обратной артериальной перфузии (СОАП). При монохориальной беременности СОАП встречается в 0,1% всех случаев. В основе развития СОАП лежит связь между артериальными и венозными анастомозами из соответствующих мест плаценты, в результате чего один плод-реципиент развивается за счет плода-донора. Считается, что наличие аномальных анастомозов является основной причиной развития акардии. Прогноз для плода-донора также неблагоприятен: при отсутствии внутриутробной коррекции смертность достигает 55%.
Многоплодная беременность характеризуется повышенной частотой осложнений по сравнению с одноплодной, особенно у монозиготных близнецов с монохориальной плацентой. Согласно данным литературы, перинатальная смертность при монохориальной двойне (с наличием одной общей плаценты) в 3-4 раза превышает таковую при дихориальной [1]. Среди осложнений монохориальной многоплодной беременности особое место занимает тяжелое нарушение формирования одного из плодов - плода-акардиуса.
Развитие акардиуса связано с наиболее тяжелым вариантом фето-фетальной трансфузии - синдромом обратной артериальной перфузии (СОАП), или TRAP-sequence (twin-reversed arterial perfusion). СОАП связан с выраженным аномальным анастомозированием сосудов монохориальной плаценты, хотя в литературе имеется описание СОАП при дихориальной двойне, когда наблюдалось анастомозирование сосудов близко расположенных плацент. Развитие плода-акардиуса отмечается чаще среди монозиготных двоен женского пола и крайне редко при беременности тройней. При монохориальной двойне СОАП встречается в 0,1% всех случаев [3, 4]. Это явление также известно под термином «акардиальный хориоангиопагусный паразитизм» (Chorioangiopagus Parasiticus). Данная патология встречается с частотой примерно 1:35 000 беременностей [5].
Для развития плода-акардиуса необходимо наличие в плаценте двух типов анастомозов: по артерио-артериальному анастомозу кровь поступает от нормального плода к акардиальному плоду, а по вено-венозному она возвращается к плоду-донору. Таким образом, нормальный плод обеспечивает кровообращение акардиального, однако кровоток в артериях плаценты и пуповины акардиуса происходит в противоположном направлении (в норме по артериям пуповины от плода оттекает венозная кровь, а по вене поступает кровь оксигенированная). Диспропорция в кровяном давлении может привести к значительному сбросу крови от здорового плода к пораженному. У акардиуса часто развиваются водянка и многоводие, отечный акардиус может значительно превышать по массе плод-донор.
Риск развития сердечной недостаточности у плода-донора повышается с увеличением массы плода-акардиуса. Прогноз для плода-донора неблагоприятен: при отсутствии внутриутробной коррекции анастомозов смертность достигает 55% [3]. Единственная возможность сохранить жизнь плоду-донору - это разобщение связи плода-донора с реципиентом [6].
Согласно наиболее распространенной теории, патогенез формирования плода-акардиуса связан с наличием артерио-артериальных анастомозов между кровеносными системами плацент, вызывающих обратный ток крови у одного плода [7]. Обратный кровоток, с одной стороны, обеспечивает выживание акардиуса, а с другой - приводит к формированию акардии. Развитие недостаточности большинства систем органов аномального плода может быть связано с гемодинамическими нарушениями, проявляющимися тем, что кровь поступает к нему под небольшим давлением и с низкой концентрацией кислорода [8]. Тот факт, что нижние конечности плода-акардиуса обычно сформированы значительно лучше верхних, объясняется их анатомической близостью к пупочным артериям с обратным кровотоком.
У плода-донора, как правило, не бывает структурных аномалий, но могут быть признаки сердечной недостаточности вследствие повышенной нагрузки на сердце.
Другая гипотеза развития плода-акардиуса при многоплодной беременности предполагает, что формирование грубых пороков развития внутренних органов одного плода из двойни обусловлено хромосомными аномалиями, являющимися причиной развития рудиментарного сердца или его полного отсутствия [9, 10] независимо от наличия аномальных анастомозов в плаценте между кровеносными системами здорового и аномального плодов. Главный постулат данной гипотезы - в основе данной патологии лежат хромосомные и другие генетические нарушения, вызывающие нарушение закладки многих органов, в том числе и сердца [11, 12]. С одной стороны, у плодов-акардиусов хромосомные аномалии выявляются достаточно редко [12, 13], с другой - частота плодов-акардиусов встречается значимо чаще среди монозиготных двоен женского пола [5].
Следует коснуться еще одной теории, основным положением которой является неравномерное распределение генетического материала между монозиготными плодами при многоплодной беременности, вследствие чего закладки сердца и внутренних органов не происходит [1]. Более того, существует мнение, что ряд ранее описанных тератом плаценты на самом деле являлись плодами-акардиусами с несформированными или нераспознанными пуповинами [14, 15].
Морфология плодов-акардиусов различна. Так, описаны случаи от полного отсутствия большинства органов до наличия почти полностью сформированных внутренних органов, таких как сердце, легкие и половые железы. Например, нижняя часть туловища и нижние конечности могут быть относительно хорошо сформированы, в то время как верхняя часть туловища может отсутствовать или быть представлена зачатками лица и/или рук. Единственным внутренним органом, который практически всегда отсутствует при акардии, является печень.
В зависимости от внешнего вида плода, а именно степени выраженности аномального развития головы или туловища, различают четыре типа плодов-акардиусов [16, 17].
1. Acardius acephalus (акардиус ацефалус): главным образом отсутствуют структуры черепа и грудной клетки; иногда присутствует аномальное туловище, но нижние конечности хорошо различимы. Этот тип связан с высоким риском осложнений для плода-донора, встречается в 60-75% наблюдений всех плодов-акардиусов.
2. Acardius amorphus (акардиус аморфус): представлен аморфными тканями, отсутствием хорошо различимых форм плода. Именно этот тип чаще всего приходится дифференцировать с тератомой плаценты; встречаемость - до 20% случаев.
3. Acardius anceps: наиболее дифференцированный тип, в котором можно четко различить структуры черепа и/или зачатки головного мозга, туловища и конечностей; встречаемость - 10% наблюдений.
4. Acardius acormus (акардиус акормус): определяются только структуры головы с близким прикреплением к ним пуповины; встречается в 5% случаев.
Для оптимизации аутопсийного исследования плодов-акардиусов до его начала рекомендуется провести рентгенологическое исследование, которое позволяет определить сложность аномалии, а также наличие осевого скелета и черепа. У большинства (но не у всех) акардиальных плодов наблюдается также единственная артерия пуповины.
В сложных случаях в постановке диагноза может помочь цитогенетическое исследование. Тератома гомозиготна, полиморфизм генов у нее отсутствует, так как она происходит из тотипотентной стволовой клетки, а нормальная ткань гетерозиготна [19, 20, 24-26].
К осложнениям, возникающим при СОАП, относятся преждевременное излитие околоплодных вод, многоводие, внутриутробная гибель плода-донора, преждевременные роды, разрыв матки. В этой связи возрастает роль перинатальной ультразвуковой диагностики [27, 28].
При допплерометрии при многоплодной беременности к критериям СОАП относятся наличие реверсного (обратного) кровотока в артерии пуповины у аномально сформированного плода, отсутствие или рудиментарное сердце. Следует отметить, что иногда в области грудной клетки у акардиусов может наблюдаться ритмичная пульсация, напоминающая сердечную деятельность, передающаяся от плода-донора по крупным сосудам [18, 19].
Единственная возможность сохранить жизнь плоду-донору - это разобщение связи плода-донора с реципиентом. Для этого применялись различные методики, способствующие окклюзии сосудов пуповины плода-реципиента: перевязка пуповины при фетоскопии, эндоскопическая лазерная коагуляция, моно- и биполярная коагуляция, эмболизация артерии пуповины посредством введения эмболов, тромбогенной спирали [6, 18, 19, 29-31], а также гистеротомия и селективное родоразрешение плода-акардиуса. При невозможности проведения окклюзии сосудов пуповины плода-реципиента осуществляют дренирование избыточного количества амниотической жидкости из амниотической полости плода-донора [32]. Эта манипуляция не устраняет причину, однако способствует снижению внутриамниотического давления, тем самым снижая компрессию поверхностных сосудов плаценты, что улучшает состояние плода-донора.
Таким образом, патогенез формирования плода-акардиуса обусловлен наличием артерио-артериальных анастомозов между кровеносными системами плацент и плодов монохориальной плаценты, вызывающей обратный ток крови у одного из плодов, т. е. здоровый плод кровоснабжает аномального.
Задачей патологоанатома при получении такого материала является определение вида акардиуса, возможное установление причин его развития, а также проведение дифференциального диагноза с тератомой. Этому может помочь проведение посмертного рентгенологического исследования: в отличие от тератомы плод-акардиус имеет сформированный краниокаудальный скелет.
Глава 8. ВЕНОЗНЫЕ АНГИОДИСПЛАЗИИ
Врожденные сосудистые мальформации (ВСМ) описываются в медицинской, исторической и художественной литературе уже на протяжении нескольких тысяч лет. На протяжении столетий мальформации называли именами людей, впервые их описавших: Мафуччи, Паркса Вебера, Клиппеля—Треноне, Сервелла, Мартореля, Ослера—Рандю и т. д.
Первые упоминания, касающиеся артериовенозных соустий конечностей, относятся к XVIII в., когда в 1737 г. появилась публикация Hunter, описавшего артериовенозные фистулы (цит. по Н. И. Краковскому, 1978).
Наиболее ранней капитальной работой по врожденной сосудистой патологии является монография Trelat и Movod (1869). Авторы, анализируя заболевания, характеризовавшиеся гипертрофией конечности и варикозным расширением сосудов (капилляры и подкожные вены), пришли к выводу, что патологический процесс в конечности связан с врожденными нарушениями развития сосудов.
Синдром заболевания, описанный перечисленными выше авторами, был детализирован в работе M. Klippel, P. Trenaunay (1900). Он включал три симптома: 1) наличие сосудистого невуса, захватывающего часто всю конечность; 2) возникновение в раннем возрасте варикозного расширения вен конечности; 3) гипертрофию всех тканей, особенно костей, которые увеличиваются как в длину, так и в ширину. К вторичным изменениям в конечности авторы относили нейротрофические расстройства. M. Klippel, P. Trenaunay назвали это заболевание остеогипертрофическим варикозным невусом.
В 1907 г. P. F. Weber описал синдром, аналогичный описанному ранее M. Klippel, P. Trenaunay. Однако, не ограничившись этим, автор позднее объединил в одну группу заболевания, характеризующиеся этим синдромом, и другие формы врожденных уродств сосудов под общим названием gemangiectasiae hypertrophiea, подчеркнув тем самым их сосудистый характер, сочетающийся с тяжелыми трофическими нарушениями. Термин «гемангиоэктатическая гипертрофия конечности», или болезнь Паркса—Вебера, в дальнейшем получил широкое распространение и применялся при любой остеогипертрофической форме. Вместе с тем, признавая сосудистый характер заболевания, P. F. Weber в первые годы изучения проблемы не связывал его с развитием артериовенозных свищей. Лишь в 1928 г. автор высказал мысль о том, что имеется прямая связь артериовенозных свищей с врожденной деформацией конечности.
Несколько позднее С. М. Рубашов (1933) также сообщил о наличии у таких больных множественных артериовенозных соустий и предположил, что они являются причиной страдания, обозначенного как macrosomia partialis congenital, но в литературе встречаются и другие различные названия этой патологии. В английской и североамериканской литературе это заболевание чаще обозначается как врожденные артериовенозные фистулы и врожденные артериовенозные аневризмы; в европейской и южноамериканской литературе — как синдром Клиппеля—Треноне или Паркса Вебера. По мнению Н. И. Краковского, Р. С. Колесниковой, Г. М. Пивоваровой (1978), наиболее оправданно название «врожденные артериовенозные свищи». Эти авторы считают, что оно наиболее точно отражает этиологию, патогенез и клиническую картину заболевания, а также патологоанатомический характер связи между артериальной и венозной системами конечности.
Клиническая картина, подобная врожденным артериовенозным свищам, может наблюдаться и при некоторых других заболеваниях, например при аплазии глубоких вен [Вагнер Е. А., Шалаев М. И. и др., 1971]. P. Piulach и F. Vidal-Borraquer (1960) считают, что синдром Клиппеля —Треноне характерен не для врожденных, а для приобретенных нарушений гемодинамики конечностей и является, в частности, последствием перенесенного тромбоза глубоких вен. M. Servelle (1967) выделил болезнь Клиппеля—Треноне из числа ангиодисплазий, связанных с артериовенозным сбросом через врожденные шунты. Автор полагает, что этот синдром возникает в результате аплазии глубоких вен. Этиология врожденной сосудистой патологии до сих пор точно не выяснена. Существует множество теорий ее развития (генетическая, эндокринная, травматическая и др.), но по мнению большинства авторов, формирование артериовенозных свищей связано с нарушением в развитии сосудистой системы эмбриона.
Зачаток сосудистой системы первоначально образуется из масс ангиобластических клеток, которые, соединяясь между собой, создают сеть капилляров — модель сосудистой системы любой соматической области. Ток крови в пределах этой сети способствует дифференциации ее на артериальные и венозные ветви, отличающиеся друг от друга различным направлением движения крови [Рыжков Е. В., 1961]. В дальнейшем, под влиянием генетических и локальных гемодинамических факторов, таких как направление, распределение и давление крови, происходит образование первичной капиллярной сети. Изменяется величина капилляра, часть капилляров, которые не были использованы для тока крови, исчезают. Все эти превращения способствуют образованию сосудистого ствола эмбриона. За этой стадией следует стадия образования окончательных «стволов». Дисэмбриологические процессы, возникающие во второй стадии развития кровеносных сосудов, могут вызвать формирование микро- и макрофистул между артериолами и венулами. При нарушении формирования стадии сосудистых стволов могут возникать аномалии развития артерий и вен. Гемодинамические факторы в развитии заболевания имеют существенное значение, так как они служат связующим звеном между аномальными сосудистыми образованиями и системой циркуляции. Гемодинамические изменения с течением времени приводят к снижению резистентности шунтов, а следовательно, и к увеличению их диаметра. Когда же размеры шунта постепенно начинают превосходить критическую величину нормальной артерии, возникает ангиоэктазия с распространением ее на всю регионарную систему вен, артерий и коллатералей [Holman E., 1962; Malan E., 1965]. Извращенный кровоток приводит в свою очередь к развитию клинической картины хронической венозной гипертензии, степень выраженности которой зависит как от объема диспластических изменений, так и от длительности их существования [Краковский Н. И., Колесникова Р. С., Пивоварова Г. М., 1978]. Регионарные гемодинамические нарушения ведут к изменению трофики тканей. Переполнение артериальной кровью венозного русла при длительно существующем артериовенозном свище приводит к повышению давления дистальнее свища. В связи с этим расширяются глубокие, коммуникантные и поверхностные вены, в результате чего возникает относительная недостаточность их клапанного аппарата. Повышение объемной скорости кровотока может вызвать и морфологические изменения стенки вены с развитием флебэктазии и истинных венозных аневризм. Венозная регионарная гипертензия в дистальных отделах конечности приводит к уменьшению градиента давления между артериальной и венозной частями капилляров. Это способствует развитию регионарной гипоксии тканей с последующими трофическими нарушениями.
Термин «врожденная мальформация сосудов» используется для описания дефектов сосудов, образовавшихся в результате остановки развития на разных этапах эмбриогенеза. ВСМ являются следствием врожденных дефектов сосудистой системы и поэтому присутствуют с самого рождения, хотя выявить их при рождении удается не всегда. Они могут затрагивать от одной до трех сосудистых систем (артериальную, венозную и лимфатическую), причем возможна ситуация, когда врожденные сосудистые мальформации доминируют в какой-то одной системе (например, венозная мальформация) либо когда они одновременно присутствуют в разных системах (например, гемолимфатическая мальформация). Мальформации продолжают рост вне зависимости от их типа.
Классификация врожденных пороков развития периферических кровеносных сосудов В. Н. Дана (1989) широко принята в нашей стране. Она позволяет провести разделение и систематизацию ВСМ с учетом их анатомических, гистологических, патофизиологических и гемодинамических характеристик.
1.1. Эмбриогенез венозной системы нижних конечностей
Большую роль в возникновении и развитии патологии вен нижних конечностей, в частности варикозной болезни, играет врожденная предрасположенность, которая реализуется, возможно, через закладку венозной системы в эмбриональном периоде. В процессе эволюции, при переходе предка человека к прямохождению, должны были сформироваться особенности строения венозной системы нижних конечностей, направленные на компенсацию возросшего гидростатического давления. С позиции эволюционизма очевидно, что закладка венозной системы может происходить в трех вариантах:
— атавистическом, при котором закладывается анатомический вариант строения, более характерный для ранних этапов эволюции человека и, соответственно, менее приспособленный для прямохождения;
— аккомодантном (от лат. аccomodatio — приспособление), который в эволюционном отношении является наиболее оптимальным вариантом венозной системы и предполагает низкую вероятность развития хронической венозной недостаточности (ХВН);
— футуристическом, при котором закладывается вариант строения венозной системы, до этого никогда ранее не существовавший у Homo sapiens. Этот вариант развития имеет поисковый характер.
Так как варикозная болезнь возникает в филогенезе человека одновременно с прямохождением, есть основания полагать, что атавистический вариант закладки является фундаментом для возникновения и развития варикозного расширения вен. При таком взгляде на проблему открываются новые подходы к оценке риска возникновения и развития ХВН. Зная соответствие варианта закладки венозной системы определенному анатомическому типу строения, можно с большой долей вероятности еще в раннем возрасте определить группу лиц с высоким риском возникновения ВБ.
Таким образом, мы можем близко подойти к реализации неосуществленной до сих пор идеи целенаправленной профилактики развития ХЗВНК у людей с высоким риском еще на доклинической стадии.
Установить анатомические критерии для каждого из вариантов закладки венозной системы можно только на основании данных о строении венозной системы на различных стадиях онто- и филогенеза. Работ, посвященных эмбриогенезу венозной системы нижних конечностей, крайне недостаточно. Публикации, которые освещают те или иные вопросы этой тематики, зачастую имеют противоречия в двух принципиальных вопросах: сроках формирования того или иного венозного отдела и источниках образования этих отделов.
В начале 7-й недели конечность вытягивается. Окончательно дифференцируются ее дорсальная (разгибательная) и вентральная (сгибательная) части, а также отделы, лежащие на границе между ними: преаксиальный (краниальный) и постаксиальный (каудальный). В это время происходит медиальный разворот конечности на 90°, так что разгибательная группа мышц становится лежащей по передней поверхности конечности. Примерно на 49-е сутки после оплодотворения можно определить лучи будущих пальцев в дистальной части конечности, в зоне формирующейся стопы. Самая первая артериальная система зачатка нижней конечности состоит из первичной аксиальной артерии с ветвями (рис. 1.1).
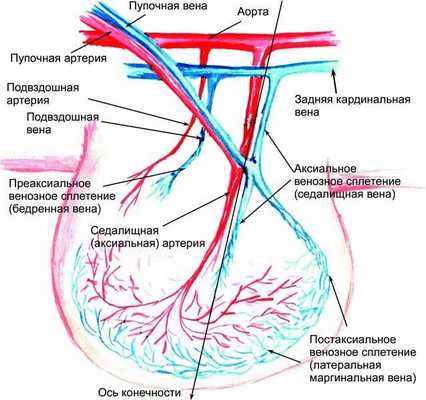
Рис. 1.1. Схема кровоснабжения зачатка нижней конечности эмбриона человека на 38—39-е сутки внутриутробного развития. Определяются три главные оси венозного оттока. Основной дренаж крови осуществляется через постаксиальное венозное сплетение
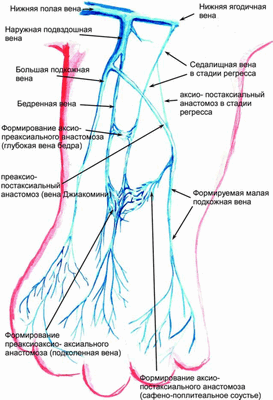
Рис. 1.2. Схема оттока крови на 50-е сутки внутриутробного развития. Появление «взрослых» глубоких сосудов и образование межвенозных анастомозов. Основным венозным коллектором становится преаксиальное сплетение
Постепенно первичная аксиальная артерия, пройдя ряд последовательных стадий, трансформируется в глубокую бедренную артерию на бедре, заднюю большеберцовую артерию и переднюю большеберцовую артерию — на голени.
В эмбриогенезе венозной системы нижних конечностей человека условно можно выделить три ключевые фазы:
— создание многочисленных анастомозов, ведущих к формированию окончательно оформленных путей венозного оттока.
Первичная венозная сеть расположена поверхностно и развивается вдоль индуцирующих ее рост нервов. Только затем образуется глубокая система, которая вначале имеет вид лакун, идущих вдоль одноименных артерий, и в дальнейшем ее рост и развитие происходят параллельно с этими артериями. В этом заключается различие между поверхностной и глубокой венозными системами. Кроме того, не только в онто-, но и в филогенезе поверхностная венозная сеть появляется гораздо раньше глубокой [Cameron J., 1982].
Применительно к возникновению и развитию путей оттока венозной крови от нижних конечностей на сегодняшний день наиболее признанной считается теория трех направляющих нервных осей [Gillot C., 1998; Uhl J.-F., 2007]. Поверхностная венозная система появляется в зачатке конечности уже у 6-недельного эмбриона. Она представлена тремя коллекторами, отводящими кровь в задние кардинальные вены. Последние представляют собой магистральные венозные сосуды, расположенные по бокам от хорды и дренирующие заднюю часть эмбриона (нижней полой вены на этой стадии еще не существует). Эти три коллектора идут вдоль направляющих их рост нервов:
- Вентрально расположен преаксиальный, или бедренный, нерв. Он отдает чувствительную ветвь, называемую ner vus saphenus. Венозное сплетение, образующееся вокруг этого нерва, называется преаксиальным. В последующем оно разделяется на большую подкожную вену (БПВ) и бедренную вену (БВ).
- Вдоль оси конечности идет седалищный, или аксиальный, нерв. Венозное сплетение, идущее вдоль этого нерва, называется осевым (аксиальным) или седалищным.
- Постаксиальное венозное сплетение следует дорсально вдоль малого седалищного нерва, который у взрослого человека представлен задним кожным нервом бедра. Он идет вниз, вдоль задней оси нижней конечности.
Доподлинно известно, что вначале образуется так называемое первичное капиллярное сплетение. Предшественники эндотелиальных клеток, рассеянные по мезенхиме, образуют агрегаты, которые затем принимают вид примитивных трубок, состоящих из одного слоя эндотелиальных клеток [Creton D., 2005]. Эта примитивная капиллярная сеть позволяет протекать по ней крови, но постепенно становится функционально недостаточной, что заставляет капилляры конденсироваться. Под воздействием факторов роста к этим капиллярам мигрируют гладкомышечные клетки [Haigh J. J., 2000; Vargesson N., 2003]. Так образуется первый кровеносный сосуд зачатка конечности — осевая, или аксиальная, артерия. Наиболее дистально расположенные венозные капилляры также сливаются и образуют так называемый маргинальный синус [Ambler C. A., 2001]. Существующие в первичной капиллярной сети многочисленные анастомозы, по мнению некоторых авторов [Brand-Saberi B., 1995], под воздействием тератогенных факторов могут сохраниться, приводя в дальнейшем к возникновению ангиодисплазий в виде артериовенозных фистул.
С образованием кровеносных сосудов первичный дренаж крови осуществляется от зачатка нижней конечности через постаксиальное венозное сплетение. Это происходит примерно на 38—39-е сутки после оплодотворения, когда длина эмбриона составляет всего около 8—9 мм. У основания зачатка конечности постаксиальная вена дренируется в седалищную и далее — в таз. Там первое время кровь попадает в пупочную и частично в заднюю кардинальную вену. Затем кровоток полностью перенаправляется в последний сосуд. Постаксиальное венозное сплетение, называемое иначе эмбриональная латеральная маргинальная вена, является прообразом малой подкожной вены. На данной стадии именно она становится главным магистральным венозным коллектором формируемой нижней конечности (рис. 1.2). Артериальный приток в это время осуществляется аксиальной артериальной системой — седалищная артерия отходит прямо от пупочной артерии и спускается в развивающийся зачаток нижней конечности [Дан В. Н., 2008]. Таким образом, на этой стадии, продолжающейся примерно от 37 до 50 сут после оплодотворения, как приток, так и основной отток крови от нижней конечности осуществляется системой пупочных сосудов.
Следующая по срокам развития — большая подкожная вена, которая возникает примерно на 44—45-е сутки напрямую из задней кардинальной вены. Одновременно из нее же развивается еще один дренирующий сосуд — прообраз БВ [Smith D. E., 1997]. Это связано с дальнейшим удлинением конечности, прежде всего с ростом бедра. Возникновение БПВ и БВ является началом перестройки системы венозного оттока от постаксиальной системы, дренирующей кровь через седалищную вену, к преаксиальной системе БПВ и бедренных сосудов. На 50-е сутки нижняя конечность напоминает ласту за счет лучей образующихся пальцев. Происходит тазовая ротация (на 90°) и значительное удлинение конечности, дренирующая система окончательно передвигается вперед от постаксиальной системы к преаксиальной системе подвздошных вен [Cameron J., 1982]. Начинают появляться «взрослые» глубокие вены [Smith D. E., 1997]. В этот момент основной отток крови осуществляется через БПВ.
Артериальный приток претерпевает похожие изменения. Бедренная артерия, ветвь наружной подвздошной артерии, входит в конечность и в canalis adductorius анастомозирует с седалищной артерией. Седалищная артерия попадает на переднюю поверхность через ramus perforans cruris, которая пенетрирует проксимальную часть пространства между образующимися берцовыми костями [Дан В. Н., 2008]. Из ramus per forans cruris «вырастает» передняя большеберцовая артерия.
Если на описанной стадии редукция эмбриональных седалищных сосудов задерживается, то могут развиться такие виды ангиодисплазий, как синдром Клиппеля—Треноне; персистирующие седалищная и латеральная маргинальная вены; персистирующая седалищная артерия (Дан В. Н., 2008; Bask erville P. A., 1985; Brand-Saberi B., 1995; Paraskevas G., 2004].
Именно удлинение конечности с тазовой ротацией, происходящее примерно на 50-е сутки после оплодотворения, можно считать рубежом, на котором заканчивается основная роль первичной поверхностной сети (системы эмбриональной латеральной маргинальной вены, прообраза малой подкожной вены — МПВ) в оттоке венозной крови. В результате происходящей ротации (окончательно она заканчивается только после рождения) дорсальная поверхность конечности превращается в переднюю, а вентральная — в заднюю. Соответственно расположенная ранее впереди преаксиальная система венозных коллекторов становится медиальной, а располагавшаяся каудально постаксиальная система МПВ смещается на заднюю поверхность конечности. Для перенаправления кровотока из системы седалищной (аксиальной) артерии в систему бедренных (преаксиальных) сосудов начинают образовываться межсистемные венозные анастомозы. Поскольку основной дренаж крови смещается в БПВ, возникающие анастомозы идут от постаксиального (МПВ) в преаксиальное сплетение. По ним почти вся кровь от голени уходит в БПВ. Этот анастомоз сохраняется и во взрослом состоянии в виде краниального продолжения МПВ (бедренно-подколенного тракта, вены Джиакомини) [Martinez R., 2001].
Постепенно, с дальнейшим ростом конечности, основной отток крови начинает смещаться в глубину, от БПВ в БВ. Это связано с тем, что глубокая венозная ось конечности становится функционально самым коротким путем к венозному коллектору основания растущей конечности. Образуется аксиально-преаксиальный анастомоз между седалищной и бедренной венами. БВ окончательно становится основным дренирующим сосудом нижней конечности (рис. 1.3). С этого момента седалищная вена окончательно утрачивает свое значение и постепенно атрофируется (во взрослом состоянии она сохраняется лишь в виде небольших аркад вдоль седалищного нерва и нижней ягодичной вены). Аксиально-преаксиальный анастомоз, расположенный вентрально по отношению к оси конечности, со временем превращается в глубокую вену бедра.
Наступает момент образования многочисленных анастомозов и формирования окончательного вида венозной системы. Уровень подколенной вены становится в этот период перекрестьем трех основных венозных осей. Седалищная вена анастомозирует с растущей вниз бедренной веной, образуя подколенную вену. Последняя в конечном итоге «захватывает» венозный дренаж из МПВ. Происходит формирование вначале подколенной вены, а затем сафенопоплитеального соустья (СПС). После того как бедро вытягивается из туловища, МПВ обособляется и теряет связь с седалищной системой. Поскольку это происходит достаточно поздно как в онто-, так и в филогенезе, мы можем наблюдать значительную вариабельность в расположении СПС [Cameron J., 1982; Gillot C., 1998; Barberini F., 2006]. Кроме собственно СПС, во взрослом состоянии могут сохраняться и другие анастомозы МПВ с глубокими венами. Они, бесспорно, являются пережитками постаксиально-аксио-преаксиальных анастомозов, существовавших в период эмбрионального развития. Описаны три такие вены — остатка эмбриональных межвенозных анастомозов [Gillot C., 1998]:
- Краниальное продолжение малой подкожной вены (задняя подкожная вена, бедренно-подколенный тракт, вена Джиакомини). Продолжается от подкожной части СПС вверх и вдоль заднего кожного нерва бедра, по срединной линии. В верхней части изменяет свой ход медиально и соединяется с БПВ.
- Задняя субфасциальная вена — начинается от СПС и идет по задней поверхности бедра субфасциально, затем теряется в массиве задней группы мышц бедра; часто она анастомозирует с глубокой веной бедра или с аркадами вдоль седалищного нерва — остатками седалищной вены.
- Задняя вена бедра — отходит от СПС или подколенной вены (ПВ) и лежит вдоль задней поверхности бедренной кости, анастомозируя с глубокой веной бедра или с остатками седалищной вены.
Отдельного внимания заслуживают перфорантные вены. Работ, посвященных их возникновению и развитию в эмбриогенезе, совсем мало. Известно, что они присутствуют уже у 16-недельного эмбриона [Flisinski P., 2004]. Безусловно, их образование также является следствием возникновения анастомозов между венозными стволами в эмбриональный период развития. При всем этом механизмы их возникновения остаются практически неизученными.
Окончательно венозная система принимает вид, близкий к «взрослому», к 13-й неделе внутриутробного развития. В этот же период появляются клапаны в поверхностных и глубоких венах конечностей [Czarniawska-Grzesinska M., 2002, 2003].
Несомненно, описание механизма развития венозной системы неполно. В закладке и формировании венозной системы нижних конечностей остается еще много белых пятен. Открытым остается вопрос об образовании сафенофеморального соустья (СФС), рефлюкс по которому служит краеугольным камнем в развитии варикозной болезни у большинства больных. Неизвестны точные сроки его возникновения. Так как СФС имеет постоянную анатомическую локализацию практически у всех людей, то, вероятно, его формирование является каким-то важным этапом эмбриогенеза. Вполне возможно, оно служит индуктором для дальнейшего органогенеза вен (а может? и не только вен) нижних конечностей. Как уже указывалось, источником образования БПВ и БВ служит преаксиальное венозное сплетение. При этом БПВ возникает сразу отдельным сосудом из задних кардинальных вен и только затем соединяется с БВ [Smith D. E., 1997]. Однако неясно, образуются ли сразу два отдельно лежащих сосуда (БПВ и БВ) или существует какой-то сосуд-предшественник, который в определенный момент времени разделяется в области будущего СФС. В первом варианте, в какой-то момент должен произойти «захват» БПВ бедренной веной. Изучая анатомию этой зоны, мы находим вариабельность количества и места впадения притоков в БПВ при постоянстве самой зоны соустья БПВ с БВ. На основании этого более вероятным нам представляется образование двух сосудов (БПВ и БП) в зоне соустья с последующим «захватом» в него притоков БПВ. СФС, как и СПС, имеет свои особенности строения у разных людей. Является ли тот или иной вариант строения соустья, формируемый при закладке, атавистическим, аккомодантным или футуристическим — покажет дальнейшее изучение развития венозной системы в онто- и филогенезе.
Не до конца раскрыт механизм образования так называемого латерального варикоза. В литературе давно утвердилось мнение, что эта патология имеет своим источником остаток эмбриональной латеральной вены [Mattassi R., 2007]. Представление это достаточно аргументированно и основано большей частью на схожести проявлений латерального варикоза и клинической картины при синдроме Клиппеля—Тренноне [Сабельников В. В., 1998; Стойко Ю. М., 2002]. Между тем при изучении эмбриогенеза венозной системы мы не нашли бесспорных указаний на связь эмбриональной латеральной вены (т. е. постаксиального венозного сплетения, прямого предшественника МПВ) и расширенного притока БПВ, который мы наблюдаем при латеральном варикозе.
В филогенезе у тетраподых (т. е. имеющих четыре конечности) животных основным поверхностным венозным коллектором служит МПВ. Даже у наших ближайших родственников — обезьян — основной дренаж крови от поверхностных структур задних конечностей осуществляет МПВ [Dyl L., 2007]. Смещение основного венозного оттока от МПВ к БПВ произошло, по-видимому, в результате перехода к прямохождению. Это одно из приспособительных изменений, связанное со значительным удлинением конечности и прежде всего — бедра. Нагрузка возросшим объемом крови на удлиненный ствол БПВ, окруженный недостаточно прочным фасциальным футляром, вполне вероятно может приводить к функциональной его неполноценности у определенной части человеческой популяции. При этом следует отметить, что на голени, претерпевшей в процессе эволюции меньшее удлинение, фасциальный футляр БПВ гораздо толще и прочнее и варикозная трансформация ствола БПВ в нижней и средней трети голени встречается редко.
СПС у тетраподых животных находится достаточно высоко. Существует мнение, что в филогенезе млекопитающих оно смещалось дистальнее, а его расположение в подколенной ямке стало свойственно только человеку. В связи с этим низко расположенное СПС предрасполагает к развитию несостоятельности его клапанного аппарата [Creton D., 2005].
Артерии нижней конечности
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Бедренная артерия (a. femoralis) является продолжением наружной подвздошной артерии, проходит под паховой связкой (через сосудистую лакуну) латеральнее одноименной вены, следует по подвздошно-гребенчатой борозде вниз будучи прикрыта (в бедренном треугольнике) только фасцией и кожей. В этом месте можно прощупать пульсацию бедренной артерии, затем артерия входит в приводящий канал и покидает его в подколенной ямке.
Подколенная артерия (a. poplitea) является продолжением бедренной артерии. На уровне нижнего края подколенной мышцы делится на свои конечные ветви - переднюю и заднюю большеберцовые артерии.
Задняя большеберцовая артерия (a. tibialis posterior) служит продолжением подколенной артерии, проходит в голеноподколенном канале, который покидает под медиальным краем камбаловидной мышцы. Затем артерия отклоняется в медиальную сторону, направляется к медиальной лодыжке, позади которой в отдельном фиброзном канале под удерживателем сухожилий сгибателей переходит на подошву. В этом месте задняя большеберцовая артерия покрыта только фасцией и кожей.
Передняя большеберцовая артерия (a. tibialis anterior) отходит от подколенной артерии в подколенной ямке (у нижнего края подколенной мышцы), входит в голеноподколенный канал и сразу же покидает его через переднее отверстие в верхнем отделе межкостной перепонки голени. Затем артерия вместе с одноименными венами и глубоким малоберцовым нервом спускается по передней поверхности мембраны вниз и продолжается на стопу как тыльная артерия стопы.
Тыльная артерия стопы (a. dorsalis pedis) является продолжением передней большеберцовой артерии, идет кпереди от голеностопного сустава между сухожилиями длинного разгибателя пальцев в отдельном фиброзном канале. В этом месте артерия лежит под кожей и доступна для определения пульса.
Для артерий таза и нижней конечности характерно наличие анастомозов между ветвями подвздошных, бедренной, подколенной и большеберцовых артерий, которые обеспечивают коллатеральный ток артериальной крови и кровоснабжение суставов. На подошвенной стороне стопы в результате анастомозирования артерий имеются две артериальные дуги. Одна из них - подошвенная дуга - лежит в горизонтальной плоскости. Эту дугу образует концевой отдел латеральной подошвенной артерии и медиальная подошвенная артерия (обе из задней большеберцовой артерии). Вторая дуга расположена в вертикальной плоскости. Ее формирует анастомоз между глубокой подошвенной дугой и глубокой подошвенной артерией - ветвью тыльной артерии стопы. Наличие этих анастомозов обеспечивает прохождение крови к пальцам в любом положении стопы.
Развитие кровеносных сосудов
Кровеносные сосуды человека развиваются из мезенхимы с опережением по сравнению с развитием и дифференцировкой органов и тканей. Происхождение микрососудов связано с мезенхимными клетками и желточным мешком, где на 12-14 день развития эмбриона появляются первыеочаги кроветворения, а вокруг них из первичных эндотелиоцитов возникаютпервые органные микрососуды. По желточному стебельку они врастают в первичную кишку и образуют в ней первые внутриорганные капиллярные сети, с которыми впоследствии соединяются внеорганные и магистральные сосуды.
На 3-й неделе из артериального ствола сердца вырастают правая и левая вентральные и такие же дведорсальные аорты. Вентральные аорты располагаются впереди от первичной кишки, а дорсальные позади от нее, вдоль хорды и внизу сливаются в общий ствол брюшной аорты. Обе пары аорт на головном конце эмбриона в области висцеральных дуг первичной кишки соединяются между собой 6-ю парами аортальных дуг.
С развитием головы, шеи, туловища и конечностей, а с ними мозга, сердца и всех внутренних органов происходит в разные сроки перестройка эмбриональной сосудистой системы. Она начинается с редукции части аортальных дуг (I, II, V)и образования из третьей, четвертой и шестой дуг артерий головы, шеи и грудной полости. Передний отдел вентральной аорты от I-й до III-й аортальной дуги превращается в наружную сонную артерию, а из переднего отдела дорсальной аорты и третьей дуги возникает внутренняя сонная артерия. Участок левой вентральной аорты на уровне III-IV дуг превращается в более длинную левую общую сонную артерию. Конечная часть правой вентральной аорты и часть IV-ой дуги формируют правую подключичную артерию и правую общую сонную артерию. Четвертая дуга становится собственной дугой аорты, которая соединяет восходящую часть аорты с левой дорсальной аортой, постепенно превращающейся в нисходящую аорту. В месте соединения возникает из-за разности диаметров узость, именуемая перешейком аорты. Шестая аортальная дуга превращается в легочные артерии, левая из них узким артериальным (Боталловым) протоком срастается с собственной дугой аорты, что является необходимым приспособлением для внутриутробного кровообращения плода.
Боковые ветви вентральных и дорсальных аорт называются межсегментарными и сегментарными (латеральными и медиальными), так как они направляются в сегментарно расположенные сомиты и между ними. Из ветвей дорсальных аорт развиваются длинная левая подключичная, позвоночные и базилярная артерии, задние межреберные, поясничные. Подключичные артерии, врастая в верхние конечности, создают осевые артерии, от которых в процессе развития остаются общие межкостные артерии предплечий. Сегментарность закладки латеральных и вентральных артерий дорсальных аорт со временем нарушается. Латеральные сегментарные артерии дают начало парным артериям живота: диафрагмальным, почечным, яичниковым. Вентральные артерии образуют непарные сосуды: чревный ствол, брыжеечные артерии. Из каудальных артерий возникают пупочные, а из них осевые артерии нижних конечностей.
Вены закладываются на 4-й неделе двумя парными кардинальными стволами передними и задними, желточно-кишечными и пупочными венозными сосудами. Кардинальные стволы ложатся вентральнее дорсальных аорт. Спереди они называются предкардинальными, сзади посткардинальными венами, но обе пары впадают в общие кардинальные вены, соединенные с венозным синусом сердца. Развитие полых вен связано с перестройкой пре- и посткардинальных вен и анастомозов между ними, редукцией венозного синуса и формированием четырех камерного сердца. На образование нижней полой вены сильно влияет первичная почка (мезонефрос) и перестройка правой задней кардинальной вены. Верхняя полая вена возникает на основе правой общей кардинальной и правой прекардинальной вены. Воротная вена образуется под влиянием желточно-кишечных вен и развития печени с ее сосудистыми приспособлениями для внутриутробного кровообращения: венозным протоком, пупочными венами и анастомозами.
Аномалииразвития кровеносных сосудов чаще встречаются у аортальных дуг, особенно тех, что подвергаются редукции. При сохраненииIV-ой правой и левой дуги и начала дорсальных аорт может образоваться аортальное кольцо вокруг грудной части трахеи и пищевода. Возможно впадение легочных вен не в левое предсердие, а в верхнюю полую вену, непарную или плечеголовные вены. Особенно тяжелые пороки возникают при нарушениях развития сердца и главных сосудов с ним связанных, когда меняются позициями в разных вариантах и сочетаниях аорта и легочный ствол, полые и легочные вены. По анатомо-функциональным признакам многообразие вариантного строения артерий и вен можно разделить нааномалии строения без нарушения гемодинамикии пороки развития, сопровождающиеся нарушениями кровотока (патологическое перераспределение венозного оттока между предсердиями или артериального тока крови между желудочками и предсердиями).
Читайте также:
- Диэнцефальные причины предменструального синдрома. Менструальная волна при ПМС
- Пример операции при аномалиях прикуса. Лечение мезиального прикуса
- Синдром периодической спячки. Пароксизмальная гиперсомния. Нарушения ночного сна.
- Естественно-научный подход к поведению. Охранительное торможение
- Состав половых клеток. Спермий
