Атрезия и гипоплазия. Объем циркулирующей крови. Объем кровотока и величина шунта.
Добавил пользователь Morpheus Обновлено: 21.01.2026

Общие сведения
Причины атрезии трехстворчатого клапана
В этиологии атрезии трехстворчатого клапана ведущая роль отводится нарушению формирования сердца на ранних сроках эмбриогенеза (2-8 недели). Тератогенными факторами в этот период гестации могут являться вирусные инфекции (краснуха, грипп), хронический алкоголизм матери, производственные вредности, прием некоторых лекарственных средств (сульфаниламидов, антибиотиков, аспирина и др.).
Причинами, предрасполагающими к формированию врожденных пороков сердца, служат возраст матери старше 35 лет, токсикоз I триместра беременности, угроза прерывания беременности, случаи мертворождения в анамнезе, эндокринные заболевания (сахарный диабет). Также следует иметь в виду наследственный фактор: наличие в семье других детей или родственников с врожденными пороками развития сердца.
Особенности гемодинамики при атрезии трехстворчатого клапана
Анатомической основой атрезии трехстворчатого клапана является облитерация правого предсердно-желудочкового отверстия. Вследствие этого неразвитым оказывается и приточный конус правого желудочка, т. е имеет место гипоплазия правого желудочка. При этом происходит шунтирование крови из правого предсердия в левое через дефект в межпредсердной перегородке.
Т. о, при атрезии трехстворчатого клапана в левом желудочке происходит смешивание венозной крови из полых вен и артериальной крови из легочных вен. В большинстве случаев больший объем крови в дальнейшем попадает в аорту, меньшая часть - в легкие. Недостаточная степень насыщенности крови кислородом обусловливает развитие цианоза. Ввиду недоразвития правого желудочка, левый желудочек испытывает повышенную нагрузку, фактически полностью обеспечивая насосную функцию сердца, что в конечном итоге приводит к развитию сердечной недостаточности.
Классификация атрезии трехстворчатого клапана
В зависимости от морфологических особенностей выделяют несколько форм атрезии трехстворчатого клапана: мышечную (76%), мембранозную (7-12%), клапанную (4,8-6%), атрезию типа аномалии Эбштейна (2-8%) и атрезию типа открытого атриовентрикулярного канала (редко встречающиеся случаи).
При наиболее частой, мышечной форме атрезии трехстворчатого клапана дно правого предсердия располагается над свободной стенкой левого желудочка (дискордантность предсердно-желудочковых взаимоотношений); имеет место гипоплазия правого желудочка, обусловленная отсутствием его приточного синуса. Мембранная форма атрезии трехстворчатого клапана характеризуется расположением дна правого предсердия над атриовентрикулярной частью межжелудочковой перегородки; имеется гипоплазия правого желудочка вследствие отсутствия его синуса.
При клапанной форме атрезии правое предсердие и желудочек разделены неперфорированной фиброзной мембраной, образованной сросшимися створками трикуспидального клапана (конкордантность предсердно-желудочковых взаимоотношений); несмотря на имеющуюся гипоплазию, правый желудочек сформирован полностью.
Атрезию типа аномалии Эбштейна характеризует смещение трехстворчатого клапана со сросшимися створками в полость правого желудочка. Атрезия типа атриовентрикулярной коммуникации (открытого АВ-канала) обусловлена блокадой выхода из правого предсердия в правый желудочек створками общего предсердно-желудочкового клапана.
Кроме морфологических форм, различают следующие анатомические варианты атрезии трехстворчатого клапана:
- Атрезия трехстворчатого клапана с увеличенным или нормальным легочным кровотоком: с нормальным расположением магистральных сосудов, отсутствием стеноза легочной артерии, наличием дефекта межжелудочковой перегородки; с атрезией легочного ствола и открытым артериальным протоком; с транспозицией магистральных сосудов, отсутствием стеноза легочной артерии, наличием дефекта межжелудочковой перегородки; с транспозицией магистральных сосудов, атрезией устья аорты, открытым артериальным протоком; с транспозицией магистральных сосудов, отсутствием стеноза легочной артерии, наличием дефекта межжелудочковой перегородки, двух- или трехстворчатого митрального клапана.
- Атрезия трехстворчатого клапана с редуцированным легочным кровотоком: с нормальным расположением магистральных сосудов, наличием дефекта межжелудочковой перегородки и стеноза легочной артерии; с нормальным расположением магистральных сосудов, атрезией легочного ствола и открытым артериальным протоком; с транспозицией магистральных сосудов, наличием дефекта межжелудочковой перегородки и стеноза легочной артерии; с транспозицией магистральных сосудов, наличием дефекта межжелудочковой перегородки и гипоплазии правого желудочка; с транспозицией магистральных сосудов, наличием дефекта межжелудочковой перегородки, гипоплазии правого желудочка, стеноза легочной артерии и митрального клапана.
Симптомы атрезии трехстворчатого клапана
Нередко возникают гипоксемичесике кризы - приступы пароксизмальной одышки с выраженным цианозом, обусловленные внезапным уменьшением легочного кровотока, увеличением сброса неоксигенированной крови в левые отделы сердца и гипоксемией в большом круге кровообращения.
Одышечно-цианотические приступы при атрезии трехстворчатого клапана могут провоцироваться психоэмоциональным напряжением, физической активностью, интеркуррентными заболеваниями, протекающими с лихорадкой, диареей и др. факторами. Гипоксемический криз развивается внезапно, ребенок при этом становится беспокойным, усиливаются одышка и цианоз, возникает тахикардия. В тяжелых случаях такие приступы могут привести к судорогам, потере сознания, коме и летальному исходу.
При атрезии трехстворчатого клапана быстро развивается недостаточность кровообращения по большому кругу с характерными отеками, гепатомегалией, гидротораксом, асцитом. При отсутствии хирургической коррекции порока большинство детей с атрезией трехстворчатого клапана погибает в течение первого года жизни. При достаточно больших размерах шунта и нормальном легочном кровотоке пациенты с некорригированной атрезией трехстворчатого клапана могут дожить до 15-30 и даже более лет.
Диагностика атрезии трехстворчатого клапана
К физикальным данным, характеризующим атрезию трехстворчатого клапана, относят перкуторно определяемое увеличение границ сердца, выслушиваемые при аускультации шумы: систолический шум в III и IV межреберных промежутках (при ДМЖП и стенозе ЛА), систолический шум во II межреберье (при ТМС), диастолический шум на верхушке сердца, обусловленный увеличенным кровотоком через митральный клапан.
На ЭКГ выявляется отклонение электрической оси сердца влево, гипертрофия правого предсердия и левого желудочка. При рентгенографии грудной клетки определяется усиление легочного рисунка, увеличение тени сердца, преимущественно его левых отделов. С помощью ЭхоКГ обнаруживается отсутствие эхосигналов от трикуспидального клапана, дефекты перегородок, аномальное положение магистральных сосудов, ОАП, стеноз легочной артерии. Данные зондирования полостей сердца при атрезии трехстворчатого клапана указывают на невозможность проведения катетера из правого предсердия в правый желудочек; вместе с тем свободно катетеризируется левое предсердие; давление в правом предсердии повышено. Исследование газового состава крови выявляет снижение содержания кислорода в артериальной крови.
Рентгеноконтрастные исследования (атриография, вентрикулография, аортография) обнаруживают поступление контрастного вещества из правого предсердия в левое, просветление в месте отсутствия приточного синуса правого желудочка (симптом светлого треугольника). Кроме этого, удается увидеть сопутствующие атрезии трехстворчатого клапана дефекты - стеноз ЛА, ДМЖП, транспозицию магистральных сосудов.
Лечение атрезии трехстворчатого клапана
Медикаментозная терапия при атрезии трехстворчатого клапана показана для купирования одышечно-цианотических приступов и коррекции недостаточности кровообращения. Во всех случаях при атрезии трехстворчатого клапана требуется хирургическое лечение, метод которого определяется кардиохирургом.
Атрезия трехстворчатого клапана - сложный порок, коррекция которого выполняется поэтапно. На первом этапе достигается обеспечение адекватного легочного кровотока и устранение гипоксемии. На втором и третьем этапах последовательно достигается перенаправление системного возврата в легочный круг кровообращения.
Атрезия трехстворчатого клапана с увеличенным легочным кровотоком, протекающая с респираторным дистресс-синдромом и ацидозом, является показанием к сужению легочного ствола с помощью манжеты. При недостаточном легочном кровотоке на первом этапе выполняется наложение системно-легочных анастомозов (аорто-легочный анастомоз по Блелоку).
На втором этапе пациентам с атрезией трехстворчатого клапана производится наложение двухстороннего двунаправленного кава-пульмонального анастомоза или операция Геми-Фонтена, предполагающие различные варианты анастомозирования ВПВ и легочной артерии.
Полная гемодинамическая коррекция атрезии трехстворчатого клапана обеспечивается проведением операции Фонтена, благодаря которой достигается разобщение малого и большого круга кровообращения и ликвидируются нарушения гемодинамики. В результате операции Фонтена правый желудочек исключается из участия в кровообращении. Левый желудочек нагнетает кровь в аорту, к легким кровь поступает пассивно из полых вен.
Прогноз и профилактика атрезии трехстворчатого клапана
Комплексная хирургическая коррекция атрезии трехстворчатого клапана позволяет достичь высокой выживаемости: в течение 5-лет - 80 -88% и 10-лет - 70%. В отдаленные сроки смерть пациентов, как правило, наступает от хронической сердечной недостаточности или цирроза печени. Часть пациентов нуждается в повторном вмешательстве в связи со стенозом или окклюзией имплантированных протезов. При отсутствии кардиохирургического лечения смерть больных с атрезией трехстворчатого клапана наступает в раннем детстве.
Профилактика врожденных пороков сердца включает медико-генетическое консультирование, исключение антенатальных вредностей, определение показаний к прерыванию беременности при выявлении критических пороков, несовместимых с жизнью плода. Предупреждение неблагоприятного развития атрезии трехстворчатого клапана сводится к своевременной диагностике аномалии, обеспечению специального ухода за ребенком, определению оптимального метода и сроков хирургической коррекции порока.
Все пациенты с атрезией трехстворчатого клапана (как до, так и после операции) должны наблюдаться у кардиолога, получать превентивную антибактериальную терапию перед хирургическими и стоматологическими процедурами во избежание развития инфекционного эндокардита.
Нарушение маточно-плацентарного кровотока
Нарушение маточно-плацентарного кровотока - симптомокомплекс, развивающийся во время беременности вследствие расстройства функций плаценты или происходящих в ее строении морфологических изменений. Со стороны матери клиника может отсутствовать. На фоне акушерской патологии возникает гипоксия плода, проявляющаяся учащением или замедлением сердечных сокращений, снижением активности. Диагностика нарушений маточно-плацентарного кровотока осуществляется посредством УЗИ, КТГ, допплерометрии. Лечение проводится в стационаре консервативным путем с использованием препаратов, улучшающих гемодинамику в сосудах плаценты.
Нарушение маточно-плацентарного кровотока - акушерская патология, возникающая вследствие расстройства функций гемодинамики в системе «женщина-плацента-ребенок». Диагностируется такая аномалия примерно у 4% беременных. В 25% случаев заболевание развивается на фоне уже имеющихся экстрагенитальных заболеваний пациентки. Нарушение маточно-плацентарного кровотока представляет угрозу для здоровья и жизни плода, поскольку может приводить к недостаточному поступлению питательных веществ, что осложняется задержкой внутриутробного развития, гипоксией и даже возможной гибелью ребенка.
Опасность нарушения маточно-плацентарного кровотока зависит от выраженности и продолжительности существования данной акушерской патологии. Чем меньше питательных веществ поступает к ребенку, тем выше вероятность формирования отклонений. По статистике, около 85% новорожденных, подверженных такой патологии, появляются на свет с признаками гипоксии или врожденными аномалиями различной степени выраженности. Нарушение маточно-плацентарного кровотока способно возникать на разных этапах беременности, чаще всего оно диагностируется во 2-3 триместре вынашивания. Расстройство гемодинамики, развившееся до 16 недель, нередко заканчивается самопроизвольными выкидышами.
Причины нарушения маточно-плацентарного кровотока
Нарушение маточно-плацентарного кровотока развивается вследствие неправильного формирования ворсинчатого слоя плодных оболочек еще в период закладки плаценты или в результате влияния на организм матери неблагоприятных факторов, становящихся причиной расстройства гемодинамики в нормальной плаценте. Патогенез заболевания заключается в неполноценной маточно-плацентарной перфузии, приводящей к недостаточному поступлению кислорода к плоду. Как следствие, нарушение маточно-плацентарного кровотока запускает механизм гипоксических изменений, способствующих задержке развития плода.
Спровоцировать нарушение маточно-плацентарного кровотока могут эндогенные и экзогенные причины. К первой группе относятся факторы, влияющие изнутри организма будущей матери. Риск развития патологии наблюдается при наличии у женщины сахарного диабета, заболеваний почек, сердца и сосудов, на фоне дисфункции щитовидной железы. Формированию нарушения маточно-плацентарного кровотока способствует отягощенный акушерский анамнез - поздний гестоз, угрозы прерывания, множественные аборты и выкидыши, доброкачественные опухоли матки. Высокий риск расстройства гемодинамики наблюдается на фоне беременности с резус-конфликтом, а также, если пациентка страдала бесплодием.
Нарушение маточно-плацентарного кровотока нередко развивается на фоне генетических нарушений у плода и при наличии врожденных пороков репродуктивной системы матери (при двурогой или седловидной матке, перегородках в полости органа). Вероятность возникновения акушерской патологии существует и при половых инфекциях, а также, если больная перенесла вирусные заболевания, к примеру, грипп, ОРВИ. К экзогенным факторам, способствующим нарушению маточно-плацентарного кровотока относится работа на вредных производствах, употребление наркотиков и алкоголя, курение. Неблагоприятным образом сказывается и нерациональное питание. В группу риска по развитию нарушения маточно-плацентарного кровотока входят женщины в возрасте до 18 и старше 35 лет. Риск аномальной гемодинамики присутствует при постоянных стрессах, интенсивных физических нагрузках.
Классификация нарушения маточно-плацентарного кровотока
В зависимости от локализации патологических изменений в акушерстве различают несколько степеней тяжести нарушения маточно-плацентарного кровотока:
- 1а - характеризуется расстройством гемодинамики между маткой и плацентой, при этом к ребенку попадает достаточное количество питательных веществ.
- 1б - нарушение кровообращения происходит в круге «плод-плацента».
- 2 степень - нарушение маточно-плацентарного кровотока наблюдается в круге «плод-плацента-мать», однако гипоксия выражена незначительно.
- 3 степень - сопровождается критическим расстройством показателей гемодинамики, может привести к гибели ребенка или самопроизвольному аборту.
Учитывая срок гестации, на котором происходит нарушение маточно-плацентарного кровотока, можно выделить следующие виды патологии:
- Первичная - возникает в первом триместре, обычно развивается на фоне аномальной имплантации, нарушений в формировании или прикреплении плаценты.
- Вторичная - диагностируется после 16 недель эмбриогенеза, как правило, провоцируется негативными внешними факторами или состоянием здоровья матери.
Симптомы нарушения маточно-плацентарного кровотока
Клинические проявления нарушения маточно-плацентарного кровотока зависят от выраженности акушерской аномалии. Со стороны матери патологические признаки наблюдаются не всегда. У пациентки может развиться гестоз, нередко присутствует угроза выкидыша или преждевременных родов, что сопровождается болью в животе и в области паха. Возможно появление кровянистой слизи из половых путей. На фоне нарушения маточно-плацентарного кровотока происходит активизация деятельности условно-патогенной флоры, нередко возникают кольпиты. Это осложнение нарушения маточно-плацентарного кровотока может стать причиной внутриутробного инфицирования плода.
Нарушение маточно-плацентарного кровотока более выражено со стороны ребенка. Заподозрить признаки гипоксии плода в ряде случаев может сама пациентка. Патологическое состояние проявляется снижением двигательной активности ребенка. В ходе осмотра акушер-гинеколог выявляет учащение или уменьшение частоты сердечных сокращений у малыша, что также является достоверным признаком нарушения маточно-плацентарного кровотока. Недостаток питательных компонентов способен вызвать преждевременную отслойку плаценты. При этом состояние женщины и плода стремительно ухудшается, возможно возникновение угрозы для жизни.
Диагностика и лечение нарушения маточно-плацентарного кровотока
Выявить нарушение маточно-плацентарного кровотока можно в ходе УЗИ. О наличии акушерской патологии свидетельствуют патологии плаценты и внутриутробная задержка развития плода, проявляющаяся несоответствием размеров анатомических частей сроку гестации. Оценить степень нарушения маточно-плацентарного кровотока удается с помощью допплерографии. Для оценки функциональности сердечно-сосудистой системы ребенка используется КТГ. Характерным признаком является тахикардия или брадикардия, возникшая на фоне гипоксии.
Лечение нарушения маточно-плацентарного кровотока проводится в условиях стационара. Больной показан постельный режим, исключение стрессов и интенсивных физических нагрузок. Консервативная терапия заключается в использовании препаратов для купирования нарушений маточно-плацентарного кровотока и улучшения оксигенации плода. Также используются антиагреганты и средства, улучшающие питание тканей головного мозга. При нарушении маточно-плацентарного кровотока показано употребление витаминов, блокаторов кальциевых каналов. Последние применяются для устранения гипертонуса матки.
Прогноз и профилактика нарушения маточно-плацентарного кровотока
Своевременное лечение нарушения маточно-плацентарного кровотока позволяет женщине продлить беременность до 37 недель гестации и родить абсолютно здорового младенца. При первичной форме патологии возможна внутриутробная гибель плода или самопроизвольный выкидыш. Профилактика нарушения маточно-плацентарного кровотока состоит в устранении экстрагенитальных патологий еще до момента зачатия, ранней постановке на учет к акушеру-гинекологу и выполнении всех его рекомендаций. Беременная должна придерживаться рационального питания, отказаться от вредных привычек, стрессов и тяжелой физической работы. Уменьшить вероятность развития нарушения маточно-плацентарного кровотока позволяет также исключение контактов с возможными источниками инфекций.
Атрезия легочной артерии
МКБ-10

Аномалия легочных сосудов — редкое заболевание, распространенность которого составляет не более 3-4% от всех врожденных пороков сердца. Патология манифестирует сразу после рождения ребенка, встречается одинаково часто среди мальчиков и девочек. Состояние ассоциировано с высоким риском летального исхода в первые 2-3 года жизни. Атрезия легочной артерии, как правило, сочетается с другими аномалиями сердца и магистральных сосудов — открытым артериальным протоком, дефектом межпредсердной перегородки (ДМПП), транспозицией сосудов.
Причины
Порок формируется на эмбриональном этапе внутриутробного развития ребенка. Точные причины появления атрезии не установлены. Главными этиологическими факторами считаются тератогенные воздействия на организм матери в первом триместре беременности. Эти причины провоцируют генные мутации, нарушения дифференцировки органов и тканей. Все неблагоприятные факторы разделяют на 3 группы с учетом их природы:
- Физические воздействия. Формированию кардиальных пороков способствует ионизирующее излучение и повышенный радиационный фон. Вероятность атрезии увеличивается при проживании женщины на территории, пострадавшей от аварии на ЧАЭС.
- Химические вещества. Тератогенное влияние оказывает ряд медикаментов: цитостатики и иммуносупрессоры, некоторые антибиотики, ингибиторы АПФ. К химическим факторам также относят никотин, употребление алкоголя в период беременности.
- Биологические агенты. Ряд вирусов и бактерий, которые инфицируют организм беременной в I триместре, вызывают нарушения внутриутробного развития. Чаще всего грубые аномалии возникают при заболеваниях из группы TORCH — токсоплазмозе, краснухе, цитомегаловирусной инфекции.
Патогенез
Патофизиологической основной болезни является нарушение оттока крови из правого желудочка в легочную артерию, из-за чего не формируется правильный малый круг кровообращения. В зависимости от варианта атрезии кровь может сбрасываться в систему легочных сосудов через коллатеральные артерии или открытый артериальный проток. Наблюдается хроническая ишемия миокарда правого желудочка, определяются эластоз и фиброэластоз сердечной мышцы.
Классификация
Все атрезии легочной артерии делятся на 2 большие группы. К первой отнесены пороки с интактной межжелудочковой перегородкой (синдром гипоплазии правых отделов сердца). Внутри нее выделяют 3 варианта аномалии по степени развития правого желудочка (трехпартитный, двухпартитный и однопартитный).
Вторую группу составляют атрезии легочного ствола с поражением межжелудочковой перегородки (МЖП). Данная группа пороков делится на 4 типа:
- Тип I. Характеризуется атрезией клапана между легочной артерией и правым желудочком. При этом все сосуды правильно сформированы и обеспечивают гемодинамическую функцию.
- Тип II. Выявляется атрезия и клапана легочной артерии, и ее ствола. Правая и левая легочные артерии хорошо развиты, имеют раздельное или общее начало.
- Тип III. Характерна распространенная атрезия, которая захватывает клапан, ствол и одну из ветвей легочной артерии.
- Тип IV. Происходит полное заращение сосудов, входящих в систему легочной артерии, вместе с клапаном. Самый тяжелый вид порока, при котором кровообращение обеспечивается за счет коллатералей.
Симптомы
Атрезия легочных сосудов относится к «синим» сердечным порокам, клинически проявляется сразу после того, как ребенок родился. У новорожденного заметен акроцианоз или диффузный цианоз, на выраженность которого влияют тип атрезии и количество коллатеральных сосудов. Синюшность кожи усугубляется при крике или плаче. Одышка отмечается даже в покое, она значительно усиливается при кормлении ребенка, активных движениях руками, ползании.
У детей после года наблюдается резкая слабость и одышка при попытке ходьбы. Они могут сделать всего несколько шагов, а затем останавливаются, чтобы отдохнуть и перевести дыхание. Для облегчения состояния дети садятся на корточки. При атрезии легочной артерии характерен медленный прирост массы тела, гипотрофия мышечной ткани. У длительно болеющих пациентов грудная клетка приобретает бочкообразную форму.
Осложнения
Вероятность неблагоприятных последствий зависит от типа атрезии легочной артерии. При дуктус-зависимой гемодинамике, когда кровоснабжение легких осуществляется только через незаращенный артериальный проток, смертность достигает 90% в течение первых 10-12 месяцев жизни. При формировании коллатералей, кровоснабжающих легкие, риск летального исхода составляет около 50%.
При атрезии происходит сброс крови справа налево, поэтому все органы и ткани пребывают в состоянии хронической гипоксии. Отмечается задержка роста и физического развития, атрофия мышц. Гипоксия головного мозга вызывает грубые нарушения психического развития, умственную отсталость. У детей появляется хроническая сердечная недостаточность, постепенно происходит гипоплазия обоих желудочков сердца.
Диагностика
Опытный неонатолог или детский кардиолог подозревает заболевание уже при объективном исследовании. Во время аускультации сердца обнаруживают грубый систолический шум и ослабление 2 тона по левому краю грудины. Обычно с одной стороны отсутствует пульс на плечевой артерии. Чтобы определить характер атрезии и состояние системной гемодинамики, назначают следующие обследования:
- ЭКГ. Электрокардиографическими признаками патологии являются отклонение электрической оси сердца вправо и гипертрофированная мышечная стенка правого желудочка. Зачастую возникают неполные блокады правой ножки пучка Гиса, для длительного течения характерны ЭКГ-симптомы перегрузки правого предсердия.
- ЭхоКГ. Эхокардиография — информативный метод визуализации размеров сердца и обнаружения дефектов МЖП. Данные УЗИ сердца показательны при первом и втором типе атрезии. С целью дифференцировки аномалии со стенозом легочной артерии рекомендована допплер-эхокардиография.
- Рентгенография ОГК. При атрезии с дефектом межжелудочковой перегородки повышается прозрачность легочных полей. При наличии больший коллатеральных ветвей типично усиление легочного рисунка на отдельных участках. Обнаруживают увеличенную в поперечнике сердечную тень и уменьшение размеров левых отделов сердца.
- Ангиокардиография. Инвазивное исследование предполагает катетеризацию сердечных камер и применение контрастного вещества. Вентрикулография проводится для подготовки к операции, а также используется для измерения давления в желудочках. Для изучения источников кровоснабжения легких дополнительно выполняется аортография.
- Лабораторные исследования. В клиническом анализе крови оценивают уровень гемоглобина — показатель свыше 180-190 г/л является неблагоприятным прогностическим критерием. Для оценки свертываемости крови изучают коагулограмму. Показан постоянный контроль уровня насыщения крови кислородом.
Лечение атрезии легочной артерии
Хирургическое лечение
Любой из анатомических вариантов атрезии легочной артерии является абсолютным показанием к оперативному вмешательству, которое проводится в максимально ранние сроки, чаще на первом году жизни ребенка. Перед кардиохирургическим вмешательством назначается медикаментозная терапия антикоагулянтами, антиаритмическими препаратами. Существует 2 варианта оперативного лечения порока:
- Радикальная коррекция. Вмешательство допустимо при удовлетворительном клинико-функциональном состоянии больных. Операция эффективна, если система легочной артерии достаточно развита (атрезии I и II типов) и отсутствуют признаки гипоплазии желудочков сердца.
- Паллиативная операция. Хирургический метод направлен на улучшение объема легочного кровотока и стабилизацию состояния ребенка. Паллиативные вмешательства в кардиохирургии предполагают создание системно-легочных анастомозов. В дальнейшем возможно выполнение радикальной коррекции.
Реабилитация
Даже после радикальных оперативных вмешательств показан длительный реабилитационный период. Пациенты находятся на лечении в кардиохирургическом стационаре, после чего отправляются на долечивание в амбулаторных условиях. После стабилизации гемодинамики и исчезновения симптомов детям рекомендовано санаторно-курортное лечение. Всех больных ставят на пожизненный диспансерный учет.
Прогноз и профилактика
Благоприятный исход заболевания наблюдается при 1-2 типе атрезии и раннем проведении хирургического вмешательства. Более неблагоприятный прогноз у пациентов с дуктус-зависимой гемодинамикой, которым для улучшения состояния требуются сложные многоэтапные операции. Учитывая отсутствие четких этиологических факторов, меры первичной профилактики не разработаны.
1. Атрезия легочной артерии с дефектом межжелудочковой перегородки. Клинические рекомендации Министерства здравоохранения РФ. - 2016.
2. Атрезия легочной артерии с дефектом межжелудочковой перегородки/ Подзолков В.П.// Грудная и сердечно-сосудистая хирургия. - 2013.
3. Врожденные пороки сердца: справочник для врачей/ под ред. Е.В. Кривощепкова, И.А. Ковалева, В.М. Шипулина. - 2009.
Синдром левосторонней гипоплазии сердца (Q23.4)
Термин "синдром гипоплазии левого сердца" или "синдром гипоплазии левого желудочка" (СГЛЖ) применяют для обозначения гетерогенной группы пороков, характеризующихся недоразвитием комплекса левое сердце-аорта, которое создает обструкцию Обструкция - непроходимость, закупорка
кровотоку. В результате левое сердце не в состоянии поддерживать на должном уровне системное кровообращение.
Наиболее тяжелая форма порока представлена атрезией аорты, часто сочетающейся с резкой гипоплазией митрального клапана и практически отсутствующей полостью левого желудочка. Более благоприятный прогноз у пациентов с критическим аортальным стенозом, который сопровождается умеренной гипоплазией левого желудочка.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Выделяют два варианта синдрома гипоплазии левого желудочка (СГЛЖ):
1. СГЛЖ с атрезией устья аорты в сочетании с атрезией или стенозом митрального клапана.
2. СГЛЖ со стенозом и гипоплазией устья аорты в сочетании со стенозом митрального клапана.
Этиология и патогенез
При синдроме гипоплазии левого сердца нарушения гемодинамики возникают уже на ранних стадиях развития плода. В норме кровь из полых вен частично проходит через открытое овальное окно в левые отделы и в большой круг кровообращения. При синдроме гипоплазии левого сердца вся кровь поступает в правый желудочек и в легочный ствол. В связи с этим появляется перегрузка правых отделов сердца наблюдается с момента рождения.
После рождения состояние кровообращения можно охарактеризовать как гемодинамическую "катастрофу". Венозная кровь поступает из полых вен в правые отделы и легкие обычным путем. Но кровь из легких, которая поступает в левое предсердие, может пройти только через открытое овальное окно в правые отделы. Здесь происходит смешение крови, после чего она вновь поступает в легочную артерию. Часть крови поступает в нисходящую часть аорты и в нижнюю половину тела через широко открытый артериальный проток, а другая в восходящую часть аорты и брахиоцефальные сосуды.
Поскольку аортальный клапан закрыт, восходящая часть аорты функционирует в качестве "общей коронарной артерии". Таким образом, возникает ситуация, когда правый желудочек функционирует как общий для большого и малого круга кровообращения, перекачивая смешанную кровь. В сосуды большого круга поступает недонасыщенная кислородом кровь в объеме, определенном величиной открытого артериального протока. Сердце, в свою очередь, снабжается кровью аорты в объеме, зависящем от величины просвета аорты.
Тяжелейшие нарушения гемодинамики включают резкий застой крови в легких, высокое давление в системе сосудов малого круга кровообращения, правом желудочке и предсердии, неадекватное снабжение кровью большого круга (выражается в низком артериальном давлении, неадекватной работе сердца вследствие сниженного коронарного кровотока).
Одним из компонентов нарушений гемодинамики выступает артериальная гипоксемия Гипоксемия артериальная - пониженное содержание кислорода в артериальной крови
, хотя ее степень может быть не резко выраженной достаточного смешения крови в правом желудочке.
Эпидемиология
Частота синдрома гипоплазии левого сердца составляет 0,12-0,21 на 1000 новорожденных, 3,4-7,5% - среди всех врожденных пороков сердца. Частота критических состояний при данном синдроме составляет более 92%. У мальчиков порок встречается в 2 раза чаще, чем у девочек.
Факторы и группы риска
Факторы риска, влияющие на формирование врожденных пороков сердца у плода
Семейные факторы риска:
- наличие детей с врожденными пороками сердца (ВПС);
- наличие ВПС у отца или ближайших родственников;
- наследственные заболевания в семье.
Клиническая картина
Клинические критерии диагностики
кожа землисто-серая, снижение двигательной активности, одышка в покое, учащенное дыхание, втяжение уступчивых мест грудной клетки, влажные хрипы в легких, синеватый цвет кожи (цианоз), сердечная недостаточность, увеличение печени, отеки
Cимптомы, течение
С первых же дней выявляется недостаточность кровообращения, которая проявляется застойными хрипами в легких, увеличенной печенью, периферическими отеками.
Для крайних форм устья аорты с атрезией или стенозом митрального клапана характерна картина "кардиогенного шока". При наличии проходимости клапанных отверстий, общие клинические проявления порока носят идентичный характер, но симптоматика развивается не так бурно.
При осмотре область сердца не изменена. Сердечный толчок усилен, что контрастирует со слабым периферическим пульсом.
При аускультации тоны приглушены, II тон усилен в половине случаев. Систолический шум слабой или умеренной интенсивности выслушивается над всей областью сердца. Иногда шум полностью отсутствует.
1. Электрокардиография:
- низкий вольтаж зубцов;
- фиксируются признаки изолированной перегрузки правого желудочка;
- электрическая ось сердца отклонена вправо, но может быть вертикальной;
- присутствуют признаки перегрузки правого предсердия.
4. Эхокардиография:
- резкое сужение восходящей части аорты;
- уменьшение размера левого желудочка до 0,4-0,9 см;
- сужение диаметра устья аорты до 0,6 см и более;
- увеличение размера правого желудочка в среднем до 2,5 см (2,3-3,2 см);
- соотношение размеров левого и правого желудочков - менее 0,6;
- наличие грубых изменений митрального клапана.
5. Катетеризация сердца позволяет выявить сниженное насыщение крови кислородом в периферической артерии, большой сброс крови слева направо на уровне предсердий.
Цифры насыщения крови кислородом в правом желудочке, легочной артерии и аорте одинаковы.
Давление в правом желудочке и легочной артерии составляет 75 мм рт. ст. и выше, а также значительно превышает давление в плечевой артерии или нисходящей части аорты при одновременной регистрации.
Диастолическое давление в правом желудочке повышено. При выходе катетера из нисходящей части аорты через открытый артериальный проток в легочный ствол регистрируется градиент систолического давления в 10-15 мм рт. ст.. Сам маневр прохождения зонда через открытый артериальный проток может вызвать брадикардию Брадикардия - пониженная частота сердечных сокращений.
и остановку сердца.
6. Ангиография выявляет резкую дилатацию правого желудочка, расширение легочного ствола и легочных артерий, а также одновременное нисходящей части аорты через открытый артериальный проток. Восходящая часть аорты в виде нитевидного образования ретроградно, после заполнения брахиоцефальных сосудов.
Когда контрастное вещество вводится в левое предсердие, ангиокардиографическая картина повторяется: вначале заполняются правые отделы, затем проток и аорта. При наличии проходимого левого отверстия возможно наблюдать резко уменьшенную полость левого желудочка.
Для исследования состояния восходящей части аорты и ее ветвей рекомендуют введение контрастного вещества через катетер в лучевой или пупочной артерии.
Дифференциальный диагноз
Синдром гипоплазии левого сердца необходимо дифференцировать от внесердечных аномалий и нарушений ритма, которые могут вызвать критическое состояние:
- синдром острой дыхательной недостаточности;
- кровоизлияние в мозг или травма черепа;
- геморрагический диатез;
- сепсис;
- проксимальная суправентрикулярная тахикардия.
При отсутствии возможности хирургической коррекции больной погибает в первые 2-3 недели жизни. При переходе к постнатальному типу кровообращения у большинства больных развивается критическая сердечная недостаточность, приводящая к быстрой гибели новорожденных.
Лечение
Основные принципы лечения синдрома гипоплазии левого сердца заключаются в снижении метаболических потребностей организма (создание температуры комфорта, ограничение физической активности ребенка) и коррекции метаболических нарушений.
В значительном числе случаев прибегают к искусственной вентиляции легких с регуляцией баланса легочного и системного кровотоков при помощи снижения концентрации кислорода во вдыхаемой смеси до 16-18%, гиповентиляции.
Больным показана также инотропная поддержка, введение натрия гидрокарбоната, диуретиков и седативных препаратов. Улучшить периферическое кровообращение и метаболические показатели помогает раннее применение простагландинов группы Е.
В отсутствие хирургического вмешательства срок жизни больных не превышает нескольких месяцев. Результаты хирургических вмешательств также неутешительны, в связи с чем даже в развитых странах ограничиваются симптоматическим лечением или "пассивной эвтаназией".
Выполнение операции (при принятии такого решения) желательно в первые 30 дней жизни.
Операционная реконструкция направлена на разделение легочной и системной циркуляции с помощью операции Фонтена. Правый желудочек остается системным, в то время как легкие кровоснабжаются пассивно. Эта реконструкция проводится в три этапа:
2. Процедура Геми-Фонтен - операция проводится через 6 месяцев после процедуры Норвуда. Создается анастомоз между верхней полой веной и правой ветвью легочной артерии. Закрывается заплатой соединение верхней полой вены с правым предсердием. Только нижняя полая вена впадает в правое предсердие. Аорто-легочный шунт, выполненный на первом этапе, перевязывают.
3. Процедура Фонтена - операция проводится через 12 месяцев после второго этапа и заключается в соединении нижней полой вены с легочной артерией. Вся системная кровь пассивно поступает в легкие. Правый желудочек работает на системную циркуляцию.
При невозможности выполнения хирургической операции осуществляется трансплантация сердца.
Прогноз
При синдроме гипоплазии левого сердца быстро развивается критическое состояние и дети погибают через несколько дней после рождения. 72% детей погибают в течение первой недели жизни, из них 38% − в первые 48 часов.
Продолжительность жизни зависит от конкретного варианта порока. При умеренной степени гипоплазии левого желудочка со стенозом (а не атрезией) клапанных отверстий продолжительность жизни может увеличиваться до нескольких недель и месяцев.
Прогноз любого варианта синдрома гипоплазии левого сердца больных погибают в течение первого года жизни. Непосредственными причинами смерти являются сердечная недостаточность, пневмония состояние.
Профилактика
Профилактика возникновения врожденных пороков сердца (ВПС) очень сложна и в большинстве случаев сводится к медико-генетическому консультированию и разъяснительной работе среди людей, относящихся к группе повышенного риска заболевания. К примеру, в случае, когда 3 человека, состоящие в прямом родстве, имеют ВПС, вероятность появления следующего случая составляет 65-100% и беременность не рекомендуется. Нежелателен брак между двумя людьми с ВПС. Помимо этого необходимо тщательное наблюдение и исследование женщин, имевших контакт с вирусом краснухи или имеющих сопутствующую патологию, которая может привести к развитию ВПС.
Профилактика неблагоприятного развития ВПС:
- своевременное выявление порока;
- обеспечение надлежащего ухода за ребенком с ВПС;
- определение оптимального метода коррекции порока (чаще всего, это хирургическая коррекция).
Обеспечение необходимого ухода является важной составляющей в лечении ВПС и профилактике неблагоприятного развития, так как около половины случаев смерти детей до 1-го года во многом обуславливаются недостаточно адекватным и грамотным уходом за больным ребенком.
Специальное лечение ВПС, (в том числе, кардиохирургическое) должно проводиться в наиболее оптимальные сроки, а не немедленно по выявлению порока, и не в самые ранние сроки. Исключение составляют только критические случаи угрозы жизни ребенка. Оптимальные сроки зависят от естественного развития соответствующего порока и от возможностей кардиохирургического отделения.
Профилактика осложнений ВПС определяется характером осложнений.
Грозным осложнением ВПС является инфекционный эндокардит Инфекционный эндокардит - это инфекционное полипозно-язвенное воспаление эндокарда, сопровождающееся образованием вегетаций на клапанах или подклапанных структурах, их деструкцией, нарушением функции и формированием недостаточности клапана
Подробно , который может осложнить любой вид порока и может появиться уже в дошкольном возрасте.
Рекомендуется ограничить назначение антибиотикопрофилактики инфекционного эндокардита группам пациентов с наибольшей вероятностью развития инфекционного эндокардита:
1. Пациенты после протезирования клапана сердца.
2. Инфекционный эндoкардит в анамнезе.
3. Пациенты со следующими врожденными пороками:
- "синие" пороки, без предшествующей хирургической коррекции или с остаточными дефектами, паллиативными шунтами или кондуитами;
- пороки после хирургической коррекции с применением искусственных материалов до 6 месяцев (до тех пор, пока не произошла эндотелизация);
- если после операции на сердце или чрескожной коррекции есть остаточный дефект в месте имплантации искусственного материала или устройства.
Оценка церебральной и центральной гемодинамики у новорожденных с перинатальной энцефалопатией

Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Материалы и методы
Было обследовано 103 ребенка (I группа - 58 детей, родившихся недоношенными со сроком гестации 27-36 недель и массой при рождении от 910 до 1910 г, II группа - 45 детей, родившихся доношенными с массой от 2070 до 4400 г) в возрасте от 4 дней до 6 месяцев. Исследования проводились в динамике через 7-10 дней во время пребывания ребенка в стационаре на втором этапе выхаживания, а затем при явке его для наблюдения в поликлинику Научного центра здоровья детей РАМН (НЦЗД). Состояние всех детей в момент обследования было стабильным, а в клинической картине ведущей была неврологическая симптоматика различной степени тяжести. Всем пациентам проводили ультразвуковое исследование мозга и цветную допплерографию внутричерепных сосудов - передней мозговой, внутренней сонной и базиллярной артерий (рис. 1). Учитывали максимальную систолическую скорость (Vmax), среднюю скорость кровотока за время сердечного цикла (Vmean), минимальную диастолическую скорость (Vmin) и индекс резистентности RI=(Vmax-Vmin)/Vmin. Параллельно проводили ЭХО-кардиографическое исследование, определяя общий ударный объем (УО), вычисляемый как разница между диастолическим и систолическим объемами левого желудочка; эффективный ударный объем (УО эфф); минутный объем кровообращения (МО); фракцию изгнания (ФИ). Все ультразвуковые обследования проводили в одно и то же время - через 1 час после кормления детей в состоянии покоя. Регулярно оценивали пациентам соматический и неврологический статус и проводили общеклинические лабораторные исследования.
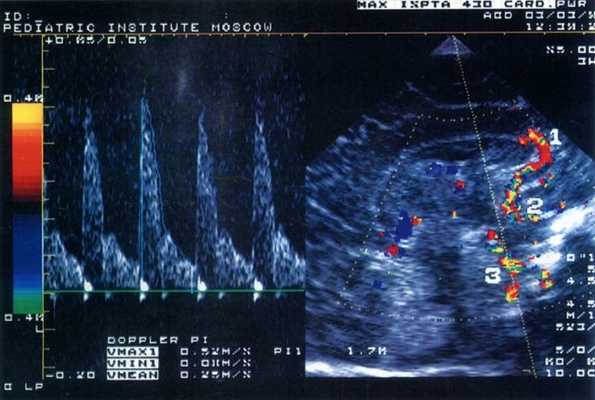
Рис. 1. Эхограмма головного мозга новорожденного (сагиттальный срез через большой родничок) и допплерограмма кровотока по базиллярной артерии.
Результаты
Для вычисления описательных характеристик показателей центральной и церебральной гемодинамики обследованные были разделены на подгруппы по возрасту и периоду перинатальной энцефалопатии: первые 28 дней - острый период, старше 28 дней - восстановительный период.
Значения скоростей мозгового кровотока во всех трех обследованных сосудах были выше у доношенных детей по сравнению с недоношенными и в восстановительном периоде по сравнению с острым периодом (табл. 1). Другими словами, абсолютные скорости кровотока в крупных мозговых артериях повышались с увеличением массы тела, гестационного и постнатального возраста ребенка, что подтвердил корреляционный анализ. Наиболее выраженной была зависимость скоростей кровотока от массы тела (табл. 2). Индексы резистентности мозговых артерий были выше в группе детей, родившихся недоношенными (в остром периоде разница была высокодостоверной с р
| Показатель | Доношенные | Недоношенные | ||
|---|---|---|---|---|
| Острый период | Восстановительный период | Острый период | Восстановительный период | |
| V max ПМА, м/сек | 0,33±0,12 | 0,49±0,14 | 0,32±0,12 | 0,48±0,18 |
| V min ПМА, м/сек | 0,09±0,04 | 0,13±0,05 | 0,07±0,04 | 0,12±0,08 |
| V mean ПМА, м/сек | 0,20±0,08 | 0,30±0,09 | 0,19±0,07 | 0,29±0,12 |
| RI ПМА | 0,72±0,08 | 0,74±0,08 | 0,77±0,09 | 0,76±0,11 |
| V max ВСА, м/сек | 0,48±0,13 | 0,71±0,11 | 0,46±0,13 | 0,58±0,15 |
| V min ВСА, м/сек | 0,12±0,05 | 0,16±0,07 | 0,09±0,06 | 0,14±0,08 |
| V mean ВСА, м/сек | 0,29±0,09 | 0,41±0,07 | 0,26±0,09 | 0,35±0,12 |
| RI ВСА | 0,75±0,07 | 0,78±0,10 | 0,81±0,09 | 0,77±0,09 |
| V max БА, м/сек | 0,46±0,14 | 0,59±0,13 | 0,40±0,12 | 0,53±0,16 |
| V min БА, м/сек | 0,11±0,05 | 0,13±0,05 | 0,07±0,04 | 0,12±0,08 |
| V mean БА, м/сек | 0,27±0,09 | 0,34±0,08 | 0,22±0,07 | 0,32±0,11 |
| RI БА | 0,75±0,08 | 0,77±0,08 | 0,81±0,09 | 0,78±0,10 |
ПМА - передняя мозговая артерия.
ВСА - внутренняя сонная артерия.
БА - базиллярная артерия.
Vmax - максимальная систолическая скорость.
Vmin - минимальная диастолическая скорость.
Vmean - средняя скорость кровотока за время сердечного цикла.
RI - индекс резистентности.
Абсолютные показатели сердечного выброса - общий ударный объем, эффективный сердечный выброс и минутный объем кровообращения были выше в группе доношенных детей как в остром, так и в восстановительном периодах (табл. 3). Так же, как и скорости мозгового кровотока, значения сердечного выброса увеличивались с увеличением массы тела у всех обследованных детей (табл. 2). Относительные показатели (сердечные индексы) - УО/кг, УО эфф/кг и МО/кг - были выше у недоношенных, что можно объяснить более высокими темпами роста, большей потребностью в кислороде и напряженностью метаболических процессов у таких детей по сравнению с доношенными.
Таблица 2. Коэффициенты корреляции между массой тела при обследовании и показателями центральной и церебральной гемодинамики (р<0,01).
| Дети | УО эфф | УО эфф/кос | МО | МО/кг | УО | УО/кг |
|---|---|---|---|---|---|---|
| Доношенные | 0,42 | -0,47 | 0,37 | -0,44 | 0,43 | -0,48 |
| Недоношенные | 0,69 | -0,31 | 0,60 | -0,36 | 0,57 | -0,42 |
| Дети | Vmax ПМА | Vmin ПМА | Vmean ПМА | RI ПМА | Vmax ВСА | Vmin ВСА |
| Доношенные | 0,27 | 0,28 | 0,30 | - | 0,35 | 0,30 |
| Недоношенные | 0,51 | 0,57 | 0,55 | -0,27 | 0,36 | 0,37 |
| Дети | Vmean ВСА | RI ВСА | Vmax ВСА | Vmin ВСА | Vmean ВСА | RI ВСА |
| Доношенные | 0,34 | - | 0,43 | 0,40 | 0,46 | - |
| Недоношенные | 0,37 | -0,23 | 0,42 | 0,54 | 0,50 | -0,34 |
ПМА - передняя мозговая артерия.
ВСА - внутренняя сонная артерия.
УО - общий ударный обьем.
УО эфф - эффективный ударный обьем.
МО - минутный объем кровообращения.
Vmax - максимальная систолическая скорость.
Vmin - минимальная диастолическая скорость.
Vmean - средняя скорость кровотока за время сердечного цикла.
RI - индекс резистентности.
Один из основных параметров сократимости миокарда - фракция изгнания - в обеих группах был одинаковым и соответствовал норме.
| Показатель | Доношенные | Недоношенные | ||||
|---|---|---|---|---|---|---|
| Острый период | Восстановительный период | Острый период | P1 | Восстановительный период | P2 | |
| УО, мл | 6,35±1,61 | 6,70±2,04 | 4,84±0,99 | 5,78±1,81 | ||
| УО/кг, мл/кг | 2,08±0,60 | 1,78±0,48 | 2,27±0,58 | 2,14±0,56 | ||
| УО эфф, мл | 6,14±1,55 | 6,85±2,16 | 4,58±1,20 | 5,90±2,22 | ||
| УО эфф/кг, мл/кг | 2,01±0,54 | 1,71±0,55 | 2,16±0,67 | >0,05 | 2,09±0,58 | |
| МО, л/мин | 0,91±0,26 | 1,04±0,31 | 0,70±0,19 | 0,92±0,33 | ||
| МО/кг, л/мин/кг | 0,30±0,09 | 0,26±0,09 | 0,33±0,11 | 0,33±0,10 | ||
| ФИ | 0,69±0,04 | 0,69±0,04 | 0,69±0,03 | - | 0,69±0,05 | - |
УО - общий ударный обьем.
УО эфф - эффективный ударный обьем.
МО - минутный объем кровообращения.
ФИ - фракция изгнания.
P1 - коэффициент достоверности по отношению к подгруппе доношенных детей в остром периоде.
Р2 - по отношению к подгруппе доношенных детей в восстановительном периоде.
Между сердечными индексами и скоростями мозгового кровотока связь была обратной в обеих группах детей.
Зависимости между показателями мозгового кровотока, в том числе и индексами резистентности, и частотой сердечных сокращений в нашем исследовании не выявлено.
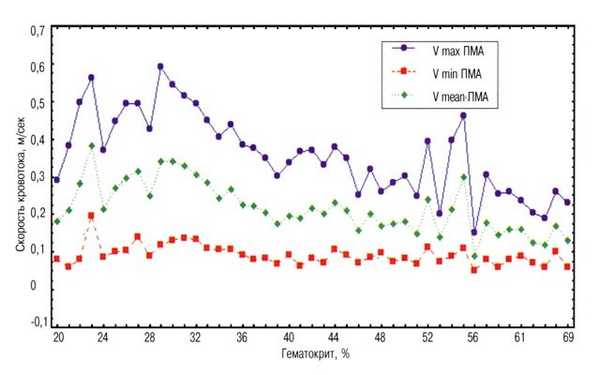
Рис. 2. Зависимость скоростей кровотока в передней мозговой артерии от величины гематокрита.
Результаты наших исследований показали, что у новорожденных детей с перинатальным гипоксическитравматическим поражением головного мозга после выхода их из критического состояния основными факторами, влияющими на показатели мозгового кровотока, были масса тела, гестационный и постнатальный возраст - так же, как и у здоровых новорожденных [3]. Это говорит о том, что нарушения мозгового кровотока без тяжелых органических изменений в головном мозге носят преходящий характер и быстро компенсируются.
Абсолютные скорости кровотока в крупных мозговых артериях растут с увеличением возраста и, в большей степени, массы тела ребенка. Индексы резистентности снижаются с увеличением гестационного возраста, т.е. у недоношенных детей, резистентность сосудов мозга в норме выше, чем у доношенных.
Сердечный выброс в обеих группах обследованных детей увеличивался с возрастанием массы тела, что также согласуется с литературными данными в отношении здоровых новорожденных [4, 5].
Обнаруженную нами положительную связь между сердечным выбросом и скоростями кровотока в передней мозговой и базиллярной артериях у недоношенных детей, на первый взгляд, можно объяснить влиянием на эти показатели массы тела. Известно, что связь между двумя физиологическими параметрами может быть не прямой, а опосредованной через третий показатель. Такое объяснение применимо к обнаруженной нами обратной связи между сердечными индексами и скоростями кровотока в мозговых артериях - с возрастанием массы происходит увеличение скоростей, но в меньшей степени, чем снижение значений сердечного выброса на килограмм веса, причем такое соотношение соблюдается в обеих группах обследованных детей.
У недоношенных детей имеется достоверная прямая зависимость абсолютных значений сердечного выброса и скоростей мозгового кровотока от массы тела. Однако такая же зависимость выявлена и у доношенных детей, но между собой показатели сердечного выброса и мозгового кровотока в этой группе не были связаны. Это означает, что зрелые новорожденные в стабильном состоянии уже со второй недели жизни обладают способностью поддерживать постоянство кровоснабжения мозга независимо от изменений центральной гемодинамики.
Н.С. Lou et al [6], обследуя доношенных и недоношенных новорожденных, находившихся в критическом состоянии (перенесших тяжелую асфиксию или имевших тяжелый синдром дыхательных расстройств), методом оценки клиренса радиоактивного ксенона, обнаружили у них прямую связь между мозговым кровотоком и изменениями артериального давления. Авторы назвали этот феномен нарушением ауторегуляции. Позже, с помощью допплерографического метода наличие такой же связи было установлено у глубоконедоношенных детей (с гестационным возрастом менее 31 недели и весом при рождении менее 1501 г) [7]. Из-за отсутствия регуляции мозговой кровоток пассивно следовал за изменениями артериального давления, увеличивая риск развития ишемических поражений при гипотензии и кровоизлияний при повышении артериального давления.
В нашем исследовании мы измеряли не артериальное давление, а непосредственно сердечный выброс у доношенных и недоношенных детей, находившихся в стабильном состоянии. Все обследованные дети живы и, более того, ни у одного ребенка с момента начала наблюдения не появилось новых патологических очагов ишемического или геморрагического генеза в головном мозге.
Мы полагаем, что выявленная нами зависимость мозгового кровотока от сердечного выброса у детей, родившихся ранее 34-й недели гестации, говорит не о тяжести состояния ребенка, а отражает морфологические особенности сосудистой системы мозга на этом этапе развития. К ним можно отнести значительную незрелость в количественном и качественном отношениях всех трех слоев стенок внутримозговых сосудов, а также наличие широких анастомозов между ветвями отдельных артерий и их связь с венами. После 30-32-й недель внутриутробного развития начинается регрессия артериальных анастомозов, бурный рост капиллярной сети, дифференцировка и созревание нервных окончаний и гладко-мышечных компонентов сосудистой стенки. Причем формирование внутримозговой ангиоархитектоники продолжается и у доношенных детей длительное время после рождения [8].
Результаты наших исследований еще раз подчеркивают необходимость максимально щадящей тактики выхаживания детей, родившихся недоношенными. Такое выхаживание должно включать в себя: придание удобного положения, поддержание стабильного уровня температуры тела (в кювезе или кроватке с подогревом), кормление через зонд (поскольку для незрелого ребенка даже акт сосания является серьезной физической нагрузкой), ограничение различных манипуляций, особенно связанных с болевыми ощущениями.
При обследовании новорожденных с перинатальным поражением головного мозга мы рекомендуем пользоваться не абсолютными значениями скоростей артериального кровотока ввиду их значительной вариабельности и зависимости от большого количества внешних факторов, а индексами резистентности, учитывая поправку на гестационный возраст. У недоношенных детей, особенно родившихся ранее 34-й недели гестации, также необходимо регулярно оценивать морфометрические и функциональные показатели сердца для раннего выявления отклонений, которые могут усугубить церебральную патологию.
Литература
УЗИ аппарат HM70A
Читайте также:
