Аутофагально-лизосомальная система расщепления белка - апоптоз
Добавил пользователь Cypher Обновлено: 28.01.2026
Апоптоз представляет собой систему контроля клеточной дифференцировки, обеспечивающую самоуничтожение дефектных структур. Тем самым поддерживая нормальное функционирование целостного организма. Регуляторами апоптоза являются белки семейства Bcl-2, которые могут обладать как антиапоптическими свойствами, так и проапоптическими. Проапоптические белки запускают синтез цитохрома С в миохондриях, провоцирующего образование апоптосомы, активирующей каспазы, которые обладают способностью к денатурации белков, что приводит к гибели клетки. Для обнаружения дефектов в клетке существует белок р53, который при наличии повреждений в клетке активирует синтез проапоптических белков. При недостаточном апоптозе, дефектные клетки пролиферируют, что приводит к их злокачественной трансформации. Злокачественные клетки подвергаются серии генетических изменений. Если это способствует их преимущественному росту над нормальными клетками, то риск развития новообразований значительно возрастает. Потеря предшественника апоптоза - белка P53 является наиболее распространенным механизмом уклонения от гибели. Канцерогенез можно рассматривать как сложный клеточный процесс, который связан с неограниченным репликативным потенциалом, независимостью от сигналов роста и параллельным сопротивлением ингибирующему рост сигналу, уклонение от активации клеточной смерти, устойчивый ангиогенез, а также способность тканевой инвазии и метастазирования.

1. Кузнецов, С.Л. Гистология, цитология и эмбриология / С.Л. Кузнецов, Н.Н. Мушкамбаров Н. - М.: МИА, 2007.
2. Галицкий В.А. Возникновение эукариотических клеток и происхождение апоптоза // Цитология, 2008, том 47, вып. 2, с. 103-120
3. Hanahan D, Weinberg RA: The hallmarks of cancer. Cell. 2000, 100: 57-70. 10.1016/S0092-8674(00)81683-9.
4. Taylor, R. C., Cullen, S. P., and Martin, S. J. (2008). Apoptosis: controlled demolition at the cellular level. Nat. Rev. Mol. Cell Biol. 9, 231-241.
5. Czabotar PE, Lessene G, Strasser A, Adams JM. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy. Nat Rev Mol Cell Biol 2014; 15: 49-63.
7. Galluzzi L, Bravo-San Pedro JM, Vitale I, Aaronson SA, Abrams JM, Adam D et al. Essential versus accessory aspects of cell death: recommendations of the NCCD 2015.
8. McIlwain DR, Berger T, Mak TW. Caspase functions in cell death and disease. Cold Spring Harb Perspect Biol 2013; 5: a008656.
9. Manzl C, Fava LL, Krumschnabel G, Peintner L, Tanzer MC, Soratroi C et al. Death of p53-defective cells triggered by forced mitotic entry in the presence of DNA damage is not uniquely dependent on Caspase-2 or the PIDDosome. Cell Death Dis 2013; 4: e942.
10. Shalini S, Dorstyn L, Dawar S and Kumar S: Old, new and emerging functions of caspases. Cell Death Differ. 22:526-539. 2015.
Клеточный гомеостаз в организме здорового человека определяется балансом между гибелью и пролиферацией клеток. Дефекты, возникающие в процессах дефференцировки и новообразования клеток, ведут к самоуничтожению этих структур [2]. Может показаться парадоксальным, что стимуляция клеточной гибели может способствовать выживанию организма.
Механизм, отвечающий за инициирование и выполнение запрограммированной гибели клеток, называется апоптозом. Он осуществляется под действием внеклеточных или внутриклеточных факторов. Под воздействием этого процесса, ДНК распадается на фрагменты, клетка сжимается, клеточные мембраны разрушаются, происходит элиминация и она поглощается соседней клеткой или специфичной клеткой имунной системы. Особенностью этого процесса является то, что мембрана клетки не разрушается до полного завершения этапов самопроизвольной гибели. Что дает возможность избежать риска возникновения воспалительных процессов. Обычно от начала запуска апоптоза до окончательной клеточной фрагментации требуется несколько часов. Однако этот период зависит от типа клетки, стимула и апоптотического пути [1,2].
Апоптозные клетки выглядят как округлые либо овальные скопления интенсивно эозинофильной цитоплазмы с плотными фрагментами ядерного хроматина [1]. (Рис. 1.).
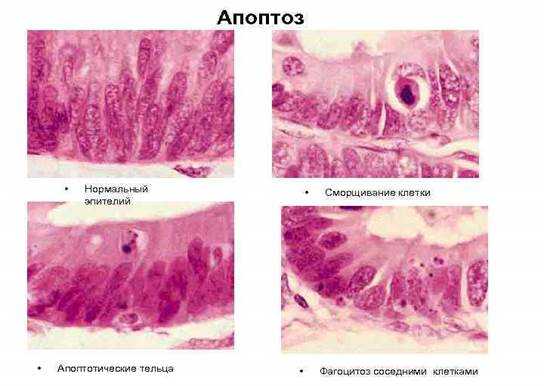
Рис. 1. Стадии апоптоза эпителиальной клетки
Основными регуляторами запрограммированной гибели клеток являются белки, принадлежащие к семейству Bcl-2. Эти белки могут, как активировать апоптоз, то есть быть проапоптотическими, так и ингибировать его, обладая антиапоптотическими свойствами. Антиапоптотические белки в здоровой клетке связывают и инактивируют проапоптотические. Это происходит тогда, когда она не нуждается в гибели [4,5].
Существует два основных пути апоптоза: внутренний и внешний. Внешний путь обеспечивает связывание «лиганд смерти» с «рецептором смерти». Внутренний путь контролируется митохондриями и выделением цитохрома С. Регуляторы апоптоза взаимодействуют со специфическими рецепторами на мембране клетки, называющимися «рецепторы смерти», которые связываются с молекулами, сигнализирующими гибель, как часть внешнего апоптотического пути. Это связывание вызывает эффект апоптоза [7].
Контроль такой элиминации производится в митохондриях, которые обеспечивают внутреннюю часть апоптического пути. В этих органеллах содержатся сигнальные молекулы, связаные с митохондриальной мембраной и известные как цитохром C. В ответ на проапоптотические сигналы из проапоптотических белков, высокую концентрацию Ca 2+ в цитозоле или гипоксию цитохром C высвобождается в клетку митохондриями и связывается с белком. Это приводит к образованию апоптосомы. После образования апоптосома активирует группу белков под названием каспазы, которые денатурируют другие белки в клетках [8]. Так как активные каспазы могут разрушающе воздействовать внутри здоровой клетки, они производятся в неактивной форме - прокаспазы. В фазе апоптоза семейство каспаз представляет собой основные эффекторные молекулы самого процесса элиминации, которые вносят вклад в конечные стадии апоптотической гибели клеток путем компонентов цитоскелетного аппарата и ядерной ДНК [4,9]. Все каспазы подразделяются на инициаторы, эффекторы и стимуляторы. Инициаторы расщепляют и активируют каспазы эффекторы, амплифицируя сигнал. Эффекторы расщепляют различные белки, что приводит к процессу апоптоза. Активация каспаз ведет к запуску протеолитического каскада реакций, провоцирующих гибель клетки [9].
Помимо каспаз, чрезвычайно важным является белок P53, обеспечивая обнаружение повреждения ДНК, аномалий хромосом и остановку клеточного цикла. Если повреждения необратимые, то апоптоз актимируется. P53 активирует процесс путем увеличения продуцирования проапоптотического белка, который активирует каспазный каскад, что в конечном итоге приводит к самоуничтожению клетки [10].
Апоптоз — это защита организма от персистенции пораженных клеток, которые могут оказаться потенциально опасными для многоклеточного организма. Однако, эти процессы могут нарушаться, сопровождаясь либо чрезмерным апоптозом, например, в случае дегенеративных заболеваний, либо недостаточным, что приводит к ускоренной пролиферации дефектных клеток и возникновению онкологии [2]. Проблемы недостаточного самоуничтожения клеток могут возникать на любом этапе апоптоза, что приводит к злокачественной трансформации пораженных клеток, метастазированию опухолей и устойчивости к противоопухолевым препаратам [6]. Следовательно, устойчивость к апоптозу или угнетение этого процесса играют жизненно важную роль в канцерогенезе. Одной из причин торможения процессов самопроизвольной гибели клеток является нарушения баланса проапоптотических и антиапоптотических белков. Проапоптотические (например, Bax, Bad, Bcl-Xs) и антиапоптотические белки (например, Bcl-2, Bcl-XL, Mcl-L и т. Д.) являются двумя основными группами белков семейства Bcl -2. Антиапоптотические белки регулируют апоптоз, блокируя выделение цитохрома С в митохондриях, в то время как проапоптические -стимулируют . Нарушение этого баланса вызывает угнетение процесса апоптоза в пораженных клетках. Причиной может стать как чрезмерная экспрессия антиапоптотических белков, так и проапоптотических или их комбинации.
Так, в основе возникновения В-клеточной лимфомы лежит механизм, подавляющий синтез проапоптического белка семейства Bcl-2, что приводит к торможению апоптоза клеток фолликулярной лимфомы и их пролиферацию [3]. (Рис. 2.).
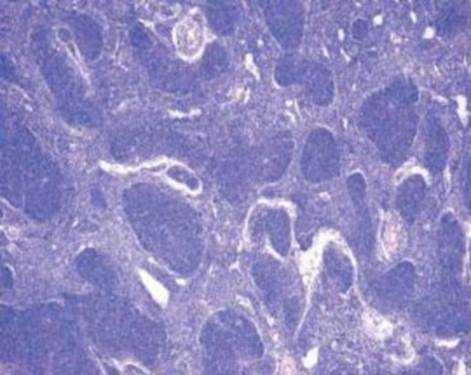
Рис. 2. Гистопрепарат ткани лимфатического узла. Фолликулярная лимфома.
Новообразования можно рассматривать как результат последовательности генетических изменений, в течение которых нормальная клетка превращается в злокачественную. И именно несостоявшийся апоптоз таких клеток является одним из существенных критериев, которые вызывают злокачественную трансформацию [3]. Злокачественные клетки подвергаются серии генетических изменений. Если это способствует их преимущественному росту над нормальными клетками, то риск развития и роста новообразований значительно возрастает. Например, когда в клетках кожи возникают повреждения под воздействием ультрафиолетового излучения (например, солнцем, соляриями), обычно срабатывает апоптоз. Это помогает устранить патологические элементы. Если апоптоз не происходит, такие клетки могут выживать и пролифирировать, превращаясь в злокачественные. (Рис.3.).
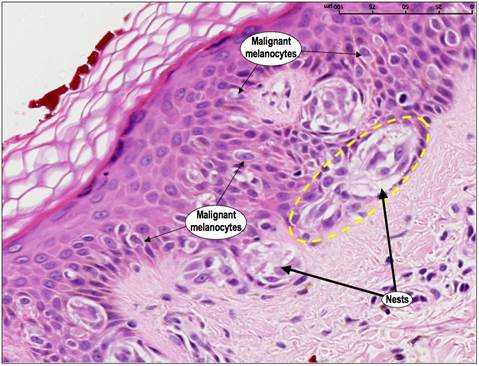
Запрограммированная гибель также играет роль в распространении онкологического процесса. Чтобы злокачественная клетка переместилась в другую часть тела ( метастазирование), она должна уметь выживать в крови или лимфатических системах и проникать в окружающие ткани. Апоптоз предотвращает эти процессы [6]. Наиболее распространенным механизмом уклонения от гибели является потеря предшественника апоптоза - белка P53 или его мутация. Более половины всех онкологических пациентов имеют мутированный или отсутствующий ген, программирующий синтез р53, что приводит к повреждению или отсутствию белка. При некоторых опухолевых процессах р53 трансформируется из активатора апоптоза в ингибитор, тем самым он не только не индуцирует апоптоз, а его блокирует. Это же провоцирует метастазирование новообразований, так как позволяет обходиться злокачественным клеткам без специфического микроокружения, избегая самопроизвольной гибели [3,9]. Однако, ингибирование процессов апоптоза не единственное условие для роста и развития новообразований. Без устойчивого ангиогенеза, самодостаточности сигналов роста и нечувствительности к сигналам против роста, «прото-раковые» клетки все еще могут умирать другими способами, даже если они избегают апоптотической запрограммированной клеточной смерти [6].
Выводы. Таким образом, канцерогенез можно рассматривать как сложный клеточный процесс, который связан с неограниченным репликативным потенциалом, независимостью от сигналов роста и параллельным сопротивлением ингибирующему рост сигналу, уклонение от активации клеточной смерти, устойчивый ангиогенез, а также способность тканевой инвазии и метастазирования. Злокачественные опухоли являются инвазивными и могут метастазировать в отдаленные места через систему кровообращения. Следовательно, метастатическое распространение, а не первичная опухолевая нагрузка, является основной причиной смертей от рака [6,4,7].
Аутофагально-лизосомальная система расщепления белка - апоптоз
Лизосомальные механизмы клеточных повреждений
Участие лизосом в патогенезе заболеваний связано с тремя следующими механизмам: болезни накопления, разрыв лизосом и секреция ферментов.
Болезни накопления обусловлены врожденной недостаточностью одного из лизосомальных ферментов, отвечающих за разрушение или метаболизм целого ряда молекул. Вещества, которые не разрушились, накапливаются в лизосомах преимущественно фагоцитов, а также в клетках печени, нейронах, фибробластах, эпителии почечных канальцев.
Таким образом накапливаются углеводы (гликоген), комплексные мукополисахариды, целый ряд сфинголипидов и других веществ, обусловливая широкий спектр клинических и патологических синдромов. Обычно метаболические аномалии воспроизводятся и в лабораторных условиях на культуре клеток больного. В некоторых случаях (например, синдром Хюрлера, мукополисахаридоз) пересадка донорского гистосовместимого костного мозга позволяет контролировать прогрессирующее развитие болезни.
Разрыв лизосом приводит к массивному поступлению лизосомальных ферментов в клеточную цитоплазму. Разрыв лизосомальной мембраны наблюдают при двух совершенно различных заболеваниях: подагре и силикозе. В первом случае поражаются нейтрофилы, во втором - макрофаги. В обоих случаях фагоцитоз кристаллического материала приводит к образованию аномальных водородных связей между поверхностью фагоцитированной частицы и лизосомальной мембраной. Изменение структуры мембраны приводит к ее разрыву и выходу содержимого лизосом в цитоплазму клетки.
Секрецию лизосомальных ферментов в окружающее пространство обычно осуществляют макрофаги. Установлена связь этого механизма с развитием некоторых видов артрита. При избытке витамина А разрушаются гликозаминогликаны хрящевой ткани, хотя хондроциты остаются вполне жизнеспособными. В эксперименте на животных введение избытка папаина или витамина А (дестабилизатор лизосомальных мембран) приводило к тому, что у кроликов, например, уши становились обвислыми. Это связано с потерей одного из комплексных углеводов в хрящевом матриксе. У больных ревматоидным артритом суставная жидкость содержит лизосомальные ферменты. Очевидно, что в этом случае лизосомальное повреждение участвует в патогенезе заболевания.
Стрессовые протеины
Повреждающие механизмы стрессовых протеинов
При воздействии на клетку внешних стрессовых факторов наблюдают увеличение концентрации высокоагрессивных протеинов в межклеточном пространстве. Этот механизм повреждения клетки наилучшим образом изучен на культуре тканей при температурных повреждениях (т.е. при температурах, на 5 - 1000С превышающих оптимальную для клетки). Поэтому группу повреждающих белков назвали протеинами теплового шока. Название это неточное, поскольку протеины данной группы накапливаются при целом ряде стрессовых (для клетки) состояний, таких как:
- лихорадка;
- ишемия;
- повреждение радикалами кислорода;
- некоторые инфекционные заболевания;
- рак;
- различные химические повреждения, включая повреждения металлами с переменной валентностью (они являются генераторами свободных радикалов), ионами кальция, алкоголем, метаболическими ядами, такими как азиды и различные оксиданты.
На сегодняшний день получены доказательства того, что накопление стресс-протеинов является защитным механизмом, помогающим клетке пережить стресс гораздо более сильный, чем тот, что инициировал синтез самих стресс-протеинов. Например, в случае ишемии миокарда стресс-белки помогают миокарду адаптироваться к состоянию ишемии. Увеличение синтеза различных классов стресс-протеинов наблюдают на многих стадиях развития заболевания.
Общие функции стресс-протеинов:
- участие в сборке всех продуцируемых клеткой белков;
- участие в разборке некоторых структур, например тех, которые вовлечены в процессы репликации ДНК.
Классификация стресс-протеинов
Различают 4 основных класса стресс-протеинов в зависимости от молекулярной массы и скорости миграции в процессе электрофореза (см. таблицу).
Дефицит лизосомной кислой липазы (ДЛКЛ) - редкое аутосомно-рецессивное заболевание, связанное с наличием мутаций в гене LIPA. В статье представлены современные сведения о болезни, описаны наиболее характерные клинико-лабораторные признаки, особенности фермент-заместительной терапии Себелипазой альфа, исходы и прогноз заболевания у детей. Выделяют две формы ДЛКЛ: болезнь Вольмана и болезнь накопления эфиров холестерина (БНЭХ). Возраст начала заболевания и темпы его прогрессирования вариабельны. Манифестация болезни Вольмана наблюдается у пациентов первого полугодия жизни и характеризуется быстрым прогрессированием, имеет неблагоприятный исход в течение первого года жизни. Дебют БНЭХ регистрируется у детей более старшего возраста и взрослых, прогрессирует медленнее и характеризуется менее тяжелым клиническим течением, проявляется гепатоспленомегалией, синдромом цитолиза, гиперхолестеринемией, дислипидемией, микровезикулярным стеатозом в биопсийном материале, формированием фиброза и цирроза печени при отсутствии лечения. Обсуждены имеющиеся в настоящее время возможности пренатальной диагностики, приведен клинический пример БНЭХ и эффективности терапии у пациента детского возраста.
Ключевые слова: дефицит лизосомной кислой липазы, болезнь Вольмана, гиперхолестеринемия, дислипидемия, синдром цитолиза, дети, гепатомегалия.
Lysosomal acid lipase deficiency
Strokova Т.V. 1,2 , Bagaeva M.E. 1,2 , Matinyan I.A. 1
1 Federal Research Center for Nutrition, Biotechnology and Food Safety, Moscow
2 Russian National Research Medical University named after N.I. Pirogov, Moscow
Lysosomal acid lipase deficiency (LAL-D) is a rare autosomal recessive disease associated with the presence of mutations of the LIPA gene. The article presents modern information on the disease associated with a deficiency of lysosomal acid lipase, describes the most common clinical and laboratory signs of the disease, the features of enzyme-replacement therapy by sebelipase alpha, outcomes and prognosis of the disease in children. There are two forms of the disease: Wolman's disease and the accumulation of cholesterol esters. The age of the onset of the disease and the rate of its progression are variable. The manifestation of Wolman's disease is observed in young infants and is characterized by a rapid rate of progression, and has an unfavorable outcome during the first year of life. The debut of the accumulation of cholesterol ester is detected in older children and adults, progresses more slowly and is characterized by a less severe clinical course. The accumulation of esters is manifested by hepatosplenomegaly, cytolysis syndrome, hypercholesterolemia, dyslipidemia, microvesicular steatosis in the biopsy material, the formation of fibrosis and cirrhosis in case of the absence of therapy. The current possibilities of prenatal diagnosis are discussed, a clinical example of the accumulation of cholesterol ester and the effectiveness of therapy in children is given.
Key words: lysosomal acid lipase deficiency, Wolman's disease, hypercholesterolemia, dyslipidemia, cytolysis syndrome, children, hepatomegaly.
For citation: Strokova Т.V., Bagaeva M.E., Matinyan I.A. Lysosomal acid lipase deficiency // RMJ. 2017. № 19. P. 1346-1351.
Статья посвящена редкому наследственному заболеванию, связанному с дефицитом лизосомной кислой липазы
Дефицит лизосомной кислой липазы (ДЛКЛ) - редкое аутосомно-рецессивное заболевание лизосомального накопления, вызванное повреждающими мутациями гена LIPA, кодирующего синтез фермента - лизосомной кислой липазы. Ген LIPA, кодирующий лизосомную кислую липазу (гидролазу эфиров холестерина), расположен на хромосоме 10, имеет 10 экзонов. Пациенты с ДЛКЛ являются, как правило, либо гомозиготами, либо сложными гетерозиготами по мутациям гена LIPA. У некоторых пациентов могут иметь место скрытые мутации [1]. По разным источникам, частота встречаемости ДЛКЛ составляет 1:40 000-1:300 000 [2, 3]. Предполагаемая частота встречаемости в России - 1:100 000-1:150 000.
В норме после связывания с рецептором на поверхности клетки липопротеиды низкой плотности (ЛПНП), в составе которых, как известно, большая часть холестерина находится в виде эфиров холестерина, проникают в клетку, транспортируются внутри эндосомы, сливаются с лизосомой, где фермент лизосомная кислая липаза осуществляет гидролиз эфиров холестерина и триглицеридов до свободного холестерина и жирных кислот. Внутриклеточное накопление свободного холестерина посредством сложных биохимических механизмов приводит к подавляющему воздействию на рецепторы ЛПНП, уменьшению поступления в клетку и снижению синтеза холестерина, а также усилению его этерификации. Вследствие внутриклеточного накопления жирных кислот ингибируется образование фосфолипидов и триглицеридов [4, 5].
При недостаточности лизосомной кислой липазы нарушается распад эфиров холестерина и триглицеридов и происходит их накопление в лизосомах клеток печени, селезенки, кровеносных сосудов, слизистой тонкого кишечника, надпочечников, на поверхности которых определяется высокая плотность рецепторов ЛПНП.
В гепатоцитах больных с ДЛКЛ увеличение синтеза холестерина приводит к увеличению продукции холестерина липопротеидов очень низкой плотности и его секреции. Это, в свою очередь, стимулирует образование холестерина ЛПНП и, таким образом, может выступать в качестве важного содействующего фактора в развитии гиперхолестеринемии при ДЛКЛ [6].
Отложение эфиров холестерина в ткани печени приводит к мелкокапельной жировой дистрофии (также называемого микровезикулярным стеатозом), что вызывает повреждение клеток печени. Маркером этого повреждения является повышенный уровень трансаминаз (АСТ, АЛТ) в сыворотке крови. Поврежденные гепатоциты замещаются соединительной тканью, развиваются фиброз и цирроз печени. Нарушение функции клеток сопровождается дислипидемией с повышенным уровнем общего холестерина в сыворотке крови, высоким уровнем холестерина ЛПНП, аполипопротеина В, низким уровнем холестерина липопротеинов высокой плотности (ЛПВП), повышенным или нормальным уровнем триглицеридов. Изменения в липидограмме соответствуют изменениям при дислипидемии IIb, что приводит к ускоренному развитию атеросклероза, сердечно-сосудистых нарушений и преждевременной смертности [2, 7].
Отложение эфиров холестерина в клетках слизистой оболочки кишечника вызывает развитие синдрома мальабсорбции, проявляющегося разной степенью выраженности диареи, стеатореи, а также синдромом избыточного бактериального роста, метеоризмом.
Увеличение селезенки может быть связано с накоплением эфиров холестерина в клетках, а также с прогрессированием заболевания, портальной гипертензией.
Возраст начала заболевания и темпы его прогрессирования в значительной степени вариабельны и могут быть связаны с природой лежащих в основе мутаций и количественным показателем остаточной ферментативной активности [8, 9].
Клиника
Диагностика
Обследование пациентов включает целый ряд исследований, которые помогут сориентировать врача в нужном направлении диагностического поиска.
В клиническом анализе крови обращают на себя внимание нормоцитарная анемия, переходящая в гипохромную анемию. Анемия более выражена у детей с болезнью Вольмана. У части пациентов с ДЛКЛ определяется повышенная СОЭ. При прогрессировании цирроза печени при ДЛКЛ нарастают лейко- и тромбоцитопения.
Основными биохимическими характеристиками заболевания являются синдром цитолиза, гиперхолестеринемия, дислипидемия (повышение ЛПНП, триглицеридов, аполипопротеина В, снижение ЛПВП) [16]. На стадии цирроза печени о нарастании белково-синтетической недостаточности свидетельствуют гипопротеинемия, гипоальбуминемия, возможно снижение уровня холестерина до нормальных значений.
Основные диагностические маркеры ДЛКЛ, подтверждающие заболевание: дефицит активности лизосомной кислой липазы и мутации гена LIPA (однако в некоторых случаях при использовании стандартных методов клинической диагностики мутации не обнаруживаются) [2]. Уровень лизосомной кислой липазы определяется в сухом пятне крови на специальных фильтрах, применяемых, например, для неонатального скрининга. Преимуществами метода являются небольшой объем образца, транспортировка в специализированные лаборатории при температуре окружающей среды, а также возможность длительного хранения.
Молекулярно-генетическое исследование позволяет выявить мутации в гене LIPA кодирующих и прилегающих интронных областей. Большинство пациентов являются гомозиготами или сложными гетерозиготами по мутациям гена LIPA. У некоторых больных могут иметь место протяженные делеции, не выявляемые при проведении обычного генетического скрининга [2].
Важными визуализирующими методами диагностики являются УЗИ органов брюшной полости и забрюшинного пространства, рентгенография, МРТ.
УЗИ при подозрении на ДЛКЛ оценивает состояние печени, селезенки, надпочечников, диаметра стволов воротной и селезеночной вен. У пациентов с ДЛКЛ определяются увеличение размеров печени (верхне-нижних размеров правой и левой долей), гиперэхогенность и мелкоочаговая диффузная неоднородность паренхимы печени, у части больных - ослабление ультразвука в дистальных отделах паренхимы печени. У части пациентов отмечается увеличение селезенки, а при дальнейшем прогрессировании болезни - расширение ствола воротной и селезеночной вен, что свидетельствует о нарастании портальной гипертензии. При УЗИ можно определить кальцинаты в надпочечниках, которые говорят также в пользу болезни Вольмана.
При проведении рентгенологического исследования органов брюшной полости определяются увеличенные надпочечники полулунной или пирамидной формы с наличием точечных очагов кальцификации по всей паренхиме.
При проведении МРТ органов брюшной полости выявляют гепатоспленомегалию, при болезни Вольмана определяются гипертрофированные брыжеечные и периаортальные лимфатические узлы. Проведение МРТ необходимо для оценки степени жировой дистрофии печени, а также характера течения заболевания и эффективности проводимой патогенетической терапии [17].
При выявлении признаков портальной гипертензии, проводят эзофагогастродуоденоскопию для определения варикозного расширения вен пищевода и оценки риска возможного кровотечения.
Биопсию печени с последующим исследованием морфологической картины рекомендуют, если нет возможности применить иные, неинвазивные методы диагностики ДЛКЛ [18, 19]. При морфологическом исследовании ткани печени определяется стадия заболевания.
Макропрепарат биоптата печени имеет желто-оранжевую окраску, а при проведении гистологического анализа выявляются различные степени портального и перилобулярного фиброза, а также выраженный микровезикулярный стеатоз в связи с накоплением эфиров холестерина и триглицеридов в лизосомах гепатоцитов [20]. Характерная черта - наличие в значительной степени гипертрофированных клеток Купфера и портальных макрофагов с пенистой, окрашиваемой в коричневатый цвет, резко ШИК-положительной цитоплазмой.
Результаты визуализирующих методов обследования и биопсии печени являются диагностическими в отношении ДЛКЛ. Учитывая, что ДЛКЛ - мультисистемное заболевание, при необходимости требуется проведение исследований сердечно-сосудистой системы (ЭКГ, Эхо-КГ, допплерография сосудов головы и шеи и т. д.).
Дифференциальный диагноз проводят с различными болезнями печени, нарушениями липидного обмена. Тактика дифференциального диагноза зависит от формы ДЛКЛ. При болезни Вольмана необходимо исключить все заболевания с гепатоспленомегалией, поражением печени, кишечника, мозга: болезнь Ниманна - Пика, тип IA; болезнь Гоше, тип II; GM1- ганглиозидоз; болезнь Фабера; атипичные формы галактосиалидоза; галактоземию, тип I; наследственную непереносимость фруктозы; тирозинемию, тип I. БНЭХ необходимо дифференцировать с большим количеством различных болезней, протекающих с гепатомегалией, синдромом цитолиза и нарушениями липидного обмена, а также с неалкогольной жировой болезнью печени.
Лечение
Единственным патогенетическим методом лечения является длительная ферментная заместительная терапия препаратом Себелипаза альфа. Лечение ДЛКЛ заключается в восстановлении сниженного уровня фермента для предотвращения накопления эфиров холестерина и триглицеридов и, как следствие, восстановлении нормальной функции органа. Препарат Себелипаза альфа - это рекомбинантная кислая лизосомная липаза человека. Действующее вещество попадает в лизосомы клеток за счет связывания со специфическими рецепторами, где оказывает непосредственный терапевтический эффект. Доза препарата зависит от формы болезни: при болезни Вольмана она составляет 3 мг/кг/сут, при БНЭХ - 1 мг/кг внутривенно капельно. Режим введения при БНЭХ - 1 раз в 2 нед., при болезни Вольмана, при наличии показаний, возможно более частое проведение инфузий - 1 раз в неделю. В клинических исследованиях продемонстрировано улучшение биохимических показателей (нормализация уровня трансаминаз, показателей липидограммы), морфологической картины в биоптатах печени, а также увеличение выживаемости пациентов [21]. Препарат разрешен к применению во многих европейских странах, США, Японии. На территории РФ ожидается регистрация препарата.
При отсутствии патогенетической терапии проводится симптоматическая терапия. При нарушении всасывания и задержке развития, а также для коррекции липидного обмена необходима консультация диетолога в целях оптимизации питания. Клинические проявления надпочечниковой недостаточности требуют назначения заместительной гормональной терапии, выраженная анемия и тромбоцитопения - переливания крови и ее компонентов.
Прогноз зависит от формы заболевания и выраженности клинических проявлений. При своевременной диагностике заболевания и начале патогенетической терапии прогноз благоприятный. При болезни Вольмана без проведения фермент-заместительной терапии летальный исход наступает на первом году жизни.
В связи с высоким риском болезни (25%) в семьях, имеющих ребенка с ДЛКЛ, требуется обследование всех детей, т. к. заболевание в течение длительного времени может протекать без выраженной клинической симптоматики.
При наличии в семье ребенка с подтвержденным диагнозом ДЛКЛ для определения риска повторного рождения ребенка с данным заболеванием необходимо медико-генетическое консультирование. Возможна пренатальная диагностика: определение активности кислой липазы в культурах ворсин хориона и молекулярно-генетическое исследование на 9-11-й неделе беременности или исследование амниотической жидкости на 20-22-й неделе [1].
В нашем центре было обследовано 20 детей с ДЛКЛ, все дети - с БНЭХ. Мы неоднократно докладывали о результатах обследования и характере течения болезни [22]. Ниже приведен клинический случай ДЛКЛ у мальчика с установленным диагнозом ДЛКЛ.
Клинический случай ДЛКЛ (БНЭХ)
Заключение
Таким образом, при ДЛКЛ наблюдается прогрессирующее поражение печени с гепатомегалией, повышенным уровнем трансаминаз, микровезикулярным стеатозом. Низкая распространенность, неспецифичность клинико-лабораторных признаков болезни объясняют ее недостаточную выявляемость.
Следует помнить, что болезнь Вольмана необходимо исключить у любого ребенка первых месяцев жизни с постоянной рвотой или диареей, отставанием в развитии, гепатоспленомегалией, синдромом мальабсорбции. Выявление увеличенных надпочечников с кальцификацией - прямое показание к исследованию уровня кислой лизосомной липазы и молекулярно-генетическому исследованию. Идентичность липидных профилей при БНЭХ с большой группой заболеваний, особенно при выявлении синдрома цитолиза, свидетельствует о том, что необходимо исключать ДЛКЛ, если предполагаются наследственные нарушения липидного обмена.
X Международная студенческая научная конференция Студенческий научный форум - 2018

В программе клетки заложены не только этапы ее развития, специфика функций, но и ее самоуничтожение. Явление запрограммированной гибели клетки известно давно и получило название «апоптоза». Апоптоз — генетически управляемый процесс и может быть включен различными пусковыми сигналами без существенного предварительного повреждения исполнительного аппарата клетки или после умеренного повреждения органелл. Органеллы так же могут быть подвержены физиологическим повреждениям и нарушению их функции.Это не всегда ведет к апоптозу,чаще к непоправимым изменениям в нашем организме.
Патологии клеточных органелл весьма опасное явление в нашем организме, оно может быть обусловлено различными факторами.При нарушении работы и строения клеточных органелл функции органов и систем человека будут нарушены .
Цель:Рассмотреть различные варианты патологий клеточных органелл.
Патология митохондрий в большинстве случаев сопровождается развитием разобщения процессов дыхания и фосфорилирования.
Разобщение дыхания и фосфорилирования может осуществляться несколькими путями;
1. Токсическое действие на клетки ряда ядовитых веществ сводится к избирательной блокаде некоторых звеньев цепи переноса электронов, т.е. они являются ингибиторами дыхания. Примером могут служить цианиды: цианистый водород, цианистый калий, цианистый натрий, попадание которых в организм приводит к быстрой смерти в результате жадного связывания цианистым анионом CN атома железа в цитохроме Аз. Противогрибко- вый антибиотик антимицин А оказывает токсическое действие на клетки млекопитающих, избирательно блокируя перенос электронов между цитохромами В и С|.
Барбитурат барбамил и инсектицид ротенон относятся к веществам, которые блокируют «низко» расположенные звенья цепи переноса электронов, действуя на уровне флавопротеидов. Все они в первую очередь действуют на окислительно-восстановительные реакции в дыхательной цепи, блокируя поток электронов. Кроме того, они препятствуют образованию АТФ путем окислительного фосфорилирования, что и объясняет причину их токсичности.
2. Существуют также ингибиторы, которые действуют непосредственно на процесс образования АТФ и, таким образом, нарушают механизмы сопряжения в окислительном фосфорилировании.
а. Разобщающие агенты, например, нитрофенолы (динитрофенол — ДНФ), галофенолы (тироксин и пентахлорфенол) не влияют на движение потока электронов по дыхательной цепи, значительно повышают скорость процессов клеточного дыхания. Однако, такое ускорение дыхания не приводит к образованию АТФ. Это приводит к бесплодному дыханию, при котором освобождающаяся энергия целиком рассеивается в виде тепла.
б. Вещества, действующие непосредственно на ферментную систему превращения АДФ в АТФ. Примером может служить антибиотик олиго- мицин.
3. Набухание митохондрий (как это имеет место, например, при действии тироксина, вазопрессина, инсулина, жирных кислот) приводит к удалению друг от друга ферментов окисления и фосфорилирования, что также уменьшает сопряженность этих процессов.
4. Возможен при ряде патологических процессов, сопровождающихся повышением проницаемости митохондриальных мембран, выход ферментов в цитоплазму клетки, где процессы окисления и фосфорилирования также идут независимо друг от друга.
5. Длинноцепочечные жирные кислоты блокируют АДФ-АТФ-трансло- казу. Такой же эффект оказывает атрактилозид — токсический гликозид, полученный из средиземноморских растений.
6. Нарушение транспорта через мембрану митохондрий различных ионов и веществ. Салицилаты, ионы щелочно-земельных металлов влияют на транспорт и функцию Са' (как и ионы некоторых редкоземельных металлов). Йоны тяжелых металлов способны блокировать Н-группы носителей. Блокируют транспорт и вещества, образующие радикалы, способные окислять цепи насыщенных жирных кислот в процессе липопероксидации.
Говоря о материнском происхождении пероксисом и митохондрий, следует отметить, что они (так же, как аппарат Гольджи, лизосомы и ЭР) происходят из женской гаметы, которая после оплодотворения мужской гаметой становится зиготой, и далее ее структурнофункциональные элементы передаются каждой соматической клетке в ходе развития многоклеточного организма.
Передача цитоплазмы из клетки в клетку идет в три этапа:
• первый этап (митоз) - цитоплазма исходно делящейся соматической клетки поступает только в одну из двух образующихся дочерних клеток;
• второй этап (мейоз) - дочерняя клетка, получившая всю цитоплазму материнской клетки, в свою очередь делится на две дочерние клетки, в одну из которых передается вся цитоплазма; вторая дочерняя клетка цитоплазму не получает;
• третий этап - одна из четырех дочерних клеток, получившая цитоплазму, становится функционально активной, способной к
оплодотворению яйцеклеткой; три другие дочерние клетки цитоплазму не получают - это полярные тельца.
Иными словами, передача цитоплазмы (и ее структур) от исходной соматической клетки идет исключительно через женские гаметы по линии мать-дочь. Это материнское наследование.
Однако полное материнское наследование возможно только в случае, если в зиготу не попадут даже единичные отцовские митохондрии или их деление будет заблокировано. Данный факт имеет принципиальное значение для понимания механизмов формирования полиморфизма мтДНК, ибо при отсутствии митохондрий отцовского происхождения невозможен кроссинговер между родительскими гомологами мтДНК и образование новых комбинаций митохондриальных генов, т.е. мтДНК - всегда материнского происхождения. Как показали результаты выполнения международной программы «Геном человека», мтДНК, выделенная из костей черепа современного человека, по нуклеотидному составу соответствует мтДНК, выделенной из костей черепа ископаемого человека, проживавшего на севере африканского континента предположительно 150-200 тыс. лет тому назад. Данный факт был положен в основу гипотезы Г. Уилсона (1987) о происхождении вида: Homo sapiens (Человек разумный) произошел от этого ископаемого первобытного человека.
Гиперплазию рибосом изучали главным образом в связи с действием некоторых стимуляторов на клетке, отличающейся в норме малой популяцией рибосом (например, лимфоциты). Такими стимуляторами служат: растительное вещесі во фитогемоагглютинин и некоторые антигены (например, микобактерии туберкулеза). При таких воздействиях численность рибосом в клетке быстро и значительно увеличивается. Эту реакцию используют при иммунологических реакциях (реакция бласттрансформации).
При некоторых противоположных условиях можно констатировать уменьшение популяции рибосом; например, в клетках печени, в которых подавлен синтез белка, рибосомы не образуются; синтез белка, следовательно, прекращен.
Кроме того, удается наблюдать довольно любопытное явление: выход рибосом из клегки посредством «взлома» и переход их в межклеточное пространство.
Многие лекарственные препараты, в частности антибиотики, могут изменять состояние и активность рибосом. Тетрациклины конкурируют с комплексом тРНК-аминокислота за связывание с зоной А большой рибосомной субьединицы. Стрептомицин, соединяясь с ЗО-субъединицей рибосомы, мешает правильному «чтению» кодов мРНК. Левомицетин связывается с крупными субъединицами рибосом и блокирует пептидилтраисферазу.
ЛИЗОСОМЫ. Среди клеточных органелл особого внимания заслуживают лизосомы, представляющие собой скопление (вместилище) приблизительно 40 гидролитических ферментов
Недостаточная активность лизосомальных ферментов является причиной так называемых болезней накопления. Важнейшие из них: гликогеноз типа II (болезнь Помпе), болезнь Гоше, болезнь Ниманна-Пика, метахроматическая лейкодистрофия, фукозидоз, ганглиозидоз, болезнь Фабри, болезнь Тея-Сакса и многие другие.
Болезни накопления характеризуют следующие черты:
1. Патологическое, вызванное недостатком активности соответствующих ферментов, накопление различных веществ, которые, скапливаясь в системе клеточных вакуолей, вызывают расширение лизосом.
2. Накапливаемые продукты довольно неоднородны из-за того, что действие лизосомальных ферментов мало специфично. Они гидролизируют определенные субстраты, а не конкретные связи. Например, фукозидаза отщепляет фукозу от различных субстратов, что приводит к накоплению в клетках липомукополисахаридов.
3. Лизосомные болезни имеют проградиентное течение: они возникают с рождением и более или менее быстро приводят к смерти.
4. Ферментный дефект, как при многих наследственных заболеваниях, затрагивает различные ткани.
ЭНДОПЛАЗМАТИЧЕСКАЯ СЕТЬ. На эндоплазматическую сеть в клетках возложены важные физиологические функции накопления и распределения веществ: ее патология составляет, следовательно, важную главу патологии клетки.
На рибосомах, прикрепленных к мембранам эндоплазма гической сети, происходит синтез белков. Структуры эндоплазматической сети выполняют при этом функцию опоры, а также накопления и распределения продукта. Это имеет большое значение для понимания функции экзокринных желез и клеток, участвующих в иммунологических реакциях выработки, накопления и распределения глобулинов, антител или ферментов.
Существует связь между агранулярной сетью и биосинтезом холестерина. Клеточные гомогенаты, содержащие агранулярные мембраны эндоплазматической сети, способны синтезировать из ацетатов холестерин и другие стерины. С этих позиций становится понятно, почему в клетках желез, продуцирующих стероиды (желтые тела, интерстициональные клетки семенника, корковое вещество надпочечника), особенно интенсивно развита агранулярная сеть.
Самые разнообразные воздействия могут вызывать изменения эндоплазматической сети — ее гипертрофию или атрофию, а также изменение ее ультраструктуры.
Изменения структуры эндоплазматической сети может касаться объема цистерн (или мешочков) и присутствия или отсутствия рибосом, прикрепленных к мембранам.
При голодании уменьшается доля шероховатой сети и увеличивается доля агранулярной. Люминал, наряду с набуханием цистерн и митохондрий, также вызывает гипертрофию гладкой сети.
В процессе исследования печеночной клетки удалось выявить связь между эндоплазматической сетью и гликогеном. Есть достаточно оснований считать, что существует связь между гладкими мембранами эндоплазматической сети и гликогенолизом в печени. У экспериментальных животных, получавших люминал, одновременно с гипертрофией агранулярной сети отмечалось снижение содержания гликогена. Гипертрофия гладкой эндоплазматической сети связана не с исчезновением гранул, а с белее интенсивным развитием мембран. Следовательно, в мембранах сети содержатся ферменты, способные вызывать распад гликогена. Возможно также, что гликогенолитические ферменты находятся в цитоплазме и увеличивают свою активность, чтобы удовлетворить возросшим требованиям, связанным с синтезом новых агранулярных мембран.
В системе гладкого эндоплазматического ретикулума, свободного от рибосом, протекают окислительные процессы, необходимые, например, для детоксикации некоторых лекарственных препаратов (в частности, барбитуратов). При систематическом поступлении таких веществ в организм в течение длительного периода времени наблюдается адаптивное накопление гладкого эндоплазматического ретикулума в клетках печени, что обусловлено индуцированным синтезом новых мембран для повышения интенсивности процесса детоксикации.
ПЕРОКСИСОМЫ (микротельца). Топографически тесно связаны с эндоплазматической сетью. Патология может быть приобретенной — алкогольная интоксикация приводит к увеличению их числа, а гипоксия, ионизирующая радиация вызывают уменьшение их количества в клетке, так и наследственной — «пероксисомные болезни», характеризующиеся патологией обмена в результате дефицита и (или) дефекта отдельных ферментов пероксисом либо в результате сниженного содержания или полного отсутствия микротелец.
Эндоплазматический ретикулум пронизывает цитоплазму и в некоторых местах сливается с ядром, плазматической мембраной и АППАРАТОМ ГОЛЬДЖИ. Аппарат Гольджи состоит из целого ряда как бы сложенных стопкой канальцев, содержащих секреторные белки.
Наиболее частые изменения состоят в распаде уплощенных мешочков и усиленном образовании в нем мелких пузырьков. Эти изменения отмечаются в раковых клетках.
Аппарат Гольджи подвергается фрагментации на гранулы в ходе дегенеративных изменений клетки. Возможно, что эти гранулы превращаются в капельки жира. Эти изменения наблюдаются в ходе медленного аутолиза клетки. Если аутолиз протекает быстро, аппарат Гольджи как будто не успевает реагировать.
МИКРОТРУБОЧКИ, МИКРОФИЛАМЕНТЫ, ПРОМЕЖУТОЧНЫЕ ФИЛАМЕНТЫ (цитокерагины, нейрофиламенты, глиальные нити) — формируют «скелет» клетки и обеспечивают опорную, транспортную, контрактильную, двигательную функции. Их повреждение имеет следствием нарушение гока секреторных гранул или жидкостей, ми готического деления клеток, нарушение фагоцитарной активности фагоцитов, нарушение упорядоченного движения ресничек клеток эпителия дыхательных путей или «хвоста» сперматозоида (эквивалент реснички).
ГИАЛОПЛАЗМА— жидкая слабовязкая внутренняя среда клетки, включающая в себя внутриклеточную жидкость и различные структуры: органеллы, метаплазматические образования и включения. Ее состав отличается в различных регионах клетки. Под влиянием повреждающих факторов происходят следующие изменения:
— нарушение упорядоченного характера циркуляции цитоплазматической жидкости (вариантами дисциркуляторных расстройств являются изменение скорости транспорта нейромедиаторов по аксону от тела нейрона к синапсу, замедление движения подвижных клеток — медленное перемещение гиалоплазмы в псевдоподии нейтрофилов);
— «парциальный» отек— отек ядра, митохондрий или микрофибрилл и т.д.;
— протеолиз или коагуляция белка;
— образование «включений», в норме не встречающихся;
— увеличение или уменьшение в ней жидкости (пример: осмотическое набухание клетки или наоборот потеря ею жидкости);
— поступление ферментов из клеточных органелл.
КЛЕТОЧНЫЕ МЕМБРАНЫ. Патология клеточных мембран частично носит наследственный характер, частично приобретенный.
К самым мощным факторам, повреждающим клеточные мембраны, относятся свободные радикалы, вызывающие в клетке неконтролируемые реакции. В небольшом количестве свободные радикалы присутствуют в физиологических условиях, однако основным источником их служит ионизирующее или упырафиолетовое излучение, а іакже искусственные полимеры. Радикалы имеют свободную валентность и легко вступают в различные химические реакции.
Наиболее чувствительны к патогенному действию свободных радикалов липиды клеточных мембран и нуклеиновые кислоты. Кроме них могут повреждаться также белки и углеводы. Данные повреждения имеют место при лучевой болезни, влияние канцерогенных факторов, а также интоксикации (в том числе при алкогольном гепатите).
именно в мембранах чаще всего наблюдается окислительное повреждение полинена- сыщенных жирных кислот.
В пределах клеточной мембраны особенно подвержены перекисному окислению ароматические аминокислотные остатки. Отдавая свой водород свободным радикалам, они деформируются, что повышает вероятность повреждения и самой клеточной мембраны.
Особенно подвержены перекисному окислению и ненасыщенные жирные кислоты. Атом углерода, расположенный у них рядом с двойной связью, например в положении 8 и 11, лишь весьма слабо связан со своими атомами водорода. Такой атом углерода называют метиленовым, а его водород— алкильным. В присутствии даже незначительного количества оксидантов происходит окисление, при котором алкильный водород переходит к окислителю, в результате чего возникает центр радикалов с СН2-мети- леновым углеродом. Этот алкильный радикал становится весьма активным и превращается в «пергидрокси» — радикал.
Таким образом, «гидро пер окси»-группы присоединяются к С Н2-метиленовому углероду жирных кислот. Это вызывает цепочку реакций, изменяющих структуру, а затем и функцию мембран
Однако повреждение клеточных мембран может быть обусловлено и другими механизмами. При действии металлов, особенно тяжелых, они, соединяясь с биологически активными группами — карбоксильными, фосфатными, имидазольными, сульфгидрильными, дисульфидными и т.п., подавляют биологические реакции мембран (трансмембранный транспорт, агглютинацию клеток), причем особенно большим сродством к SH-группам отличаются ртугь, серебро и медь.
Заключение. Клиническое проявление отдельных форм МТБ может изменяться, например, в случаях «обменов» симптомами между разными нозологиями, что затрудняет их диагностику. Только в последние годы, когда были идентифицированы разные типы мутаций мтДНК, удалось систематизировать нозологии с учетом обусловливающих их развитие молекулярных механизмов, связанных с расстройствами процессов окисления и фосфорилирования в митохондриях, и каждый синдром стал определяться в зависимости от конкретной мутации. Молекулярно-
генетическая диагностика МТБ направлена на идентификацию мутаций мтДНК, включая выявление нуклеотидных замен в генах, кодирующих полипептиды (миссенс-мутации); нуклеотидных замен в генах, кодирующих тРНК; делеций и вставок в мтДНК; мутаций, изменяющих число копий мтДНК. Важными для диагностики являются морфологические изменения в мышечной ткани - РКМВ. Этот признак более свойственен состояниям, обусловленным крупными делециями мтДНК. Основными диагностическими тестами служат:
• обнаружение в биоптатах тканей гетероплазии или неравномерного распределения митохондрий с мутантной ДНК по тканям в эмбриональном периоде, что ведет к поражению мышц, печени и др.;
• выявление при ДНК-анализе в клетках разных тканей протяженных делеций или точковых мутаций мтДНК, которые реплицируются быстрее и поэтому быстро накапливаются;
• повышение концентрации метаболитов (в крови и мышечных биоптатах), являющихся биохимическими маркерами нарушений окислительного фосфорилирования;
• нарушение активности ферментов дыхательной цепи митохондрий в мышечном биоптате (дефицит дегидрогеназы, цитохромс-оксидазы).
2. В. А. Черешнев Б. Г. Юшков. ПАТОФИЗИОЛОГИЯ. 2001
3. Киберленинка.Болезни клеточных органелл.
4.Мутовин Г.Р Клиническая генетика. Геномика и протеомика наследственной патологии : учеб. пособие. - 3-е изд., перераб. и доп. - 2010. - 832 с.
VIII Международная студенческая научная конференция Студенческий научный форум - 2016
Апоптоз - программированная клеточная гибель, энергетически зависимый, генетически контролируемый процесс, который запускается специфическими сигналами и избавляет организм от ослабленных, ненужных или повреждённых клеток. Ежедневно, примерно около 5% клеток организма подвергаются апоптозу, а их место занимают новые клетки. В процессе апоптоза клетка исчезает бесследно в течение 15-120 минут.
Запрограммированная клеточная гибель это биохимически специфический тип гибели клетки, который характеризуется активацией нелизосомных эндогенных эндонуклеаз, которые расщепляют ядерную ДНК на маленькие фрагменты. Морфологически апоптоз проявляется гибелью единичных, беспорядочно расположенных клеток, что сопровождается формированием округлых, окруженных мембраной телец (“апоптотические тельца”), которые тут же фагоцитируются окружающими клетками.
Апоптоз - энергозависимый процесс, посредством которого удаляются нежелательные и дефектные клетки организма. Он играет большую роль в морфогенезе и является механизмом постоянного контроля размеров органов. При снижении апоптоза происходит накопление клеток, пример - опухолевый рост. При увеличении апоптоза наблюдается прогрессивное уменьшение количества клеток в ткани, пример - атрофия.
Морфологические проявления апоптоза.
Апоптоз имеет свои отличительные морфологические признаки, как на светооптическом, так и на ультраструктурном уровне. При окраске гематоксилином и эозином апоптоз определяется в единичных клетках или небольших группах клеток. Апоптотические клетки выглядят как округлые или овальные скопления интенсивно эозинофильной цитоплазмы с плотными фрагментами ядерного хроматина. Поскольку сжатие клетки и формирование апоптотических телец происходит быстро и также быстро они фагоцитируются, распадаются или выбрасываются в просвет органа, то на гистологических препаратах он обнаруживается в случаях его значительной выраженности. К тому же апоптоз - в отличие от некроза - никогда не сопровождается воспалительной реакцией, что также затрудняет его гистологическое выявление.
Наиболее четко морфологические признаки выявляются при электронной микроскопии. Для клетки, подвергающейся апоптозу характерно:
Сжатие клетки. Клетка уменьшается в размерах; цитоплазма уплотняется; органеллы, которые выглядят относительно нормальными, располагаются более компактно. Предполагается, что нарушение формы и объема клетки происходит в результате активации в апоптотических клетках трансглютаминазы. Этот фермент вызывает прогрессивное образование перекрестных связей в цитоплазматических белках, что приводит к формированию своеобразной оболочки под клеточной мембраной, подобно ороговевающим клеткам эпителия.
Конденсация хроматина. Это наиболее характерное проявление апоптоза. Хроматин конденсируется по периферии, под мембраной ядра, при этом образуются четко очерченные плотные массы различной формы и размеров. Ядро же может разрываться на два или несколько фрагментов. Механизм конденсации хроматина изучен достаточно хорошо. Он обусловлен расщеплением ядерной ДНК в местах, связывающих отдельные нуклеосомы, что приводит к развитию большого количества фрагментов, в которых число пар оснований делится на 180-200. При электрофорезе фрагменты дают характерную картину лестницы. Эта картина отличается от таковой при некрозе клеток, где длина фрагментов ДНК варьирует.
Формирование в цитоплазме полостей и апоптотических телец. В апоптотической клетке первоначально формируются глубокие впячивания поверхности с образованием полостей, что приводит к фрагментации клетки и формированию окруженных мембраной апоптотических телец, состоящих из цитоплазмы и плотно расположенных органелл, с или без фрагментов ядра.
Фагоцитоз апоптотических телец. Фагоцитоз апоптотических клеток или телец осуществляется окружающими здоровыми клетками, или паренхиматозными, или макрофагами. Апоптотические тельца быстро разрушаются в лизосомах, а окружающие клетки либо мигрируют, либо делятся, чтобы заполнить освободившееся после гибели клетки пространство. Фагоцитоз апоптотических телец макрофагами или другими клетками активируется рецепторами на этих клетках: они захватывают и поглощают апоптотические клетки. Один из таких рецепторов на макрофагах - рецептор витронектина, который является β3-интегрином и активирует фагоцитоз апоптотических нейтрофилов.
Участие апоптоза в физиологических и патологических процессах
Запрограммированном разрушении клеток во время эмбриогенеза (включая имплантацию, органогенез). Несмотря на то, что при эмбриогенезе апоптоз не всегда является отражением “запрограммированной смерти клетки”, это определение апоптоза широко используют различные исследователи.
Гормон-зависимой инволюции органов у взрослых, например, отторжение эндометрия во время менструального цикла, атрезии фолликулов в яичниках в менопаузе и регрессия молочной железы после прекращения лактации.
Удалении некоторых клеток при пролиферации клеточной популяции.
Гибели отдельных клеток в опухолях, в основном при ее регрессии, но также и в активно растущей опухоли.
Гибели клеток иммунной системы, как В -, так и Т-лимфоцитов, после истощения запасов цитокинов, а также гибели аутореактивных Т-клеток при развитии в тимусе.
Патологической атрофии гормон-зависимых органов, например, атрофии предстательной железы после кастрации и истощении лимфоцитов в тимусе при терапии глюкокортикоидами.
Патологической атрофии паренхиматозных органов после обтурации выводных протоков, что наблюдается в поджелудочной и слюнных железах, почках.
Гибели клеток, вызванных действием цитотоксических Т-клеток, например, при отторжении трансплантата и болезни “трансплантат против хозяина”.
Повреждении клеток при некоторых вирусных заболеваниях, например, при вирусном гепатите, когда фрагменты апоптотических клеток обнаруживаются в печени, как тельца Каунсильмана.
Гибели клеток при действии различных повреждающих факторов, которые способны вызвать некроз, но действующих в небольших дозах, например, при действии высокой температуры, ионизирующего излучения, противоопухолевых препаратов.
Биохимия апоптоза.
Активация цистеиновых (и некоторых других) протеаз — наиболее универсальная черта программируемой клеточной гибели независимо от организма, в котором она происходит. Основные участники программируемой клеточной гибели, каспазы («caspase» от «cysteine aspase») — это семейство эволюционно консервативных цистеиновых протеаз, которые специфически расщепляют белки по остаткам аспарагиновой кислоты. В настоящее время идентифицировано 10 каспаз. При апоптозе помимо активации цистеиновых протеаз, у растений выявлено возрастание активности сериновой и аспарагиновой протеаз.
Кроме того, в апоптозе принимают участие и другие протеазы, прежде всего, кальпаины, или Са2+-зависимые протеазы и убиквитин (протеаза, ковалентно связывающаяся с белком-мишенью). Эти протеазы — обязательный компонент каскада протеолитических ферментов. Так, ингибиторы кальпаина блокируют апоптоз. Убиквитин-протеосомный путь деградации белков активируется при апоптозе.
Роль каспаз в апоптозе разнообразна. Результатом активности протеаз являются характерные изменения в морфологии клеток при апоптозе.1. Гидролиз белков ламинов, армирующих ядерную мембрану. Это ведет к распаду ядерной оболочки и конденсации хроматина. Мишенями протеаз при апоптозе являются также белки ядрышек, гистоны и негистоновые белки и топоизомераза. Топоизомераза — связующее звено между ДНК хроматина и белковыми структурами ядра, с помощью которого хроматин прикрепляется к ядерному матриксу. Расщепление топоизомеразы — это этап образования высокомолекулярных фрагментов ДНК.
2. Расщепление антиапоптозных белков — протеолиз ингибитора ДНКазы, ответственной за фрагментацию ДНК. В нормальных клетках апоптозная ДНКаза CAD (caspase-activated DNase) образует неактивный комплекс с ингибитором 1CMiwm DFF (DNA fragmentation factor). При апоптозе ингибитор Гмс участием каспаз 3 и 7 инактивируется и свободная CAD, вызывая нуклеосомные разрывы хроматина, ведет к образованию фрагментов ДНК с молекулярной массой кратной молекулярной массе ДНК в нуклеосомных частицах — 180-200 пар нуклеотидов. Эти фрагменты и дают характерную лесенку ДНК при электрофоретическом разделении в агарозном геле. Апоптоз возможен и без фрагментации ДНК. Обнаружен ядерный белок ACCINVS (apoptotic chromatin condensation inducer in the nucleus), который при комбинированном действии каспазы 3 и неидентифицированной протеазы расщепляется на фрагменты. Один из них в присутствии дополнительных неядерных факторов вызывает апоптотическую конденсацию хроматина и фрагментацию ядра (кариорексис) без фрагментации ДНК. Кроме непосредственной активации нуклеаз, протеазы (путем ограниченного протеолиза) устраняют структурное разобщение между нуклеазами и ДНК в составе хроматина, удаляют белки, защищающие ДНК.3. Угнетение репарации ДНК: инактивирование и нарушение регуляции белка, участвующего в репарации ДНК, а также в сплайсинге мРНК, репликации ДНК. Мишенью каспаз является поли-(АДФ-рибозо)-полимераза (ПАРП), которая участвует в репарации ДНК (катализирует полиАДФ-рибозилирование белков, связанных с ДНК). Донором АДФ-рибозы является NAD'. Активность ПАРП-полимеразы возрастает в 500 раз и более при связывании с участками разрыва ДНК. ПАРП участвует в репарации поврежденной ДНК, регуляции активности эндонуклеаз, поддержании структуры хроматина посредством АДФ-рибозилирования. Апоптотическая гибель клетки сопровождается расщеплением ПАРП каспазами. При массированных разрывах ДНК чрезмерная активация ПАРП, сильно снижая содержание внутриклеточного NAD*, ведет к подавлению гликолиза и митохондриального дыхания и вызывает гибель клетки по пути некроза.4. Разрушение белков цитоскелета. Деградация структурных и функциональных белков митотического аппарата.5. Участие в экспрессии генов. Эта функция связана с протеолизом репрессоров и с образованием пептидов, регулирующих транскрипцию (модификация факторов транскрипции). Субстратом протеаз является, например, гистон, выступающий репрессором генов.6. Одна из функций протеаз — передача апоптозного сигнала от индукторов апоптоза. Сигналы могут быть трансмембранными, рецептор-зависимыми. Рецепторами служат трансмембранные белки. Протеазы принимают участие либо непосредственно при взаимодействии индукторов апоптоза с рецепторами, либо через активацию протеинкиназ, играющих важную роль в передаче трансмембранного сигнала с целого ряда рецепторов.Локализация протеаз в различных отделах (компартментах) клетки способствует эффективной трансмембранной передаче сигналов программируемой клеточной гибели. Часть протеаз связаны с мембранами (цитоплазматической, ядерной, мембранами органелл или вакуоли) — это мембраносвязанные протеазы. Другие — находятся в матриксе ядра, цитоплазмы или органелл. Аспарагиновая протеаза растений, по всей видимости, локализована в вакуоли. Предполагается, что сериновые протеазы локализуются в цитоплазме и в ядре. Известно, что в ядрах протеазы могут быть прочно ассоциированы с хроматином и, в том числе, непосредственнно с гистонами. Перемещение протеаз в клетке может сопровождаться их активацией. Например, повышение концентрации Ca2+ внутри клетки способствует перемещению Са2+-зависимой протеазы и протеинкиназы из цитоплазмы в мембрану. При этом происходит автокаталитическая активация неактивных форм протеазы.Так, активация некоторых протеаз может быть обусловлена увеличением концентрации кальция в клетках, наблюдаемой при разных типах апоптоза (раздел выше). АФК также могут быть непосредственными индукторами активации протеаз. Появление локальных участков однонитевой ДНК активирует, например, ядерные ДНК-зависимые сериновые протеазы, специфичные к гистону.
Множество ветвей сигнальной трансдукции перепроверяет правильность выбранного алгоритма событий на пути к апоптозу, уберегая клетку от бессмысленной гибели. Выявлено несколько механизмов, ограждающих клетку от случайного самоуничтожения с участием протеаз.
Во-первых, протеазы синтезируются в клетке в неактивной форме, а процессинг неактивных форм протеаз происходит путем автолиза или путем протеолиза другими протеазами. Например, каспазы синтезируются в клетке в виде прокаспазы — неактивного мономера с молекулярной массой 30-50 кДа. Активные формы — тетрамеры, содержащие по две субъединицы: (р 10 — р20)2 (рис. 9.7). Прокаспазы обладают незначительной протеолитической активностью, составляющей 1-2% активности зрелой каспазы. Механизм протеолитического само- или перекрестного расщепления (ауто- или транс-процессинга), а затем пространственного сближения ведет к образованию активных каспаз. От прокаспазы отделяется регуляторный N-концевой домен (продомен), а оставшаяся часть молекулы разделяется на большую (около 20 кДа) и малую (около 10 кДа) субъединицы. Затем происходит ассоциация большой и малой субъединиц. Два гетеродимера образуют тетрамер с двумя каталитическими центрами, работающими независимо. Первоначально концентрация каспаз в клетке ничтожна. Благодаря свойству автокатализа, концентрация активных каспаз может возрастать лавинообразно.Во-вторых, протеазы обратимо взаимодействуют с эндогенными белковыми ингибиторами, образуя неактивные комплексы (латентные комплексы описаны для цистеиновых, Са2+-зависимых и некоторых других протеаз). При действии различных индукторов апоптоза происходит диссоциация неактивных комплексов протеаза-ингибитор. Обратимое взаимодействие Са2+-зависимых протеаз с эндогенными ингибиторами регулируется кальцием. Цистеиновая протеаза связывается ковалентно с ингибитором через дисульфидную связь. Высвобождение и активация каспазы происходит в результате тиол-дисульфидного обмена и сопряжена с окислительно-восстановительным состоянием клетки и метаболизмом глюкозы.В-третьих, протеазы могут быть компонентами специальных рецептор-зависимых систем. Так, [рецептор + лиганд + адаптер + прокаспаза] формируют специфический агрегат, в котором происходит активация каспаз. Такой агрегат называют апоптосомой или апоптозным шапероном. Самое интересное, что выявлены консервативные области гомологии (в том числе NB-область) белка адаптера у животных и продуктов генов резистентности у растений, включая томат, арабидопсис и табак. Более того, белки похожи структурно. Предполагается, что продукты гена резистентности могут играть роль адаптеров в апоптосоме. Таким образом, при узнавании продукта авирулентности, по всей видимости, происходит диссоциация апоптосомы и развертывание программы апоптоза.
Продукты генов резистентности, по-видимому, ответственны за эффективность гибели клеток при заражении — узнавание факторов и запуск машины самоуничтожения, за первые (самые важные) шаги на пути к стремительной гибели клетки.Существует несколько путей реализации программы ПКГ. Путь передачи сигнала: индукторы — рецепторы — адаптеры — каспазы первого эшелона — регуляторы — каспазы второго эшелона. Рецептор взаимодействует с лигандом. Насколько обратима гибель клетки? На этапе активации каспаз первого эшелона жизнь клетки еще можно сохранить. Существуют регуляторы, которые блокируют или, напротив, усиливают разрушительное действие каспаз первого эшелона. После активации каспазами первого эшелона каспаз второго эшелона путем протеолиза из прокаспаз процесс, запушенный программой смерти, становится необратим. Эти каспазы способны в дальнейшем к самоактивации (автокатализу или автопроцессингу) и активируют фактор фрагментации ДНК на нуклеосомные фрагменты. Вернемся к митохондриям. Апоптотическое изменение митохондрии может индуцироваться окислительным стрессом, повышением концентрации Ca2+. При апоптозе из межмембранного пространства митохондрий высвобождаются белки — апоптогенные факторы:
AIF (Apoptosis Inducing Factor) — флавопротеин с молекулярной массой 57 кДа. Будучи добавлен к изолированным ядрам, он вызывает конденсацию хроматина и фрагментацию ДНК, а при добавлении к изолированным митохондриям — высвобождение цитохрома С и каспазы 9. Высвобождаемый цитохром С вместе с цитоплазматическим фактором APAF-1 (apoptosis protease activating factor-1) образует комплекс с прокаспазой. APAF-I играет роль арматуры, на которой происходит аугокаталитический процессинг каспазы 9 (мультимерная арматура APAF1-цитохром-С-комплексов напоминает пропеллер). Обнаружены ингибиторы высвобождения цитохрома С, блокирующие апоптоз, например, белок Bel.
Список используемой литературы:
Гордеева А.В., Лабас Ю.А., Звягильская Р.А.Апоптоз одноклеточных организмов: механизмы и эволюция Биохимия, 2004, том 69, вып. 10, с. 1301—1313
Голубев А.М., Москалева Е. Ю., Северин С.Е., Веснянко Т.П., Кузовлев А.Н., Алкадарский А.С., Порошенко Г.Г. Апоптоз при критических состояниях
Читайте также:
- Техника разреза для доступа к седалищной и лобковой костям
- Грыжа пищеводного отверстия диафрагмы (ГПОД): причины, симптомы и лечение
- Жировая ткань эмбриона. Образование хряща у плода
- Артериальная дистония по гипертоническому типу. Пограничная гипертония
- Варианты операций при периодическом расходящемся косоглазии (экзотропии)
