Ауторегуляция кровотока. Теории механизма ауторегуляции кровотока. Миогенная, нейрогенная теория. Теория тканевого давления. Обменная теория.
Добавил пользователь Alex Обновлено: 28.01.2026
Сосудистый тонус в зависимости от происхождения может быть миогенным и нервным.
Миогенный тонус возникает, когда некоторые гладкомышечные клетки сосудов начинают спонтанно генерировать нервный импульс. Возникающее возбуждение распространяется на другие клетки, и происходит сокращение. Тонус поддерживается за счет базального механизма. Разные сосуды обладают разным базальным тонусом: максимальный тонус наблюдается в коронарных сосудах, скелетных мышцах, почках, а минимальный - в коже и слизистой оболочке. Его значение заключается в том, что сосуды с высоким базальным тонусом на сильное раздражение отвечают расслаблением, а с низким - сокращением.
Нервный механизм возникает в гладкомышечных клетках сосудов под влиянием импульсов из ЦНС. За счет этого происходит еще большее увеличение базального тонуса. Такой суммарный тонус - тонус покоя, с частотой импульсов 1-3 в секунду.
Таким образом, сосудистая стенка находится в состоянии умеренного напряжения - сосудистого тонуса.
В настоящее время выделяют три механизма регуляции сосудистого тонуса - местный, нервный, гуморальный.
Ауторегуляция обеспечивает изменение тонуса под влиянием местного возбуждения. Этот механизм связан с расслаблением и проявляется расслаблением гладкомышечных клеток. Существует миогенная и метаболическая ауторегуляция.
Миогенная регуляция связана с изменением состояния гладких мышц - это эффект Остроумова—Бейлиса, направленный на поддержание на постоянном уровне объема крови, поступающей к органу.
Метаболическая регуляция обеспечивает изменение тонуса гладкомышечный клеток под влиянием веществ, необходимых для обменных процессов и метаболитов. Она вызвана в основном сосудорасширяющими факторами:
1) недостатком кислорода;
2) повышением содержания углекислого газа;
3) избытком К, АТФ, аденина, цАТФ.
Метаболическая регуляция наиболее выражена в коронарных сосудах, скелетных мышцах, легких, головном мозге. Таким образом, механизмы ауторегуляции настолько выражены, что в сосудах некоторых органах оказывают максимальное сопротивление суживающему влиянию ЦНС.
Нервная регуляция осуществляется под влиянием вегетативной нервной системы, осуществляющей действие как вазоконстриктора, так и вазодилататора. Симпатические нервы вызывают сосудосуживающий эффект в тех из них, в которых преобладают β1-адренорецепторы. Это кровеносные сосуды кожи, слизистых оболочек, желудочно-кишечного тракта. Импульсы по сосудосуживающим нервам поступают и в состоянии покоя (1-3 в секунду), и в состоянии активности (10-15 в секунду).
Сосудорасширяющие нервы могут быть различного происхождения:
1) парасимпатической природы;
2) симпатической природы;
Парасимпатический отдел иннервирует сосуды языка, слюнных желез, мягкой мозговой оболочки, наружных половых органов. Медиатор ацетилхолин взаимодействует с М-холинорецепторами сосудистой стенки, что приводит к расширению.
Для симпатического отдела характерна иннервация коронарных сосудов, сосудов головного мозга, легких, скелетных мышц. Это связано с тем, что адренергические нервные окончания взаимодействуют с β-адренорецепторами, вызывая расширение сосудов.
Аксон-рефлекс возникает при раздражении рецепторов кожи, осуществляющихся в пределах аксона одной нервной клетки, вызывая расширение просвет сосуда в данной области.
Таким образом, нервная регуляция осуществляется симпатическим отделом, который может оказывать как расширяющее, так и суживающее действие. Парасимпатическая нервная система оказывает прямое расширяющее действие.
Гуморальная регуляция осуществляется за счет веществ местного и системного действия.
К веществам местного действия относятся ионы Са, оказывающие суживающий эффект и участвующие в возникновении потенциала действия, кальциевых мостиков, в процессе сокращения мышц. Ионы К также вызывают расширение сосудов и в большом количестве приводят к гиперполяризации клеточной мембраны. Ионы Nа при избытке могут вызвать повышение кровяного давления и задержку воды в организме, изменяя уровень выделения гормонов.
Гормоны оказывают следующее действие:
1) вазопрессин повышает тонус гладкомышечных клеток артерий и артериол, приводя к их сужению;
2) адреналин способен оказывать расширяющее и суживающее действие;
3) альдостерон задерживает Nа в организме, влияя на сосуды, повышая чувствительность сосудистой стенки к действию ангиотензина;
4) тироксин стимулирует обменные процессы в гладкомышечных клетках, что приводит к сужению;
5) ренин вырабатывается клетками юкстагломерулярного аппарата и поступает в кровоток, действуя на белок ангиотензиноген, который превращается в ангиотензин II, ведущий к сужению сосудов;
6) атриопептиды оказывают расширяющее действие.
Метаболиты (например, углекислый газ, пировиноградная кислота, молочная кислота, ионы Н) действуют как хеморецепторы сердечно-сосудистой системы, повышая скорость передачи импульсов в ЦНС, что приводит к рефлекторному сужению.
Вещества местного действия производят разнообразный эффект:
1) медиаторы симпатической нервной системы оказывают в основном суживающее действие, а парасимпатической - расширяющее;
2) биологически активные вещества: гистамин - расширяющее действие, а серотонин - суживающее;
3) кинины (брадикинин и калидин) вызывают расширяющее действие;
4) простагландины в основном расширяют просвет;
5) эндотелиальные ферменты расслабления (группа веществ, образуемых эндотелиоцитами) оказывают выраженный местный суживающий эффект.
Таким образом, на сосудистый тонус оказывают влияние местные, нервные и гуморальные механизмы.
Местная регуляция тканевого кровотока
Капиллярный кровоток должен постоянно приспосабливаться к потребностям тканей, которые определяются уровнем метаболической активности ее клеток. Так, например, кровоток через ткань печени, в клетках которой постоянно идет активный обмен веществ, составляет 95 мл/мин/100 г, а кровоток через менее активную ткань костей — всего 3 мл/мин/100 г. При изменении метаболической активности ткани кровоток через нее тоже изменяется. К примеру, кровоток через ткань неработающей скелетной мышцы составляет 4 мл/мин/100 г, а при интенсивной физической нагрузке он может возрасти до 80 мл/мин/100 г, т.е. в 20 раз. В некоторых органах, например в ГМ, где уровень метаболизма ткани и уровень капиллярного кровотока всегда очень высоки, задача регуляторных механизмов состоит в том, чтобы поддерживать кровоток на стабильном уровне, предохраняя его от резких колебаний.
Приспособительные изменения кровотока в тканях обусловлены влиянием на тонус артериол и прекапиллярных сфинктеров со стороны регуляторных факторов, которые образуются в самой кровоснабжаемой ткани в результате происходящих в ней метаболических процессов.
Дефицит кислорода является одним из важнейших регуляторных факторов. От недостатка 02 страдают гладкие мышцы в стенках сосудов, что приводит к их расслаблению. Одновременно дефицит кислорода влияет на обменные процессы в клетках, окружающих артериолы. В результате этого в избыточных количествах образуются метаболиты, обладающие сосудорасширительным действием: С02, Н + , лактат, пируват, аденозин, АТФ, АДФ, АМФ и др. Набор этих метаболитов в разных тканях может отличаться. Так, например, в скелетных мышцах к ним добавляются ионы К + , выходящие из мышечных волокон при возбуждении. Помимо непосредственного влияния на гладкие мышцы артериол, продукты метаболизма повышают осмотическое давление тканевой жидкости. Повышенное осмотическое давление также является сосудорасширительным фактором.
Примерами метаболического контроля ткани над кровотоком являются реактивная и активная гиперемия.
Реактивная гиперемия представляет собой сосудорасширительную реакцию, которая наблюдается в ткани после восстановления временно прекращавшегося кровоснабжения. Продолжительность гиперемической реакции определяется продолжительностью остановки кровотока. Сосуды расширяются под влиянием метаболических факторов, накопившихся в ткани, которая не получала достаточного количества крови. Увеличенный кровоток уменьшает количество этих метаболитов до исходного уровня, что приводит к окончанию гиперемической реакции.
Активная гиперемия представляет собой сосудорасширительную реакцию, которая сопровождает переход ткани в активное функциональное состояние. Примером может быть усиление кровотока через работающие скелетные мышцы или через отдельные области ГМ при интенсивной умственной деятельности. В этом случае на сосуды оказывают влияния метаболические факторы, дополнительно образующиеся в тканях при усиленной работе клеток. Усиление кровотока дает тканям дополнительные питательные субстраты для поддержания нового, более высокого уровня метаболизма.
Местные механизмы регуляции тканевого кровотока способны влиять только на самые мелкие артерии и артериолы. Для расширения более крупных сосудов включаются дополнительные механизмы с участием клеток сосудистого эндотелия. Эндотелиальные клетки способны синтезировать и выделять как сосудорасширяющие, гак и сосудосуживающие вещеетва. Важнейшим сосудорасширяющим фактором эндотелиального происхождения является оксид азота (N0). Расширение прекапиллярных сосудов под влиянием тканевых метаболитов вызывает ускорение тока крови в более крупных артериях. Под воздействием усилившегося потока крови происходит деформация эндотелиальных клеток (возникает напряжение сдвига), которая стимулирует выделение N0 и приводит к расширению сосудов. Такой механизм многократно повышает эффективность местной регуляции кровотока (рис. 8.3).

Рис. 8.3. Механизм распространения сосудорасширителыюй реакции от артериол на артерии с участием эндотелиальных клеток:
а — в — последовательные этапы реакции
Оксид азота (N0) образуется из аминокислоты L-аргинина с помощью фермента NO-сиптетазы. Его образование усиливается при гипоксии (недостатке кислорода) и уменьшается при гипероксии (избытке кислорода). Образуясь в эндотелиальных клетках, оксид азота выходит из них, проникает в близлежащие гладкомышечные клетки и вызывает их расслабление. Действие NO реализуется без связывания с рецепторами поверхностной мембраны. Оксид азота взаимодействует с внутриклеточным ферментом — гуанилатциклазой, что запускает цепочку реакций, приводящих к снижению содержания в цитоплазме ионов Са 2+ . Кроме того, NO повышает проницаемость К + -каналов, что приводит к гиперполяризации мембраны, закрытию потенциалзависимых Са 2+ -каналов и уменьшению входа в клетку ионов Са 2+ из наружной среды. Оксид азота вырабатывается в эндотелии непрерывно, но скорость его образования возрастает при действии таких биологически активных веществ, как АХ, гистамин, бради- кинин и др. Эти вещества реализуют свое сосудорасширяющее действие через образование NO в клетках эндотелия.
Помимо оксида азота, эндотелиальные клетки сосудов являются источником ряда других факторов, участвующих в регуляции тканевого кровотока. Наиболее значимыми из них являются простагландины и эндотелии.
Простагландины являются производными арахидоновой кислоты, они получили свое название от органа, где впервые были обнаружены, а именно от простаты. Эта группа веществ с многообразным действием па различные физиологические процессы вырабатывается во многих органах и тканях. В эндотелии сосудов вырабатываются простагландины, относящиеся к группе простациклинов и обладающие мощным сосудорасширяющим действием, которое дополняет действие оксида азота.
Эндотелии представляет собой пептид, состоящий из 21 аминокислоты и обладающий мощным сосудосуживающим действием. Он присутствует в эндотелиальных клетках практически всех кровеносных сосудов, но выделяется в кровь главным образом при повреждениях эндотелия. Местное выделение эндотелина и вызванное им сужение сосуда могут предотвратить кровотечение из поврежденной артерии диаметром до 5 мм. Свое действие на гладкомышечные клетки эндотелии реализует через усиление поступления в цитоплазму ионов Са 2+ , как из эндоплазматического ретикулума, так и из наружной среды. Помимо сосудов, эндотелии повышает тонус гладких мышц бронхов, матки, желудочно-кишечного тракта. Он также усиливает выброс эндокринными железами гормонов, обладающих сосудосуживающим действием, например вазопрессина.
Факторы, образующиеся при травмах и воспалениях тканей, обладают способностью влиять на тонус сосудов. Одних из таких факторов является гистамин. Он высвобождается во всех без исключения тканях организма при развитии аллергических реакций, воспалениях и травмах и обладает сосудорасширяющим действием. Большая часть гистамина образуется в тучных клетках и базофильных лейкоцитах крови. Помимо расширения артериол, гистамин способен увеличивать проницаемость капилляров. Это приводит к выходу в ткань избыточного количества жидкости и развитию отека.
Сходным образом на артериолы и капилляры влияет брадикинин. Этот пептид образуется из неактивного предшественника каллидина, который отщепляется от одного из глобулинов плазмы крови иод воздействием фермента калликреина. Калликреин присутствует в крови и тканевой жидкости в неактивной форме и активируется при изменениях состава крови, развитии воспалительных реакций, а также иод действием других химических и физических факторов.
Все перечисленные механизмы регуляции тканевого кровотока связаны с изменениями метаболизма либо кровоснабжаемых тканей, либо стенок сосудов. Однако существует один механизм местной регуляции кровотока, не связанный с метаболическими процессами.
Миогенная ауторегуляция связана со способностью гладких мышц сосудов сокращаться при повышении давления крови и расслабляться при понижении давления. Благодаря миогенной ауторегуляции сосудов органы поддерживают кровоток на постоянном уровне, нивелируя колебания артериального давления. Наиболее сильно миогенная ауторегуляция выражена в сосудах почек и ГМ, менее — в сосудах сердца и скелетных мышц и менее всего — в сосудах печени и кишечника. Основными участниками этой регуляторной реакции являются артериолы, но она наблюдается, хотя и в меньшей степени, в артериях, венулах, венах и даже в лимфатических сосудах. При растяжении стенок сосудов мембраны гладкомышечных клеток деполяризуются, что усиливает поступление ионов Са 2+ из наружной среды. Ионы Са 2+ , поступая в гладкомышечные клетки, способствуют их сокращению. Точный механизм влияния растяжения мембраны на ее ионную проницаемость неизвестен, но можно предположить существование меха- ночувствительных каналов, сходных с каналами в нервных окончаниях, которые входят в состав механорецепторов.
Таким образом, рассмотренные нами механизмы местной регуляции тканевого кровотока срабатывают очень быстро после изменения метаболизма ткани (от нескольких секунд до нескольких минут) и достаточно полно удовлетворяют возросшие потребности в поступлении крови. Однако при длительных изменениях метаболической активности ткани местных механизмов регуляции кровотока начинает не хватать. В дополнение к ним развиваются механизмы долговременной регуляции тканевого кровотока.
Долговременная регуляция тканевого кровотока осуществляется путем изменения густоты сосудистой сети — васкуляризации тканей.
Васкуляризация возрастает при длительном повышении метаболических потребностей ткани, что может быть связано с ее усиленным функционированием, или при продолжительном снижении содержания кислорода в крови, например в условиях высокогорья, где в атмосферном воздухе мало кислорода. В обоих случаях дефицит кислорода стимулирует выработку тканевых факторов роста сосудов. На сегодняшний день известно около 10 таких факторов, например эндотелиальный фактор роста, ангио- генин, тромбоцитарный фактор роста и другие, которые по своему химическому строению являются полипептидами или мелкими белками. Новые кровеносные сосуды образуются путем разрастания и ветвления старых. В точке роста растворяется базальная мембрана, и через стенку сосуда в ткань мигрируют новые эндотелиальные клетки, формируя сосудистый росток. Росток удлиняется по направлению к источнику фактора роста и позднее сливается с другим таким же ростком от другого сосуда. Образуется капиллярная петля, через которую начинается кровоток. Если кровоток достаточно интенсивен, то в новый сосуд мигрируют гладкомышечные клетки, и он превращается в артериолу, венулу или более крупный сосуд (рис. 8.4).
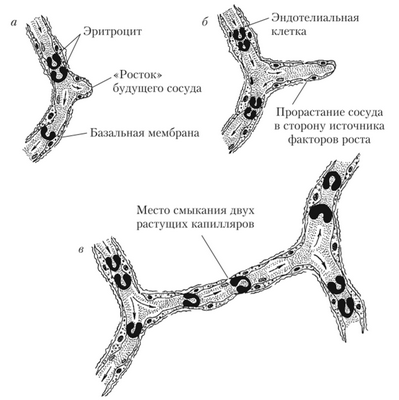
Рис. 8.4. Прорастание нового капилляра (схема):
а — растворение базальной мембраны и образование эндотелиального «ростка» б — удлинение будущего сосуда в сторону источника факторов роста; в — смыкание двух растущих капилляров и начало кровотока
Ряд других факторов, таких, например, как некоторые стероидные гормоны, обладают противоположным действием на мелкие кровеносные сосуды. При этом происходит разрушение клеток сосудистой стенки и сосуд исчезает. Конечным результатом такой регуляции становится уменьшение густоты сосудистой сети.
Изменения густоты сосудистой сети, связанные с продолжительным недостатком кислорода, происходят за несколько дней в молодых организмах или в быстрорастущих тканях зрелых организмов, но требуют значительно большего времени в высокодифференцированных тканях (несколько недель).
Сочетание быстрых и долговременных механизмов регуляции тканевого кровотока позволяет значительно расширить адаптивные возможности органов и тканей, а следовательно, и организма в целом.
Глава 18 органное кровообращение
Задача регионарного (локального) кровотока — обеспечение кровью данного региона, в интересах этого региона. В определенной степени при этом игнорируются интересы или запросы организма в целом.
Считается, что регуляция регионарного кровотока осуществляется различными механизмами — местными, гуморальными, нервными. Одни механизмы срабатывают быстро, в пределах секунд, минут, другие механизмы реализуются в пределах недель, месяцев. Поэтому физиологи выделяют долговременную регуляцию и кратковременную, или быструю регуляцию. Обычно физиологи детально рассматривают механизмы быстрой или срочной регуляции, а представители других дисциплин (патофизиологи, морфологи) — долговременную. Необходимость долговременной регуляции возникает в том случае, когда все механизмы срочной регуляции не создают все-таки оптимальных условий для кровообращения. Ведущим фактором в этом случае является недостаток кислорода в тканях. Это вызывает продукцию так называемого фактора ангиогенеза, который вызывает в свою очередь выход из стенки вен, предшественников капилляров, что приводит к росту капилляров в ткани, которая испытывает кислородную недостаточность, возрастает число капилляров и длина работающих капилляров, т. е. возрастает степень капилляризации. Это происходит, например, при всех ситуациях, при которых в тканях возникает кислородная точность (пороки сердца, жизнь в условиях высокогорных районов, альпинисты). Предполагается, что использование в клинической практике фактора ангиогенеза или фактора роста новых сосудов — это перспективное направление.
Быстрая, или срочная, регуляция регионарного кровотока осуществляется за счет местных, гуморальных и нервных механизмов.
Местная регуляция регионарного кровотока играет ведущую роль в процессах обеспечения необходимого уровня кровотока при данной интенсивности метаболизма. Здесь принято выделять 2 варианта механизмов: метаболическую ауторегуляцию периферического кровообращения и миогенную ауторегуляцию периферического кровообращения.
Метаболическая ауторегуляция (или — гистометаболическая ауторегуляция перифери-ческого тонуса, или вазодилататорная регуляция) заключается в том, что в результате недо-статочного снабжения данного региона кислородом и питательными веществами (в основном, за счет недостаточности кровотока) в тканях накапливаются метаболиты, среди которых имеются мощные вазодилататоры (расслабляющие гладкие мышцы сосудов), особенно прекапиллярных сфинктеров. Среди этих метаболитов-дилататоров выделяют такие как молочная кислота, АТФ, АМФ, АДФ, аденозин, ионы калия, избыток ионов водорода (явление ацидоза), избыток углекислого газа. Эти вещества одновременно могут менять чувствительность гладких мышц к медиатору симпатических волокон — к норадреналину (например, за счет «маскировки» бета-адренорецепторов сосудов) и тем самым уменьшать влияяние сосудосуживающих нервов на сосуды данного региона.
Некоторые исследователи считают, что главным фактором, определяющим состояние тонуса гладких мышц сосудов в регионе, является кислород: когда кислорода много, сосуды находятся в состоянии сокращения, когда кислорода мало (уменьшается парциальное напряжение кислорода), тогда происходит релаксация мышц и кровоток возрастает. В легких (см. подробнее «Малый круг»), наоборот, если в альвеоле много кислорода, то капил-
ляр, подходящий к этой альвеоле, будет открыт (прекапилляры расслаблены), а если альвеола не вентилируется (не содержит в достаточных количествах кислорода), то капилляр не функционирует. Итак, теория кислородного запроса (как вариант вазодилататорной мета- болической теории) имеет право на существование. Следовательно, уровень метаболизма клетки может определять интенсивность регионарного кровотока.
2-й механизм, поддерживающий на необходимом уровне кровенаполнение данного региона, это миогенная ауторегуляция. Во многом она напоминает закон сердца (Франка-Старлинга): чем больше мышца растянута, тем выше тонус этой мышцы. Механизм миогенной ауторегуляции выражен наиболее отчетливо в сосудах мозга, почки, сердечной мышце, печени, чревной области. Он состоит в том, что в ответ на повышение артериального давления (кровяного давления) сосуд растягивается. Если бы стенка сосуда пассивно следовала за величиной давления, то это привело бы к расширению диаметра сосуда и к увеличению ее проходимости, что привело бы к увеличению кровенаполнения. Не все области «желают» роста кровенаполнения. Для защиты от этого явления возникает рост активности гладких мышц стенок растягиваемого сосуда — и чем больше растягивается сосуд (за счет бокового давления), тем на большую величину возрастает тонус гладких мышц этого сосуда. В итоге — диаметр остается неизменным. При падении давления, наоборот, чтобы сохранить исходный просвет сосуда, гладкие мышцы расслабляются.
Нервный механизм регуляции регионарного кровотока. Выше подробно рассматривались вопросы нервной регуляции сосудистого тонуса. За счет потока импульсов, идущих от работающего органа, интенсивность регионарного кровотока может меняться рефлекторно. Например, При возбуждении скелетных мышц с рецепторов этих мышц (сухожильные, проприорецепторы, или мышечные веретена) идет поток импульсов, в ответ на который происходит возбуждение симпатической нервной системы — это вызывает повышение вазоконстрикторных влияний на все сосуды, но особенно — на сосуды кожи, сосуды чревной области. В результате — происходит перераспределение кровотока: в неработающих мышцах, коже, чревной области — кровоток снижается, а в сосудах работающих мышц — он возрастает (за счет того, что в них происходит рабочая гиперемия, вызванная метаболитами, и за счет того, что эти метаболиты блокируют констрикторные эффекты работающей мышце, идущие от симпатических воздействий (см. подробнее — «Кровоток в скелетных мышцах»).
Гуморальная регуляция регионарного кровотока заключается в том, что помимо метабо- литов, накапливающихся в работающих органах, сюда же с током крови могут подходить гормоны и биологически активные вещества, оказывающие вазодилатацию (гистамин, бра- дикинин, простациклины, атриопептин) или вазоконстрикцию (адреналин, норадреналин, дофамин, ангиотензин II, альдостерон, серотонин). Эти вещества будут модулировать ме- таболические эффекты и эффекты симпатических воздействий на сосуд.
Рассмотрим некоторые особенности регионарного кровотока.
КОРОНАРНЫЙ КРОВОТОК
Особенностью коронарного кровотока (главным образом, кровотока левого желудочка) является его импульсность, периодичность: в момент систолы кровоток по артериям пре- кращается, а по венам кровь выталкивается. Таким образом, в основном, миокард (левый желудочек) до 85% крови получает в период диастолы. Поэтому, чем длительнее диастолический период (или — чем короче систола, а точнее — чем меньше систолический показатель), тем лучше кровоснабжение миокардиальных клеток.
В среднем, в условиях покоя на 100 г массы сердца приходится 50—90 мл крови в 1 минуту, а с учетом, что средняя масса сердца составляет 300 г — в условиях покоя сердце получает около 200—250 мл крови, т. е. около 4—6% от минутного объема крови (от 4,5— 5 л/мин). В условиях физической нагрузки, когда потребность в кровотоке резко возрастает (МОК достигает 25 л), значительно возрастает коронарный кровоток — он становится рав-
Ауторегуляция кровотока. Теории механизма ауторегуляции кровотока. Миогенная, нейрогенная теория. Теория тканевого давления. Обменная теория.
Теория миогенной ауторегуляции глазного кровотока в норме и при патологии, представленная на основании теоретических и практических изысканий, с применением законов физики и математических принципов. Тот факт, что, согласно закону Лапласа, когда давление, необходимое для растяжения трубки (сосуда) против окружного натяжения в ней, обратно пропорционально радиусу трубки (сосуда), сосуды микроциркуляторного русла работают по принципу «периферического сердца», полностью изменяет понимание механизмов регуляции кровообращения на микроциркуляторном уровне и предполагает изменение функциональной классификации сердечно-сосудистой системы, а также показывает необоснованность утверждения, что жидкость из стекловидного тела проходит ткань сетчатки и всасывается хориоидеей.
1. Александров В.Н., Марпин С.А., Шастин И.В. Опыт лечения гиперосмолярных ком и гиперкинетических коматозных состояний низкими дозами инсулина // Тер. архив. - 1990. - № 8. - С. 63-68.
3. Бунин А.Я. Микроциркуляция глаза / А.Я. Бунин, Л.А. Кацнельсон, А.А. Яковлев. - М.: Медицина, 1984. - 172 с.
5. Запускалов И.В. Роль венозных сосудов в регуляции периферического кровообращения. - Томск: Изд-во ТГУ, 1994 . - 160 с.
7. Запускалов И.В. Кривошеина О.И., Хороших Ю.И. Биомеханика «периферического сердца» в тканях глаза / И.В. Запускалов, О.И. Кривошеина, Ю.И. Хороших. - Томск: Изд-во «Иван Федоров», 2013. - 140 с.
8. Каро К. Механика кровообращения / К. Каро, Т. Педли, Р. Шротер, У. Сид; пер. с англ. - М.: Мир, 1981. - 624 с.
9. Кацнельсон Л.А. Сосудистые заболевания / Л.А. Кацнельсон, Т.И. Форофонова, А.Я. Бунин. - Сосудистые заболевания. - М.: Медицина, 1990. - 272 с.
12. Balch W.E., Dunphy W.G., Braell W.A., Rothman J.E. Reconstitution of the transport of protein between successive compartments of the Golgi measured by the coupled incorporation of N-acetylglucosamine // Cell. - 1984. - V. 39. - P. 405-416.
13. Hata Y., Slaughter C.A., Südhof T.C. Synaptic vesicle fusion complex contains unc-18 homologue bound to syntaxin // Nature. - 1993. - V.366. - P.347-351.
14. Kaiser C.A., Schekman R. Distinct sets of SEC genes govern transport vesicle formation and fusion early in the secretory pathway // Cell. - 1990. - V. 61. - P.723-733.
16. Perin M.S., Fried V.A., Mignery G.A., Jahn R., Südhof T.C. Phospholipid binding by a synaptic vesicle protein homologous to the regulatory region of protein kinase C. // Nature. - 1990. - V. 345. - P.260-263.
Во всех учебниках по офтальмологии и литературных источниках, посвященных изучению гемодинамики сетчатки, убедительно рассказывают, но не доказывают, что вода из стекловидного тела проходит через ткань сетчатки и всасывается хориоидеей [3, 9]. Не будем углубляться в подробности возникновения данной гипотезы, но этот парадоксальный факт полностью искажает патогенез многих заболеваний сетчатки.
Морфофункциональное строение хориокапилляров практически ничем не отличается от капилляров цилиарного тела и капилляров клубочкового аппарата почек. Нет ни у кого сомнений, что клубочки почек и цилиарное тело продуцируют жидкость, но почему тогда хориоидея ее всасывает? Современные исследования гемодинамики показывают, что по закону Лапласа для эластических трубок, которыми по сути являются мышечные артерии, находящиеся в эластиновой адвентиции, после сердечного сокращения сосуды микроциркуляторного русла сначала пассивно расширяются поглощая пульсовой объем крови, а затем, вследствие сокращения мышечных волокон сосудистой стенки продавливают объем полученной жидкости в обменные сосуды, выполняя тем самым роль «периферического сердца». Причем этот факт полностью меняет понимание механизмов регуляции кровообращения на микроциркуляторном уровне и предполагает изменение функциональной классификации сердечно-сосудистой системы [4, 5, 6, 7, 8].
В соответствии с вышеизложенным материалом нам представляется необходимым несколько изменить классификацию сердечно-сосудистой системы, предложенную Б.И. Ткаченко, следующим образом (рис. 1):
Исследование процесса обмена веществ между кровью и тканями требует детальных знаний таких факторов, как объем диффузии, градиенты концентрации, и структурные барьеры, ограничивающие свободное распространение жидкости в общем ее потоке. Незнание этих факторов в описании массопереноса довольно часто приводит к ошибкам, порождая такие термины, как «насыщение ткани», «улучшение трофики» и тому подобное [1, 3]. Применение основных физических и математических законов позволяет по-новому взглянуть на эту проблему [2, 4, 5, 10].

Рис. 1. Функциональная схема кровеносных сосудов: 1 - сердце; 2 - артерии эластического типа; 2А - артерио-артериальный анастомоз; 3 - артерии мышечного типа; 4 - артериолы; 5 - обменные сосуды (капилляры и посткапиллярные венулы); 6 - регуляторы кровотока (венулярные сфинктеры и малые мышечные вены); 7 - шунтирующие сосуды; 8 - аккумулирующие сосуды; 9 - сосуды возврата крови (крупные венозные коллекторы); 10 - лимфатические сосуды; 11 - циркулярные мышечные волокна
Существует два основных механизма массопереноса через сосудистую стенку [4, 6, 8, 11, 14]: 1 - движение веществ с молекулами воды по градиенту гидростатического давления (конвективный перенос); 2 - диффузионного обмена молекул за счет различных концентраций вещества по разные стороны сосудистой стенки.
Диффузия веществ из микрососудов в ткани подчиняется закону Фика, согласно которому, разница концентрации веществ в среде, провоцирует движение этого вещества в направлении области низкой концентрации и пропорциональна градиенту концентрации.
Направление движения воды зависит от двух сил - градиента осмотического и гидравлического давления. В обменных сосудах эти силы чаще всего имеют противоположное действие, осмотическое трансмуральное давление заставляет двигаться молекулы воды внутрь сосуда, а гидравлическое - из сосуда. В работе двадцатилетней давности мы показали и доказали, что в хориокапиллярах трансмуральное гидравлическое давление выше, чем в обменных сосудах сетчатки, поэтому жидкость движется в наружных слоях сетчатки из хориокипилляров в сосуды сетчатки. Пора пересмотреть выражение «наружные слои сетчатки питаются из хориокапилляров, а внутренние из сосудов сетчатки», так как обе сосудистые системы обеспечивают метаболизм палочек и колбочек. За счет диффузии из обеих систем по градиенту концентрации поступает кислород, в обратную сторону движется углекислый газ. Вещества, вступающие в нековалентную связь с молекулами воды, не могут свободно проникать через клеточную мембрану, поэтому они проходят внутрь клетки за счет пиноцитоза.
В 2013 году Нобелевский комитет решил отметить работу ученых, раскрывших тайны внутриклеточного транспорта. Каждая клетка, по сути - «завод» по производству молекул: производится и выбрасывается в кровь инсулин, нейротрансмиттеры передаются от одной клетки к другой… [18].
Клетке, производящей гормоны, нейромедиаторы, цитокины, ферменты и другие молекулы, как крупному оживленному порту, необходима система, обеспечивающая правильную и своевременную доставку молекулярных «грузов». Пузырьки везикул, окруженные защитными мембранами, перевозят молекулы в пределах клетки (от одной органеллы к другой) или выпускают наружу, слившись с клеточной мембраной. Этот процесс имеет жизненно важное значение: если в качестве груза выступает нейротрансмиттер - его доставка необходима для активации нерва, а, например, «выгруженные» в нужном месте гормоны регулируют процесс обмена веществ. Откуда же эти крошечные пузырьки, везикулы, знают, где и когда сбросить свою ношу [12]?
Еще в 1970-х годах Рэнди Шэкман, очарованный четкой организацией внутриклеточной транспортной системы, взялся за изучение её генетической основы. В качестве модельных организмов он выбрал дрожжи и выделил среди них те клетки, в которых был нарушен механизм везикулярного транспорта. В результате генетических мутаций в клетке образовывалось подобие дорожных пробок: везикулы скапливались в одной её части [15]. Шекман выделил три класса генов, регулирующих «дорожное движение» внутри клетки, сформировав новое научное видение процессов и механизмов, определяющих организацию везикулярного транспорта [14].
Джеймс Ротман, также заинтересовавшийся природой внутриклеточной транспортной системы, обнаружил белковый комплекс, который позволяет везикулам присоединяться к клеточной мембране и сливаться с ней. В процессе слияния белковые молекулы на поверхности везикулы и мембраны стыкуются друг с другом, как две половинки замка-молнии. Каждый из множества таких «парковочных» белков может связываться с парным ему только в определенной комбинации. Благодаря такой избирательности гарантируется, что «груз» будет доставлен точно по назначению [12, 17].
Выяснилось, что ряд генов, кодирующих необходимые для везикулярного транспорта белки и обнаруженных Шэкманом в дрожжевых клетках, имеет своих «потомков» и в клетках млекопитающих, исследованиями которых занимался Ротман. Ученые выявили эволюционную взаимосвязь между везикулярными транспортными системами различных организмов и обозначили важнейшие компоненты этих систем. [13].
Томас Зюдхоф занимался изучением вопроса «общения» нервных клеток мозга между собой. Нейротрансмиттеры (молекулы, служащие для передачи сигнала) доставляются к месту назначения везикулами, сливающимися с мембранами нервных клеток - механизм этого процесса описали Шэкман и Ротман. Но высвобождается этот «груз» не сразу, а только в тот момент, когда нервной клетке необходимо подать сигнал своей соседке. Как везикула «узнает», что момент настал? Было известно, что в этом процессе каким-то образом участвуют ионы кальция, и Зюдхоф стал искать в нервных клетках белки, чувствительные к кальцию. Он выявил механизм, отвечающий за пунктуальность везикул в нервных клетках и позволяющий «пузырькам» высвобождать своё содержимое по команде. [16].
Несомненно, процессы обмена, потребления и секреции сложных молекул генетически детерминированы и выстраивались природой на протяжении миллионов лет. Однако первичный механизм возникновения пиноцитозных пузырьков, также является результатом действия гидравлических сил. Свободная молекула воды легко проходит через поры клеточной мембраны, но связанная с другими молекулами вода застревает в этих порах, создавая плоскостное сопротивление общему потоку воды. Клеточная мембрана механически продавливается и образуется везикула. В дифференцированных клетках эти везикулы обычно вливаются в клеточные органеллы, таким образом, в частности, глюкоза попадает в митохондрии и т.д. А уже за применение и распределение вещества отвечают регуляторные белки отвечающие за реализацию функциональной принадлежность клетки в которой происходит транспорт веществ . В эндотелиоцитах капилляров они проходят через клетку, выбрасывая свое содержимое в интерстициальное пространство. Когда в хориокапиллярах описывают фенестрированный эндотелий, на самом деле это гистологическая ошибка. Фенестрированная цитоплазматическая мембрана не может существовать, это просто скопление застывших везикул вдоль наружной клеточной мембраны, возникающее в результате падения трансмурального гидравлического давления в хориокапиллярах из-за гибели организма или энуклеации глаза.
Однонаправленный поток воды в наружных слоях сетчатки необходим для секреторной деятельности палочек и колбочек. Для поддержания нормальной зрительной функции эти клетки должны вырабатывать и выбрасывать в синаптическое пространство не менее 50 везикул с водным раствором нейропептида за одну секунду (средняя величина критической частоты слияния мельканий - КЧСМ). Можно себе представить какой объем воды необходим для осуществления этого действия.
Такому мощному потоку воды через палочки и колбочки помогает анатомическое строение самой сетчатки. Наибольшее сопротивление движению воды составляют пограничные мембраны эпителиальных слоев. Наружная пограничная мембрана сетчатки, в отличие от внутренней, имеет окна, в которые вставлены отростки сенсорного нейроэпителия. Поскольку сосуды сетчатки только впитывают в себя свободные молекулы воды (для этого не нужны везикулы), они создают определенный вакуум в ткани сетчатки. За счет окон наружной пограничной мембраны она присасывается к пигметному эпителию сетчатки, втягивая в себя воду с секретом пигментного эпителия, необходимого для жизнедеятельности палочек и колбочек. Чем больше света, тем глубже погружаются наружные сегменты нейроэпителия в клетки пигментного эпителия сетчатки. Нами подробно описан механизм миогенной ауторегуляции кровотока на микроциркуляторном уровне, отвечающий за постоянство трасмурального гидравлического давления в обменных сосудах сетчатки. Малейший срыв ауторегуляции кровотока как в хориоидее, так и в бассейне центральной артерии сетчатки, сопровождается выраженными функциональными нарушениями со стороны сетчатки.
Описанные выше механизмы о массопереносе в сосудах сетчатки и хориоидее можно изобразить следующей схемой (рис. 2).

Рис. 2. Схема движения интерстициальной жидкости в наружных слоях сетчатки: 1 - a. Ophtalmica; 2 - артериолы хориоидеи; 3 - артериолы сетчатки; 4 - капилляры хориоидеи; 5 - пигментный эпителий; 6 - ткань сетчатки; 7 - капилляры сетчатки; 8 - ток интерстициальной жидкости; 9 - венозный коллектор; Ph - трансмуральное давление крови в капиллярах хориоидеи; Pt - тканевое давление; Ps - трансмуральное давление крови в капиллярах сетчатки
Учитывая, что обе сосудистые системы глаза находятся в единой гидравлической системе, ограниченной фиброзной капсулой глазного яблока, жидкость по градиенту давления будет выходить из хориокапилляров и всасываться капиллярами сетчатки, что подтверждается результатами флюоресцентной ангиографии. Только при тромбозе венозных сосудов и воспалительных процессах сетчатки наблюдается экстравазация флюоресцеина из сосудов сетчатки. Необходимо отметить также, что отсутствие выхода флюоресцеина из ретинальных сосудов не связано с наличием гематоофтальмического барьера, краситель не выходит только лишь потому, что трансмуральное гидравлическое давление в капиллярах сетчатки ниже осмотического давления плазмы крови. Вследствие этого наблюдается однонаправленное движение жидкости из ткани в обменные сосуды сетчатки.
Однонаправленный ток жидкости наблюдается и в других тканях глазного яблока. Так, внутриглазная жидкость выходит из капилляров цилиарного тела, проходит из задней камеры глаза в переднюю, через эндотелий проникает в ткань роговицы, двигается по направлению к лимбу и всасывается сосудами петлистой сети, которая также при флюоресцентной ангиографии не дает картины экстравазации. Не наблюдается в норме выхода флюоресцеина и из сосудов радужки.
Таким образом, применение фундаментальных законов физики и математики позволяет с новых позиций подойти к пониманию регуляции и функционирования системы кровообращения на уровне микроциркуляторного русла. Направленное движение тканевой жидкости наблюдается не только в полости глазного яблока, но и в других органах и системах организма - почках, печени и т.д. Признание факта однонаправленности движения жидкости в организме, подчиняющееся действию физических законов позволяет существенно изменить взгляд на патогенез многих сосудистых заболеваний.
Применение данной гипотезы в клинической практике (новые подходы в лечении воспалительных заболеваний глаза, пролиферативной витреоретинопатии различного генеза, макулярных дегенераций) доказало ее правильность.
В последние годы почти любое заболевание сетчатки пытаются связать с «нарушением питания и гипоксией сетчатки». Этот парадокс не поддается объяснению, поскольку задний отрезок глаза является самой васкуляризированной частью всего организма. Пора прекратить средневековый взгляд на гемодинамику глаза и рассматривать патогенез заболеваний сетчатки с позиции современной биохимии, биофизики и биомеханики с использованием математических моделей.
Кафедра неврологии Российского государственного медицинского университета
Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, Москва, Россия
Кафедра факультетской хирургии Московского факультета ГОУ ВПО Российского государственного медицинского университета, Центральная клиническая больница Святителя Алексия, Москва
Состояние ауторегуляции мозгового кровотока
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2011;111(1): 68‑73
Федин А.И., Кузнецов М.Р., Берестень Н.Ф., Холопова Е.А., Тугдумов Б.В., Румянцева Е.И., Павочкина Е.С. Состояние ауторегуляции мозгового кровотока. Журнал неврологии и психиатрии им. С.С. Корсакова. 2011;111(1):68‑73.
Fedin AI, Kuznetsov MR, Beresten' NF, Kholopova EA, Tugdumov BV, Rumiantseva EI, Pavochkina ES. State of the brain blood flow autoregulation. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2011;111(1):68‑73. (In Russ.).
Изучалась ауторегуляция мозгового кровообращения (АМК) в норме и при различных вариантах атеросклероза у 97 человек. В 1-ю группу вошли 32 пациента с облитерирующим атеросклерозом артерий нижних конечностей с различными стадиями хронической артериальной недостаточности без гемодинамических поражений брахиоцефальных артерий; во 2-ю - 30 больных с различными формами хронической ишемии головного мозга с гемодинамически значимыми односторонними атеросклеротическими стенозами внутренней сонной артерии (от 70 до 95%). В контрольной группе было 35 здоровых мужчин 20-25 лет. Параметры АМК оценивали по разработанной авторами оригинальной методике. Установили, что в норме механизм АМК позволяет поддерживать постоянство перфузионного давления головного мозга за счет двух основных составляющих. На первом этапе - это усиление притока артериальной крови, продолжающееся на протяжении первых 1,5 мин после снятия пневматических манжет, после чего ему на смену приходит опережающее увеличение оттока венозной крови из полости черепа, снижающее тканевое давление. Более выраженные изменения АМК наблюдаются у пациентов с гемодинамически значимыми стенозами внутренней сонной артерии, менее - с периферическим атеросклерозом.
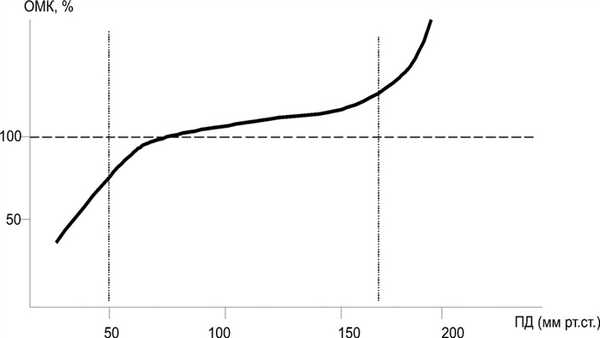
Основная функция сосудистой системы головного мозга - поддержание постоянства его гемодинамического и биохимического гомеостаза при различных физиологических и патологических состояниях, что предполагает наличие сложной структурно-функциональной организации процесса ауторегуляции мозгового кровообращения (АМК) [9, 13]. АМК - одно из фундаментальных свойств мозгового кровообращения [1, 7]. Она имеет принципиальное значение для адекватного кровоснабжения головного мозга и характеризуется способностью мозговых сосудов сохранять относительно неизменной объемную скорость мозгового кровотока при изменении перфузионного давления (разница между системным артериальным и внутричерепным) в пределах от 50 до 180 мм рт.ст. (рис. 1). Рисунок 1. Зависимость объемного мозгового кровотока (ОМК) от величины перфузионного давления (ПД) в норме. Объяснение в тексте. При выходе перфузионного давления за эти пределы наступает «срыв» ауторегуляции [5, 10, 11, 12, 15] и формируется линейная зависимость мозгового кровотока от динамики внутрисосудистого давления.
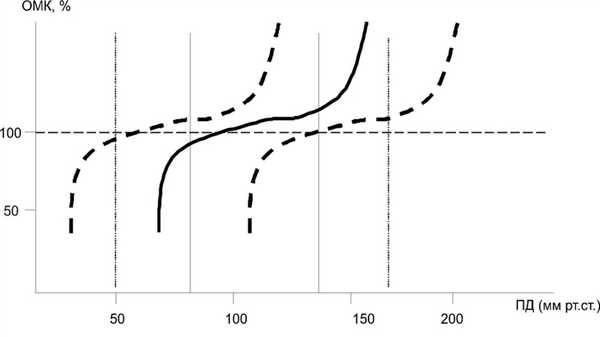
При атеросклеротическом поражении может возникать дискоординация тонуса сосудов головного мозга с изменением параметров ауторегуляции (рис. 2). Рисунок 2. Зависимость объемного мозгового кровотока (ОМК) от величины перфузионного давления (ПД) при различных патологических состояниях. Объяснение в тексте. Оперативные вмешательства, выполняемые у таких больных на сосудах головного мозга и артериях других органов (коронарные, почечные, аорта, артерии нижних конечностей), могут приводить к колебаниям перфузионного давления не только во время операции, но и в послеоперационном периоде с возможностью возникновения гемодинамического нарушения мозгового кровообращения. В связи с этим существует потребность правильной оценки возможностей АМК в предоперационном периоде, что может позволить своевременно провести терапию, направленную на нормализацию активности мозгового кровотока.
В клинической практике для оценки АМК применяются методики, как правило, основанные на применении ультразвуковой допплерографии магистральных артерий головы до и после химических, фармакологических и физических воздействий. К тестам химической природы относят гиперкапнические (ингаляция 4-8% карбогена, произвольная задержка дыхания, дыхание в замкнутом контуре, индуцированная гиповентиляция) и гипокапнические (спонтанная или индуцированная гипервентиляция) пробы. Достоинством этих тестов является то, что естественный «информационный переносчик» в сосудистой системе головного мозга - углекислый газ, а также, что они быстро выполнимы, так как насыщение крови углекислым газом наступает сравнительно быстро [6]. Недостатки: по достижении гиперкапнии обследуемый начинает испытывать ощущение нехватки воздуха, у него наступает «прилив» крови к голове, крайне нежелательный у больных с системным атеросклерозом, возможно развитие неспецифических реакций дыхательной и сердечно-сосудистой систем, способных искажать или маскировать эффект исследования.
Этих недостатков лишены физические тесты оценки АМК, в частности тест индуцированной нефармакологической гипотензии [8]. Суть данного метода заключается в сравнительном анализе изменений системного артериального давления (АД) и линейной скорости кровотока в сосудах головного мозга в ответ на острое снижение АД (на 20-25%) в результате постишемической гиперемии нижних конечностей после компрессии бедер пневматическими манжетами. В процессе мониторинга АД линейной скорости кровотока определяются относительные изменения этих параметров. Разница времени восстановления системного АД и линейной скорости кровотока в сосудах головного мозга указывает на возможности АМК. При низких функциональных возможностях АМК тренд линейной скорости кровотока когерентен динамике АД, при достаточной реактивности мозгового кровотока линейная скорость кровотока в сосудах головного мозга восстанавливается значительно быстрее системного АД. Показателем ауторегуляции АМК является RoR, который рассчитывается по следующей формуле:
RoR = ΔCVR : ΔT50·ΔCPP x 100%,
где Dgr;CVR - относительное изменение цереброваскулярного сопротивления после снижения давления в манжетах; Dgr;T50 - время, в течение которого линейная скорость кровотока после своего максимального снижения во время манжетного теста восстанавливается до 50% от исходного значения; Dgr;CPP - относительное изменение перфузионного давления после снижения давления в манжетах.
Недостаток методики в том, что при локальных нарушениях АМК в случае очаговых церебральных поражений регионарный кровоток зависит от разницы внутриартериального и локального тканевого давления. Поскольку это давление на уровне мелких артерий и артериол и в норме составляет лишь несколько мм рт.ст., даже небольшое повышение тканевого давления резко уменьшает тканевой кровоток за счет уменьшения перфузионного давления. Неравномерность тканевого давления при очаговых поражениях обусловливает неравномерную перфузию головного мозга, что усугубляет нарушения АМК и может вызвать расстройство мозгового кровообращения. В связи с этим исследования динамики лишь системного артериального давления и скорости кровотока по магистральным артериям головного мозга недостаточно, поскольку не отражает динамику тканевого давления. Применяемый же в этом методе мониторинг внутричерепного давления требует сложной специальной диагностической системы и особого программного обеспечения.
Цель исследования - разработка новых ультразвуковых критериев диагностики функциональных возможностей АМК.
Материал и методы
Параметры АМК были изучены у 97 обследованных мужчин, разделенных на 3 группы.
1-ю группу составили 32 пациента в возрасте 46-72 лет (в среднем - 57,46+5,15 года) с облитерирующим атеросклерозом артерий нижних конечностей с различными стадиями хронической артериальной недостаточности. У этих больных имелось поражение аорты, артерий таза и нижних конечностей без гемодинамических поражений брахиоцефальных артерий. У 21 из них была IIБ стадия и у 11 - III стадия ишемии по Фонтейну-Покровскому.
2-ю группу составили 30 больных с различными формами хронической ишемии головного мозга в возрасте 44-69 лет (в среднем - 55,39±6,25 года) с гемодинамически значимыми односторонними атеросклеротическими поражениями внутренней сонной артерии (ВСА). У 8 больных имелась I, у 7 - II и у 15 - III стадия ишемии. В данную группу мы не включали пациентов с IV стадией ишемии, т.е. перенесших острое нарушение мозгового кровообращения. Степень стеноза ВСА составила от 70 до 95% (в среднем 82,10±7,33%). Больные с окклюзией ВСА из исследования исключались. Функциональные возможности АМК у данной группы пациентов определяли на стороне поражения.
3-я группа была контрольной. Ее составили 35 здоровых в возрасте 20-25 лет.
Состояние АМК оценивали по специально разработанному методу [1] . Для измерения скорости кровотока в средней мозговой артерии использовали транскраниальный датчик с частотой 2 МГц, во внутренней яремной вене - линейный датчик с частотой 6-10 МГц. Исследование проводили на аппарате Philips - HDI 5000 (США). В состоянии физиологического покоя определяли АД на плечевой артерии, визуализировали среднюю мозговую артерию и внутреннюю яремную вену, измеряли средние линейные и объемные скорости кровотока. Далее пациенту на 5 мин накладывали пневматические манжеты на обе нижние конечности в верхней трети бедра до полного прекращения кровотока по артериям нижних конечностей ниже места компрессии. По истечении 5-минутного временного интервала одномоментно снимали пневматические манжеты и определяли системное АД и скорости кровотока в средней мозговой артерии и внутренней яремной вене.
После этого оценивали абсолютные показатели скоростей кровотока, а также процент их изменения после компрессионной пробы. Указанные сосуды были выбраны в связи с тем, что средняя мозговая артерия является прямым продолжением ВСА, поставляющей головному мозгу основной объем артериальной крови, а внутренняя яремная вена - основной сосуд, обеспечивающий отток крови из полости черепа.
В процессе исследования определялся диаметр средней мозговой артерии и внутренней яремной вены как до, так и после компрессионной пробы. Это исследование показало, что диаметр сосудов достоверно не меняется в зависимости от этапов исследования. Учитывая, что объемная скорость прямо пропорциональна диаметру сосуда и линейной скорости кровотока, в дальнейших исследованиях мы упростили методику ультразвуковой диагностики, ориентируясь только на линейную скорость кровотока.
Результаты и обсуждение
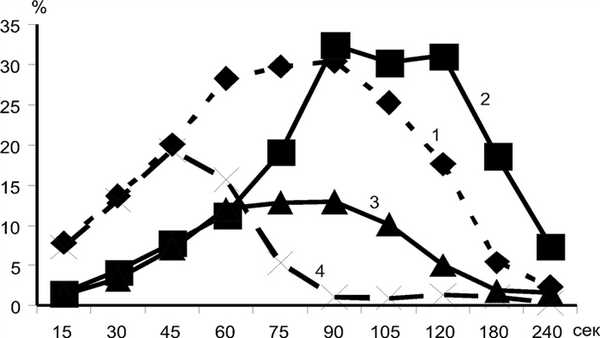
После устранения компрессии с бедренных артерий у пациентов контрольной группы происходит усиление артериального притока к головному мозгу вследствие двух физиологических механизмов (табл. 1). Первый связан с реперфузией головного мозга вслед за кратковременным падением системного АД после снятия пневматических манжет с бедренных артерий. Второй обусловлен раздражением хеморецепторов мозговых сосудов, появившимися в общем кровотоке недоокисленными продуктами обмена, накапливающихся в нижних конечностях во время моделированной ишемии. Это является компенсаторным механизмом, способствующим увеличению перфузионного давления в полости черепа. Максимум увеличения притока артериальной крови происходит в интервале от 60 до 90 с после прекращения компрессионной пробы. В дальнейшем интенсивность артериального кровотока падает (рис. 3). Рисунок 3. Нормальные показатели изменения максимальной скорости кровотока до и после компрессионной пробы (в %) в средней мозговой артерии (кривая 1) и внутренней яремной вене (кривая 2). Объяснение в тексте. Перфузионное давление в тканях головного мозга продолжает оставаться на высоком уровне в течение еще некоторого времени, что обусловлено опережающим увеличением оттока венозной крови из полости черепа. Максимальное увеличение скорости тока крови во внутренней яремной вене соответствует временному интервалу 90-120 с после снятия манжет с бедренных артерий (см. рис. 3).
Таким образом, в физиологических условиях проведения теста, близких к основному обмену, в течение 2 мин после прекращения 5-минутной компрессии обеих бедренных артерий отмечается рост перфузионного давления в тканях головного мозга. Причинами этого феномена можно считать, во-первых, увеличение притока артериальной крови на первом этапе и, во-вторых, опережающее повышение оттока венозной крови из полости черепа на втором этапе. Оба эти компонента, дополняя друг друга, играют значительную роль в поддержании адекватного кровоснабжения головного мозга. От взаимодействия этих компонентов зависит эффективность АМК.
У пациентов 1-й группы имелись достоверные (p <0,05) отклонения гемодинамических показателей по сравнению с контролем (табл. 2). В первую очередь это касается внутренней яремной вены, отток крови по которой косвенно отражает величину тканевого давления головного мозга. Если в контрольной группе имелось прогрессирующее увеличение данного показателя с максимальным значением в диапазоне от 90 до 120 с после снятия манжет с бедер, то у пациентов с периферическим атеросклерозом увеличение тока венозной крови носило несущественный характер с коротким пиком максимального значения на 90-й секунде компрессионной пробы (рис. 4). Рисунок 4. Показатели изменения максимальной скорости кровотока (в с) до и после компрессионной пробы (в %) в средней мозговой артерии и внутренней яремной вене в 1-й группе и контроле. Кривая 1 - средняя мозговая артерия в контрольной группе, 2 - внутренняя яремная вена в контрольной группе, 3 - средняя мозговая артерия в 1-й группе, 4 - внутренняя яремная вена в 1-й группе. На протяжении всего исследования скоростные характеристики внутренней яремной вены в 1-й группе больных были существенно меньше по сравнению с контролем (p<0,05). Это связано, по-видимому, с неадекватным функциональным состоянием сосудов микроциркуляторного русла, развивающимся на фоне атеросклероза, приводящего к увеличению микровязкости клеточных мембран как эндотелия, так и форменных элементов крови [3]. В норме основная роль мелких артериоловенулярных шунтов заключается в быстром перераспределении артериальной крови в венозное сосудистое русло для поддержания адекватного кровоснабжения органа. Физиологическое значение артериоловенулярных анастомозов заключается во включении пути юкстакапиллярного (шунтирующего) кровотока при необходимости разгрузки капиллярного русла и ускорении кровообращения органа. Гемодинамическое значение шунтирующего кровотока вытекает из того, что диаметр анастомозов почти в 10 раз больше диаметра капилляров и в перерасчете на единицу длины объем кровотока в анастомозах в 10 тыс. раз превышает его объем в капиллярах. Так, 1 мкл крови у здорового человека проходит через капилляр диаметром 10 мкм в течение 6 ч, а через артериоловенулярный анастомоз всего за 2 с [2, 14]. Таким образом, артериоловенулярные шунты в нормальных условиях служат средством борьбы с сопротивлением току крови на уровне капиллярной сети - при открытии анастомозов увеличивается давление в венозном русле и возрастает ток крови в нем. Без имеющегося биологического механизма быстрого перераспределения крови при увеличении ее притока возникало бы полнокровие органа с развитием интерстициального отека. Для головного мозга, находящегося в закрытой черепной коробке, это грозило бы смертельными осложнениями.
В отличие от контрольной группы, достоверное повышение кровотока во внутренней яремной вене у больных этой группы начинается уже через 15 с после снятия компрессионных манжет с бедер и сохраняется на протяжении 1-й минуты исследования (рис. 5). Рисунок 5. Показатели изменения максимальной скорости кровотока (в с)(ось абсцисс) до и после компрессионной пробы (в %) (ось ординат) в средней мозговой артерии и внутренней яремной вене в контрольной группе (кривые 1 и 2) и во 2-й группе (кривые 3 и 4). В дальнейшем, начиная с 75-й секунды, когда в норме интенсивность венозного оттока увеличивается, у больных с гемодинамическим стенозом ВСА компенсаторные возможности мозгового кровотока падают, и скоростные показатели кровотока по внутренней яремной вене возвращаются к исходным значениям.
Наше исследование показало, что в норме механизм АМК позволяет поддерживать постоянство перфузионного давления головного мозга за счет двух основных составляющих. На первом этапе - это усиление притока артериальной крови, продолжающееся на протяжении первых 1,5 мин после снятия с бедер пневматических манжет, после чего ему на смену приходит опережающее увеличение оттока венозной крови из полости черепа, снижающее тканевое давление. У больных с атеросклерозом данный адаптационный механизм может быть нарушен.
Наиболее выраженные изменения ауторегуляции мозгового кровотока наблюдаются у пациентов с гемодинамически значимыми стенозами внутренней сонной артерии как за счет низкого притока артериальной крови, так и вследствие короткого парадоксального увеличения кровотока по внутренней яремной вене. У больных с периферическим атеросклерозом нарушения ауторегуляции менее выражены, хотя и они в определенных ситуациях могут привести к развитию гемодинамического нарушения мозгового кровообращения. В их основе лежат низкие функциональные возможности микроциркуляции головного мозга, не позволяющие своевременно перераспределять артериальную кровь в венозное сосудистое русло через артериоловенулярные шунты и тем самым поддерживать перфузионное давление в необходимом диапазоне.
Читайте также:
