Бактерицидные антибиотики. Постантибиотический эффект (ПАЭ)
Добавил пользователь Алексей Ф. Обновлено: 01.02.2026
Антибактериальные препараты получают из бактерий или плесневых грибов или синтезируют de novo. Технически слово «антибиотик» относится только к антибактериальным препаратам, полученным из бактерий или плесневых грибов, но часто (включая информацию по данному РУКОВОДСТВУ) используется синонимично с выражением «антибактериальный препарат».
Антибиотики имеют много механизмов действия, включая:
Ингибирование синтеза клеточной стенки
Увеличение проницаемости клеточной мембраны
Препятствование синтезу белка, обмену нуклеиновых кислот и другим метаболическим процессам (например, синтезу фолиевой кислоты)
В некоторых случаях антибиотики взаимодействуют с другими препаратами, повышая или понижая их концентрацию в крови путем ускорения или замедления их метаболизма, а также за счет иных механизмов взаимодействия (см. таблицу Некоторые распространенные эффекты антибиотиков на другие лекарственные препараты [Some Common Effects of Antibiotics on Other Drugs] Некоторые наиболее частые способы влияния антибиотиков на другие лекарственные средства ). Наиболее клинически важные взаимодействия имеют препараты с низким терапевтическим соотношением (т.е. когда токсические уровни близки к терапевтическим). Интересно, что некоторые лекарства могут увеличивать или уменьшать содержание антибиотиков в крови и других биологических жидкостях.
Многие антибиотики химически связаны между собой и группируются по классам. Хотя препараты в пределах каждого класса имеют структурные и функциональные общие черты, у них часто различная фармакология и спектры активности.
Выбор и использование антибиотиков
Антибиотики должны использоваться только в том случае, если клинические или лабораторные данные свидетельствуют о бактериальной инфекции. В большинстве случаев не рекомендуется их назначение при вирусном заболевании или лихорадке неопределенной этиологии, антибиотики предрасполагают к развитию осложнений у пациентов без какого-либо положительного воздействия и способствуют формированию бактериальной резистентности.
Определенные бактериальные инфекции (например, абсцессы, инфекции, обусловленные инородными телами) требуют хирургического вмешательства и не могут быть излечены одними только антибиотиками.
В целом, клиницисты должны стараться использовать антибиотики с самым узким спектром действия в максимально короткий временной отрезок.
Спектр активности
Анализы посева и восприимчивости к антибиотикам важны для отбора препарата при тяжелых инфекциях. Однако лечение зачастую должно начинаться прежде, чем будут доступны результаты посева; это требует выбора препарата с опорой на наиболее вероятные патогенные микроорганизмы (эмпирический отбор антибиотиков).
Соответственно полученным результатам культурального исследования или при их отсутствии, желательно использовать препараты с самым узким спектром активности, которые могут контролировать инфекцию. Для эмпирического лечения тяжелых инфекций, которые могут быть связаны с одним из нескольких болезнетворных микроорганизмов (например, лихорадка у пациентов с нейтропенией) или которые могут быть вызваны множественными болезнетворными микроорганизмами (например, полимикробная анаэробная инфекция), желателен широкий спектр активности. Наиболее вероятные патогенные микроорганизмы и их чувствительность к антибиотикам изменяются согласно географическому местоположению (в городах или даже в больнице) и могут меняться от месяца к месяцу. Данные о восприимчивости должны быть скомпилированы в антибиограммы и, когда это возможно, использованы для направления эмпирического лечения. Антибиотикограммы обобщают характерные для региона (или местоположения) особенности антибиотикочувствительности распространенных патогенов в отношении обычно используемых антибиотиков.
Эффективность
В естественных условиях на эффективность антибиотика влияет множество факторов, включая следующие:
Наличие инородных материалов
Контроль источника инфекции
Бактерицидные препараты уничтожают бактерии. Бактериостатические препараты замедляют или останавливают рост бактерий in vitro. Эти определения не являются абсолютными; бактериостатические препараты способны уничтожать некоторые чувствительные виды бактерий, а бактерицидные препараты могут только затормозить рост некоторых чувствительных видов бактерий. Более точные количественные методы идентифицируют минимальную концентрацию in vitro, при которой антибиотик может затормозить рост (минимальная ингибирующая концентрация [МИК]) или убить бактерию (минимальная бактерицидная концентрация [МБК]). Использование антибиотиков с бактерицидной активностью может улучшить уничтожение бактерий в случае локального нарушения защитных сил организма в месте инфекции (например, при менингите или эндокардите), или системного нарушения (например, у пациентов с нейтропенией или иммунодефицитами по иным причинам). Тем не менее, существуют незначительные клинические данные, указывающие на то, что следует выбирать бактерицидный препарат вместо бактериостатического просто на основе этой классификации. Для оптимальной эффективности выбор лекарственного средства должен основываться на том, как концентрация лекарственного средства изменяется во времени по отношению к МИК, а не на том, обладает ли лекарственное средство бактерицидной или бактериостатической активностью.
Зависящие от концентрации: величина, при которой пиковая концентрация препарата, превышающая МИК (обычно выражаемая как отношение пика к МИК), наилучшим образом коррелирует с антимикробной активностью.
Зависящие от длительности лечения: продолжительность периода приема дозы, в ходе которого концентрация антибиотика превышает МИК (как правило, выражается в процентах от времени при показаниях выше нормы МИК), лучше всего коррелирует с антимикробной активностью.
Зависящие от времени экспозиции: вводимое количество препарата, приближенное к МИК (количество лекарственного препарата вводится относительно 24-часового интервала по кривой распределения времени (AUC24); отношение AUC24 к МИК лучше всего коррелирует с антимикробной активностью).
Аминогликозиды Аминогликозиды Аминогликозиды (см. таблицу Аминогликозиды [Aminoglycosides]) обладают зависимой от концентрации бактерицидной активностью. Эти антибиотики связываются с рибосомой 30S, таким образом подавляя. Прочитайте дополнительные сведения , фторхинолоны Фторхинолоны Фторхинолоны (см. таблицу Фторхинолоны [Fluoroquinolones]) проявляют зависимую от концентрации бактерицидную активность, подавляя активность ДНК-гиразы и топоизомеразы, т.е. ферментов, необходимых. Прочитайте дополнительные сведения и даптомицин Даптомицин Даптомицин - циклический липопептидный антибиотик, который обладает уникальным механизмом действия. Он связывается с бактериальными клеточными мембранами, вызывая быструю деполяризацию мембраны. Прочитайте дополнительные сведения показывают зависимую от концентрации бактерицидную активность. Увеличение их концентраций от уровней немного выше MПК к уровням намного выше MПК увеличивает скорость и степень их бактерицидной активности. Кроме того, если концентрации превышают MПК даже краткосрочно, у аминогликозидов и у фторхинолонов имеется постантибиотический эффект (ПАЭ) на остаточные бактерии; продолжительность постантибиотического эффекта также зависит от концентрации. Если постантибиотический эффект продолжительный, уровни препарата могут быть ниже MПК в течение длительных периодов без потери эффективности, что позволяет менее частое дозирование. Следовательно, аминоглигозиды и фторхинолоны обычно являются наиболее эффективными при условии болюсного введения, когда достигаются пиковые сывороточные уровни свободного препарата ≥ 10 раз МИК бактерий; при этом обычно промежуточные уровни не важны.
Бета-лактамы бета-лактамы Бета-лактамы - антибиотики, у которых есть кольцевое ядро бета-лактама. Подклассы включают: Цефалоспорины и цефамицины (цефемы) Клавамы Карбапенемы Монобактамы Прочитайте дополнительные сведения , кларитромицин и эритромицин показывают бактерицидную активность с временной зависимостью. Увеличение их концентрации выше MПК не увеличивает бактерицидную деятельность. Кроме этого, поскольку не существует или присутствует очень краткосрочное торможение роста бактерий после того, как концентрации препарата становятся ниже МИК (т.е. минимальный постантибиотический эффект), применение бета-лактамов является наиболее эффективным, когда сывороточные уровни свободного препарата (препарата, не связанного с белками сыворотки) превышают MПК в течение ≥ 50% времени. Поскольку у цефтриаксона длительный период полувыведения из сыворотки (~8 ч), то свободные уровни в сыворотке превышают MИК по очень восприимчивым болезнетворным микроорганизмам в течение всего 24-часового интервала дозирования. Однако при бета-лактамах, у которых полувыведение из сыворотки ≤ 2 часов, с целью оптимизирования времени концентрации выше MИК требуется частое дозирование или непрерывная инфузия.
Активность большинства антибактериальных препаратов зависит от времени экспозиции и лучше всего описывается соотношением AUC-МПК. Примерами являются ванкомицин, тетрациклины и клиндамицин.
Бактерицидные антибиотики. Постантибиотический эффект (ПАЭ)
Эта глава направлена на то, чтобы в дальнейшем мы могли говорить на одном языке и понимать друг друга.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач - клинический фармаколог
Итак, «Азбука Антибиотиков». Почему «Азбука»? Потому что любое новое направление изучения чего-либо должно начинаться с самых азов. Публикаций по антибактериальной терапии великое множество, книг не меньше, только есть одна маленькая загвоздка - все они предназначены, что называется, для продвинутого пользователя. Вопрос в том, как этим продвинутым стать. Мы решили попытаться решить эту задачу, и поэтому данный цикл не будет содержать ни науки, ни даже наукообразия. Здесь в максимально доступной, а где-то даже в просторечной форме, просто об очень сложном, будет публиковаться материал, без которого постижение антибактериальной терапии становится очень трудоемкой и времязатратной задачей, а то и вовсе вырождается в тоску зеленую. Вот эту самую трудность мы и попытаемся снять, чтобы в дальнейшем было легко ориентироваться в том, что написано для продвинутых пользователей.
Почему «Антибиотиков»? Безусловно, правильно говорить «антимикробный препарат» и «антимикробная терапия». Во-первых, потому что антибиотик - это «антижизнь», и тогда куда девать бактериостатики, которые лишь подавляют размножение? В микробиологические контрацептивы относить? Во-вторых, истинные антибиотики - это то, что природа сама насинтезировала в процессе эволюции в течение даже не веков, а тысячелетий - пенициллин, например. Думать о том, что микромир примитивен - это крайне наивное заблуждение. У микробов формируются целые сообщества (классический пример - биопленка), внутри которых ведется бурная социальная, да, я не оговорилась, именно социальная жизнь. Члены сообщества обмениваются информацией, осуществляют горизонтальный перенос факторов устойчивости, кого-то геноцидят, а кого-то холят и лелеют, как своеобразный back up, на случай гибели популяции. Кроме того, там постоянно ведется борьба за «место под солнцем», и одни популяции тиранят другие, вплоть до межвидовых сражений на уничтожение одних другими. А чем удобнее всего сражаться? Правильно - применением антибиотиков. Или подавлять размножение ненужной популяции в рамках одного сообщества бактериостатиками - именно по этому принципу дикие формы уничтожают антибиотикорезистентные - вторые банально не выдерживают накала внутривидовой борьбы. Все остальное, людьми сочиненное и синтезированное - это антимикробные препараты, перекрывающие весь возможный на данный момент спектр возбудителей и обладающие как бактерицидным, так и бактериостатическим действием. Но как дань традиции и, скажем честно, просто привычке, в медицинской среде всю антимикробную терапию привычно обзывают антибиотиками, и кто мы такие, чтобы эту самую традицию менять. Поэтому все, что будет написано далее, будет называться антибиотиками и антибиотикотерапией (АБТ), подразумевая под собой исключительно антимикробность существующего.
Как будет строиться наш цикл? Во-первых, от простого к более сложному, во-вторых, по алфавиту, для простоты навигации. И сегодня мы поговорим о первой букве алфавита А - «азах».
А - «Азы»
Эта глава направлена на то, чтобы в дальнейшем мы могли говорить на одном языке и понимать друг друга. Что-то объяснено подробно, а что-то пока надо принять за аксиому, так как объяснения займут объем, намного превосходящий данную статью. Мы поговорим и об этом, но чуть позже.
1. С какими возбудителями инфекций мы имеем дело в повседневной практике?
В 95% случаев это будет дикая, непуганая микрофлора, ни разу не встретившая на своем пути сделанный человечеством антибиотик. Таких возбудителей мы будем называть дикими (пару раз в литературе встречалось название «наивные», но оно не прижилось, ибо где, например Yersinia pestis (возбудитель чумы), а где наивность?).
Все, что будет написано в дальнейшем, будет касаться дикой микрофлоры, если не будет указано иное.
2. Что мы понимаем под антимикробной активностью препарата.
Казалось бы, вопрос очень простой - открываем аннотацию к любому антибиотику, и там все подробно написано. Но все не так просто.
Как определяется антимикробная активность? Правильно - в чашке Петри, на которой в присутствии дисков с антимикробными препаратами (или в жидкой питательной среде с разными концентрациями антибиотиков) засевают изучаемую культуру и смотрят, вырастет ли она вообще (тогда говорят о чувствительности к данному препарату), а если вырастет, то в каком количестве (те самые пресловутые один, два или три креста), в результате чего микроб будет объявлен умеренно чувствительным или полностью резистентным. В более продвинутых случаях детекцию антибиотикочувствительности проводят в автоматических анализаторах с определением минимальных подавляющих концентраций возбудителя (MIC или МПК возбудителя). И в этом кроется главная заковыка - все эти чашки и анализаторы не являются живым человеком, а мы даже близко не чашки Петри. В организме имеется великое множество ферментных систем и естественных барьеров, за которые умеют прятаться возбудители и куда не могут пробиться антибиотики. Кроме того, в чашке и анализаторе можно создать совершенно убийственную для микроба среду, а если то же самое повторить с пациентом, пациент может кончиться намного быстрее, чем кончится микроб (об этом мы поговорим в главе «Безопасность»). Давайте примем за аксиому, что то, что написано в аннотации, - это то, что произошло исключительно в чашках и анализаторах, но чаще всего не имеет никакой клинической значимости, то есть по описанному в аннотации антимикробному спектру ориентироваться нельзя, нужна клиническая эффективность.
Кроме того, достаточно регулярно появляются публикации о том, что какой-то пытливый ум провел очередной эксперимент с каким-нибудь НПВС или антиконвульсантом, или еще чем-нибудь совершенно не антимикробным: замешав его в питательную среду, попытался вырастить какой-нибудь микроб, и тот не вырос. И так мы получаем очередную «сенсацию». А сенсация ли это? Конечно, нет. Напомню еще раз - человек не чашка Петри, а главной целью антимикробного препарата является микроб, а никак не человек. А теперь представьте, какую концентрацию того же НПВС в теле человека надо будет создать, чтобы некоторое количество микробной популяции хотя бы придавить. И что будет с тушкой этого человека после этого, так как первоначальная точка приложения данной группы препаратов отнюдь не патогенная флора, не говоря уж о том, что и спектр действия подобной «терапии» совершенно неясен. Что-то упорно подсказывает, что на фоне подобных экспериментов опыты доктора Менгеле покажутся детским лепетом.
Так на что же мы должны ориентироваться в определении антимикробной активности? Как мы уже договорились выше, говорить будем в основном о дикой микрофлоре, и для нее антимикробная активность является табличным справочным материалом, который можно использовать в качестве шпаргалки на первых порах освоения вопроса. Где же взять эти таблицы? Для начала - это любой качественный справочник по антимикробной терапии с соответствующей вкладкой. Причем любой за последние 10-15 лет, так как принципиально в антимикробных спектрах дикой флоры ничего не поменялось, а введенные в практику новые антибиотики - это препараты настолько глубокого резерва, что без специальных знаний их не то, что использовать, трогать нельзя. Вопросы безопасности АБТ мы обсудим отдельно в соответствующей главе.
Какие справочники мы могли бы посоветовать? Во-первых, это издания Смоленского НИИ антимикробной химиотрерапии, которые каждый год реализуются в рамках Конгресса МАКМАХ в Москве в мае. Во-вторых, это в том числе переведенные на русский язык Сэнфордские справочники антимикробной терапии и, отдельно для педиатров, - «Антимикробная терапия у детей по Нельсону». Все они карманного формата и помимо антимикробных спектров содержат огромное количество полезной и необходимой для работы информации. Если вы владеете английским на уровне чтения технической литературы, перед вами раскроются такие источники как справочник по антимикробной терапии Хопкинса (отдельные материалы доступны по этой ссылке) и оригинальный Сэнфорд, которые можно установить в свои гаджеты.
3. Каких возбудителей мы будем истреблять?
В обязательном порядке всех абсолютных патогенов (возбудителей чумы, малярии, тифа и далее по списку). Этих представителей микромира в норме в человеке быть не может. А если они есть, да не просто на коже (тогда бы вымерли все хирурги, АиРы и дерматовенерологи), а во внутренних средах организма - это патоген в 95% случаев. Оставшиеся 5% оставим ацинеткам и синегнойкам на так называемую контаминацию/колонизацию, не вызывающую заболевания, но такие состояния надо уметь отличать от истинного заболевания.
Кроме того, меры высшей социальной защиты применяем по отношению к так называемым условным патогенам, то есть тем микробам, которые в местах своего естественного обитания являются нормальными жителями (например, кишечная палочка в кишке выполняет множество полезных функций, начиная с синтеза витамина К), но стоит им выбраться из этой среды туда куда не надо - тут же начинаются грандиозные проблемы (та же E.coli, влетевшая в легкие в процессе аспирации, вызывает тяжелую пневмонию, а попав в мочевыводящие пути не менее тяжелый пиелонефрит).
Для того чтобы понимать, в какой локации какой микроб норма, а какой уже патология, необходимо знать микробиологию на достаточно высоком уровне, чем мы и будем заниматься в дальнейших главах нашего проекта, а именно постигать АБТ через призму микробиологии, а не банальное перечисление групп препаратов и отдельных их представителей (согласитесь, подобных описаний и так в достатке). Но так как для этого потребуется время, а работать надо здесь и сейчас, то вам помогут вышеуказанные справочники, которые содержат главы «Антибиотикотерапия в зависимости от локализации инфекции», где указываются патогенные микробы для конкретных сред и локаций организма, как уже упомянутая E.coli в бронхоальвеолярном лаваже.
4. Виды антимикробной терапии
Эмпирическую терапию мы используем ежедневно, назначая антибактериальные препараты и не зная наверняка, какой именно возбудитель вызвал заболевание, но предполагая совершенно определенный спектр возбудителей, вызывающих данную инфекцию в зависимости от жалоб, анамнеза и локализации оной. Так как пациента лечить надо сразу, так как при многих состояниях задержка с назначением адекватной терапии увеличивает летальность в 2-3 раза, не говоря о тяжести течения и осложнениях, то были разработаны соответствующие схемы эмпирической терапии. Это тоже является справочным материалом, и толковая книжка в кармане очень помогает решить проблему. Кроме того, в назначении эмпирической терапии может помочь микробиологическая лаборатория, даже в условиях минимального ее оснащения, просто покрасив мазок по Граму, что занимает максимум час с учетом доставки до места. Это поможет сориентироваться, грамположительный или грамотрицательный микроб вызвал текущую проблему (классический пример - покрасить мазок с патологически измененных миндалин и увидеть стрептококк), и назначить антимикробный препарат с соответствующим спектром активности. Еще одним видом помощников являются экспресс-тесты. Подробнее вопрос обсудим в главе по микробиологической диагностике.
Этиотропную терапию мы используем, когда микробиологическая лаборатория выдает результаты посева и чувствительности к антибиотикам и теперь уже почти точно известно, что вызвало заболевание. Почти - это не оговорка, лаборатория может выдать очень странный результат, и задача врача понимать, пришел ли действительно возбудитель, или контаминат, или вообще артефакт. А еще вопрос в том, как быстро лаборатория выдаст этот результат. Идеальной является ситуация, когда лаборатория оснащена системами автоматической детекции и результат выдается в течение максимум 48 часов, укладываясь в рамки сроков оценки эффективности АБТ и принятия последующих решений. Но чаще всего получается так, что пациент давно выписан или переведен в другое отделение, а результаты только-только прибыли, и в такой ситуации смотрим следующий пункт.
5. Критерии эффективности АБТ
- основываются на субъективном мнении врача и клинических критериях.
К клиническим критериям улучшения состояния относятся:
- Уменьшение ЧСС
- Нормализация нервно-психического статуса
- Уменьшение болевых ощущений
- Уменьшение напряжения брюшной стенки
- Возможность приема пищи
- Появление чувства голода
- Появление стула
- Восстановление диуреза
В зависимости от механизма действия препарата, мы используем либо «правило 48 часов», либо «правило 72 часов»
«Правило 48 часов» заключается в том, что мы оцениваем клинические результаты применения антибиотика не ранее, чем через 48 часов, а именно на 3-и сутки. Мы четко должны видеть положительную динамику в виде снижения температуры и интоксикации на фоне приема антибактериальных препаратов. Это правило используется при применении бактерицидных препаратов.
6. Критерии окончания АБТ
Общим правилом для прекращения приема антимикробных препаратов является наступление явного клинического улучшения, определяемого на основании субъективного мнения врача и объективных признаков, таких как:
Введение в проблему (часть 1)
Здесь мы рассмотрим один из сложнейших моментов в использовании антибактериальных препаратов, а именно поговорим об их фармакокинетических и фармакодинамических особенностях.
Мы уже говорили, как работают лекарства в целом и как нужно их дозировать. Сегодня же мы поднимем один из сложнейших моментов в использовании антибактериальных препаратов, а именно поговорим об их фармакокинетических и фармакодинамических особенностях.
Если не вдаваться в сложные определения, то фармакокинетика - это то, что организм делает с лекарством, а именно всасывает, распределяет и выводит, а фармакодинамика - это то, что лекарство делает с организмом, т.е. реализует свои терапевтические эффекты.
Когда мы говорим об антибактериальных препаратах, то под фармакодинамическими эффектами мы будем понимать токсический эффект и антибактериальный эффект в очаге инфекции. Выраженность антибактериального действия в очаге инфекции определяется фармакокинетикой препаратов и особенностями их взаимодействия с микробами при различных концентрациях. Предполагается, что количество микроорганизмов в очаге инфекции в каждый момент времени определяется соотношением концентрации антибиотика и уровнем его антимикробной активности в этой концентрации (Сидоренко С.В.)
Антибактериальные эффекты проявляются в разных вариантах:
1. Полное подавление видимого роста - это один из возможных вариантов и с ним все понятно
2. Действие на микроб субингибирующий концентраций, то есть концентраций меньших, чем МПК (минимальная подавляющая концентрация). Дело в том, что при действии этих концентраций в микробной клетке изменяется распределение энергии и она начинает тратиться на компенсацию частично угнетенных функций и уменьшается количество энергии на обеспечение жизненно-важных функций клетки и проявляется это множеством эффектов, самые показательные из которых - снижение скорости роста и уменьшение биомассы культуры в стационарной фазе роста.
Что это нам дает в практическом плане? Важнейшим эффектом субингибирующих доз антибиотиков является нарушение синтеза внешней мембраны, что проявляется в изменении морфологии микроба, (т.е. появляются овоидные, филаментные и другие формы) и снижается уровень продукции факторов вирулентности (адгезинов, факторов инвазии, токсинов и т.п.). Все эти изменения приводят к повышению чувствительности микробов к гуморальными клеточным бактерицидным факторам, а также резко снижают адгезивную способность микроорганизмов.
3. Часть антибиотиков проявляет в отношении на микробов бактерицидное действие, при концентрациях превышающих МПК. Выраженность бактерицидного действия характеризуется величиной МБК (минимальной бактерицидной концентрацией) - это концентрация, обеспечивающая отмирание 99,99% микробной популяции в течение периода наблюдения (чаще всего 8 - 12 часов).
Здесь антибиотики можно разделить на 2 группы:
a) Антибиотики, у которых бактерицидный эффект зависит от концентрации, т.е. скорость отмирания микроорганизмов под действием антибиотика прямо пропорциональна концентрации этого самого антибиотика. Сюда относятся фторхинолоны, аминогликозиды, метронидазол и азитромицин
b) Антибиотики, чей бактерицидный эффект зависит от времени. Превышение их концентрации выше определенного уровня не сопровождается усилением бактерицидного эффекта. Сюда относятся все бета-лактамы, макролиды, кроме азиромицина, линкозамиды и гликопептиды. (не пугаемся, в дальнейшем я объясню все это подробнее)
4. Кроме того имеются еще и персистирующие эффекты, самым известным из которых является постантибиотический эффект (ПАЭ), определенный как время задержки пролифирации микроорганизмов после их обработки антибиотиком как в ингибирующих, так и в субингибирующих концентрациях. Чтобы было понятно - возьмем 2 чашки с посеянными микробами, одну из которых обработаем антибиотиком, а потом каким-то образом удалим этот антибиотик - по сравнению с необработанной чашкой, рост в обработанной начнется заметно позже - это и есть постантибиотический эффект.
Он важен с практической точки зрения тем, что микроорганизмы, обработанные антибиотиком более чувствительны к бактерицидному действию фагоцитов.
Для чего мы сейчас во все это вникали и через все это продирались? Дело в том, что в процессе химиотерпаии происходит смена всех вариантов взаимодействия между микробом и антибиотиком (рисунок 1).
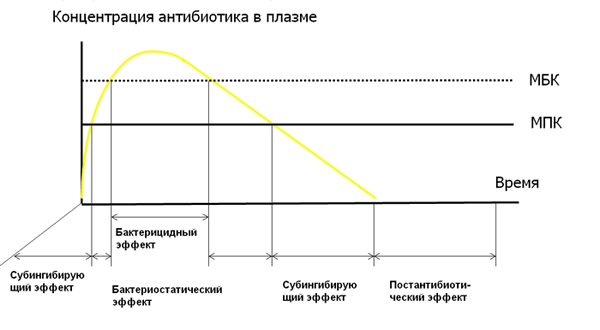
На стадии всасывания и распределения лекарственного вещества на микроб последовательно действуют субингибирующая, ингибирующая и бактерицидная концентрации. В период выведения последовательность становится обратной - бактерицидная, ингибирующая, субингибирующая и, если есть, постантибиотический эффект, т.е. после полного выведения антибиотика микробы не размножаются в период его действия.
Мы помним, что, за очень редким исключением, после однократного введения обеспечить эрадикацию всех микробов в организме невозможно, так как микробы могут находиться в биопленках, да и вообще они довольно социальные существа и у них есть пул клеток, которые находятся как бы в споре и не размножаются, а тихо спят, пока все остальные ведут веселую общественную жизнь, но как только популяция начинает гибнуть, тут же оживают и восстанавливают ее в том же объеме (эта гипотеза недавно получившая экспериментальное подтверждение). Так что антибактериальная терапия должна быть курсовой. А вот длительность этого курса определяется эмпирически, но об этом мы поговорим в другой раз.
Введение в проблему (часть 2)
Как и любое лечение, применение АБП должно быть прогнозируемым. Это было достигнуто путем изучения in vitro антибактериального действия различных препаратов при экспериментальных инфекциях.
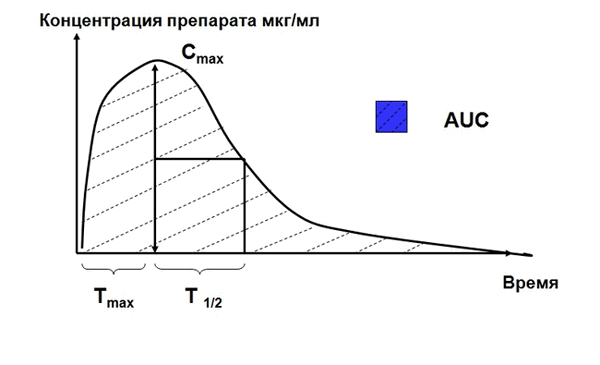
Как и любое лечение, применение АБП должно быть прогнозируемым. Это было достигнуто путем изучения in vitro антибактериального действия различных препаратов при экспериментальных инфекциях. Эксперименты проводились потому что с самого начала было очевидно, что сами по себе ни фармакокинетические ФК параметры (Cmax в сыворотке, Т1/2, площадь под фармакокинетической кривой AUC), ни фармакодинамические ФД параметры (ингибирующая, бактерицидная активность, ПАЭ) не позволяют осуществить прогнозирование. И, в итоге, благодаря экспериментам, высокая прогностическая ценность была выявлена у ряда комплексных фармакокинетических/фармакодинамических (ФК/ФД) параметров.
В качестве ФК параметров наиболее информативной оказалась AUC, время, в течение которого концентрация антибиотика в сыворотке крови превосходит МПК (MIC) этого препарата в отношение возбудителя, а также Cmax - максимальная концентрация препарата в сыворотке крови.
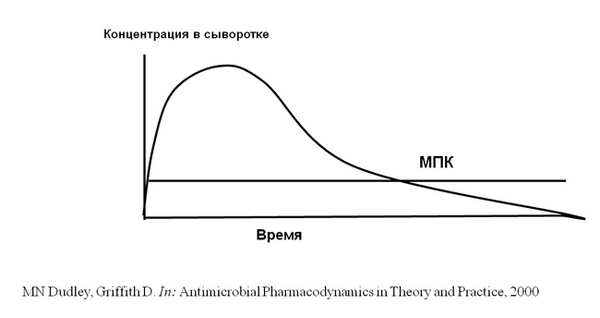
А из всего разнообразия ФД параметров оказалось достаточным использовать только значение МПК.
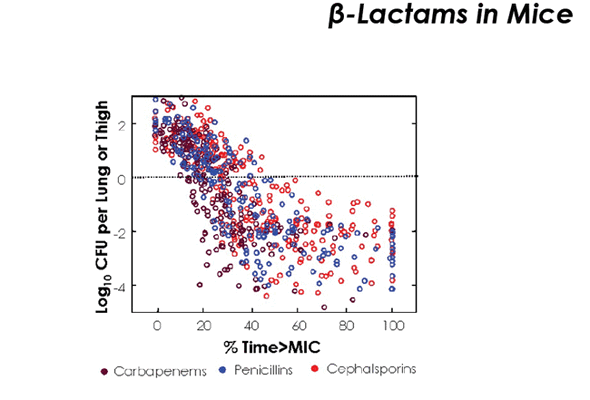
Аналогичным образом были получены предикторы эффективности для большинства АБП основных классов.
Для антибиотиков, проявлявших in vitro бактерицидную активность, зависимую от концентрации, предиктором эффективности является показатель AUC/MIC (AUC/МПК) - к таким антибиотикам относятся аминогликозиды, фторхинолоны, метронидазол, азитромицин.
Для препаратов, проявляющих бактерицидную активность, зависимую от времени (бета-лактамы, макролиды, линкозамиды, гликопептиды), предиктором эффективности является время превышения МПК (Time > MIC)
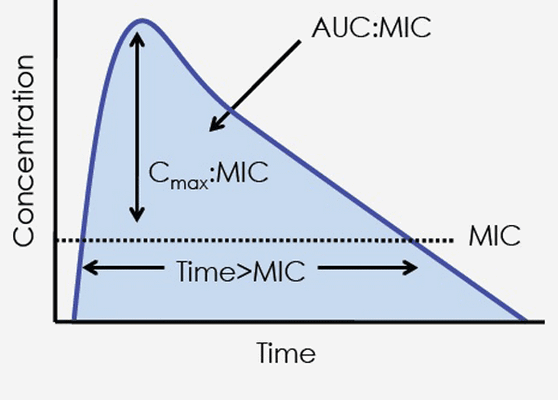
Для чего это нужно знать. Одно из самых перспективных направлений использования предикторов эффективности - корректировка схем применения антибиотиков.
Для бета-лактамов, как для препаратов с времязависимым бактерицидным эффектом и практически отсутствующем ПАЭ, очень важно, чтобы Time > MIC был больше 50 - 60% интервала дозирования, а при нейтропениях - выше 80%. Достигается это частотой введения антибиотика - а значит соблюдение интервалов введения здесь крайне необходимо (т.е. то о чем мы говорили в декабре в теории дозирования лекарств - бета-лактомы мы вводим строго по часам), а в тяжелых случаях (нейтропении) вообще идем на продленные инфузии препарата, потому что нам крайне важно удержать то самое время, когда препарат будет содержаться в состоянии выше МПК (это к вопросу о продленном введении карбопенемов - не надо их при тяжелых состояниях капать быстро, в идеале вообще бы через инфузоматы запускать).
Тот же самый предиктор эффективности характерен для макролидов (которые обладают постантибиотическим эффектом), линкозамидов и гликопептидов - все это мы вводим по часам.
Что касается концентрационно зависимых препаратов (фторхинолоны, аминогликозиды, метронидазол, азитромицин) предиктором эффективности является AUC/MIC + у препаратов этой группы очень выражен постантибиотический эффект. Эта особенность позволила доказать рациональность одноразового введения аминогликозидов в сутки, но обязательно с расчетом дозы на килограмм веса в сутки - нам нужна бактерицидная концентрация в организме сразу, а не большое количество дырок в ягодице, но с неработающими концентрациями препарата в крови. Так что аминогликозиды мы считаем на килограмм массы тела (если есть ожирение - то на идеальную массу тела) и вводим разово всю дозу.
Ну и еще одно коротенькое объяснение, по поводу бактерицидной активности времязависимых и концентрационно-зависимых препаратов. В проведенных экспериментах была выявлена определенная зависимость, когда для одних препаратов при повышении их концентрации бактерицидная активность увеличивалась, а для каких-то, после определенной концентрации наступало стационарное состояние.
Обратите внимание на хрестоматийный рисунок «кривых отмирания» P.aeruginosa при различных концентрациях препаратов.
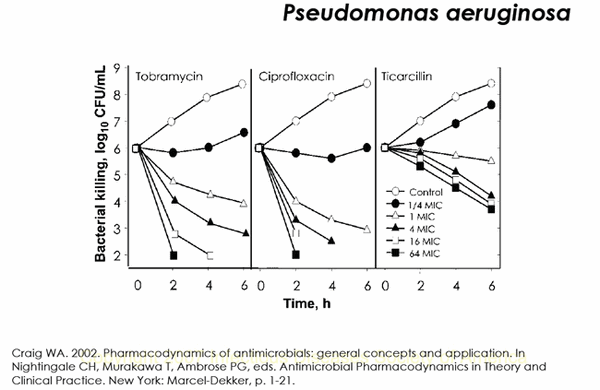
При действии тобрамицина и ципрофлоксацина пропорционально увеличению концентрации препаратов происходит ускорение отмирания культуры P.aeruginosa, а увеличение концентрации тикарциллина от 4 до 64 МПК не приводит к существенному отмиранию микроорганизма.
Про времязависимые эффекты мы поговорили выше в эксперименте с мышками с пневмонией, вызванной клебсиеллой.
При написании данной статьи использовались слайды, предоставленные С.В. Сидоренко в рамках семинара для клинических фармакологов в октябре 2010 на Альянсе клинических химиотерапевтов в Москве.
Обзор антибактериальных препаратов (Overview of Antibacterial Drugs)
Читайте также:
- Распространенность избыточного потребления натрия. Значение диеты в развитии сердечно-сосудистых заболеваний
- Лучевые признаки поражения легких при нейрофиброматозе
- Рентгенограмма, КТ, МРТ при переднем вывихе плеча
- Женская дружба. Как разорвать общение с подругой?
- Внутриорбитальные инородные тела. Обследование, диагностика
