Биохимическая регуляция мозгового кровотока. Влияние углекислого газа и кислорода
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Регуляция мозгового кровообращения осуществляется сложной системой, включающей интра- и экстрацеребральные механизмы. Эта система способна к саморегуляции (т.е. может поддерживать кровоснабжение головного мозга в соответствии с его функциональной и метаболической потребностью и тем самым сохранять постоянство внутренней среды), что осуществляется путем изменения просвета мозговых артерий. Эти гомеостатические механизмы, развившиеся в процессе эволюции, весьма совершенны и надежны. Среди них выделяют следующие основные механизмы саморегуляции.
Нервный механизм передает информацию о состоянии объекта регулирования посредством специализированных рецепторов, расположенных в стенках сосудов и в тканях. К ним, в частности, относятся механорецепторы, локализующиеся в кровеносной системе, сообщающие об изменениях внутрисосудистого давления (баро- и прессорецепторы), в том числе прессорецепторы каротидного синуса, при их раздражении расширяются мозговые сосуды; механорецепторы вен и мозговых оболочек, которые сигнализируют о степени их растяжения при увеличении кровенаполнения или объема мозга; хеморецепторы каротидного синуса (при их раздражении суживаются мозговые сосуды) и самой ткани мозга, откуда идет информация о содержании кислорода, углекислоты, о колебаниях рН и о других химических сдвигах в среде при накоплении продуктов метаболизма или биологически активных веществ, а также рецепторы вестибулярного аппарата, аортальной рефлексогенной зоны, рефлексогенные зоны сердца и коронарных сосудов, ряд проприорецепторов. Особенно велика роль синокаротидной зоны. Она оказывает влияние на мозговое кровообращение не только опосредовано (через общее АД), как это представлялось ранее, но и непосредственно. Денервация и новокаинизация этой зоны в эксперименте, устраняя сосудосуживающие влияния, ведет к расширению мозговых сосудов, к усилению кровоснабжения головного мозга, к повышению в нем напряжения кислорода.
Гуморальный механизм заключается в прямом воздействии на стенки сосудов-эффекторов гуморальных факторов (кислорода, углекислоты, кислых продуктов метаболизма, ионов К и др.) путем диффузии физиологически активных веществ в стенку сосудов. Так, мозговое кровообращение усиливается при уменьшении содержания кислорода и (или) увеличении содержания углекислого газа в крови и, наоборот, ослабляется, когда содержание газов в крови меняется в противоположном направлении. При этом происходит рефлекторная дилятация или констрикция сосудов в результате раздражения хеморецепторов соответствующих артерий мозга при изменении содержания в крови кислорода и углекислоты. Возможен и механизм аксонрефлекса.
Миогенный механизм реализуется на уровне сосудов-эффекторов. При их растяжении тонус гладких мышц возрастает, а при сокращении наоборот снижается. Миогенные реакции могут способствовать изменениям сосудистого тонуса в определенном направлении.
Разные механизмы регуляции действуют не изолировано, а в различных сочетаниях друг с другом. Система регулирования поддерживает постоянный кровоток в мозге на достаточном уровне и быстро изменяет его при воздействии различных «возмущающих» факторов.
Таким образом, понятие «сосудистые механизмы» включает структурные и функциональные особенности соответствующих артерий или их сегментов (локализацию в микроциркуляторной системе, калибр, строение стенок, реакции на различные воздействия), а также их функциональное поведение - специфическое участие в тех либо иных видах регуляции периферического кровообращения и микроциркуляции.
Выяснение структурно-функциональной организации сосудистой системы головного мозга позволило сформулировать концепцию о внутренних (автономных) механизмах регуляции мозгового кровообращения при различных возмущающих воздействиях. Согласно этой концепции, в частности, были выделены: «замыкательный механизм» магистральных артерий, механизм пиальных артерий, механизм регуляции оттока крови из венозных синусов мозга, механизм внутримозговых артерий. Суть их функционирования заключается в следующем.
«Замыкательный» механизм магистральных артерий поддерживает в мозге постоянство кровотока при изменениях уровня общего артериального давления. Это осуществляется путем активных изменений просвета мозговых сосудов - их сужения, увеличивающего сопротивление кровотоку при повышении общего АД и, наоборот, расширения, снижающего цереброваскулярное сопротивление при падении общего АД. Как констрикторные, так и дилятаторные реакции возникают рефлекторно с экстракраниальных прессорецепторов, либо с рецепторов самого мозга. Основными эффекторами в таких случаях являются внутренние сонные и позвоночные артерии. Благодаря активным изменениям тонуса магистральных артерий гасятся дыхательные колебания общего артериального давления, а также волны Траубе - Геринга, и тогда кровоток в сосудах мозга остается равномерным. Если же изменения общего АД очень значительны или механизм магистральных артерий несовершенен, вследствие чего нарушается адекватное кровоснабжение головного мозга, то наступает второй этап саморегуляции - включается механизм пиальных артерий, реагирующий аналогично механизму магистральных артерий. Весь этот процесс многозвеньевой. Основную роль в нем играет нейрогенный механизм, однако определенное значение имеют и особенности функционирования гладкомышечной оболочки артерии (миогенный механизм), а также чувствительность последней к различным биологически активным веществам (гуморальный механизм).
При венозном застое, обусловленном окклюзией крупных шейных вен, избыточное кровенаполнение сосудов головного мозга устраняется путем ослабления притока крови в его сосудистую систему вследствие констрикции всей системы магистральных артерий. В таких случаях регуляция происходит также рефлекторно. Рефлексы посылаются с механорецепторов венозной системы, мелких артерий и оболочек мозга (вено-вазальный рефлекс).
Система внутримозговых артерий представляет собой рефлексогенную зону, которая в условиях патологии дублирует роль синокаротидной рефлексогенной зоны.
Таким образом, согласно разработанной концепции, существуют механизмы, ограничивающие влияние общего АД на мозговой кровоток, корреляция между которыми во многом зависит от вмешательства саморегулирующихся механизмов, поддерживающих постоянство сопротивления мозговых сосудов (табл. 1). Однако саморегуляция возможна лишь в определенных пределах, ограниченных критическими величинами факторов, являющихся ее пусковыми механизмами (уровень системного АД, напряжения кислорода, углекислоты, а также рH вещества мозга и др.). В клинических условиях важно определить роль исходного уровня АД, его диапазона, в рамках которого мозговой кровоток сохраняет стабильность. Отношение диапазона этих изменений к исходному уровню давления (показатель саморегуляции мозгового кровотока) в и звестной мере определяет потенциальные возможности саморегуляции (высокий или низкий уровень саморгеуляции).
Нарушения саморегуляции мозгового кровообращения возникают в следующих случаях.
1. При резком снижении общего АД, когда градиент давления в кровеносной системе мозга уменьшается настолько, что не может обеспечить достаточный кровоток в мозге (при уровне систолического давления ниже 80 мм рт. ст.). Минимальный критический уровень системного АД равен 60 мм рт. ст. (при исходном - 120 мм рт. ст.). При его падении мозговой кровоток пассивно следует за изменением общего АД.
2. При остром значительном подъеме системного давления (выше 180 мм рт. ст.), когда нарушается миогенная регуляция, так как мышечный аппарат артерий мозга утрачивает способность противостоять повышению внутрисосудистого давления, в результате чего расширяются артерии, усиливается мозговой кровоток, что чревато «мобилизацией» тромбов и эмболией. Впоследствии изменяются стенки сосудов, а это ведет к отеку мозга и резкому ослаблению мозгового кровотока, несмотря на то, что системное давление продолжает оставаться на высоком уровне.
3. При недостаточном метаболическом контроле мозгового кровотока. Так, иногда после восстановления кровотока в ишемизированном участке мозга концентрация углекислоты снижается, но рН сохраняется на низком уровне вследствие метаболического ацидоза. В результате сосуды остаются расширенными, а мозговой кровоток - высоким; кислород утилизируется не в полной мере и оттекающая венозная кровь имеет красный цвет (синдром избыточной перфузии).
4. При значительном снижении интенсивности насыщения крови кислородом или увеличении напряжения углекислоты в мозге. При этом активность мозгового кровотока также меняется вслед за изменением системного АД.
При срывах механизмов саморегуляции артерии мозга утрачивают способность к сужению в ответ на повышение внутрисосудистого давления, пассивно расширяются, вследствие чего избыточное количество крови под высоким давлением направляется в мелкие артерии, капилляры, вены. В результате повышается проницаемость стенок сосудов, начинается выход белков, развивается гипоксия, возникает отек мозга.
Таким образом, нарушения мозгового кровообращения компенсируются до определенных пределов за счет местных регуляторных механизмов. Впоследствии в процесс вовлекается и общая гемодинамика. Однако даже при терминальных состояниях в течение нескольких минут за счет автономности мозгового кровообращения в мозге поддерживается кровоток, а напряжение кислорода падает медленнее, чем в других органах, так как нервные клетки способны поглощать кислород при таком низком парциальном давлении его в крови, при котором другие органы и ткани поглощать его не могут. По мере развития и углубления процесса все более нарушаются взаимоотношения между мозговым кровотоком и системной циркуляцией, иссякает резерв ауторегулирующих механизмов, и кровоток в мозге все больше начинает зависеть от уровня общего АД.
Таким образом, компенсация нарушений мозгового кровообращения осуществляется при помощи тех же, функционирующих в нормальных условиях, регуляторных механизмов, но более напряженных.
Для механизмов компенсации характерна двойственность: компенсация одних нарушений вызывает другие циркуляторные расстройства, например, при восстановлении кровотока в ткани, испытавшей дефицит кровоснабжения, в ней может развиться постишемическая гиперемия в виде избыточной перфузии, способствующей развитию постишемического отека мозга.
Конечной функциональной задачей системы мозгового кровообращения являются адекватное метаболическое обеспечение деятельности клеточных элементов мозга и своевременное удаление продуктов их обмена, т.е. процессы, протекающие в пространстве микрососуд - клетка. Все реакции мозговых сосудов подчинены этим главным задачам. Микроциркуляция в головном мозге имеет важную особенность: в соответствии со спецификой его функционирования активность отдельных областей ткани меняется почти независимо от других областей ее, поэтому микроциркуляция также меняется мозаично - в зависимости от характера функционирования мозга в тот или иной момент. Благодаря ауторегуляции перфузионное давление микроциркуляторных систем любых частей мозга менее зависит от центрального кровообращения в других органах. В мозге микроциркуляция усиливается при повышении уровня метаболизма и, наоборот. Те же механизмы функционируют и в условиях патологии, когда имеет место неадекватность кровоснабжения ткани. При физиологических и патологических условиях интенсивность кровотока в микроциркуляторной системе зависит от величины просвета сосудов и от реологических свойств крови. Однако регулирование микроциркуляции осуществляется в основном путем активных изменений ширины сосудов, в то же время при патологии важную роль играют также изменения текучести крови в микрососудах.
Механизмы регуляции мозгового кровообращения и компенсации его нарушений
Нервный механизм передает информацию о состоянии объекта регулирования посредством специализированных рецепторов, расположенных в стенках сосудов и в тканях. К ним, в частности, относятся механорецепторы, локализующиеся в кровеносной системе, сообщающие об изменениях внутрисосудистого давления (баро- и прессорецепторы), в том числе прессорецепторы каротидного синуса, при их раздражении расширяются мозговые сосуды; механорецепторы вен и мозговых оболочек, которые сигнализируют о степени их растяжения при увеличении кровенаполнения или объема мозга; хеморецепторы каротидного синуса (при их раздражении суживаются мозговые сосуды) и самой ткани мозга, откуда идет информация о содержании кислорода, углекислоты, о колебаниях рН и о других химических сдвигах в среде при накоплении продуктов метаболизма или биологически активных веществ, а также рецепторы вестибулярного аппарата, аортальной рефлексогенной зоны, рефлексогенные зоны сердца и коронарных сосудов, ряд проприорецепторов. Особенно велика роль синокаротидной зоны. Она оказывает влияние на мозговое кровообращение не только опосредовано (через общее АД), как это представлялось ранее, но и непосредственно. Денервация и новокаинизация этой зоны в эксперименте, устраняя сосудосуживающие влияния, ведет к расширению мозговых сосудов, к усилению кровоснабжения головного мозга, к повышению в нем напряжения кислорода.
Таким образом, согласно разработанной концепции, существуют механизмы, ограничивающие влияние общего АД на мозговой кровоток, корреляция между которыми во многом зависит от вмешательства саморегулирующихся механизмов, поддерживающих постоянство сопротивления мозговых сосудов (табл. 1). Однако саморегуляция возможна лишь в определенных пределах, ограниченных критическими величинами факторов, являющихся ее пусковыми механизмами (уровень системного АД, напряжения кислорода, углекислоты, а также рH вещества мозга и др.). В клинических условиях важно определить роль исходного уровня АД, его диапазона, в рамках которого мозговой кровоток сохраняет стабильность. Отношение диапазона этих изменений к исходному уровню давления (показатель саморегуляции мозгового кровотока) в известной мере определяет потенциальные возможности саморегуляции (высокий или низкий уровень саморгеуляции).
Биохимическая регуляция мозгового кровотока. Влияние углекислого газа и кислорода
Кафедра офтальмологии педиатрического факультета ГБОУ ВПО "Российский национальный научно-исследовательский медицинский университет им. Н.И. Пирогова", Москва;
ГБУЗ "Городская больница №8" Департамента здравоохранения Москвы
Кафедра офтальмологии педиатрического факультета ГБОУ ВПО "Российский национальный научно-исследовательский медицинский университет им. Н.И. Пирогова", Москва
Кафедра офтальмологии педиатрического факультета Российского государственного медицинского университета, Москва
ГБУЗ "Городская больница №8" Департамента здравоохранения Москвы
Изучение биохимической ауторегуляции кровотока в системе внутренней сонной артерии у недоношенных детей
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(10): 90‑93
Николаева Г.В., Сидоренко Е.И., Гусева М.Р., Бабак О.А. Изучение биохимической ауторегуляции кровотока в системе внутренней сонной артерии у недоношенных детей. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(10):90‑93.
Nikolaeva GV, Sidorenko EI, Guseva MR, Babak OA. The study of biochemical autoregulation of blood flow in the vascular basin of the inner carotid artery in premature children. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2014;114(10):90‑93. (In Russ.).
Основной функцией сосудистого русла является достаточное поступление кислорода и питательных веществ к тканям и органам, необходимое для адекватного поддержания клеточного дыхания и выживания организма в целом. Объем кровотока в органе или ткани зависит от соотношения между перфузионным давлением и сопротивлением кровотоку [1, 2]. Способность сохранять постоянный уровень кровотока независимо от колебаний перфузионного давления называют ауторегуляцией.
Биохимическая ауторегуляция - способность поддерживать в органе или ткани уровень кровотока, соответствующий метаболическим потребностям. Наиболее мощными регуляторами местного кровотока являются кислород и углекислый газ. При гипероксигенемии калибр артериол уменьшается - включается гипероксический драйв, направленный на снижение токсического действия кислорода. При увеличении напряжения углекислого газа в крови калибр артериол увеличивается - включается гиперкапнический драйв [3].
Ауторегуляция кровотока характерна для органов и тканей с высоким уровнем метаболизма, в первую очередь к ним относятся ЦНС и сетчатка глаза.
Нарушение регуляции кровотока может привести как к гипер-, так и гипоперфузии с развитием ишемии, часто сопровождается барьерной дисфункцией, в частности ослаблением состояния гематоэнцефалического и гематоофтальмического барьера 3.
Существует анатомическая и функциональная общность глазных и церебральных сосудов [1, 2, 4]. Это позволяло до эры ультразвуковой допплерографии использовать офтальмоскопическую картину сосудов глазного дна для диагностики нарушений кровотока по внутренней сонной артерии и сосудистых поражений головного мозга.
Полученные нами данные 5 подтверждают существование у недоношенных детей общих механизмов нарушения гемодинамики в конечных ветвях внутренней сонной артерии: передней мозговой и глазной артерий и возможности использования допплерографического параметра кровотока - индекса резистентности передней мозговой артерии для прогнозирования гемодинамических нарушений в глазной артерии. Индекс резистентности рассчитывается по результатам измерения систолической и диастолической скорости кровотока и отражает степень резистентности сосудистой стенки [9]. Выраженные нарушения мозгового кровотока, подтвержденные критическими значениями индексов резистентности передней мозговой артерии (более 0,8), являются одним из патогенетических факторов развития перивентрикулярной лейкомаляции и ретинопатии недоношенных (РН). Этот факт подтверждается едиными возрастными параметрами развития первых клинических признаков данных заболеваний и выявленной взаимосвязью нарушений кровотока в ЦНС и сетчатке [5-8, 10].
РН - тяжелое вазопролиферативное заболевание глаз, развивающееся преимущественно у глубоко недоношенных детей на первых месяцах жизни. Частота РН составляет 32-37% среди детей группы риска [11, 12]. Тяжелое течение заболевания может приводить к отслойке сетчатки, слепоте и слабовидению с детства.
Исследования ауторегуляции кровотока у новорожденных детей малочисленны. Основная их масса проводилась на новорожденных поросятах и крысах.
Известно, что ауторегуляция кровотока ЦНС формируется на последних неделях III триместра беременности [13].
У здоровых новорожденных детей уже на 2-й день жизни выявлялась регуляция мозгового кровотока при изменении парциального давления СО 2 . У новорожденных с выявленными по данным нейросонографии структурными постгипоксическими нарушениями в ЦНС такая регуляция отсутствовала [14]. Колебания церебрального кровотока в первые дни жизни ассоциировались с высокой частотой и тяжестью внутрижелудочковых кровоизлияний [15].
В сетчатке у новорожденных кровоток ауторегулируется в гораздо более узком диапазоне, чем у взрослых, а у недоношенных детей, по мнению ряда авторов 16, ауторегуляция совсем отсутствует. Нормальную регуляцию кровотока в сетчатке у недоношенных новорожденных нарушают гипероксигенация и увеличенная поставка токсичного кислорода [16, 19, 20].
Гипероксия в эксперименте приводила к снижению кровотока в сетчатке у новорожденных поросят, но не вызывала снижения кровотока и доставки кислорода в сосудистой оболочке, являющейся основным источником питания сетчатки, что способствовало развитию кислородиндуцированной ретинопатии [21]. У глубоко недоношенных детей, подвергавшихся на 1-й неделе жизни гипероксии и гиперкапнии, с высокой частотой выявлялись тяжелые формы РН [22].
По нашим данным, у недоношенных детей с нормально завершившимся васкулогенезом сетчатки до 30-й недели гестационного периода ауторегуляция осуществляется за счет работы гиперкапнического механизма, с 30-й недели начинает превалировать гипероксический механизм ауторегуляции, устойчивая работа которого отмечается с 31-32-й недели [5, 10].
В наших исследованиях было показано, что РН развивается на фоне неадекватной работы биохимической ауторегуляции кровотока в сетчатке глаза. У таких детей с 29-й недели гестационного периода выявлялся выраженный спазм артерий сетчатки, который сохранялся вплоть до развития РН. Неадекватная реакция артериол обнаруживалась на фоне невысоких значений парциального давления кислорода (показатели рО 2 были в пределах нормальных значений, не достигая верхней границы) и повышенных - углекислого газа [5, 8, 10].
В последние годы в связи с переходом на новые критерии живорожденности увеличилось количество выживших детей со сроком гестации на момент рождения 24-25 нед. Эта группа недоношенных детей характеризуется глубокой морфологической незрелостью, полиорганной недостаточностью, крайне тяжелым соматическим и неврологическим состоянием, высокими смертностью, частотой развития РН и удельным весом случаев задней агрессивной формы РН и РН I зоны.
До сих пор ауторегуляция кровотока в сосудах глаза и ЦНС на первых неделях жизни у детей, рожденных на 24-25-й неделе гестации, не изучалась.
Визуальный осмотр глазного дна у недоношенных детей невозможен до 29-30-й недели гестационного возраста из-за морфологической незрелости и низкой прозрачности роговицы, выраженной сосудистой эмбриональной капсулы хрусталика [12, 23].
Обоснованная в наших работах 5 возможность использования индекса резистентности передней мозговой артерии для прогнозирования гемодинамических нарушений в глазной артерии позволила нам провести настоящее исследование.
Цель исследования - изучение биохимической ауторегуляции кровотока в сосудах бассейна внутренней сонной артерии у детей, рожденных на 24-25-й неделе гестации.
Материал и методы
Обследовали 18 детей, рожденных на 24-25-й неделе гестации. Масса тела на момент рождения составила 763±138 г. Из исследования были исключены умершие дети.
Офтальмологическое наблюдение осуществлялось с 29-30-й недели гестационного возраста. При первом осмотре выявлялась низкая прозрачность и опалесценция роговиц, выраженная эмбриональная сосудистая капсула хрусталика. Фон глазного дна был серо-желтым. Диск зрительного нерва - бледный. Ретинальные сосуды были очень малой протяженности и визуализировались непосредственно около диска зрительного нерва. Офтальмоскопический осмотр проводился 1 раз в 10 дней, при выявлении РН - 1 раз в 7 дней, при активном течении процесса - 1 раз в 3-5 дней.
По итогам офтальмологического скрининга в исследуемой группе в 100% случаев отмечалось развитие РН с локализацией в заднем полюсе глазного яблока (РН 11+ с локализацией в I-II зоне выявлялась в 53,5% случаев, задняя агрессивная РН - в 37,5%). Первые признаки заболевания выявлялись на 32-33-й неделе гестационного возраста. Всем детям потребовалось проведение профилактической лазеркоагуляции сетчатки.
Ретроспективно проводился анализ историй болезни. Тяжесть состояния новорожденных была обусловлена соматической и неврологической отягощенностью. У всех детей в раннем неонатальном периоде отмечался респираторный дистресс-синдром. Бронхолегочная дисплазия развилась у 15 (77%) детей. Все дети нуждались в длительной дополнительной оксигенотерапии. У всех детей была диагностирована генерализованная врожденная инфекция. У 7 (38%) детей отмечался гнойный менингит. Язвенно-некротический энтероколит формировался у 9 (50%) детей. Диагноз «внутриутробная пневмония» выставлен в 100% случаев. Дистрибутивное состояние отмечено у 5 (28%) детей. Коагулопатия выявлена у 5 (28%) детей, ранняя анемия недоношенных - у 10 (55%). У всех обследованных отмечалось гипоксическое поражение ЦНС. Отмечена высокая частота выявления структурных поражений ЦНС при проведении нейросонографии: перивентрикулярная лейкомаляция развилась у 9 (50%) детей, внутрижелудочковое кровоизлияние III степени - у 9 (50%), II степени - у 5 (28%).
С 25-й по 30-ю неделю гестационного возраста учитывались результаты анализа газового состава капиллярной крови: парциальное давление кислорода и углекислого газа в дни проведения нейросонографии с допплерографией сосудов ЦНС; показатели индекса резистентности передней мозговой артерии по данным допплерографического исследования (нормальные значения для новорожденных 0,64-0,72 до 30-й недели гестационного возраста [3]). Нормальными значениями при исследовании кислородно-основного состава капиллярной крови для данной группы детей считалось рО 2 40-60 мм рт.ст.; рСО 2 35-45 мм рт.ст., при рН >7,25 [24].
Результаты и обсуждение
У детей исследуемой группы отмечался высокорезистентный спастический характер кровотока в передней мозговой артерии. Среднее значение систолической скорости кровотока за весь период наблюдения составило 34,2±9 см/с, диастолической - 5,9±1,9 см/с. Среднее значение индекса резистентности было 0,83±0,04 и превышало (>0,8) критическое значение. Исходя из наших предыдущих исследований, можно утверждать, что и в глазной артерии отмечались нарушения кровотока спастического характера 6.

До 29-й недели гестационного возраста спастический характер кровотока отмечался на фоне низких (нижняя граница нормы и ниже) значений рО 2 (см. таблицу).
На 1-й и 2-й неделях жизни (25-я, 26-я недели гестационного периода) по результатам исследования газового состава капиллярной крови у детей отмечалась гипоксемия. Парциальное давление кислорода было ниже нормы: 39,6±4,6 и 37,7±3,6 мм рт.ст. соответственно. Отмечался спастический характер кровотока в передней мозговой артерии, индекс ее резистентности составил 0,82±0,03 на 25-й неделе и 0,85±0,04 на 26-й неделе гестационного периода. Парциальное давление углекислого газа на первых неделях жизни соответствовало нижним значениям нормы и составило на 25-й неделе 38,8±6 мм рт.ст. и на 26-й - 39,8±4 мм рт.ст. Таким образом, гиперкапнический механизм ауторегуляции на этих сроках гестационного периода недостаточно чувствителен. Артериоспазм отмечается при низких значениях парциального давления кислорода (не соответствует нормальному механизму регуляции) и нормальных - углекислого газа, биохимическая ауторегуляция кровотока на этих сроках гестационного периода не выявляется.
По данным литературы [16, 22], устойчивая гиперкапния существенно нарушает регуляцию кровотока у недоношенных, приводит к резкому увеличению глазного кровотока, «глазной гиперемии» и развитию РН в эксперименте. В нашем исследовании стойкое повышение уровня рСО 2 выявлялось с 27-й недели гестационного периода, достоверная разница с показателями первых дней жизни отмечалась на 28, 29 и 30-й неделях. Резкое нарастание гиперкапнии приводило к снижению резистентности, увеличению калибра сосудов, притоку крови к тканям и, в конечном итоге, раннему развитию РН, формированию перивентрикулярной лейкомаляции и внутрижелудочковых кровоизлияний. Первые признаки РН в исследуемой группе выявлялись уже на 31-32-й неделе гестационного периода. У детей отмечалась высокая частота выявления внутрижелудочковых кровоизлияний - 77% (14 детей), из них в 50% (9 детей) случаев развивались внутрижелудочковые кровоизлияния III степени с вентрикуломегалией. Кистозная перивентрикулярная лейкомаляция сформировалась в 50% (9 детей) случаев.
Регуляция мозгового кровообращения.
Система регуляции мозгового кровообращения обеспечивает адекватность кровоснабжения мозга при изменениях его функциональной активности и независимость энергетического обеспечения мозга от различных внешних воздействий.
Деятельность системы регуляции мозгового кровообращения направлена на компенсацию двух видов возмущений:
При изменении условий притока или оттока крови от черепа система регуляции стремится снизить отклонения кровотока через мозг, проявляется ее способность поддерживать мозговой кровоток при изменениях системного кровообращения Это феномен ауторегуляции.
При изменении химического состава притекающей к мозгу крови возникает отклонение гемодинамических показателей мозгового кровотока (феномен функциональной гиперемии) с целью поддержания на необходимом уровне тканевого метаболизма.
Согласно установившимся представлениям, деятельность системы регуляции мозгового кровообращения основана на трех физиологических принципах: нейрогенном, метаболическом (СО2, лактат, АДФ), гуморальном (мало изучена, ангиотензин) и ауторегуляции.
Ауторегуляция мозгового кровообращения - поддержание постоянства мозгового кровотока в условиях изменения перфузионного давления в основном за счет АД. При повышении АД резистивные сосуды суживаются, а при снижении АД - расширяются.
Метаболическая ауторегуляция: определяется балансом между метаболизмом в мозге и мозговым кровотоком в каждом отдельном участке.
Миогенная ауторегуляция: базируется на особенностях сократительных свойств гладкомышечных элементов сосудистой стенки, определяющих ее способность активно отвечать на растягивающее усилие (эффект Бейлиса).
Нейрогенная ауторегуляция: обусловлена симпатическими нервными волокнами.
Деятельность системы ауторегуляции мозгового кровотока может быть охарактеризована диапазоном ауторегуляции (его нижней и верхней границами), он составляет 60-180 мм рт.ст. Временные характеристики становления феномена ауторегуляции лежат в пределах от 1-2 мин. до 25 с.
Особенности мозгового кровообращения
Строение функциональная организация сосудистой системы мозга обладает рядом особенностей, которые с одной стороны делают его обособленным от остальной сосудистой системы организма (с целью поддержания строго гомеостаза), а с другой - позволяют защитить чувствительные нервные клетки от ишемии.
Развитая система анастомозов (уровни):
уровень вилизиева круга,
уровень коллатерального кровообращения на поверхности мозга в субарахноидальном пространстве,
анастомозы внутри какой-либо области, например полушарий головного мозга,
внутримозговая капиллярная сеть,
внечерепной уровень коллатерального кровообращения за счет анастомозирования ВСА и ПА с бассейном НСА.
Самым важным для поддержания адекватной внутримозговой гемодинамики при окклюзирующих поражениях брахиоцефальных артерий, по мнению большинства авторов, является вилизиев круг.
Высокий уровень перфузии мозга (2,0-2,5% массы тела получает 15% крови из ОЦК).
Тонкая регуляция внутричерепного давления. Мозг расположен внутри ригидного черепа, необходимый баланс между объемом крови и ликвора позволяет изменять приток крови к мозгу во избежание сдавления и ишемии мозговой ткани.
Относительная автономность нервной регуляции мозгового кровотока.
Выявлена высокая чувствительность мозговых сосудов к увеличению парциального давления СО2 и снижению pH крови, которые направлены на уменьшение периферического сосудистого сопротивления и улучшение мозгового кровотока. Величина прироста кровотока на вдыхание газовой смеси с повышенным содержанием СО2 рассматривается как функциональный резерв мозгового кровообращения. Установлено, что у больных с нарушениями мозгового кровообращения реакция сосудов мозга на вдыхание СО2 снижена извращена или отсутствует.
Артериальная гипертензия как приспособительная реакция организма встречается у 20-30% больных с недостаточностью мозгового кровообращения.
Отмечается ряд сдвигов в общей гемодинамике в виде увеличения объема циркулирующей крови, сердечного индекса за счет увеличения сократимости желудочков у больных с окклюзирующими поражениями брахиоцефальных артерий. Хотя существует относительная автономность мозгового кровообращения от системного АД в пределах 60-150 мм рт.ст.
Гемоглобин: роль в газообмене и процессе дыхания
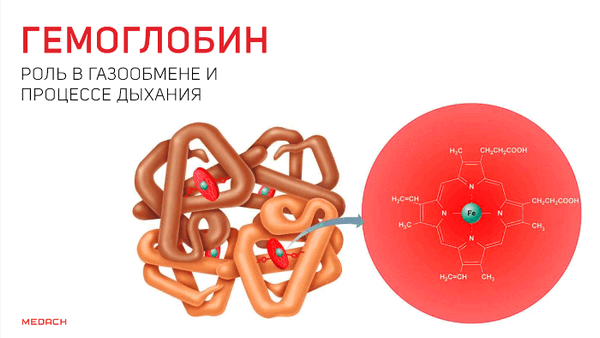
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии. Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1-2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
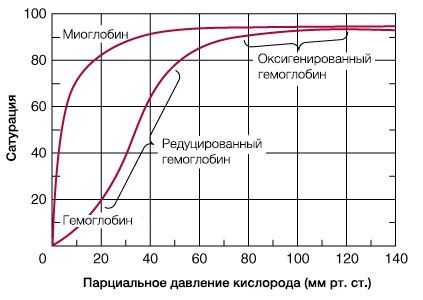
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.

В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.

Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Читайте также:
- Влияние эстрогенов на организм
- Особенности височной кости новорожденного. Формирование наружного слухового прохода
- Пример дермоидной кисты. Диагностика дермоида
- Методика забора артериальной крови из катетера. Удаление периферического катетера из артерии
- Ушная-зубная или отодентальная дисплазия. Липодистрофия лица, плеч и кисты костей с глухотой
