Биологическая теория опухолей. Биологические особенности опухолей.
Добавил пользователь Skiper Обновлено: 21.01.2026
Этиология опухолей. Характеристика канцерогенных факторов.
Современные представления о механизмах развития опухолей. Понятие опухолевой прогрессии.
Опухолевый рост - типовая форма нарушения тканевого роста, возникающая под действием канцерогена. Характерезуется атипизмом роста, обмена веществ, структуры и функции.
Опухолевый рост проявляется патологическим разрастанием ткани с атипичными свойствами.
Согласно цитологической и гистологической структуре опухолевых клеток и тканей выделяют доброкачественные и злокачественные опухоли.
Доброкачественные опухоли. Клетки их морфологически похожи на нормальные и формируют характерные для данной ткани,высокодифференцированные структуры. Такие опухоли растут медленно и, как правило, не метастазируют.
Злокачественные опухоли. Клетки их морфологически отличаются от нормальных и образуют низкодифференцированные тканевые структуры. Эти опухоли растут быстро, инвазируют в соседние ткани, формируют метастазы. Выделяют следующие разновидности злокачественных опухолей:
♦ Карциномы - злокачественные опухоли, происходящие из эпителия.
♦ Саркомы - злокачественные опухоли, возникающие из тканей мезенхимального происхождения (соединительных, костной, хрящевой).
Инициальным звеном опухолевого роста является образование опухолевых клеток под воздействием канцерогенов.
Опухолевая трансформация - процесс превращения нормальных клеток в опухолевые вследствие трансформации нормальной генетической программы в программу формирования опухолевого атипизма.
Факторы химической, физической и биологической природы, способные вызвать опухолевую трансформацию, называют канцерогенами.
• Химические канцерогены. Более 75% случаев злокачественных опухолей человека вызвано воздействием химических факторов внешней среды. К возникновению опухолей приводят преимущественно продукты сгорания табака, некоторые компоненты пищи и промышленные соединения. Известно более 1500 химических соединений, обладающих канцерогенным эффектом. Из них не менее 20 опре- делённо являются причиной опухолей у человека. Например, к ним отнесены 2-нафтиламин, бензидин, 2-аминотиофенил, вызывающие рак мочевого пузыря у работников анилинокрасочной и резиновой промышленности; бис-(хлорметил)-эфир, приводящий к возникновению рака бронхов и лёгких.
• Онкогенные вирусы.
♦ ДНК-вирусы, вызывающие опухолевую трансформацию, называют онковирусами. Гены ДНК-онковирусов способны непосредственно внедряться в геном клетки-мишени. Участок ДНК-вируса (собственноонкоген), интегрированный с клеточным геномом, может осуществить опухолевую трансформацию клетки. Не исключают также, что один из генов онковируса может играть роль промотора клеточного протоонкогена. К ДНК-содержащим онковирусам относят некоторые аденовирусы, паповавирусы и герпесвирусы (так, вирус Эпстайна-Барр вызывает развитие лимфом, а вирус гепатита B способен инициировать рак печени).
♦ РНК-содержащие вирусы, относящиеся к ретровирусам. Интеграция РНК-генов ретровирусов в клеточный геном происходит не непосредственно, а после образования их ДНК-копий.
УСЛОВИЯ, СПОСОБСТВУЮЩИЕ ВОЗНИКНОВЕНИЮ ОПУХОЛЕЙ (ФАКТОРЫ РИСКА)
Наследственные факторы. Существует не менее 300 так называемых семейных форм злокачественных опухолевых заболеваний. В ряде
случаев генетическая природа предрасположенности к возникновению опухолей определена. К числу наиболее значимых относятся следующие:
• Аномалии генов, контролирующих процесс репарации ДНК. Это определяет повышенную чувствительность к канцерогенным воздействиям.
• Аномалии генов-супрессоров опухолевого роста. Выявлены при новообразованиях толстой кишки и поджелудочной железы (делеция 18q21.1), множественном канцероматозе (потеря гетерозиготности в 10q23).
• Аномалии генов синтеза молекул межклеточного взаимодействия, например, E-кадгерина (расположенного в 16q22.1). Уменьшение экспрессии E-кадгерина - один из молекулярных механизмов, способствующих инвазии и метастазированию опухоли.
Низкая активность механизмов противоопухолевой защиты организма (см. ниже).
Клетка под воздействием канцерогена претерпевает ряд последовательных изменений, которые приводят к опухолевому росту. Механизм развития опухолевого роста называют канцерогенезом.
ОБЩИЕ ЭТАПЫ КАНЦЕРОГЕНЕЗА
Вне зависимости от конкретной причины опухолевой трансформации клетки, гистологической структуры и локализации новообразования, в процессе канцерогенеза можно выделить несколько общих этапов
• На первом этапе происходит взаимодействие канцерогенов химической, физической или биологической природы с протоонкогенами и антионкогенами (онкосупрессорами) генома нормальной клетки.
• На втором этапе канцерогенеза (в результате воздействия канцерогена на геном) подавляется активность антионкогенов и происходит трансформация протоонкогенов в онкогены. Последующая экспрессия онкогена - необходимое и достаточное условие для опухолевой трансформации.
• На третьем этапе канцерогенеза, в связи с экспрессией онкогенов, синтезируются и реализуют свои эффекты (непосредственно или
с участием клеточных факторов роста и рецепторов к ним) онкобелки. С этого момента генотипически изменённая клетка приобретает опухолевый фенотип.
• Четвёртый этап канцерогенеза характеризуется пролиферацией и увеличением числа опухолевых клеток, что ведёт к формированию новообразования (опухолевого узла).
Основные биологические особенности опухолевой ткани
Опухоль, новообразование, бластома (от греч.blasto - росток) -патологический процесс, характеризующийся безудержным размножением клеток. Он заканчивается созреванием и дифференцировкой клеток и имеет компенсаторно-приспособительный характер. Размножение клеток при опухоли не подчиняется регуляторным влияниям организма. Автономный или бесконтрольный рост - первое из основных свойств опухоли.
Клетки опухоли под влиянием ряда факторов приобретают особые свойства, которые отличают их от нормальных клеток. Атипизм клетки, который касается ее структуры, обмена, функции, размножения и дифференцировки - второе важное свойство опухоли. Приобретение опухолевой клеткой новых, не присущих нормальной клетке, свойств получило название анаплазии (от греч. Ana - обратно и plasis - образование) или катаплазии (от греч. Kata - вниз и plasis - образование).
Выделяют морфологический, биохимический, гистохимический и антигенный атипизм опухолевой клетки.
Морфологический атипизмопухоли может быть тканевым и клеточным.
Тканевой атипизм характеризуется нарушением тканевых взаимоотношений, свойственных данному органу, т.е. отражает нарушения органотипической и гистотипической дифференцировки. Речь идет о нарушении формы и величины эпителиальных структур, соотношений паренхимы и стромы в них, о различной толщине волокнистых (соединительнотканных, гладкомышечных и др.) структур, о хаотичном их расположении - в опухолях мезенхимального происхождения. Тканевой атипизм характерен для зрелых, доброкачественных, опухолей.
Клеточный или цитологический атипизм - это морфологические проявления опухолевого роста на уровне клетки, отражающие нарушения цитотипической дифференцировки. Он выражается в полиморфизме, или, напротив, мономорфизме клеток, ядер и ядрышек, в гиперхромии ядер, полиплоидии, изменениях ядерно-цитоплазматического индекса в пользу ядер в связи с их укрупнением, появлением множества митозов.
В ряде случаев опухолевые клетки по внешнему виду становятся непохожими на клетки исходной ткани или органа. Когда морфологическая катаплазия достигает крайней степени, строение опухоли становится монотонным по клеточному составу. В связи с этим анапластические опухоли различных органов очень похожи друг на друга.
Важным проявлением морфологического атипизма опухолевой клетки является патология митоза.
Клеточный атипизм характерен для незрелых, злокачественных опухолей. Электронно-микроскопически определяется как атипизм ультраструктурной организации опухолевой клетки, так и признаки ее специфической дифференцировки.
Атипизм ультраструктур выражается в увеличении числа рибосом, связанных не только с мембранами эндоплазматической сети, но и лежащих свободно в виде розеток и цепочек. Изменяются форма, величина и расположение митохондрий. Появляются аномальные митохондрии. Функциональная гетерогенность митохондрий в значительной степени нивелируется за счет митохондрий с низкой или отрицательной активностью цитохромоксидазы. Цитоплазма скудная, но ядро крупное с диффузным или маргинальным расположением хроматина. Появляются многочисленные мембранные контакты ядра, митохондрий и эндоплазматической сети, которые в нормальной клетке крайне редки.
Специфическая дифференцировка опухолевых клеток при электронно-микроскопическом исследовании может быть выражена в различной степени - высокой, умеренной и низкой.
Группа дифференцированных опухолевых клеток, выявляемых при электронно-микроскопическом исследовании, неоднородна и по степени выраженности специфических ультраструктурных признаков: одни клетки опухоли ничем не отличаются от нормальных элементов того же типа, другие - имеют лишь некоторые специфические признаки, позволяющие говорить о принадлежности опухолевой клетки к определенному типу.
В практическом отношении важен вопрос о том, существуют ли какие-либо специфические морфологические особенности опухолевой клетки. Результаты многочисленных исследований показали, что ряд описанных выше признаков опухолевой клетки может наблюдаться при воспалении, регенерации тканей, заживлении ран, поэтому иногда трудно провести дифференциальный морфологический диагноз между опухолью, регенерацией и воспалением. Диагноз опухоли ставится по совокупности морфологических признаков, при этом методы цитологического и гистологического исследований должны дополнять друг друга.
Биохимический атипизмопухолевой ткани выражается рядом особенностей обмена, отличающих их от нормальных.
Ткань опухоли богата холестерином, гликогеном и нуклеиновыми кислотами. В опухолевой ткани гликолитические процессы преобладают над окислительными, содержится мало аэробных ферментных систем. Выраженный гликолиз сопровождается накоплением в тканях молочной кислоты. Это своеобразие обмена опухоли усиливает ее сходство с эмбриональной тканью, в которой также преобладают явления анаэробного гликолиза.
Гистохимический атипизм отражает биохимические особенности опухоли. Он характеризуется изменениями обмена в опухолевой клетке белков и, в частности, их функциональных групп (сульфгидрильных и дисульфидных), накоплением нуклеопротеидов, гликогена, липидов, гликозаминогликанов, изменениями окислительно-восстановительных процессов. В клетках разных опухолей определяется неоднородная картина гистохимических изменений, и каждая опухоль в гистохимическом отношении, также как и в биохимическом, неповторима. Сделана попытка выявить специфические ферменты (ферменты-маркеры) и “ферментный профиль”, характерные для данного вида опухоли.
Так, в клетках рака предстательной железы обнаружена высокая активность кислой фосфотазы, эстеразы и неспецифической экзонуклеазы. В гепатоцеллюлярном раке в отличие от холангицеллюлярного выявляется аминопептидаза; в опухолях из экзокринной части поджелудочной железы в отличие от опухолей из ее островков сохраняется высокая активность эстеразы.
Гистохимическое исследование имеет большое значение не только для диагностики опухоли, но и для изучения ее гистогенеза.
Антигенный атипизм опухоли проявляется в том, что она содержит ряд свойственных только ей антигенов. Среди опухолевых антигенов различают: 1) антигены вирусных опухолей; 2) антигены опухолей, вызванных канцерогенами; 3) изоантигены трансплантационного типа; 4) эмбриональные антигены; 5) гетероорганные антигены.
Антигены вирусных опухолей детерминированы вирусным геномом ДНК - и РНК-содержащих вирусов, но принадлежат опухолевой клетке. Это ядерные и мембранные антигены, которые идентичны для любых опухолей, вызванных данным вирусом.
Антигены опухолей, вызванных канцерогенами, индивидуальны как в отношении носителя опухоли, так и ее характера.
Изоантигены трансплантационного типа обнаруживаются в опухолях, индуцированных онкориавирусами (лейкозы, рак молочной железы и др).
Эмбриональные антигены - антигены опухоли, специфичные для эмбриональных стадий развития организма и отсутствующие в постнатальном периоде. К ним относятся: α1-фетопротеин, обнаруживаемый чаще всего в клетках печеночно-клеточного рака и эмбрионального рака яичка; α2-фетопротеин, выявляемый у детей при нейробластоме и злокачественной лимфоме; карциноэмбриональный антиген, который находят при раке кишечника или поджелудочной железы. Эмбриональные антигены выявляют не только в опухоли, но и в крови больных.
Гетероорганные антигены - органоспецифические антигены, не соответствующие органу, в котором развивается опухоль (например, появление специфического почечного антигена в карциноме печени, или, напротив, печеночного антигена - в карциноме почек). Помимо атипичных антигенов, опухолевые клетки содержат и типичные видоспецифические, органоспецифические, изо - и другие антигены.
В недифференцированных злокачественных опухолях происходит антигенное упрощение, которое является отражением катаплазии опухолевой клетки.
Выявление типичных и атипичных антигенов в опухоли с помощью иммунногистохимических методов служит дифференциальной диагностике и установлению гистогенеза опухоли.
Микроскопическое строениеопухолей отличается большим разнообразием. Однако все опухоли имеют некоторые общие черты строения. Каждая опухоль состоит из паренхимы и стромы, соотношения которых могут сильно варьировать. В одних опухолях преобладает паренхима, в других - строма, в третьих - паренхима и строма распределены равномерно.
Паренхиму опухоли образуют клетки, которые характеризуют данный вид опухоли, ими определяется морфологическая ее специфика.
Строма опухоли образована соединительной тканью органа, в котором она развилась. Она содержит сосуды и нервные волокна.
Большинство опухолей по строению напоминают орган, т.е. имеют паренхиму и выраженную в той или иной степени строму. Такие опухоли называют органоидными. В некоторых, особенно недифференцированных опухолях, строма развита слабо и состоит лишь из тонкостенных сосудов и капилляров. Такие опухоли называют гистиоидными. Они обычно быстро растут и рано подвергаются некрозу.
Опухоль, строение которой соответствует строению органа (ткани), в котором она развивается, обозначают как гомологичную. В тех случаях, когда клеточное строение опухоли отличается от строения органа (ткани), в котором она возникла, говорят о гетерологичной опухоли. Гомологичные опухоли - зрелые, дифференцированные, гетерологичные - незрелые, мало - или недифференцированные.
Опухоли, возникшие в результате гетеротопий, называют гетеротопическими (например, опухоль из костной ткани в стенке матки или легком).
Функциональные свойства опухолевой клетки, отражающие тканевую и органную специфику, зависят от степени морфологической и биохимической (гистохимической) катаплазии. Более дифференцированные опухоли сохраняют функциональные особенности клеток исходной ткани. Например, опухоли, исходящие из клеток островков поджелудочной железы, выделяют инсулин; опухоли надпочечников, передней доли гипофиза выделяют большое количество соответствующих гормонов и дают характерные клинические симптомы, позволяющие высказывать предположение об опухолевом поражении этих эндокринных желез. Удаление опухолей ликвидирует эти симптомы.
Малодифференцированные и недифференцированные клетки опухоли могут потерять способность выполнять функции исходной ткани. В то же время слизеобразование иногда сохраняется в резко анаплазированных раковых клетках, например, желудка.
Поведение опухолевых клеток, их способность к нерегулируемому безграничному росту, свойство развиваться и размножаться при отрыве их от основного узла, отсутствие наклонности к созреванию, способность инфильтрировать ткани и разрушать их, а также способность к имплантации и перевивке свидетельствуют о том, что опухолевые клетки приобретают новые качества, которые за ними наследственно закрепляются. Но возможно и “созревание” малодифференцированной опухоли, когда ее клетки приобретают внешнее сходство с клетками исходной ткани. Следовательно, опухоль обладает способностью к безграничноу росту, подвержена влиянию организма, в котором она развивается. В то же время и опухоль оказывает определенное воздействие на организм. Поэтому нельзя считать, что опухоль является автономным образованием.
В зависимости от степени дифференцировки различают три вида роста опухоли: экспансивный, аппозиционный, инфильтрирующий (инвазивный).
При экспансивном росте опухоль растет “сама из себя”, отодвигая окружающие ткани. Паренхиматозные элементы окружающей опухоль ткани атрофируются, развивается коллапс стромы и опухоль окружается как бы капсулой (псевдокапсула). Экспансивный рост опухоли медленный, он характерен для зрелых, доброкачественных опухолей. Однако некоторые злокачественные опухоли (рак почки, рак щитовидной железы, фибросаркома и др.) могут расти экспансивно.
Аппозиционный рост опухоли происходит за счет неопластической трансформации нормальных клеток в опухолевые, что наблюдается в опухолевом поле.
Инфильтрирующий, или инвазивный рост характеризуется тем, что клетки опухоли врастают за ее пределами в окружающие ткани и разрушают их (деструирующий рост). Инвазия обычно происходит в направлении наименьшего сопротивления по межтканевым щелям, по ходу нервных волокон, кровеносных и лимфатических сосудов. Комплексы клеток опухоли разрушают их, проникают в ток крови и лимфы, врастают в рыхлую соединительную ткань. Если по пути инвазии клеток опухоли встречаются капсула органа, мембраны и другие плотные ткани, то клетки опухоли вначале распространяются по их поверхности, а затем, прорастая капсулу и мембраны, проникают в глубь органа. Понятно, что границы опухоли при инфильтрирующем ее росте, нечеткие, стертые.
Инфильтрирующий рост опухоли быстрый, он характерен для незрелых, злокачественных опухолей.
В зависимости от числа очагов возникновения опухоли говорят об уницентрическом (один очаг) и мультицентрическом (множественные очаги) росте.
По отношению к просвету полого органа рост опухоли может быть эндофитным или экзофитным.
Эндофитный рост - инфильтрирующий рост опухоли в глубь стенки органа. При этом опухоль с поверхности слизистой оболочки (например, желудка, мочевого пузыря, бронха, кишки) может быть почти незаметна, в то время как на разрезе стенки видно, что она проросла опухолью.
Экзофитный рост - экспансивный рост опухоли в полость органа (например, желудка, мочевого пузыря, бронха, кишки). Опухоль при этом может целиком заполнить полость, будучи соединенной со стенкой ее небольшой ножкой.
Злокачественные опухоли дают метастазы, рецидивируют.
Метастазирование - это многоступенчатый процесс, требующий массового отделения клеток опухоли, приобретения отторгнутыми клетками способности существовать вне поддержки первичного очага. Опухолевые клетки попадают в кровеносные и лимфатические сосуды, образуют опухолевые эмболы, уносятся током крови и лимфы от основного узла, задерживаются в капиллярах органов или в лимфатических узлах и там размножаются. Так возникают метастазы, или вторичные (дочерние) опухолевые узлы, в лимфатических узлах, печени, легких, головном мозге и других органах.
Различают гематогенные, лимфогенные, имплантационные и смешанные метастазы.
Одни злокачественные опухоли (например, саркома) метастазируют главным образом по току крови - гематогенные метастазы, другие (например, рак) - по току лимфы в лимфатические узлы - лимфогенные метастазы, а затем уже раковые клетки попадают в ток крови. Об имплантационных (контактных) метастазах говорят при распространении клеток по серозным оболочкам, прилежащим к узлу опухоли.
Чаще в метастазах опухоль имеет то же строение, что и в основном узле. Клетки метастаза могут продуцировать те же секреты и инкреты, что и клетки основного узла опухоли. Однако опухолевые клетки в метастазах могут дифференцироваться и становиться более зрелыми, или, напротив - приобретать большую степень катаплазии по сравнению с первичным узлом опухоли. В таких случаях по гистологической структуре метастаза установить природу и локализацию первичного узла опухоли очень трудно.
В метастазах нередко возникают вторичные изменения (некроз, кровоизлияние и др.). Метастатические узлы, как правило, растут быстрее, чем основной узел опухоли, и поэтому нередко крупнее его. Так, например, диаметр раковой опухоли желудка может достигать 1-2 см, а диаметр ее гематогенных метастазов в печени - 10-20 см. Естественно, что в клинической картине болезни на первое место выступают изменения печени.
Время, необходимое для развития метастаза, может быть различным. В одних случаях метастазы появляются очень быстро, вслед за возникновением первичного узла, в других -они развиваются через 1-2 года.
Возможны так называемые поздние латентные, или дремлющие, метастазы, которые возникают через много (7-10) лет после радикального удаления первичного узла опухоли. Такого рода метастазы особенно характерны для рака молочной железы.
Рецидивирование опухоли -появление ее на том месте, откуда она была удалена хирургическим путем или с помощью лучевой терапии. Опухоль развивается из отдельных опухолевых клеток, оставшихся в зоне опухолевого поля. Рецидивы опухоли иногда возникают из ближайших лимфогенных метастазов, которые не были удалены во время операции.
Влияние опухоли на организм может быть местным и общим.
Местное влияние опухоли зависит от ее характера: доброкачественная опухоль лишь сдавливает окружающие ткани и соседние органы, злокачественная -разрушает их, приводя к тяжелым последствиям.
Общее влияние на организм особенно характерно для злокачественных опухолей. Оно выражается в нарушениях обмена веществ, развитии кахексии. Так, при злокачественных опухолях происходит изменение активности ферментов в крови, уменьшение содержания белков и липидов, увеличение СОЭ, уменьшение числа эритроцитов в крови и другие.
Опухоли, определение, основные биологические особенности опухолей
Опухоль - это избыточное, продолжающееся после прекращения действия вызывающих его причин, некоординированное с организмом, патологическое возрастание ткани, состоящая из клеток, ставших атипичными в отношении дифференцировки и характера роста и передающих эти свойства своим потомкам (Л.М. Шабад).
Опухоли бывают доброкачественными и злокачественными.
Доброкачественная опухоль растет экспансивно, раздвигая, сдавливая, но не разрушая здоровые ткани.
Для злокачественногороста характерен инфильтративный, деструктивный рост, завершающийся разрушением здоровых тканей.
*Опухолям и опухолевым клеткам независимо от вызвавшей их причин, локализации и гистогенеза присущи особенности (атипизм), отличающие их от нормальных клеток и тканей.
Все разновидности атипизма можно разделить на 2 вида:
- характерные для добро- и злокачественных опухолей;
-характерные только для злокачественных опухолей.
К первому типу относятся:
1. Атипизм размножения и дифференцировки.
2. Морфологический атипизм.
3. Биохимический атипизм.
4. Физико-химический атипизм.
5. Антигенный атипизм.
6. Функциональный атипизм.
Только злокачественному росту присущи:
1. Инфильтративный (инвазивный, деструктивный) рост.
Атипизм размножения - заключается в том, что опухолевые клетки обладают относительной автономностью и слабо поддаются регулирующим влияниям со стороны организма. Это обусловлено прежде всего нарушением контактного торможения деления осуществляемого соседними клетками.Нарушается и процесс дифференцировки клеток, что проявляется частичным или полным торможением их созревания.
Клетка как бы «дедидференцируется», становится более молодой похожей на эмбриональную (анаплазия). Это свойство опухолевых клеток является следствием утраты факторов, стимулирующих дифференцировку или снижением к ним чувствительности.
Морфологический атипизм- включает в себя:
1) - нарушение структуры ткани (тканевый атипизм) и
2) - клеток (клеточный атипизм).
* Тканевый атипизм выражается нарушением в ткани опухоли стромально- паренхиматозных соотношений, изменением расположения сосудов, нервных волокон, цитоархитектоники.
* Клеточный атипизмпроявляется клеточным полиморфизмом (изменение ядер по форме и размерам);
увеличением ядерно-цитоплазматического состояния; увеличением размеров и числа ядрышек; увеличением количества рибосом; уменьшением количества митохондрий; появлением различных по величине и форме митохондрий; увеличением числа митозов; изменением числа, формы и размеров хромосом (хромосомные аберрации); увеличением поверхности клеток за счет пластинчатых выростов.
Биохимический атипизм- характеризуется изменением основных биохимических процессов в опухолях и, прежде всего, вследствии утраты такими клетками ряда ферментов, необходимых для выполнения специфических функций.
1. Опухолевая клетка получает энергию (АТФ) преимущественно за счет анаэробного гликолиза (брожения), причем и в присутствии кислорода в ней продолжается интенсивное образование молочной кислоты (так называемый, отрицательный эффект Пастера), тогда как обычно в аэробных условиях клетка получает энергию прежде всего за счет процессов тканевого дыхания (аэробного окисления), а гликолиз заторможен (так называемый, положительный эффект Пастера). Это свойство опухолевых клеток обепечивает им высокую устойчивость и выживаемость в условиях гипоксии.
2. В опухолевой ткани существенно изменен обмен белков и углеводов.
- Основными проявлениями физико-химического атипизма являются:
1. Наличие в опухолевой ткани содержания молочной кислоты и концентрации водородных ионов (ацидоз), прежде всего, в зоне интенсивного деления клеток.
2. Увеличение поверхностного отрицательного заряда опухолевой клетки.
3. В опухолевых клетках увеличивается количество воды и ионов калия, уменьшается количество кальция и магния.
Гидратация клетки повышает электропроводимость и снижает вязкость клеточных коллоидов. Снижение кальция приводит к уменьшению сцепления между клетками, что облегчает отрыв и миграцию клеток, метастазирование и инвазивный рост.
- Функциональный атипизмпроявляется:
1. Частичной или полной утратой опухолевой тканью способности выполнять свои специфические функции.
2. Может наблюдаться повышенное, по сравнению с нормой, выделение опухолевыми клетками веществ, подчас обладающих высокой биологической активностью (например, гормонов).
3. опухолевые клетки могут синтезировать и секретировать вещества, не свойственные клеткам тканей, из которых они произошли.
- Инфильтративный (инвазивный) рост связан со способностью опухолевых клеток прорастать ткани (это присуще только злокачественным опухолям). Такой рост обусловлен изменениями мембран опухолевых клеток, нарушением межклеточного взаимодействия и контактного ингибирования.
Метастазирование - это свойство опухолевых клеток отделяться от первичного узла, распространяться по организму и вызывать образование новых, вторичных опухолевых узлов. Распространение опухолевых клеток может идти по лимфогенным, гематогенным и имплантационным (непосредственный переход этих клеток с поверхности опухоли на контактирующие органы и ткани, например, с верхней губы на нижнюю) путями.
Рецидивирование - это возврат, повторное появление опухоли по гистологическому строению идентичной той, которая была удалена ранее каким-либо способом (хирургическим, химиотерапией, лучевой терапией).
Раковая кахексия - симптокомплекс, развивающийся при злокачественном росте и характеризуется истощением и общей слабостью организма.
Основные биологические особенности опухолей
Все опухоли принято делить на доброкачественные и злокачественные. Основными критериями, позволяющими отдиф-ференцировать злокачественную опухоль от доброкачественной, принято считать: характер роста (доброкачественная опухоль растет экспансивно, отодвигая, сдавливая, но не разрушая здоровые ткани; для злокачественных опухолей характерен инфильтрирующий, инвазивный и деструктивный рост, т.е. они прорастают здоровые ткани и при этом их разрушают), склонность к метастазированию и развитию истощения - кахексии. Более полное представление об отличительных особенностях злокачественных и доброкачественных опухолей можно составить, рассмотрев следующие биологические свойства опухоли.
1. Относительная автономность и нерегулируемость роста опухоли - обязательный универсальный признак любого новообразования - и злокачественного и доброкачественного, коренной признак любой неоплазмы.
Бесконтрольная избыточная пролиферация клеточных элементов опухоли не означает, что деление опухолевых клеток происходит со скоростью, превышающей максимальную скорость деления гомологичных клеток здоровой ткани. Многие здоровые ткани (эмбриональная ткань, регенерирующая печень) растут значительно более интенсивно, чем любая самая злокачественная опухоль. Независимость скорости роста опухоли от интегративных влияний целостного организма, «функциональная глухота» (А.С. Салямон, 1974) - вот что характерно для опухоли.
Некоторые из известных причин бесконтрольной и беспредельной пролиферации при опухолевом росте:
значительное понижение у опухолевых клеток контактного торможения. Клетки нормальной ткани в культуральной среде растут монослоем - по достижении определенной плотности популяции, при контакте с соседними клетками деление прекращается. Раковые клетки, размножаясь, образуют, как правило, многослойные культуры;
отсутствие лимита клеточного деления Хейфлика;
снижение интенсивности синтеза в ткани опухолей кейлонов (вещества, вырабатываемые зрелыми клетками; специфически подавляют митотическую активность пролиферирующих клеток) и понижение чувствительности к их действию клеток опухоли;
различие в микрорельефах нормальной и опухолевой клеток (рис. 3). Множественность микроворсинок клетки злокачественной опухоли существенно увеличивает ее поверхность, позволяя захватывать большие количества необходимых для жизнедеятельности метаболитов и ионов, ослабляет межклеточные контакты.
Морфологическая диагностика опухолей: сдвиг в сторону молекулярно-генетического анализа
Александр Иванцов, кандидат медицинских наук,
Максим Клещёв, кандидат медицинских наук,
Екатерина Кулигина, кандидат биологических наук,
НМИЦ онкологии им. Н. Н. Петрова МЗ РФ (Санкт-Петербург)
«Природа» №6, 2018
Диагностика онкологических заболеваний начинается с морфологического анализа фрагмента пораженного органа, который зафиксирован в формалине, обезвожен в спиртах восходящей плотности и заключен в парафин. Данная процедура позволяет выполнить срез толщиной 3 мкм и поместить его на стекло, затем окрасить ядра клеток и другие базофильные структуры ярко-синим щелочным красителем гематоксилином, а цитоплазму — розовым кислым красителем эозином. Окрашивание позволяет четко визуализировать основные элементы клетки. Затем сопоставляют микроскопический «пейзаж» исследуемого образца с эталонным, на котором зафиксирована характерная для конкретной анатомической области гистологическая структура. О присутствии инвазивного неопластического процесса свидетельствуют утрата типичной гистоархитектоники и клеточных молекулярных структур, наличие полиморфных неорганизованных клеток (рис. 1).
Рис. 1. Рак толстой кишки: утрата типичной гистологической структуры в ходе неопластического процесса
Помимо установления самого факта злокачественной трансформации для назначения индивидуализированной терапевтической схемы важно как можно раньше определить гистологический тип опухоли и оценить стандартные маркеры агрессивности (степень дифференцировки, митотическая активность и т. д.). В пределах одного органа патологический процесс может развиваться по совершенно разным сценариям, вовлекать разнообразные клетки и структуры. Например, среди злокачественных новообразований легкого насчитывают, по современным представлениям, более шести гистологических типов, для каждого из которых необходимы свои терапевтические подходы (рис. 2) [1]. Мелкоклеточный рак легкого отличается стремительным течением, ранним метастазированием и очень плохим прогнозом. Карциноидные опухоли, происходящие из клеток диффузной нейроэндокринной системы, имеют наилучший прогноз; это единственный тип карцином легкого, который, как ныне считается, никак не связан с курением. Саркома легких — агрессивная опухоль, развившаяся из клеток соединительнотканных структур легкого. Аденокарциномы состоят преимущественно из железистых клеток и имеют периферическую локализацию. Опухоли этого типа зачастую развиваются у некурящих людей. Они могут нести активирующие мутации в генах EGFR, ALK и ROS1, которые являются терапевтической мишенью для действия таргетных препаратов — ингибиторов тирозинкиназ.
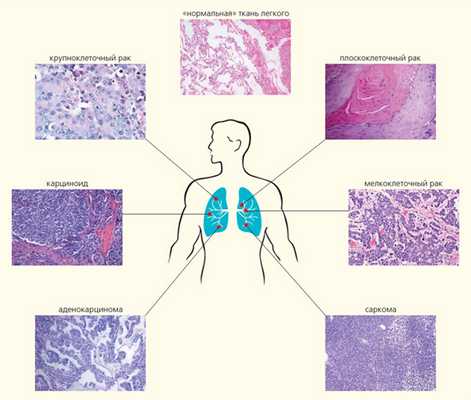
Рис. 2. Гистологические типы рака легкого: мелкоклеточный рак (14%); плоскоклеточный (эпидермоидный) рак (20%); аденокарцинома (38%); крупноклеточный рак (3%); карциноид (5%); мезенхимальные, в том числе саркомы и лимфомы (5%); опухоли смешанных типов — плоскоклеточный и аденокарцинома, аденокарцинома и мелкоклеточный и т.д. (15%)
Чтобы безошибочно установить гистологический тип опухоли в затруднительных ситуациях, вызванных, к примеру, маленьким размером образца или утратой опухолевыми клетками способности к образованию специфических структур (низкая степень дифференцировки), или выявить некоторые специфические характеристики новообразования, морфологи используют иммуногистохимическое окрашивание (ИГХ). Этот метод сформировался еще в середине 1980-х годов [2] и сразу стал одним из наиболее востребованных в клинической онкологии (рис. 3). Появление такого диагностического теста, например, существенно изменило роль патоморфологического исследования в лечении рака молочной железы: именно от результатов ИГХ-анализа на рецепторы к эстрогенам (ER) и прогестерону (PgR), которые синтезируется опухолевыми клетками при этом заболевании, зависит назначение эндокринной терапии. В настоящее время антагонисты эстрогенов, замедляющих деление клеток рака молочной железы, принимают примерно 70% пациенток [3]. С помощью ИГХ можно также обнаружить увеличение синтеза онкобелка HER2/neu (от англ. human epidermal growth factor receptor — рецептор эпидермального фактора роста, или трансмембранная рецепторная тирозинкиназа). Опухоли, вырабатывающие HER2/neu, оказались чувствительными к терапевтическим ингибиторам этой тирозинкиназы, и назначение соответствующих лекарственных препаратов (например, трастузумаба) основано на результатах тестов, в числе которых и ИГХ-анализ [4].
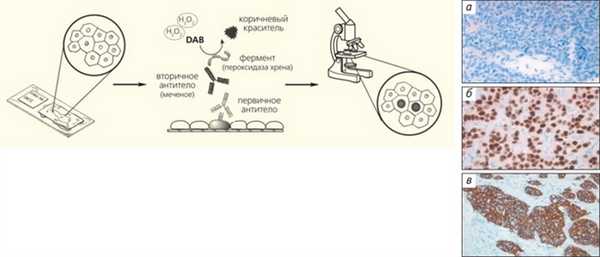
Рис. 3. Схема иммуногистохимического (ИГХ) метода и примеры его применения. Первичные антитела связываются с искомым антигеном (гормоном или его рецептором) и становятся видны в световой микроскоп благодаря соединению с вторичными антителами, мечеными ферментом, при этом пероксидазная активность выявляется с помощью 3,3-диаминобензидина (DAB). Справа приведены примеры оценки рецепторного статуса карцином молочной железы: ИГХ-реакция с антителами к рецепторам эстрогенов (а — негативная реакция, б — ядерное окрашивание, 100% клеток) и с антителами к HER2/neu (в — мембранное окрашивание, оценка 3+)
Диагностику опухолей сегодня невозможно представить без сочетания традиционного морфологического и молекулярно-генетического анализа. Первые мутации, ассоциированные с ответом опухолей на терапию, были обнаружены в прошлом десятилетии. Уже сейчас онкологические клиники применяют десятки молекулярных тестов, предназначенных для персонализации лечения. Еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречается у пациентов с аденокарциномой легкого. Таким образом, актуальной задачей стала дифференциальная диагностика между аденокарциномой и другими гистологическими разновидностями. Маркером первичных аденокарцином является ядерный белок TTF-1 [5]. Если ядра раковых клеток демонстрируют положительное окрашивание (рис. 4), то патоморфолог ставит диагноз «аденокарцинома», и в этом случае пациенту целесообразно подвергнуться молекулярному тестированию на предмет наличия в опухоли мутаций EGFR.
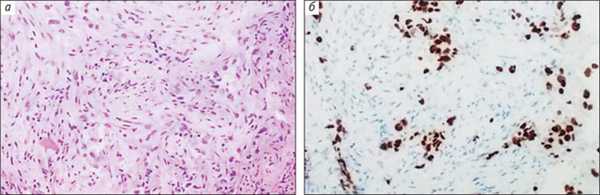
Рис. 4. Низкодифференцированная аденокарцинома легкого (а, среди фиброзной ткани отдельно расположенные опухолевые клетки) и положительная ИГХ-реакция с антителом к TTF-1 в ядрах опухолевых клеток (б)
В клиническом исследовании изучали эффективность EGFR-ингибитора (гефитиниба) на самом первом этапе лечения пациентов с мутацией EGFR [6]. Чтобы включить в исследование 25 больных, нам потребовалось проанализировать образцы тканей более 500 пациентов с раком легкого, что связано с низкой частотой этой мутации, которая в общей выборке больных не превышает 6-7%. Результаты исследования поражают воображение: эффект от препарата наблюдался у всех без исключения пациентов, в то время как аналогичный показатель при назначении стандартной терапии обычно не составляет 20-30% (рис. 5).
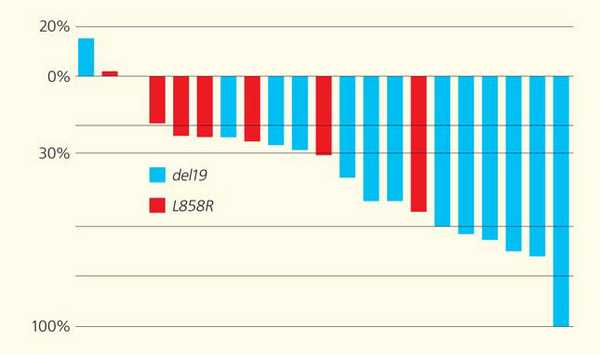
Рис. 5. Снижение размеров опухолевых очагов (%) в ответ на применение EGFR-ингибитора (гефитиниба) у пациентов с активирующими мутациями в гене EGFR: делецией 19-го экзона (19del) и заменой в 21-м экзоне (L858R) [6]
В настоящее время патоморфология переживает фундаментальные изменения. В стройную систему знаний, накопленных десятилетиями в рамках классической цитологии, гистологии и патологической анатомии, интегрируются новейшие представления о молекулярной патологии раковых клеток. Все это дает основания говорить о появлении новой дисциплины — молекулярной патологии [7]. Многие современные алгоритмы принятия врачебных решений уже ориентируются не столько на гистологические разновидности рака, сколько на молекулярные характеристики клеток. Однако роль патолога по-прежнему остается ведущей, поскольку именно он интегрирует все полученные сведения (микроскопические и молекулярные) в общий «портрет» опухоли.
Важность молекулярной морфологии в онкологии будет возрастать в ближайшем будущем, поскольку молекулярная диагностика больше не представляет собой однократное исследование, выполняемое только на этапе постановки диагноза. Многие современные технологии лечения рака предусматривают мониторинг характеристик опухолевых клонов на протяжении всех этапов онкологической медицинской помощи. В этом десятилетии большую популярность приобрели методы «жидкой биопсии», основанные на идентификации фрагментов опухолевых клеток в периферической крови. Другой важный аспект развития морфологии — ее интеграция с различными методами компьютерного анализа, искусственного интеллекта. На наших глазах морфология опухолей превращается из относительно консервативного раздела онкологии в одну из самых динамично развивающихся дисциплин современной медицины.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 16-04-00921).
Литература
1. Wistuba I., Brambilla E., Noguchi M. Chapter 17: Classic Anatomic Pathology and Lung Cancer // IASLC Thoracic Oncology. Pass H. I., Ball D., Scagliotti G. V. (eds) Aurora, Colorado, 2014; 217-240.
2. Taylor C. R., Burns J. The demonstration of plasma cells and other immunoglobulin-containing cells in formalin-fixed, paraffin-embedded tissues using peroxidase-labelled antibody // J. Clin. Pathol. 1974; 27(1): 14-20.
3. Pertschuk L. P., Tobin E. H., Gaetjens E. et al. Histochemical assay of estrogen and progesterone receptors in breast cancer: correlation with biochemical assays and patients’ response to endocrine therapies // Cancer. 1980; 46(12 Suppl): 2896-2901.
4. Pegram M. D., Lipton A., Hayes D. F. et al. Phase II study of receptor-enhanced chemosensitivity using recombinant humanized anti-p185HER2/neu monoclonal antibody plus cisplatin in patients with HER2/neu-overexpressing metastatic breast cancer refractory to chemotherapy treatment // J. Clin. Oncol. 1998; 16: 2659-2671.
5. Stenhouse G., Fyfe N., King G. et al. Thyroid transcription factor 1 in pulmonary adenocarcinoma // J. Clin. Pathol. 2004; 57(4): 383-387. DOI: 10.1136/jcp.2003.007138.
6. Moiseyenko V. M., Procenko S. A., Levchenko E. V. et al. High efficacy of first-line gefitinib in non-Asian patients with EGFR-mutated lung adenocarcinoma // Onkologie. 2010; 33(5): 231-238. DOI: 10.1159/000302729.
7. Birner P., Prager G., Streubel B. Molecular pathology of cancer: how to communicate with disease // ESMO Open. 2016; 1(5): e000085. DOI: 10.1136/esmoopen-2016-000085.
Читайте также:
- Рак корня языка. Рак валлекул надгортанника и гипофаринкса
- Доброкачественное пароксизмальное позиционное головокружение (ДППГ) горизонтального полукружного канала, связанное с каналолитиазом
- Синдром Дюшенна-Лейдена (Duchenne-Leyden)
- Этапы и техника операции при пупочной грыже
- Одонтома: причины, симптомы и лечение
