Блокада синаптического пути торакальных больных. Показатели адекватности анестезии
Добавил пользователь Alex Обновлено: 21.01.2026
1 Отдел Центр новых медицинских технологий Института химической биологии и фундаментальной медицины Сибирского отделения РАН, Новосибирск
В статье приведен собственный опыт использования анестезиологического мониторирования биспектрального индекса при лапароскопических вмешательствах хирургического и гинекологического профиля. Выполнен анализ историй болезни 74 пациентов, оперированных в том числе с использованием хирургических технологий NOTES и SILS. На основании исследования показателей биспектрального индекса на различных этапах операции была проведена дополнительная оценка адекватности низкопоточной анестезии севофлураном. Приведены убедительные доказательства того, что использование BIS-мониторирования при проведении анестезиологического пособия является высокоинформативным методом регистрации уровня седации пациента. Собственные данные подтверждают, что показатели биспектрального индекса могут использоваться для комплексной оценки адекватности проводимого анестезиологического пособия и стандартизации ведения основных этапов наркоза. Данный способ оценки глубины наркоза дает возможность оценить влияние на мозг неблагоприятных факторов и эффективность проводимых мероприятий, а также создать документальные доказательства функционального состояния ЦНС во время анестезии.
1. Бунятян А.А., Флеров Е.В., Саблин И., Бройтман О. // Альманах анестезиологии и реаниматологии. - 2001. - №1. - С. 24.
2. Byspectral index (BIS) - новая идеология в решении старой проблемы / В.Л. Виноградов, В.В. Лихванцев, В.В. Субботин и др. // Анестезиология и реаниматология. - 2002. - № 1. - С. 49-53.
4. Johansen J., Sigl J. Bispectral Index (BIS) Monitoring: Cost Analysis and Anesthetic Outcome // Anesthesiology. - 1997. - №87 (3A). - Р. A434.
Общепринятая методика оценки состояния больного во время наркоза основана на изучении параметров центральной и периферической гемодинамики. Однако многочисленные исследования, как за рубежом, так и у нас в стране, показали, что проблема гарантированного отсутствия сознания во время операции, далека от разрешения. Состояния неоправданно поверхностной анестезии, когда возможно развитие интранаркозного пробуждения, продолжают пугающе регулярно регистрироваться, несмотря на авансы, которые предлагают новые анестетики и методики мониторинга. Анализ проблемы безопасности больных показывает, что почти половина анестезиологических смертей могла бы быть потенциально предотвращена с помощью широкого использования приборов слежения за жизненно-важными функциями организма [1, 3].
Одним из последних направлений эндоскопической хирургии являются оперативные вмешательства на органах брюшной полости с использованием гибких эндоскопов и гибкого эндоскопического инструментария (NOTES) и технологии «однопортового» доступа в брюшную полость (SILS). NOTES- и SILS- операции позволяют снизить травматичность вмешательства путем уменьшения числа проколов передней брюшной стенки, а также добиться желаемого косметического эффекта. Но надо отметить и ряд проблем, связанных с их применением. Технические возможности гибких эндоскопов не позволяют свободно действовать ими в зоне оперативного вмешательства, ограничивают хирурга в количестве манипуляторов. Это, в свою очередь, откладывает отпечаток на продолжительности операции и требует своевременно поставить вопрос об адекватности и безопасности анестезии в данных условиях.
Такой подход усложняет мониторинг глубины анестезии, так как будучи зависимым от различных условий, уровень анестезии будет ступенчато изменяться.
Методы интраоперационного мониторинга могут классифицироваться по наблюдаемым параметрам:
1. Биохимический мониторинг.
- Изучение уровня в сыворотке крови провоспалительных (IL-1, IL-6, IL-8, TNFα, IFNγ) и противовоспалительных цитокинов (IL-4, IL-10, TGFβ), оценка показателей антипротеазной системы, катехоламинов (норадреналина, дофамина). Эти соединения участвуют в процессах трансдукции. Циркуляция медиаторов в крови активирует пусковые механизмы заинтересованных органов при повреждении. Медиаторы усиливают афферентную ноцицептивную трансмиссию, вызывают и потенцируют гормональную секрецию гипоталамуса.
- Оценка гормонального фона (гормонов стресса). В гипоталамо-гипофизарно-надпочечниковой системе - кортикотропин-рилизинг-гормон, АКТГ, гормон роста, кортизол, альдостерон; в симпато-адрено-медуллярной системе - норадреналин, адреналин, лей- и мет-энкефалины, производные проэнкефалина А.
2. Клинические признаки. Артур Гведел в 1937 г. описал признаки анестезии, разделенные на стадии и уровни при спонтанном дыхании под общей анестезией эфиром, которые являются классическими и используются по сей день.
3. Балльная оценка по клиническим признакам. В системе оценки глубины анестезии учитываются частота сердечных сокращений, артериальное давление, наличие или отсутствие потливости или слезотечения; чем больше цифра баллов, тем более облегчённой считается анестезия.
4. Популяционные параметры. Для контроля уровня анестезии используются уровень минимальной альвеолярной концентрации (МАК) анестетика и минимальная скорость инфузии (МСИ) - это эквивалент МАК для внутривенных анестетиков. Сила действия ингаляционных анестетиков традиционно определяется минимальной альвеолярной концентрацией (MAК), и, хотя развитие анестезии скорее связано с парциальным давлением в мозге, термин МАК получил широкое признание как индекс анестетической силы.
5. Аппаратный мониторинг.
- неинвазивные параметры мониторинга (Гарвардский стандарт). Обязательное применение данного стандарта мониторинга сказалось на безопасности больных во время анестезии и операции. До его применения (1976‒1985 гг.) анестезиологическая летальность составляла 1 случай на 75700 больных, а после его внедрения за следующие 5 лет с обязательным стандартом мониторинга составила 1:392000;
- анализ сердечного ритма, импендансометрия, электроэнцефалограммма (ЭЭГ), электромиограмма спонтанной активности мышц, вызванные соматосенсорные, слуховые и зрительные потенциалы.
Несмотря на широкие исследования в оценке ноцицептивной и антиноцицептивной систем организма, до сих пор не существует общепринятой методики ее точной оценки. Перечисленные способы регистрации объективных характеристик, отражающих состояние этих систем в большей степени, доступны специализированным учреждениям, интересующимися фундаментальными изысканиями в области патофизиологии боли. Тем не менее проводимые исследования в области анестезиологии учитывают максимально доступное число цифровых значений, объективизирующих ноцицептивные восприятия интраоперационной боли.
В середине 90-х годов на рынке медицинского оборудования появились первые мониторы ЭЭГ фирмы Aspect Medical System, Inc (США) с новой функцией расчета биспектрального индекса (Byspectral Index, BIS). Предлагаемый параметр является экспертным заключением, которое в числовой форме отражает степень седации ЦНС, независимо от того, каким образом она индуцирована, естественным сном или медикаментозно, и во втором случае отражает функциональное состояние, а не концентрацию препарата в крови. По данным разработчиков, величина BIS отражает конкретно степень гипнотического эффекта анестетика, а не его антиноцицептивный эффект [2, 4].
Цель исследования: оценить адекватность низкопоточной анестезии севофлураном при лапароскопических операциях путем анализа показателей биспектрального индекса на различных этапах хирургического и гинекологического профиля и операций, выполненных по технологиям NOTES и SILS.
Материал и методы исследования
Интраоперационный мониторинг включал в себя неинвазивное определение артериального давления, частоты сердечных сокращений, пульсоксиметрию, оценку минутной вентиляции легких, дыхательного объема, определение пикового давления на вдохе, минимального давления на выдохе, электрокардиографию, измерение концентрации кислорода в дыхательной смеси, концентрации севофлурана на вдохе и выдохе, концентрации углекислого газа на вдохе и выдохе.
Использовался монитор А - 2000 ХР производства компании Aspect Medical System Inc., США (рис. 1).
Рис. 1. Монитор для регистрации биспектрального индекса А-2000 ХР. Общий вид
Крепление датчика производилось согласно рекомендациям фирмы-производителя (рис. 2).
Рис. 2. Расположение датчиков на пациенте при BIS-мониторировании
Результаты исследований и их обсуждение
Используя значения биспектрального индекса, полученные в ходе исследования, можно представить основные тактические моменты при проведении анестезиологического пособия. При проведении премедикации на операционном столе по указанной методике отмечается максимальное снижение BIS до 91 % , средние значения - 95 %. Для того, чтобы индекс не превысил значение 60 % после интубации трахеи, индукцию в анестезию следует проводить исходя из целевых значений BIS, не превышающих 45 %. Основные этапы оперативного вмешательства проводились при показателе BIS - 33-60 %, что является оптимальным для безопасности пациента во время общей анестезии и характеризуется стабильными показателями центральной гемодинамики. Эти данные подтверждаются исследованиями отечественных авторов [2]. Перевод на спонтанное дыхание с последующей экстубацией проводился на уровне BIS, равного не менее 78 %, что обеспечивало адекватное восстановление спонтанного дыхания и должного уровня сатурации крови. Перевод пациента в общее отделение осуществлялся при значениях 90 % и выше, что исключает возможность реседации и депрессии дыхания в ближайшем послеоперационном периоде.
Проведенный статистический анализ выявил достоверную положительную коррелятивную связь между гемодинамическими параметрами (частота сердечных сокращений, систолическое и диастолическое артериальное давление), оцениваемыми неинвазивно и степенью электрической активности головного мозга, оцениваемой по показателям BIS (табл. 1).
Таблица 1
Оценка корреляционных связей показателей гемодинамики и биспектрального
индекса во время операции
Применение регионарных блокад для послеоперационного обезболивания при травмах грудной клетки

Послеоперационное обезболивание на органах грудной клетки, несмотря на многочисленные исследования в этой области, остается актуальной проблемой современной анестезиологии. Известно, что операции на органах грудной клетки являются одним из наиболее травматичных, так как висцеральная и париетальная плевры богаты ноцицептивными рецепторами [1, 3, 8].
После обширных операций на органах грудной полости преобладают легочные нарушения, сопровождающиеся снижением ЖЕЛ, замедлением форсированного выдоха, сокращением амплитуды дыхательного объема [5, 12]. Поэтому сразу после пробуждения больного необходимо добиться эффективной кашли и ранней двигательной активности. Достичь этого можно лишь при адекватной аналгезии [2, 6]. Все это диктует определенные требования, предъявляемые к анестезии при торакальных вмешательствах, которые могут быть сформулированы следующим образом: надежная антиноцицепция, хорошая управляемость газообменом и миорелаксацией, быстрое восстановление сознания и самостоятельного дыхания, высококачественная анальгезия [7].
Более того, в последние годы многими исследованиями доказано, что современные ингаляционные и внутривенные методы общей анестезии не способны полноценно блокировать прохождение ноцицептивных импульсов ни на спинальном, ни на супраспинальном уровне, более того они не предотвращают развития ответной реакции на хирургический стресс [4, 9, 10]. Из этого следует, что сбалансированная анестезия - это фармакологические средства в сочетании с регионарными методиками, воздействующими на физиологические процессы, реализующие ноцицепцию, трансмиссию, модуляцию и перцепцию на базе мультимодальности [3, 10].
Цель нашего исследования заключается в оценке эффективности послеоперационного обезболивания при применении грудной паравертебральной блокады после экстренных оперативных вмешательств у больных с повреждениями грудного каркаса.
Материал и методы обследования.
Обследованы 116 больных, поступивших в РНЦЭМП в экстренном порядке с травматическими повреждениями грудной клетки. Больные разделены на 3 группы в зависимости от применяемого метода анестезии и послеоперационного обезболивания.
Первую группу составили 40 больных, которым по экстренным показаниям проводилось оперативное вмешательство под общей анестезией. Средний возраст больных этой группы составил 37±3,2 года из них 30 мужчин и 10 женщин. Средняя продолжительность оперативного вмешательства в контрольной группе составила 58±8,4 мин. В послеоперационном периоде обезболивание в данной группе осуществлялось введением промедола.
Вторую группу составили 37 пациентов, средний возраст которых составил 38,5±2,4 года, из них 26 мужчин и 11 женщин. Перед индукцией в анестезию производилась интраплевральная аналгезия во втором межреберье с повреждённой стороны местным анестетиком бупивакаином в дозе 50-75 мг. Катетер оставляли в плевральной полости для повторного введения местного анестетика при необходимости и для послеоперационного обезболивания. Аналгетический компонент поддерживался вышеуказанной интраплевральной аналгезией и болюсным введением фентанила. Средняя продолжительность оперативного вмешательства в данной группе составила 65,4±7,6 мин. Послеоперационное обезболивание осуществлялось введением в интраплевральное пространство через катетер местного анестетика бупивакаин, также кетонал в дозе 300 мг в сутки и при необходимости наркотический аналгетик промедол.
Третью группу с оставили 39 пациентов, средний возраст которых составил 36,8±5,4 года, из них 25 мужчин и 14 женщин. Перед индукцией в анестезию производилась паравертебральная блокада на уровне от Th 4 до Th 7 c последующей катетеризацией для послеоперационного обезболивания. В паравертебральное пространство вводился местный анестетик бупивакаин в дозе 25 мг на каждый сегмент (в среднем всего 100-125 мг). Дождавшись эффекта от паравертебральной блокады, начиналась индукция в анестезию в/в введением дормикума 0,8 мг/кг, фентанила 3 мкг/кг, кетамина в дозе 1,2 мг/кг. Средняя продолжительность оперативного вмешательства 63,7±8,9 мин, послеоперационное обезболивание проводилось сочетанием паравертебральной блокады бупивакаином в дозе 30-50 мг, также кетонал в дозе 300 мг в сутки и при необходимости добавлялся промедол.
Исследовались показатели кислотно - основного состояния (КОС). Нами также были исследованы следующие показатели центральной и периферической гемодинамики АДс (систолическое артериальное давление), АДд (диастолическое артериальное давление), АДср (среднее артериальное давление), ЧСС (частота сердечных сокращений), МРЛЖ (минутная работа левого желудочка), МОС (минутный объём сердца), СИ (сердечный индекс), ОПСС (общее периферическое сосудистое сопротивление), рассчитанные по следующим формулам:
АДср = АДд + (АДс - АДд) / 3 (1)
МРЛЖ = МОС х АДср х 0,0136 (2)
ОПСС = (АДср х 60 х 1333) / МОС (3)
Оценку боли в послеоперационном периоде проводили по визуально-аналоговой шкале (ВАШ). Вышеуказанные исследования были проведены на следующих этапах послеоперационного периода: 1- до начала обезболивания, 2 -через 30 мин после обезболивания, 3- через 2 часа, 4 - через 5 часов.
торакоскопия с ликвидацией посттравматического гемоторакса- 45 (38,3%);
торакоскопия с ликвидацией посттравматического пневмоторакса-32 (27,5%);
торакоскопия с ушиванием разорвавшихся булл- 20 (17,5%);
Проведённые нами исследования выявили следующие результаты :
Больные трёх групп поступали в операционную с имеющейся дыхательной недостаточностью, с гипертензией и тахикардией ввиду повреждения каркаса грудной клетки. Превалировал болевой фактор, ограничивающий дыхательную подвижность лёгких. Проведённая премедикация у всех больных полностью не снимала болевого фактора и при поступлении в операционную больные трёх групп ощущали боль равную 7-8 баллам по ВАШ, что соответствует сильной боли.
У всех больных на исходном этапе исследования проявлялись явления респираторного ацидоза с повышением рСО2 и уменьшением О2, что возможно связано с болевым фактором и соответственно ограничением дыхания из-за перелома рёбер. У больных 2 и 3 групп после применения ПВБ и ИПА отмечалась нормализация показателей КОС. Показатели гемодинамики на протяжении всего интраоперационного периода оставались стабильными, чего не скажешь о 1 группе, где оставалась склонность к тахикардии и гипертензии.
Показатель времени экстубации больных в послеоперационном периоде представлен на рис 1. Время экстубации больных в 1 группе составило 80,5±19,2 мин, что на 43,5% достоверно выше относительно 2 группы, где данный показатель составил 45,5±8,4 мин. В сравнении между 1 и 3 группами, где показатель времени экстубации составил 34,3±7,3 мин, отмечается достоверное повышение вышеуказанного показателя на 57,4 %.
Рис. 1. Время экстубации больных в 3-х группах в мин.
Было интересным сравнение двух групп с применением регионарной анестезии, т. е. 2 и 3. Данное сравнение выявило удлинение времени экстубации у больных 2 группы по сравнению 3 группы на 24,7%, что доказало эффективность ПВБ как аналгетического компонента и сокращения времени пребывания на ИВЛ за счёт меньшего применения наркотических аналгетиков в интраоперационном периоде.
30 % больных 1 группы сразу же после экстубации жаловались на боль с требованием обезболивания. Время первого требования аналгетика (ВПТА) в 1 группе составило 45±11,5 мин, во 2 группе 98,1±8,5* мин, а в 3 группе 150,3±7,9** мин. Отмечается достоверное сокращение ВПТА на 34,7% в 1 группе по сравнению со 2-й группой, и на 70% в сравнении с 3-й группой больных. Сравнивая 2 и 3 группы нами отмечено достоверное удлинение ВПТА в 3 группе, нежели во 2 группе, что доказывало более длительный эффект обезболивания при применении ПВБ. Динамика исследованных нами показателей КОС в послеоперационном периоде не выявило каких либо значимых изменений. Снижавшиеся показатели рО2 и повышавшиеся показатели СО2 изменялись на пике ощущений боли пациентами, но за рамки нормальных величин не выходили.
Показатели гемодинамики, исследованные нами в послеоперационном периоде, были следующими: Показатель АДср до начала обезболивания, и показатель ЧСС соответствовали ощущениям боли пациентами трёх групп по ВАШ. Пациенты 1 и 2 групп ощущали очень сильную боль соответствующую 7-8 баллам, пациенты 3 группы ощущали сильную боль соответствующую 6 баллам по ВАШ. Показатели СИ, МРЛЖ, ОПСС в трёх группах на 1 этапе послеоперационного периода в трёх группах достоверных различий не имели и соответствовали вышеуказанным ощущениям боли пациентами.
Через 30 мин после обезболивания показатели АДср в 1 группе на фоне обезболивания промедолом 20 мг снижались на 12,2%, а ЧСС на 23,5% в сравнении с исходным этапом. Во 2 группе, на фоне сочетания применения интраплеврального обезболивания бупивакаином 50 мг и НПВС кетонала 100 мг, АДср снижалось на 18,1 %, а ЧСС на 25,5%. В 3 группе на фоне применения паравертебральной блокады бупивакаином 50 мг, кетоналом 100 мг АДср снизилось на 19%, ЧСС на 32,2%. Показатель СИ снижался на фоне обезболивания в 1 группе на 23%, во 2 группе на 15,5%, а в 3 группе на 28 % в сравнении с данным показателем на исходном этапе послеоперационного периода. МРЛЖ снижался на 34,4% в 1 группе, во 2 группе на 33,3% и в 3 группе достоверно снижался на 41%. Сравнивая показатель МРЛЖ между 2 и 3 группами на 2 этапе исследования выявлено достоверное снижении этого показателя на 12,3% в 3 группе, что доказывало более лучший эффект обезболивания при применении сочетания НПВС кетонала и ПВБ. Ощущения боли пациентами трёх групп также достоверно изменялись на фоне проводимого обезболивания. На 2 этапе исследования показатель ВАШ в 1 группе снижался на 55,6%, соответствовал слабой боли. Во 2 группе этот показатель адекватности обезболивания достоверно снижался на 73,5% и соответствовал отсутствию боли по ВАШ. В 3 группе вышеуказанный показатель снижался на 82,6% и соответствовал полному отсутствию боли по ВАШ.
Через два часа после обезболивания показатели гемодинамики в трёх группах оставались в пределах нормальных величин, однако имелась некоторая тахикардия в первой группе с соответственным изменением АДср, СИ и МРЛЖ. Показатель МРЛЖ был достоверно выше в 1 группе на 26,8%, по сравнению со 2 группой, и на 37,1% выше по сравнению с 3 группой. СИ на фоне обезболивания достоверно снижался, приближаясь к нормальным величинам во 2 группе на 23%, в 3 группе на 31,4% в сравнении с 1 группой. Таким образом, несмотря на незначительные колебания основных показателей АДс, АДд, ЧСС, показатели центральной гемодинамики СИ и МРЛЖ имели достоверные различия между группами на 3 этапе послеоперационного периода. Что касается показателя ВАШ, то больные 1 группы ощущали боль равносильную 5-6 баллам, что соответствовало умеренной боли по субъективной шкале оценки боли. Больные 2 группы ощущали менее интенсивную боль, которая была достоверно ниже на 22,9% по сравнению с ощущениями пациентов контрольной группы. Пациенты 3 группы на данном этапе послеоперационного периода практически не ощущали боли, и показатели ВАШ в этой группе были на 79% ниже в сравнении с 1 группой. Проведённое сравнение субъективных ощущений боли между пациентами 2 и 3 групп выявило достоверную разницу на 73%. У пациентов 3 группы качество послеоперационного обезболивания было выше и эффективнее, нежели у пациентов 2 группы. 30% больных 2 группы на данном этапе исследования требовали дополнительного обезболивания, и в качестве обезболивающего препарата применялся промедол 20 мг однократно.
Таблица 1. Динамика показателей гемодинамики в послеоперационном периоде
Предоперационная диагностика, мониторирование и выбор метода анестезии у пациентов в стационарных условиях
2.Вентиляция.
Обязательно оцениваются:
экскурсия грудной клетки;
аускультация дыхательных шумов;
наблюдение за дыхательным мешком;
количественный мониторинг объема вдыхаемого и выдыхаемого газа (при ИВЛ);
количественное определение СО2 во вдыхаемом и выдыхаемом воздухе (при ИВЛ);
при ИВЛ необходимо активировать тревогу дисконнекции.
3.Гемодинамика.
Обязательно:
пальпация пульса и аускультация сердца, ЧСС и АД через 5 минут;
ЭКГ.
Лечение (стационар)
НАИБОЛЕЕ ЧАСТО ИСПОЛЬЗУЕМЫЕ МЕТОДИКИ АНЕСТЕЗИИ В СТАЦИОНАРНЫХ УСЛОВИЯХ
| Методики анестезии | Диагностика (диагностика и мониторинг) | Лечение | ||||||
|---|---|---|---|---|---|---|---|---|
| при установлении диагноза (перед операцией) | в процессе лечения (во время анестезии) | необходимое (анестезия) | ||||||
| обязательная | дополнительная (по показаниям) | |||||||
| 1 | 2 | 3 | 4 | 5 | ||||
| Ингаляционная анестезия с сохраненным спонтанным дыханием (не более 1 часа, пациенты I -II ASA) | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Премедикация: легкая: атропин 0,3-0,6 мг внутримышечно за 30 мин. ± диазепам 5-10 мг внутримышечно или внутрь за 30 мин. умеренная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + фентанил 50-100 мкг внутривенно перед операцией или + тримеперидин 20 мг внутримышечно за 30 мин. усиленная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + тримеперидин 20 мг внутримышечно за 30 мин. или + фентанил 50-100 мкг внутривенно перед операцией или + морфин 0,1 мг/кг внутримышечно за 30 мин. ± дроперидол 2,5-5 мг внутривенно перед операцией ± кеторолак 30 мг внутримышечно за 30 мин. или ± диклофенак 75 мг внутримышечно за 30 мин. Преоксигенация: 100% кислород через маску 2-3 мин Индукция: преиндукция - дополнительная седация/анальгезия: фентанил 1-2 мкг/кг внутривенно ± мидазолам 0,03-0,05 мг/кг внутривенно. Вводная анестезия: тиопентал-натрия 3-5 мг/кг или пропофол 2-2,5 мг/кг или кетамин 1-2 мг/кг или мидазолам 0,2-0,35 мг/кг или подача анестетиков через лицевую маску 35-100% кислород ± 0 - 65% закись азота + севофлюран - болюсная методика: поток свежего газа 4-8 л/мин., 100% О2, севофлюран 6-8% (менее 2 минут, до эффекта); пошаговая методика: поток свежего газа 4-8 л/мин., 100% О2, севофлюран 1% (с последующим увеличением на 1% каждые 4-5 вдохов до максимальной концентрации 6-8 (до эффекта); Поддержание анестезии: подача анестетиков через лицевую или ларингеальную маску 35-100 % кислород ± 0 - 65 % закись азота + севофлюран (суммарно до 1,5 МАК) до эффекта | ||||
| Внутривенная анестезия с сохраненным спонтанным дыханием (не более 1 часа, пациенты I - II ASA) | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Определяется принадлеж-ностью пациента к группе в зависимости от характера оперативного вмешательства | Премедикация: легкая: атропин 0,3-0,6 мг внутримышечно за 30 мин. ± диазепам 5-10 мг внутримышечно или внутрь за 30 мин. умеренная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + фентанил 50-100 мкг внутривенно перед операцией или + тримеперидин 20 мг внутримышечно за 30 мин. усиленная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + тримеперидин 20 мг внутримышечно за 30 мин. или + фентанил 50-100 мкг внутривенно перед операцией или + морфин 0,1 мг/кг внутримышечно за 30 мин. ± дроперидол 2,5-5 мг внутривенно перед операцией ± кеторолак 30 мг внутримышечно за 30 мин. или ± диклофенак 75 мг внутримышечно за 30 мин. Преоксигенация: 100% кислород через маску 2-3 минуты Индукция: преиндукция - дополнительная седация/анальгезия: фентанил 1-2 мкг/кг внутривенно ±мидазолам 0,03-0,05 мг/кг внутривенно Вводная анестезия: тиопентал-натрия 3-5 мг/кг или пропофол 2-2,5 мг/кг или кетамин 1-2 мг/кг внутривенно или мидазолам 0,2-0,35 мг/кг Поддержание анестезии мидазолам 0,05-0,1 мг/кг или пропофол 50-150 мкг/кг/мин. + фентанил 1-5 мкг/кг/час или кетамин 0,5-1мг/кг внутривенно ± дроперидол 0,02-0,04 мг/кг/час | ||||
| Сбалансированная анестезия с ИВЛ | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Премедикация: легкая: атропин 0,3-0,6 мг внутримышечно за 30 мин. ± диазепам 5-10 мг внутримышечно или внутрь за 30 мин. умеренная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + фентанил 50-100 мкг внутривенно перед операцией или + тримеперидин 20 мг внутримышечно за 30 мин. усиленная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + тримеперидин 20 мг внутримышечно за 30 мин. или + фентанил 50-100 мкг внутривенно перед операцией или + морфин 0,1 мг/кг внутримышечно за 30 мин. ± дроперидол 2,5-5 мг внутривенно перед операцией ± кеторолак 30 мг внутримышечно за 30 мин. или ± диклофенак 75 мг внутримышечно за 30 мин. Преоксигенация: 100% кислород через маску 2-3 мин. Индукция: преиндукция - дополнительная седация/анальгезия: фентанил 1-3 мкг/кг внутривенно ±мидазолам 0,03-0,05мг /кг внутривенно Вводная анестезия: тиопентал-натрия 3-5 мг/кг или пропофол 2-2,5 мг/кг или мидазолам 0,2-0,35 мг/кг или кетамин 1-2 мг/кг или 35-100% кислород +0 - 65% закись азота + севофлюран (суммарно до 3 МАК) до эффекта миорелаксант для интубации: сукцинилхолин 1,5 мг/кг или атракурий 0,5-0,6 мг/кг (пациенты не выше 2 баллов по ИТИ) или пипекурониум 0,06-0,08 мг/кг/(пациенты не выше 2 баллов по ИТИ) или рокуроний 0,6 мг/кг (пациенты не выше 2 баллов по ИТИ) или цисатракурий 0,15 мг/кг (пациенты не выше 2 баллов по ИТИ) Поддержание анестезии 35 - 100% кислород +0 - 65% закись азота + изофлуран или севофлюран (суммарно до 1,5 МАК) до эффекта +фентанил 1-10 мкг/кг/час ±дроперидол 0,02-0,05 мг/кг/час поддержание миорелаксации: атракурий 0,1-0,2 мг/кг или пипекурониум 0,01-0,015 мг/кг или рокуроний 0,1-0,2 мг/кг или цисатракурий 0,03 мг/кг Выход из анестезии. Прекратить подачу ингаляционных анестетиков и перейти на 100% кислород. Подача галогеновых анестетиков прекращается при ушивании подкожно-жировой клетчатки, закись азота - при наложении последних швов на кожу. Санация: тщательно санируется трахея и ротовая полость. Уход от миорелаксации (декураризация) по окончании оперативного вмешательства: устранить остаточную мышечную релаксацию (если присутствует сознание и частично восстановлена нейромышечная передача): атропин 0,015 мг/кг внутривенно + неостигмин 0,05% раствор 1-2 мл внутривенно. Экстубация: после восстановления адекватного спонтанного дыхания, сознания, защитных рефлексов и способности пациента выполнять команды. Профилактика тошноты и рвоты: метоклопрамид 10 мг внутривенно, дроперидол 0,625 мг внутривенно, ондансетрон 4 мг внутривенно. | ||||
легкая: атропин 0,3-0,6 мг внутримышечно за 30 мин.
+диазепам 5-10 мг внутримышечно или перорально за 30 мин.
или мидазолам 1-2 мг внутривенно перед операцией
умеренная: атропин 0,3-0,6 мг внутримышечно за 30 мин.
+диазепам 10 мг внутримышечно за 30 мин.
или мидазолам 1-2 мг внутривенно перед операцией
+ фентанил 50-100 мкг внутривенно перед операцией
или + тримеперидин 20 мг внутримышечно за 30 мин.
Методика анестезии.
Катетеризация вены.
Прегидратация 15-20 мл/кг (по показаниям).
В строго асептических условиях пункция субарахноидального пространства ниже L2 - L3.
Однократное введение раствора анестетика ± эпинефрин 5 мкг/мл (1:200000).
Коррекция гипотонии путем постоянной внутривенной инфузии фенилэфрина 0,04-0,18 мг/мин. либо болюсных внутривенных введений фенилэфрина 0,05-0,1 мг.
Адекватный наркоз в нейроанестезиологии. Новые концепции и подходы
Новая концепция анестезиологического обеспечения операций на головном мозге
Клиницистам хорошо известно, что в ходе оперативного вмешательства на головном мозге ярко выделяются этапы операции, которые существенно отличаются по клинико-физиологическим характеристикам состояния больного, а реальное состояние реактивности организма, уровня его защиты от хирургической агрессии далеко не в полной мере отражаются обычными критериями адекватности наркоза (отклонение показателей гемодинамики, некоторых биохимических тестов, уровня гормонов, изменений электроэнцефалограммы и пр.).
Рассмотрим эти обстоятельства. Одним из основных клинических показателей в нейроанестезиологии и интенсивной терапии является внутричерепное давление (ВЧД). Уровень ВЧД определяется взаимодействием нескольких функциональных систем, именно он оказывает существенное влияние на работу этих систем. Та или иная степень внутричерепной гипертензии (ВЧГ) является характерным состоянием для больных с нейрохирургическими заболеваниями головного мозга. Выделяют два основных патологических следствия повышения ВЧД:
а) гипоперфузию мозга за счет снижения перфузионного давления мозга (ПДМ) - разницы между средним артериальным и внутричерепным давлением;
б) различные виды смещения мозга и его ущемления в образованиях твердой мозговой оболочки (ТМО).
При прямом многофакторном воздействии на мозг в ходе внутричерепного хирургического вмешательства возникают своеобразные реакции, обусловленные прямым раздражением вещества мозга. По своей сути они являются рефлекторными, но они имеют принципиальное отличие - ту или иную степень укорочения афферентного звена рефлекторной дуги. Известно, что уже на сегментарном уровне формируется функциональная специфичность, своеобразная "узнаваемость" афферентного сигнала.
От этого в значительной степени зависит физиологическая целесообразность эфферентного ответа, его согласованность с состоянием организма в данной конкретной ситуации. Рефлекторные реакции на раздражение и повреждение в общей хирургии имеют полноценную рефлекторную дугу, поэтому чрезмерные колебания физиологических параметров (чаще регистрируются гемодинамические) отражают уровень реактивности организма и адекватность анестезиологической защиты. В нейроанестезиологии взаимоотношения между раздражением, ответом на него и функциональным состоянием организма далеко не так однозначны. Укорочение афферентной части дуги рефлекса делает эфферентный ответ в той или иной степени обособленным от общей реактивности организма.
Только вызываемые "укороченными рефлексами" отклонения физиологических параметров становятся полноценным афферентным сигналом. Исходя из этого, в нейроанестезиологии реальное состояние реактивности больного отражают скорее не первичные изменения физиологических параметров в ответ на прямое воздействие на мозг, а скорость и направленность коррекции упомянутых отклонений.
Наиболее ярко это проявляется при удалении больших базальных менингиом, опухолей, прилегающих к образованиям дна III желудочка, опухолей области среднего мозга, а также субтенториальных опухолей, интимно связанных со стволом. Но, кроме реакций, четко связанных с хирургическими манипуляциями и определенной анатомической структурой головного мозга (реакции 1-го типа), на наш взгляд, к центральным реакциям (то есть к "укороченным рефлексам") следует отнести стойкие, относительно медленно возникающие изменения параметров системной гемодинамики и электроэнцефалограммы, не связанные непосредственно с действиями хирурга. Как правило, это клинически проявляющаяся артериальная гипертензия и гиперсинхронизация биоэлектрической активности мозга в мед-ленноволновом диапазоне. Наиболее частая причина проявления реакций этого типа - чрезмерная тракция мозга шпателями.
Реакции первого типа в определенной степени позволяют судить об анатомической дозволенности хирургических манипуляций на головном мозге. Реакции второго типа отражают "общее состояние" мозга. Характерно, что реакции обоих типов возникают на фоне глубины наркоза, достаточной для полной защиты больного от ноцицептивных воздействий с обычным афферентным звеном, что легко можно проверить в ходе операции путем дополнительного воздействия на ТМО (отсутствие изменений гемодинамических параметров после такого воздействия является убедительным доказательством адекватности наркоза с общехирургических позиций).
Пренебрежение центрогенными реакциями обоих типов приводит не только к превышению физиологической дозволенности хирургических манипуляций на головном мозге, но и к ухудшению податливости мозга, увеличению его объема и кровоточивости, что ограничивает возможности хирургической операции и повышает риск дополнительных повреждений мозга. Наиболее распространенным направлением профилактики возникновения центрогенных реакций гемодинамики является воздействие на эфферентные механизмы их реализации: использование ганглиоблокаторов, внутривенного введения новокаина и средств, расслабляющих гладкие мышцы сосудов (нитропруссид натрия, нитроглицерин, аденозин и пр.).
Описаны попытки применения искусственного водителя сердечного ритма в ходе удаления опухолей, интимно связанных со стволом головного мозга. Не менее распространенным методом профилактики центрогенных реакций является использование медикаментов, обеспечивающих определенный уровень разобщения телэнцефалических и стволовых структур головного мозга (препараты фенотиазинового ряда). Основным недостатком обоих направлений является существенное ограничение управляемости и длительный выход из наркоза, практически полная невозможность контроля физиологической дозволенности хирургических манипуляций в ходе операции и неврологической оценки в раннем послеоперационном периоде.
Кроме того, попытки изменения реактивности головного мозга на внешние воздействия фармакологическими препаратами, избирательно действующими на различные его структуры, ограничены гетерохимичностью сенсорных систем мозга. Одним из наиболее очевидных проявлений гетерохимичности является сохранность восприятия больным окружающей среды в ходе операции под наркозом, без эмоциональной окраски этого восприятия и без вегетативных признаков неадекватности наркоза. Прямое воздействие на вещество головного мозга вызывают, кроме описанных выше "укороченных рефлексов", и нерегистрируемые обычными методами реакции мозга (неосознанные ощущения), которые также способствуют снижению податливости мозга и увеличению его объема за счет возрастания локального мозгового кровотока. Взаимосвязь между функцией и кровотоком в ЦНС хорошо изучена.
Таким образом, головной мозг в условиях многокомпонентного анестезиологического обеспечения функционирует как орган, формирующий состояние наркоза. При прямом воздействии он генерирует эфферентную информацию ("укороченные рефлексы") и обеспечивает коррекцию отклонений функциональных параметров, вызываемыми этими рефлексами. Если к этому добавить исходное нарушение мозговых функций у нейрохирургических больных, то становится очевидным, что в нейрохирургии применение стандартных критериев адекватности наркоза весьма ограничено, и выбор оптимальной методики анестезиологического обеспечения имеет существенные особенности. Нам представляется, что для оценки адекватности защиты больного в ходе прямого воздействия на головной мозг целесообразно использовать понятие "интенсивность функционирования структуры", то есть количество функций, которое приходится на единицу массы органа. Несомненно, что в ходе хирургической операции на открытом мозге интенсивность его функционирования неизбежно выше, чем при любом ином хирургическом вмешательстве.
Исходя из вышесказанного, в ходе хирургической операции на головном мозге на этапе до рассечения ТМО (декомпрессии мозга) одним из основных критериев адекватности наркоза является возможность реализации системообразующей задачи компенсаторной функциональной системы - поддержания стабильного пер-фузионного давления головного мозга. Опытный анестезиолог всеми доступными средствами пытается осуществить это во время вводного наркоза, восполняя ОЦК, поддерживая сердечный выброс и сосудистый тонус, используя препараты, снижающие ВЧД. Как правило, это требует определенных усилий, так как большинство факторов вводного наркоза (фармакологических, технических) способствуют повышению ВЧД и снижению САД.
На этапе прямого воздействия на мозг основной задачей и критерием адекватности анестезиологического обеспечения становится максимально возможное ограничение формирования "укороченных рефлексов" при сохранной активности структур мозга, обеспечивающих вегетативный гомеостаз организма и жизнеобеспечение участков мозга, подвергающихся прямому воздействию. Желательно быстрое и гармоничное восстановление функций мозга как на любом этапе операции (когда это необходимо), так и в раннем послеоперационном периоде.
Иными словами, возможность реализации системообразующей приспособительной задачи для конкретного этапа операции при ограниченной жизнедеятельности структур, не участвующих в реализации этой задачи, но в то же время при полной сохранности их жизнеобеспечения и возможности быстрого восстановления является важной составляющей понятия "адекватный наркоз" в нейроанестезиологии. Мы отдаем себе отчет в громоздкости и определенной клинико-физиологической неотчетливости приведенной выше фразы. Но это не попытка дать определение понятия, а только уточнение одного из перспективных для клиники направлений исследования.
Использование пептидергической модели передачи информации в ЦНС в клинической нейроанестезиологии и интенсивной терапии
К началу 1980-х годов в РНХИ им. проф. А. Л. Поленова были детально разработаны и широко применялись различные методики "умеренной нейровегетативной блокады" на основе использования фенотиазинов, ганглиоблокаторов и новокаина. Наряду с несомненными достоинствами этих методик проявились и их существенные недостатки, обусловленные в основном фармакологическим разобщением различных структур ЦНС. Стала очевидной необходимость разработки нового методологического подхода к анестезиологическому обеспечению хирургических операций на головном мозге. В основу такого подхода была положена пептидергическая модель передачи информации в ЦНС. Оказалось, что данная модель по сравнению с классической "синаптической концепцией" функционирования головного мозга позволяет глубже и продуктивнее анализировать механизмы развития состояния наркоза.
Количество публикаций, посвященных различным аспектам пептидергической регуляции функций организма, в настоящее время огромно и с трудом поддается анализу. С точки зрения практической нейроанестезиологии, представляются наиболее перспективными некоторые положения:
а) головной мозг обладает эндогенными системами, обеспечивающими при экстремальных воздействиях на организм оптимальный уровень стабилизации вегетативных функций и выключение из функционирования структур мозга (в основном телэнцефалических), не участвующих в реализации этих функций;
б) функциональная система является единицей интегратив-ной деятельности мозга, она обеспечивает реализацию саморегуляции и гомеостаза внутренней среды организма в экстремальных условиях, только в функциональной системе различные функции организма оказываются целесообразно взаимосвязанными; в) нейропептиды способны включать или оказывать модулирующее воздействие не только на отдельную функцию, но и на их комплекс, нейропептид - это созданный эволюцией биохимический пакет программ;
г) каскадные реакции, первично индуцированные каким-то одним пептидом, составляют биохимическую основу для запуска и реализации скоординированного во времени комплекса взаимосвязанных компенсаторных и саногенетических реакций.
В настоящее время нет нейропептидов, доступных для широкого применения в нейроанестезиологии и интенсивной терапии. Однако существует возможность запуска опиоидной и адренергической нейрорегуляторных пептидергических ан-тиноцицептивных систем с помощью препаратов, хорошо изученных и апробированных в клинике, - опиоидных анальгетиков и адреноагонистов центрального действия. Для разработки оптимальных методик нейроанестезиологического обеспечения и нейровегетативной стабилизации больного в процессе интенсивной терапии сотрудниками отделения изучены различные комбинации опиоидных анальгетиков с адреноагонистом центрального действия клофелином (клонидином).
Опыт более трех тысяч наркозов с использованием сочетанного введения опиоидных анальгетиков и адреноагониста центрального действия показал, что в результате у пациентов формируется состояние, обеспечивающее стабильность перфузионного давления мозга на этапе до рассечения ТМО практически без дополнительных усилий. Во время манипуляций на открытом мозге активно функционируют структуры ствола мозга, обеспечивающие саморегуляцию вегетативных функций и гомеостаза внутренней среды организма, в то же время практически отсутствуют центрогенные реакции ("укороченные рефлексы"). Мозг остается податливым и стабильным по объему в течение многочасового оперативного вмешательства. Практически у всех больных происходит быстрое и гармоничное восстановление функций ЦНС непосредственно после окончания операции.
Кроме того, появляется возможность объективизации критериев физиологической дозволенности хирургических манипуляций, так как уровень защиты ограничен функциональными возможностями ствола мозга, и воздействия, превышающие эти возможности, целесообразно рассматривать как чрезмерные. Существенно снижается количество дополнительных препаратов, используемых во время наркоза, что позволяет избежать осложнений, связанных с их введением.
Приведенные выше теоретические предпосылки как для определения адекватности наркоза в нейрохирургии, так и для разработки новых анестезиологических методик нашли достаточно убедительное экспериментальное и клиническое подтверждение. Есть все основания полагать, что пептидергическая модель мозга в ближайшее время станет одной из основных фундаментальных концепций для клинической нейроанестезиологии и интенсивной терапии.
Отделение анестезиологии и реанимации РНХИ им. проф. А.Л. Поленова
Отделение анестезиологии и реанимации было создано в 1962 году по инициативе директора института проф. В.М. Угрюмова. Тогда в структуру отделения входила палата послеоперационного наблюдения и группа анестезиологов. В декабре 1980 года Ученым советом института было принято решение о формировании многоструктурного, соответствующего уровню развития нейрохирургии, отделения анестезиологии и реанимации. Весной 1981 года было открыто отделение реанимации на 12 коек, оснащенное современной аппаратурой, с лабораториями экспресс-диагностики и электрофизиологии. Большой вклад в организацию нового отделения внесли доктор мед. наук В.П. Раевский и канд. мед. наук С.М. Капустин. В 1987 году руководителем отделения анестезиологии-реанимации стал канд. мед. наук (в настоящее время - доктор мед. наук, профессор) А.Н. Кондратьев. Основным направлением научной работы отделения является разработка методических подходов к анестезиологическому обеспечению и интенсивной терапии нейрохирургических больных.
За время работы врачами отделения:
-детально изучен диэнцефально-катаболический синдром, показаны принципиальные отличия его от послеоперационной стресс-реакции;
-разработана оригинальная система анестезиологического обеспечения операций на головном мозге;
- разработана так называемая "умеренная вегетативная блокада";
- проведены исследования по клинико-физиологическим проявлениям различных форм дислокаций головного мозга;
-разработаны рекомендации по интенсивной терапии больных с различными типами течения посттравматической болезни головного мозга;
- в результате совместных исследований с отделением патологии сосудов головного мозга разработан метод профилактики повторного кровотечения из разорвавшейся артериальной аневризмы;
-разработан и внедрен в практику метод сочетанного введения опиоидного анальгетика: и а2-адреноагониста центрального действия при анестезиологическом обеспечении нейрохирургических операций. Основные направления клинической работы: анестезиология, реанимация, электрофизиология, лабораторная диагностика.
Разрабатываются и внедряются в практику современные методы анестезиологического пособия при нейрохирургических операциях. В настоящее время операционные оснащены современной дыхательной и следящей аппаратурой фирмы Siemens, позволяющей проводить анестезиологическое пособие во время много часовых сложнейших оперативных вмешательств, сохраняя высокую степень надежности и безопасности пациента. Анестезиологические бригады при проведении диагностических процедур работают не только на территории института, но и за его пределами. В среднем в течение года проводится 1200 анестезиологических пособий во время операций, манипуляций и диагностических процедур. Ответственная за работу подразделения - ведущий научный сотрудник, доктор мед. наук И.А. Саввина.
Отделение реанимации на 13 коек обеспечивает интенсивную терапию и контроль состояния пациента в послеоперационном периоде, реанимационные мероприятия и интенсивную помощь больным в критическом состоянии. Отделение оснащено дыхательной и следящей аппаратурой фирмы Siemens, позволяющей проводить длительные лечебные наркозы с подбором индивидуального режима вспомогательной или принудительной ИВЛ, тщательно контролируя показатели гемодинамики и дыхания, газовый состав на вдохе и выдохе.
Снизить летальность нейрохирургических больных позволило:
- внедрение оригинальных методик послеоперационного ведения больных в за висимости от локализации и гистоструктуры опухоли;
- широкое применение Triple-H-терапии при ишемии мозга;
- применение антифибринолитической терапии при кровоизлияниях вследствие разрыва аневризм;
- применение ликворосорбции;
- регулярная профилактика и адекватное лечение легочных осложнений.
Одним из новых направлений работы отделения реанимации является реабилитация пациентов, находящихся в вегетативном состоянии вследствие поражения ЦНС различной этиологии. В 2000 году организована реанимационная служба, обеспечивающая наблюдение за больными детьми и их лечение не только в отделении реанимации, но и в детском отделении совместно с лечащими нейрохирургами. Ответственная за работу подразделения -старший научный сотрудник И.М. Ивченко.
Лаборатория электрофизиологии
Реорганизация лаборатории электрофизиологии и переход ее в структуру отделения анестезиологии и реанимации произошли в 1987 году. Регулярно проводится электроэнцефалографический контроль во время нейрохирургических операций и в послеоперационном периоде. Большое внимание уделяется динамическому наблюдению за больными в вегетативном статусе и с постгипоксической энцефалопатией. Лаборатория обеспечивает регистрацию и анализ ЭЭГ, ЭКГ как пациентам, находящимся в отделениях института, так и амбулаторно. Ответственная за работу подразделения - старший научный сотрудник канд. мед. наук Т.Н. Фадеева.
Экспресс-лаборатория
Создана одновременно с отделением анестезиологии и реанимации и работает круглосуточно, выполняя биохимические и клинические исследования крови, мочи, ликвора не только для больных, находящихся в отделении реанимации и в операционной, но и для больных других отделений. Много лет основным научным направлением лаборатории является коагулология. Ответственная за работу подразделения - врач А.С. Алексеева.
Большое внимание в отделении анестезиологии и реанимации уделяется обучению клинических ординаторов и аспирантов.
В течение года врачи из различных больниц Санкт-Петербурга и регионов России проходят стажировку на рабочем месте в отделении анестезиологии и реанимации.
Каудально-эпидуральная блокада как компонент ранней реабилитации в детской онкохирургии
Реферат
Актуальность. Преимуществом лапароскопических вмешательств при злокачественных новообразованиях брюшной полости у детей является уменьшение сроков послеоперационной реабилитации и раннее начало химиотерапии. Несмотря на большой опыт использования каудальной блокады в педиатрии, до сих пор не установлено, дает ли использование ультразвуковой навигации какое-либо клиническое преимущество в выполнении каудальных блокад при лапароскопических операциях в детской онкохирургии.
Цель исследования. Оценить влияние каудальной эпидуральной блокады, выполненной под ультразвуковым контролем, на течение периоперационного периода и частоту послеоперационной тошноты и рвоты при лапароскопических вмешательствах.
Материалы и методы. Обследовано 40 пациентов НИИ Детской онкологии и гематологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, ASA II-III, оперированных в 2017-2019 гг. по поводу опухолей брюшной полости лапароскопическим методом. Все дети были разделены на 2 группы. В первую группу вошли 23 ребенка, которым на фоне сочетанной анестезии применялась каудальная эпидуральная блокада, выполняемая под контролем УЗИ (группа КА, n = 23). В группу контроля вошли 17 детей, которым проводилась общая анестезия (ОА). Проведен анализ интраоперационного и послеоперационного периодов.
Результаты. Суммарная доза фентанила в группе КА составила 7,29 (6-9,25) мкг/кг, а в группе ОА — 10,7 (7,6-12,5) мкг/кг (р = 0,012). В послеоперационном периоде дополнительное обезболивание в группе КА после каудально-эпидурального введения раствора морфина не требовалось в течение 24 ч, а после каудально-эпидурального введения тримеперидина — в течение 12 ч. Энтеральное питание у детей в группе КА подключали с 4,7 ± 0,5 ч. В группе ОА энтеральное питание у 10 (59 %) пациентов подключили через 20 ч после окончания оперативного вмешательства.
Заключение. Каудальная блокада, выполненная под ультразвуковым контролем до начала оперативного вмешательства, обеспечивает эффективную анальгезию в 100 % случаев, как в интра-, так и в послеоперационном периоде длительностью более 12 ч, способствует раннему началу энтерального питания, снижает частоту послеоперационной тошноты и рвоты и не сопровождается развитием осложнений.
Ключевые слова: детская онкология, каудальная блокада, лапароскопические операции, детская анестезиология
Поступила: 18.03.2020
Принята к печати: 02.06.2020
Введение
В последние годы малоинвазивная хирургия стала стандартом при проведении операций у детей, в том числе и в онкохирургии. Преимуществом лапароскопических вмешательств при злокачественных новообразованиях брюшной полости является сокращение времени послеоперационной мобилизации, ранее начало энтерального питания и специального лекарственного лечения (полихимиотерапии) [1].
Технологии Fast Track хирургии («быстрого пути») и ERAS (early rehabilitation after surgery) подразумевают уменьшение длительности лечебного процесса и раннюю реабилитацию после операции. Подбор оптимальных методов анестезии, малоинвазивных способов хирургического вмешательства, эффективного контроля боли и активного послеоперационного восстановления (в том числе ранние энтеральное питание и мобилизация) уменьшают стрессовые реакции и дисфункцию органов, значительно сокращая время полного восстановления [2, 3]. Применение нейроаксиальных методов анестезии и анальгезии под ультразвуковой навигацией способствует раннему восстановлению пациентов и максимально раннему проведению полихимиотерапии [4].
Каудальная эпидуральная блокада является наиболее широко используемой нейроаксиальной блокадой у детей и применяется не только при операциях на нижнем этаже брюшной полости и органах малого таза, но и на верхнем этаже брюшной полости за счет введения вспомогательных веществ (адъювантов), таких как морфин и тримеперидин, которые, обладая гидрофильными свойствами в эпидуральном пространстве, обеспечивают обширную зону периоперационной анальгезии. Применение адъювантов позволяет существенно увеличить зону операционного обезболивания и длительность каудальной эпидуральной блокады. Популярность метода в педиатрической анестезии объясняется главным образом широким спектром показаний, высокими показателями успеха и относительно низкой частотой осложнений [5].
Каудальную эпидуральную анестезию применяют как самостоятельно, так и в комбинации с общей анестезией, при этом регионарная блокада является анальгетическим компонентом сочетанной анестезии. Несмотря на большой опыт использования каудальной блокады у педиатрических пациентов, до сих пор не определено, дает ли использование ультразвуковой навигации какое-либо клиническое преимущество при выполнении каудально-эпидуральных блокад при лапароскопических операциях в детской онкохирургии. Нет однозначного ответа, насколько целесообразно применение нейроаксиальных блокад при лапароскопических вмешательствах.
Цель исследования — оценить влияние каудальной эпидуральной блокады, выполненной под ультразвуковым контролем, на течение периоперационного периода, частоту возникновения послеоперационной тошноты и рвоты при лапароскопических оперативных вмешательствах в детской онкохирургии.
Материалы и методы
Исследование выполнено в рамках научно-исследовательской работы (НИР) НИИ Детской онкологии и гематологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. Название НИР: «Разработка новых методов общей и сочетанной анестезии в детской онкохирургии», регистрационный номер № 01201373435. На каждого пациента имеется информированное согласие от законного представителя на проведение данной методики. Дизайн исследования — проспективное, рандомизированное контролируемое, одноцентовое исследование. Проведен анализ течения интраоперационного и раннего послеоперационного периодов у 40 пациентов с физическим статусом пациентов по классификации ASA (Американского общества анестезиологов) II-III, оперированных в 2017-2019 гг., по поводу злокачественных опухолей брюшной полости лапароскопическим методом в НИИ Детской онкологии и гематологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. Пациенты были разделены на две группы случайным образом.
В группу общей анестезии (ОА) вошли 17 детей, которым проводилась общая анестезия. Распределение детей по полу и возрасту представлено в табл. 1. Индукция общей анестезии проводилась севофлураном (быстрая индукция), далее внутривенно вводился 0,005% раствор фентанила в дозе 0,002-0,005 мг/кг. После введения рокурония бромида 0,6 мг/кг выполняли интубацию трахеи с последующим проведением пневмонпротективной искусственной вентиляции легких (ИВЛ). Поддержание анестезии во всех случаях обеспечивалось севофлураном в минимальной альвеолярной концентрации 1 МАК с внутривенным введением 0,005% раствора фентанила в дозе 0,002 мг/кг. Миоплегия достигалась постоянной внутривенной инфузией рокурония бромида со скоростью 0,2 мг/кг/ч под контролем акселерометрии TOF-Watch SX (MSD).
В группу КА вошли 23 ребенка, у которых в качестве компонента сочетанной анестезии проводили каудальную эпидуральную блокаду, которая выполнялась за 15 мин до разреза. Пациентам группы КА в условиях общей анестезии и ИВЛ (севофлураном 1 МАК) проводили ультразвуковое (УЗ) исследование в латеральной или prone-позиции (у детей старшего возраста) высокочастотным линейным датчиком. Определяли каудально-эпидуральное пространство методом “out of plane” по короткой оси (рис. 1). У детей старшего возраста идентификация каудально-эпидурального пространства проводилась конвексным датчиком. После ротации ультразвукового датчика на 90 градусов между крестцово-копчиковой связкой, крестцовыми рогами и крестцом находили гиперэхогенное пространство — каудально-эпидуральное пространство. Иглу для блокады (30 мм 25G) вводили в плоскости луча сканирования и визуализировали в гиперэхогенном пространстве под очертанием крестцового рога.
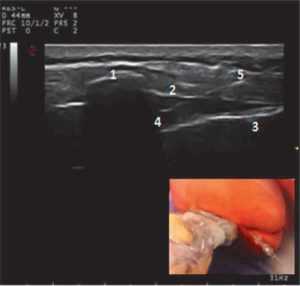
Рис. 1. Ультразвуковое изображение каудально-эпидурального пространства (сагиттальный скан):
1 — крестцовые рога; 2 — крестцово-копчиковая связка (мембрана); 3 — копчик; 4 — каудально-эпидуральное пространство; 5 — игла в проекции сканирования
Fig. 1. Ultrasound image of the caudal-epidural space (sagittal scan)
1 — sacral horns; 2 — sacrococcygeal ligament (membrane); 3 — tailbone; 4 — caudal-epidural space; 5 — a needle in a projection of scanning.
После проведения стандартных тестов — аспирации на отсутствие крови и спинномозговой жидкости — вводили смесь 0,2% раствора ропивакаина в дозе до 1,25 мл/кг и 2% раствор тримеперидина в дозе 0,1 мг/кг для пролонгирования блока и достижения желаемого уровня сенсорной блокады с проведением повторной аспирации. Для обеспечения сакральной блокады объем вводимого местного анестетика (МА) составляет 0,5 мл/кг, люмбосакральной — 0,75 мл/кг, пояснично-грудной — 1,0 мл/кг (анестезия до пупка); с целью обеспечения сенсорной блокады на уровне Th8 и ниже необходим МА в объеме 1,25 мл/кг [5]. В ряде случаев использовали 1% раствор морфина гидрохлорида в дозе 0,05-0,1 мг/кг, растворяемый в 0,9% раствора хлорида натрия. Морфин в качестве адъюванта применяли у 10 (43,5 %) пациентов, а тримеперидин — у 13 (56,5 %) пациентов. При правильном положении канюли пробный болюс визуализировался как смещение заднего отдела спинномозговой оболочки вперед [6, 7]. Процедура считалась успешной при отсутствии гемодинамической реакции в виде увеличения частоты сердечных сокращений (ЧСС) или/и среднего артериального давления (АДср) на 20 % от исходного после начала оперативного вмешательства.
В табл. 1 и табл. 2 представлены характеристика пациентов и продолжительность хирургического вмешательства.
Читайте также:
- Продукты распада урана. Поражающее действие продуктов деления урана
- Спасание тонущих. Спасательные суда и средства на воде
- Складчатый язык. Туберкулез слизистой рта. Опоясывающий лишай.
- Яичниковый стероидогенез. Теория двух клеток
- Интраренальная форма почечной недостаточности. Почечная недостаточность при гломерулонефрите
