Яичниковый стероидогенез. Теория двух клеток - двух гонадотропинов
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Гипогонадотропный гипогонадизм - состояние, обусловленное снижением выроботки гонадотропных гормонов при интактных гонадах.
Транзиторный гипогонадизм - временное состояние, обусловленное снижением продукции гонадотропинов или половых стероидов вследствие воздействия негативных факторов, при устранении которых продукция гормонов восстанавливается.
Стимуляционные пробы с ГтРГ - проводятся с целью стимуляции выброса гонадотропинов
1. Краткая информация
1.1. Определение
Гипогонадизм (Г) - патологическое состояние, обусловленное снижением продукции половых гормонов в яичках у лиц мужского пола и в яичниках у лиц женского пола или резистентностью к половым гормонам органов - мишеней.
Говоря о подростках, гипогонадизмом называют отсутствие появление вторичных половых признаков у девочек после 13 лет, у мальчиков после 14 лет
1.2 Этиология, патогенез
Клиническая картина гипогонадизма вариабельна и зависит от многих факторов: возраста возникновения гипогонадизма, причин, приведших к развитию гипогонадизма, возраста обращения пациента. Диагностика гипогонадизма в детском возрасте затруднена, вследствие физиологически обусловленной низкой продукцией половых гормонов у детей, Исключением являются случаи, где Г сочетается с задержкой роста или другими эндокринными нарушениями.
Гипогонадизм - полиэтиологическое состояние. Оно может обусловлено как врожденными нарушениями, так и приоберетенными причинами ( см.классификацию)
Наиболее частой причиной врожденного гипергонадотропного гипогонадизма, как у мужчин, так и у женщин, являются хромосомные аномалии, приводящие к нарушению закладки гонад и развитию их дисгенезии.
Врожденный гипогонадотропный гипогонадизм обусловлен нарушением закладки, развития гонадотрофов в случае изолированных форм, или двух и более других гормон-продуцирующих клеток аденогипофиза (тиреотрофов, соматотрофов, кортикотрофов, лактотрофов), в случаях выпадение двух и более тропных гормонов. Наиболее частой причиной дефицита всех тропных гормонов является дефект PROP 1 гена. Основной причиной развития приобретенного гипогондотропного гипогонадизма являются оперативные вмешательства на гипоталамо-гипофизарную область, травмы головного мозга, облучение на область гипофиза.
1.3. Эпидемиология
Среди женщин частота встречаемости синдрома Шерешевского-Тернера, обусловленного отсутствием/аномалией Х хромосомы, колеблется от 1:2000 до 1:5000 новорожденных девочек. Среди мужчин, частота синдрома Клайнфельтера, обусловленного наличием дополнительной одной и более Х хромосомы у лиц мужского пола, колеблется от 1:300 до 1:600 новорожденных мальчиков. Другие формы врожденного первичного гипогонадизма, такие как дефекты ферментов, участвующих в биосинтеза стероидных гормонов и резистентность к гонадотропинам встречаются крайне редко. В основном эти формы диагностируются в семьях с близкородственным браком или изолятах, т.к. большинство форм имеет аутосомно-рецессивный характер наследования.
Распространенность врожденных форм гипогонадотропного гипогонадизма колеблется от 1: 8000-10000 новорожденных с изолированными формами, до 1: 4.000-10.000 новорожденных, при сочетанном дефиците других тропных гормонов, в зависимости от популяции. Частота встречаемости гипогонадотропного гипогонадизма среди мужчин в 5 раз выше чем у женщин.
В последние десятилетия, в связи с улучшением качества лечения и прогнозом выживаемости пациентов с онкологическими заболеваниями, отмечается увеличение частоты приобретенных форм как первичного, так и вторичного гипогонадизма среди пациентов с онкологическими заболеваниями в анамнезе. Это обусловлено использованием химиопрепаратов, обладающих токсическим воздействием как на герменативные клетки, так и на клетки гипофиза, применением лучевой терапии на область гонад , головы или тотальным облучением всего тела.
Реже встречается нормогонадотропный гипогонадизм, который характеризуется низкой продукцией половых стероидов при нормальном уровне гонадотропинов. Предполагают, что в его основе лежат смешанные нарушения в репродуктивной системе.
Транзиторный (симптоматический) гипогонадизм.- возникает на фоне тяжелой соматической патологии (при ряде заболеваний эндокринной системы - с. Иценко-Кушинга, тиреотоксикоз, пролактинома, соматотропинома, нервная анорекися и т.д.) , нарушениях функции печени или почек или под действием препаратов (ятрогенный гипогонадизм).
1.4. Кодирование по МКБ-10
Е29.1 - Гипофункция яичек
1.5. Классификация
В зависимости от уровня поражения и время возникновения гипогонадизм разделяют на:
Первичный гипогонадизм (гипергонадотропный) - обусловлен первичным поражением гонад
- Хромосомные аномалии . приводящие к дисгенезии гонад (с.Тернера, с.Клайнфельтера, ХХ дисгенезия гонад, ХУ дисгенезия гонад, различные формы мозаицизма)
- Дефекты ферментов, участвующих в биосинтезе стероидных гормонов: липоидная гиперплазия коры надпочечников, дефект 17-а-гидроксилазы, дефект 17 ?- гидроксистероиддегидрогеназы III типа, дефект 17,20- лиазы
- Резистентность к гонадотропинам: гипоплазия клеток Лейдига ( нечувствительность к лютеинизирующему гормону (ЛГ) у мужчин), нечувствительность к фоликулостимулирующему гормону (ФСГ) у женщин, псевдогипопаратиреоз тип 1А (резистентность к ЛГ, ФСГ , вследствие мутации в гене GNAS)
2. Приоберетенные формы (вследствие повреждения или дисфункции гонад):
- перекрут яичек,
- синдром регрессии яичек,
- анорхизм,
- орхит,
- преждевременное истощение яичников,
- травма,
- операции,
- лучевая терапия,
- химиотерапия,
- аутоиммунные заболевания,
- инфекции, передаваемее половым путем
- прием токсических препаратов ( наркотики, алкоголь и т.д.)
- прием медикаментов, блокирующих биосинтез половых гормонов (блокаторы стероидогенеза, блокаторы ароматазы и т.д.)
Вторичный гипогонадизм (гипогонадотропный)- обусловлен нарушениями гипоталамо-гипофизарной системы, приводящими к снижению секреции гипоталамических и/или гипофизарных гормонов, стимулирующих работу гонад.
- Изолированные формы: с.Кальманна с аносмии/ без аносмии,
- В составе дефицита других гипофизарных гормонов: дефект PROP-1, с.фертильных евнухов, с.Паскуалинни.
При синдромальных патологиях: с.Прадера-Вилли, с. Барде-Бидля, с. Лоренса- Муна, Синдром Рода, Синдром Мэдока
Мозжечковые атаксии с гипогонадизмом
(Атаксия Фридрейха, синдром Маринеско—Шегрена, синдром Луи— Барр, синдром Буше—Нойхаузера, атаксия Холмса, синдром Оливера— МакФарлана)
Гипоплазия надпочечников в сочетании с гипогонадизмом (дефект DAX-1 гена)
2.Приобретенные формы (повреждение гипоталамо-гипофизарной области):
- травма,
- операции,
- лучевая терапия,
- химиотерапия,
- аутоиммунные заболевания,
- прием больших доз или длительное время опиоидов, половых гормонов
- прием психотропных препаратов
Транзиторный (симптоматический) гипогонадизм:
Конституциональная задержка роста и полового развития
Как осложнение, на фоне неблагоприятных эндогенных или экзогенных факторов.
2. Диагностика
2.1.Жалобы и анамнез
Основные жалобы: отсутствия появления вторичных половых признаков у девочек в возрасте старше 13 лет, у мальчиков в возрасте старше 14 лет.
Симптомы гипогонадизма зависят не только от степени недостаточности половых гормонов, но и сроков возникновения их дефицита: внутриутробные, допубертатные и постпубертатные.
В большинстве случаев в допубертатном периоде пациенты женского пола не предъявляют никаких жалоб, пациентов мужского пола может беспокоить недоразвитие наружных половых органов, крипторхизм. С достижением крайнего срока физиологического начала полового созревания пациентов (13 лет у девочек, и 14 лет у мальчиков) беспокоит отсутствие развития вторичных половых признаков: отсутствие или скудное оволосение на лобке, отсутствие развития молочных желез у девочек, отсутствие увеличения объема яичек и наружных половых органов у мальчиков.
Сбор анамнеза при подозрении на гипогонадизм включает: выяснение этнической принадлежности, степени родства родителей, сроков начала полового развития у ближайших родственниках, наличие подобных жалоб у родственников, выяснение особенностей неонатального периода (травмы, крипторхизм, микропенис), текущей или проводимой ранее химиотерапии, лекарственной терапии, перенесенных ранее заболеваниях, сопутствующих эндокринных и системных заболеваниях, хронической патологии печени, почек, органов половой системы, травмах или облучении головы, половых органов, хирургических вмешательствах в гипоталамо-гипофизарной области и в области половых органов.
2.2. Физикальное обследование
Общий осмотр: оценка общего физического состояния, оценка состояния кожи - тургор, дряблость, наличие стрий, пигментаций, наличие стигм дисэмбриогенеза. Проведение антропометрических исследований - измерение роста, пропорций тела (включает измерение длины конечностей, верхнего сегмента, размаха рук). Оценка степени развития подкожно-жировой клетчатки, характер распределения, оценка развития мышечной массы. Оценка полового созревания производится по шкале Таннер (таблица 1).
Яичниковый стероидогенез. Теория двух клеток - двух гонадотропинов
Для цитирования: Индукция суперовуляции в программах вспомогательных репродуктивных технологий у женщин старшего репродуктивного возраста. Влияние экзогенного лютеинизирующего гормона на результативность программ вспомогательных репродуктивных технологий. РМЖ. Мать и дитя. 2015;23(14):821.
Клинические особенности пациенток старшей возрастной группы
В репродуктивной медицине к пациенткам старшего репродуктивного возраста принято относить женщин старше 35 лет. Каждый год Европейская ассоциация репродукции человека и эмбриологии (ESHRE) и Российская ассоциация репродукции человека (РАРЧ) публикуют свои отчеты по количеству проведенных программ вспомогательных репродуктивных технологий (ВРТ), показателям наступления беременности и другим по различным странам и регионам в соответствии с принятым ESHRE делением по возрастам — до 34, 35-39 и более 40 лет. В нашей стране, согласно отчетам РАРЧ за , число пациенток старшего репродуктивного возраста, участвовавших в программах ВРТ, колеблется: в стандартной программе экстракорпорального оплодотворения (ЭКО) — в интервале от 31,6 до 42,9%; в программах с использованием метода интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ) — от 40,4 до 45,9% [1].
Как видно из приведенных данных, доля пациенток старшего и позднего репродуктивного возраста в программах ЭКО/ИКСИ составляет более 1/3 [1], при этом половина из них — женщины старше 40 лет [1, 2]. Они составляют значительную часть пациенток с неэффективными исходами программ ВРТ. В старшей возрастной группе показатели наступления беременности достоверно ниже, чем у женщин моложе 35 лет, а также у женщин с хорошим ответом яичников [1-3, 6]. У этой категории отмечаются уменьшение способности к зачатию в расчете на один менструальный цикл (МЦ), снижение эффективности программ ВРТ. Частота рождения живого ребенка у пациенток с субоптимальным ответом на стимуляцию суперовуляции ниже, чем у больных с хорошим ответом [7, 8]. Деление по возрастам пациенток с бесплодием в программах ВРТ имеет свои обоснования в связи с постепенной утратой женщинами фолликулярного (овариального) резерва.
Фолликулярный резерв отражает способность яичников отвечать на стимуляцию ростом фолликулов, содержащих яйцеклетки. В процессе старения репродуктивный потенциал женщины снижается как за счет истощения запаса фолликулов в яичниках, так и ухудшения качества яйцеклеток. С момента рождения у девочки в результате запрограммированного апоптоза начинается массовая атрезия фолликулов, заложенных в яичниках во внутриутробном периоде, которая продолжается вплоть до наступления менопаузы. Пик потери фолликулярного резерва приходится на возраст 37-38 лет с известными колебаниями. Таким образом, происходит возрастное снижение фолликулярного резерва. Существуют многочисленные исследования, посвященные изучению различных показателей для оценки фолликулярного резерва и прогнозирования ответа яичников на стимуляцию: возраст, длительность МЦ, количество антральных фолликулов, объем яичников, уровень в крови фолликулостимулирующего гормона (ФСГ), ингибина В, тестостерона 12.
В практической деятельности фолликулярный резерв оценивается прежде всего по эхографическим данным: количеству антральных фолликулов в яичниках и биохимическому показателю — уровню антимюллерова гормона (АМГ) в периферической крови. Считается, что АМГ может быть лучшим предиктором овариального ответа, чем такие показатели, как возраст, уровень ФСГ, эстрадиол, ингибин [4, 9, 10].
Безусловно, врач должен учитывать возраст и анамнез пациентки: наличие операций на яичниках и матке, исходы предыдущих программ ВРТ, еще до осмотра пациентки врача должны насторожить сведения об укорочении МЦ на 2-3 дня в течение последних нескольких месяцев. Пороговое значение уровня АМГ, по которому можно прогнозировать нормальный ответ на стимуляцию (>4 фолликулов) с результативностью 98%, — 1,26 нг/мл.
Хороший и «бедный» ответы яичников
Выделяют пациенток с хорошим, нормальным и так называемым «бедным», или плохим, ответом яичников на стимуляцию суперовуляции в циклах ЭКО. Хорошим ответом принято считать образование 5 и более преовуляторных фолликулов на введение стандартных доз ФСГ и агонистов без необходимости повышения дозы гонадотропинов. Для нормального овариального резерва характерны уровни ФСГ не более 10 МЕ/л, ингибина В — не менее 40 пг/мл, АМГ — не менее 1,0 нг/мл, число антральных фолликулов в яичниках — 4-5. «Бедный» (низкий, плохой) ответ — это недостаточная или субоптимальная реакция яичников на введение больших доз (более 300 МЕ/сут) гонадотропинов при стимуляции суперовуляции, при которой не удается обеспечить рост и созревание более 3 фолликулов. Такую реакцию яичников на индукторы овуляции в англоязычной литературе принято обозначать термином «бедный» («poor»), или «низкий» («low»), ответ.
Женщин, имеющих «бедный» ответ яичников, называют poor responder, в русскоязычной профессиональной среде таких пациенток часто называют «бедные ответчики».
По различным оценкам, число женщин с «бедным» ответом на введение препаратов ФСГ составляет около 10-30% [1, 2, 4, 13]. Большинство пациенток poor responder — это женщины старшей возрастной группы.
По данным et al. [13], у 15% пациенток отмечается плохой ответ яичников, характеризующийся ростом менее 5 фолликулов, несмотря на повышение суточной дозы ФСГ до 450 МЕ, еще у 15% женщин отмечается рост более 5 фолликулов, но при этом требуется усиленная и более длительная стимуляция ФСГ для продолжения и завершения роста фолликулов. Таких пациенток авторы выделяют в отдельную группу — медленного ответа на введение ФСГ — «гипоответчиков» [13, 14].
Следует отметить, что у женщин с «бедным» ответом образуется повышенное число анеуплоидных эмбрионов по сравнению с пациентками с нормальным ответом того же возраста; часто встречающиеся анеуплоидии — моносомии и трисомии — указывают на старение яичников [15].
Другими признаками снижения овариального резерва являются уменьшение числа антральных фолликулов и объема яичников, повышение уровня ФСГ, снижение значений ингибина В. К числу пациенток poor responder относятся также женщины с операциями на яичниках и матке. Удаление даже небольших миоматозных узлов, эмболизация маточных артерий по поводу миомы матки, тубэктомии очень часто приводят к снижению фолликулярного резерва яичников.
В силу разнообразных причин (медицинских, социальных) число женщин старшего репродуктивного возраста, особенно в крупных городах, обращающихся в репродуктивные клиники для лечения бесплодия, растет.
Практическим врачам, которые являются своеобразным фильтром для направления пациенток старшей возрастной группы с бесплодием в клинику репродукции, необходимо помнить, что реализация репродуктивной функции женщины ограничена ее фолликулярным резервом. Успех лечения бесплодия во многом определяется способностью яичников отвечать на стимуляцию суперовуляции и, в немалой степени, — грамотной и конструктивной позицией амбулаторной сети.
Согласно теории клеток — гонадотропинов (интегральное взаимодействие лютеинизирующего гормона (ЛГ) и ФСГ в обеспечении оптимального роста фолликула и овуляции), ФСГ вызывает образование антрального фолликула и рост фолликулов, а ЛГ имеет важное значение для преантральной стадии, стимулирует продукцию андрогенов клетками теки фолликулов [16]. Действие ФСГ на гранулезные клетки осуществляется посредством связывания с рецептором ФСГ. Далее, под влиянием стимуляции ФСГ, андрогены преобразуются в эстрогены в гранулезных клетках фолликулов. Приблизительно на день МЦ гранулезные клетки под воздействием ФСГ индуцируют выработку . ЛГ играет критически важную роль в регуляции заключительной стадии созревания яйцеклетки. Таким образом, синергизм между ФСГ и ЛГ необходим для стероидогенеза в яичниках и последующего развития фолликула, овуляции и лютеинизации лидирующего фолликула [17].
Генетический полиморфизм. Роль ЛГ
Реакция яичников на стимуляцию зависит не только от возраста, но и от генетических факторов. Для понимания особенностей ответа яичников на введение гонадотропинов необходимо знание о полиморфизме рецепторов генов ФСГ и ЛГ [18, 19]. ЛГ и ФСГ являются гетеродимерами, состоящими из субъединиц — α и β. Cубъединица α идентична у ЛГ и ФСГ, а β-субъединица определяет специфичность действия каждого из гормонов. Активность гормона проявляется при объединении субъединиц в димер. Рецепторы этих гормонов располагаются в мембранах и по структуре весьма схожи.
Наибольшее количество мутаций, влияющих на функцию гонад, выявлено в генах рецепторов ЛГ и ФСГ. В генах, кодирующих ФСГ и его рецептор, обнаружено несколько мутаций. Более медленный ответ на стимуляцию ФСГ [18] отмечается у пациенток с полиморфизмом гена рецептора к ФСГ. Для гена β-субъединицы ЛГ тоже характерен полиморфизм. Кроме нормального гена обнаружены еще 2 аллельных варианта, наиболее частым вариантом является v-β-ЛГ. В различных этнических группах v-β-ЛГ встречается с различной частотой — от 0 до 52%: к примеру, в Италии — в 12-13%, в Китае — в 14% случаев; считается, что в нормальной популяции встречаемость данного гена составляет около 1% [20]. Короткодействующий вариант v-β-ЛГ обладает меньшей биологической активностью.
С. Alviggi et al. [10] показали, что v-β-ЛГ чаще выявляют у женщин с повышенным потреблением экзогенного рекомбинантного человеческого ФСГ (рФСГ) в программах ВРТ во время стимуляции яичников и небольшим числом полученных яйцеклеток по сравнению с женщинами с нормальным потреблением и ответом на рФСГ. Авторы считают, что субоптимальный ответ яичников на рФСГ можно объяснить меньшей биологической активностью ЛГ [10].
Добавление ЛГ при проведении протоколов овариальной стимуляции
Совершенствование протоколов контролируемой овариальной стимуляции (КОС), особенно с учетом гетерогенности характеристик пациенток, всегда было объектом пристального внимания исследователей. Для улучшения исходов ВРТ у пациенток с «бедным» ответом проводились многочисленные исследования [2-5, 6, 8, 13, 14]. Хотя эффективность монотерапии рчФСГ при использовании ВРТ доказана, опубликованные результаты клинических исследований свидетельствуют о преимуществах дополнительного назначения рекомбинантного ЛГ (рЛГ) пациенткам с недостаточной эффективностью терапии рФСГ 25.
Стимуляция только препаратами ФСГ у «бедных ответчиц» приводит к росту небольшого числа фолликулов, недостаточному развитию эндометрия, низкой частоте имплантации и клинической беременности. По данным et al. [13], около 30% пациенток имеют недостаточный ответ на индукцию суперовуляции препаратами ФСГ в длинных протоколах с применением агонистов. Сниженный ответ на ФСГ может быть связан с ятрогенным дефицитом ЛГ, вызванным применением агонистов. Для того чтобы добиться полноценного роста фолликулов у пациенток с «бедным» ответом, как правило, используются более 3000-3500 МЕ ФСГ на цикл. Повышенные дозы ФСГ у таких пациенток обеспечивают достаточную зрелость фолликулов и позволяют получить необходимое число яйцеклеток, готовых к оплодотворению.
et al. [13] выдвинули гипотезу, которая заключается в том, что потребность в повышенных дозах ФСГ служит индивидуальным биологическим маркером, косвенным, но высокоспецифичным, дефицита ЛГ, который нельзя выявить путем измерения уровня ЛГ в крови. Эта гипотеза поддерживается исследованием Р. Humaidan et al. [28]. Авторы показали, что назначение экзогенного ЛГ эффективно у женщин с сывороточной концентрацией ЛГ >1,99 МЕ/л на день КОС, следовательно, наличие менее биоактивного ЛГ может вызывать повышение сывороточных концентраций гормона [27, 28]. Резистентность яичников клинически может проявляться в виде медленного или «бедного» ответа на контролируемую препаратами ФСГ стимуляцию яичников, которая часто встречается у женщин старшего репродуктивного возраста. Добавление экзогенного ЛГ в ходе КОС при нормогонадотропном бесплодии при ЭКО является дискуссионным с момента появления ВРТ. Главный вопрос связан с необходимостью добавления экзогенного ЛГ на уровне финального созревания ооцитов для завершения фолликулогенеза и подготовки эндометрия к имплантации. Интерес к терапии ЛГ объясняется тем, что в современных протоколах стимуляции концентрация эндогенного ЛГ ниже, чем в естественном МЦ. Применение аналогов гонадотропин (ГнРГ), как агонистов, так и антагонистов, вызывает временное, иногда значительное снижение уровня сывороточного ЛГ. У некоторых пациенток содержание эндогенного ЛГ временно становится даже ниже уровня, чем у женщин с гипогонадотропным гипогонадизмом [28, 30-34].
Можно считать доказанным, что добавление ЛГ может повысить чувствительность яичников к ФСГ, индуцировать секрецию эстрадиола преовуляторным фолликулом, улучшая тем самым рост эндометрия; защитить клетки кумулюса от апоптоза, обеспечить ранние этапы оплодотворения, стимулировать позднюю лютеинизацию фолликула и выработку достаточного количества прогестерона. Совершенно бесспорным является назначение препаратов при гипогонадотропном состоянии пациентки [24].
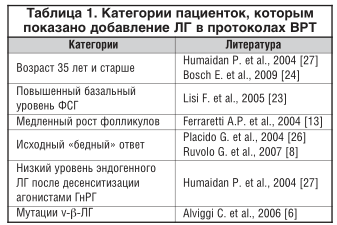
В результате многочисленных исследований были определены другие категории пациенток, нуждающихся в добавлении экзогенного ЛГ в программах ВРТ: старшего репродуктивного возраста, с повышенным базальным уровнем ФСГ, медленным ростом фолликулов, низким овариальным резервом, генетическим полиморфизмом ЛГ (табл. 1).
Поскольку мочевые гонадотропины также содержат в своем составе ЛГ, возникает вопрос относительно выбора гонадотропных препаратов между мочевыми и рекомбинантными для стимуляции суперовуляции в программах ВРТ у пациенток с «бедным» ответом.
В различных исследованиях проводился сравнительный анализ применения мочевых и рекомбинантных гонадотропинов (табл. 2).
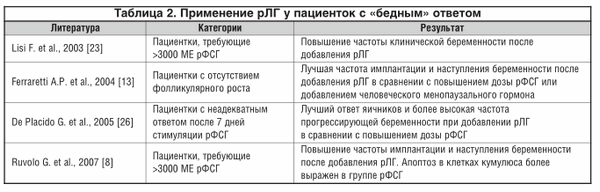
Результаты систематического обзора и метаанализа et al. [34] данных о применении экзогенного рЛГ в программах ВРТ у женщин старшего репродуктивного возраста показали, что добавление рЛГ у этой категории женщин может повышать частоту имплантации и клинической беременности.
Применение перговериса в программах ВРТ
Перговерис — первый препарат, содержащий комбинацию рФСГ и рЛГ, появился в 2007 г. как итог многочисленных лабораторных и клинических исследований, направленных на повышение результативности программ ВРТ у определенных категорий пациенток. Рекомбинантные фоллитропин-α (рФСГ) и лутропин-α 75 (рЛГ) содержатся в препарате в соотношении 2:1 (150 МЕ: 75 МЕ). Исследования биоэквивалентности подтвердили, что фармакокинетические характеристики фоллитропина-α и лутропина-α, вводимые в комбинации, сохраняют те же свойства, что и по отдельности [36]. Оба активных вещества находятся в одной ампуле, не требуют раздельного дозирования и смешивания с растворителем и применяются в виде одной подкожной инъекции. В этом отношении перговерис вполне удобен и эргономичен для пациенток (RESOLVE) [35].
В настоящее время имеется достаточно данных об эффективности и безопасности комбинации рФСГ и рЛГ в соотношении 2:1 в препарате перговерис. Эта комбинация является оптимальной для применения в клинической практике. В 1997 г. Европейской группой по изучению рЛГ проведено базовое исследование по подбору доз, и подтверждена наиболее высокая эффективность стимуляции овуляции при соотношении гонадотропинов ФСГ и ЛГ 2:1 [37]. Исследователи показали, что ежедневное введение 75 ME рЛГ и 150 ME рФСГ эффективно у большинства женщин и обеспечивает оптимальный рост фолликулов и максимальный рост эндометрия. Небольшой части пациенток может потребоваться доза до 225 МЕ/сут, но даже в этой дозе рЛГ не оказывал иммуногенного действия и хорошо переносился [37]. Рекомендуемый режим лечения начинается с назначения 300 ME рФСГ 1 р./сут в течение 5-7 дней. Начиная с дня овариальной стимуляции вместо рФСГ начинают введение ампул препарата перговерис (300 ME рФСГ и 150 ME рЛГ). Возможно назначение ампул перговериса (300 ME рФСГ и 150 ME рЛГ) в 1 сут начиная с первого дня КОС, следующей за десенситизацией гипофиза.
Лечение продолжается до необходимого уровня развития фолликула, определяемого по концентрации эстрогенов в сыворотке крови и результатам УЗИ. При увеличении дозы рФСГ следует иметь в виду, что его суточная доза не должна превышать 450 ME.
В в 29 немецких медицинских центрах ВРТ проводилось наиболее крупное многоцентровое наблюдательное исследование по применению перговериса, 58,7% участниц исследования были старше 35 лет. В этом исследовании частота наступления клинической беременности в расчете на перенос эмбрионов составила 27,5%. В в Испании проводилось другое многоцентровое проспективное наблюдательное исследование, включавшее 19 центров ВРТ с участием пациенток с «бедным» ответом яичников. У всех пациенток стартовая доза перговериса была 300 рФСГ и 150 рЛГ. Частота клинической беременности составила 33,2% в расчете на перенос эмбрионов.
В этих исследованиях была показана достаточно высокая частота наступления клинической беременности у пациенток с субоптимальным ответом яичников на стимуляцию овуляции. K. Buler et al. провели сравнительное исследование эффективности терапии комбинированного применения рФСГ и рЛГ с мочевыми гонадотропинами, имеющими в длинных протоколах с агонистами. Показано, что потребление ФСГ в группе комбинации рФСГ и рЛГ в фиксированном соотношении 2:1 оказалось значительно ниже, а число беременностей на цикл и на перенос, частота имплантации были достоверно и значительно выше, чем в группе мочевых гонадотропинов, имеющих . Чтобы выяснить, наблюдается ли этот эффект в протоколах как с агонистами, так и антагонистами ГнРГ, требуются дополнительные исследования.
Таким образом, можно сделать вывод, что у всех пациенток, которым необходимо экзогенное введение ЛГ, наблюдается положительный эффект, у пациенток старше 35 лет. Применение перговериса для индукции суперовуляции в программах ВРТ у пациенток старше 35 лет с «бедным» ответом и/или низким уровнем ЛГ является высокоэффективным методом лечения бесплодия.
Механизм регуляции функции яичника в норме и при гипоталамо-гипофизарной дисфункции.
Симптом бесплодия есть проявление истощения компенсаторных возможностей тех или иных звеньев системы регуляции репродукции. В 50 - 70% случае бесплодие определяется состоянием жены, в 20 - 25% случаев - состоянием мужа. В 10 - 30% случаев встречаются смешанные формы, а в 2 - 5% случаев причина бесплодия не ясна (2). В структуре женского бесплодия эндокринные нарушения встречаются в 35 - 40% случаев, нарушения функции маточных труб - в 30 - 40% случаев, маточные факторы - в 10%, шеечные - в 7 - 10% случаев, влагалищные - в 6%, экстрагенитальные - в 1%, психические - в 1% случаев. Такие или сходные данные приводятся в большинстве руководств по гинекологии (10).
Основой репродуктивной системы женщины является ось гипоталамус - гипофиз - яичник, правильное функционирование которой обеспечивает созревание полноценной яйцеклетки, адекватную подготовку эндометрия к беременности, трубный транспорт гамет, оплодотворение, имплантацию и сохранение ранней беременности.
Высшим органом регуляции гипоталамо-гипофизарно-яичниковой оси является центральная нервная система, путем целого комплекса прямых и обратных связей обеспечивающая стабильность работы системы репродукции при изменении внутренней и внешней среды (14, 21). К настоящему времени открыто более 36 пептидов, регулирующих секрецию Гн-РГ (28). На основании того, что все основные нейроэндокринные круги прямо или косвенно связаны с иммунной системой и кроме эндокринных центров связывают участки мозга с лимфоидной тканью, в настоящее время некоторые исследователи говорят не о нейроэндокринной, а о нейро-иммунно-эндокринной системе регуляции репродукции (30, 33).
Рилизинг-фактором двух главных гонадотропинов, ЛГ и ФСГ, является Гн-РГ, декапептид, синтезированный Schally и Guillemin в 1977 году. Гн-РГ синтезируется в аркуатном ядре медиобазального гипоталамуса и поступает в систему воротного кровотока гипофиза в импульсном режиме. Для обеспечения нормальной секреции гонадотропинов достаточно поддержания стабильной частоты выброса физиологических количеств Гн-РГ. Изменение частоты выброса Гн-РГ меняет не только количество ЛГ и ФСГ, выделяемых гипофизом, но и их соотношение, в то время как даже десятикратное повышение концентрации Гн-РГ ведет только к небольшому снижению выделения ФСГ и никак не меняет секреции ЛГ.
Частота выброса Гн-РГ у человека составляет 1 выброс в 70 - 90 минут и соответствует целому ряду биоритмов (чередованию фаз сна, колебанию скорости клубочковой фильтрации и желудочной секреции, частоте приливов во время климакса и т.д., что подтверждает гипотезу Kleitmann о существовании общего ритма с периодичностью около 90 минут, имеющего связь с базальным циклом покоя - активности (20), который объясняется геофизическими причинами (22, 37). Основными факторами, регулирующими частоту выделения Гн-РГ являются опиаты и альфа-адреноблокаторы (6, 12, 13). Пульсовой генератор ритма - аркуатное ядро - не нуждается для поддержания своей нормальной работы ни в каких влияниях со стороны других отделов нервной системы (1). В физиологических условиях пульсовой генератор получает информацию о выделении гонадотропинов гипофизом по системе короткой обратной связи, так как специальные сфинктеры регулируют градиенты давлений в воротной системе кровотока, и часть крови из гипофиза поступает не в кавернозный синус, а обратно в гипоталамус, что обеспечивает очень высокую местную концентрацию гормонов гипофиза в гипоталамусе (31). Синтез и секреция ЛГ и ФСГ в гипофизе осуществляются одними и теми же клетками (7). На поверхности гонадотропов имеются рецепторы к Гн-РГ, плотность которых зависит от уровня стероидных гормонов в крови и от концентрации Гн-РГ. Соединение Гн-РГ с рецептором вызывает массивное поступление ионов кальция внутрь клетки, что через несколько минут ведет к выбросу запаса ЛГ и ФСГ в кровоток. Кроме того, Гн-РГ вызывает стимуляцию синтеза ЛГ и ФСГ и поддерживает целостность гонадотропов (40). Изменения частоты пульсового генератора меняет соотношение ЛГ и ФСГ, выделяемых гипофизом (24). Так, повышение ритма ведет к значительному повышению выброса ФСГ и к снижению выброса ЛГ. Частотная модуляция информации обеспечивает быстроту и надежность регуляции репродуктивной системы и ее устойчивость к помехам (4, 36). В лютеиновую фазу прогестерон через эндогенные опиаты урежает частоту пульсового генератора, причем данное действие определяется не концентрацией прогестерона, а длительностью его воздействия. Эстрадиол, действуя на гипоталамус и на гонадотропы (увеличение плотности рецепторов Гн-РГ), повышает амплитуду волны ЛГ /ФСГ (16, 39).
Прогестерон стимулирует образование в гипоталамусе ингибитора, устраняющего данное влияние эстрадиола (29, 35). Таким образом исключается возможность пика ЛГ в лютеиновую фазу, что могло бы нарушить созревание когорты фолликулов для следующего менструального цикла (11).
Гонадотропины являются главными регуляторами синтеза и секреции половых стероидов. Местом выработки половых стероидов в организме могут быть фолликулярный комплекс (тека интерна, тека экстерна, гранулеза и ооцит), желтое тело и строма яичника. Полноценность циклических изменений, обеспечивающих подготовку организма женщины к беременности, определяется качеством селекции и созревания доминантного фолликула. Основные закономерности фолликулогенеза были установлены рабочей группой профессора Ходжена на рубеже 1970-х и 1980-х годов (11). Ими были предложены термины рекрутирование, когорта, селекция, установление доминантности. Рекрутированием назван процесс перехода фолликулов из примордиальной стадии в антральную, так как только с этого времени процесс созревания становится зависимым от действия гонадотропинов. Процесс рекрутирования определяется внутрияичниковыми факторами и происходит постоянно, но образовать когорту - группу фолликулов, из которой выделится доминантный - смогут только те фолликулы, которые рекрутируются в последние 4 дня лютеиновой фазы предыдущего цикла (39). Число рекрутируемых фолликулов определяется скорее всего уровнем гонадотропинов в позднюю лютеиновую фазу и локальной концентрацией прогестерона в яичнике, что объясняет чередование овуляции в правом и в левом яичниках. Рост когорты фолликулов в раннюю фолликулярную фазу объясняется благоприятными условиями соотношения ЛГ и ФСГ и локальных концентраций эстрогенов и андрогенов. Действие ЛГ и ФСГ на фолликул строго специализировано: ЛГ стимулирует процесс синтеза андрогенов de novo клетками теки и практически не действует на клетки гранулезы, а ФСГ активирует ароматазную систему гранулезы, превращающую синтезированные в теке андрогены в эстрадиол (15).
Эстрогены и ФСГ тормозят атрезию преантрального фолликула и стимулируют пролиферацию клеток гранулезы, синтез рецепторов к ФСГ и индукцию рецепторов к ЛГ, начинающуюся на периферии фолликула и идущую к центру. Появление рецепторов к ЛГ в клетках гранулезы больших фолликулов является предпосылкой для синтеза прогестерона желтым телом. ЛГ через стимуляцию андрогенного синтеза ограничивает и уменьшает синтез рецепторов к ФСГ, ЛГ, эстрадиолу в клетках фолликула. Синергизм действия ЛГ и ФСГ в раннюю фолликулярную фазу вызывает значительное усиление секреции эстрогенов яичником. Это в свою очередь индуцирует повышение индекса ЛГ/ФСГ, что смещает синтез половых стероидов в фолликулах в сторону преимущественного образования андрогенов. При нормальном развитии событий к 8 дню менструального цикла заканчивается селекция доминантного фолликула, главным свойством которого является способность усиливать эстрогенную продукцию в условиях дефицита ФСГ и полностью подавлять развитие других фолликулов когорты с помощью внутрияичниковых и гипоталамо-гипофизарных связей (8, 11, 18, 42). Если по какой-либо причине доминантный фолликул гибнет, должен вновь произойти рекрутский набор, так как ни один другой фолликул данной когорты не сможет принять на себя роль доминантного. Важную роль в процессе подавления других фолликулов играет полипептидный регулятор ингибин, избирательно подавляющий секрецию ФСГ, и фолликул-регулирующий протеин, избирательно подавляющий ароматазную активность гранулезы.
На 12 - 14 день цикла доминантный фолликул отвечает почти за всю продукцию эстрадиола в больших количествах, что вызывает пик ЛГ и ФСГ, являющийся причиной овуляции.
Важное значение для нормальной работы желтого тела имеет пик ФСГ в середине цикла, обеспечивающий индукцию синтеза рецепторов к ЛГ в клетках гранулезы преовуляторного фолликула.
У здоровых женщин правильное развитие доминантного фолликула вызывает:
- адекватную продукцию эстрадиола, обеспечивающую созревание эндометрия и накопление в его эпителии рецепторов к прогестерону и созревание шеечной слизи;
- полноценную овуляцию;
- подготовку рецепторов к ЛГ в гранулезе, долженствующей превратиться в желтое тело.
Таким образом, качество лютеиновой фазы определяется прежде всего процессами, происходящими в первую фазу цикла. По классификации ВОЗ 1976 года все нарушения эндокринной функции яичников делятся на 7 больших групп:
- гипогонадотропная нормопролактинемическая недостаточность;
- нормогонадотропная нормопролактинемическая недостаточность;
- гипергонадотропная недостаточность;
- анатомическая форма аменореи;
- гиперпролактинемии;
- гиперпролактинемии;
- объемные процессы в гипоталамо-гипофизарной области, не меняющие секрецию пролактина (5).
Подавляющее большинство больных с нарушением функции яичников, обращающихся по поводу бесплодия, относятся ко 2-й группе нарушений по классификации ВОЗ - эугонадотропной гипоталамо-гипофизарной дисфункции. Клинически в данной группе можно выделить подгруппу 2а - больные со спонтанными менструальными циклами - и подгруппу 2б - больные с аменореей. Для больных подгруппы 2а характерны недостаточность лютеиновой фазы вследствие нарушения созревания доминантного фолликула, нарушения овуляции и нарушения функции желтого тела, а также ановуляторные менструальные циклы, отличающиеся тем, что доминантный фолликул созревает, но не овулирует, в период атрезии доминантного фолликула происходит лютеинизация гранулезы и теки, сопровождающиеся резко сниженной продукцией прогестерона. Базальная температура при этом или не повышается, или повышается незначительно.
Недостаточность лютеиновой фазы, ановуляция и аменорея как правило являются выражением степени эндокринных нарушений и часто выступают как стадии одной процесса (34).
Типичным выражением яичниковой недостаточности 2-го типа является повышение отношения ЛГ/ФСГ, сопровождается небольшой (в сравнении с гормон-продуцирующими опухолями) надпочечниковой и /или яичниковой гиперсекрецией андрогенов (5). Традиционно такие формы гипоталамо-гипофизарно-яичниковой дисфункции относили к синдрому поликистозных яичников. Однако данный термин оспаривается рядом авторов. С одной стороны, увеличение яичников может иметь место при синдроме Кушинга, андрено-генитальном синдроме, при гормон-продуцирующих опухолях, а иногда - у здоровых подростков. С другой стороны, у женщин с типичными проявлениями данного синдрома могут быть яичники нормальных размеров. Кроме того, при данном синдроме анатомические изменения яичников являются только следствием нарушенных гормональных взаимодействий в организме.
Поэтому предлагается называть данный вид патологии синдромом гиперандрогении с хронической ановуляцией (19). Со стороны гормональных изменений самыми характерными признаками являются значение отношения ЛГ/ФСГ больше 2 и повышение уровня андрогенов (тестостерона, андростендиона и ДГЭА-С) в периферической крови (17).
По сравнению со здоровыми женщинами, у которых главным эстрогеном в циркулирующей крови является эстрадиол, у женщин с синдромом гиперандрогении значительно повышен уровень эстрона, который может превышать концентрацию эстрадиола. Главным источником повышения уровня эстрона у таких больных является периферическая ароматизация андростендиона. Постоянная и монотонная продукция эстрона сенсибилизирует гипофиз к действию Гн-РГ, следствием чего является повышение отношения ЛГ/ФСГ, секретируемых гипофизом. В свою очередь, высокий уровень ЛГ ведет к чрезмерной стимуляции стромы яичника и теки, результатом чего является чрезмерная продукция андрогенов. В этих условиях резко нарушаются как процесс селекции доминантного фолликула, так и его полноценность, что ведет к опсоменорее, ановуляции, недостаточности лютеиновой фазы и к аменорее (9, 27).
Гипоталамо-гипофизарная дисфункция при II типе яичниковой недостаточности является чисто функциональным нарушением, при котором нарушается положительная обратная связь. Этиология синдрома гиперандрогении с хронической ановуляцией до сих пор не известна. Доказано, что важную роль в развитии синдрома играют наследственность, центральные нарушения катехоламинов, психический стресс и ожирение (32).
Важную роль в развитии заболевания придают дисфункции коры надпочечников. У значительной части больных надпочечники очень чувствительны к стимуляции АКТГ. В связи с этим высказана гипотеза о секреции гипофизом специфического гормона, стимулирующего андрогены коры надпочечников с молекулярным весом около 60 000 (32). Часть больных является гетерозиготными носительницами дефекта С-21-гидроксилазы (38).
Кроме того, повышенную продукцию андрогенов клетками теки может вызвать и повышенный уровень инсулина за счет перекрытия специфичности инсулина и локальных факторов роста (3). Следовательно, гирсутизм и гиперандрогения могут быть проявлением глубоких метаболических расстройств.
Для гиперандрогенной недостаточности яичников характерно повышение амплитуды и частоты залпов ЛГ гипофиза (41).
Важную роль в патогенезе играет влияние андрогенов на уровень белка, связывающего тестостерон и эстрогены (ТЭСГ). При гиперандрогении и ожирении синтез ТЭСГ в печени снижается, что ведет к повышению активных концентраций эстрогенов и тестостерона в крови, в результате чего проявления гиперандрогении усиливаются. Есть указания на то, что важную роль в развитии синдрома играют ненаследственные внутриутробные влияния, и что гиперандрогения у матери может оказывать неблагоприятное влияние на созревание различных ферментных систем плода (25). При синдроме гиперандрогении меняется соотношение норадреналина и допамина, и возникающий дефицит допамина ведет к усилению выброса ЛГ.
Нарушение развития доминантного фолликула и овуляции при нормогонадотропной недостаточности яичников ведет к развитию НЛФ (23).
Выделяют 5 причин развития НЛФ: нарушение созревания фолликула; недостаточная стимуляция ЛГ во 2- фазу цикла; недостаточная и /или запоздалая лютеинизация преовуляторного фолликула; мягкие формы гиперпролактинемии; гиперандрогении различного происхождения (23). Гормональным проявлением НЛФ является снижение продукции прогестерона желтым телом, сопровождающееся нормальной или повышенной секрецией эстрадиола (относительная гиперэстрогения). На клеточном уровне НЛФ проявляется усилением клеточных делений (эндрометрий, молочная железа, миометрий). Клинически НЛФ проявляется предменструальным синдромом, нарушениями менструального цикла, снижением фертильности, доброкачественными опухолями молочных желез и миомой матки. Причинами бесплодия при НЛФ являются недостаточная зрелость эндометрия, затрудняющая нормальную имплантацию и недостаточный для поддержки ранней беременности уровень прогестерона (26).
Медицинская биохимия, принципы измерительных технологий в биохимии, патохимия, диагностика, биохимия злокачественного роста. Часть 3
1 Энрико Сертоли (Enrico Sertoli, 1842-1910) - гистолог и физиолог, Италия.
2 Франц Лейдиг (Franz Leydig, 1821-1908) - гистолог, Германия, иностранный член-корреспондент Петербургской Академии наук.
3 Иоганн Петер Мюллер (Johannes Peter Müller, 1801-1858) - физиолог, Германия.
4 Габриэль Фаллопий (Gabriele Falloppio, 1523-1562), анатом, Италия.
5 Каспар Фридерик Вольфф (Caspar Friedrich Wolff, 1733-1794) - физиолог, один из основателей эмбриологии, Германия.
6 Германн Гартнер (Hermann Treschow Gartner, 1785-1827) - хирург и анатом, Дания.
7 Александр Скин (Alexander Johnston Chalmers Skene, 1837-1900) - гинеколог Великобритания (Шотландия).
8 Каспар Бартолин, младший (Caspar Bartholin the Younger, 1655-1738) - анатом, Дания.
9 Вильям Купер (William Cowper FRS, 1666-1709) - хирург и анатом, Великобритания.
Провести анализ данных, представленных в современной литературе, о взаимосвязи инсулинорезистентности и синдрома поликистозных яичников.
МАТЕРИАЛ И МЕТОДЫ
В обзор включены данные отечественных и зарубежных исследований, опубликованные за последние 10 лет. Поиск проведен в электронных базах Medline, PubMed, eLibrary.
РЕЗУЛЬТАТЫ
В статье рассмотрены данные литературы о взаимосвязи инсулинорезистентности со спецификой протекания гинекологических заболеваний, которые сопровождаются хронической ановуляцией и гиперандрогенией. Отмечены наиболее важные особенности репродуктивной системы женщин с синдромом поликистозных яичников, сопровождающимся гиперинсулинизмом. На основании анализа литературы определена основная причина бесплодия, которая заключается в овариальной дисфункции и хронической ановуляции.
ЗАКЛЮЧЕНИЕ
Инсулинорезистентность, гиперандрогения, дислипидемия, характерные для синдрома поликистозных яичников, вероятно, являются критическими факторами для процессов инвазии трофобласта и плацентации, а также могут повлиять на здоровье матери и ребенка.
ФГБОУ ВО «Оренбургский государственный медицинский университет» Министерства здравоохранения Российской Федерации
ФГБОУ ВО «Оренбургский государственный медицинский университет» Минздрава России
- SPIN РИНЦ: 2067-5253
- Scopus AuthorID: 7004706491
- ORCID: 0000-0003-0369-0281
Дата принятия в печать:
Введение
Широко распространенный синдром поликистозных яичников (СПКЯ) — это полисиндромное заболевание, часто ассоциирующееся с бесплодием. СПКЯ является наиболее частой эндокринной патологией у женщин репродуктивного возраста как в России, так и за рубежом. СПКЯ характеризуется сложным каскадом биохимических процессов, нарушением гормонального баланса, избытком андрогенов, развитием гирсутизма, акне, поликистозом яичников, нерегулярным менструальным циклом, нарушением овуляции и, как следствие, бесплодием. СПКЯ диагностируют почти у 50% женщин с нарушениями менструальной и овуляторной функции, у 5—10% пациенток с бесплодием, причем более чем у 40% женщин СПКЯ является причиной ановуляторного бесплодия.
Цель работы — провести анализ данных, представленных в современной литературе, о взаимосвязи инсулинорезистентности (ИР) и СПКЯ.
Материал и методы
В обзор включены данные отечественных и зарубежных исследований, опубликованных в электронных базах Medline, PubMed, eLibrary за последние 10 лет.
Результаты
Согласно данным Роттердамского консенсуса (2003 г.), СПКЯ — это синдром овариальной дисфункции, к специфическим проявлениям которого относятся ановуляция, гиперандрогения и поликистозная морфология яичников, подтвержденная с помощью ультразвукового исследования. У женщин с СПКЯ имеется высокий риск развития гипертензии, сердечно-сосудистых заболеваний, нарушения толерантности к глюкозе, сахарного диабета 2-го типа и дислипидемии, абдоминального и висцерального ожирения, возникновения осложнений при родовой деятельности и психологического стресса [1—4]. На сегодняшний день патогенез СПКЯ изучен недостаточно и считается мультифакторным, хотя достоверно известно, что среди главных причин этой патологии — генетическая предрасположенность и образ жизни пациентки [5, 6]. В патофизиологических процессах развития СПКЯ, как и ряда других заболеваний, проявляющихся нарушением метаболического профиля, основная роль отведена развитию ИР тканей организма [2, 4, 7]. Повреждение рецепторного аппарата провоцирует увеличение выброса гормона в кровяное русло, вызывая гиперинсулинемию. Вследствие повышенного сывороточного уровня инсулина происходит нарушение нормального функционирования гипоталамо-гипофизарно-овариальной системы: повышение частоты пульсации гипоталамического гонадотропин-рилизинг-гормона, что в свою очередь увеличивает уровень продукции лютеинизирующего гормона и фолликулостимулирующего гормона (ФСГ). Инсулин влияет на стероидогенез, вызывает ингибиторную реакцию на белок SHBG (глобулин, связывающий половые гормоны) и провоцирует продукцию IGFBP-1 (белок-1, связывающий инсулиноподобный фактор роста) [8, 9]. Последний дополнительно способствует синтезу андрогенов яичниками. Описанные изменения в биохимическом профиле «рисуют» клиническую картину пациенток с СПКЯ [10, 11]. Таким образом, ИР, способствующую гиперинсулинемии, считают важным фактором, который влияет на дисбаланс гормонального профиля организма и является «ключом» в терапевтических вопросах решения проблем эндокринного бесплодия, снижения риска развития метаболических нарушений, гестационного сахарного диабета, сахарного диабета 2-го типа и ряда кардиоваскулярных заболеваний [2, 4, 10, 12]. СПКЯ является не только причиной эндокринного бесплодия у женщин, но и представляет угрозу здоровью женщин в целом [8, 13]. Лечение женщин с СПКЯ осуществляется на основании комплексного подхода, включающего в себя изменение образа жизни, пищевого рациона, нормализацию массы тела и медикаментозное лечение [11, 14]. Прегравидарная подготовка позволяет выявить факторы риска репродуктивных потерь и обеспечить их устранение в начале лечения бесплодия [7]. Дефект сигнальных инсулиновых рецепторов тесно связан с недостаточностью фосфогликановых медиаторов (инозитолсодержащих веществ), которые действуют как вторичные мессенджеры в регулировании гормонов, в том числе инсулина [8]. Учитывая это, единственным теоретически оправданным подходом к коррекции подобных сдвигов остается использование инсулиносенситайзеров. Применение в клинической практике последних способствует не только нормализации уровня инсулина, но и восстановлению баланса продукции гормонов половой системы и снижению проявлений метаболического синдрома [3, 5, 10]. В медицинских рекомендациях для повышения чувствительности тканей к инсулину предлагают использовать положительное действие метформина [15]. Вместе с тем с позиций доказательной медицины высказан ряд сомнений относительно эффективности применения этого препарата, особенно если речь идет не о терапевтическом эффекте, в результате которого снижается ИР и модулируется липидный профиль, а о случаях, в которых использование препарата нежелательно, или существуют противопоказания с угрозой возникновения побочных реакций [13, 16, 17].
В статьях зарубежных исследователей, опубликованных в 2019 и 2021 гг., неоднократно поднимался вопрос об ИР как недооцененном факторе СПКЯ [9, 14]. Однако в руководстве Европейского общества репродукции человека и эмбриологии (ESHRE) переключено внимание с репродуктивных проблем, связанных с СПКЯ, на метаболические последствия, следовательно, по-прежнему имеет место недооценка важности ИР. Фактически специалисты ESHRE рекомендуют оценивать гликемический статус пациентов с СПКЯ, выполняя пероральный глюкозотолерантный тест, который подходит для диагностики нарушения толерантности к глюкозе или сахарного диабета 2-го типа, но не для ИР (уровень инсулина не измеряется одновременно с уровнем глюкозы). Это рекомендация содержит противоречия, так как большинство женщин с СПКЯ, включая пациенток с пониженной массой тела, не болеют сахарным диабетом 2-го типа, но у них выявлена ИР. Следовательно, нормальные результаты пероральных тестов на толерантность к глюкозе могут создать ложное чувство безопасности у пациента и врача, препятствуя инициированию целенаправленного изменения образа жизни [15].
По данным рандомизированных контролируемых исследований с оценкой биохимической панели пациентов, положительному эффекту метформина, в тех случаях, когда его можно применять, не уступает эффект, вызываемый инозитолом [16, 17]. Оценку проводили по уровню гликемии натощак, уровню сывороточного инсулина, лептина и адипонектина, глюкозоинсулиновому соотношению, индексу HOMA, а также липидному профилю [11, 13]. В последние годы все большее количество исследований направлено на изучение влияния инозитола в прегравидарной подготовке у женщин с СПКЯ. Инозитол (витамин B8) — это циклический шестиатомный спирт циклогексана (C6 H12O6), который имеет 9 стереоизомеров [14]. Впервые открыт в 1848 г. немецким ученым Ю. Либихом. Мио-инозитол и D-хиро-инозитол являются двумя основными стереоизомерами инозита, которые образуются после эпимеризации гидроксильных групп инозитола и обладают инсулиносенситайзерными свойствами [8, 11]. Самым распространенным видом, как в природе, так и в клетках человека является мио-инозитол, именно его недостаточность влияет на патогенетические процессы развития СПКЯ [13]. В организме запасы последнего возобновляются вместе с поступлением пищи, однако, когда экзогенные источники инозитола отсутствуют, или существует их дефицит, нарушается чувствительность специфических рецепторов к инсулину [5]. Мио-инозитол — одна из наиболее широко используемых форм инозитола. Он является субстратом для многих инозитолопроизводных, образующихся под действием эпимеразных реакций, фосфорилирования и метилирования гидроксильных групп [6]. Именно в нарушении достаточного уровня синтеза коферментов-конвертеров заключается суть изменения концентрации одного или другого активного инозитола и их производных. В организме человека мио-инозитол синтезируется из глюкозо-6-фосфата в мио-инозитол-1-фосфат с помощью фермента инозит-3-фосфат-синтазы, который в дальнейшем дефосфорилируется, образуя свободный мио-инозит под действием фермента инозит-монофосфата. NAD/NADH эпимераза — инсулинозависимый кофермент — конвертирует мио-инозитол в D-хиро-инозитол в зависимости от специфических потребностей тканей в этих молекулах. Различные ткани организма проявляют разную потребность в количественном соотношении мио-инозита к D-хиро-инозитолу (в яичниках это соотношение равно 100:1) [5, 8]. Вследствие вызванной ИР недостаточности инсулинозависимых коферментов-конвертеров у пациентов с СПКЯ снижается коэффициент отношения концентрации мио-инозитола к D-хиро-инозитолу [2, 10]. D-хиро-инозитол регулирует синтез пируватдегидрогеназы, поддерживая уровень продукции АТФ в цикле Кребса. Таким образом, в организме мио-инозитол активирует работу глюкозных транспортеров и утилизацию глюкозы, а D-хиро-инозитол активизирует синтез гликогена. Последний локально, на овариальном уровне, регулирует синтез андрогенов, индуцированный инсулином, в то время как мио-инозитол влияет на синтез ФСГ. Оба стереоизомера используют в комплексном лечении у женщин с поликистозом яичников в качестве инсулиносенсибилизирующих агентов [5].
Уникально то, что ткани яичников, в отличие от других тканей организма, никогда не бывают инсулинорезистентными. С этого момента возможно искажение информации о том, что пациенты с СПКЯ и гиперинсулинемией имеют повышенный уровень эпимеразной активности, а соответственно повышены концентрации D-хиро-инозитола и дефицит мио-инозитола. Хорошо известный «парадокс D-хиро-инозитола» поддерживает право на существование гипотезы о том, что только мио-инозит имеет качественное значение для функционирования яичников. Эта теория позже подтверждена рядом зарубежных научных исследований. Констатирован факт, что качество ооцитов и ответ яичников значительно ниже при изолированном экзогенном введении только D-хиро-инозитола вследствие токсического действия его высоких концентраций на ткани организма [5, 6, 14]. Инозитол с кровью попадает во все клетки организма в достаточно высокой концентрации и скапливается в клеточной мембране. Доказана важная роль инозитола в воздействии на качество яйцеклеток и результаты беременности [1, 3, 13]. Как структурная основа мио-инозитол играет важную роль для синтеза многих вторичных мессенджеров, в том числе фосфатидилинозитол-3-киназы как ключевого мессенджера чувствительности к инсулину.
Производный мио-инозитола — фосфоинозитол-3-фосфат способствует транспорту глюкозы внутрь клетки, индуцируя транслокацию глюкозного транспортера GLUT-4 на мембрану клетки. Еще один производный мио-инозитола — инозитол фосфогликан привлекает особое внимание, регулируя релиз свободных жирных кислот в постоянный режим депрессии [13]. В результате дефицита мио-инозитола с последующей недостаточностью его производных увеличивается окисление жирных кислот, что уменьшает использование глюкозы вследствие развития ИР тканей организма и повышения уровня синтеза триглицеридов [8, 11]. Поглощение свободного инозитола клетками осуществляется натрий-зависимым котранспортом. Доказано выраженное влияние инозитола на реализацию репродуктивной функции женщин и развитие эмбриона [12]. Инозитол играет немаловажную роль в матурации и оплодотворении яйцеклеток посредством регуляции сигнальных путей кальция.
Показано, что уровни мио-инозита в крови и фолликулярной жидкости находятся в прямой зависимости с качеством яйцеклеток и частотой наступления беременности. Использование мио-инозита в прегравидарной подготовке способствует влиянию на мейоз ооцитов, что приводит к образованию ооцитов и эмбрионов лучшего качества [12].
В работе F. Caprio и соавт. (2015) представлено, что введение инозитола женщинам в процессе прегравидарной подготовки к началу индукции суперовуляции в циклах экстракорпорального оплодотворения способствует повышению качества ооцитов и эмбрионов, а также снижает необходимую дозу ФСГ и количество дней, которые необходимы для протекания процесса суперстимуляции [2].
По результатам многих рандомизированных исследований эффективности применения мио-инозитола доказано достоверное улучшение работы яичников у женщин с СПКЯ, при этом снижались уровни тестостерона и увеличивались уровни прогестерона, а побочные эффекты отсутствовали [3, 8]. Согласно данным Международного консенсуса 2015 г., посвященного применению мио-инозитола в программах вспомогательных репродуктивных технологий, получены данные о том, что мио-инозитол является важной составляющей фолликулярной микросреды.
Гиперинсулинемия косвенно связана с СПКЯ, поэтому цель лечения пациенток с СПКЯ — восстановление овуляторных менструальных циклов. Таким образом, использование инозитол-содержащих препаратов в качестве прегравидарной подготовки перед программами вспомогательных репродуктивных технологий (ВРТ) способствует улучшению ожидаемых результатов в вопросе лечения бесплодия.
Согласно клиническим рекомендациям, утвержденным в 2021 г., пациенткам с СПКЯ рекомендуется использовать модификацию образа жизни, включающую физические упражнения и рациональное сбалансированное питание, для достижения и поддержания нормальной массы тела, общего состояния здоровья и качества жизни на протяжении всей жизни.
Достижение целей, таких как снижение массы тела на 5—10% в течение 6 мес. у пациенток с избыточным весом, приводит к значительным клиническим улучшениям. Снижение массы тела на фоне модификации образа жизни у пациенток с СПКЯ способствует нормализации менструальной функции и улучшению ряда метаболических показателей (преимущественно углеводного обмена), однако ответ имеет индивидуальный характер.
Если пациентка не планирует беременность, рекомендуется проводить терапию комбинированными гормональными контрацептивами: применять комбинированные оральные контрацептивы (по анатомо-терапевтическо-химической классификации препаратов (АТХ) — прогестагены и эстрогены, фиксированные сочетания), пластырь, интравагинальное кольцо. Для лечения пациенток с СПКЯ, нарушениями менструального цикла и клиническими проявлениями гиперандрогении (гирсутизм и акне) эти средства применяют в качестве терапии первой линии.
Согласно международным клиническим рекомендациям, препаратом первой линии для лечения ановуляторного бесплодия назван нестероидный ингибитор ароматазы — летрозол, однако в России этот препарат может быть назначен только с подписанием информированного добровольного согласия.
Рекомендуется использовать кломифен у пациенток с СПКЯ в качестве терапии первой линии для лечения ановуляторного бесплодия.
Женщинам с СПКЯ, не заинтересованным в беременности, разрешены любые методы контрацепции с учетом критериев приемлемости контрацепции ВОЗ.
Основные показания к лапароскопии у женщин с СПКЯ и бесплодием — это резистентность к кломифену, другие показания к лапароскопической операции (эндометриоз, трубно-перитонеальный фактор бесплодия), невозможность мониторинга при использовании гонадотропинов.
Завершающим этапом лечения бесплодия при СПКЯ является ВРТ. У пациенток с данной патологией имеется высокий риск гиперстимуляции яичников, поэтому в настоящее время чаще всего применяют длинный протокол с антагонистами гонадотропин-рилизинг-гормона и рекомбинантным ФСГ, рекомендуется перенос одного эмбриона.
Использование инозитола способствует балансу показателей метаболического профиля и нормализует содержание гормонов. В связи с этим наибольшее внимание специалистов привлекают исследования, касающиеся влияния инозитола на повышение фертильных возможностей пациенток с СПКЯ. Доказано, что использование инозитол-содержащих препаратов в качестве прегравидарной подготовки перед программами ВРТ способствует улучшению результатов лечения бесплодия.
Заключение
Синдром поликистозных яичников остается актуальной проблемой современного акушерства, гинекологии и репродуктологии. Инсулинорезистентность, гиперандрогения, дислипидемия, характерные для синдрома поликистозных яичников, вероятно, являются критическими факторами для процессов инвазии трофобласта и плацентации, а также могут повлиять на здоровье матери и ребенка. Поэтому важен поиск новых подходов и оптимизация методов прегравидарной подготовки женщин с этим заболеванием. На основе анализа современной зарубежной и отечественной литературы установлено, что инозитол:
1) играет важную роль в устранении метаболических нарушений и нормализации гормонального фона у женщин с синдромом поликистозных яичников, его применение способствует повышению уровня липопротеинов высокой плотности, снижению уровня тестостерона и увеличению уровня эстрадиола и прогестерона;
2) оказывает влияние на репродуктивную функцию женщины (способствует нормализации регуляции менструального цикла, восстановлению овуляции);
3) оказывает значительное влияние на результаты вспомогательных репродуктивных технологий (улучшает качество яйцеклеток и эмбрионов, повышая частоту наступления беременности).
Прегравидарная подготовка перед программами вспомогательных репродуктивных технологий, которая включает препараты инозитола, дает возможность снижать дозы рекомбинантного фолликулостимулирующего гормона и продолжительность стимуляции суперовуляции. Перспективы дальнейших исследований заключаются в развитии относительно нового, эффективного и вспомогательного направления лечения синдрома поликистозных яичников, который ассоциируется с эндокринным бесплодием, в процессе прегравидарной подготовки и в протоколах вспомогательных репродуктивных технологий.
Читайте также:
- Диагностика травматического расслоения внутричерепной артерии по КТ, МРТ, ангиограмме
- Гиперпигментации (меланозы) после неостровоспалительных дерматозов
- Симптомы апицита (воспаления верхушки пирамиды) и его лечение
- Мониторинг лечения сильнодействующими и наркотическими средствами
- Этика медицинских исследований в педиатрии. Требования
