Боль - происхождение, механизмы развития
Добавил пользователь Alex Обновлено: 22.01.2026
Сайт предоставляет справочную информацию. Адекватная диагностика и лечение болезни возможны под наблюдением добросовестного врача. У любых препаратов есть противопоказания. Необходима консультация специалиста, а также подробное изучение инструкции!
Боль - это первый из описанных врачами Древней Греции и Рима симптомов - признаков воспалительного повреждения. Боль - это то, что сигнализирует нам о каком-либо неблагополучии, возникающем внутри организма или о действии некоего разрушающего и раздражающего фактора извне.
Боль, по мнению широко известного русского физиолога П. Анохина, призвана мобилизовывать разнообразные функциональные системы организма для его защиты от воздействия вредящих факторов. Боль включает в себя такие компоненты как: ощущение, соматические (телесные), вегетативные и поведенческие реакции, сознание, память, эмоции и мотивации. Таким образом, боль есть объединяющая интегративная функция целостного живого организма. В данном случае - человеческого организма. Ибо живые организмы, даже не обладая признаками высшей нервной деятельности, могут испытывать боль.
Имеются факты изменения электрических потенциалов у растений, которые фиксировались при повреждении их частей, а также такие же электрические реакции, когда исследователи наносили травму соседним растениям. Таким образом, растения реагировали на причиняемые им или соседним растениям повреждения. Только боль имеет такой своеобразный эквивалент. Вот такое интересное, можно сказать, универсальное свойство всех биологических организмов.
Виды боли - физиологическая (острая) и патологическая (хроническая)
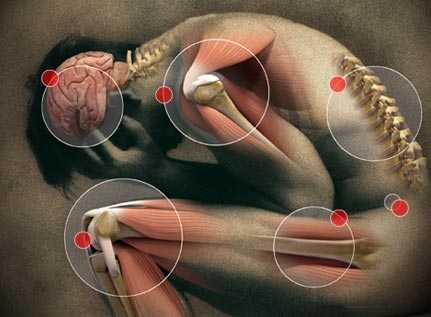
Боль бывает физиологической (острой) и патологической (хронической).
Острая боль
По образному выражению академика И.П. Павлова, является важнейшим эволюционным приобретением, и требуется для защиты от воздействия разрушающих факторов. Смысл физиологической боли заключается в отбрасывании всего, что угрожает жизненному процессу, нарушает равновесие организма с внутренней и внешней средой.
Хроническая боль
Это явление несколько более сложное, которое формируется в результате длительно существующих в организме патологических процессов. Процессы эти могут быть как врожденными, так и приобретенными в течение жизни. К приобретенным патологическим процессам относят следующие - длительное существование очагов воспаления, имеющих различные причины, всевозможные новообразования (доброкачественные и злокачественные), травматические повреждения, операционные вмешательства, исходы воспалительных процессов (например, образование спаек между органами, изменение свойств тканей, входящих в их состав). К врожденным патологическим процессам относятся следующие - различные аномалии расположения внутренних органов (например, расположение сердца снаружи грудной клетки), врожденные аномалии развития (например, врожденный дивертикул кишечника и прочие). Таким образом, длительно существующий очаг повреждения, приводит к постоянным и небольшим повреждениям структур организма, что также постоянно создает болевую импульсацию о повреждениях данных структур организма, затронутых хроническим патологическим процессом.
Так как данные повреждения минимальны, то и болевые импульсы довольно таки слабые, а боль становится постоянной, хронической и сопровождает человека повсеместно и практически круглосуточно. Боль становится привычной, однако никуда не исчезает и остается источником длительного раздражающего воздействия. Болевой синдром, существующий у человека шесть или более месяцев, приводит к значительным изменениям в организме человека. Происходит нарушение ведущих механизмов регуляции важнейших функций организма человека, дезорганизация поведения и психики. Страдает социальная, семейная и личностная адаптация данного конкретного индивида.
Как часто встречаются хронические боли?
Согласно исследованиям Всемирной Организации Здравоохранения (ВОЗ), каждый пятый житель планеты страдает хроническими болями, причиняемыми всевозможными патологическими состояниями, связанными с заболеваниями различных органов и систем организма. Это означает, что как минимум 20% людей страдают хроническими болями разной степени выраженности, различной интенсивности и длительности.
Что такое боль и как она возникает? Отдел нервной системы ответственный за передачу болевой чувствительности, вещества вызывающие и поддерживающие болевые ощущения
Ощущение боли представляет собой сложный физиологический процесс, включающий периферические и центральные механизмы, и имеющий эмоциональную, психическую, а зачастую и вегетативную окраску. Механизмы болевого феномена полностью на сегодняшний день не раскрыты, несмотря на многочисленные научные исследования, которые продолжаются вплоть до сегодняшнего времени. Однако рассмотрим основные этапы и механизмы восприятия боли.
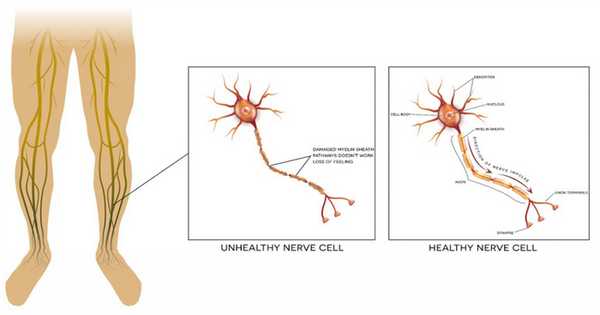
Нервные клетки, передающие болевой сигнал, виды нервных волокон
Самый первый этап восприятия боли представляет собой воздействие на болевые рецепторы (ноцицепторы). Данные болевые рецепторы расположены во всех внутренних органах, костях, связках, в коже, на слизистых оболочках различных органов, соприкасающихся с внешней средой (например, на слизистой кишечника, носа, горла и т.д.).
На сегодняшний день выделяют два основных вида болевых рецепторов: первые - это свободные нервные окончания, при раздражении которых возникает ощущение тупой, разлитой боли, а вторые представляют собой сложные болевые рецепторы, при возбуждении которых возникает чувство острой и локализованной боли. То есть характер болевых ощущений напрямую зависит от того, какие болевые рецепторы восприняли раздражающее воздействие. Относительно специфических агентов, которые могут раздражать болевые рецепторы, можно сказать, что к ним относятся различные биологически активные вещества (БАВ), образующиеся в патологических очагах (так называемые, алгогенные вещества). К данным веществам относятся различные химические соединения - это и биогенные амины, и продукты воспаления и распада клеток, и продукты локальных иммунных реакций. Все эти вещества, совершенно разные по химической структуре, способны оказывать раздражающее действие на болевые рецепторы различной локализации.
Простагландины - вещества, поддерживающие воспалительную реакцию организма
Однако, существует ряд химических соединений, участвующих в биохимических реакциях, которые сами непосредственно не могут воздействовать на болевые рецепторы, однако усиливают эффекты веществ вызывающих воспаление. К классу данных веществ, например, относятся простагландины. Простагландины образуются из особых веществ - фосфолипидов, которые составляют основу клеточной мембраны. Данные процесс протекает следующим образом: некий патологический агент (например, ферментов образуются простагландины и лейкотриены. Простагландины и лейкотриены в целом называются эйкозаноиды и играют важную роль в развитии воспалительной реакции. Доказана роль простагландинов в формировании болевых ощущений при эндометриозе, предменструальном синдроме, а также синдроме болезненных менструаций (альгодисменорее).
Итак, мы рассмотрели первый этап формирования болевого ощущения - воздействие на специальные болевые рецепторы. Рассмотрим, что происходит дальше, каким образом человек чувствует боль определенной локализации и характера. Для понимания данного процесса необходимо ознакомиться с проводящими путями.
Как болевой сигнал поступает в головной мозг? Болевой рецептор, периферический нерв, спинной мозг, таламус - подробнее о них
Биоэлектрический болевой сигнал, сформировавшийся в болевом рецепторе, по нескольким типам нервных проводников (периферическим нервам), минуя внутриорганные и внутриполостные нервные узлы, направляется к спинальным нервным ганглиям (узлам), расположенным рядом со спинным мозгом. Эти нервные ганглии сопровождают каждый позвонок от шейных до некоторых поясничных. Таким образом, образуется цепочка нервных ганглиев, идущая справа и слева вдоль позвоночного столба. Каждый нервный ганглий связан с соответствующим участком (сегментом) спинного мозга. Дальнейший путь болевого импульса из спинальных нервных ганглиев направляется в спинной мозг, который непосредственно соединен с нервными волокнами.
На самом деле спинной мог - это неоднородная структура - в нем выделяют белое и серое вещество (как и в головном мозге). Если спинной мозг рассмотреть на поперечном разрезе, то серое вещество будет выглядеть как крылья бабочки, а белое будет окружать его со всех сторон, формируя округлые очертания границ спинного мозга. Так вот, задняя часть этих крылышек бабочки называется задними рогами спинного мозга. По ним нервные импульсы переправляются к головному мозгу. Передние же рога, по логике должны располагаться в передней части крыльев - так оно и происходит. Именно передние рога проводят нервный импульс от головного мозга к периферическим нервам. Так же в спинном мозге в центральной его части существуют структуры, которые непосредственно соединяют нервные клетки передних и задних рогов спинного мозга - благодаря этому имеется возможность формирования так называемой «кроткой рефлекторной дуги», когда некоторые движения происходят неосознанно - то есть без участия головного мозга. Примером работы короткой рефлекторной дуги является одергивание руки от горячего предмета.
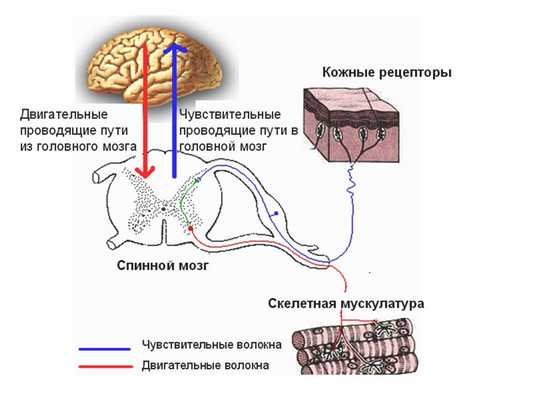
Поскольку спинной мозг имеет сегментарное строение, следовательно, в каждый сегмент спинного мозга входят нервные проводники со своей зоны ответственности. При наличии острого раздражителя с клеток задних рогов спинного мозга возбуждение может резко переключаться на клетки передних рогов спинномозгового сегмента, что вызывает молниеносную двигательную реакцию. Коснулись рукой горячего предмета - одернули сразу руку. При этом болевая импульсация все равно достигает коры головного мозга, и мы осознаем, что прикоснулись к горячему предмету, хотя руку уже рефлекторно отдернули. Подобные нервно-рефлекторные дуги для отдельных сегментов спинного мозга и чувствительных периферических участков могут различаться в построении уровней участия центральной нервной системы.
Подпишитесь на Здоровьесберегающий видеоканал
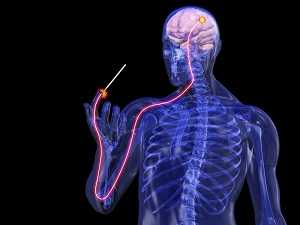
Как нервный импульс достигает головного мозга?
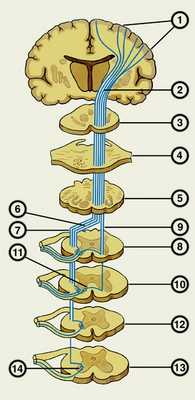
Далее из задних рогов спинного мозга путь болевой чувствительности направляется в вышележащие отделы центральной нервной системы по двум путям - по так называемым «старым» и «новым» спиноталамическим (путь нервного импульса: спинной мозг - таламус) путям. Названия «старый» и «новый» являются условными и говорят лишь о времени появления указанных путей на историческом отрезке эволюции нервной системы. Не будем, однако, вдаваться в промежуточные этапы довольно сложного нервного пути, ограничимся лишь констатацией факта, что оба указанных пути болевой чувствительности оканчиваются в участках чувствительной коры головного мозга. И «старый», и «новый» спиноталамические пути проходят через таламус (особый участок головного мозга), а «старый» спиноталамический путь - еще и через комплекс структур лимбической системы мозга. Структуры лимбической системы мозга во многом участвуют в образовании эмоций и формировании поведенческих реакций.
Предполагается, что первая, более эволюционно молодая система («новый» спиноталамический путь) проведения болевой чувствительности рисует более определенную и локализованную боль, вторая же, эволюционно более древняя («старый» спиноталамический путь) служит для проведения импульсов, дающих ощущение тягучей, плохо локализованной боли. Дополнительно к этому, указанная «старая» спиноталамическая система обеспечивает эмоциональное окрашивание болевого ощущения, а также участвует в формировании поведенческих и мотивационных составляющих эмоциональных переживаний, связанных с болью.
Перед достижением чувствительных участков коры головного мозга, болевая импульсация проходит, так называемую, предварительную обработку в определенных отделах центральной нервной системы. Это уже упомянутый таламус (зрительный бугор), гипоталамус, сетчатая (ретикулярная) формация, участки среднего и продолговатого мозга. Первый, и, пожалуй, один из самых важных фильтров на пути болевой чувствительности - это таламус. Все ощущения из внешней среды, от рецепторов внутренних органов - всё проходит через таламус. Невообразимое количество чувствительной и болевой импульсации проходит ежесекундно, днем и ночью через данный участок мозга. Мы не ощущаем, как происходит трение клапанов сердца, движение органов брюшной полости, всевозможных суставных поверхностей друг о друга - и всё это благодаря таламусу.
При нарушении работы, так называемой, антиболевой системы (например, в случае отсутствия выработки внутренних, собственных морфиноподобных веществ, возникшей по причине употребления наркотических средств) вышеупомянутый шквал всевозможной болевой и прочей чувствительности просто захлестывает головной мозг, приводя к ужасающим по длительности, силе и выраженности эмоционально-болевым ощущениям. Такова причина, в несколько упрощенном виде, так называемой «ломки» при дефиците поступления извне морфиноподобных веществ на фоне длительного приема наркотических средств.
Как болевой импульс обрабатывается головным мозгом?
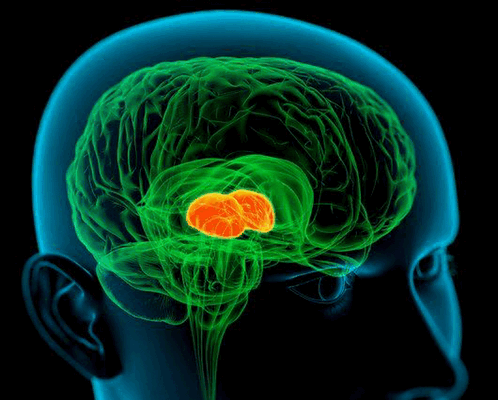
Задние ядра таламуса дают информацию о локализации источника боли, а срединные его ядра - о продолжительности воздействия раздражающего агента. Гипоталамус, как важнейший регуляторный центр вегетативной нервной системы, участвует в образовании вегетативного компонента болевой реакции опосредованно, через задействование центров регулирующих обмен веществ, работу дыхательной, сердечно-сосудистой и других систем организма. Ретикулярная формация координирует уже частично обработанную информацию. Особенно подчеркивается роль ретикулярной формации в формировании ощущения боли как некоего особого интегрированного состояния организма, с включением всевозможных биохимических, вегетативных, соматических составляющих. Лимбическая система мозга обеспечивает негативную эмоциональную окраску.Сам процесс осознания боли как таковой, определение локализации болевого источника (имеется ввиду конкретная область собственного тела) в совокупности со сложнейшими и разнообразнейшими реакциями на болевую импульсацию происходит непременно при участии мозговой коры.
Сенсорные участки коры головного мозга являются высшими модуляторами болевой чувствительности и играют роль, так называемого, коркового анализатора информации о факте, длительности и локализации болевого импульса. Именно на уровне коры происходит интеграция информации от различных видов проводников болевой чувствительности, что означает полновесное оформление боли как многогранного и многообразного ощущения.В конце прошлого века было выявлено, что каждый уровень построения болевой системы от рецепторного аппарата до центральных анализирующих систем мозга может обладать свойством усиления болевой импульсации. Как бы своего рода трансформаторные подстанции на линиях электропередач.
Приходится говорить даже о, так называемых, генераторах патологически усиленного возбуждения. Так, с современных позиций данные генераторы рассматриваются как патофизиологические основы болевых синдромов. Упомянутая теория системных генераторных механизмов позволяет объяснить, почему при незначительном раздражении болевой ответ бывает довольно значителен по ощущениям, почему после прекращения действия раздражителя ощущение боли продолжает сохраняться, а также помогает объяснить появление боли в ответ на стимуляцию зон кожной проекции (рефлексогенных зон) при патологии различных внутренних органов.
Хронические боли любого происхождения приводят к повышенной раздражительности, снижению работоспособности, потере интереса к жизни, нарушению сна, изменениям эмоционально-волевой сферы, часто доводят до развития ипохондрии и депрессии. Все указанные последствия уже сами по себе усиливают патологическую болевую реакцию. Возникновение подобной ситуации трактуется как образование замкнутых порочных кругов: болевой раздражитель - психо-эмоциональные нарушения - поведенческие и мотивационное нарушения, проявляющиеся в виде социальной, семейной и личностной дезадаптации - боль.
Антиболевая система (антиноцицептивная) - роль в организме человека. Порог болевой чувствительности
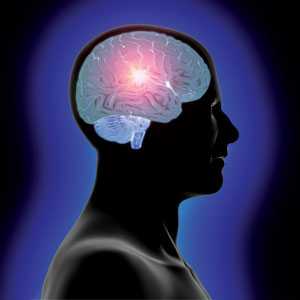
Наряду с существованием в организме человека болевой системы (ноцицептивной), существует еще и антиболевая система (антиноцицептивная). Что осуществляет антиболевая система? Прежде всего, для каждого организма существует свой, генетически запрограммированный порог восприятия болевой чувствительности. Данный порог позволяет объяснить, почему на раздражители одинаковой силы, продолжительности и характера разные люди реагируют по-разному. Понятие порога чувствительности - это универсальное свойство всех рецепторных систем организма, в том числе и болевых. Так же как и система болевой чувствительности, антиболевая система имеет сложное многоуровневое строение, начиная с уровня спинного мозга и заканчивая мозговой корой.
Как регулируется деятельность антиболевой системы?
Сложная деятельность антиболевой системы обеспечивается цепочкой сложных нейрохимических и нейрофизиологических механизмов. Основная роль в этой системе принадлежит нескольким классам химических веществ - мозговым нейропептидам, В их число входят и морфиеподобные соединения - эндогенные опиаты (бета-эндорфин, динорфин, различные энкефалины). Названные вещества могут считаться так называемыми эндогенными анальгетиками. Указанные химические вещества обладают угнетающим воздействием на нейроны болевой системы, активируют антиболевые нейроны, модулируют активность высших нервных центров болевой чувствительности. Содержание данных антиболевых веществ в центральной нервной системе при развитии болевых синдромов уменьшается. По всей видимости, этим и объясняется снижение порога болевой чувствительности вплоть до появления самостоятельных болевых ощущений на фоне отсутствия болевого раздражителя.
Следует также отметить, что в антиболевой системе наряду с морфиеподобными опиатными эндогенными анальгетиками большую роль играют и широко известные мозговые медиаторы, такие как: серотонин, норадреналин, дофамин, гамма-аминомасляная кислота (ГАМК), а также гормоны и гормоноподобные вещества - вазопрессин (антидиуретический гормон), нейротензин. Интересно, что действие мозговых медиаторов возможно как на уровне спинного, так и головного мозга. Резюмируя вышесказанное, можно заключить, что включение антиболевой системы позволяет ослабить поток болевой импульсации и снизить болевые ощущения. При возникновении каких-либо неточностей в работе данной системы любая боль может быть воспринята как интенсивная.
Таким образом, все болевые ощущения регулируются совместным взаимодействием ноцицептивной и антиноцицептивной систем. Только их согласованная работа и тонкое взаимодействие позволяет адекватно воспринимать боль и её интенсивность, в зависимости от силы и продолжительности воздействия раздражающего фактора.
Боль: от патогенеза к выбору лекарственного препарата
Боль является наиболее частой и сложной по субъективному восприятию жалобой пациентов. В 40% всех первичных обращений к врачу боль является ведущей жалобой. Большая распространенность болевых синдромов оборачивается значительными материальными, социальными и духовными потерями.
Как уже говорилось выше, комитет по классификации Международной ассоциации по изучению боли определяет боль как «неприятное сенсорное и эмоциональное переживание, связанное с существующим или возможным повреждением ткани или описываемое в терминах такого повреждения» [37]. В этом определении подчеркивается, что ощущение боли может возникать не только при повреждении ткани, но даже при отсутствии какого-либо повреждения, что указывает на важную роль психических факторов в формировании и поддержании боли.
Классификация боли
Боль - понятие клинически и патогенетически сложное и неоднородное. Она различается по интенсивности, локализации и по своим субъективным проявлениям. Боль может быть стреляющей, давящей, пульсирующей, режущей, а также постоянной или периодической. Все существующее многообразие характеристик боли во многом связано с самой причиной, вызвавшей ее, анатомической областью, в которой возникает ноцицептивный импульс, и очень важно для определения причины боли и последующего лечения [3].
Одним из наиболее существенных факторов в понимании этого феномена является разделение боли на острую и хроническую (рис. 8).
Рис. 8. Боль: острая и хроническая. Главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения.
Острая боль всегда указывает на конкретную проблему или угрозу для человека. В этом ее биологический смысл и «польза». Хроническая боль является во всех случаях патологическим состоянием, приводящим к дезадаптации и снижению качества жизни пациента. А для общества хроническая боль оборачивается огромными экономическими потерями.
Острая боль - это сенсорная реакция с последующим включением эмоционально-мотивационных вегетативных и других факторов при нарушении целостности организма. Развитие острой боли связано, как правило, с вполне определенными болевыми раздражениями поверхностных или глубоких тканей и внутренних органов, нарушением функций гладкой мускулатуры. Острый болевой синдром развивается в 80% случаев, имеет защитное, предупредительное значение, так как свидетельствует о «повреждении» и вынуждает человека предпринять меры для выяснения причины боли и ее устранения. Длительность острой боли определяется временем восстановления поврежденных тканей и/или нарушенной функции гладких мышц и обычно не превышает 3 месяцев. Острая боль обычно хорошо купируется анальгетиками.
В 10-20% случаев острая боль переходит в хроническую, которая длится более 3-6 месяцев. Однако главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения. Хроническая боль не носит защитного характера. Хроническая боль в последние годы стала рассматриваться не только как синдром, но и как отдельная нозология. Ее формирование и поддержание зависит в большей степени от комплекса психологических факторов, нежели от характера и интенсивности периферического ноцицептивного воздействия. Хроническая боль может сохраняться после завершения процессов заживления, т.е. существовать вне зависимости от повреждения (наличия ноцицептивного воздействия). Хроническая боль не купируется анальгетиками и часто приводит к психологической и социальной дезадаптации пациентов.
Одной из возможных причин, способствующих хронификации боли, является лечение, неадекватное причине и патогенезу болевого синдрома. Устранение причины острой боли и/или максимально эффективное ее лечение - залог профилактики трансформации острой боли в хроническую.
Важное значение для успешного лечения боли имеет определение ее патогенеза. Наиболее часто встречается ноцицептивная боль, возникающая при раздражении периферических болевых рецепторов - «ноцицепторов», локализованных практически во всех органах и системах (коронарный синдром, плеврит, панкреатит, язва желудка, почечная колика, суставной синдром, повреждения кожи, связок, мышц и т.д). Нейропатическая боль возникает вследствие повреждения различных отделов (периферической и центральной) соматосенсорной нервной системы [9].
Ноцицептивные болевые синдромы чаще всего являются острыми (ожог, порез, ушиб, ссадина, перелом, растяжение), но могут носить и хронический характер (остеоартроз). При этом виде боли фактор, вызвавший ее, как правило, очевиден, боль обычно четко локализована (обычно в зоне повреждения). Описывая ноцицептивную боль, пациенты чаще всего пользуются определениями «сжимающая», «ноющая», «пульсирующая», «режущая». В лечении ноцицептивной боли хороший терапевтический эффект можно получить при назначении простых анальгетиков и НПВП. При ликвидации причины (прекращении раздражения «ноцицепторов») ноцицептивная боль проходит [9].
Причинами нейропатической боли могут быть повреждения афферентной соматосенсорной системы на любом уровне, начиная от периферических чувствительных нервов и заканчивая корой больших полушарий, а также нарушения в нисходящих антиноцицептивных системах. При поражении периферической нервной системы боли называют периферическими, при поражении центральной нервной системы - центральными (рис. 9).
Нейропатическая боль, возникающая при повреждении различных участков нервной системы, характеризуется пациентами как жгучая, стреляющая, холодящая и сопровождается объективными симптомами раздражения нервов (гиперестезия, парестезия, гипералгезия) и/или нарушения их функции (гипестезия, анестезия). Характерным симптомом нейропатической боли является аллодиния - феномен, характеризующийся возникновением боли в ответ на действие безболевого стимула (поглаживание кисточкой, ватой, температурного фактора).
Рис. 9. Периферическая и центральная нейропатическая боль.
Нейропатическая боль характерна для хронических болевых синдромов разной этиологии. При этом их объединяют общие патофизиологические механизмы формирования и поддержания боли.
Нейропатическая боль плохо поддается лечению стандартными анальгетиками и НПВП и часто приводит к выраженной дезадаптации пациентов.
В практике невролога, травматолога, онколога встречаются болевые синдромы, в клинической картине которых наблюдаются симптомы как ноцицептивной, так и нейропатической боли - «смешанная боль» (рис. 10). Такая ситуация может возникать, например, при компрессии опухолью нервного ствола, раздражении межпозвонковой грыжей спинномозгового нерва (радикулопатии) или при компрессии нерва в костном или мышечном канале (туннельные синдромы). В лечении смешанных болевых синдромов необходимо воздействие на оба, ноцицептивный и нейропатический, компоненты боли.
Рис. 10. Представленность различных типов боли.
Ноцицептивная и антиноцицептивная системы
Сегодняшние представления о формировании боли основаны на представлениях о существовании двух систем: ноцицептивной (НС) и антиноцицептивной (АНС) (рис. 11).
Ноцицептивная система (является восходящей) обеспечивает проведение боли от периферических (ноцицептивных) рецепторов до коры головного мозга. Антиноцицептивная система (является нисходящей) предназначена для контроля над болью [17, 18].
На первом этапе формирования боли происходит активация болевых (ноцицептивных) рецепторов. К активации болевых рецепторов может привести, например, воспалительный процесс. Это вызывает проведение болевых импульсов к задним рогам спинного мозга.
На сегментарном спинальном уровне происходит модуляция ноцицептивной афферентации, которая осуществляется влиянием нисходящих антиноцицептивных систем на различные опиатные, адренергические, глютаматные, пуриновые и другие рецепторы, расположенные на нейронах заднего рога. Этот болевой импульс затем передается в вышележащие отделы центральной нервной системы (таламус, кора головного мозга), где происходит обработка и интерпретация информации о характере и локализации боли.
Рис. 11. Современные представления о боли: ноцицептивная (НС) и антиноцицептивная системы (АНС).
Однако итоговое восприятие боли в значительной степени зависит от активности АНС. АНС головного мозга играют ключевую роль в формировании боли и изменении реакции на боль. Очевидна их широкая представленность в головном мозге и включение в различные нейротрансмиттерные механизмы (норадреналин, серотонин, опиоиды, дофамин). АНС работают не изолированно, а, взаимодействуя между собой и с другими системами, они регулируют не только болевую чувствительность, но и сопряженные с болью вегетативные, моторные, нейроэндокринные, эмоциональные и поведенческие проявления боли. Это обстоятельство позволяет рассматривать их как важнейшую систему, определяющую не только характеристики болевого ощущения, но и его многообразные психофизиологические и поведенческие корреляты [3]. В зависимости от активности АНС боль может усиливаться или уменьшаться.
Препараты для лечения боли
Препараты для лечения боли назначают с учетом предполагаемых механизмов боли. Понимание механизмов формирования болевого синдрома позволяет проводить индивидуальный подбор лечения. При ноцицептивной боли с наилучшей стороны зарекомендовали себя нестероидные противовоспалительные препараты (НПВП) и опиоидные анальгетики. При нейропатической боли обоснованным является применение антидепрессантов, антиконвульсантов, местных анестетиков, а также блокаторов калиевых каналов.
Нестероидные противовоспалительные препараты
Если в патогенезе болевого синдрома ведущую роль играют механизмы воспаления, то наиболее целесообразно в этом случае применение НПВП. Их использование позволяет подавить синтез альгогенов в поврежденных тканях, что предотвращает развитие периферической и центральной сенситизации [26]. Помимо болеутоляющего эффекта препараты из группы НПВП оказывают противовоспалительное и жаропонижающее действие.
Современная классификация НПВП предполагает разделение этих средств на несколько групп, отличающихся селективностью в отношении ферментов циклооксигеназы 1 и 2 типа, которые участвуют в ряде физиологических и патологических процессов (рис. 12).
Рис. 12. Селективные и неселективные НПВП.
Считается, что противоболевой эффект препаратов из группы НПВП связан в основном с их влиянием на ЦОГ2, а желудочно-кишечные осложнения обусловлены их влиянием на ЦОГ1. Однако исследования последних лет обнаруживают и другие механизмы анальгетического действия некоторых препаратов из группы НПВП. Так, было показано, что диклофенак (Вольтарен) может оказывать противоболевое действие не только через ЦОГ-зависимые, но и другие периферические, а также центральные механизмы [15].
Местные анестетики
Ограничения поступления ноцицептивной информации в ЦНС можно достичь при применении различных местных анестетиков, которые могут не только предотвратить сенситизацию ноцицептивных нейронов, но и способствовать нормализации микроциркуляции в зоне повреждения, уменьшению воспаления и улучшению обмена веществ. Наряду с этим местные анестетики расслабляют поперечно-полосатую мускулатуру, устраняют патологическое напряжение мышц, которое является дополнительным источником боли [26].
К местным анестетикам относят вещества, вызывающие временную потерю чувствительности тканей в результате блокады проведения импульсов в нервных волокнах. Наибольшее распространение среди них получили лидокаин, новокаин, артикаин и бупивакаин. Механизм действия местных анестетиков связан с блокированием Na + -каналов на мембране нервных волокон и торможением генерации потенциалов действия.
Антиконвульсанты
Длительно существующее раздражение ноцицепторов или периферических нервов приводит к развитию периферической и центральной сенситизации (гипервозбудимости).
Существующие сегодня антиконвульсанты, применяемые для лечения боли, имеют различные точки приложения. Дифенин, карбамазепин, окскарбазепин, ламотриджин, вальпроаты, топиромат действуют главным образом, подавляя активность потенциал-зависимых натриевых каналов, предотвращая спонтанную генерацию эктопических разрядов в поврежденном нерве. Эффективность этих препаратов доказана у пациентов с тригеминальной невралгией, диабетической невропатией, фантомно-болевым синдромом.
Габапентин и прегабалин тормозят вход ионов кальция в пресинаптическую терминаль ноцицепторов, тем самым уменьшая выброс глутамата, что приводит к уменьшению возбудимости ноцицептивных нейронов спинного мозга (уменьшает центральную сенситизацию). Эти препараты также модулируют активность NMDA-рецепторов и снижают активность Na + -каналов.
Антидепрессанты
Антидепрессанты и препараты из группы опиоидов назначают с целью усиления антиноцицептивных влияний. При лечении болевых синдромов в основном используют препараты, механизм действия которых связан с блокадой обратного захвата моноаминов (серотонина и норадреналина) в ЦНС. Обезболивающий эффект антидепрессантов может быть частично обусловлен и непрямым анальгетическим действием, так как улучшение настроения благоприятно сказывается на оценке боли и уменьшает болевое восприятие. Кроме того, антидепрессанты потенцируют действие наркотических анальгетиков, повышая их сродство к опиоидным рецепторам [26].
Мышечные релаксанты
Мышечные релаксанты применяют в случаях, когда вклад в формирование боли вносит мышечный спазм. Следует отметить, что мышечные релаксанты оказывают воздействие на уровне спинного мозга, а не на уровне мышц.
В нашей стране для лечения болезненных мышечных спазмов используются тизанидин, баклофен, мидокалм, а также препараты из группы бензодиазепинов (диазепам). В последнее время с целью расслабления мышц в лечении миофасциальных болевых синдромов применяются инъекции ботулинотоксина типа А [22]. У представленных препаратов - разные точки приложения. Баклофен является агонистом ГАМК-рецепторов, ингибирует активность вставочных нейронов на спинальном уровне.
Толперизон блокирует Na + -и Ca 2+ -каналы интернейронов спинного мозга и уменьшает выброс болевых медиаторов в нейронах спинного мозга. Тизанидин относится к мышечным релаксантам центрального действия. Основная точка приложения его действия находится в спинном мозге. Стимулируя пресинаптические a2-рецепторы, он подавляет высвобождение возбуждающих аминокислот, которые стимулируют рецепторы к N-метил-D-аспартату (NMDA-рецепторы). Вследствие этого на уровне промежуточных нейронов спинного мозга происходит подавление полисинаптической передачи возбуждения. Поскольку именно этот механизм отвечает за избыточный мышечный тонус, то при его подавлении мышечный тонус снижается. В дополнение к миорелаксирующим свойствам, тизанидин оказывает также центральный умеренно выраженный анальгезирующий эффект.
Исходно тизанидин был разработан для лечения мышечного спазма при различных неврологических заболеваниях (при травматических повреждениях головного и спинного мозга, рассеянном склерозе, инсульте). Однако в скором времени после начала его применения были выявлены анальгетические свойства тизанидина. В настоящее время применение тизанидина в монотерапии и в комплексном лечении болевых синдромов получило широкое распространение [11].
Селективные активаторы нейрональных калиевых каналов (SNEPCO)
Принципиально новым классом препаратов для лечения болевых синдромов являются селективные активаторы нейрональных калиевых каналов - SNEPCO (Selective Neuronal Potassium Channel Opener), оказывающие воздействие на процессы сенситизации нейронов заднего рога за счет стабилизации мембранного потенциала покоя.
Первый представитель этого класса лекарственных средств - флупиртин (Катадолон), обладающий широким спектром ценных фармакологических свойств, выгодно отличающих его от других обезболивающих препаратов.
В последующих главах подробно изложены сведения о фармакологических свойствах и механизме действия Катадолона, представлены результаты исследований его эффективности и безопасности, рассказывается об опыте применения препарата в разных странах мира, даны рекомендации по применению Катадолона при различных болевых синдромах.
Механизмы возникновения абдоминальной боли
Информация только для специалистов в сфере медицины, фармации и здравоохранения!
Глава пятая карманных рекомендаций по
Болям в животе у ребенка - тактика педиатра
Тамразова О.Б.
Специализированное издание,
предназначенное для медицинских и фармацевтических работников.
• мышечной оболочке стенки полых органов,
• капсуле паренхиматозных органов,
• брыжейке,
• париетальной брюшине.
Висцеральная брюшина и большой сальник лишены болевой чувствительности. В соответствии с анатомией нервной системы брюшной полости различают три основных типа боли в животе:
1. Висцеральная (вегетативная) боль. Органы брюшной полости и прикрывающая их висцеральная брюшина снабжены сетью нервных окончаний, относящихся к системе чревных нервов. Веточки вегетативной нервной системы разветвляются и перекрывают друг друга, отсутствует четкое представительство органов брюшной полости в коре головного мозга. Болевые импульсы, возникающие во внутренних органах при их ишемии, перерастяжении, а также при усиленной перистальтике кишки в случае полной закупорки ее просвета распространяются по нервным волокнам автономной (вегетативной) нервной системы. Эта боль, как правило, нечетко локализована, чаще всего бывает диффузной, появляется приблизительно в средней части живота, возникает при раздражении висцеральной брюшины. Это связано с мультисегментарной иннервацией внутренних органов и небольшим количеством в них нервных окончаний по сравнению с кожей и мышцами. Чаще всего, указывая локализацию этой боли, пациенты проводят раскрытой ладонью циркулярно по всему животу или по большей его части. Висцеральная боль отмечается в эпигастральной, околопупочной областях или над лоном (рис. 7).
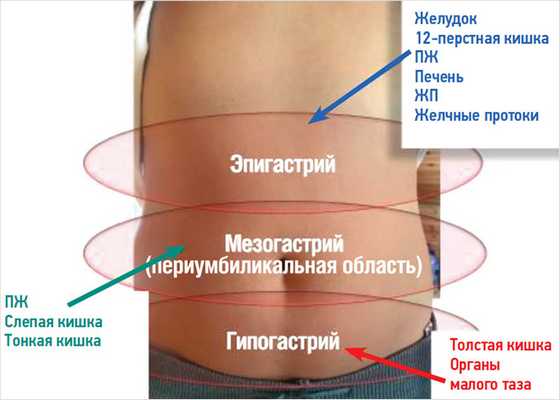
Рисунок 7. Проекция висцеральной боли
Рецепторы, воспринимающие висцеральную боль, реагируют на изменение внутриполостного давления в органе (спазм, растяжение полого органа, нарушение в немкровотока), а не на прямые раздражения (разрушение тканей и т. п.). Висцеральную боль нередко сопровождают вегетативные расстройства - побледнение или покраснение кожи, потливость, тошнота, рвота.
2. Отраженная боль представляет собой проявление рефлекторного механизма проведения висцеральной боли по чувствительным волокнам цереброспинальных нервов. Сегментарные анатомические взаимосвязи между автономной (вегетативной) нервной системой и спиноталамическими нервами часто являются причиной распространения и иррадиации висцеральной боли.
Боль далеко не всегда возникает в месте истинной локализации патологического процесса в брюшной полости. Нередко она иррадиирует за пределы живота. Например, при перфоративной язве желудка или двенадцатиперстной кишки, плеврите, гемоперитонеуме или поддиафрагмальном абсцессе может возникать раздражение диафрагмы. В результате этого болевые импульсы по диафрагмальным нервам передаются к четвертому шейному сегменту, а затем распространяются на области, иннервируемые C4, - верхнюю часть плеча и боковую поверхность шеи. Часто такая иррадиация боли помогает поставить правильный диагноз. При этом в определенных участках кожи возникает гиперчувствительность и повышенная болевая восприимчивость (зоны Захарьина - Геда). Отраженные боли четко локализованы, могут ощущаться поверхностно на коже и более глубоко в мышцах. Иррадиацию боли можно спутать с миграцией, которая также характерна для некоторых заболеваний органов живота. Различие состоит в том, что при миграции боль возникает в одном месте, затем постепенно проходит и с новой силой появляется уже в другом месте. При иррадиации боль, возникшая в каком-либо месте, сохраняется умеренной по интенсивности, и при этом вторично возникшая в другом месте боль, как правило, менее интенсивна.
Классическим примером является иррадиация боли в левое плечо при раздражении диафрагмы и скулу и надбровное пространство при патологии билиарной системы (рис. 8).
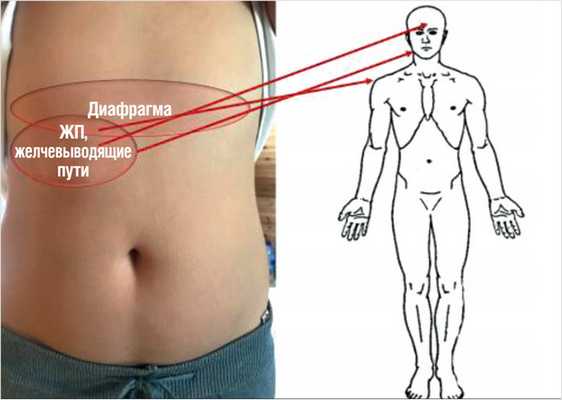
Рисунок 8. Схема иррадиации боли при патологии диафрагмы и билиарного тракта
3. Париетальная (соматическая) боль. Париетальная брюшина снабжена соматическими афферентными нервами, что позволяет точно локализовать возникающий в области нервных окончаний воспалительный процесс. Париетальная боль связана со структурными нарушениями в стенке пораженного органа или в париетальной брюшине, имеет локализованный характер, может сопровождаться гиперестезией кожи, локальной мышечной защитой. Она усиливается при физической нагрузке (хождении, прыжках), вибрации в транспорте, резком сгибании или разгибании туловища, при кашле. Болевые импульсы, берущие начало в брюшной полости, передаются как через автономные нервные волокна (вегетативную нервную систему), так и через передние и боковые спиноталамические тракты. Болевые импульсы, которые проводятся через спиноталамические тракты, характеризуются четкой локализацией. Пациенты, как правило, могут показать конкретную точку одним или двумя пальцами. Эта боль возникает при развитии внутрибрюшного воспалительного процесса, который распространяется на париетальную брюшину (рис. 9).
В табл. 5, 6 представлены основные заболевания, сопровождающиеся возникновением висцеральной или париетальной боли, а также основные отличительные признаки данных видов боли.
Таблица 5. Характер боли, по изменению интенсивности
На восприятие боли могут влиять личностные особенности больного: порог болевой чувствительности снижается при тревоге, страхе, гневе, печали, усталости, бессоннице и повышается при устранении отрицательных эмоций.
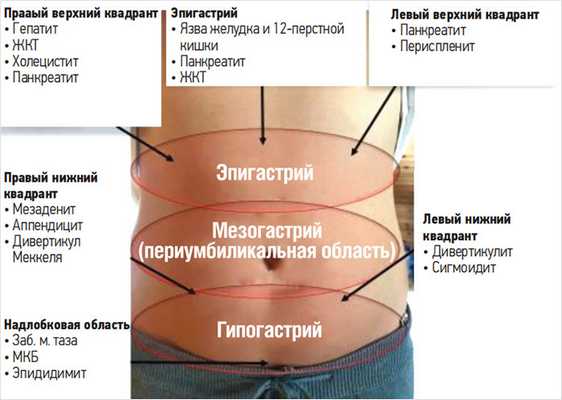
Рисунок 9. Проекция париетальной боли
Таблица 6. Основные причины болей в брюшной полости
Общие причины боли в животе
1. Нарушение моторики - спазм гладкой мускулатуры полых органов и выводных протоков (пищевода, желудка, кишечника, желчного пузыря, желчевыводящих путей, протока поджелудочной железы), гиперперистальтика кишечника.
2. Растяжение стенок полых органов и натяжение их связочного аппарата, натяжение капсулы органа.
3. Структурные (воспалительные) повреждения органов брюшной полости (язвообразование, гастриты, опухоли и т. д.).
4. Гипоксия и ишемия органов брюшной полости (врожденное стенозирование ветвей брюшной аорты, тромбозы и эмболии мезентериальных сосудов, ущемленная грыжа, инвагинация).
5. Перфорация и пенетрация с переходом процесса на брюшину (париетальная боль).
Абдоминальные боли: функциональные и органические
Абдоминальная боль на фоне функциональных нарушений представляет собой симптомо
комплексы со стороны различных органов пищеварительной системы, возникающие при отсутствии органической патологии органов ЖКТ (табл. 7). Согласно литературным данным, примерно у 90% детей с абдоминальной болью органического заболевания не выявляется при первичном обследовании, и только в 10% случаев удается установить органическую причину болевого синдрома.
В соответствии с Римскими критериями выделяются общие признаки функциональных расстройств ЖКТ, независимо от уровня поражения:
• продолжительность основных симптомов не менее 1 раза в неделю на протяжении 3 мес. в течение последних 6 мес.,
• отсутствие органической патологии органов ЖКТ,
• множественный характер жалоб при общем хорошем состоянии пациента и благоприятное течение заболевания без заметного прогрессирования,
• значение психосоциальных факторов и нарушений нейрогуморальной регуляции в формировании основных симптомов.
В 1994 г. D.A. Drossman определилфункциональные нарушения ЖКТ как «разнообразную комбинацию гастроинтестинальных симптомов без структурных и биохимических нарушений», что согласуется с Римскими критериями II. В 2016 г. разработаны обновленные Римские критерии IV, согласно которым функциональные заболевания ЖКТ представляют собой группу расстройств, характеризующихся нарушением взаимодействия ЦНС (головной мозг) и периферического звена нервной системы, обеспечивающего деятельность органов ЖКТ (ось «головной мозг - ЖКТ»)

Таблица 7. Абдоминальная боль функционального характера
Другие главы из книги:
- Глава 2.Подходы к организации питания беременных женщин и кормящих матерей
- Глава 3. Питание здорового ребенка первого года жизни
- Глава 4.Острые респираторные вирусные инфекции у детей
- Глава 5.Прорезывание зубов у детей
- Глава 6.Современные аспекты вакцинопрофилактики у детей
- Глава 7.Бронхиальная астма у детей
- Глава 8.Аллергический ренит у детей
- Глава 9.Заболевания системы пищеварения у детей: подходы к диагностике и рациональная терапия
- Глава 10.Заболевания ЛОР-ОРГАНОВ у детей
- Глава 11.Современный взгляд на микробиомсберегающую терапию при применении антибиотиков у детей с острыми респираторными инфекциями: стремление к совершенству
- Глава 12.Пищевая аллергия у детей: причины, симптомы, лечение
- Глава 13.Возможности элиминационно-ирригационной терапии в лечении и профилактике заболеваний верхних дыхательных путей
© Все права защищены. Никакая часть данной книги не может быть воспроизведена в какой бы то ни было форме без письменного разрешения владельцев авторских прав.
Механизмы боли
Наиболее распространенным и актуальным определением боли, разработанным Международной ассоциацией по изучению боли (IASP), является определение, согласно которому «боль - это неприятное сенсорное и эмоциональное переживание, связанное с острым или потенциальным повреждением ткани, или описанное в терминах такого повреждения, или и то, и другое». Хотя для объяснения физиологических основ боли было предложено несколько теоретических схем, ни одна теория не смогла полностью охватить все аспекты восприятия боли.
Четырьмя наиболее общепризнанными теориями восприятия боли являются теория специфичности, интенсивности, теория паттернов и теории воротного контроля. Однако в 1968 году Melzack и Casey описали боль как многомерную, где измерения не являются независимыми, а скорее интерактивными. Эти измерения включают сенсорно-дискриминативный, аффективно-мотивационный и когнитивно-оценочный компоненты.
Определение наиболее вероятного механизма (механизмов) боли имеет крайне важное значение во время клинической оценки, поскольку это может служить руководством для определения наиболее подходящего лечения. Таким образом, критерии, на которых клиницисты могут основывать свои решения в отношении соответствующих классификаций, были установлены с помощью экспертного консенсусного перечня клинических показателей.
Друзья, 30 ноября — 1 декабря в Москве состоится семинар от авторов легендарного бестселлера Explain Pain. Узнать подробнее…
Приведенные ниже таблицы были взяты у Smart и соавт. (2010), которые классифицировали болевые механизмы как «ноцицептивные», «периферические невропатические» и «центральные», и выделили как субъективные, так и объективные клинические показатели для каждого механизма. Таким образом, эти таблицы являются дополнением к любым общепринятым данным и служат основой для принятия клинических решений при определении наиболее подходящего механизма (механизмов) боли.
Кроме того, знание факторов, которые могут изменить боль и восприятие боли, может помочь в определении имеющегося у пациента механизма боли. Ниже перечислены факторы риска, которые могут изменить боль и восприятие боли.
- Биомедецинский.
- Психосоциальный или поведенческий.
- Социальный и экономический.
- Профессиональный /связанный с работой.
Механизм ноцицептивной боли
Ноцицептивная боль связана с активацией периферических окончаний первичных афферентных нейронов в ответ на вредные химические (воспалительные), механические или ишемические стимулы.
Субъективные показатели
- Четкий, пропорциональная механическая/анатомическая природа провоцирующих и облегчающих факторов.
- Боль, связанная и пропорциональная травме, или патологическому процессу (воспалительный ноцицептивный), или двигательной / постуральной дисфункции (ишемический ноцицептивный).
- Боль, локализованная в области травмы/дисфункции (с/без отраженного компонента).
- Обычно быстрое уменьшение/исчезновение боли в соответствии с ожидаемым временем заживления/восстановления ткани.
- Эффективность нестероидных противовоспалительных препаратов/анальгетиков.
- Периодический (резкий) характер боли, что может быть связано с движениями/механической нагрузкой; может быть постоянной тупой ноющей или пульсирующей.
- Боль в сочетании с другими симптомами воспаления (например, отек, покраснение, жар).
- Отсутствие неврологических симптомов.
- Боль, которая началась недавно.
- Четкая суточная или 24-часовая картина симптомов (т.е. утренняя скованность).
- Отсутствие или незначительная связь с неадаптивными психосоциальными факторами (например, негативными эмоциями, низкой самоэффективностью).
Объективные показатели
- Четкий, последовательный и пропорциональный механический/анатомический характер воспроизведения боли при движении/механическом тестировании тканей-мишеней.
- Локализованная боль при пальпации.
- Отсутствие или ожидаемое/ пропорциональное соотношение результатов (первичной и/или вторичной) гипералгезии и/или аллодинии.
- Анталгические (то есть обезболивающие) позы/движения.
- Наличие других кардинальных признаков воспаления (отек, покраснение, жар).
- Отсутствие неврологических признаков: отрицательные нейродинамические тесты (например, тест подъема прямой ноги, тест натяжения плечевого сплетения, тест Тинеля).
- Отсутствие дезадаптивного болевого поведения.
Механизм периферической нейропатической боли
Периферическая невропатическая боль инициируется или вызывается первичным поражением или дисфункцией периферической нервной системы (ПНС) и включает в себя многочисленные патофизиологические механизмы, связанные с измененным функционированием нерва и его реактивностью. Механизмы включают в себя повышенную возбудимость и аномальную генерацию импульсов, а также повышенную механическую, термическую и химическую чувствительность.
- Провоцирование боли/симптомов с помощью механических/двигательных тестов (т. е. активных/пассивных, нейродинамических), которые перемещают/нагружают/сжимают нервную ткань.
- Провокация боли/симптомов при пальпации соответствующих нервов.
- Положительные неврологические результаты (включая измененные рефлексы, ощущения и мышечную силу в дерматомальном/миотомическом или кожном распределении).
- Анталгическое положение пораженной конечности/части тела.
- Положительные результаты гипералгезии (первичной или вторичной) и/или аллодинии и/или гиперпатии в пределах зоны распределения боли.
- Отсроченная боль в ответ на движение/механическое тестирование.
- Клинические исследования, подтверждающие периферический невропатический характер (например, МРТ, КТ, тесты нервной проводимости).
- Признаки вегетативной дисфункции (такие как трофические изменения).
Примечание: вспомогательные клинические исследования (например, МРТ) могут не понадобиться для того, чтобы врачи-клиницисты могли классифицировать боль, как «периферическую невропатическую».
Механизм центральной боли
Центральная боль — это боль, инициированная или являющаяся следствием первичного поражения или дисфункции центральной нервной системы (ЦНС).
- Непропорциональная, непоследовательная, немеханическая/неанатомическая картина провоцирования боли в ответ на движение/механическое тестирование.
- Положительные результаты гипералгезии (первичной, вторичной) и/или аллодинии и/или гиперпатии в пределах распределения боли.
- Диффузные/неанатомические области боли/болезненности при пальпации.
- Позитивная идентификация различных психосоциальных факторов (например, катастрофизация, избегание, дистресс).
- Отсутствие признаков повреждения ткани/патологии.
- Отсроченная боль в ответ на движение/механическое испытание.
- Атрофии мышц.
- Признаки дисфункции вегетативной нервной системы (изменение цвета кожи, потливость).
- Анталгические позы/движения.
Клинические примеры
Следующие клинические примеры дополнят приведенную выше информацию о вероятных механизмах боли.
Случай № 1
Случай № 2
Пациент “B” — 30-летний мужчина, бухгалтер. История текущей жалобы — внезапное начало - неспособность повернуть и наклонить шею вправо, что возникло 2 дня назад. При этом у пациента голова находится в положении небольшого поворота и наклона влево. Пациент сообщает о низком уровне боли (ВАШ 2-3/10), но только в момент поворота головы вправо, при этом движение «застревает». Пациент отрицает какое-либо онемение, покалывание или жгучую боль, но НПВС неэффективны. Также известно, что тепло и мягкий массаж уменьшают симптомы. Объективный осмотр указывают на то, что пассивные физиологические и добавочные движения вправо имеют меньшую амплитуду. Все другие движения шейного отдела в пределах нормы. Каков доминирующий механизм боли?
Случай № 3
Пациент «С» — 25-летняя студентка. История текущей жалобы — дорожно-транспортное происшествие около месяца назад по пути на учебу — пациентка получила удар сзади. С тех пор пациентка была на 6 сеансах физиотерапии без каких-либо улучшений в плане постоянных болей в шее. Боль локализуется слева на уровне С2-7 (ВАШ 3-9/10) и варьируется от тупой боли до острой боли в зависимости от положения шеи. Боль усугубляется при сидении и ходьбе в течение более 30 минут и при поворотах влево. Ночью при поворотах в постели пациентка может просыпаться от боли, кашель/чихание не усиливают боль. Боль иногда уменьшается при воздействии тепла и растяжки. НПВС неэффективны. Результаты инструментальной диагностики без особенностей. Общее состояние здоровья в целом хорошее. Незначительные растяжения при занятиях спортом, что никогда не требовало лечения. Пациентка высказывает озабоченность по поводу вождения (ни разу не садилась за руль после аварии). Также пациентка сообщила о повышении чувствительности в нижних конечностях. Каков ведущий механизм боли?
Читайте также:
- УЗИ при почечноклеточном раке почки
- Характеристика инфузионно-трансфузионных средств. Общие принципы компонентной гемотерапии
- Миоклонус-эпилепсия MERRF: причины, диагностика, лечение
- Трахеотомия и техника ее выполнения при стенозе гортани и трахеи
- Гетерогенность популяций в эпидемиологии. Устойчивость паразитарной системы.
