Болезнь Помпе. Кардиомиопатии при врожденном гипо- и гипертиреоидизме.
Добавил пользователь Skiper Обновлено: 21.01.2026
Вторичная кардиомиопатия - структурные и функциональные изменения сердечной мышцы, возникающие вследствие основного первичного заболевания. К симптомам вторичной кардиомиопатии относятся одышка, головокружение, боли в грудной клетке, нарушения ритма, слабость. Диагностика вторичной кардиомиопатии включает проведение ЭКГ, эхокардиографии, рентгенографии органов грудной клетки, биохимического исследования крови. Патогенетическое лечение вторичной кардиомиопатии заключается в воздействии на метаболические процессы в миокарде; симптоматическое - в устранении нарушений ритма и проводимости, сердечной недостаточности.
Общие сведения
Кардиомиопатии - заболевания, сходные клинически, но различные по этиологии и патогенезу, характеризующиеся дистрофическими изменениями сердечной мышцы. Понятие «кардиомиопатия» исключает повреждения миокарда, возникающие вследствие ИБС, артериальной гипертензии, легочной гипертензии, клапанных пороков сердца и пр.
Первичные (идиопатические) кардиомиопатии объединяет преимущественное или изолированное поражение миокарда некоронарного и невоспалительного генеза, в основе которого лежит недостаточность сократительной функции сердечной мышцы в связи с ее дистрофией. Первичные кардиомиопатии могут иметь врожденное (генетическое, наследственное), приобретенное или смешанное происхождение. К первичным (идиопатическим) кардиомиопатиям относят гипертрофическую (констриктивную, субаортальный стеноз), дилатационную (конгестивную, застойную), рестриктивную (эндомиокардиальный фиброз) кардиомиопатии и аритмогенную дисплазию правого желудочка (болезнь Фонтана).
Термином «вторичные кардиомиопатии» (симптоматические кардиомиопатии, миокардиодистрофия, дистрофия миокарда) в кардиологии объединяют гетерогенную группу специфических поражений миокарда различной этиологии, обусловленных биохимическими или физико-химическими нарушениями метаболизма. В отличие от первичной кардиомиопатии, этиология которой не установлена, вторичная кардиомиопатия всегда является следствием генерализованных системных заболеваний других органов или патологических состояний.
Причины вторичной кардиомиопатии
Причины вторичных кардиомиопатий могут быть разнообразны. Вторичные кардиомиопатии могут встречаться при уремии, интоксикациях алкоголем, лекарственными препаратами, этиленгликолем, солями тяжелых металлов и др. В некоторых случаях к развитию вторичной кардиомиопатии приводят инфекции: вирусные заболевания, тифы, трихинеллез, трипаносомоз; заболевания обмена - гиперпаратиреоз, тиреотоксикоз, сахарный диабет, подагра, амилоидоз, нарушения электролитного обмена, авитаминоз и пр. Встречаются вторичные кардиомиопатии, обусловленные патологией органов пищеварения (панкреатитом, циррозом печени, синдроме мальабсорбции).
Дистрофия миокарда может возникать при системных нервно-мышечных заболеваниях, таких, как миопатия, миастения. К вторичным кардиомиопатиям относятся такие редкие формы, как амилоидоз сердца, гемохроматоз сердца, ксантоматоз, гликогеноз.
При вторичной кардиомиопатии развивается диффузное равномерное поражение миокарда. Первичная роль в цепи изменений принадлежит поражению ферментных систем, участвующих во внутриклеточном метаболизме. Нарушение обменных процессов в сердечной мышце приводит к дисфункции внутриклеточных структур миофибрилл и ослаблению сократительной активности миокарда. На гистохимическом уровне при вторичной кардиомиопатии имеет место метаболическая нестабильность миокарда.
Классификация вторичной кардиомиопатии
С учетом повреждающих факторов выделяют следующие клинические формы вторичной кардиомиопатии:
- алкогольная кардиомиопатия - обусловлена повреждающим воздействием этанола на клетки миокарда. Чаще встречается у мужчин, злоупотребляющих алкоголем. При вторичной алкогольной кардиомиопатии развивается жировая дистрофия миокарда, вследствие чего макроскопически сердечная мышца приобретает желтоватый оттенок;
- токсические и медикаментозные кардиомиопатии - связаны с повреждением миокарда такими элементами, как кадмий, литий, мышьяк, кобальт, изопротиренол. Следствием токсического влияния являются возникающие в сердечной мышце микроинфаркты и последующая воспалительная реакция;
- метаболические кардиомиопатии - возникают при нарушениях обменных процессов в миокарде, обусловленных гипертиреозом, гипотиреозом, гиперкалиемией (болезнь Аддисона, сахарный диабет), гипокалиемией (заболевания почек, болезнь Иценко-Кушинга, частые поносы и рвоты), гликогенозом, недостаточностью тиаминов и др. витаминов;
- вторичные кардиомиопатии, ассоциированные с заболеваниями органов пищеварения (синдромом нарушенного всасывания, панкреатитом, циррозом печени и т. д.);
- вторичные кардиомиопатии, ассоциированные с заболеваниями соединительной ткани (ревматоидным артритом, узелковым периартериитом, системной красной волчанкой, склеродермией, дерматомиозитом, псориазом и др.);
- вторичные кардиомиопатии, ассоциированные с нервно-мышечными заболеваниями (миотонической дистрофией, мышечной дистрофией, атаксией Фридрейха и др.);
- вторичные кардиомиопатии, ассоциированные с мукополисахаридозом и дислипидозом (синдром Хантера, болезнь Сандхоффа, болезнь Андерсона-Фабри);
- вторичные кардиомиопатии, ассоциированные с вирусными, бактериальными, паразитарными инфекциями;
- вторичные кардиомиопатии, ассоциированные с инфильтрацией миокарда при карциноматозе, лейкемии, саркоидозе;
- климактерическая (дизовариальная) кардиомиопатия - развивается у женщин в период климакса.
Симптомы вторичной кардиомиопатии
Клинические проявления вторичной кардиомиопатии связаны с нарушением сократительной способности миокарда. При этом отмечаются разлитые ноющие боли в области сердца, не зависящие от физической нагрузки. Ангинозные боли не сопровождаются характерной для ИБС иррадиацией и проходят самостоятельно, без приема коронаролитиков. Со временем присоединяются и нарастают признаки сердечной недостаточности - одышка, периферические отеки. Характерны слабость, головокружение, тахикардия, нарушения ритма сердца (экстрасистолия, мерцательная аритмия).
Симптоматика вторичной кардиомиопатии развивается на фоне клинической картины основного заболевания. Осложнения вторичных кардиомиопатий включают хроническую сердечно-сосудистую недостаточность, тромбоэмболический синдром, внезапную смерть вследствие фибрилляции желудочков (при алкогольной кардиомиопатии).
Диагностика вторичной кардиомиопатии
Вторичная кардиомиопатия всегда является лишь дополнением к основному диагнозу. Распознавание вторичной кардиомиопатии осуществляется на основании данных электрокардиографии, ритмокардиографии, эхокардиографии, рентгенографии органов грудной клетки, биохимического анализа крови.
ЭКГ-признаки вторичной кардиомиопатии проявляются, главным образом, снижением, сглаживанием или отрицательным значением зубца Т. Отчетливая связь между изменениями ЭКГ с выраженностью кардиалгического синдрома не прослеживается. При проведении велоэргометрии толерантность к физической нагрузке снижена, однако признаки явной коронарной недостаточности также отсутствуют. Рентгенологическое и электрокардиографическое исследование обнаруживают увеличение границ и расширение полостей сердца.
Биохимические исследования крови могут включать определение содержания микроэлементов, уровня глюкозы, липопротеидов, электролитов, гормонов щитовидной железы, катехоламинов, маркеров некроза миокарда, и др. Для верификации диагноза вторичной кардиомиопатии также используются фонокардиография, ритмография, холтеровское мониторирование, МРТ, сцинтиграфия миокарда с таллием-201, биопсия миокарда и др.
Дифференциальная диагностика вторичной кардиомиопатии проводится с миокардитом, ишемической болезнью сердца, атеросклеротическим и миокардитическим кардиосклерозом.
Лечение вторичной кардиомиопатии
Ввиду полиэтиологичности патологии и многообразия клинических форм вторичной кардиомиопатии, к ее лечению целесообразно привлекать специалистов различных профилей - кардиологов, гинекологов, инфекционистов, ревматологов. Лечения вторичной кардиомиопатии направлено на улучшение метаболических процессов, максимальное увеличение сердечного выброса и предотвращение дальнейшего прогрессирования снижения сократительной способности сердечной мышцы.
С целью снижения нагрузки на сердце исключаются прием алкоголя, курение, интенсивные физические нагрузки. При ярко выраженных клинических проявлениях вторичной кардиомиопатии назначаются β-адреноблакаторы, антиаритмические средства, антикоагулянты, соли калия, витамины группы В, сердечные гликозиды. Целесообразно применение активаторов миокардиального метаболизма (инозина, АТФ). Улучшению функции миокарда и повышению толерантности к нагрузкам способствует бальнеотерапия, умеренные занятия лечебной физкультурой.
При жизнеугрожающих нарушениях ритма показана имплантация электрокардиостимулятора или кардиовертер-дефибриллятора. Тяжелые варианты вторичной кардиомиопатии, не поддающиеся медикаментозной коррекции, следует рассматривать как основание для трансплантации сердца.
Прогноз и профилактика вторичной кардиомиопатии
Трудоспособность больных с вторичной кардиомиопатией, как правило, нарушается в связи с основным заболеванием, а при развитии сердечной недостаточности - и вследствие поражения миокарда. Прогноз вторичной кардиомиопатии во многом определяется течением первичного заболевания и развитием осложнений со стороны сердца.
Профилактика вторичной кардиомиопатии заключается в предупреждении поражения миокарда при заболеваниях, часто сопровождающихся дистрофическими изменениями сердечной мышцы. Раннее и адекватное лечение данных заболеваний, применение средств, улучшающих метаболические процессы в миокарде, позволяют предупредить или отсрочить поражение сердца.
Кардиомиопатия у детей
Кардиомиопатия у детей — это полиэтиологическое невоспалительное заболевание миокарда, которое проявляется структурными изменениями сердечной мышцы и нарушениями кровообращения. Патофизиологически различают гипертрофические, рестриктивные и дилатационные варианты болезни. Основные симптомы: одышка и синкопальные состояния, боль в сердце, отеки и другие признаки сердечной недостаточности. С диагностической целью применяются инструментальные методы (ЭКГ, ЭхоКГ, рентгенография грудной клетки), общеклинические и биохимические анализы. План терапии кардиомиопатий состоит из лечебно-охранительного режима, кардиотропных медикаментов и кардиохирургической коррекции.
МКБ-10
Кардиомиопатия (КМП) как проявление некоронарогенной патологии миокарда остается одной из наиболее сложных проблем в педиатрии и детской кардиологии. Частота встречаемости первичных форм составляет от 0,65 до 1,24 случаев на 100 тыс. детей. Такая неоднозначность эпидемиологических данных вызвана трудностями прижизненной и посмертной диагностики. Среди педиатрических пациентов, погибших от синдрома внезапной сердечной смерти, типичные для кардиомиопатий изменения в сердечной мышце находят у 20-40%.
Причины
Большое значение в этиологической структуре имеют наследственные факторы, поскольку до 60% случаев гипертрофических кардиомиопатий обусловлены генетическими мутациями с аутосомно-доминантным типом наследования. В отдельную группу выделяют первичные детские кардиомиопатии, причины которых пока не установлены. Вторичные формы патологии у детей имеют полиэтиологический характер. Они развиваются под влиянием следующих факторов:
- Инфекции. Повреждения миокарда вызываются вирусными возбудителями (Коксаки, герпесвирусы, группа респираторных вирусов). Нередко проявления болезни манифестируют во время ОРВИ или пневмонии. Провоцирующими факторами могут стать бактериальные, грибковые и протозойные инвазии.
- Метаболические нарушения. Патологии часто формируются у детей с эндокринными расстройствами: микседемой, тиреотоксикозом, сахарным диабетом и ожирением. Реже причиной кардиомиопатий выступают болезни накопления (амилоидоз, мукополисахаридоз, гликогеноз).
- Дефицитные состояния. У детей частым этиологическим фактором является неадекватное поступление питательных веществ и витаминов, которое приводит к белково-энергетической недостаточности. Дефицит микроэлементов (калия, магния, кальция) усугубляет возникшие нарушения.
- Коллагенозы. Аутоиммунные процессы при системных поражениях соединительной ткани сопровождаются структурными перестройками миокарда и формированием КМП. Это наблюдается при дерматомиозите, склеродермии, системной красной волчанке.
- Нейромышечные заболевания. Кардиомиопатии — типичное проявление миастении, мышечных дистрофий Дюшенна, Беккера. Иногда миокардиальные патологии встречаются при атаксии Фридрейха, синдроме Нунана.
- Токсины. Повреждающим влиянием на сердечную мышцу обладают соли тяжелых металлов, антрациклиновые антибиотики, ионизирующая радиация. У подростков провоцирующим фактором может выступать ранняя алкоголизация и прием наркотических соединений.
Патогенез
Кардиомиопатии являются некоронарогенными патологиями, их развитие не связано с нарушениями кровоснабжения миокарда. В формировании структурно-функциональных изменений мышечных волокон сердца играют роль нарушения иннервации тканей, расстройства образования и утилизации энергии в клетках. Снижение энергообразования сопровождается выбросом реактивных молекул, повреждением клеточных мембран и активацией свободнорадикального перекисного окисления.
Развитие первичных форм кардиомиопатии в первую очередь связывают с расстройствами на молекулярном уровне, нарушениями экспрессии генов, которые кодируют структурные белки миокарда или регулируют его сократительную функцию. Независимо от патогенетических особенностей, при прогрессировании заболевания миокард не способен к адекватному сокращению и сердечному выбросу, в результате чего у детей формируется систолическая или диастолическая дисфункция.
Патоморфологически для различных вариантов кардиомиопатий характерны специфические изменения. Гипертрофическая форма проявляется утолщением стенки левого желудочка, межжелудочковой перегородки, реже — правого желудочка с хаотическим расположением мускульных волокон. У страдающих дилатационной кардиомиопатией расширяются сердечные полости. При рестриктивной КМП поражаются эндокард и миокард, вследствие чего ограничивается подвижность стенок сердца.
Классификация
К детской кардиологии используется деление кардиомиопатий по патофизиологическому принципу на 3 формы: гипертрофическую, рестриктивную и дилатационную, которые отличаются по клиническим критериям и инструментальным данным. По времени развития бывают врожденные и приобретенные формы болезни. В 1996 г. ВОЗ была принята расширенная классификация по этиологическому принципу, в которой выделены следующие кардиомиопатии:
- Идиопатические (неизвестного генеза) — включают вышеназванные 3 вида КМП, а также аритмогенную дисплазию правого желудочка.
- Специфические (возникающие при соматических заболеваниях) — инфекционные, метаболические, кардиомиопатии при системных болезнях соединительной ткани и нейромышечных патологиях.
- Неклассифицируемые повреждения миокарда — разнородная группа нозологических форм, которая включает фиброэластоз, идиопатический миокардит Фридлера.
Симптомы кардиомиопатии у детей
Дилатационная кардиомиопатия
Заболевание характеризуется бессимптомным началом. Постепенно у ребенка нарастают признаки астенизации: повышенная утомляемость, беспричинная слабость, склонность к дурноте и обморокам при нагрузках или в жарких помещениях. Пациент может жаловаться на перебои в работе сердца, ощущение замирания или сильного сердцебиения. При дилатационном варианте кардиомиопатии дети отстают в физическом и психическом развитии, у школьников снижается успеваемость.
При усугублении гемодинамических нарушений возникают симптомы сердечной недостаточности (СН). У детей появляется одышка, синюшность кожи пальцев рук и ног, возможны отеки нижних конечностей, усиливающиеся к вечеру. При декомпенсированной форме наблюдается увеличение живота из-за гепатомегалии и асцита, влажные хрипы в легких, сильные боли в области сердца.
Гипертрофическая кардиомиопатия
При этой форме патологии выделяют 2 варианта течения: бессимптомное, когда диагноз случайно устанавливается в ходе инструментального обследования, и манифестное. Во втором случае ребенок испытывает регулярные болевые ощущения в сердце, приступы головокружения и слабости, нередко заканчивающиеся синкопальным состоянием. О нарушениях кровообращения свидетельствуют одышка, отеки на ногах, акроцианоз.
Расстройства кровоснабжения органов ЖКТ сопровождаются диспепсическими симптомами, особенно у младенцев до года, что проявляется учащением стула до 10 раз в сутки. У детей любого возраста бывают поносы, боли в животе, рвота. При длительно недиагностированной болезни возможно появление запоров, которые вызваны ишемическим колитом.
Рестриктивная кардиомиопатия
Для этой формы заболевания характерна плохая переносимость физической активности, повышенная слабость и астенизация, которые проявляются с раннего возраста. Одышка беспокоит не только при активности, но и в покое. Отличительная особенность рестриктивной кардиомиопатии — отсутствие болей в сердце и обмороков, в отличие от других форм, для которых типичны синкопе. У детей рано определяются признаки право- и левожелудочковой недостаточности.
Осложнения
При любом виде кардиомиопатии у детей возникает тяжелая сердечная недостаточность, которая неуклонно прогрессирует без лечения. Гемодинамические расстройства ассоциированы с ишемией и поражением всех внутренних органов, нарушениями интеллектуального развития. Зачастую на фоне КМП формируются аритмии — пароксизмальная тахикардия, желудочковая экстрасистолия.
Кардиомиопатии относятся к жизнеугрожающим заболеваниям. Около 40% больных на протяжении 2 лет от момента подтверждения диагноза переживают декомпенсацию состояния, что требует от врачей неотложной хирургической коррекции патологии. При ранней антенатальной диагностике прерывают до 13% беременностей, если порок несовместим с жизнью. До 65% плодов с тяжелыми врожденными КМП погибают в перинатальном периоде.
Диагностика
Детский кардиолог получает ценную информацию при пальпации (изменение площади и силы верхушечного толчка), перкуссии (расширение границ сердечной тупости), аускультации (появление патологических шумов, акцентов тонов). По физикальным данным специалист не может поставить окончательный диагноз, поэтому назначается план комплексной диагностики, включающий:
- ЭКГ. На кардиограмме заметны признаки гипертрофии одного или обоих желудочков, проявления субэндокардиальной ишемии, патологические расширения или инверсии зубцов. Характерна полиморфность данных ЭКГ у детей, что зависит от формы кардиомиопатии, степени ее тяжести.
- УЗИ сердца. Ультразвуковая визуализация информативна для выявления утолщения стенки миокарда (при гипертрофической КМП), расширения камер сердца (при дилатационной форме), фиброза и ограничения подвижности (при рестриктивном варианте). ЭхоКГ используется для диагностики СН и степени нарушений гемодинамики.
- Рентгенография ОГК. Рентгенограмма в двух проекциях необходима для визуализации размеров и конфигурации сердца, определения застойных явлений в легких. По показания проводится вентрикулография — инвазивное рентгенологическое исследование для детального осмотра анатомии полостей сердца.
- Лабораторные анализы. В общеклиническом исследовании у детей могут быть признаки сгущения крови. В результатах биохимического анализа врач изучает протеинограмму, уровни основных электролитов, показатели печеночных проб (билирубин, АСТ и АЛТ, тимоловая проба) и количество азотсодержащих молекул.
- Миокардиальные маркеры. Для исключения острой кардиопатологии необходимо измерить уровни КФК-МВ, миоглобина и тропонина, кардиоспецифических фракций ЛДГ. При подозрении на активный воспалительный процесс рекомендована оценка острофазовых показателей.
Лечение кардиомиопатии у детей
Консервативная терапия
Для стабилизации состояния ребенка с кардиомиопатией прежде всего необходимы немедикаментозные методы. В диету добавляют продукты с высоким содержанием кальция и калия, исключают жирные блюда и концентрированные бульоны. При недостаточности кровообращения IIA и выше необходимо ограничить употребление жидкости для уменьшения отеков. Грудным детям рекомендуют лечебные смеси, чтобы устранить расстройства пищеварения.
Объем двигательной активности подбирают с учетом состояния. При ухудшении клинической картины следует соблюдать постельный или полупостельный режим. После исчезновения отеков и других проявлений сердечной недостаточности двигательную активность расширяют до общего или палатного режима. Для снижения физических нагрузок грудничков могут временно переводить на кормление сцеженным молоком с ложечки или зондовое питание.
Медикаментозная терапия при кардиомиопатиях направлена на поддержание нормальной гемодинамики, ликвидацию симптомов, улучшение качества жизни ребенка. Этиотропное лечение не разработано. При вторичных формах важную роль играет диагностика и терапия основного заболевания. В протоколах лечения кардиомиопатии у детей используются:
- при гипертрофической форме — бета-адреноблокаторы, антагонисты кальция, ингибиторы АПФ;
- при дилатационной КМП — блокаторы рецепторов ангиотензина II, антиаритмические препараты, антиагреганты;
- при рестриктивной кардиомиопатии — тиазидные диуретики, бета-адреноблокаторы, иногда назначаются сердечные гликозиды.
Хирургическое лечение
Кардиохирургические операции показаны при тяжелой степени сердечной недостаточности, выраженном аритмическом и тромбоэмболическом синдроме, отсутствии эффекта от назначенной медикаментозной терапии. Для устранения СН имплантируют электрокардиостимуляторы с функцией кардиовертера-дефибриллятора. Поддержание кровообращения проводят путем установки механического желудочка. Перспективным направлением является трансплантация сердца.
Прогноз и профилактика
Кардиомиопатия — тяжелая прогрессирующая болезнь, которая имеет высокий риск летального исхода в течение 5 лет от постановки диагноза. Однако современные лечебные схемы и развитие детской кардиохирургии значительно повышают шансы ребенка на продление жизни и улучшение ее качества. Меры по специфической профилактике кардиомиопатий не разработаны.
1. Кардиомиопатии у детей — клинические, генетические и морфологические аспекты/ О.П. Сарычева, Л.В. Кулида, Е.В. Проценко, М.В. Малышева //Российский медико-биологический вестник. — 2020.
4. Гипертрофическая кардиомиопатия у детей/ И.В. Леонтьева, В.А. Макарова // Российский вестник перинатологии и педиатрии. — 2013.
Болезнь Помпе
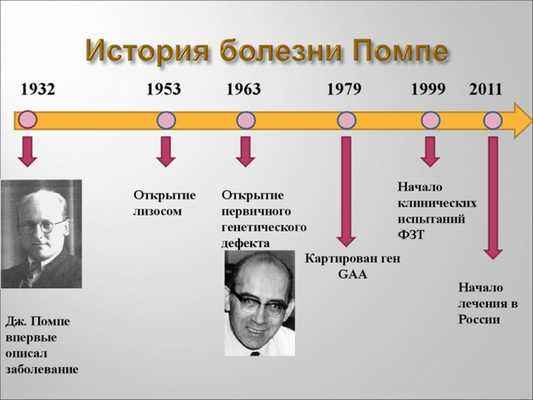
Это редкое генетическое заболевание, относящееся к группе лизосомных болезней. Характерно повсеместное поражение нервных и мышечных клеток из-за накопления гликогена. Симптомы болезни Помпе вариативны, но в целом характерна прогрессирующая мышечная слабость, а для некоторых форм заболевания кардиомегалия и дилатационная кардиомиопатия. Лечение болезни Помпе осуществляется фермент-заместительной терапией, однако эффективность отличается у разных пациентов.
Причины болезни Помпе
Болезнь Помпе — это классический гликогеноз — заболевание, при котором нарушено расщепление гликогена. Как следствие, происходит его накопление и отложение в организме. Патология развивается в результате мутации гена GAA, располагающегося на 17-й хромосоме и отвечающего за кодирование фермента мальтазы.
Мальтаза представляет собой ключевой лизосомный фермент, который расщепляет гликоген до более простых отрезков. Они метаболизируются до глюкозы и участвуют в энергетическом обмене клетки. При болезни Помпе сначала развивается дефицит глюкозы в клетках, а потом там начинает накапливаться гликоген, что приводит к развитию клеточной дистрофии.
Классификация болезни Помпе
Клиническая классификация болезни Помпе основана на возрасте манифестации проявлений. Различают следующие формы:
- ранняя инфантильная — возникает на первых месяцах жизни больного, проявляется миопатией, гепатомегалией и кардиомиопатией;
- поздняя инфантильная форма манифестирует в 1-3 года, прогрессирует медленнее;
- ювенильная форма начинается в возрасте 6-10 лет. Основным пораженным органом является сердце;
- взрослая форма развивается в возрасте 20-40 лет, в основном характеризуется миопатией.
Симптомы болезни Помпе
Симптомы болезни Помпе различаются в зависимости от формы патологии. Для ранней инфантильной характерна выраженная слабость мышц. Ребенок становится плаксивым, гиподинамичным. Педиатры часто диагностируют задержку психомоторного развития. По мере прогрессирования заболевания из-за слабости сосательной мускулатуры присоединяются проблемы с кормлением, как следствие, развивается общая гипотрофия. Со временем нарастает кардиомиопатия и слабость дыхательной мускулатуры.
Что касается поздней инфантильной и ювенальной форм болезни, то они протекают со сходной симптоматикой и отличаются только возрастом начала клинической манифестации. Обычно диагностируется мышечная слабость и признаки миопатии сердца. По мере прогрессирования этих симптомов увеличивается печень и селезенка.
Взрослая форма болезни Помпе имеет наиболее благоприятный прогноз в плане продолжительности жизни. Из симптомов раньше всего обнаруживают дистальную миопатию, которая проявляется слабостью мышц конечностей. Постепенно в процесс вовлекаются мышцы туловища, в частности спины, что приводит к развитию сколиоза. Сердце и печень поражаются не всегда.
Диагностика и лечение болезни Помпе
Диагностика болезни Помпе основывается на клинических симптомах, лабораторном тестировании и инструментальном обследовании (ЭКГ). Специфичным исследованием является определение кислой альфа-1,4-глюкозидазы в сыворотке крови и гликогена в биоптатах мышечной ткани.
Из генетических исследований выполняется секвенирование гена GAA для выявления в нем мутаций. Данное тестирование назначается не только больным пациентам, но и их клинически здоровым родственникам для определения носительства мутации. Выполнить этот анализ можно в медико-генетическом центре «Геномед».
Единственный метод лечения на сегодня — это фермент-заместительная терапия, которая восполняет недостаточность кислой альфа-1,4-глюкозидазы. Терапия дорогостоящая. Что касается прогноза, то он зависит от формы болезни. Ранняя инфантильная наиболее неблагоприятна. При отсутствии лечения такие пациенты редко доживают до двух лет.
Наиболее благоприятно протекает взрослая форма заболевания. Она прогрессирует медленно, поэтому такие пациенты доживают до старости без специфического лечения и с сохранением приемлемого качества жизни.
Гипертрофическая кардиомиопатия
Гипертрофическая кардиомиопатия - первичное изолированное поражение миокарда, характеризующееся гипертрофией желудочков (чаще левого) при уменьшенном или нормальном объеме их полостей. Клинически гипертрофическая кардиомиопатия проявляется сердечной недостаточностью, болью в грудной клетке, нарушениями ритма, синкопальными состояниями, внезапной смертью. Диагностика гипертрофической кардиомиопатии включает проведение ЭКГ, суточного ЭКГ-мониторирования, ЭхоКГ, рентгенологического исследования, МРТ, ПЭТ сердца. Лечение гипертрофической кардиомиопатии проводится b-адреноблокаторами, блокаторами кальциевых каналов, антикоагулянтами, антиаритмическими препаратами, ингибиторами АПФ; в ряде случаев прибегают к кардиохирургической операции (миотомии, миоэктомии, протезированию митрального клапана, двухкамерной электрокардиостимуляции, имплантации кардиовертер-дефибриллятора).
В кардиологии различают первичные (идиопатические) кардиомиопатии (гипертрофическую, констриктивную, дилатационную, рестриктивную, аритмогенную дисплазию правого желудочка) и специфические вторичные кардиомиопатии (алкогольную, токсическую, метаболическую, климактерическую и ряд других).
Гипертрофическая кардиомиопатия - самостоятельное, не зависящее от других сердечно-сосудистых заболеваний, значительное утолщение миокарда левого (реже правого) желудочка, сопровождающееся уменьшением его полости, нарушением диастолической функции с развитием нарушений сердечного ритма и сердечной недостаточности.
Гипертрофическая кардиомиопатия развивается у 0,2-1,1% населения, чаще мужского пола; средний возраст пациентов составляет от 30 до 50 лет. Коронарный атеросклероз среди больных гипертрофической кардиомиопатией встречается в 15-25 % случаев. Внезапная смерть, вызванная с тяжелыми желудочковыми аритмиями (пароксизмальной желудочковой тахикардией), наступает у 50% пациентов с гипертрофической кардиомиопатией. У 5-9 % больных заболевание осложняется инфекционным эндокардитом, протекающим с поражением митрального или аортального клапана.
Гипертрофическая кардиомиопатия - заболевание с аутосомно-доминантным типом наследования, поэтому обычно носит семейный характер, что не исключает, однако, возникновение спорадических форм.
В основе семейных случаев гипертрофической кардиомиопатии лежат передаваемые по наследству дефекты генов, кодирующих синтез сократительных белков миокарда (гена тяжелой цепи b-миозина, гена сердечного тропонина Т, гена а-тропомиозина, гена, кодирующего сердечную изоформу миозин-связывающего белка). Спонтанные мутации этих же генов, происходящие под воздействием неблагоприятных факторов среды, обусловливают развитие спорадических форм гипертрофической кардиомиопатии.
Гипертрофия миокарда левого желудочка при гипертрофической кардиомиопатии не связана с врожденными и приобретенными пороками сердца, ИБС, гипертонической болезнью и другими заболеваниями, которые обычно приводят к подобным изменениям.
В патогенезе гипертрофической кардиомиопатии ведущая роль принадлежит компенсаторной гипертрофии сердечной мышцы, обусловленной одним из двух возможных патологических механизмов - нарушением диастолической функции миокарда или обструкцией выходного тракта левого желудочка. Диастолическая дисфункция характеризуется поступлением в желудочки недостаточного количества крови в диастолу, что связано с плохой растяжимостью миокарда, и обусловливает быстрый подъем конечного диастолического давления.
При обструкции выходного отдела левого желудочка имеет место утолщение межжелудочковой перегородки и нарушение движения передней створки митрального клапана. В связи с этим в период изгнания возникает перепад давления между полостью левого желудочка и начальным отрезком аорты, что сопровождается повышением конечного диастолического давления в левом желудочке. Возникающая в этих условиях компенсаторная гиперфункция сопровождается гипертрофией, а затем и дилатацией левого предсердия, в случае же декомпенсации развивается легочная гипертензия.
В ряде случаев гипертрофической кардиомиопатии сопутствует ишемия миокарда, обусловленная снижением вазодилататорного резерва коронарных артерий, увеличением потребности гипертрофированного миокарда в кислороде, сдавлением во время систолы интрамуральных артерий, сопутствующим атеросклерозом венечных артерий и т. д.
Макроскопическими признаками гипертрофической кардиомиопатии служит утолщение стенок левого желудочка при нормальных или уменьшенных размерах его полости, гипертрофия межжелудочковой перегородки, дилатация левого предсердия. Микроскопическая картина гипертрофической кардиомиопатии характеризуется беспорядочным расположением кардиомиоцитов, замещением мышечной ткани на фиброзную, аномальным строением интрамуральных венечных артерий.
В соответствии с локализацией гипертрофии выделяют гипертрофическую кардиомиопатию левого и правого желудочков. В свою очередь, гипертрофия левого желудочка может быть асимметричной и симметричной (концентрической). В большинстве случаев выявляется асимметричная гипертрофия межжелудочковой перегородки на всем протяжении или в ее базальных отделах. Реже встречается асимметричной гипертрофия верхушки сердца (апикальная гипертрофическая кардиомиопатия), задней или переднебоковой стенки. На долю симметричной гипертрофии приходится около 30 % случаев.
С учетом наличия градиента систолического давления в полости левого желудочка различают обструктивную и необструктивную гипертрофическую кардиомиопатию. Симметричная гипертрофия левого желудочка, как правило, представляет собой необструктивную форму гипертрофической кардиомиопатии.
Асимметричная гипертрофия может являться как необструктивной, так и обструктивной. Так, синонимом асимметричной гипертрофии межжелудочковой перегородки служит понятие «идиопатический гипертрофический субаортальный стеноз», гипертрофии средней части межжелудочковой перегородки (на уровне папиллярных мышц) - «мезовентрикулярная обструкция». Верхушечная гипертрофия левого желудочка, как правило, представлена необструктивным вариантом.
В зависимости от степени утолщения миокарда выделяют умеренную (15-20 мм), среднюю (21-25 мм) и выраженную (более 25 мм) гипертрофию.
На основании клинико-физиологической классификации выделяют IV стадии гипертрофической кардиомиопатии:
- I - градиент давления в выходном тракте левого желудочка (ВТЛЖ) не более 25 мм рт. ст.; жалобы отсутствуют;
- II - градиент давления в ВТЛЖ возрастает до 36 мм рт. ст.; появляются жалобы при физической нагрузке;
- III - градиент давления в ВТЛЖ увеличивается до 44 мм рт. ст.; появляются стенокардия, одышка;
- IV - градиент давления в ВТЛЖ выше 80 мм рт. ст.; развиваются выраженные нарушения гемодинамики, возможна внезапная сердечная смерть.
Симптомы гипертрофической кардиомиопатии
Длительное время течение гипертрофической кардиомиопатии остается бессимптомным, клиническая манифестация чаще происходит в возрасте 25-40 лет. С учетом преобладающих жалоб выделяют девять клинических форм гипертрофической кардиомиопатии: малосимптомную, вегетодистоническую, кардиалгическую, инфарктоподобную, аритмическую, декомпенсационную, псевдоклапанную, смешанную, молниеносную. Несмотря на то, что каждый клинический вариант характеризуется определенными признаками, всем формам гипертрофической кардиомиопатии присущи общие симптомы.
Необструктивная форма гипертрофической кардиомиопатии, не сопровождающаяся нарушением оттока крови из желудочка, обычно малосимптомна. В этом случае жалобы на одышку, перебои в работе сердца, неритмичный пульс могут отмечаться при выполнении физической нагрузки.
Типичными симптомами обструктивной гипертрофической кардиомиопатии служат приступы ангинозных болей (70%), выраженная одышка (90%), головокружения и обморочные состояния (25-50%), преходящая артериальная гипотензия, нарушения ритма сердца (пароксизмальная тахикардия, фибрилляция предсердий, экстрасистолия). Возможно возникновение приступов сердечной астмы и отека легких. Нередко первым эпизодом проявления гипертрофической кардиомиопатии служит внезапная смерть.
При диагностическом поиске обнаруживается систолический шум, высокий, скорый пульс, смещение верхушечного толчка. Инструментальные методы обследования при гипертрофической кардиомиопатии включают ЭхоКГ, ЭКГ, ФКГ, рентгенографию грудной клетки, холтеровское мониторирование, поликардиографию, ритмокардиографию. С помощью эхокардиографии выявляется гипертрофия МЖП, стенок миокарда желудочка, увеличение размеров левого предсердия, наличие обструкции ВТЛЖ, диастолическая дисфункция левого желудочка.
ЭКГ-признаки гипертрофической кардиомиопатии малоспецифичны и требуют дифференциальной диагностики с очаговыми изменениями миокарда, гипертонической болезнью, ИБС, аортальным стенозом и другими заболеваниями, осложняющимися гипертрофией левого желудочка. Для оценки тяжести гипертрофической кардиомиопатии, прогноза и выработки рекомендаций по лечению используются нагрузочные пробы (велоэргометрия, тредмил-тест).
Суточное мониторирование ЭКГ позволяет документировать пароксизмальные эпизоды желудочковой экстрасистолии и тахикардии, фибрилляции и трепетания предсердий. На фонокардиограмме регистрируется систолический шум различной степени выраженности, сохранность амплитуды I и II тонов. Сфигмография демонстрирует двухвершинную кривую каротидного пульса, характеризующуюся дополнительной волной на подъеме.
При рентгенологическом исследовании изменения контуров сердца (увеличение левых отделов сердца, расширение восходящей части аорты, выбухание ствола и расширение ветвей легочной артерии) обнаруживаются только в развернутой стадии гипертрофической кардиомиопатии. Для получения дополнительных данных за гипертрофическую кардиомиопатию прибегают к проведению зондирования левых отделов сердца, вентрикулографии, коронарографии, сканированию сердца с радиоизотопом таллия, МРТ, ПЭТ сердца. Окончательным подтверждающим методом служит генодиагностика.
Лечение гипертрофической кардиомиопатии
Пациентам с гипертрофической кардиомиопатией (особенно с обструктивной формой) рекомендуется ограничение физических нагрузок, которые могут спровоцировать увеличение градиента давления «левый желудочек-аорта», аритмии сердца и обмороки.
При умеренно выраженных симптомах гипертрофической кардиомиопатии назначают b-адреноблокаторы (пропранолол, атенолол, метопролол) или блокаторы кальциевых каналов (верапамил), уменьшающие ЧСС, удлиняющие диастолу, улучшающие пассивное наполнение левого желудочка и снижающие давление наполнения. В связи с наличием высокого риска развития тромбоэмболий необходим прием антикоагулянтов. При развитии сердечной недостаточности показаны диуретики, ингибиторы АПФ; при нарушениях желудочкового ритма - антиаритмические препараты (амиодарон, дизопирамид).
При обструктивной гипертрофической кардиомиопатии проводится профилактика инфекционного эндокардита, т. к. в результате постоянной травматизации передней створки митрального клапана на ней могут появляться вегетации. Кардиохирургическое лечение гипертрофической кардиомиопатии целесообразно при градиенте давления между левым желудочком и аортой >50 мм рт.ст. В этом случае может выполняться септальная миотомия или миоэктомия, а при структурных изменениях митрального клапана, вызывающих значительную регургитацию, - протезирование митрального клапана.
Для уменьшения обструкции ВТЛЖ показана имплантация двухкамерного электрокардиостимулятора; при наличии желудочковых нарушений ритма - имплантация кардиовертер-дефибриллятора.
Прогноз гипертрофической кардиомиопатии
Течение гипертрофической кардиомиопатии вариабельно. Необструктивная форма гипертрофической кардиомиопатии протекает относительно стабильно, однако при длительном стаже заболевания все же развивается сердечная недостаточность. У 5-10% пациентов возможен самостоятельный регресс гипертрофии; у такого же процента больных отмечается переход гипертрофической кардиомиопатии в дилатационную; еще столько же пациентов сталкивается с осложнением в виде инфекционного эндокардита.
Без лечения летальность при гипертрофической кардиомиопатии составляет 3-8 %, при этом в половине подобных случаев возникает внезапная смерть вследствие фибрилляции желудочков, полной атриовентрикулярной блокады, острого инфаркта миокарда.
Гипотиреоз - симптомы и лечение
Что такое гипотиреоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., эндокринолога со стажем в 28 лет.
Над статьей доктора Курашова О. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Гипотиреоз — это заболевание эндокринной системы, возникающее из-за длительно низкого уровня тиреоидных гормонов, вырабатываемых щитовидной железой, и проблем с их воздействием на организм преимущественно на тканевом уровне.
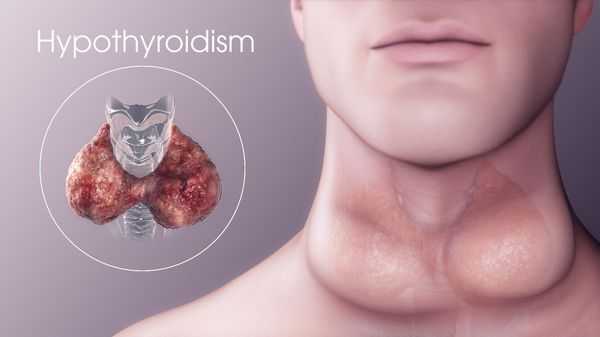
Ежегодно на каждую тысячу человек приходится 0,6-3,5% заболевших гипотиреозом. [3] [6] [8] Данное нарушение может возникнуть в любом возрасте, но обычно оно возникает у пожилых людей старше 60 лет. [14] Среди новорождённых гипотиреоз встречается в одном случае из 4-5 тысяч.
К факторам риска относятся:
- ; ;
- подострый и послеродовой тиреоидит;
- аутоиммунные заболевания (B1-дефицитная анемия, болезнь Аддисона, сахарный диабет I типа);
- рак тканей головы и шеи (леченый);
- курение;
- болезни щитовидной железы у родственников;
- применение радиоактивного йода при лечении рака щитовидной железы ;
- приём некоторых препаратов (амиодарон, α-интерферон, карбонат лития, йод-, бромсодержащие и другие лекартсва). [15]
В 80% случаев гипотиреоз связан с поражением защитных сил организма, т. е. аутоиммунным тиреоидитом. Он является ведущей причиной первичного гипотиреоза у взрослых людей. [3]
Риск возникновения аутоиммунного тиреоидита зависит от возраста и пола пациента: у женщин в возрасте 40-50 лет он возникает в 10-15 раз чаще, чем у мужчин. [6] [9]
При аутоиммунном тиреоидите даже на фоне длительной ремиссии функциональное состояние щитовидной железы в разное время может значительно различаться. Так, с возрастом деструктивные изменения в щитовидной железе постепенно нарастают. Этот фактор, а также наличие тиреоидных аутоантител могут спровоцировать переход субклинического (скрытого) гипотиреоза, протекающего на фоне аутоиммунного тиреоидита, в явный. Частота таких случаев составляет около 5 % в год.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гипотиреоза
Симптомы гипотиреоза крайне обманчивы, разнообразны и не всегда заметны. Их проявление зависит от степени выраженности заболевания.
К основным клиническим проявлениям относятся: [9] [11] [14]
- Обменно-гипотермический синдром. Характерно постоянное чувства холода, снижение температуры тела, увеличение веса.
- Нарушение нервной системы и органов чувств. Человек становится заторможенным, вялым, появляется сонливость, ухудшается память, нарушается носовое дыхание и слух, голос становится низким и грубым, а речь замедленной. На лице и конечностях может возникнуть плотный отёк. Кожа утолщается, становится сухой и холодной, приобретает бледный окрас с желтоватым оттенком, волосы становятся тусклыми и ломкими, подверженными выпадению.
- Нарушение сердечно-сосудистой системы. Наблюдается пониженное или нормальное артериальное давление. У части пациентов возникает мягкая диастолическая гипертензия.
- Изменения со стороны ЖКТ. Замедляется перистальтика кишечника, возникают запоры, изменения желчного пузыря и его протоков, снижается аппетит, вплоть до развития анорексии.
- Анемический синдром. Из-за недостатка гормонов щитовидной железы возникает депрессия костно-мозгового кроветворения, нередко развивается В12-дефицитная и постгеморрагическая анемия, время кровотечения увеличивается.
- Дисфункция почек. Почечный кровоток и скорость клубочковой фильтрации снижаются, как и эффективность почечного плазмотока, уровень глюкозы и натрия в крови становится ниже нормы.
- Сбои репродуктивной системы. У женщин происходит нарушение овуляции, менструальные циклы становятся короткими и редкими, возникает бесплодие. В большинстве случаев развивается вторичная гиперпролактинемия, которая сопровождается самопроизвольным вытеканием молока из молочной железы и отсутствием месячных. На фоне декомпенсированного гипотиреоза беременность наступает крайне редко. Снижение либидо наблюдается у лиц обоего пола. У мужчин может развиваться эректильная дисфункция, нарушение сперматогенеза.
- Нарушение опорно-двигательной системы. Как правило, замедляется костное ремоделирование, снижается интенсивность резорбции (рассасывания) кости и костеобразования. Часто возникает снижение плотности костной ткани и рабдомиопатия, причём как с гипертрофией (увеличением) мышц, так и с их атрофией.
Патогенез гипотиреоза
Тиреоидные гормоны, которые вырабатывает щитовидная железа, называются "трийодтиронин" (Т3) и "тироксин" (Т4). Они влияют практически на все процессы, протекающие в организме. Стимулирующее влияние на них оказывает тиреотропный гормон гипофиза (ТТГ).
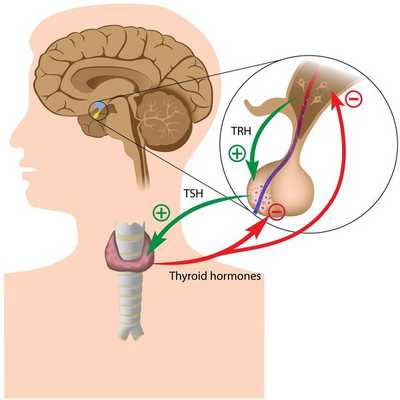
Синтез тиреоидных гормонов начинается после того, как щитовидная железа захватывает йод. Он является регулятором гормоногенеза и размножения тиреоцитов — клеток эпителия щитовидной железы. Попав в тиреоциты, йодид окисляется до активной формы при помощи тиреопероксидазы — микросомального антигена, к которому образуются антитела, в частности при аутоиммунном тиреоидите. [4] [6] [7] Уровень поступления йода изменяет чувствительность тиреоцитов к воздействию ТТГ, которая усиливается при дефиците йода. [3] [6]
Исходя из этого механизма возникновения гормонов щитовидной железы, патогенетически гипотиреоз делится на три типа:
- первичный (тиреогенный);
- вторичный (гипофизарный);
- третичный (гипоталамический);
- периферический (тканевой).
Первичный гипотиреоз возникает в 80-95% случаев и чаще всего обусловлен нарушениями общей структуры щитовидной железы, которые являются врождёнными или приобретёнными, а также сбоем секреторной функции её клеток.
Вторичный и третичный гипотиреоз возникают в 3-4% случаев. Они связаны с заболеваниями таких участков головного мозга, как аденогипофиз или гипоталамус в результате которых наблюдается стойкая нехватка гормонов щитовидной железы и нарушение секреции ТТГ гипофиза. [4] [6]
Периферический гипотиреоз развивается крайне редко — в 0-1% случаев. Основным фактором его возникновения является резистентность (сопротивляемость) тканей-мишеней (например, мозга, гипофиза, сердца, костей, печени) гормонам Т4 и Т3. [5] [6] [7]
В патогенезе аутоиммунных заболеваний щитовидной железы взаимодействуют генетические и средовые факторы. Однако точная роль тех и других не определена. Ведущее значение в гибели тиреоцитов при этих заболеваниях придают клеточным механизмам, т.е. цитотоксическим эффектам аутореактивных Т- лимфоцитов. [3] [5] Отсутствие при аутоиммунных поражениях щитовидной железы классических признаков гнойного воспаления (боли, отёка и других), обычно сопровождающих массивный некроз ткани, указывает в таких случаях на иной механизм гибели тиреоцитов. В последние годы установлено, что Т-лимфоциты способны вызывать гибель клеток-мишеней не только путём некроза, но в основном путём индукции их разрушения. [3] [5] [7] [9]
Классификация и стадии развития гипотиреоза
В Международной классификации болезней десятого пересмотра выделены две формы гипотиреоза:
- Субклинический (скрытый) гипотиреоз, развившийся в результате йодной недостаточности.
- Иные формы гипотиреоза:
- врожденный гипотиреоз с диффузным зобом;
- врождённый гипотиреоз без зоба;
- гипотиреоз, возникший по причине приёма лекарств и других экзогенных веществ;
- постинфекционный гипотиреоз;
- атрофия щитовидной железы (приобретённая);
- другие уточнённые гипотиреозы;
- неуточнённый гипотиреоз.
Первичный гипотиреоз подразделят на три большие группы:
- Врождённый гипотиреоз.
- Гипотиреоз, связанный с уменьшением количества функционирующей ткани щитовидной железы:
- возникающий после операции
- развивающийся после облучения
- вызванный аутоиммунным нарушением щитовидной железы
- связанный с вирусным заболеванием щитовидной железы
- возникающий на фоне новообразований щитовидной железы.
- Гипотиреоз, связанный с нарушением выработки тиреоидных гормонов:
- эндемический зоб — возникает в районах с йододефицитом;
- спорадический зоб с гипотиреозом — развивается в случае дефектов биосинтеза гормонов;
- медикаментозный гипотиреоз — появляется в результате приёма тиреостатиков и других препаратов;
- зоб и гипотиреоз, развившиеся в связи с употреблением продуктов, содержащих вредные вещества. [3][5][7][9]
В последнее время разработана классификация первичного гипотиреоза, которая основывается на выраженности симптомов и результатах гормональных исследований (определяющий показатель — уровень ТТГ). В неё включают:
- Субклинический (скрытый) гипотиреоз — симптомы размыты или отсутствуют, уровень ТТГ повышен, содержание Т4 в норме.
- Манифестный — возникает типичная клиническая картина гипотиреоза, уровень ТТГ повышен, концентрация Т4 снижена:
- компенсированный.
- декомпенсированный.
- Осложнённый — развивается кретинизм, сердечная недостаточность, выпот в серозные полости, вторичная аденома гипофиза. [2]
Осложнения гипотиреоза
Гипотиреоидная кома ("спячка") — это угрожающее жизни состояние, которое чаще развивается у пожилых людей, которые долгое время не лечили тяжёлый гипотиреоз, который был у них довольно долгое время. [3] [5] [7] [9]
К основным провоцирующим факторам такого осложнения относят:
- охолаждение;
- сердечно-сосудистые заболевания;
- острые инфекции;
- травмы;
- кровопотерю;
- хирургические вмешательства;
- приём алкоголя или лекарств, угнетающих функцию центральной нервной системы;
- стрессовые ситуации. [6][7][8]
При гипотиреоидной коме температура тела, как правило, снижается до 24-32,2°С, возникают судороги и угнетение дыхания. Лечение такого состояния нужно начинать незамедлительно. [14] Но даже при своевременном обнаружении осложнения и незамедлительном лечении смерть может наступить в 25-60% случаев. [15]
Но появление осложнений может вызвать не только отсутствие лечения, но и неграмотная медикаментозная терапия. Например, передозировка лекарствами может привести к избыточному синтезу гормонов щитовидной железы и патологиям со стороны сердечно-сосудистой системы. В связи с этим крайне важно соблюдать все рекомендации врача по лечению заболевания и ни в коем случае не лечиться самостоятельно.
Диагностика гипотиреоза
Диагностика гипотиреоза включает в себя подробный опрос пациента, осмотр и лабораторные исследования.
Так как симптомы гипотиреоза неспецифичны, он может скрываться под масками других заболеваний. Поэтому по проявлениям его иногда можно спутать с железодефицитной анемией, депрессией, аменореей, невритом и другими нарушениями. [15] [16] В связи с этим важную роль в определении гипотиреоза играют лабораторные исследования. Они показаны всем пациентам с нарушениями щитовидной железы и предполагают оценку уровня ТТГ и свободного Т4. [2] [12] Определение уровня Т3 в крови, как правило, не является информативным, так как при первичном гипотиреозе этот показатель находится в норме. [14]
На явное наличие гипотиреоза будет указывать высокий уровень ТТГ и низкий уровень свободного Т4 в крови. При субклиническом гипотиреозе уровень ТТГ также будет повышен, а уровень свободного Т4 будет находиться в пределах нормы.
После того как наличие гипотиреоза подтверждено, при помощи показателя ТТГ также определяется характер заболевания и наличие возможных осложнений. Уровень ТТГ также позволяет в значительном большинстве случаев оценить адекватность проводимой терапии: об этом будет свидетельствовать стойкий уровень ТТГ в крови в пределах нормы. [6] [7] [8]
В достаточно редких случаях проводят пробу с тиреолиберином для оценки аутоиммунных заболеваний щитовидной железы. [6] [9] [15]
Дополнительные методы диагностики, такие как УЗИ щитовидной железы, сцинтиграфия или пункционная биопсия, используются для уточнения характера и степени выраженности заболевания. [6] [11] [12] [16]
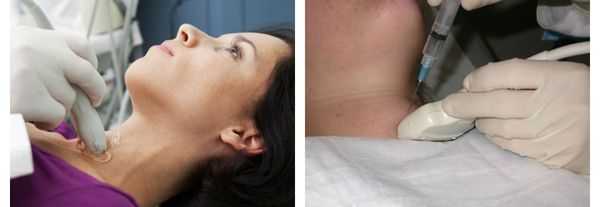
Так как с возрастом учащаются случаи узлового зоба, выраженный шейный кифоз может смещать трахею кзади и вниз, что затрудняет пальпаторную оценку состояния щитовидной железы, в результате чего своевременная диагностика заболевания не проводится. [4] [5] [6] [7] [8]
В связи с тем, что гипотиреоз не всегда проявляет себя, среди населения принято проводить массовую диагностику данного заболевания — скрининг. Так, определение уровня ТТГ позволяет обнаружить первичный гипотиреоз у людей без каких-либо других его проявлений, а также у новорождённых (исследование проводится на 4-5 сутки жизни). При планировании беременности и на ранних её сроках также важно пройти исследование на гипотиреоз. [3] [5] [7] [9]
Лечение гипотиреоза
Цель лечения гипотиреоза — это поддержание уровня ТТГ в пределах 0,5-1,5 мМЕ/л.
Единственным методом лечения является пожизненная заместительная терапия. Начинать её стоит при уровне ТТГ более 10 мЕД/л, высоких титрах антител к ТПО и других показателях. Для этого предпочтительны препараты левотироксина натрия. Его применение противопоказано лишь в случае нелеченого тиреотоксикоза и недостаточности коры надпочечников, остром инфаркте миокарда, аллергии и индивидуальной непереносимости препарата. [16]
Обычно лечение проводится в условиях стационара. Показаниями к госпитализации пациентов с гипотиреозом служат:
- тяжёлая степень заболевания;
- наличие выраженной сердечной патологии;
- гипотиреоидная кома.
Заместительная терапия первичного (манифестного) гипотиреоза показана пожизненно с назначением тироксина в средней дозе 1,6-1,8 мкг/кг. Пациентам с кардиальной патологией доза рассчитывается, исходят из расчёта 0,9 мкг/кг. Стоит отметить, что в связи с уменьшением метаболизма тиреоидных гормонов потребность в них с возрастом снижается. [5] [7] [9]
Дозы тироксина зависят от причин и патогенеза заболевания. Потребность в препарате у людей со спонтанным гипотиреозом выше, чем у пациентов с гипотиреозом, возникшим после хирургического лечения и применения радиоактивного йода.
Уровень ТТГ при диагностике гипотиреоза напрямую связан с оптимальной заместительной дозой тироксина: у большинства женщин она составляет 75-100 мкг, а у мужчин — до 150 мкг в день приёма.
Первый контроль уровня ТТГ после начатого лечения проводят через 2-3 месяца, затем один раз в шесть месяцев (при обязательном условии соблюдения пациентом схемы лечения). [6] [9] [13]
При субклиническом гипотиреозе существует риск развития манифестной формы заболевания со всеми характерными проявлениями. Так, явный гипотиреоз возникает у 20-50% пациентов в течение 4-8 лет, а присутствие антитиреоидных антител увеличивает риск до 80%. [8] [9] [10] Потому людям со скрытым гипотиреозом следует длительно наблюдаться у специалистов.
Проблемы при лечении гипотиреоза
Лечение тироксином безопасно, просто и сравнительно дешево. Но, несмотря на многолетний опыт его использования, при нём всё же могут возникать многие проблемы. Основная из них связана с несоблюдением пациента схемы лечения. Так, одновременное повышение уровней Т4 и ТТГ, по всей вероятности, будет указывать на то, что за несколько дней до визита к врачу пациент не выполнял его назначений.
Снижение эффективности установленной дозы тироксина часто связано с меньшим содержанием гормона в таблетках (например, в непатентованных препаратах) или взаимодействием лекарств при одновременном приёме других препаратов. [9] [13]
Недостаточность дозы также может быть связана с уменьшением всасывания тироксина, нарушением энтеропечёночного кровотока, ускорением кругооборота или выделением гормона с мочой, медленным снижением тиреоидной функции после лечения гипертиреоза.
Существуют и другие особенности и проблемы при лечении гипотиреоза. [6]
Лучшим критерием подбора дозы тироксина при аутоиммунном тиреоидите является исследование ТТГ и свободного Т4. При этом лечение нацелено на компенсацию гипотиреоза благодаря той же заместительной терапии и редукция зоба при помощи супрессивной терапии. [6] [9] Критериями эффективности лечения при этом будут служить:
- уменьшение зоба в объёме;
- снижение плотности щитовидной железы;
- уменьшение титра антител до нормы;
- поддержание уровня ТТГ в пределах нормы.
Назначение препаратов тиреогормонов при аутоиммунном тиреоидите без нарушения функции щитовидной железы нецелесообразно, а операция может привести к состоянию, способному значительно ухудшить качество жизни пациента с возможностью развития тяжёлого гипотиреоза и инвалидизации. [9] [13]
Прогноз. Профилактика
Прогноз заболевания при своевременной диагностике и лечении благоприятный. [10] Осложнить его, особенно в отношении трудоспособности и состояния здоровья в целом, могут фибрилляция предсердий и выраженная сердечная недостаточность, развивающиеся на фоне тиреотоксикоза. [5]
Специфической профилактики заболевания не существует. Снизить риск развития гипотиреоза можно только при помощи сбалансированного правильного питания , употребления достаточного количества йода с пищей (включения в рацион морепродуктов) и контроля гормонального баланса. Крайне важно проходить профилактические осмотры и являться на контрольные приёмы к лечащему врачу. [5] [11] [12]
В качестве неспецифической профилактики патологий щитовидной железы стоит проходить санаторно-курортное лечение по показаниям врача.
Доказано, что медикаментозная терапия при гипотиреозе становится более эффективной в сочетании с радоновыми процедурами, а азотные ванны, не содержащие радон, оказывают профилактическое воздействие. [1] [5] Благодаря этому удаётся добиться стойкости ремиссии заболевания.

Рекомендуется проведение до трёх курсов таких процедур с интервалом от 8 до 12 месяцев. Подбор схем лечения в санатории (в т.ч. медикаментозных), рациональное использование природных и климатических факторов определяют ближайший и отдалённый результат оздоровления.
Читайте также:
