Больные в хирургической стоматологии. Заживление слизистой полости рта
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Рекомендовано
Экспертным советом
РГП на ПХВ «Республиканский центр
развития здравоохранения»
Министерства здравоохранения
и социального развития
Республики Казахстан
от «15» октября 2015 года
Протокол № 12
Название протокола: Хронические травматические повреждения слизистой оболочки полости рта
Хронические травматические повреждения слизистой оболочки полости рта - возникают при длительном воздействие слабого по силе раздражителя (острые края зубов или их корни, некачественные ортодонтические. ортопедические конструкции или аппараты, при наличии вредных привычек и т.д.).[134].
Код протокола:
Код(ы) по МКБ-10:
S00.5 Поверхностная травма губы и полости рта
S01.5 Открытая рана губы и полости рта
K12.1 Другие формы стоматита
К13.1 Прикусывание щеки и губ
Сокращения, используемые в протоколе:
МБК -международная классификация болезни
Дата разработки/пересмотра протокола: 2015 год
Категория пациентов: взрослые.
Пользователи протокола: онколог, врач общей практики, дерматолог, фтизиатр, врач-стоматолог терапевт, зубной врач. врач - стоматолог общей практики.
Оценка на степень доказательности приводимых рекомендаций [1 2 4 6 10].
Таблица - 1. Шкала уровня доказательности
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с не высоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая фармацевтическая практика. |

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Классификация травм слизистой оболочки полости рта [1 4 7].
I. Травматические повреждения
Механические;
Химические;
Физические;
Комбинированные.
По течению:
Острые;
Хронические.
По клиническому проявлению:
Эритема;
Десквамация;
Экскарияация (ссадина);
Эрозия;
Пузырь (при термической травме);
Язва;
Некроз (при химической травме);
Рана;
Кровоизляние (гематома, экхимиоз, петихия);
Гиперкератоз (лейкоплакия);
Гиперплазия (папиллома, папилломатоз, дольчатая фиброма).
Клиническая картина
Cимптомы, течение
Диагностические критерии постановки диагноза:
Жалобы и анамнез:
| Нозология | Жалобы | Анамнез |
| Хроническая механическая травма слизистой оболочки полости рта | Жалоб могут отсутство вать или на незначительную болезненность, жжение при приеме пищи, особенно при кислой , горячей пищи, чувство неловкости, дискомфорта, припухлость. | Вредные привычки: кусание губ, привычные прикусывание и жевание слизистой оболочки . Некачественные ортопедические и ортодонтические конструк ции; некачественный пломбы, плохая гигиена полости рта, зубной камень, длительно действующие острые края зубов |
Физикальное обследование:
Таблица - 2. Данные физикального обследования больных
| Хроническая механическая травма слизистой оболочки полости рта | ||
| Данные обследование | Симптомы | Патогенетические обоснование |
| Жалобы | на незначительную болезненность, жжение при приеме пищи, особенно при кислой , горячей пищи, чувство неловкости, дискомфорта, припухлость. | Постоянное травмирование слизистой оболочки приводит к хроническому воспалению с отеком и гиперемией слизистой оболочки и нарушением целостности эпителия. |
| Осмотр | При осмотре в зависимости от характера раздражителя и особенности реактивности организма выявляется виде катарального воспаления, эрозии и язвы. | Язва имеет неровные края и дно, покрытое легко снимающимся фиброзным либо некротическим налетом, вокруг нее слизистая отечна, гиперемированы,. |
| Локализация | ||
Диагностика
Перечень основных и дополнительных диагностических мероприятий:
Основные (обязательные) и дополнительные диагностические обследования, проводимые на амбулаторном уровне:
1. внешний осмотр лица (кожные покровы, симметрия лица, цвет кожи, состояние лимфатических узлов);
2. жалобы и анамнез;
3. визуальный осмотр слизистой полости рта (цвет, влажность, консистенция, утолщенность, истонченность, деформация, целостность эпителий);
4. пальпация регионарных лимфатических узлов (подчелюстные, околоушные, подбородочные лимфатические узлы);
5. определение целостность эпителия;
6. общий анализ крови;
7. гистологическое исследование.
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: нет
Основные (обязательные диагностичекие обследования, проводимые на стационарном уровне (при экстренной госпитализации проводятся диагностичсекие обследования непроведенные на амбулаторном уровне): нет
Диагностические мероприятия, проводимые на этапе скорой неотложной помощи: нет
Инструментальные исследования: не проводятся.
Показания для консультации специалистов: Длительные незаживающие язвы после устранения причинного фактора и применения местного лечения.
Лабораторная диагностика
[5 8 9 11 12 13].
- анализ крови клинический;
- цитологическое исследование;
- бактериологическое исследование;
Таблица - 3. Данные лабораторных исследований
Дифференциальный диагноз
Дифференциальный диагноз.
Таблица - 4. Данные дифференциальной диагностики
| Заболевание | Общие клинические признаки | Отличительные признаки |
| Контактный аллергический стоматит | Жжение, боль при приеме преимущественно острой и горячей пищи. Гиперемия слизистой оболочки полости рта. | Разлитая гиперемия в месте контакта с амальгамой, материалами протеза (золото, пластмасса и др.) через 7—10 дней после первого соприкосновения (период сенсибилизации). |
| Хронический рецидивирующий афтозный стоматит | Болезненная эрозия, гиперемия окружающей слизистой оболочки. | Эрозии овальной формы, резко болезненные, покрытые плотным, не снимающимся при поскабливании налетом, с ободком гиперемии. Эрозии рецидивируют, локализуются на участках слизистой оболочки рта, в норме не ороговевающих. Нет связи с действием травмирующего фактора. |
| Раковая язва | Длительно незаживающая язва слизистой оболочки полости рта | Длительное существование (до нескольких месяцев) язвы, отсутствие тенденций к заживлению после устранения травмирующего фактора. Уменьшение болезненности, уплотнение краев и основания язвы, регионарные лимфатические узлы увеличены, спаяны с окружающими тканями, безболезненны. В соскобе с поверхности язвы атипичные эпителиальные клетки. Раковая язва не всегда связана с механической травмой. |
| Твердый шанкр (язвенная форма) | Язва на слизистой оболочке рта, красной кайме губы. | Длительное существование язвы, отсутствие боли, плотные края и основание. Края ровные, дно гладкое, окружающая слизистая оболочка не изменена. Лимфатические узлы увеличены, плотные. В соскобе с язвы бледная трепонема. Реакция Вассермана положительная. |
| Туберкулезная язва | Язва, боль при приеме пищи, разговоре. Увеличение лимфатических узлов | Резко болезненная язва имеет мягкие неровные края, зернистое дно. Нередко на поверхности и вокруг язвы имеются желтые точки — зерна Трела. В анамнезе туберкулез легких, иногда его выявляют при обследовании |
| Трофическая язва | Язва на слизистой оболочке полости рта, во время приема пищи боль разной выраженности. Возможна связь с травмирующими факторами. | Длительное существование язвы без тенденции к эпителизации даже после устранения травмирующего фактора. Наблюдается у больных с сердечно-сосудистой и сердечно-легочной недостаточностью II—III степени. Язва покрыта фибринозным налетом, слабо болезненна, располагается на слегка гиперемированном фоне. Лимфатические узлы не увеличены. Эпителизация возможна только при лечении общего заболевания. |
Лечение
Лечение хронических травматических повреждений СОПР предусматривает обязательное устранение травмирующего агента, обработку язвы и полости рта растворами антисептиков. При наличии некротизированных тканей их удаляют механически под анестезией или с помощью протеолитических ферментов. Чистые эрозии и язвы обрабатывают препаратами, которые усиливают эпителизации и выздоровление.
Тактика лечения:
Выбор метода лечения зависит от нозологической формы хронической механической травмы. При лечении больного следует соблюдать следующие принципы:
1. Устранение местного травмирующего фактора, удаление разрушенного зуба, лишенного функционально ценности.
2. Сошлифовывание острых краев зубов
3. Коррекция протеза
4. Удаление зубных отложении
5. Санация полости рта
6. Обезболивание
7. Очистка поверхности эрозии и язвы от некротического налета
8. Антисептическая обработка
9. Стимуляция эпителизации
Таблица - 5. Данные о этапах лечения
| Этапы лечения | Средства лечения | Способ применения | Цель использования | Механизм действия |
| Устранение местного травмирующего фактора, удаление разрушенного зуба, лишенного функционально ценности | Хирургический инструментарий | Устранить травму слизистой оболочки | Ликвидация очага хронического воспаления | |
| Сошлифовывание острых краев зубов | Карборундовые камни, диски алмазные, другие полировочные инструменты | Турбинный, механический наконечник | Устранить травму слизистой оболочки полости рта | Способствует устранению воспаления, стимулирует регенерацию |
| Коррекция протеза | Ортопедическое отделение | Коррекция или изготовление нового протеза | Устранить хроническую травму | Снижение или устранение воспаления слизистой оболочки |
| удаление зубных отложении | Набор кюреток, ультразвуковой скалер и др. | Механическое удаление зубных отложений, налета | Устранить возможную травму и инфицирование | Снижается механическое воздействие на слизистую оболочку, десну и инфицирование полости рта |
| Санация полости рта | Лечение кариеса, его осложнений, болезней пародонта и др. | Предупредить возможные осложнения эрозии, язвы. | Снижается возможность вторичного инфицирования и травмы. | |
| Обезболивание | Лидокаин аэрозоль 10%, | Аэрозоль 1-3 дозы , | Устранить или уменьшить боль во время приема пищи и дальнейшего лечения. | Блокируют чувствиительные окончания нервных волокон слизистой оболочки полости рта. |
| Антисептическая обработка | 0,06% раствор хлоргексидина,, 1% раствор перекиси водорода и др. | Обработка ватными тампонами, ротовые ванночки | Ослабить или устранить действие вторичной инфекции | Бактерицидное действие на микрофлору, денатурация белка бактериальной клетки, дезодорирующее действие |
| Стимуляция эпителизации | Ретинола ацетат, актовегин (желе, мазь), солкосерил (гель, мазь), масло шиповника и др. | Аппликации на 15—20 мин. | Ускорить эпителизацию эрозий и язв | Стимулируют регенерацию, ускоряют заживление вследствие улучшения обменных процессов в слизистой оболочке, эпителии |
регулирование и коррекция характера питания, стол №15
Медикаментозное лечение: [4 9 10 11 13 14].
Местная медикаментозная терапия: местноанестезирующие препараты, очистка поверхности эрозии и язвы от некротического налета ферментами, антисептические препараты, воздействие на очаг с целью уменьшения явлений гиперкератоза, кератопластические, влияющие на тканевой обмен препараты, антибиотики, гипосенсибилизирующие, седативные препараты, витаминотерапия.
Медикаментозное лечение, оказываемое на амбулаторном уровне:перечень основных лекарственных средств с указанием формы выпуска (имеющих 100% вероятность применения)
Местная медикаментозная терапия
1. Лидокаин аэрозоль 10%, 1-3 дозу аэрозоля на пораженный область слизистой полости рта с целью обезболивания перед обработкой раневой поверхности.
2. Трипсин по 0,005 и 0,01 г, 10 мг препарата растворяют в 15—20 мл дистиллированной воде в виде аппликаций на элемент поражения на 3-5 мин до полного удаление некротических масс.
3. 3% раствор перекиси водорода для антисептической обработки поверхность язвы 1 раз в день.
4. Хлоргексидина биглюконат, раствор, 0,05% для антисептической обработки поверхность язвы 3 раза в день перед наложением мази для аппликации.
Другие виды лечения:
Другие виды лечения, оказываемые на амбулаторном уровне:
- физиотерапевтическое лечение (УВЧ-терапия, СВЧ-терапия, озоно-, лазеро-, ультразвуковая терапия). [5]
Хирургические вмешательство: нет
Индикаторы эффективности лечения.
· удовлетворительное состояние;
· эпителизация и восстановление целостности эпителий слизистой полости рта
Больные в хирургической стоматологии. Заживление слизистой полости рта
Отделение хирургической стоматологии ФГБУ "Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии" Минздрава РФ, Москва
ГБОУ ДПО «Российская медицинская академия последипломного образования»
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии;
Первый МГМУ им. И.М. Сеченова
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздрава России, Москва, Россия
Современные раневые покрытия в хирургической стоматологии
Журнал: Стоматология. 2016;95(4): 87‑90
Проанализированы современные раневые покрытия, применяемые в хирургической стоматологии и челюстно-лицевой хирургии. Описаны их виды и свойства. Приведены результаты их клинического применения при хирургических вмешательствах в полости рта.
Раневой процесс в полости рта (ПР) отличается от такового в других частях человеческого тела. Заживление ран протекает во влажной среде на фоне большого количества микроорганизмов, множества травмирующих факторов. Наряду с этим слюна и десневая жидкость содержат значительное количество факторов иммунной защиты и биологически активных веществ, стимулирующих процессы регенерации. Раны П.Р. заживают быстрее ран кожных покровов, что связано с более развитой кровеносной системой, ускоренной пролиферацией клеток [4].
Лечение ран ПР представляет большой интерес. В хирургической стоматологии часто возникает потребность в лечении обширных постоперационных дефектов мягких тканей ПР. К основным хирургическим методам, приводящим к обширным раневым дефектам, следует отнести: иссечение новообразований ПР (дольчатая фиброма, лейкоплакия); забор мягкотканных трансплантатов; операции по увеличению глубины преддверия ПР в различных модификациях. При подобных операциях чаще всего применяется рассечение тканей скальпелем. Если удаляют или рассекают небольшой по площади участок тканей и края раны сближают швами без натяжения, обычно наступает быстрое заживление с формированием малозаметного рубца. Если же иссечение ткани проводят на большом протяжении и сблизить края раны не удается, заживление происходит вторичным натяжением с образованием рубца, который может ограничивать подвижность нижней челюсти, языка [8].
Последующее лечение направлено на изоляцию раневого дефекта от агрессивной среды ПР, стимуляцию заживления, снижение послеоперационной боли. Всем этим требованиям отвечает особый класс лекарственных форм для местного применения - раневые покрытия, которые с успехом используют в раннем послеоперационном периоде.
Сотрудниками отделения хирургической стоматологии Центрального НИИ стоматологии и челюстно-лицевой хирургии проведен обзор литературы, посвященной применению различных раневых покрытий в хирургической стоматологии за последние 10 лет. Использованы научные данные отечественных авторов о результатах клинического применения раневых покрытий.
Раневые покрытия - композиционные системы разной степени сложности, сочетающие свойства повязки и лекарственного средства, активно влияющего на процессы заживления раны. Для эффективного местного лечения ран, в том числе нагноившихся, термических, необходимо иметь большой набор перевязочных материалов, отвечающих принципам патогенетической терапии [36].
В настоящее время не существует единой классификации раневых покрытий, использующихся в стоматологии [1]. По аналогии с клиникой общей хирургии, в которой тема «раны и раневые поверхности» более широко изучена, раневые покрытия классифицируют по типу воздействия на рану: 1) сорбционные; 2) защитные; 3) содержащие лекарственные препараты; 4) атравматичные, а также по происхождению (синтетические и биологические), по структуре: 1) гидроколлоиды; 2) гидрогели; 3) перфорированные повязки; 4) пленочные однослойные и по типу фиксации к тканям (адгезивные и неадгезивные). Данная классификация частично применима в хирургической стоматологии, однако требует пересмотра и адаптации в соответствии с физиологическими особенностями ПР и спецификации методов оперативного лечения.
Сегодня в российской стоматологии прошли клиническую апробацию и широко используются около 30-40 раневых покрытий отечественного и зарубежного производства для лечения ран мягких тканей П.Р. Часть этих материалов разработаны специально для стоматологии, другие - используют в клинике общей хирургии. Как правило, все раневые покрытия имеют сложный композиционный состав: полимерная основа (коллаген, акрилаты, гидроколлоиды) и дополнительные вещества (хитозан, ферменты, антисептики). Стоит также отметить, что эти лекарственные формы существенно различаются по ценам и производятся как за рубежом, так и в РФ (см. таблицу).
Раневые покрытия, сертифицированные и апробированные на территории РФ
Наиболее широкое распространение в стоматологии получили раневые покрытия (полимерные адгезивные пленки) «Диплен» [43]. Доказана их высокая эффективность при травмах слизистой ПР разного генеза [2]. Отмечено, что при использовании раневых покрытий «Диплен» достигается более быстрое заживление послеоперационных ран с меньшим количеством осложнений, тогда как в группе сравнения дольше наблюдались отек, боль, были более выражены признаки воспаления слизистой оболочки [25]. Включение в состав пленок иммуномодуляторов оказывает стимулирующее действие на кислородный метаболизм фагоцитов без выраженного истощения клеточных ресурсов, что положительно сказывается на течении раневого процесса [44]. В настоящее время разработаны материалы с бактерицидным и фунгицидным действием [42].
Материалы на основе факторов свертывания крови используют для лечения открытых раневых дефектов [5, 6]. Имеются данные об эффективности богатой тромбоцитами плазмы для покрытия дефектов после вестибулопластики. А.И. Грудянов и А.И. Ерохин использовали ее для лечения дефектов (10-11 см 2 по площади) нижней губы после вестибулопластики по Эдлан-Мейхер в модификации Шмидта. Отмечены более быстрые сроки заживления, однако данному покрытию свойственна слабая адгезия к тканям [18]. Более широко распространены раневые покрытия на основе коллагена и факторов свертывания крови. Они обладают хорошей адгезией к кровоточащим операционным ранам, обеспечивают гемостаз даже у пациентов с артериальной гипертензией [22]. В хирургии используют покрытие Тахокомб, которое представляет собой готовую к применению стерильную коллагеновую пластину с фибриногеном и тромбином [16]. При лечении онкологических заболеваний челюстно-лицевой области применение покрытия Тахокомб способствует более легкому течению послеоперационного периода и быстрому восстановлению больных, а также сокращению длительности госпитализации [20]. Изучена эффективность раневого покрытия Тахокомб при вестибулопластике, при которой оно обеспечивает изоляцию операционной раны на период заживления. Срок биодеградации материала достигает 14-16 дней [21, 22, 30, 31]. По данным Е.А. Шеремета и соавт. (2012), операционная рана у пациентов основной группы заживала в сроки до 10±0,9 дня без признаков воспаления, в контрольной группе (йодоформная турунда) период заживления достигал 14-16±1,1 дня [45]. Доказана эффективность препарата при лечении альвеолита: выявлены меньшие сроки сохранения болевого синдрома, утраты трудоспособности, меньшее число визитов к врачу [37, 38].
Заслуживают внимания коллагеновые раневые покрытия с протеолитическими ферментами. К числу таких композиций относят покрытие Дигестол - коллагеновую губку, в состав которой входит фермент дигестаза - комплекс коллагенолитических трипсиноподобных протеаз. Лизируясь в раневом экссудате, губка Дигестол освобождает фермент в активном состоянии. Таким образом, некролитическая активность покрытия сочетается с противовоспалительным и стимулирующим регенерацию действием [3]. В литературе есть данные об использовании губки Дигестол для закрытия донорских раневых участков в ПР при операции устранения рецессии десны.
В настоящее время в медицине применяют раневые покрытия на основе хитозан-коллагенового соединения: «Коллахит-Г», «Коллахит-Ш», «Коллахит-ФА» [10, 11].
Хитозан получают из панцирей морских крабов, креветок, криля, омаров, лангустов, раков путем удаления ацила (карбонового соединения), который придает жесткость хитину. Эти материалы обладают высокой адгезией к тканям, оказывают антисептическое и пластическое действие [19, 35, 47, 49]. Адгезивные свойства хитозана делают его полезным для доставки лекарственных средств через слизистые оболочки. Доказана эффективность коллаген-хитозанового покрытия при местном лечении ожоговых ран в эксперименте и клинике; оно увеличивает скорость заживления ожоговых ран благодаря ускоренному образованию грануляционной, волокнистой соединительной ткани, уменьшению толщины струпа [12, 14, 24].
Заслуживают внимания прозрачные раневые покрытия на полимерной основе. Описано оперативное лечение 24 пациентов с дольчатыми фибромами ПР [46]. Для закрытия раневых дефектов использовали медицинский силикон, который фиксировали швами. При средних дефектах 3,3 см 2 авторы применяли силиконовую мембрану, при больших дефектах - 13,7 см 2 - дополнительно новосформированное преддверие ПР «закрепляли» силиконовым валиком путем чрескожной фиксации. Указано на возможность введения лекарственных средств под мембрану, наблюдения за раневым процессом через прозрачный силикон. Отмечено заживление дефектов в среднем на 20-й день после операции [46].
В диссертационной работе Д.А. Мочаловой (2015) в эксперименте и клинике изучено раневое покрытие Реперен, представляющее собой прозрачную полимерную двухслойную мембрану на метакрилатной основе. Материал фиксируют к поверхности раны швами, заживление открытого участка слизистой происходит под мембраной. Автором доказано, что использование раневого покрытия Реперен повышает скорость регенерации тканей, снижает болезненность в сравнении с таковой в группе контроля, где раневые дефекты вели «открытым» способом. В другом исследовании доказана безопасность Реперена при краниопластике для закрытия дефектов твердой мозговой оболочки. Вокруг материала на 60-е сутки эксперимента формируется плотная соединительнотканная капсула [40].
Существуют также прилипающие, сорбирующие покрытия на основе природных и синтетических полимеров. К ним относятся альгинаты (Альгипор). Препарат представляет собой листы пористого материала. Пористая структура обеспечивает высокую всасывающую способность и необходимое прилегание к влажной поверхности раны [13, 15].
Есть данные об эффективности коллагеновых мембран и матриксов, которые используют для наращивания объема кератинизированной десны. Эти материалы можно приравнять к раневым покрытиям, поскольку их применяют для изоляции открытой раневой поверхности и стимуляции ее заживления. Х.Х. Мухаев и соавт. (2008) предложили использовать лиофилизированную твердую мозговую оболочку, насыщенную препаратом плаценты, при вестибулопластике по методике Кларк. Авторы наблюдали адгезию трансплантата на 5-6-е сутки, эпителизацию раневого дефекта на 10-12-е сутки [33]. Имеются данные о высокой эффективности коллагенового матрикса Мукографт в хирургической коррекции зоны кератинизированной десны [7, 9, 48]. При вестибулопластике с использованием Мукографта новосформированная ткань гистологически идентична кератинизированной десне. По мнению авторов, использование коллагенового матрикса позволяет хирургу отказаться от применения донорских участков твердого неба [39].
Отдельный класс раневых покрытий - гидроколлоиды. Основу гидроколлоида обычно составляют микрогранулы натриевой соли карбоксиметилцеллюлозы, пектина и желатины, диспергированные в адгезивной массе. Гидроколлоид сорбирует раневой секрет, переходя при этом в желеобразное состояние. В медицине нашли широкое применение раневые покрытия Грануфлекс («Granuflex»). Внешний слой покрытия представлен полиуретановой пленкой, соединенной с полиуретановой губкой, которые служат основой для фиксации гидроколлоидной основы [5, 6].
Накоплен большой опыт в использовании пародонтальных повязок для изоляции зоны оперативного вмешательства при оперативных вмешательствах на пародонте в ранний постоперационный период [17]. Пародонтальные повязки (Septo-pack, Coe-pack, Voco-pack, Perio-pack) показаны при операциях на «неподвижных» мягких тканях (прикрепленная десна) [34]. Они самоотвердеющие, имеют пластичную консистенцию, что облегчает их фиксацию.
В настоящее время успешно апробирован медицинский клей при оперативных вмешательствах в ПР [28, 29]. Область применения медицинского клея в хирургической стоматологии достаточно широкая: изоляция раневых поверхностей при мукогингивальной хирургии, лоскутных операциях, удалении зубов, цистэктомии [27]. Клей представляет собой бесцветную прозрачную жидкость со специфическим запахом, состоит из этил-α-цианакрилата (связующий компонент), бутилакрилата (пластификатор) и сульфоланметакрилата (противовоспалительный, антимикробный компонент). При контакте с влажной средой клей быстро полимеризуется с образованием прочной эластичной пленки [26]. Он обладает хорошими адгезивными свойствами и при полимеризации плотно фиксирует фрагменты склеиваемых тканей. Возможно применение клея как раневого покрытия. Полное рассасывание клея происходит через 30-45 дней после нанесения в зависимости от толщины клеевого слоя и характера тканей.
Представленный анализ литературы позволяет заключить, что вопрос лечения послеоперационных дефектов мягких тканей ПР остается актуальным и до конца не решенным. Отсутствует единая классификация раневых покрытий. Не проведена сравнительная оценка эффективности (адгезия, сроки заживления, уровень послеоперационной боли) раневых покрытий, применяемых в отечественной стоматологии. Не изучена эффективность вышеописанных раневых покрытий на разных этапах раневого процесса и при разных способах хирургического воздействия на ткани П.Р. До конца не определены показания к применению указанных лечебных средств.
Московский государственный медико-стоматологический университет
Кафедра патологической физиологии, кафедра госпитальной терапевтической стоматологии, пародонтологии и гериартрической стоматологии Московского государственного медико-стоматологического университета
Кафедра госпитальной терапевтической стоматологии, пародонтологии и гериатрической стоматологии Московского государственного медико-стоматологического университета
Заживление хирургической раны слизистой оболочки полости рта под влиянием применения рекомбинантного эпидермального фактора роста в эксперименте
Журнал: Российская стоматология. 2011;4(1): 32‑37
Воложин А.И., Гемонов В.В., Кабалоева Д.В., Суражев Б.Ю. Заживление хирургической раны слизистой оболочки полости рта под влиянием применения рекомбинантного эпидермального фактора роста в эксперименте. Российская стоматология. 2011;4(1):32‑37.
Volozhin AI, Gemonov VV, Kabaloeva DV, Surazhev BIu. Healing of surgical wound in oral mucosa after the treatment with recombinant epidermal growth factor in experiment. Russian Stomatology. 2011;4(1):32‑37. (In Russ.).
Экспериментальное исследование позволило установить благоприятное влияние применения рекомбинантного эпидермального фактора роста на регенерацию при лечении ран слизистой оболочки полости рта у здоровых крыс. Анализ полученных данных показал, что преимущественное усиление репаративной регенерации было достигнуто при повышении концентрации препарата в питьевой воде до 500 мкг/мл.
Факторы роста при лечении ран
Травма слизистой оболочки полости рта является распространенной причиной обращения за стоматологической помощью. Ее возникновение обусловлено различными причинами: хирургическими вмешательствами, ожогами и повреждениями при местном применении лекарственных препаратов; нарушением целостности слизистой оболочки в период адаптации к съемным протезам; механическим воздействием на десну и слизистую оболочку во время препарирования зубов, краем искусственной коронки и др. Негативные особенности заживления подобных ран обусловлены наличием в полости рта разнообразной микробной флоры, постоянной механической и термической нагрузкой на ткани этой локализации и высокой специфичностью их гистологического строения [9]. Несмотря на различную этиологию поражений, общим принципом лечения таких пациентов в стоматологической клинике является применение средств, направленных на регенеративные процессы в тканях [3]. Учитывая, что регенерация тканей представляет собой четко регулируемый каскадный и многокомпонентный морфофункциональный процесс, обеспечиваемый сложными кооперативными межклеточными взаимодействиями, представляет интерес поиск препаратов, применение которых обеспечило бы наилучший результат регенерации слизистой оболочки полости рта [4, 7]. Получение рекомбинантного эпидермального фактора роста (РЭФР) и его экспериментальное испытание на моделях регенерации эпидермиса явилось мощным толчком к развитию этого направления. РЭФР не обладает видовой специфичностью, т.е. функционирует у животных различных видов. Эпидермальный фактор роста (ЭФР) специфически связывается с рецепторами на поверхности клеточных мембран, стимулируя тем самым пролиферацию, таксис и дифференциацию клеток, что способствует быстрому и качественному заживлению ран [5, 10]. Этот фактор управляет ростом клеток эпителия, эндотелия и фибробластов, регулирует их хемотаксис [2]. При повреждениях в полости раны количество рецепторов к ЭФР возрастает [6]. Это вызывает перемещение клеток из здоровых неповрежденных тканей в пораженные участки [1, 8]. Эффективность отечественного РЭФР для оптимизации заживления ран слизистой оболочки полости рта еще не была изучена в эксперименте. Сейчас РЭФР проходит экспериментальную проверку, по итогам которой может быть рекомендован в качестве специфического стимулятора заживления ран на слизистой оболочке полости рта.
Целью настоящей работы явилось экспериментальное обоснование применения РЭФР для оптимизации заживления повреждений слизистой оболочки полости рта.
Материал и методы
ЭФР относится к группе факторов роста (цитокины) и является полипептидом, состоящим из 53 аминокислот, его молекулярная масса 6021 Д. Фактор устойчив к действию кислот и высоких температур. Относится к наиболее стабильным из всех изученных белков. ЭФР играет значительную роль в регуляции обменных и восстановительных процессов, присутствуя в клетках всех тканей организма и регулируя рост клеток. Стимулирует таксис противовоспалительных клеток, что способствует быстрому и качественному заживлению ран.
Эксперимент выполнен на 36 белых крысах линии Вистар, массой 220-280 г. Под наркозом (Zoletil 50, «Vibrac», Франция) животным наносили круглые раны диаметром 5 мм на твердом небе до кости. Кровотечение останавливали гемостатической губкой. Животных были разделены на 3 группы по 12 крыс в каждой. В 1-й группе животные постоянно получали чистую питьевую воду; во 2-й группе животным давали воду с РЭФР в концентрации 100 мкг/мл; в 3-й группе животные получали воду с РЭФР в концентрации 500 мкг/мл. Растворы для питья готовили ежедневно, хранили при температуре -40°С. Воду с РЭФР животные 2-й и 3-й групп получали с 9 до 18 ч, в остальное время крысы пили обычную водопроводную воду, потребляли одинаковое количество жидкости, получали сбалансированный брикетированный корм. Из эксперимента животных выводили на 3, 7, 14 и 21-е сутки.
Выделяли верхнюю челюсть, фиксировали в 10% нейтральном формалине, декальцинировали в трилоне Б, заливали в целлоидин. Микропрепараты окрашивали гематоксилином и эозином, PAS-реакцией, азокармином, импрегнировали серебром. Динамику заживления ран оценивали планиметрически и патоморфологически, гистохимическую оценку репаративного процесса проводили по содержанию гликозаминогликанов, гликогена и нуклеиновых кислот.
РЭФР предоставлен ГНИИ особо чистых биопрепаратов (Санкт-Петербург). В России РЭФР синтезирован из E. сoli.
Результаты и обсуждение
В 1-й группе на 3-й день наблюдений диаметр раны у всех животных не отличался от первоначального в момент ее нанесения. Края раны ровные, на поверхности тонкий, мягкий струп из сохранивших жизнедеятельность лейкоцитов, склеенных плазмой. Центральная часть раны ограничена пластом многослойного эпителия. Дно дефекта образовано костной тканью твердого неба, покрытой утолщенной надкостницей (рис. 1). Рисунок 1. Раневой дефект на 3-и сутки (1-я группа). Костная ткань на дне дефекта. Утолщенная надкостница. Окраска гематоксилином и эозином. ×200. В самой кости и в надкостнице воспалительный процесс. Наряду с ним на границе дефекта с тканью отмечено начало репаративных процессов. На 7-е сутки область раны окружена пластом эпителия, внедряющимся под струп (рис. 2). Рисунок 2. Слизистая оболочка твердого неба на участке раны к 7-м суткам эксперимента (1-я группа). Наползающий пласт эпителия. Окраска гематоксилином и эозином. ×200. Диаметр дефекта уменьшается за счет наползания пласта эпителия под струп. Под струпом на поверхности кости располагается утолщенная надкостница с клетками фибробластического ряда. В клетках регенерирующего эпителия гранулы гликогена, заполняющие цитоплазму новообразованных клеток (рис. 3). Рисунок 3. Слизистая оболочка твердого неба на участке раны к 7-м суткам эксперимента (1-я группа). Гликоген в наползающем пласте эпителия. Окраска: PAS-реакция. ×200. По краю дефекта происходит образование грануляционной ткани, ее основная масса представлена фибробластами различной степени зрелости, макрофагами, отдельными сегментоядерными лейкоцитами и тонкими пучками коллагеновых волокон. Фибробласты заполняли саму зону дефекта, формируя поверх костной ткани грануляционную ткань, содержащую кровеносные капилляры, по которой шло напластование эпителия. На 14-е сутки сохранялся тонкий струп. Пласт эпителия продолжал свое движение к центру дефекта. В эпителии появлялись клетки с признаками паракератоза, что свидетельствует о дифференциации клеток. Гликогенсодержащие клетки располагались непосредственно на мигрирующем крае эпителиального пласта. По мере дифференциации эпителиоцитов глыбки гликогена в них исчезали. Наползание пласта эпителия шло по грануляционной ткани, в этот период отмечалось увеличение коллагеновых волокон, происходило восстановление соединительнотканной основы (рис. 4). Рисунок 4. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (1-я группа). Новообразованные пучки коллагеновых волокон (синего цвета) в зоне дефекта. Окраска азокармином. ×200. Незакрытым пластом эпителия оставался лишь центральный участок дефекта. На 21-е сутки зона дефекта во всех наблюдениях была перекрыта утолщенным эпителием с менее выраженным роговым слоем. Нижняя поверхность его имела ровную границу. Под эпителием волокнистая соединительная ткань, богатая фибробластами различной степени зрелости. Обнаруживаются кровеносные сосуды, заполненные форменными элементами. В двух случаях центр дефекта оставался незакрытым эпителием, что связано с воспалительным процессом. При этом на поверхности дефекта находился струп, и эпителизация шла под его поверхностью.
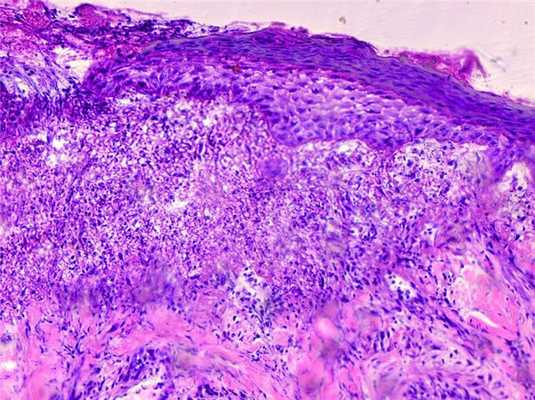
Во 2-й группе (РЭФР 100 мкг/мл) на 3-и сутки дефект покрыт эластичным струпом. Отмечается образование грануляционной ткани. По краям раны утолщенный пласт регенерирующего эпителия без ороговения, а в его клетках выявлялся гликоген (рис. 5). Рисунок 5. Слизистая оболочка твердого неба на участке раны к 3-м суткам эксперимента (2-я группа). Начало эпителизации. Наползание эпителия под струпом. В пласте эпителия содержится гликоген. Окраска: PAS-реакция. ×200. Под струпом скопление фибробластов, макрофагов, лейкоцитов. Средняя часть дефекта заполнена рыхло расположенными лейкоцитами и макрофагами, а также фибробластами различной степени зрелости. Костная ткань покрыта утолщенной надкостницей, в составе которой обнаруживались остеобласты. В некоторых случаях отмечалось образование костной ткани. На 7-е сутки эксперимента по краю раны прогрессирующая эпителизация. Эпителиальный пласт утолщен, внедряется под струп, имеет ровную нижнюю поверхность. Толщина струпа неравномерна и варьировала в широких пределах. Эпителиальные сосочки отсутствовали.
В новообразованном эпителии гликоген в виде мелких глыбок (рис. 6). Рисунок 6. Слизистая оболочка твердого неба на участке раны к 7-м суткам эксперимента (2-я группа). Пласт новообразованного эпителия внедряется под расположенный на поверхности дефекта струп. В эпителии располагается гликоген. Окраска: PAS-реакция. ×200. Под эпителием типичная грануляционная ткань с наличием капилляров и клеток: фибробластов, отдельных макрофагов, а ближе к центру дефекта располагались лейкоциты. Репаративные процессы шли от периферии к центру дефекта. Это относилось к образованию грануляционной ткани и процессу эпителизации дефекта. Сам процесс эпителизации происходил быстрее по сравнению с аналогичным сроком у животных 1-й группы. Это ускорение репаративных процессов относилось и к дифференциации новообразованного пласта эпителия. На 14-е сутки значительная часть дефекта была покрыта утолщенным пластом новообразованного эпителия. У одной из крыс отмечено полное перекрытие дефекта эпителием, характеризующимся выраженным роговым слоем (рис. 7). Рисунок 7. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (2-я группа). Большая часть дефекта закрыта эпителием с явлением ороговения. Окраска гематоксилином и эозином. ×200. Его поверхностную часть образовывали клетки с явлениями ороговения, и лишь клетки самой передней части эпителиального клина не имели признаков ороговения. В них обнаруживались скопления гликогена, которые сливались в однородную массу. Под эпителием располагалась грануляционная ткань с коллагеновыми и аргирофильными волокнами (рис. 8). Рисунок 8. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (2-я группа). Коллагеновые и аргирофильные волокна в расположенной под эпителием ткани. Окраска: импрегнация серебром. ×400. У остальных крыс большая часть дефекта покрыта новообразованным пластом эпителия. На 21-е сутки дефекты у всех крыс были эпителизированы. По краям раны структура эпителия была полностью восстановлена, сам пласт немного утолщен (рис. 9). Рисунок 9. Слизистая оболочка твердого неба на участке раны к 21-м суткам эксперимента (2-я группа). Область дефекта закрыта утолщенным пластом эпителия с наличием в клетках шиповатого слоя следов гликогена. Окраска: PAS-реакция. ×400. Струпа на поверхности раны нет. Дифференциация эпителия шла от центра дефекта к его периферии. По периферии отмечалось полное восстановление структуры эпителиального пласта. Имело место восстановление рогового слоя и соединительнотканной основы, состоявшей из пучков коллагеновых волокон. Нижняя поверхность эпителиального пласта имела на большом протяжении сосочки, их появление шло от периферии дефекта к его центру.
В 3-й группе (РЭФР 500 мкг/мл) уже на 3-и сутки было отмечено наползание эпителия с краев дефекта, на поверхности которого располагался тонкий струп (рис. 10). Рисунок 10. Слизистая оболочка твердого неба на участке раны к 3-м суткам эксперимента (3-я группа). Наползание толстого пласта новообразованного эпителия. Эпителий внедряется под струп. Окраска гематоксилином и эозином. ×400. Толщина и рост наползающего под струп новообразованного эпителия более интенсивны, чем в 1-й группе. Утолщение идет в основном за счет клеток шиповатого слоя. Под пластом новообразованного эпителия образовывалась грануляционная ткань, богатая фибробластами различной степени зрелости и макрофагами. Новообразованный эпителий имел толстый роговой слой, нижняя поверхность эпителия была неровная за счет образованных здесь эпителиальных сосочков. На 7-е сутки эпителизация дефекта в сравнении с 1-й группой была более интенсивной. Эпителий покрывал большую часть дефекта, имел довольно толстый роговой слой. Активно образовывалась волокнистая соединительная ткань. Струп большей частью отсутствовал, и в этих участках поверхность дефекта была перекрыта тонкой эластичной пленкой, состоящей из плазмы крови и отдельных лейкоцитов. Под пластом эпителия располагалась новообразованная соединительная ткань с пучками рыхло расположенных коллагеновых волокон, а также разнообразных клеточных элементов. Вся площадь дефекта заполнена волокнистой соединительной тканью, которая ниже новообразованного пласта эпителия срасталась с надкостницей. Кость имела строение, типичное для пластинчатой кости, на ее поверхности располагались остеобласты. В некоторых участках отмечались узуры, заполненные соединительной тканью. На 14-е сутки у всех крыс дефект перекрыт эпителием с выраженным роговым слоем (рис. 11). Рисунок 11. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (3-я группа). Новообразованный пласт эпителия, перекрывающий зону травмы. На поверхности пласта четко виден роговой слой. Окраска гематоксилином и эозином. ×200. На его поверхности располагались уплощенные роговые чешуйки, которые местами слущивались. Лишь в отдельных случаях в самом центре дефекта имелся утолщенный пласт эпителия. Скорость пролиферации эпителия заметно увеличивалась. Подлежащая соединительная ткань построена из волокнистых структур, изменяющих свое расположение. Часть из них располагалась параллельно пласту эпителия. Нижняя поверхность эпителия образовывала выросты или сосочки. Подлежащая костная ткань имела обычную структуру, характерную для пластинчатой кости. На 21-е сутки выявлена полная регенерация эпителия, восстановлена и структура эпителиального пласта. На всем протяжении на поверхности эпителия имело место восстановление рогового слоя (рис. 12). Рисунок 12. Слизистая оболочка твердого неба на участке раны к 21-м суткам эксперимента (3-я группа). Новообразованный утолщенный пласт эпителия с выраженным роговым слоем. Коллагеновые волокна в подлежащей соединительной ткани. Окраска азокармином. ×400. Роговые чешуйки плотно прилежат друг к другу. Сам роговой слой отличался от остальных слоев по окраске. Гликоген в новообразованном эпителии нигде не выявлялся. Нижняя поверхность эпителиального пласта имеет волнообразный вид за счет образовавшихся здесь эпителиальных сосочков. Соединительная ткань собственной пластинки слизистой оболочки содержала волокнистые структуры и клеточные элементы, главным образом фибробласты.
Таким образом, исследование установило благоприятное влияние применения РЭФР при заживлении ран слизистой оболочки полости рта. Анализ полученных данных показал, что наиболее оптимальной концентрацией препарата является 500 мкг/мл. Именно в этом случае происходит выраженное ускорение процесса эпителизации дефекта. В целом процесс репаративной регенерации осуществляется на базе одного и того же комплекса стереотипных реакций без проявления каких-либо новых их вариантов. Говоря о влиянии РЭФР, можно лишь отметить ускорение восстановительных процессов в слизистой оболочке неба у экспериментальных животных.
В целом результаты проведенного исследования показывают хорошую репаративную способность отечественного РЭФР, что может быть использовано в дальнейшем для его клинических испытаний.
Стоматологическое лечение пациентов в процессе химио- и радиотерапии: обзор клинических подходов
Ранее сообщалось, что накопительный эффект острых и хронических форм поражений полости рта в результате химио- и радиотерапии провоцирует развитие осложненных стоматологических патологий. В данной статье рассмотрены аспекты стоматологического лечения онкологических пациентов до, во время и после соответствующей противораковой терапии.
Рак представляет собой одно из наиболее сложных для лечения заболеваний, поскольку характеризуется неконтролируемым ростом тканей и наличием дисбаланса между процессами деления и апоптоза клеток. Большинство побочных эффектов химио- и радиотерапии могут быть вызваны токсическим воздействием на специфический орган или нарушением процесса деления нормальных клеток в структуре пораженного органа.
Ниже перечислены побочные эффекты химиотерапевтических агентов, используемых для лечения рака.
- Супрессия костного мозга:
- лейкопения;
- тромбоцитопения;
- анемия;
- повышение восприимчивости к инфекциям;
- увеличение частоты развития вторично злокачественных поражений;
- Поражения желудочно-кишечного тракта:
- тошнота;
- рвота;
- диарея;
- мукозит;
- Поражения кожи:
- эритема;
- макулопапулезная сыпь;
- эксфолиативный дерматит;
- алопеция;
- гиперпигментация;
- светочувствительность;
- Необратимая кардиомиопатия.
- Токсичное поражение легких.
- Гепатотоксичный эффект.
- Токсичное поражение почек.
- Нейротоксические эффекты по типу боли, периферической невропатии, судорог.
- Подавление сперматогенеза, оогенеза и менструального цикла.
- Поражения полости рта:
- мукозит;
- инфекционные поражения (бактериальные, вирусные, грибковые);
- кровотечения;
- ксеростомия.
Профилактика и терапевтическое лечение перед началом проведения противоопухолевой терапии
Перед началом каких-либо манипуляций, направленных на лечение рака, рекомендована предварительная диагностика состояния полости рта с целью:
- предупредить дальнейшее развитие заболеваний, которые могут обостриться во время терапии рака;
- получить данные об исходном состоянии полости рта, которые в дальнейшем будут использоваться в ходе мониторинга и анализа эффекта действия радио- и химиотерапии;
- своевременно выявить метастазы;
- минимизировать уровень дискомфорта в полости рта пациента в ходе противоопухолевой терапии.
Все пациенты с неопластическими поражениями, получающие химиотерапию, должны пройти тщательную стоматологическую диагностику, которая включает клинический осмотр и рентгенографическое исследование. Перед началом химиотерапии пациент должен быть проинструктирован и надлежащим образом мотивирован для осуществления гигиены полости рта.
В случае химиотерапии области головы и шеи нужно обязательно учесть следующие рекомендации:
- пародонтально или структурно скомпрометированные зубы подлежат удалению;
- зубы, связанные с абсцессами челюстно-лицевой области, также нужно удалять или лечить посредством эндодонтического вмешательства;
- все хирургические процедуры должны быть завершены не менее чем за 10—12 дней до начала развития нейтропении;
- желательно в полном объеме провести необходимое стоматологическое лечение, направленное на восстановление зубов, пораженных кариесом или патологической стираемостью, замену дефектных реставраций, удаление плохо фиксированных ортопедических конструкций и ортодонтических дуг;
- имеющиеся протезы следует тщательно очищать и ежедневно обрабатывать нистатином с целью профилактики развития грибковых поражений;
- у детей необходимо провести удаление подвижных молочных зубов, а также тех зубов, которые, вероятно, не удастся спасти после проведения химио- и радиотерапии, с учетом времени, необходимого для заживления лунок перед началом противоопухолевой терапии.
Рекомендации по удалению зубов у пациентов, которые планируют проходить процедуры радио- или химиотерапии
- Процедура экстракции должна быть минимально инвазивной и выполняться за 2, а лучше — за 3 недели до начала радиотерапии.
- На верхней челюсти экстракцию зубов следует проводить не менее чем за 5 дней до начала химиотерапии. На нижней челюсти — не менее чем за 7 дней.
Во избежание ранений слизистой оболочки полости рта острыми краями лунки следует сглаживать их сразу же после экстракции.
Необходимо обеспечить первичное закрытие раны.
Следует избегать внесения гемостатических препаратов внутрь лунки, поскольку в дальнейшем они могут стать очагом развития инфекции.
Если количество тромбоцитов менее 50 000 ед./мм3, процедура переливания крови обязательна.
Проведение экстракции следует отсрочить, если количество тромбоцитов в крови составляет менее 2000 ед./мм3 или же количество нейтрофилов менее 1000 ед./мм3. В качестве альтернативного подхода можно провести удаление зубов с обязательным назначением антибиотиков.
Пациенты, которые хотят сохранить собственные зубы, должны быть проинформированы о возможном развитии гипосаливации, повышении риска развития инфекционных поражений по типу кариеса или остеонекроза, ассоциированных именно с эффектом химио- и радиотерапии.
Уход за полостью рта во время химиотерапии
С самого начала химиотерапии следует уделять особое внимание надлежащей гигиене полости рта с целью минимизации риска развития возможных осложнений. На сегодняшний день не существует общепринятых протоколов профилактики и лечения мукозита, индуцированного проведением химиотерапии.
Полоскания полости рта физиологическим или бикарбонатным растворами способствуют купированию симптомов мукозита, удалению зубного налета, разбавлению кислот и токсинов в среде полости рта. Некоторые коммерчески доступные ополаскиватели, например перекись водорода, могут негативно воздействовать на полость рта при наличии мукозита, поэтому использование таковых пациентами должно быть прекращено.
Учитывая повышенную вероятность инфицирования полости рта во время прохождения химиотерапии и повышение кровоточивости мягких тканей, пациентам рекомендуется проводить чистку зубов 2—3 раза в день.
Пациенты, которые подвергаются общему облучению тела или химиотерапии, также имеют вероятность развития тромбоцитопении. Кровоточивость слизистой оболочки полости рта обычно развивается при количестве тромбоцитов менее 5000 ед./мм3. Для контроля кровотечения могут быть использованы местные средства, например давящая желатиновая губка с тромбином или микрофибриллярным коллагеном, а также антифибринолитические вещества в мягкой капе. Если подобные вмешательства не дают желаемого эффекта, необходимо рассмотреть возможность переливания тромбоцитов.
Стоматолог-хирург должен быть осведомлен о количестве лейкоцитов и тромбоцитов в крови пациента, проходящего химио- или радиотерапию, еще перед началом лечения. Если количество тромбоцитов выше 50 000 ед./мм3, пациенту можно выполнять большинство рутинных стоматологических манипуляций, однако, если уровень тромбоцитов ниже указанной цифры, нужно обязательно проконсультироваться с онкологом. В случае необходимости выполнения инвазивных стоматологических вмешательств следует рассмотреть возможность переливания крови или тромбоцитарного концентрата. Если же количество тромбоцитов менее 2000 ед./мм3, рекомендуется назначить антибиотикопрофилактику и консультацию с лечащим врачом.
Кроме того, пациентам необходимо рекомендовать:
- Пить много воды и других жидкостей, кроме кофе и чая.
- В ходе проведения радиотерапии и после нее зубы могут стать гиперчувствительными, что может быть связано с уменьшением секреции слюны и снижением ее рН. Местное применение фторидного геля позволяет купировать симптомы гиперчувствительности.
- Радиотерапия области головы и шеи может спровоцировать повреждение сосудов мышц, вызвать тризм жевательных мышц и суставной капсулы. Чтобы свести к минимуму влияние излучения на мышцы челюстно-лицевой области, при внешнем облучении необходимо использовать специальные защитные капы. Пациент также должен выполнять упражнения для растяжки мышц по крайней мере 3—4 раза в день.
- В течение первых 6 месяцев после завершения лучевой терапии пациентам следует избегать использования протезов.
- Установка дентальных имплантатов может проводиться через полтора года после лучевой терапии с учетом состояния тканей ротовой полости, уровня их васкуляризации и возможного прогноза заживления.
Противорвотные средства могут использоваться для уменьшения или предотвращения симптомов тошноты и рвоты. Использование высококалорийных и высокобелковых добавок часто помогает поддерживать адекватный качественный уровень питания пациента во время противораковой терапии.
Уход за пациентами после химиотерапии
Период после химиотерапии наиболее подходит для проведения большинства стоматологических процедур. Уход за полостью рта должен включать ежедневную чистку зубов мягкими щетками. Промывание полости рта физиологическим или бикарбонатным растворами, применение лубрикантов и поверхностной анестезии, а также полоскания хлоргексидином следует продолжать, чтобы предотвратить развитие инфекционных поражений и облегчить остаточные симптомы ксеростомии. Применение фтора и консультации по поводу коррекции диеты также полезны в программе профилактики развития кариеса, индуцированного эффектом ксеростомии.
Мониторинг за пациентами после противораковой терапии следует проводить по нескольким причинам:
- пациент с онкопатологией находится в группе риска развития дополнительных поражений;
- вероятность развития скрытых метастазов;
- вероятность рецидива первичных поражений;
- риск развития осложнений, связанных с терапией.
Лечение мукозита может проводиться посредством выполнения пациентом следующих рекомендаций:
- Умеренные полоскания полости рта (раствор соль + сода).
- Местные анестетики (лидокаин 5%) и антигистаминные растворы (бензидамин хлорид).
- Противомикробные полоскания, например полоскания хлоргексидином.
- Применение противовоспалительных средств: жидкость «Камилосан» (водно-спиртовой экстракт ромашки) или стероидные препараты местного действия (дексаметазон).
- Адекватное увлажнение полости рта.
- Применение пероральных лубрикантов.
- Увлажнение воздуха.
Если у пациента после химиотерапии развилась определенная форма иммуносупрессии, а количество лейкоцитов менее 2000 ед./мм3, иммунная система не в состоянии самостоятельно побороть большинство инфекций. Кроме того, у пациентов после химио- или радиотерапии часто отмечается уменьшение саливации и развитие оппортунистических инфекций. При кандидозном поражении слизистой следует использовать противогрибковые препараты (по типу нистатина).
Остеорадионекроз после лучевой терапии
Остеорадионекроз — патологическое состояние, характеризующееся обнажением костной ткани, участки которой не в состоянии регенерировать после значительной дозы облучения. Протоколы для снижения риска развития остеорадионекроза включают в себя адекватный выбор эндодонтического лечения вместо экстракции зубов, использование нелидокаиновых местных анестетиков без содержания адреналина или же с очень низкой его концентрацией, профилактический прием антибиотиков, а также их использование после операционного вмешательства в течение двух недель, применение гипербарической оксигенации перед началом инвазивных процедур.
На ранних стадиях развития некроза показано консервативное лечение. Обнаженную кость можно промыть физиологическим раствором или раствором антибиотика, также пациенты должны быть проинформированы о необходимости промывания пораженной области при помощи ирригатора. При образовании костного секвестра его сразу следует удалить для обеспечения процесса эпителизации.
Читайте также:
