CDK как регулятор клеточного цикла
Добавил пользователь Дмитрий К. Обновлено: 01.02.2026
Клетка является элементарной единицей всего живого. Вне клетки жизни нет. Размножение клеток происходит только путем деления исходной клетки, которому предшествует воспроизведение ее генетического материала. Активация деления клетки происходит вследствие воздействия на нее внешних или внутренних факторов. Процесс деления клетки с момента ее активации называется пролиферацией. Иными словами, пролиферация - это размножение клеток, т.е. увеличение числа клеток (в культуре или ткани), происходящее путем митотических делений. Время существования клетки как таковой, от деления до деления, обычно называют клеточным циклом
Во взрослом организме человека, клетки различных тканей и органов имеют неодинаковую способность к делению. Кроме того, при старении интенсивность пролиферации клеток снижается (т.е. увеличивается интервал между митозами). Встречаются популяции клеток, полностью потерявшие свойство делиться. Это, как правило, клетки, находящиеся на терминальной стадии дифференцировки, например, зрелые нейроны, зернистые лейкоциты крови, кардиомиоциты. В этом отношении исключение составляют иммунные В- и Т- клетки памяти, которые, находясь в конечной стадии дифференцировки, при появлении в организме определенного стимула в виде ранее встречавшегося антигена способны начать пролиферировать. В организме есть постоянно обновляющиеся ткани - различные типы эпителия, кроветворные ткани. В таких тканях существуют клетки, которые постоянно делятся, заменяя отработавшие или погибающие типы клеток (например, клетки крипт кишечника, клетки базального слоя покровного эпителия, кроветворные клетки костного мозга). Также в организме существуют клетки, которые не размножаются в обычных условиях, но вновь приобретают это свойство при определенных условиях, в частности при необходимости регенерации тканей и органов. Процесс пролиферации клеток жестко регулируется как самой клеткой (регуляция клеточного цикла, прекращение или замедление синтеза аутокринных ростовых факторов и их рецепторов), так и ее микроокружением (отсутствие стимулирующих контактов с соседними клетками и матриксом, прекращение секреции и/или синтеза паракринных ростовых факторов). Нарушение регуляции пролиферации приводит к неограниченному делению клетки, что в свою очередь инициирует развитие онкологического процесса в организме.
Активация пролиферации
Основную функцию, связанную с инициацией пролиферации, берет на себя плазматическая мембрана клетки. Именно на ее поверхности происходят события, которые связаны с переходом покоящихся клеток в активированное состояние, предшествующее делению. Плазматическая мембрана клеток за счет располагающихся в ней молекул-рецепторов воспринимает различные внеклеточные митогенные сигналы и обеспечивает транспорт в клетку необходимых веществ, принимающих участие в инициации пролиферативного ответа. Митогенными сигналами могут служить контакты между клетками, между клеткой и матриксом, а также взаимодействие клеток с различными соединениями, стимулирующими их вступление в клеточный цикл, которые получили название факторов роста. Клетка, получившая митогенный сигнал на пролиферацию, запускает процесс деления.
КЛЕТОЧНЫЙ ЦИКЛ
Весь клеточный цикл состоит из 4 этапов: пресинтетического (G1), синтетического (S), постсинтетического (G2) и собственно митоза (М). Кроме того, существует так называемый G0-период, характеризующий состояние покоя клетки. В G1-периоде клетки имеют диплоидное содержание ДНК на одно ядро. В этот период начинается рост клеток, главным образом, за счет накопления клеточных белков, что обусловлено увеличением количества РНК на клетку. Кроме того, начинается подготовка к синтезу ДНК. В следующем S-периоде происходит удвоение количества ДНК и соответственно удваивается число хромосом. Постсинтетическая G2 фаза называется также премитотической. В этой фазе происходит активный синтез мРНК (матричная РНК). Вслед за этой стадией следует собственно деление клетки надвое или митоз.
Деление всех эукариотических клеток связано с конденсацией удвоенных (реплицированных) хромосом. В результате деления эти хромосомы переносятся в дочерние клетки. Такой тип деления эукариотических клеток - митоз (от греч. mitos - нити) - является единственным полноценным способом увеличения числа клеток. Процесс митотического деления подразделяют на несколько этапов: профаза, прометафаза, метафаза, анафаза, телофаза.
РЕГУЛЯЦИЯ КЛЕТОЧНОГО ЦИКЛА
Назначение регуляторных механизмов клеточного цикла состоит не в регуляции прохождения клеточного цикла как такового, а в том, чтобы обеспечить, в конечном счете, безошибочность распределения наследственного материала в процессе репродукции клеток. В основе регуляции размножения клеток лежит смена состояний активной пролиферации и пролиферативного органа. Регуляторные факторы, контролирующие размножение клеток можно условно разделить на две группы: внеклеточные (или экзогенные) или внутриклеточные (или эндогенные). Экзогенные факторы находятся в микроокружении клетки и взаимодействуют с поверхностью клетки. Факторы, которые синтезируются самой клеткой и действуют внутри нее, относятся к эндогенным факторам. Такое подразделение весьма условно, поскольку некоторые факторы, будучи эндогенными по отношению к продуцирующей их клетке, могут выходить из нее и действовать как экзогенные регуляторы на другие клетки. Если регуляторные факторы взаимодействуют с теми же клетками, которые их продуцируют, то такой тип контроля называется аутокринным. При паракринном контроле синтез регуляторов осуществляется другими клетками.
ЭКЗОГЕННЫЕ РЕГУЛЯТОРЫ ПРОЛИФЕРАЦИИ
У многоклеточных организмов регуляция пролиферации различных типов клеток происходит вследствие действия не одного какого-либо ростового фактора, а их совокупности. Кроме того, некоторые ростовые факторы, будучи стимуляторами для одних типов клеток, ведут себя как ингибиторы по отношению к другим. Классические ростовые факторы представляют собой полипептиды с молекулярной массой 7-70 кДа. К настоящему моменту известно более сотни таких ростовых факторов. Однако здесь будут рассмотрены только некоторые из них.
Пожалуй, самое большое количество литературы посвящено фактору роста из тромбоцитов (PDGF). Освобождаясь при разрушении сосудистой стенки, PDGF участвует в процессах тромбообразования и заживления ран. PDGF является мощным ростовым фактором для покоящихся фибробластов. Наряду с PDGF, не менее обстоятельно изучен эпидермальный фактор роста (EGF), который также способен стимулировать пролиферацию фибробластов. Но, кроме этого также стимулирующе влияет и на другие типы клеток, в частности на хондроциты.
Большую группу ростовых факторов составляют цитокины (интерлейкины, факторы некроза опухоли, колоние-стимулирующие факторы и т.д.). Все цитокины полифункциональны. Они могут, как усиливать, так и угнетать пролиферативные ответы. Так, например, разные субпопуляции CD4+ Т-лимфоцитов, Th1 и Th2, продуцирующие разный спектр цитокинов, по отношению друг к другу являются антагонистами. То есть, Th1 цтокины стимулируют пролиферацию клеток, которые их продуцируют, но в то же время подавляют деление Th2 клеток, и наоборот. Таким образом, в норме в организме сохраняется постоянный баланс этих двух типов Т-лимфоцитов. Взаимодействие факторов роста с их рецепторами на поверхности клетки приводит к запуску целого каскада событий внутри клетки. В результате чего происходит активация факторов транскрипции и экспрессия генов пролиферативного ответа, что в конечном итоге инициирует репликацию ДНК и вступление клетки в митоз.
ЭНДОГЕННЫЕ РЕГУЛЯТОРЫ КЛЕТОЧНОГО ЦИКЛА
В нормальных эукариотических клетках прохождение клеточного цикла жестко регулируется. Причиной онкологических заболеваний является трансформация клеток, как правило, связанная с нарушениями регуляторных механизмов клеточного цикла. Одним из основных результатов дефективности клеточного цикла является генетическая нестабильность, поскольку клетки с ущербным контролем клеточного цикла теряют способность корректно удваивать и распределять между дочерними клетками свой геном. Генетическая нестабильность приводит к приобретению новых особенностей, которые отвечают за прогрессирование опухоли. Циклин-зависимые киназы (CDK)и их регуляторные субъединицы (циклины) являются основными регуляторами клеточного цикла. Прохождение клеточного цикла достигается путем последовательной активации и дезактивации разных комплексов циклин-CDK. Действие комплексов циклин-CDK заключается в фосфорилировании ряда белков-мишеней в соответствии с фазой клеточного цикла, в которой активен тот или иной комплекс циклин-CDK . Так, например, циклин Е-CDK2 активен в поздней G1 фазе и фосфорилирует белки, необходимые для прохождения через позднюю G1 фазу и вход в S фазу. Циклин А-CDK2 активен в S и G2 фазах, он обеспечивает прохождение S фазы и вход в митоз. Циклин А и циклин Е являются центральными регуляторами репликации ДНК. Поэтому неправильная регуляция экспрессии какого-либо из этих циклинов приводит к генетической нестабильности. Было показано, что накопление ядерного циклина А происходит исключительно в тот момент, когда клетка входит в S фазу, т.е. в момент G1/S перехода. С другой стороны, было показано, что уровень циклина Е повышался после прохождения так называемой точки ограничения (R-точки) в поздней G1 фазе, а затем существенно понижался, когда клетка входила в S фазу.
ПУТИ РЕГУЛЯЦИИ CDK
Активность циклин-зависимых киназ (CDK) жестко регулируется, по крайней мере, по четырем механизмам:
1) Основной способ регуляции CDK - это связывание с циклином, т.е. в свободном виде киназа не активна, и только комплекс с соответствующим циклином обладает необходимыми активностями.
2) Активность комплекса циклин-CDK также регулируется за счет обратимого фосфорилирования. Для того чтобы приобрести активность, необходимо фосфорилирование CDK, которое осуществляется при участии CDK активирующего комплекса (САК), состоящего из циклина Н, CDK7 и Mat1.
3) С другой стороны, в молекуле CDK, в регионе, ответственном за связывание субстрата, имеются сайты, фосфорилирование которых приводит к ингибированию активности комплекса циклин-CDK. Эти сайты фосфорилируются группой киназ, включая Wee1 киназу, и дефосфорилируются фосфатазами Cdc25. Активность этих ферментов (Wee1 и Cdc25) существенно варьирует в ответ на разные внутриклеточные события, такие как повреждения ДНК.
4) В конце концов, некоторые комплексы циклин-CDK могут быть заингибированы вследствие связывания с ингибиторами CDK (CKI). Ингибиторы CDK состоят из двух групп белков INK4 и CIP/KIP. Ингибиторы INK4 (p15, p16, p18, p19) связываются с CDK4 и CDK6 и инактивируют их, предотвращая взаимодействие с циклином D. CIP/KIP ингибиторы (p21, p27, p57) могут связываться с комплексами циклин-CDK, содержащими CDK1, CDK2, CDK4 и CDK6. Примечательно, что при определенных условиях CIP/KIP ингибиторы могут усиливать киназную активность комплексов циклин D-CDК4/6
РЕГУЛЯЦИЯ G1 ФАЗЫ
В G1 фазе, в так называемой точке рестрикции (ограничения, R-точка), клетка принимает решение, делится ей или нет. Точка рестрикции - это та точка клеточного цикла, после которой клетка становится невосприимчивой к внешним сигналам вплоть до завершения всего клеточного цикла. Точка рестрикции делит G1 фазу на два функционально различных этапа: G1pm (постмитотический этап) и G1ps (пресинтетический этап). В течение G1pm клетка оценивает присутствующие в ее окружении ростовые факторы. Если необходимые ростовые факторы присутствуют в достаточном количестве, то клетка переходит в G1ps. Клетки, перешедшие в G1ps период, продолжают нормальное прохождение всего клеточного цикла даже при отсутствии ростовых факторов. Если отсутствуют необходимые ростовые факторы в G1pm периоде, то клетка переходит в состояние пролиферативного покоя (G0 фаза).
Основным результатом каскада сигнальных событий, происходящих вследствие связывания ростового фактора с рецептором на поверхности клетки, является активация комплекса циклин D-CDK4/6. Активность этого комплекса существенно возрастает уже в раннем G1 периоде. Этот комплекс фосфорилирует мишени, необходимые для прохождения в S фазу. Основным субстратом комплекса циклин D-CDK4/6 является продукт гена ретинобластомы (pRb). Нефосфорилированный pRb связывается и, тем самым, инактивирует транскрипционные факторы группы E2F. Фосфорилирование pRb комплексами циклин D-CDK4/6 приводит к высвобождению E2F, который проникает в ядро и инициирует трансляцию генов белков, необходимых для репликации ДНК, в частности генов циклина Е и циклина А. В конце G1 фазы происходит кратковременное увеличение количества циклина Е, которое предвещает накопление циклина А и переход в S фазу.
Остановку клеточного цикла в G1 фазе могут вызвать следующие факторы: повышение уровня ингибиторов CDK, депривация ростовых факторов, повреждения ДНК, внешние воздействия, онкогенная активация
РЕГУЛЯЦИЯ S ФАЗЫ
S фаза - это этап клеточного цикла, когда происходит синтез ДНК. Каждая из двух дочерних клеток, которые образуются в конце клеточного цикла, должна получить точную копию ДНК материнской клетки. Каждое основание молекул ДНК, составляющих 46 хромосом человеческой клетки, должно быть скопировано только один раз. Именно поэтому синтез ДНК регулируется крайне жестко.
Было показано, что только ДНК клеток, находящихся в G1 или S фазе, может реплицироваться. Это наводит на мысль, что ДНК должна быть для репликации и что тот кусочек ДНК, который был удвоен, теряет эту . Репликация ДНК начинается в месте связывания белков, называемых ORC (Origin of replicating complex). Несколько компонентов, необходимых для синтеза ДНК, связываются с ORC в поздней М или ранней G1 фазе, формируя пререплекативный комплекс, что собственно и дает ДНК для репликации. На стадии перехода G1/S к пререплекативному комплексу добавляются еще белки, необходимые для репликации ДНК, таким образом, образуется комплекс инициации. Когда начинается процесс репликации и образуется репликативная вилка, многие компоненты отделяются от инициирующего комплекса, а в месте инициации репликации остаются только компоненты пострепликативного комплекса.
Во многих работах было показано, что для нормального функционирования инициирующего комплекса необходима активность циклин А-CDK2. Кроме того, для успешного окончания S фазы также необходима активность комплекса циклин А-CDK2, что, собственно, и является основным регуляторным механизмом, обеспечивающим успешное завершение синтеза ДНК. Остановку в S фазе может индуцировать повреждение ДНК.
РЕГУЛЯЦИЯ G2 ФАЗЫ
G2 фаза - это этап клеточного цикла, который начинается после завершения синтеза ДНК, но до начала конденсации. Основным регулятором прохождения G2 фазы служит комплекс циклин В-CDK2. Арест клеточного цикла в G2 фазе происходит вследствие инактивации комплекса циклин В-CDK2. Регулятором перехода G2/М является комплекс циклин В-CDK1, его фосфорилирование/дефосфорилирование регулирует вход в М фазу. Повреждения ДНК или наличие нереплицированных участков предотвращает переход в М фазу.
Клеточный цикл контролируется путем взаимодействия трех типов
белков: циклинзависимые киназы (Cdk), циклины
- белки, взаимодействующие с Cdk c образованием комплексов
и ингибиторы комплексов Cdk-циклин.
Циклинзависимые киназы (Cdk) - ферменты фосфорилирующие другие
белки, изменяют их функцию. Клеточный цикл контролируется изменением
активности Cdk, которая регулируется периодическим образованием
и распадом их регуляторных субъединиц - циклинов. Смена синтезов
и разрушений различных циклинов обеспечивает переходы и протекания
различных фаз клеточного цикла. При этом концентрация Cdk
постоянна в течении всего клеточного цикла. В разные фазы
клеточного цикла образуются разные циклины, которые связываясь
с Cdk образуют различные Cdk-циклиновые комплексы. Эти комплексы
регулируют разные фазы клеточного цикла и поэтому называются
G1-, G1/S- , S- и М-Cdk (рис.1).
рис.1 Концентрации различных комплексов Cdk-циклин
в клеточном цикле.
Контрольные точки клеточного цикла
1. Точка выхода из G1-фазы, называемая
Старт - у млекопитающих и точкой рестрикции
у дрожжей. После перехода через точку рестрикции R в конце
G1 наступление S становится необратимым, т.е. запускаются
процессы ведущие к следующему делению клетки.
2.
Точка S - проверка точности репликации.
3.
Точка G2/M-перехода - проверка завершения репликации.
4. Переход от метафазы к анафазе митоза.
Контроль различных этапов клеточного
цикла
ARC подавляет S- и M-циклины и не подавляет G1/S-циклины.
В G1-фазе работают различные ингибиторы Cdk.
Внутренние и внешнии сигналы приводят к образованию G1/S-
и S-циклинов и активации G1/S-Cdks.
Активность G1/S-Cdk увеличивается потому что G1/S циклины
не атакуются APC и потому что G1
Cdk ингибиторы так же не действуют на G1/S-Cdks
(у мух и дрожжей) или удаляются от G1/S-Cdks другими
механизмами (у млекопитающих).
S-Cdk инактивирует ингибиторы Cdk и подавляет ARC, которые
в G1-фазе подавляли S-Cdk. S-Cdk фосфорилируют
различные белки, что ведет к началу дупликации ДНК и S-фазы.
После начала S-фазы S/G1-Cdk обеспечивают собственную
инактивацию.
В конце S-фазы, в G2-фазе начинают накапливаться
М-Cdk, приводящая к вступлению клетки в митоз. М-Cdk активирует
ARC-комплекс, управляющий метафазно-анафазным переходом. Основная
функция ARC-комплекса состоит в разрушении когезинов, приводящее
к началу расхождения хромосом
Циклин зависимые киназы Cdk1-5 в клетках млекопитающих
Cdks активируется при связывании с циклинами (так же как фосфориляция
и дефосфориляция киназ). Cdks-фосфорилируют белки участвующие
в кл цикле
M-phase Cdk (M-Cdk) запускают каскад белковых фосфориляций,
запускающих М-фазу к.ц. (конденсация хромосом, разрушение
ядра, перестройка АГ иЭР, потеря адгезии с большинством других
клеток и внеклеточному матриксу, реорганизация цитоскелета)
anaphase-promoting complex (APC) регулятор митоза - инициация
разделения и расхождения хромосом и инактивация М-Cdk в конце
митоза
При выходе из G0 под действием факторов роста начинает
синтезироваться Cdk2-циклинD: распознает в-ва, регулирующие
ферменты синтеза белков, необходимых для репликации ДНК. В
это же время выявляются Cdk4-циклинD, и Cdk5циклинD
циклин-cdks
запускает М-стадию кц, деградация циклина снижает активность
cdks
Cdk2-циклинE появляется в G1 и достигает max
на границе G1-S, после чего его концентрация
резко снижается
Cdk2-циклинА появляется в промежутке G1-S и присутствует
в высокой концентрации на протяжении S
Сdk2-циклинB в конце G2 до М - резко разрушается
в каждой стадии синтезируются свои циклины M-циклины запускают
события митоза, G1/S-циклины - связывают цзк
в конце G1 подготавливает кл к S-фазе, S-циклины
- связывают цзк, запуская репликацию, G1-циклины
обеспечивают прохождение через точку рестрикции.
Регуляция репликации
Перед началом репликации Sc ORC-комплекс (origin recognition
complex) садится на ori - точку начала репликации. Cdc6 представлен
во всем клеточном цикле, но его концентрация возрастает вначале
G1, где он связывается c ОRC комплексом, к которому затем
присоединяются Mcm белки с образованием pre-replicative complex
(pre-RC). После сборки pre-RC клетка готова к репликации.
Для инициации репликации S-Cdk соединяется с протеинкиназой
(?), которая фосфорилирует pre-RC. При этом Cdc6 диссоциирует
от ОRC после начала репликации и фосфорилируется, после чего
убиквитинируется SCF и деградирует. Изменения в pre-RC препятствуют
повторному запуску репликации. S-Cdk так же фосфорилирует
некоторые Mcm белковые комплексы, что запускает их экспорт
из ядра. Последующая дефосфориляция белков вновь запустит
процесс образования pre-RC.
Регуляция митоза
В эмбриональных клетках синтез М-циклина постоянен во всем
клеточном цикле и накопление его происходит из-за уменьшения
деградации. У большинства клеток М-циклин синтезируется во
время G2 и М-фаз. Накопление циклина ведет к накоплению M-Cdk.
Cdk ингибируется, фосфорилируясь протеинкиназой Wee1. Активация
Cdc25 в поздней G2 дефосфорилирует M-Cdk, так же происходит
репрессия Wee1. Две протеинкиназы фосфорилируют Cdc25 - Polo
kinase и M-Cdk. M-Cdk так же фосфорилирует и ингибирует Wee1.
Способность M-Cdk активировать свой собственный активатор
(Cdc25) и ингибировать свой собственный ингибитор (Wee1) предполагает,
что активация M-Cdk в митозе резко усиливается при наличии
такой позитивной обратной связи. Малое количество активированных
Cdc25 активируют M-Cdk, которые активирует еще больше Cdc25
и супрессируют Wee1. Это приводит к большей дефосфориляции
M-Cdk и активации и тд. Такой механизм обеспечивает полную
активацию всех M-Cdk
Фосфорилирование ламинов M-Cdk приводит к их деградации. М-Cdk
фосфорилирует несколько субъединиц конденсинов, запуская конденсацию
хромосом.
M-Cdk фосфорилирует различные белки, запуская реорганизацию
микротрубочек и другие события ведущие к организации веретена
деления.
Циклин-зависимые
киназы
G1/S, S, возможно М
В животных клетках имеются, по крайней мере, 7 различных
Cdk. Cdk1,2,4,6 напрямую участвуют в регуляции клеточного
цикла, тогда как остальные фосфорилируют другие Cdk и называются
Cdk-активирующие киназы (CAK).
Cdk7,8,9 являются регуляторами РНК полимеразы II. Cdk5 участвует
в дифференцировке нервных клеток.
У дрожжей Sc и Sp все события клеточного цикла контролируются
одной Cdk1. У многоклеточных организмов события контролируются
Cdk1 и Cdk2. Также у высших эукариот имеются Cdk4 и Cdk6
которые регулируют клеточный цикл в ответ на внеклеточные
сигналы.
Cdk фосфорилируют сотни различных белков по сериновым (S)
или треониновым (T) аминокислотным остаткам. Cdk узнает
мотиф другого белка по которому необходимо фосфорилировать:
[S/T*]PX[K/R], где S/T*- место фосфорилирования, X - любая
аминокислота, K/R-основные аминокислоты лизин (K) или аргинин
(R).
В отсутствии циклина активный центр Cdk заблокирован.
Cdk состоит из нескольких доменов: Т-петля (инактивирующая
петля) - закрывает активный центр в отсутствии циклина.
L12 helix, PSTAIRE helix.
Циклины
| Вид | G1 | G1/S | S | M |
| S.cerevisiae | Cln3 |
Циклины - цитоплазматические белки. Разрушение циклинов
происходит в протеосомах (см. обзор Протеасомы). Циклин
B - белок киназный домен, регуляторная субъединица. Начинает
синтезироваться в G1, достигает max в S и ранней профазе
и быстро разрушается в начале анафазы М. Когда концентрация
регуляторной субъединицы возрастает - активируется киназный
домен. Фосфорилирование специфических белков приводит к
компактизации х-м, разрушению ядерной об-ки и сборке веретена.
Циклин фосфорилирует сериновые и треониновые остатки ламинов
вызывая их деполимеризацию, фосфорилирует гистон H1, участвует
в фосфорилировании блокирующим везикулярный транспорт -
разрушение ЭПР и АГ, фосфорилирует участок легкой цепи миозина,
ингибируя АТФ-азную активность и связывание с F-актином
- блокировка цитокинеза в раннем митозе. После разрушения
циклина белки дефосфорилируются.
Циклины - активаторы Cdk. Циклины, так же как и Cdk вовлечены
в различные, помимо контроля клеточного цикла, процессы.
Циклины разделяются на 4 класса в зависимости от времени
действия в клеточном цикле: G1/S, S, M и G1 циклины.
G1/S циклины (Cln1 и Cln2 у S. cerevisiae, циклин E у позвоночных)
достигает максимальной концентрации в поздней G1-фазе и
падает в S-фазе.
G1/S cyclin-Cdk комплекс запускает начало репликации ДНК
выключая различные системы подавляющие S-phase Cdk в G1-фазе
G1/S циклины также инициируют дупликацию центросом у позвоночных,
образование веретенного тела у дрожжей. Падение уровня G1/S
сопровождается увеличением концентрации S циклинов (Clb5,
Clb6 у Sc и циклин A у позвоночных), который образует S
циклин-Cdk комплекс который напрямую стимулирует ДНК репликацию.
Уровень S циклина остается высоким в течении всей S, G2-фаз
и начала митоза, где помогает началу митозу в некоторых
клетках.
М-циклины (Clb1,2,3 и 4 у Sc, циклин B у позвоночных) появляется
последним. Его концентрация увеличивается, когда клетка
переходит к митозу и достигает максимума в метафазе. М-циклин-Cdk-комплекс
включает сборку веретена деления и выравнивание сестринских
хроматид. Его разрушение в анафазе приводит к выходу из
митоза и цитокиезу.
G1 циклины (Cln3 у Sc и циклин D у позвоночных) помогает
координировать клеточный рост с входом в новый клеточный
цикл. Они необычны, так как их концентрация не меняется
от фазы клеточного цикла, а меняется в ответ на внешние
регуляторные сигналы роста.
APC комплекс (Anaphase-Promoting Complex)
Убиквитин лигаза митоза - APC состоит из 12 субъединиц и регулирует
различные процессы митоза, такие как разделение сестринских
хроматид (запускает разрушение когезинов), переход к анафазе,
анафазное расхождение хромосом, выход из митоза, разрешение
S-фазы. ARC разрушает митотический циклин B.
Имеются различные белки регулирующие активность ARC комплекса,
такие как Mps1, Bub1, Bub3, BubR1, Mad1 и Mad2. Они ингибируют
ARC комплекс, что ведет к остановке клеточного цикла в метафазе
митоза.
Контроль клеточного цикла
CDK как регулятор клеточного цикла

Вступление
В статье о контрольных точках клеточного цикла мы рассмотрели причины, которые влияют на переход к различным фазам клеточного цикла, факторы, которые клетка учитывает при принятии решения о том, следует ли продвигаться дальше по клеточному циклу. К таким факторам относятся как внешние сигналы (например, молекулярные сигналы), так и внутренние сигналы (например, повреждение ДНК).
Подобные сигналы действуют путем изменения активности регуляторов клеточного цикла ядра внутри клетки. Регуляторы клеточного цикла клетки могут запускать ключевые процессы, такие как репликация ДНК или разделение хромосом. Они также контролируют правильный порядок выполнения событий клеточного цикла и то, что одна фаза (например, G1) запускает начало следующей фазы (например, S).
В этой статье мы рассмотрим некоторые из наиболее важных регуляторов основного клеточного цикла: белки, называемые циклинами, ферменты - циклин-зависимые киназы (Cdks), и комплекс ферментов - анафаза стимулирующего комплекса (APC/C).
Циклины
Циклины — это группа родственных белков, одни из наиболее важных регуляторов клеточного цикла ядра. И у людей, и у большинства других эукариот существует четыре основных типа: G1-циклины, G1/S-циклины, S-циклины и М-циклины.
Как следует из названия, каждый циклин связан с определенной фазой, переходом или набором фаз в клеточном цикле и помогает управлять событиями этой фазы или периода. Например, M-циклин способствует событиям фазы M, таким как разрушение ядерной оболочки и конденсация хромосом [1,2].
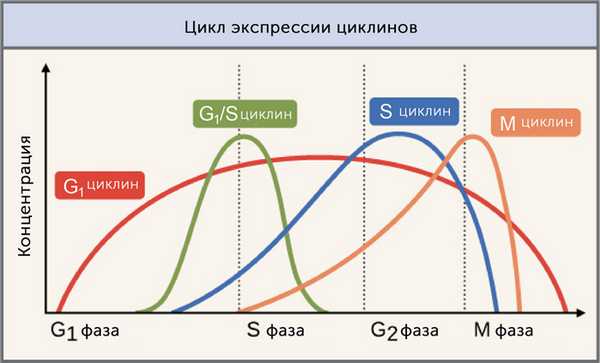
Изображение адаптировано из « Control of the cell cycle: Figure 2», OpenStax College, Biology ( CC BY 3.0 ).
Уровни разных циклинов значительно различаются в зависимости от фазы клеточного цикла, как показано на диаграмме выше. Так, концентрация циклинов остается низкой в течение большей части цикла, но сильно возрастает на стадиях, где они необходимы. М циклин, например, резко достигает пика при переходе от G2 в фазу М1. Циклины необычны тем, что они необходимы для большей части клеточного цикла.
Циклин-зависимые киназы (Cdks)
Чтобы продвигать клеточный цикл вперед, циклин должен активировать или инактивировать многие целевые белки внутри клетки. Циклины управляют событиями клеточного цикла, сотрудничая с семейством ферментов, называемых циклин-зависимыми киназами (Cdks). Сам по себе Cdk неактивен, но, связавшись с циклином, активируется, становясь функциональным ферментом, и приобретает способность модифицировать целевые белки.
Как это работает? Cdks — это киназы, ферменты, которые фосфорилируют (присоединяют фосфатные группы) к специфическим белкам-мишеням. Присоединенная фосфатная группа действует как переключатель, делая целевой белок более или менее активным. Когда циклин присоединяется к Cdk, он создает два важных эффекта: активирует Cdk в качестве киназы, и направляет Cdk к определенному набору белков-мишеней, разному для разных фаз клеточного цикла, контролируемого каждым конкретным циклином. Например, G1/S-циклины посылают Cdks к мишеням S-фазы (например, стимулируя репликацию ДНК), тогда как M-циклины посылают Cdks к мишеням M-фазы (например, разрушая ядерную мембрану).
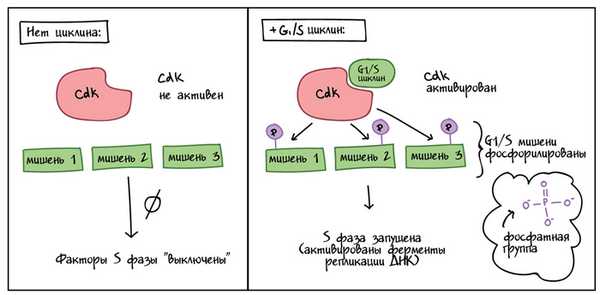
Упрощенная диаграмма, показывающая, как циклины модифицируют активность Cdks.
Левая панель (без циклина): циклин отсутствует, Cdk неактивен, а мишени, специфичные для перехода G1 / S, не фосфорилированы. Ничего не происходит, и факторы S-фазы остаются «выключенными».
Правая панель (+ G1 / S циклин): G1 / S циклин присутствует и связывается с Cdk. Cdk теперь активен и фосфорилирует различные мишени, специфичные для перехода G1 / S. Фосфорилированные мишени вызывают активацию ферментов репликации ДНК, и начинается S-фаза.
В целом, уровни Cdk остаются относительно постоянными по всему клеточному циклу, но активность Cdk и целевые белки изменяются по мере того, как уровни различных циклинов растут и падают. В дополнение к тому, что Cdks нуждается в связывании с циклином, он также должен быть фосфорилирован на определенном сайте, чтобы активироваться (не показано на диаграммах в этой статье), и может также негативно регулироваться фосфорилированием других сайтов [3,4].
Циклины и Cdks очень эволюционно консервативны, что означает, что они найдены во многих видах, от дрожжей до лягушек и человека. Детали системы немного различаются: например, у дрожжей есть только один Cdk, в то время как у людей и других млекопитающих есть несколько Cdk, которые используются на разных стадиях клеточного цикла. Да, это своего рода исключение из правила, согласно которому «уровни концентрации Cdks не меняются». Но основные принципы очень похожи, так что Cdks и различные типы циклинов можно найти у каждого вида [5].
Фактор, способствующий созреванию (MPF)
Известный пример того, как циклины и Cdks работают вместе, контролируя переходы клеточного цикла, — это фактор, способствующий созреванию (MPF). Название восходит к 1970-м годам, когда исследователи обнаружили, что клетки в фазе М содержат неизвестный фактор, который может заставить яйцеклетки лягушки (которая остановилась в G2, фазе) перейти в фазу М. Эта загадочная молекула, названная MPF, была открыта в 1980-х годах как Cdk, связанная со своим партнером M-циклином [7].
MPF — это хороший пример того, как циклины и Cdks могут работать вместе, чтобы управлять переходом клеточного цикла. Как и типичный циклин, M-циклин остается на низком уровне в течение большей части клеточного цикла, но его концентрация увеличивается, когда клетка приближается к G2/М-переходу. По мере накопления M-циклина он связывается с Cdks, уже присутствующими в клетке, образуя комплексы, которые готовы запустить M-фазу. Как только эти комплексы получают дополнительный сигнал (по сути, полностью четкое подтверждение того, что ДНК клетки не повреждены), они становятся активными и приводят в движение события фазы М [7].
Комплексы MPF добавляют фосфатные метки к нескольким различным белкам в ядерной оболочке, что приводит к ее расщеплению (ключевое событие ранней М-фазы), а также активируют мишени, способствующие конденсации хромосом и другим событиям М-фазы. Роль MPF в разрушении ядерной оболочки показана в упрощенной форме на диаграмме ниже.
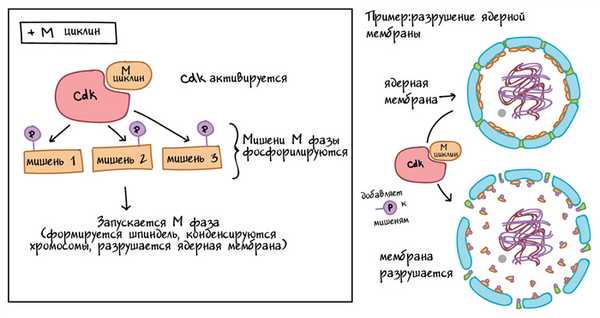
Упрощенная схема, показывающая, как Cdk и M cyclin объединяются в MPF.
Левая панель: комплекс MPF фосфорилирует различные мишени, специфичные для М-фазы, а фосфорилированные мишени вызывают образование веретена, конденсацию хромосом, разрушение ядерной мембраны и другие события ранней М-фазы.
Правая панель: конкретный пример MPF, вызывающего разрушение ядерной оболочки. Комплекс MPF фосфорилирует белки в ядерной оболочке, что приводит к фрагментации ядерной мембраны на везикулы (и высвобождению некоторых белков из мембраны).
Анафаза-стимулирующий комплекс/циклосома (APC/C)
В дополнение к управлению событиями М-фазы, MPF также запускает собственное разрушение, активируя комплекс, стимулирующий анафазу/циклосому (APC/C), белковый комплекс, который вызывает разрушение М-циклинов во время начала анафазы. Разрушение М-циклинов выводит клетки из митоза, позволяя новым дочерним клеткам войти в фазу G1. APC/C также вызывает разрушение белков, которые удерживают сестринские хроматиды вместе, позволяя им разделится в анафазе и переместиться к противоположным полюсам клетки.
Как APC/C выполняет свою работу? Как и Cdk, APC/C является ферментом, но имеет другой тип функций, чем Cdk. Вместо того, чтобы прикреплять фосфатную группу к своим мишеням, он добавляет небольшую белковую метку под названием убиквитин (Ub). Когда цель помечена убиквитином, она отправляется в протеасому (которую можно рассматривать как мусорную корзину клетки) и уничтожается. Например, APC/C прикрепляет метку убиквитина к М-циклинам, вызывая их расщепление протеасомой и позволяя вновь образующимся дочерним клеткам входить в G1-фазу [8].
APC/C также использует убиквитиновые метки для запуска отделения сестринских хроматид во время митоза. Если APC/C получает правильные сигналы в метафазе, он запускает цепь событий, которая разрушает когезин, белковый клей, который удерживает сестринские хроматиды вместе [8,9].
APC/C сначала добавляет метку убиквитина к белку, называемому секурин, и отправляет его на переработку. Секурин обычно связывает и инактивирует белок, называемый сепараза(сепарин).
Когда секурин отправляется на переработку, сепараза становится активной и может выполнять свою работу. Сепараза в свою очередь измельчает когезин — белок, который удерживает сестринские хроматиды вместе, таким образом сепараза разделяет сестринские хроматиды.
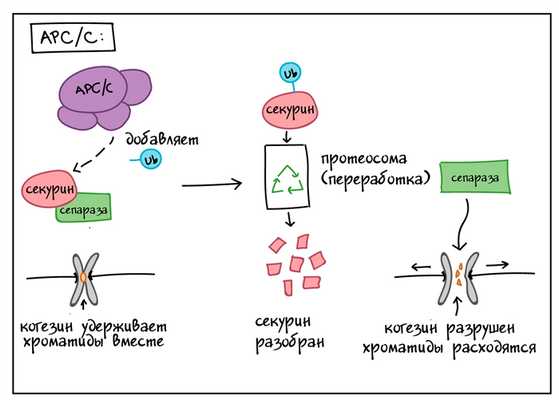
Контрольные точки и регуляторы
Cdks, cyclins и APC/C являются прямыми регуляторами клеточных циклов, но они не всегда управляют процессом. Вместо этого они реагируют на сигналы внутри и снаружи клетки. Эти сигналы влияют на активность регуляторов ядра, чтобы определить, можно ли клетке двигаться вперед в клеточном цикле. Положительные сигналы, такие как факторы роста, обычно увеличивают активность Cdks и циклинов, в то время как отрицательные сигналы, такие как повреждение ДНК, обычно уменьшают или блокируют их активность.
р53 работает на нескольких уровнях, чтобы гарантировать, что клетки не передадут свою поврежденную ДНК дочерним клеткам после деления [3].
Во-первых, он останавливает клеточный цикл в контрольной точке G1, запуская производство белков-ингибиторов Cdk (CKI). Белки CKI связываются с комплексами Cdk-циклинов и блокируют их активность (см. диаграмму ниже), выигрывая время для восстановления ДНК.
Вторая задача p53 — активировать ферменты репарации ДНК.
Если повреждение ДНК не поддается устранению, р53 приступает к исполнению своей третьей и последней роли — запуску программируемой клеточной гибели, чтобы поврежденная ДНК не передавалась дальше.
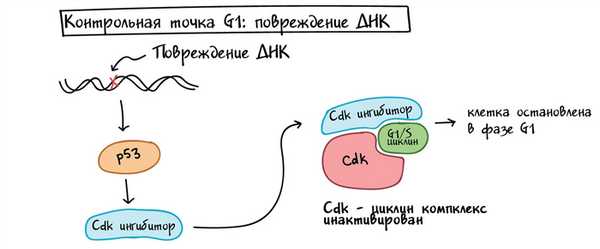
Упрощенная схема того, как p53 останавливает клеточный цикл на контрольной точке G1/S. Р53 активируется повреждением ДНК и вызывает выработку ингибитора Cdk, который связывается с циклиновым комплексом Cdk-G1/S и инактивирует его. Это останавливает клетку в фазе G1 и не позволяет ей войти в S-фазу, давая время для устранения повреждения ДНК.
Гарантируя, что клетки не делятся, когда их ДНК повреждена, p53 предотвращает передачу мутаций (изменений в ДНК) дочерним клеткам. Когда p53 дефектен или отсутствует, мутации могут быстро накапливаться, что может привести к раку. Действительно, из всего человеческого генома р53 является единственным геном, наиболее часто мутирующим при раке [11]. p53 и регуляция клеточного цикла являются ключевыми объектами изучения для исследователей, работающих над новыми методами лечения рака.
Регуляция клеточного цикла и митоза
Клеточный цикл регулируется как внутриклеточными, так и внеклеточными факторами.
Генетический контроль цикла обеспечивается семейством генов, которые обозначаются как гены клеточного деления - cdc (cell division control). Продукты этих генов представляют собой киназы - ферменты, фосфорилирующие белки по определенным аминокислотам. Поэтому гены клеточного цикла могут обозначаться также cdk (cell division kinase). Основной принцип регуляции клеточного цикла состоит в фосфорилировании и дефосфорилировании участвующих в пролиферации структурных и регуляторных белков.
Последовательность активации киназ клеточного деления определяется циклинами - регуляторными белками, концентрация которых закономерно изменяется в клеточном цикле. Например, концентрация циклина А нарастает к концу G1-периода и снижается по завершению S-периода, причем подавление репликации ДНК оксимочевиной не влияет на этот процесс. К настоящему времени обнаружено 12 циклинов, которые демонстрируют различную динамику концентрации в клеточном цикле. Наряду с комплексами Cyc/Cdk (циклин/циклинзависимая киназа) в регуляции цикла участвуют фосфатазы PP1 и PP2a, которые дефосфорилируют белки, фосфорилированные ранее киназами, циклин-активирующие киназы CAK и ингибиторы киназ CDI.
Важная роль в регуляции клеточного цикла принадлежит белку p53. Он способен узнавать специфические последовательности в ДНК и регулировать активность контролирующих пролиферацию генов. Концентрация p53 в ядре увеличивается к концу G1-периода, но резко снижается при переходе клетки в S-период. Если в клетке возникли повреждения ДНК, концентрация p53 остается на высоком уровне, клетка задерживается в конце G1-периода и не приступает к репликации ДНК до тех пор, пока повреждения не будут исправлены. Если повреждения ДНК репарировать не удалось, p53 выключает гены, блокировавшие апоптоз. Переход G1/S является первой контрольной точкой клеточного цикла (точкой рестрикции R1), в которой клетка принимает решение о репликации ДНК.
Кроме R1 в клеточном цикле есть и вторая контрольная точка - R2. Она соответствует переходу G2/M, когда клетка принимает решение о начале митоза. Главными молекулами, регулирующими начало митоза, являются фосфатаза Cdc25, а также киназы CycB/Cdk1 и weel. Фосфатаза Cdc25 способна активировать киназу CycB/Cdk1, тогда как киназа weel, наоборот, ингибирует ее. Поэтому начало митоза определяется балансом активности ферментов Cdc25 и weel.
События митоза также регулируются циклинами. В частности, циклин B (CycB) контролирует образование митотического веретена, циклин A (CycA) влияет на расхождение хроматид, а циклин B3 (CycB3) контролирует конденсацию хромосом. Для завершения митоза необходима не только определенная последовательность активации циклинзависимых киназ и фосфатаз, но также их своевременная деградация. Она контролируется APC (anaphase promoting complex) - комплексом протеаз с участием убиквитина.
Клеточный цикл регулируется также внешними по отношению к клетке молекулярными сигналами. К ним относятся гормоны, медиаторы, факторы роста, лимфокины, митогены, а также их ингибиторы.
Пролиферирующие клетки отвечают на молекулярные сигналы двух типов. Первый из них усиливает пролиферацию, вызывая переход клеток из состояния G0 в G1 и их прогрессию в клеточном цикле (так действуют многие факторы роста, например, фактор роста фибробластов ФРФ). Второй тип регуляторных белков позволяет клеткам подавлять рост их соседей (как это происходит, например, при секреции макрофагами фактора некроза опухолей ФНО).
Таким образом, в управление клеточным циклом и митозом вовлечено большое число генов. Если функция каких-либо из них утрачивается из-за мутации или нарушения экспрессии, клетки становятся нечувствительными к подавляющим их рост молекулярным сигналам, переходят в режим автономной пролиферации и могут сформировать в итоге опухоли.
Читайте также:
- Желудок при острой лучевой болезни. Морфология желудка после облучения
- Укладка при рентгенограмме органов грудной клетки (ОГК) в боковой проекции (левой)
- Синдром Мортона (Morton)
- Сердечный выброс. Минутный объем кровообращения. Сердечный индекс. Систолический объем крови. Резервный объем крови.
- Гастринома
