Частота рака легких. Эпидемиология рака легкого
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026

1. World Health Organization. Global Health Observatory. Geneva: World Health Organization, 2018. Р.45-48.
2. Gersten O., Wilmoth J.R. The cancer transition in Japan since 1951. Demogr Res. 2002. V. 7. P. 271-306.
3. Bray F. Transitions in human development and the global cancer burden. In: BW Stewart, CP Wild, eds. World Cancer Report 2014. Lyon: IARC Press, 2014. P.42‐ 55.
4. Ferlay J., Colombet M., Soerjomataram I., Mathers C., Parkin D.M., Piñeros M., Znaor A., Bray F. Global and Regional Estimates of the Incidence and Mortality for 38 Cancers: GLOBOCAN 2018. Lyon: International Agency for Research on Cancer/World Health Organization, 2018. Р.33-39.
5. Hankey B.F., Feuer E.J., Clegg L.X., Hayes R.B., Legler J.M., Prorok P.C., Ries L.A., Merrill R.M., Kaplan R.S. Cancer surveillance series: interpreting trends in prostate cancer - Part I: evidence of the effects of screening in recent prostate cancer incidence, mortality, and survival rates. J. Natl. Cancer Inst. 1999. vol.91. P. 1017‐ 1024.
6. Bray F., Colombet M., Mery L. Cancer Incidence in Five Continents, Vol. XI (electronic version). Lyon: International Agency for Research on Cancer, 2018. Р. 67-72.
7. Doll R., Payne P., Waterhouse J. Cancer Incidence in Five Continents: A Technical Report. New York: Springer, 1966. Р.23-25.
9. Alonso R., Pineros M., Laversanne M., Musetti C., Garau M., Barrios E., Bray F. Lung cancer incidence trends in Uruguay 1990-2014: an age‐period‐cohort analysis. Cancer Epidemiol. 2018. V. 55. P. 17‐ 22.
10. Lortet‐Tieulent J., Renteria E., Sharp L., Weiderpass E., Comber H., Baas P., Bray F., Coebergh J.W., Soerjomataram I. Convergence of decreasing male and increasing female incidence rates in major tobacco‐related cancers in Europe in 1988-2010. Eur. J. Cancer. 2015. V. 51. P. 1144‐1163.
11. Jha P. Avoidable global cancer deaths and total deaths from smoking. Nat. Rev. Cancer. 2009. V. 9. P. 655‐ 664.
12. Ziegler R.G., Hoover R.N., Pike M.C., Hildesheim A., Nomura A.M., West D.W., Wu-Williams A.H., Kolonel L.N., Horn-Ross P.L., Rosenthal J.F., Hyer M.B. Migration patterns and breast cancer risk in Asian‐American women. J. Natl. Cancer Inst. 1993. V. 85. P. 1819‐ 1827.
13. Brinton L.A., Gaudet M.M., Gierach G.L. Breast cancer. In: M.J. Thun, M.S. Linet, J.R. Cerhan, C.A. Haiman, D. Schottenfeld eds. Cancer Epidemiology and Prevention. 4th ed. New York: Oxford University Press. 2018. P. 861‐888.
14. Arnold M., Sierra M.S., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global patterns and trends in colorectal cancer incidence and mortality. Gut. 2017. V. 66. P. 683‐ 691.
15. Schreuders E.H., Ruco A., Rabeneck L., Schoen R.E., Sung J.J., Young G.P., Kuipers E.J. Colorectal cancer screening: a global overview of existing programmes. Gut. 2015. V. 64. P. 1637‐1649.
16. Wu K., Keum N., Nishihara R., Giovannucci E.L. Cancers of the colon and rectum. In: M.J. Thun, M.S. Linet, J.R. Cerhan, C.A. Haiman, D. Schottenfeld eds. Cancer Epidemiology and Prevention. 4th ed. New York, NY: Oxford University Press, 2018. P. 681‐706.
17. Magalhaes B., Peleteiro B., Lunet N. Dietary patterns and colorectal cancer: systematic review and meta‐analysis. Eur J Cancer Prev. 2012. V. 21. P. 15‐ 23.
18. Rebbeck T.R., Devesa S.S., Chang B.L., Bunker C.H., Cheng I., Cooney K., Eeles R. Global patterns of prostate cancer incidence, aggressiveness, and mortality in men of African descent [serial online]. Prostate Cancer. 2013. V. 2013. P. 560-567.
19. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Infection with Helicobacter pylori. IARC Monogr Eval Carcinog Risks Hum. 1994. V. 61. P.177‐ 240.
20. deMartel C., Parsonnet J.. Stomach cancer. In: M.J. Thun, M.S. Linet, J.R. Cerhan, C.A. Haiman, D. Schottenfeld eds. Cancer Epidemiology and Prevention. 4th ed. New York: Oxford University Press, 2018. P. 593‐610.
По определению Всемирной организации здравоохранения, рак - это группа заболеваний, характеризующихся тем, что происходят неконтролируемый рост и распространение аномальных клеток. В настоящее время существует понятие эпидемиологии неинфекционных заболеваний, к которым относятся и злокачественные опухоли. На первом месте по смертности находятся сердечно-сосудистые заболевания, которые являются причиной смерти в 31% случаев, а злокачественные опухоли находятся на втором месте с показателем 16% [1].
Общие уровни смертности от рака в развитых странах постепенно снижаются. Например, в Японии смертность уменьшается с 1960-х гг. (стандартизированные по возрасту показатели смертности в возрасте 30-69 лет). В снижении смертности от некоторых форм злокачественных опухолей (рака желудка, рака шейки матки) в Японии сыграли роль рост экономики страны и улучшение оказания онкологической помощи населению. Однако внедрение западного образа жизни (курение, употребление алкоголя и др.) привело к росту других форм рака (рака толстой кишки, рака эндометрия, рака простаты и др.). Таким образом, инфекционные причины развития рака, такие как Helicobacter pylori (H. pylori) и вирус папилломы человека, не стали основными этиологическими факторами, и на первый план стали выходить неинфекционные факторы риска (ожирение, курение, гормональные сдвиги, промышленные профессиональные вредности) [2]. Об этом также упоминает Bray F., который отмечает, что те виды рака, которые чаще встречаются в экономически развитых странах мира, такие как рак легких, рак молочной железы, стали все чаще выявляться в неразвитых государствах [3]. Обзор литературы проведен на основе данных по опухолям основных локализаций, представленных GLOBOCAN 2018 и Международным агентством по исследованию рака (МАИР) [4].
Цель исследования - изучить основные показатели заболеваемости и смертности при злокачественных новообразованиях в мире.
Количество новых случаев рака было взято из базы данных GLOBOCAN 2018 для некоторых видов рака. Эпидемиологи отмечают, что сейчас наблюдается увеличение показателей заболеваемости раком во всем мире. Некоторые исследователи (Hankey B.F. и др.) связывают это с улучшением диагностики, регистрации и частично с гипердиагностикой, как это произошло в США в 1990-х гг. в случае с внедрением теста на простат-специфический антиген (ПСА) при раке предстательной железы [5]. Bray F. и иные отмечают, что не все страны охвачены высококачественными раковыми регистрами, их только около 15%. В большинстве неразвитых стран, к сожалению, только 1-7% населения охвачены адекватными регистрами. В последнее время наблюдаются положительные сдвиги в африканских странах - охват раковыми больными достиг 13% [6]. Показатели заболеваемости раком в обзоре отражены в виде стандартизованных величин [7].
Распределение случаев заболевания и смертности по регионам мира и видам рака
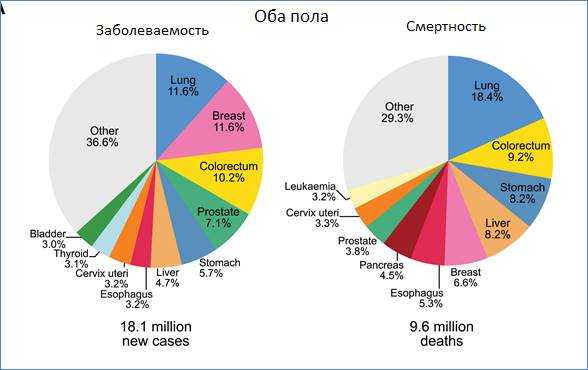
Рис. 1. Заболеваемость и смертность при злокачественных новообразованиях в мире
Глобальные модели рака
В мире наблюдается значительная глобальная вариабельность ведущих локализаций рака. Например, рак простаты - это наиболее частая опухоль в 105 странах, за ним следует рак легких в 37 странах и рак печени в 13 странах. При некоторых опухолях отмечается повышенная сосредоточенность в определенных регионах. Так, рак печени чаще встречается в странах Африки, а рак губы и полости рта - в Южной Азии, особенно в Индии. Также наблюдается повышенная заболеваемость саркомой Капоши в Восточной Африке или неходжкинской лимфомой в субэкваториальной Африке.
Рак легких является основной причиной смертности в большинстве стран ввиду высокой доли распространенных и запущенных стадий, а также отсутствия адекватного специального и радикального лечения.
Среди женской популяции мира в большинстве стран, особенно в развитых и развивающихся, наиболее часто встречается рак молочной железы: из 180 стран мира в 154. В остальных 36 государствах самой частой онкологической патологией является цервикальный рак. Как причина смертности у женщин на первом месте в большинстве стран также находятся рак молочной железы и рак шейки матки. Такая ситуация прослеживается в 105 странах из 180, а в остальных - это рак легких.
Региональная вариабельность заболеваемости и смертности при раке
Показатели смертности также были различными в странах. Самые высокие показатели смертности у мужчин наблюдались в Восточной Европе - 171,0 на 100 тыс., а самые низкие - в Центральной Америке - 67,4 на 100 тыс. У женщин ситуация со смертностью была следующей - самая высокая смертность отмечена в Меланезии - 120,7 на 100 тыс., а самая низкая - также в Центральной Америке - 64,2 на 100 тыс.
Уругвай - страна с одним из самых высоких показателей заболеваемости РЛ в мире - инициировал в 2005 г. серию всеобъемлющих антитабачных мер. С использование данных Национального регистра рака Уругвая Alonso R. и другими был проведен возрастно-когортный анализ тенденций РЛ за 1990-2014 гг. У мужчин стандартизированные по возрасту (мировые) показатели снизились с пика 165,6 в 1995 г. до 103,1 к 2014 г., что привело к снижению риска развития РЛ у мужчин, родившихся в 1970 г., на 70% по сравнению с родившимися в начале 1940-х гг. У женщин этот показатель неуклонно повышался - с 18,3 в 1991 г. до 30,0 к 2014 г., причем последовательное увеличение риска происходило среди поколений женщин, родившихся в 1940-1960 г. Однако имеются данные о снижении наблюдаемых показателей у женщин, родившихся в последнее время. Экстраполяция этих тенденций показывает, что к 2035 г. среднее число новых случаев РЛ у мужчин сократится на 8%, а у женщин - на 69%. [9]. Lortet-Tieulent J. и иные показали, что по-прежнему существуют значительные, но изменяющиеся различия в показателях заболеваемости раком, связанным с употреблением табака, в разных европейских регионах. Как правило, высокие показатели среди мужчин снижаются, в то время как более низкие показатели среди женщин увеличиваются, что приводит к их сближению. В Дании, Исландии и Швеции показатели заболеваемости РЛ у женщин были выше, чем у мужчин (35-64 года). При раке легких и гортани, где курение является основным фактором риска, показатели заболеваемости были самыми высокими в Центральной и Восточной Европе, Южной Европе и странах Балтии. Несмотря на снижение распространенности курения среди женщин, показатели заболеваемости раком легких, гортани и полости рта среди женщин увеличились в большинстве стран Европы, но в странах Балтии они были стабильными [10]. Однако в Китае у женщин тоже имеются высокие показатели заболеваемости РЛ. По мнению Jha P., это вызвано повышенным воздействием дыма от сжигания древесного угля в бытовых целях [11].
Рак молочной железы у женщин (РМЖ)
Уровень заболеваемости РМЖ исторически был в 4-7 раз выше в США, чем в Китае или Японии. Когда китайские, японские или филиппинские женщины мигрируют в США, риск развития у них РМЖ возрастает в течение нескольких поколений и приближается к тому значению, которое отмечается у белых американок. Ziegler R.G. и иные показали, что наблюдался шестикратный градиент риска развития РМЖ по характеру миграции. У женщин азиатского происхождения, родившихся на Западе, риск развития РМЖ был на 60% выше, чем у женщин азиатского происхождения, родившихся на Востоке. Среди тех, кто родился на Западе, риск определялся тем, родились ли их бабушки и дедушки, особенно бабушки, на Востоке или на Западе. Этнически специфичные показатели заболеваемости РМЖ в мигрирующем поколении были явно выше, чем в странах происхождения, в то время как показатели среди американцев азиатского происхождения, родившихся на Западе, приближались к уровню показателей заболеваемости РМЖ белых в США. Следовательно, воздействие западного образа жизни оказало существенное влияние на риск развития РМЖ у азиатских мигрантов, прибывших в США [12]. Brinton L.A. и иные продемонстрировали, что повышенные показатели заболеваемости в странах с более высоким уровнем дохода объясняются влиянием репродуктивных факторов риска [13].
Колоректальный рак (КРР)
Также существуют широко распространенные различия в статусе и стратегии осуществления скрининга КРР. Они могут быть объяснены географическими несходствами в распространенности КРР, экономическими ресурсами, структурой здравоохранения и инфраструктурой для поддержки скрининга, такими как способность идентифицировать целевую популяцию в группе риска и доступность регистра рака [15]. Это заболевание можно рассматривать как маркер социально-экономического развития, и в странах, переживающих значительный переходный период развития, показатели заболеваемости имеют тенденцию к равномерному росту [16]. Magalhaes B. и иные провели обзор 8 когортных и 8 контрольных исследований, определяющих закономерности влияния диеты и развития КРР. Метаанализы были проведены для трех паттернов: высокое потребление алкоголя, фруктов/овощей и красного/обработанного мяса («западный стиль»). Риск развития рака толстой кишки был повышен при использовании паттернов, характеризующихся высоким потреблением красного и обработанного мяса, и снижен при использовании паттернов, связанных с фруктами и овощами («здоровый стиль»). Никаких значимых ассоциаций для рака прямой кишки не наблюдалось [17].
Рак предстательной железы (РПЖ)
В последние годы во многих странах мира РПЖ занимает ведущие позиции и входит в тройку наиболее распространенных опухолей у человека. Об этом говорят следующие факты - 1,3 млн мужчин заболели РПЖ в 2018 г. и примерно 400 тыс. умерли. Четко показано, что уровни заболеваемости РПЖ очень высоки у афроамериканцев в США. По данным Rebbeck T.R. и иных, в 2008 г. среди этих мужчин было диагностировано более 30 000 случаев РПЖ. Также высокие уровни заболеваемости были отмечены на островах Карибского бассейна и в районах ниже Сахары. При этом стандартизированные по возрасту показатели заболеваемости РПЖ варьировались от 159,6 на 100 тыс. среди афроамериканцев до 71,1 на 100 тыс. в Карибском бассейне и 17,5 на 100 тыс. в Африке. Однако число смертельных случаев от РПЖ в Африке было более чем в 5 раз больше, чем среди афроамериканцев, или в 4 раза больше, чем среди мужчин, проживающих на Карибских островах. Существуют различия в показателях заболеваемости и смертности между мужчинами африканского, азиатского, латиноамериканского и европейского происхождения, что подтверждает генетическую предрасположенность. Тем не менее изучено и доказано влияние и экологических факторов, так как между мужчинами одной и той же расы могут быть неодинаковые уровни заболеваемости РПЖ [18].
Хроническое инфицирование бактерией Helicobacter pylori (H. pylori) вызывает некардиальную карциному желудка и низкодифференцированную мантийно-клеточную лимфому из В-клеток. Было показано, что 660 000 случаев рака в мире в 2008 г. были связаны с H. pylori, что соответствует 32,4% из 2 млн случаев рака, связанных с инфекционными агентами, и 5,2% из 12,7 млн общих случаев рака, имевших место во всем мире. Подавляющее большинство раковых заболеваний, связанных с H. pylori (650 000), были опухолями некардиального отдела желудка [19]. Helicobacter pylori является основным фактором риска развития РЖ, причем почти 90% новых случаев некардиального РЖ вызвано этой бактерией [20].
Таким образом, обзор литературы подтвердил, что рак является актуальной проблемой в медицине. Это обусловлено высокими показателями заболеваемости, увеличением смертности, недостаточной регистрацией первичных случаев рака, неудовлетворительными результатами лечения, продолжающимися воздействиями неблагоприятных факторов внешней среды.
В мире наблюдается выраженная неравномерность распространения рака по регионам и по основным формам рака. Наиболее частыми опухолями являются рак легких, рак молочной железы, рак простаты, рак желудка, рак шейки матки и рак печени.
Знание основных закономерностей распространения злокачественных опухолей в определенных регионах способствует своевременному проведению профилактических мероприятий, направленных на снижение уровней заболеваемости и выяснение этиологических причин и возможных патогенетических аспектов развития рака.
Случай успешного радикального хирургического лечения ложно местно-распространённого рака лёгкого

Несмотря на достижения современных медицинских технологий в торакальной онкологии, рак лёгкого остаётся одной из основных причин смертности населения. Алгоритм и тактика лечения пациентов со злокачественными опухолями лёгких определяются на основании клинической стадии заболевания. Стадия устанавливается по результатами диагностических исследований: компьютерной (КТ) и позитронно-эмиссионной томографии (ПЭТ-КТ), радиоизотопных исследований и бронхоскопии.
Достаточно часто (13-30 %) течение рака лёгкого осложняется вторичным параканкрозным (расположенным вокруг опухоли ) воспалением, которое затрудняет своевременную диагностику и адекватное стадирование рака лёгкого. Нередко это приводит к гипердиагностике, то есть ошибочному медицинскому заключению о наличии у пациента осложнений, которые на самом деле отсутствуют. Применимо к раку лёгких, гипердиагностика возможна по характеристикам первичной опухоли и поражению лимфатических узлов (категории "T" и "N" в классификации TNM), что отодвигает хирургические методы лечения на второй план или вовсе исключает их из возможных опций лечения рака лёгкого.
Приводим клиническое наблюдение пациента с ложно местно-распространённой злокачественной опухолью лёгкого. Учёт характера новообразования в этом случае позволил провести пациенту успешное хирургическое лечение первым этапом.
31.07.2020 мужчина 57 лет обратился в Клиническую больницу № 2 АО ГК МЕДСИ с данными компьютерной томографии, где выявлено центральное новообразование в корне нижней доли левого лёгкого.
Жалобы
Пациент предъявлял жалобы на боль в груди (в проекции грудины и нижне-грудного отдела позвоночника), эпизоды повышения температуры тела до субфебрильных значений (до 38 °C) и постоянный кашель с выделением небольшого количества светлой мокроты.
Сначала болезненные ощущения трактовались как проявления гастроэзофагеальной рефлюксной болезни (ГЭРБ). Пациент получал лекарственную терапию, но без существенного эффекта.
Анамнез
У пациента длительный анамнез курения — 40 пачколет (т. е., 1 пачка в день в течение 40 лет или 2 пачки в день в течение 20 лет и т .д.). Считает себя больным с апреля 2020 года, когда появилась боль в груди и кашель. С этими симптомами больной обратился к терапевту в поликлинику по месту жительства. Жалобы были расценены как проявления гастро-эзофагеальной рефлюксной болезни (ГЭРБ). По результатам гастроскопии диагностированы признаки хронического гастрита и косвенные признаки ГЭРБ. Назначенное лечение не дало эффекта.
При дальнейшем дообследовании, по данным рентгенографии и компьютерной томографии органов грудной клетки выявлено новообразование в нижней доле левого лёгкого. После этого пациент был направлен на консультацию к торакальному онкологу.
- (терапия метформином и гликлазидом);
- мультифокальный атеросклероз с преимущественным поражением сосудов головного мозга. 27.12.2019 зафиксирована транзиторная ишемическая атака (острое кратковременное нарушение кровообращения головного мозга).
Обследование
При осмотре и физикальном обследовании обращало на себя внимание наличие экспираторных (при выдохе) свистящих хрипов по всем лёгочным полям (больше слева) и ослабление дыхания в нижних отделах слева.
Периферические лимфатические узлы шеи, подмышечных, над- и подключичных областей не увеличены в размерах или не пальпируются (не прощупываются).
Первым этапом пациенту была проведена фибробронхоскопия, по данным которой выявлено, что устье нижнедолевого бронха слева сужено за счёт подслизистого и перибронхиального распространения опухоли.
Выполнена многократная биопсия из устья нижнедолевого бронха слева. По данным гистологического исследования материала эндоскопической биопсии верифицирован диагноз немелкоклеточного рака лёгкого.
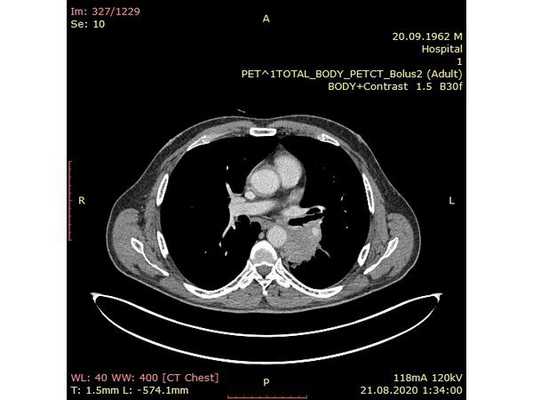
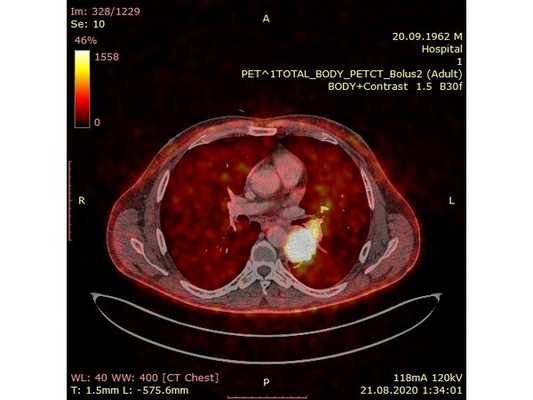
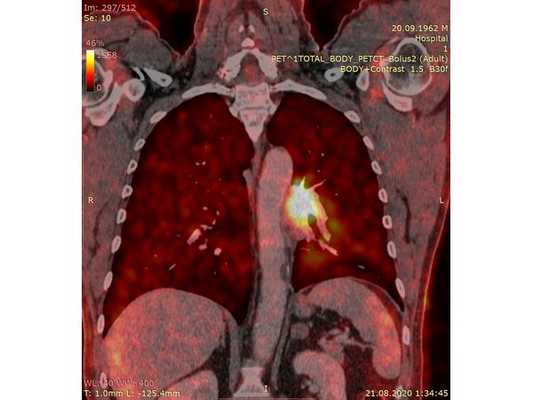
Чтобы провести первичное стадирование опухоли, пациенту проведена позитронно-эмиссионная томография в сочетании с компьютерной томографией (ПЭТ-КТ). По данным исследования, выявлена метаболически активная опухоль в корне левого лёгкого с бугристыми контурами размерами 41 х 43 мм. В толще опухоли проходят нижнедолевой бронх и бронх 6-го сегмента левого лёгкого, просветы бронхов значительно сужены. Нижняя доля левого лёгкого уменьшена в размерах за счёт того, что сегменты 6, 9 и 10 субтотально (частично) инфильтрированы и безвоздушны. Лимфатические узлы корня лёгкого и средостения не увеличены в размерах и не накапливают радиофармпрепарат (РФП), который был введён пациенту перед обследованием внутривенно. Других очаговых образований и очагов гиперметаболизма в организме не обнаружено.
При этом отмечено, что опухоль распространяется в средостение по нижней стенке левого главного бронха и широко прилежит к нижнегрудному отделу аорты (по заключению специалиста ПЭТ-КТ — имеется инвазия опухоли в ткани средостения и возможное врастание в стенку аорты). При самостоятельном пересмотре изображений отмечено, что "опухолевая" ткань, которая распространяется по нижней стенке левого главного бронха в средостение, не накапливает РФП (т. е. не является злокачественной), а стенка аорты в области "инвазии" опухоли имеет ровный чёткий контур и адвентициальную границу, что также свидетельствует об отсутствии онкологического процесса в этой области.
- эхокардиография;
- ультразвуковая допплерография (УЗДГ) артерий и вен нижних конечностей и брахиоцефальных артерий;
- спирометрия (измерение объёмных и скоростных показателей дыхания с целью диагностики и оценки функционального состояния лёгких).
По результатам исследований не выявлено существенных патологий, которые могли бы ограничить возможности хирургического вмешательства на лёгких.
На период обследования пациенту была рекомендована противовоспалительная (НПВС) и ингаляционная терапия, на фоне чего пациент отметил уменьшение болевого синдрома и выраженности кашля.
Диагноз
Основное заболевание: Центральный немелкоклеточный рак нижней доли левого лёгкого, сT2bN0M0, IIА стадия. (T2b — опухоль более 5 см, но менее 7 см в наибольшем измерении; N0 — нет метастазов в региональных лимфатических узлах; M0 — нет отдалённых метастазов).
- Сахарный диабет 2 типа, субкомпенсированный (среднетяжёлое течение болезни).
- Мультифокальный атеросклероз с преимущественным поражением сосудов головного мозга (транзиторная ишемическая атака от 27.12.2019). Код МКБ-10 — E11.9.
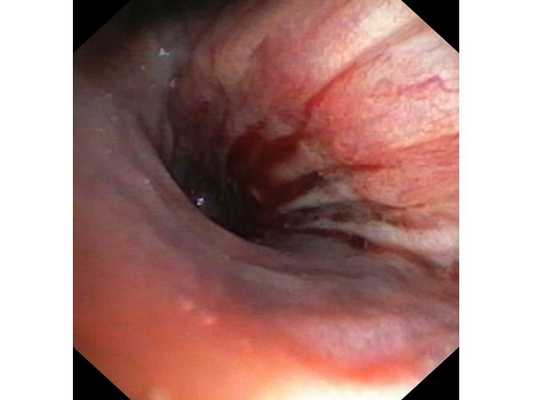
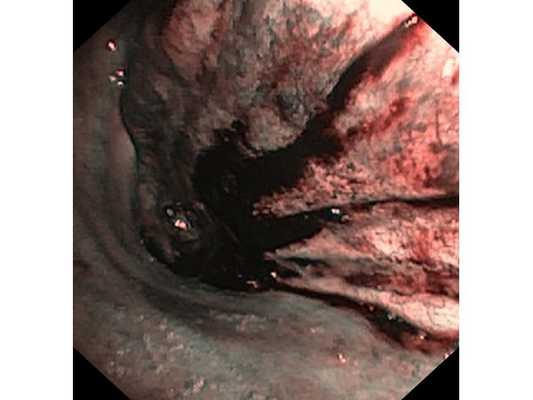
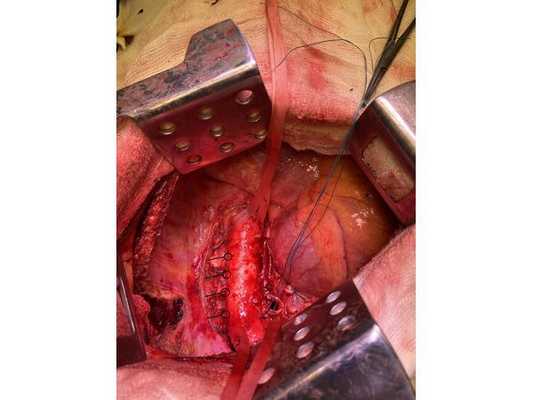
Интраоперационное фото: клипированные межрёберные артерии; аорта на тесёмочных держалках по краям зоны резекции адвентиции; культя главного бронха с провизорными швами при ушивании по Оверхольту
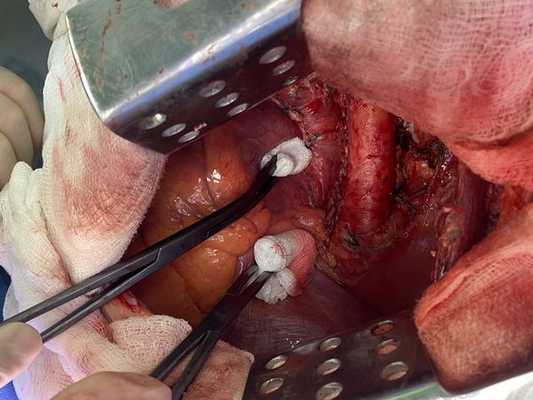
Лечение
Проведён онкологический консилиум (Клиническая больница № 2 АО ГК МЕДСИ). Решением консилиума рекомендовано первым этапом провести хирургическое лечение в объёме нижней лобэктомии (удаления доли органа) с циркулярной резекцией левого главного бронха (удалением сегмента бронха с восстановлением целостности бронхиального дерева) или пневмонэктомии слева (полного удаления лёгкого) после интраоперационной ревизии с систематической медиастинальной лимфодиссекцией (иссечением лимфатических узлов).
- боковая торакотомия (вскрытие грудной клетки) слева;
- пневмонэктомия с резекцией адвентиции (наружной оболочки) аорты, париетальной и медиастинальной плевры и мышечной стенки пищевода;
- медиастинальная лимфаденэктомия.
1. В положении на правом боку с раздельной вентиляцией лёгких выполнена боковая торакотомия слева. При ревизии:
- в плевральной полости выпота (скопления жидкости) нет;
- имеются единичные сращения в области верхней доли и 6 сегмента — разделены при помощи электрокоагуляции;
- очагового поражения париетальной и висцеральной плевры нет.
- в нижней доле имеется плотная большая опухоль, подрастающая к грудной аорте и врастающая в медиастинальную плевру и средостение;
- сосуды корня лёгкого в опухолевый процесс не вовлечены;
- определяются множественные неувеличенные в размерах лимфатические узлы.
Учитывая данные интраоперационной ревизии, диагноз скорректирован: центральный местно-распространённый немелкоклеточный рак нижней доли левого лёгкого с врастанием в адвентицию аорты и ткани средостения — cT4NxM0. Принято решение о выполнении пневмонэктомии (полного удаления лёгкого).
2. Выделены и взяты на держалки верхняя и нижняя лёгочные вены, выделен ствол лёгочной артерии, который также взят на держалку. Выполнено пробное пережатие лёгочной артерии — нарушений гемодинамики (движения крови по сосудам) и гемоксигенации (насыщения крови кислородом) нет.
3. Последовательно прошиты сшивающими аппаратами и пересечены нижняя и верхняя лёгочные вены и ствол лёгочной артерии. Выявлено, что опухоль подрастает к мышечной стенке пищевода, выполнена краевая резекция мышечной стенки пищевода на протяжении 2 см.
4. Острым путём отсечён левый главный бронх, при этом обнаружено, что опухоль распространяется перибронхиально. Культя левого главного бронха реампутирована (ампутирована повторно) в пределах визуально здоровой ткани стенки бронха, до 1,5-2 см от карины трахеи (гребня хряща между разделением двух главных бронхов). Центральная часть культи левого главного бронха ушита по Оверхольту.
5. Отступив по грудной стенке от края врастания опухоли в аорты на 2 см, рассечена и отсепарована (отделена хирургически) париетальная плевра и адвентиция аорты. Аорта мобилизована по типу "ручки чемодана" и взята на тесёмочные держалки выше и ниже места врастания опухоли.
6. Скелетизируя грудную стенку и аорту, с перевязкой левых межрёберных артерий, на участке рёбер 4, 5, 6 и 7 выполнена полуциркулярная резекция адвентиции аорты, мягких тканей грудной стенки с париетальной плеврой и тканей средостения.
7. Пневмонэктомия. Проверка аэростаза (герметичности) под уровнем жидкости — просачивания воздуха в области культи бронха нет.
8. Выполнена лимфодиссекция из области лёгочной связки, области бифуркации трахеи (места её разделения на главные бронхи), аортального окна, левого трахеобронхаильного угла и нижних паратрахеальных лимфатических узлов слева. Проверка гемостаза — сухо.
10. В плевральную полость заведён толстый силиконовый дренаж. Послойное ушивание раны, рёбра сведены тремя перикостальными швами. Наложена асептическая повязка.
- дренаж из плевральной полости удалён на первый послеоперационный день;
- из отделения реанимации и интенсивной терапии (ОРИТ) пациент переведён в госпитальное отделение с целью активизации.
Проведена профилактическая стандартная антибактериальная терапия в течение пяти суток. По данным контрольной рентгенографии, отмечено смещение средостения в оперированную сторону.
- умеренно-дифференцированная аденокарцинома лёгкого (G2) с очаговой периневральной и лимфо-васкулярной инвазией (Pn1, LV1), выраженной фибропластической реакцией стромы, умеренной воспалительной инфильтрацией, фокусами некрозов.
- Размер опухоли — 6,0 х 4,5 х 3,5 см — pT2b.
- В 40 исследованных лимфатических узлах (4 группа — 5 шт., 5 группа — 4 шт., 7 группа — 10 шт., 9 группа — 1 шт., 10 группа — 2 шт., 11 группа и внутрилегочные — 18 шт.) метастазов опухоли не обнаружено — pN0.
- Края резекции без опухоли — R0.
- Область "подрастания" опухоли к адвентиции аорты и врастания опухоли в средостения была представлена фиброзной тканью с воспалительной инфильтрацией стромы.
Еженедельный амбулаторный контроль состояния пациента в течение трёх недель констатировал неосложнённый поздний послеоперационный период.
Проведён повторный онкологический консилиум Клинической больницы № 2 АО ГК МЕДСИ по результату первого этапа лечения: учитывая размеры опухоли, периневральную и лимфо-васкулярную инфильтрацию, степень дифференцировки опухоли и возраст пациента, рекомендовано проведение химиотерапии в адъювантном режиме по схеме Пеметрексед + Карбоплатин (4 курса). Первый курс химиотерапии проведён в штатном режиме на 28 послеоперационный день.
Заключение
Таким образом, принимая во внимание данные предоперационного обследования и заключение специалистов лучевой диагностики, можно было ложно определить "нехирургическую" стадию рака лёгкого и констатировать полную невозможность радикального хирургического лечения (инвазия в стенку аорты). Однако прицельный пересмотр данных ПЭТ-КТ и учёт клинической картины воспалительного синдрома ( температура тела до 38 °С ; кашель, купированный на фоне ингаляционной терапии; болевой синдром, купированный приёмом НПВС) позволили принять решение о возможности хирургического лечения. Интраоперационная ревизия на мгновение пошатнула уверенность в правильности стадирования онкологического процесса, однако патологоанатомическое исследование полностью подтвердило предоперационную трактовку клинической ситуации.
Данное клиническое наблюдение свидетельствует о важности учёта параканкрозного воспаления при раке лёгких, которое может вносить существенный вклад в ложную трактовку стадии заболевания. Каждый пациент с злокачественной опухолью лёгкого требует индивидуального подхода и оценки рисков и возможностей радикального хирургического лечения.
Частота рака легких. Эпидемиология рака легкого
Физиология:
Популярные разделы сайта:
Эпидемиология рака легкого. Заболеваемость и смертность
Рак легкого как угроза общественному здоровью был впервые выделен в начале XX в., и с этого времени развернулась эпидемия заболевания. В настоящее время рак легкого — ведущая причина смерти от злокачественных новообразований в Объединенном Королевстве и ряде других развитых стран.
Соотношение мужчин и женщин составляет примерно 1,5:1. Эпидемия рака легкого у женщин практически не отличается от таковой у мужчин, разве что пик заболеваемости приходится на более старший возраст и частота встречаемости не такая высокая. В настоящее время заболеваемость раком легкого продолжает увеличиваться в старших возрастных группах и у мужчин, и у женщин. Однако среди молодых мужчин отмечена тенденция к снижению заболеваемости, что отражает сокращение курения.
Заболеваемость раком легкого резко возрастает с увеличением степени социальной депривации, причем величина этого градиента выше, чем у других опухолевых процессов. У людей работоспособного возраста смертность от рака легкого в 4,6 раза выше у неквалифицированных работников физического труда, чем у квалифицированных специалистов. При анализе исследования здоровья в Англии был обнаружен большой социальный градиент уровня котинина в плазме крови курильщиков, даже с учетом числа выкуриваемых сигарет в день. Эти данные свидетельствуют о том, что изменение уровня никотина может быть обусловлено социально-экономическим статусом.
Данные, полученные в США, демонстрируют, что заболеваемость раком легкого выше среди афроамериканцев, чем у представителей европеоидной расы, особенно у тех, у кого выше образование.
В Великобритании и Ирландии наибольшая летальность от рака легкого отмечена среди уроженцев Шотландии, затем — Ирландии и Западной Африки.
Рак легкого распространен во всем мире, где бы ни курили люди. Несмотря на то что наименьшая заболеваемость раком легкого в настоящее время установлена в Африке и других развивающихся странах, за распространением курения неизбежно последует и эпидемия рака легкого.
В первых исследованиях рака легкого, проведенных в 1950-х годах, плоскоклеточный рак был самым часто диагностируемым гистологическим типом, за которым следовал мелкоклеточный рак легкого. С конца 1970-х годов отмечено постепенное увеличение частоты встречаемости аденокарциномы, вероятно, в связи с увеличением уровня некоторых специфичных для табака нитрозаминов. Современные исследования свидетельствуют о том, что в настоящее время аденокарцинома — самый распространенный тип рака легкого у женщин, после которого идут плоскоклеточный, мелкоклеточный и крупноклеточный рак легкого.
Диагноз «рак легкого» означает неблагоприятный прогноз. Перспективы людей с раком легкого гораздо хуже, чем у пациентов с опухолью другой локализации. Только 25% пациентов с установленным раком легкого выживают в течение 1 года, и этот показатель падает до 7% к 5 годам.
Средняя продолжительность жизни больных мелкоклеточным раком легкого без лечения — лишь несколько месяцев. Средняя продолжительность жизни пациентов с распространенным процессом на фоне лечения — около 6 мес, при ограниченной форме заболевания — 9-12 мес. Прогноз при немелкоклеточном раке легкого немного лучше: однолетняя выживаемость составляет 25-45%.
Злокачественные опухоли легких
Злокачественные опухоли легких - общее понятие, объединяющее группу новообразований трахеи, легких и бронхов, характеризующихся бесконтрольным делением и разрастанием клеток, инвазией в окружающие ткани, их разрушением и метастазированием в лимфоузлы и отдаленно расположенные органы. Злокачественные опухоли легких развиваются из средне-, низко- или недифференцированных клеток, значительно отличающихся по структуре и функциям от нормальных. К злокачественным опухолям легких относятся лимфома, плоскоклеточный и овсяноклеточный рак, саркома, мезотелиома плевры, малигнизированный карциноид. Диагностика злокачественных опухолей легких включает рентгенографию, КТ или МРТ легких, бронхографию и бронхоскопию, цитологическое исследование мокроты и плеврального выпота, биопсию, ПЭТ.
МКБ-10
Общие сведения
Злокачественные опухоли легких - общее понятие, объединяющее группу новообразований трахеи, легких и бронхов, характеризующихся бесконтрольным делением и разрастанием клеток, инвазией в окружающие ткани, их разрушением и метастазированием в лимфоузлы и отдаленно расположенные органы. Злокачественные опухоли легких развиваются из средне-, низко- или недифференцированных клеток, значительно отличающихся по структуре и функциям от нормальных.
Самой частой злокачественной опухолью легких является рак легкого. У мужчин рак легкого встречается в 5-8 раз чаще, чем у женщин. Рак легкого обычно поражает пациентов старше 40-50 лет. Рак легкого занимает 1-е место в ряду причин смерти от рака, как среди мужчин (35%), так и среди женщин (30%). Другие формы злокачественных опухолей легких регистрируются значительно реже.
Причины злокачественных опухолей легкого
Появление злокачественных опухолей вне зависимости от локализации связывают с нарушениями дифференцировки клеток и пролиферации (разрастания) тканей, происходящими на генном уровне.
Факторами, вызывающими подобные нарушения в тканях легкого и бронхов, являются:
- активное курение и пассивное вдыхание сигаретного дыма. Курение является основным фактором риска возникновения злокачественных опухолей легких (в 90% у мужчин и в 70% у женщин). Никотин и смолы, содержащиеся в сигаретном дыме, обладают канцерогенным действием. У пассивных курильщиков вероятность развития злокачественных опухолей легких (особенно рака легкого) возрастает в несколько раз.
- вредные профессиональные факторы (контакт с асбестом, хромом, мышьяком, никелем, радиоактивной пылью). Люди, связанные в силу профессии с воздействием этих веществ, подвержены риску возникновения злокачественных опухолей легких, особенно, если они - курильщики.
- проживание в зонах с повышенным радоновым излучением;
- наличие рубцовых изменений легочной ткани, доброкачественных опухолей легкого, склонных к малигнизации, воспалительных и нагноительных процессов в легких и бронхах.
Данные факторы, влияющие на развитие злокачественных опухолей легких, могут вызывать повреждения ДНК и активизировать клеточные онкогены.
Виды злокачественных опухолей легких
Злокачественные опухоли легких могут изначально развиваться в легочной ткани или бронхах (первичная опухоль), а также метастазировать из других органов.
Рак легкого - эпителиальная злокачественная опухоль легких, исходящая из слизистой бронхов, бронхиальных желез или альвеол. Рак легкого обладает свойством метастазирования в другие ткани и органы. Метастазирование может происходить по 3 путям: лимфогенному, гематогенному и имплантационному. Гематогенный путь наблюдается при прорастании опухоли в кровеносные сосуды, лимфогенный - в лимфатические. В первом случает опухолевые клетки с кровотоком переносятся в другое легкое, почки, печень, надпочечники, кости; во втором - в лимфоузлы надключичиной области и средостения. Имплантационное метастазирование отмечается при прорастании злокачественной опухоли легких в плевру и распространении ее по плевре.
По локализации опухоли по отношению к бронхам различают периферический рак легкого (развивается из мелких бронхов) и центральный рак легкого (развивается из главного, долевых или сегментарных бронхов). Рост опухоли может быть эндобронхиальным (в просвет бронха) и перибронхиальным (в сторону легочной ткани).
По морфологическому строению различают следующие виды рака легкого:
- низко- и высокодифференцированный плоскоклеточный (эпидермоидный рак легкого);
- низко- и высокодифференцированный железистый рак легкого (аденокарцинома);
- недифференцированный (овсяноклеточный или мелкоклеточный) рак легкого.
В основе механизма развития плоскоклеточного рака легкого лежат изменения эпителия бронхов: замещение железистой ткани бронхов фиброзной, цилиндрического эпителия плоским, возникновение очагов дисплазии, переходящих в рак. В возникновении карциномы играют роль гормональные факторы и генетическая предрасположенность, способные активизировать канцерогены, попавшие в организм.
Овсяноклеточный рак относится к злокачественным опухолям легкого диффузной нейроэндокринной системы (АПУД-системы), продуцирующим биологически активные вещества. Этот вид рака легкого дает гематогенные метастазы уже на ранней стадии.
Лимфома - злокачественная опухоль легких, исходящая из лимфатический системы. Лимфома может первично локализоваться в легких или метастазировать в них из других органов (молочных желез, толстого кишечника, прямой кишки, почек, щитовидной железы, предстательной железы, желудка, яичка, шейки матки, кожи и костей).
Саркома - злокачественная опухоль легкого, развивающаяся из интраальвеолярной или перибронхиальной соединительной ткани. Саркома чаще развивается в левом, а не в правом легком, как рак. Мужчины заболевают саркомой чаще женщин в 1,5-2 раза.
Рак плевры (мезотелиомы плевры) - злокачественная опухоль, исходящая из мезотелия - эпителиальной ткани, выстилающей полость плевры. Чаще поражает плевру диффузно, реже - локально (в виде полипозных образований и узлов). В результате плевра утолщается до нескольких сантиметров, приобретает хрящевую плотность, становится шероховатой.
Малигнизированный карциноид приобретает все признаки злокачественной опухоли легкого: неограниченный инфильтративный рост, способность метастазирования в отдаленные органы (другое легкое, печень, головной мозг, кости, кожу, надпочечники, почки, поджелудочную железу). В отличие от рака легкого карциноид растет медленнее и позднее дает метастазы, поэтому радикальная операция дает хорошие результаты, местные рецидивы возникают редко.
Классификация рака легкого
В онкопульмонологии используется классификация рака легкого по международной системе TNM, где:
Т- первичная злокачественная опухоль легкого, ее размер и степень прорастания в ткани:
- ТХ - рентгенологические и бронхологические данные за наличие злокачественной опухоли легких отсутствуют, однако определяются атипичные клетки в смывах из бронхов или в мокроте
- ТО — первичная опухоль не определяется
- Tis — преинвазивный (внутриэпителиальный) рак
- Tl — в окружении легочной ткани или висцеральной плевры определяется опухоль диаметром до 3 см, при бронхоскопии признаков поражения главного бронха не обнаруживается
- Т2 — определяется опухоль диаметром более 3 см, переходящая на главный бронх ниже зоны бифуркации не менее чем на 2 см, либо с прорастанием висцеральной плевры, либо с наличием ателектаза части легкого
- ТЗ — опухоль с прорастанием в грудную стенку, париетальную плевру, перикард, диафрагму, или с распространением на главный бронх, не доходя менее 2 см до бифуркации, или сопровождающаяся ателектазом целого легкого; размер опухоли любой
- Т4 — опухоль распространяется на средостение, миокард, крупные сосуды (аорту, ствол лёгочной артерии, верхнюю полую вену), пищевод, трахею, зону бифуркации, позвоночник, а также опухоль, сопровождающаяся выпотным плевритом.
N - задействованность регионарных лимфоузлов:
- NX — недостаточно данных для оценки регионарных лимфоузлов
- NO — отсутствие метастатического поражения внутригрудных лимфоузлов
- N1 — метастазирование или распространение злокачественной опухоли легких на перибронхиальные или (и) лимфоузлы корня легкого
- N2 — метастазирование злокачественной опухоли легких в бифуркационные или лимфоузлы средостения со стороны поражения
- N3 — метастазирование злокачественной опухоли легких в лимфоузлы корня и средостения на противоположной стороне, надключичные или прескаленные лимфоузлы с любой стороны
M - отсутствие или наличие отдаленных метастазов:
- MX — недостаточно данных для оценки отдаленных метастазов
- МО — отсутствие отдаленных метастазов
- Ml — наличие отдаленных метастазов
G — градация по степени дифференцировки злокачественной опухоли легких (определяется после гистологического исследования):
- GX — невозможно оценить степень клеточной дифференцировки
- GI — высокодифференцированная
- G2 — умереннодифференцированная
- G3 — низкодифференцированная
- G4 — недифференцированная
IV стадии рака легкого:
- I - опухоль легкого размером до 3 см с локализацией в пределах одного сегмента или сегментарного бронха, метастазы отсутствуют.
- II - опухоль легкого размером до 6 см с локализацией в пределах одного сегмента или сегментарного бронха, наличие единичных метастазов в бронхопульмональных лимфоузлах
- III - опухоль легкого размером более 6 см, переходящая на соседнюю долю, соседний или главный бронх, метастазы в трахеобронхиальные, бифуркационные, паратрахеальные лимфоузлы.
- IV— опухоль легкого распространяется на другое легкое, соседние органы, имеются обширные местные и отдаленные метастазы, раковый плеврит.
Знание классификации злокачественных опухолей легких позволяет прогнозировать течение и исход болезни, план и результаты лечения.
Симптомы злокачественных опухолей легких
Проявления злокачественных опухолей легких определяются локализацией, размерами опухоли, ее отношением к просвету бронха, осложнениями (ателектазом, пневмонией), распространенностью метастазов. Ранние симптомы злокачественных опухолей легких малоспецифичны. Пациентов беспокоят нарастающая слабость, повышенная утомляемость, периодическое повышение температуры тела, недомогание. Начало развития опухоли часто маскируется под клинику бронхита, пневмонии, частых ОРВИ. Нарастание и рецидивы этих проявлений заставляют пациента обратиться к врачу.
Дальнейшее развитие злокачественных опухолей легких эндобронхиальной локализации характеризуется упорным кашлем со слизисто-гнойной мокротой и нередко кровохарканьем. Легочное кровотечение говорит о прорастании опухоли в крупные сосуды. С увеличением размеров злокачественной опухоли легких нарастают явления нарушения бронхиальной проходимости - появляется одышка.
Периферические опухоли легких протекают бессимптомно до момента прорастания в грудную стенку или плевру, когда возникают сильные боли в груди. Поздние проявления злокачественных опухолей легких - слабость, похудание, кахексия. В поздних стадиях рак легкого сопровождается массивным, рецидивирующим геморрагическим плевритом.
Диагностика злокачественных опухолей легких
Выраженные физикальные проявления на ранних этапах онкопроцесса в легких нехарактерны. Основным источником выявления злокачественных опухолей легких на стадии отсутствия клиники является рентгенография. Злокачественные опухоли легких могут быть случайно выявлены при проведении профилактической флюорографии. При рентгенографии легких определяются опухоли диаметром более 5-6 мм, участки сужения и неровностей контуров бронхов, ателектаза и инфильтрации. В сложных диагностических случаях дополнительно проводят МРТ или КТ легких.
При периферической локализации опухоли легкого определяется плевральный выпот. Подтверждается диагноз такой злокачественной опухоли легких цитологическим исследованием выпота, полученного путем плевральной пункции, или биопсией плевры. Наличие первичной опухоли или метастазов в легких может устанавливаться при цитологическом исследовании мокроты. Бронхоскопия позволяет осмотреть бронхи вплоть до субсегментарных, обнаружить опухоль, провести забор бронхиальных смывов и трансбронхиальную биопсию.
Глубоко расположенные опухоли диагностируются при помощи пункционной биопсии легкого и гистологического исследования. С помощью диагностической торакоскопии или торакотомии определяется операбельность злокачественной опухоли легких. При метастазировании злокачественной опухоли легких в прескаленные лимфоузлы проводят их биопсию с последующим определением гистологической структуры опухоли. Отдаленные метастазы первичной опухоли легких выявляются при УЗИ-эхолокации, КТ или радиоизотопном сканировании (ПЭТ).
Лечение злокачественных опухолей легких
Радикальным методом лечения злокачественных опухолей легких является их оперативное удаление, которое проводят торакальные хирурги. Учитывая стадию и обширность поражения, производят удаление одной или двух долей легкого (лобэктомия или билобэктомия); при распространенности процесса - удаление легкого и регионарных лимфоузлов (пневмонэктомия). Методом проведения оперативного вмешательства может быть торакотомия или видеоторакоскопия. Одиночные или множественные метастазы в легком оперируют, если произведено удаление первичного очага.
Оперативное лечение при злокачественных опухолях легких не проводится в случаях:
- невозможности радикального удаления опухоли
- наличия отдаленных метастазов
- тяжелых нарушений функций легких, сердца, почек, печени
Относительным противопоказанием к оперативному лечению является возраст пациента старше 75 лет.
В послеоперационном периоде или при наличии противопоказаний к операции проводится лучевая и/или химиотерапия. Часто различные виды лечения злокачественных опухолей легких комбинируют: химиотерапия - операция - лучевая терапия.
Прогноз и профилактика
Без лечения продолжительность жизни пациентов с диагностированными злокачественными опухолями легких составляет около 1 года.
Прогноз при радикально проведенной операции определяется стадией заболевания и гистологическим видом опухоли. Самые неблагоприятные результаты дает мелкоклеточный низкодифференцированный рак. После операций по поводу дифференцированных форм рака I стадии пятилетняя выживаемость пациентов составляет 85-90%, при II стадии - 60%, после удаления метастатических очагов - от 10 до 30 %. Летальность в послеоперационном периоде составляет: при лобэктомии - 3-5 %, при пневмонэктомии - до 10 %.
Профилактика злокачественных опухолей легких диктует необходимость активной борьбы с курением (как активным, так и пассивным). Важнейшими мерами являются снижение уровня воздействия канцерогенов на производстве и в окружающей среде. В предупреждении злокачественных опухолей легких играет роль профилактическое рентгенологическое обследование лиц группы риска (курящих, пациентов с хроническими пневмониями, работников вредных производств и др.).
2. Рак легкого: учебно-методическое пособие для студентов/ Иванов С. А. , Нагла Ю. В., Коннов Д.Ю. - 2011.
Рак легких
Рак легких - злокачественная опухоль, берущая начало из тканей бронхов или легочной паренхимы. Симптомами рака легких могут служить субфебрилитет, кашель с мокротой или прожилками крови, одышка, боли в грудной клетке, похудание. Возможно развитие плеврита, перикардита, синдрома верхней полой вены, легочного кровотечения. Точная постановка диагноза требует проведения рентгенографии и КТ легких, бронхоскопии, исследования мокроты и плеврального экссудата, биопсии опухоли или лимфоузлов. К радикальным методам лечения рака легкого относятся резекционные вмешательства в объеме, продиктованном распространенностью опухоли, в сочетании с химиотерапией и лучевой терапией.

Рак легкого - злокачественное новообразование эпителиального происхождения, развивающееся из слизистых оболочек бронхиального дерева, бронхиальных желез (бронхогенный рак) или альвеолярной ткани (легочный или пневмогенный рак). Рак легкого лидирует в структуре смертности населения от злокачественных опухолей. Летальность при раке легких составляет 85% от общего числа заболевших, несмотря на успехи современной медицины.
Развитие рака легкого неодинаково при опухолях разной гистологической структуры. Для дифференцированного плоскоклеточного рака характерно медленное течение, недифференцированный рак развивается быстро и дает обширные метастазы. Самым злокачественным течением обладает мелкоклеточный рак легкого: развивается скрытно и быстро, рано метастазирует, имеет плохой прогноз. Чаще опухоль возникает в правом легком - в 52%, в левом легком - в 48% случаев.
Причины
Факторы возникновения и механизмы развития рака легкого не отличаются от этиологии и патогенеза других злокачественных опухолей легкого. В развитии рака легких главная роль отводится экзогенным факторам:
- курению
- загрязнению воздушного бассейна веществами-канцерогенами
- воздействию радиации (особенно радона).
Патогенез
Раковая опухоль преимущественно локализуется в верхней доле легкого (60%), реже в нижней или средней (30% и 10% соответственно). Это объясняется более мощным воздухообменом в верхних долях, а также особенностями анатомического строения бронхиального дерева, в котором главный бронх правого легкого прямо продолжает трахею, а левый в зоне бифуркации образует с трахеей острый угол. Поэтому канцерогенные вещества, инородные тела, частицы дыма, устремляясь в хорошо аэрируемые зоны и длительно задерживаясь в них, вызывают рост опухолей.
Метастазирование рака легких возможно по трем путям: лимфогенному, гематогенному и имплантационному. Наиболее частым является лимфогенное метастазирование рака легких в бронхопульмональные, пульмональные, паратрахеальные, трахеобронхиальные, бифуркационные, околопищеводные лимфоузлы. Первыми при лимфогенном метастазировании поражаются пульмональные лимфоузлы в зоне разделения долевого бронха на сегментарные ветви. Затем в метастатический процесс вовлекаются бронхопульмональные лимфатические узлы вдоль долевого бронха.
В дальнейшем возникают метастазы в лимфоузлах корня легкого и непарной вены, трахеобронхиальных лимфоузлах. Следующими вовлекаются в процесс перикардиальные, паратрахеальные и околопищеводные лимфатические узлы. Отдаленные метастазы возникают в лимфоузлах печени, средостения, надключичной области. Метастазирование рака легкого гематогенным путем происходит при врастании опухоли в кровеносные сосуды, при этом наиболее часто поражаются другое легкое, почки, печень, надпочечники, мозг, позвоночник. Имплантационное метастазирование рака легких возможно по плевре в случае прорастания в нее опухоли.
Классификация
По гистологической структуре выделяют 4 типа рака легкого: плоскоклеточный, крупноклеточный, мелкоклеточный и железистый (аденокарцинома). Знание гистологической формы рака легкого важно в плане выбора лечения и прогноза заболевания. Известно, что плоскоклеточный рак легкого развивается относительно медленно и обычно не дает ранних метастазов. Аденокарцинома также характеризуется сравнительно медленным развитием, но ей свойственна ранняя гематогенная диссеминация. Мелкоклеточный и другие недифференцированные формы рака легкого скоротечны, с ранним обширным лимфогенным и гематогенным метастазированием. Замечено, что чем ниже степень дифференцировки опухоли, тем злокачественнее ее течение.
По локализации относительно бронхов рак легких может быть:
- центральным, возникающим в крупных бронхах (главном, долевом, сегментарном)
- периферическим, исходящим из субсегментарных бронхов и их ветвей, а также из альвеолярной ткани.
Центральный рак легкого встречается чаще (в 70%), периферический - гораздо реже (в 30%). Форма центрального рака легкого бывает эндобронхиальной, перибронхиальной узловой и перибронхиальной разветвленной. Периферическая раковая опухоль может развиваться в форме «шаровидного» рака (круглой опухоли), пневмониеподобного рака, рака верхушки легкого (Панкоста). Классификация рака легкого по системе TNM и стадиям процесса подробно дана в статье «злокачественные опухоли легких».
Симптомы
Клиника рака легкого схожа с проявлениями других злокачественных опухолей легких. Типичными симптомами служат постоянный кашель с мокротой слизисто-гнойного характера, одышка, субфебрильная температура тела, боли в грудной клетке, кровохарканье. Некоторые различия в клинике рака легких обусловлены анатомической локализацией опухоли.
Центральный рак легкого
Раковая опухоль, локализующаяся в крупном бронхе, дает ранние клинические симптомы за счет раздражения слизистой оболочки бронха, нарушения его проходимости и вентиляции соответствующего сегмента, доли или целого легкого.
Заинтересованность плевры и нервных стволов вызывает появление болевого синдрома, ракового плеврита и нарушений в зонах иннервации соответствующих нервов (диафрагмального, блуждающего или возвратного). Метастазирование рака легкого в отдаленные органы обусловливает вторичную симптоматику со стороны пораженных органов.
Прорастание опухолью бронха вызывает появление кашля с мокротой и нередко с примесью крови. При возникновении гиповентиляции, а затем ателектаза сегмента или доли легкого присоединяется раковая пневмония, проявляющаяся повышенной температурой тела, появлением гнойной мокроты и одышки. Раковая пневмония хорошо поддается противовоспалительной терапии, но рецидивирует вновь. Раковая пневмония часто сопровождается геморрагическим плевритом.
Прорастание или сдавление опухолью блуждающего нерва вызывает паралич голосовых мышц и проявляется осиплостью голоса. Поражение диафрагмального нерва приводит к параличу диафрагмы. Прорастание раковой опухоли в перикард вызывает появление болей в сердце, перикардита. Заинтересованность верхней полой вены приводит к нарушению венозного и лимфатического оттока от верхней половины туловища. Так называемый, синдром верхней полой вены проявляется одутловатостью и отечностью лица, гиперемией с цианотичным оттенком, набуханием вен на руках, шее, грудной клетке, одышкой, в тяжелых случаях - головной болью, зрительными расстройствами и нарушением сознания.
Периферический рак лёгкого
Периферический рак легкого на ранних этапах своего развития бессимптомен, т. к. болевые рецепторы в легочной ткани отсутствуют. По мере увеличения опухолевого узла происходит вовлечение в процесс бронхов, плевры, соседних органов. К местным симптомам периферического рака легких относятся кашель с мокротой и прожилками крови, синдром сдавления верхней полой вены, осиплость голоса. Прорастание опухоли в плевру сопровождается раковым плевритом и сдавлением легкого плевральным выпотом.
Развитие рака легких сопровождается нарастанием общей симптоматики: интоксикации, одышки, слабости, потери веса, повышения температуры тела. В запущенных формах рака легкого присоединяются осложнения со стороны пораженных метастазами органов, распад первичной опухоли, явления бронхиальной обструкции, ателектазы, профузные легочные кровотечения. Причинами смерти при раке легких чаще всего служат обширные метастазы, раковые пневмонии и плевриты, кахексия (тяжелое истощение организма).
Диагностика
Диагностика при подозрении на рак легкого включает в себя:
- общеклинические анализы крови и мочи;
- биохимическое исследование крови;
- цитологические исследования мокроты, смыва с бронхов, плеврального экссудата;
- оценку физикальных данных;
- рентгенографию легких в 2-х проекциях, линейную томографию, КТ легких;
- бронхоскопию (фибробронхоскопию);
- плевральную пункцию (при наличии выпота);
- диагностическую торакотомию;
- прескаленную биопсию лимфоузлов.

КТ ОГК. Солидная мягкотканная опухоль в верхней доле левого легкого с морфологическими признаками злокачественности.
Лечение рака легкого
Ведущими в лечении рака легких являются хирургический метод в сочетании с лучевой терапией и химиотерапией. При наличии противопоказаний или неэффективности данных методов проводится паллиативное лечение, направленное на облегчение состояния неизлечимо больного пациента. К паллиативным методам лечения относятся обезболивание, кислородотерапия, детоксикация, паллиативные операции: наложение трахеостомы, гастростомы, энтеростомы, нефростомы и т. д.). При раковых пневмониях проводится противовоспалительное лечение, при раковых плевритах - плевроцентез, при легочных кровотечениях - гемостатическая терапия.
Прогноз
Наихудший прогноз статистически отмечается при нелеченном раке легких: почти 90% пациентов погибают через 1-2 года после постановки диагноза. При некомбинированном хирургическом лечении рака легкого пятилетняя выживаемость составляет около 30%. Лечение рака легких на I cтадии дает показатель пятилетней выживаемости в 80%, на II - 45%, на III - 20%.
Самостоятельная лучевая или химиотерапия дает 10%-ную пятилетнюю выживаемость пациентов с раком легких; при комбинированном лечении (хирургическом + химиотерапии + лучевой терапии) процент выживаемости за это же период равен 40%. Прогностически неблагоприятно метастазирование рака легких в лимфоузлы и отдаленные органы.
Профилактика
Вопросы профилактики рака легких актуальны в связи с высокими показателями смертности населения от данного заболевания. Важнейшими элементами профилактики рака легких являются активная санпросветработа, предупреждение развития воспалительных и деструктивных заболеваний легких, выявление и лечение доброкачественных опухолей легких, отказ от курения, устранение профессиональных вредностей и повседневного воздействия канцерогенных факторов. Прохождение флюорографии не реже одного раза в 2 года позволяет обнаружить рак легкого на ранних стадиях и не допустить развития осложнений, связанных с запущенными формами опухолевого процесса.
Читайте также:
