Лечение токсического зоба радиоактивным йодом и ее эффективность
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Радиойод, или радиоактивный изотоп йода, представляет собой специально модифицированный атом йода. Искусственная модификация заставляет частицы излучать излучение. Это излучение с высокой энергией и малым радиусом действия. Уничтожает клетки на расстоянии 2 мм от радиоактивной частицы.
Препарат вводят перорально. Он всасывается из нашего пищеварительного тракта в кровь, после чего захватывается щитовидной железой и накапливается там. Поскольку другие клетки нашего организма не используют йод, остальная часть препарата быстро выводится с мочой. Таким образом, изотоп практически уничтожает только клетки щитовидной железы. Его действие не является немедленным. Вы должны ждать до 6 месяцев для полного эффекта.
Каковы могут быть побочные эффекты лечения?
В зависимости от того, какая часть железы разрушена, остальная часть щитовидной железы будет производить разное количество гормонов. В результате лечения мы можем иметь дело с дефицитом, избыточным или нормальным количеством гормонов щитовидной железы. Их избыток свидетельствует о разрушении слишком маленькой части щитовидной железы. Затем дается следующая доза радиоактивного йода.
Правильный уровень гормонов указывает на то, что часть железы, которая производит правильное количество гормонов, остается позади. Однако такая оптимальная ситуация встречается относительно редко. Следовательно, дефицит гормонов щитовидной железы следует принимать во внимание как естественный результат лечения. Этот недостаток легко дополняется гормонами, вводимыми в форме таблеток. Единственным недостатком является необходимость использовать их на всю жизнь.
Лечение радиоактивным йодом с соблюдением установленных правил является безопасным лечением. Это не приводит к бесплодию, поэтому его можно применять у молодых людей.
Когда используется такая терапия?
Лечение радиоактивным йодом широко используется. Является лучшим методом лечения для большинства пациентов с одним узлом щитовидной железы. Перед началом терапии рак следует исключить как противопоказание к изотопной терапии. Для этого проводится УЗИ и, возможно, биопсия щитовидной железы.
Радиойод также является хорошим способом лечения пациентов, страдающих болезнью Грейвса или токсическим зобом. Тем не менее, это не рекомендуется, если есть опухоль, подозреваемая в зловредности в зобе. Независимо от причины гипертиреоза, радиоактивный йод нельзя использовать во время беременности и кормления грудью.
Противопоказание связано с потенциально вредным воздействием радиации на развивающийся детский организм.
Как выглядит лечение?
Сцинтиграфия щитовидной железы выполняется до введения радиоактивного йода. Это безболезненный тест, позволяющий оценить, сколько йода захватывает железа. На основании результатов обследования определяется доза радиоактивного йода для пациента. Если ранее применялись антитиреоидные препараты, их следует прекратить заблаговременно до введения изотопа. В назначенный день пациент отправляется в центр ядерной медицины, где ему дают капсулу для глотания. Иногда госпитализация может быть необходима, но обычно пациент возвращается домой в тот же день.
В течение следующей недели лечащему человеку следует избегать контакта с беременными женщинами и маленькими детьми. Кроме того, пациент может функционировать совершенно нормально. После введения радиоактивного йода требуются регулярные медицинские осмотры. Через 3, 6 и 12 месяцев проводятся гормональные тесты для оценки эффективности лечения.
Поскольку эффекты терапии проявляются с задержкой, возможно, вам придется использовать противотиреоидные препараты в ближайшие месяцы.
Радиойодтерапия - все о методе лечения

История Радиойодтерапии ведет свое начало с 1941 года, когда в США (в Бостоне и Беркли) впервые было осуществлено введение радиоизотопов йода на практике.
С тех пор, за долгие годы использования, радиойодтерапия зарекомендовала себя в качестве достоверного, надежного и безопасного метода лечения при
- при гиперпродукции гормонов ЩЖ (диффузный токсический зоб, тиреотоксикоз, аденома ЩЖ);
- злокачественная опухоль ЩЖ (папиллярный и фолликулярный рак).
В большинстве стран мира (прежде всего в странах Европы и США) радиойодтерапия настолько безопасна, что небольшие дозы принимаются в амбулаторном режиме.
Современные российские национальные нормы радиационной безопасности РФ (НРБ-2009) позволяют проводить лечение радиоактивным йодом I 131 в амбулаторном режиме дозами, активностью, не превышающей 10,4 mCi. Во многих странах Европы данные нормы более «либеральные». Это делает возможным достижение желаемого результата с первого раза.
Хорошие результаты в лечение щитовидной железы методом радиойодтерапии во многом определяются грамотной подготовкой и реабилитацией после РЙТ.
Что такое радиоактивный йод (изотоп йода I-131)
Радиоактивный йод (I-131) - это один из изотопов самого обычного йода (I-126). Изотоп - это разновидность атома химического элемента, которая имеет тот же порядковый номер, но различается своим массовым числом. Такое отличие делает атом изотопа нестабильным, что приводит к его распаду с радиоактивным излучением. В природе существует много изотопов одного и того же химического элемента, исключением не стал и йод.
В медицине применение нашли 2 изотопа радиоактивного йода - I-131 и I-123. Йод с массовым числом 123 не имеет цитотоксического действия на клетки щитовидной железы и используется только в диагностических целях (сканирование ЩЖ).
I-131 обладает способностью к самопроизвольному распаду атома. Период полураспада составляет 8 суток. При этом образуется нейтральный атом ксенона, квант гамма-излучения и бета частица (электрон). Терапевтическое действие осуществляется именно благодаря бета частицам. Такие частицы имеют очень высокую скорость движения, но маленький пробег в тканях (до 2 мм). Таким образом, они проникают в биологические ткани (клетки ЩЖ) и разрушают клетку (цитотоксическое действие).
Благодаря тому, что йод накапливается в организме человека исключительно в клетках щитовидной железы, свое действие I-131 осуществляет только здесь, на другие ткани он не действует.
Гамма-излучение, которое образуется при радиоактивном распаде атома йода, проникает сквозь организм человека (имеет большой пробег, но маленькую энергию). Таким образом, оно не воздействует на клетки организма. Но может быть использовано в диагностических целях. Так можно определить, где еще в организме накопился йод с помощью специальной гамма-камеры, которая регистрирует такое излучение. Если такие очаги есть, то можно думать о существовании метастазов рака ЩЖ.
Радиойодтерапия в лечении щитовидной железы

Суть лечебного процесса основана на способности клеток щитовидной железы к связыванию и накоплению радиоизотопа йода I131, который обладает повреждающим действием на тиреоидную ткань. Известно, что период полураспада I 131 составляет всего 8 суток и, именно, локальный облучающий эффект, без повреждения других органов и систем делает метод радиойодтерапии таким привлекательным.
В настоящее время задачей специалистов является однократное лечение радиоактивным йодом I131 в достаточной дозе, которая вызывает развитие гипотиреоза. На второй план отходят дробные, малые дозы, которые, по сути, всего лишь отодвигают результат и часто требуют повторного введения. Безусловно, и объем расчетной дозы, а также прогноз во многом зависят от стадии заболевания, тяжести, наличия сопутствующей патологии. При тиреотоксикозе дозы радиойда I 131 в основном, варьируют от 3 до 30 mCi. При диффузно-токсическом зобе они, как правило, не превышают 25 mCi, при токсической аденоме 25-30 mCi. Однако, в каждом конкретном случае, ситуацию следует рассматривать индивидуально, на основании данных обследования. Для достижения ремиссии тиреотоксикоза при объемах щитовидной железы свыше 50-70 мл, может понадобиться повторное введение I131, что удлиняет достижение ремиссии. В отдельных случаях, можно рекомендовать оперативное лечение, как более предпочтительное.
Поправку на поглощение йода железой вносят, используя следующее уравнение:
Ожидаемым эффектом от радиойодтерапии является гипотиреоз. В первые 6-12 месяцев после приема I 131 он развивается более чем 80% случаев и является наилучшей гарантией отсутствия рецидива тиреотоксикоза. После приема I131 каждые 6-8 недель определяют уровни свТ4 и ТТГ в сыворотке и, при появлении признаков гипотиреоза, начинают заместительную терапию Т4 в дозе 0,05-0,2 мг в сутки.
Использование изотопа I 131 в качестве второго этапа лечения высокодифференцированного рака (папиллярный, фолликулярный) щитовидной железы требует назначение более высоких доз (до 200 mCi), безусловно, в зависимости от тяжести и распространенности процесса, а также соблюдение изоляционного режима в терапевтическом блоке в течение 2-3 дней.
Длительные наблюдения за больными показывают, что радиойодтерапия не приводит к бесплодию и порокам развития у плодов и не увеличивает частоту рака щитовидной железы.
Относительным противопоказанием к радиойодтерапии болезни Грейвса является тяжелая офтальмопатия, так как введение I 131 может обострять глазные проявления этого заболевания. Обострение болезни Грейвса особенно вероятно у больных с тяжелым тиреотоксикозом и у курильщиков. Однако его можно предотвратить введением преднизона по 40-60 мг в сутки на протяжении 1-2 месяцев после радиойодтерапии.
Терапия болезни Грейвса антитиреоидными средствами также не исключает развития гипотиреоза в отдаленном периоде (из-за аутоиммунной деструкции ЩЖ). Поэтому все больные нуждаются в пожизненном наблюдении.
Преимущества капсульной формы радиойода I131 жидкой

Раньше радиологические клиники и институты использовали радиойод в виде жидкого раствора, который пациенту предлагался для питья в пластиковом стаканчике.Однако, в связи с повышенным риском загрязнения окружающей среды, а также аварийности жидкой формы, данный протокол был отменен и современные медицинские учреждения перешли на капсульную форму.
- Точная дозировка радиойода в капсуле - капсула четко маркирована, упакована в свинцовый контейнер и ее удобно транспортировать до радиологических отделений. Медицинский работник всегда точно уверен в дозиметрическом контроле капсулы I131.
- Потери активности радиойода в капсульной форме минимальные. Он не остается на стенках стакана, исключаются риски случайного проливания жидкости при неосторожном обращении пациента со стаканом. Часто, у пожилых пациентов, с нарушением глотания, часть раствора может просто вытечь изо рта, или попасть «не в горло», что повлияет на результат лечения.
- При использовании капсульной формы радиойода возникает меньше побочных эффектов, чем при использовании жидкой формы. При использовании жидкой формы, орошается и полость рта, и пищевод; слюнные железы получают большую дополнительную радиационную нагрузку. В конечном итоге, больше раздражающего эффекта со стороны слизистой желудочно-кишечного тракта с соответствующими проявлениями (тошнота, вплоть до рвоты, неприятные ощущения при глотании, отечность шеи).
- Удобство использования для персонала радиологических отделений, в том числе хранения и транспорта. Вероятность возникновения аварийных ситуаций в таких отделениях сведена к минимуму.
- Комфортность для пациента, капсула не имеет запаха и вкуса, по размерам она не превышает капсулу антибиотика, витамина и т.д.
Таким образом, капсульная форма приема радиойода считается наиболее безопасной, более точной с точки зрения дозировки и с минимальными побочными эффектами. Рекомендуем Вам обращать пристальное внимание на то, в какой форме Клиника предлагает радиоактивный йод для приема пациентам.
Кюри или беккерель?
Это две единицы измерения, которые отображают одну и ту же физическую величину - радиоактивность материала.
Радиоактивность - это способность ядер атомов вещества распадаться на части. При распаде образуются ядра атомов гелия, электроны и кванты энергии - соответственно, альфа, бета и гамма лучи. Эти лучи губительно действуют на организм человека, но в умеренных дозах могут использоваться в медицинских целях.
Дозы измеряют в других единицах, а радиоактивность - в кюри и беккерелях. Подобно многим единицам в физике они названы фамилиями ученых, чья деятельность неразрывно связана с исследуемой областью. При этом сами единицы пишутся со строчной буквы, а в сокращении обозначаются заглавной - Ки (кюри) и Бк (беккерель).
За 1 Бк принято обозначать радиоактивность, при которой происходит 1 распад атомного ядра в секунду. Что касается кюри, то здесь принцип иной. 1 Ки отображает активность радона-222, газа, образующегося при распаде радия. Установлено, что в 1 г этого вещества происходит около 37 млрд. или 37•109 распадов в секунду.
Следовательно, 1 Ки = 37•109 или 3,7•1010 Бк. Соответственно, 1 Бк = 2,7027•10−11 Ки. Это значит, что 1 распад в секунду происходит всего лишь в 2,7027•10−11 граммах радия. Для значений, которые отличаются от стандартных единиц в тысячи, миллионы, миллиарды раз, используют приставки - милли (мКи), микро (мкКи), кило (кБк), мега (МБк), и др. В 1млрд. БК (1МБк) 0,027027•10 Ки, а в миллионной доле Ки (1мкКи) 3,7•104 Бк.
Исторически сложилось так, что радиоактивность измеряется в кюри, т. к. именно супруги Кюри внесли наиболее весомый вклад в открытие этого явления. Однако Генеральной конференцией по мерам и весам основной единицей измерения был признан беккерель, который входит в СИ - международную метрическую систему единиц измерения физических величин.
Поэтому в официальных докладах, в научных трудах радиоактивность, следуя правилам, представляют в беккерелях. На практике для обозначения радиоактивности, особенно ее больших значений, часто используют кюри.
Производная от радиоактивности величина - радиоактивное загрязнение, радиоактивность в единице объема, площади или массы. Здесь тоже кюри намного удобнее, чем беккерель. Поэтому степень радиоактивной загрязненности часто измеряют в Ки/м2, Ки/кг, Ки/л.
Преимущества радиойодтерапии
Согласно статистическим наблюдениям эффективность радиойодтерапии в лечении токсического зоба и аденомы составляет около 90%. Эта цифра превышает аналогичный показатель после хирургического вмешательства. К тому же хирургическое вмешательство предполагает операционную травму с высоким риском послеоперационных инфекционных осложнений. А радиойодтерапия не сопровождается болевыми ощущениями, и за исключением отдельных случаев легкого недомогания хорошо переносится пациентами. В случае щитовидного рака терапия радиоактивным йодом существенно снижает рецидивы роста опухоли и продлевает жизнь пациента.
Также после лечения изотопами йода НЕ остается страшных рубцов на шеи, чего очень боятся женщины, и нет многочисленных осложнений, как после хирургического удаления ЩЖ (гипопаратиреоз, потеря голоса, кровотечения, инфицирование раны). Организму не придется выдерживать нагрузку в виде наркоза.
Возможные осложнения и последствия

Чтобы избежать возможных осложнений после радиойодтерапии, мы разработали несколько программ реабилитации, одна из которых, включает в себя возможность восстановления здоровья в Реабилитационном Центре «Раменское». Под 24-часовым медицинским контролем наши пациенты получают весь комплекс мероприятий по скорейшему восстановлению и возвращению к привычному образу жизни.
Не менее актуальны вопросы безопасности применения радиойодтерапии, с учетом радиационного воздействия I-131 на организм. Большинство побочных эффектов удается минимизировать при правильной подготовке к лечению и соблюдении несложных правил профилактики.
Видео рекомендации по соблюдению режима и правилам поведения в терапевтическом блоке можно посмотреть здесь.
Ниже приведены как острые, так и возможные отдаленные последствия, которые могут встречаться после курса лечения радиойодом I-131:
Острые побочные явления
Сразу после проведения терапии радиойодом может возникнуть общая интоксикация, которая проявляется в виде тошноты и рвотных позывов, повышения температуры, общей слабости, боли в мышцах. Данные симптомы сугубо индивидуальны, и проходят достаточно быстро (в течение 48 - 72 часов). При необходимости подключаются симптоматические препараты, которые снимают интоксикационную нагрузку на организм.
Боли в области шеи, дискомфорт, отечность, боль при глотании. Симптомы, как правило, проходят самостоятельно в течение 14 дней после терапии, уменьшается их интенсивность и острота. При необходимости назначаются нестероидные противовоспалительные препараты.
Примерно у 10% пациентов возникает послерадиационный сиалоаденит (воспаление околоушной слюнной железы), который проявляется сухостью во рту, нарушением глотания твердой пищи, болью и припухлостью около уха. В качестве профилактики пациентам рекомендуется обильное питье, жевательные таблетки и леденцы с кислым вкусом, лимон.
Под действием радиации страдает и желудочно-кишечный тракт. Развивается лучевой гастрит и энтерит. Проявляется болью в животе, тошнотой, потерей аппетита, нарушением стула. Как правило, эти повреждения минимальны и самостоятельно проходят на протяжении нескольких дней. В последние годы используется радиоактивный йод в виде капсулы, вместо жидкого раствора, что существенно уменьшает повреждающее действия на слизистую пищевода, желудка и кишечного тракта.
В отдельных случаях, применение высоких доз радиоактивного йода угнетает кроветворную функцию костного мозга, которая проявляется в снижении количества лейко- и эритроцитов, тромбоцитов. Чаще всего, данное состояние самостоятельно проходит спустя 6 - 8 недель, однако, в ряде случаев может понадобиться консультация гематолога.
Мифы в отношении радиоактивного йода и самого метода терапии

По поводу радиойодтерапии существуют вполне объяснимые опасения, реальные и мнимые.За более, чем полувековой опыт применения радиоактивного йода I-131, клиническими исследованиями достоверно подтверждено что риск малигнизации (озлокачествления) при радиойодтерапии нисколько не превышает таковой риск при других методах лечения рака. Токсическое действие лучевой и химиотерапии несравненно сильнее, чем при использовании изотопов йода.
Доказано, что радиойод I131 захватывается клетками, имеющими на своей поверхности рецепторы к йоду, при минимальном воздействии на другие органы и ткани, что позволяет расширить показания и возрастные рамки использования данного метода.
Особенно актуальным вопросом являются мутагенные и тератогенные последствия радиойодтерапии. Долгосрочные клинические исследования не подтвердили мутагенного эффекта радиойода. Короткий период полувыведения, отсутствие накопительного эффекта, сохранность генетического материала и быстрое восстановление репродуктивных функций, позволяет пациентам, прошедшим курс радиойода I131, планировать беременность уже один год после радиойодтерапии. Как правило, этого времени организму вполне достаточно, чтобы “отремонтировать” все поломки и начать продуцировать здоровые половые клетки.
Согласно другим утверждениям, излучение от пациента, принявшего радиоактивные капсулы, может представлять опасность для окружающих. Соблюдение норм радиационной безопасности в лечебном учреждении сводит эту опасность к минимуму.
Также людей пугает то, что после курса радиойодтерапии ЩЖ перестает функционировать и развивается состояние гипотиреоза. Это действительно так, но такое состояние легко корригируется приемом синтетических тиреоидных гормонов и не несет опасности для здоровья.
г. Москва, Ленинский проспект,
д.42, корпус 2, офис 21-23.
Размещенная на сайте информация и прейскурант не являются публичной офертой.
Тиреотоксикоз: операция или радиойодтерапия
Для того, чтобы понятно ответить на этот вопрос, необходимо сделать небольшое медицинское отступление. Известно, что диффузный токсический зоб имеет достаточно высокий процент рецидивирующего течения. Следовательно, перед лечащим врачом и пациентом стоит главный вопрос - как сделать так, чтобы полностью вылечиться от этого неприятного недуга без необходимости принимать лекарственную терапию годами, не навредить своему организму и обойтись без негативных, побочных последствий.

В более чем половине случаев, лечение тиреотоксикоза начинается с назначения лекарственных препаратов из группы тирестатиков, к которым относятся:
- Мерказолил;
- Тирозол;
- Пропилтиоурацил (Пропицил).
Большой разницы в терапевтическом эффекте у них нет. При этом, назначенные медикаменты обладают целым спектром побочных эффектов, среди которых:
- струмогенный эффект (увеличение размеров железы по сравнению с начальным объемом);
- аллергические реакции (по типу крапивницы с сильным зудом);
- снижение уровня лейкоцитов в крови (как следствие - частые ангины, простуды);
- токсические эффекты на печень (повышение уровня билирубина, трансаминаз - АЛТ, АСТ).
Когда нужно рассматривать вопрос о радикальном лечении тиреотоксикоза?
Вопрос о радикальном лечении нужно рассматривать, если в течение 2-х лет (и более) наблюдаются следующие ситуации:
- нет эффекта от приема медикаментов;
- при попытке снижении дозировки, или отмены лекарственной терапии возникает рецидив (то есть возобновление симптомов тиреотоксикоза).
Если при этом в крови выявляется повышенный уровень антител к рТТГ* (рецепторам к ТТГ) - то, тем более, можно ожидать, что рецидив наступит. Данный анализ относится к прогностическому критерию слабой эффективности медикаментозной терапии. Чем выше уровень антител к рецепторам ТТГ (ат-рТТГ), тем более выраженный аутоимунный процесс и агрессивное воздействие антител на ткань щитовидной железы, которые постепенно ее разрушают.
Референсные значения антител к рецепторам ТТГ:
- Если уровень антител к ТТГ от 1 - 5 ед. - риск развития рецидива составляет 50%;
- Если уровень антител к ТТГ выше 5 и до 10 - почти в 70% случаев можно ожидать рецидива;
- Если уровень антител к ТТГболее 10 (особенно 15 - 30) - вероятность развития рецидива практически 100%.
Каковы симптомы этого состояния и его причины?
Неудовлетворительное отражение в зеркале, ухудшение качества жизни, отсутствие личной жизни и ее перспектив - вот что чаще всего подталкивает наших пациентов к поиску других путей решения проблемы и, зачастую, радикального лечения.
Особенно ярко негативная симптоматика при тиреотоксикозе проявляется у женщин. Плохое самочувствие, резкое снижение качества жизни, изменение внешности (в том числе: сухость кожи, ломкость ногтей, выпадение волос), нарушение менструального цикла, невозможность забеременеть (или сохранить беременность, в случае, если она наступила) - все это классические признаки далеко зашедшего тиреотоксикоза.
Если к уже имеющимся симптомам добавляется аритмия (перебои в работе сердца), суставные и мышечные боли, остеопороз, повышенные показатели уровня сахара в крови, то это говорит о глубокой степени тиреотоксикоза, - того состояния, когда патологический процесс может приобрести необратимую форму.
Мы прекрасно понимаем, что триггерами, то есть пусковыми факторами заболевания, служат разные состояния, и, прежде всего, - стрессовые. Уже давно известно, что любая стрессовая ситуация оставляет свой опечаток на человеке, - на его психическом и физическом здоровье. К сожалению, полностью исключить стресс из жизни невозможно. Конфликт в семейной жизни, болезнь или уход из жизни близкого человека, некоторые состояния в периоде от 3 до 6 месяцев после родов, долгое пребывание под прямыми солнечными лучами - это самые распространенные причины возникновения рецидива.
Поэтому врачи всегда призывают к своевременному лечению. И затягивать с принятием решения в данном случае просто опасно.
Какой метод лечения выбрать: операция или радиойодтерапия
Как уже отмечалось выше, если пациент в течение долгого времени (более 2-х лет) принимает (или принимал) тиреостатический препарат, а длительная ремиссия так и не наступила, - это уже веский повод для принятия решения о применении радикального метода лечения. Если такое решение, наконец, принято, то неизбежно возникает вопрос: "Какой метод лечения выбрать?"
На сегодняшний день радикальных методов лечения тиреотоксикоза два: хирургическое вмешательство и радиойодтерапия (РЙТ).
Сразу оговоримся, что задача обоих методов - добиться полного угасания функции щитовидной железы с последующим переходом на пожизненную заместительную терапию гормоном левотироксином (Л-тироксин или Эутирокс).
Вот теперь мы, наконец, можем перейти к основному вопросу данной статьи: в каких случаях стоит выбрать тот или иной вариант радикального лечения тиреотоксикоза.
На что стоит обратить внимание при выборе хирургического лечения?
В нашей практике были пациенты, которым удаляли только часть железы (как правило, одна доля), и со временем оставшаяся ткань разрасталась (пролиферировала) и, через какое-то время (возможно, у кого-то через полгода, возможно, и через 5 лет) - пациент приходил к своему врачу с той же проблемой. И перед хирургами вставал вопрос: «Что делать»?
- можно задеть паращитовидные железы - будет прямая проблема с уровнем паратгормона, который регулирует уровень кальция и фосфора в крови - отсюда ранний остеопороз;
- можно пациенту задеть возвратный нерв и, как последствие, лишить его голоса.
Щитовидная железа - богато кровоснабжаемый орган и достаточно сильно кровоточит при операции. Здесь находится много нейро-сосудистых пучков, которые можно травмировать.
Изначально маленький объем ЩЖ (без узловых образований) - также НЕ лучшая ситуация для операции.
Учитывая вышесказанное, если пациент все же принимает решение о хирургическом удалении щитовидной железы при диффузно-токсическом зобе - лучшим выбором объема операции будет тотальная тиреоидэктомия, или предельно субтотальная тиреоидэктомия, то есть удаление полностью всей ткани щитовидной железы, ради минимизации риска рецидива в будущем.
Повторимся, удаление только части железы (так называемая "резекция ткани железы") - влечет за собой высокий риск рецидива тиреотоксикоза в будущем. Причина тому ясна: аутоиммунный процесс, лежащий в основе диффузного токсического зоба, никуда не девается и удаление только части (одной доли) щитовидной железы со временем чревато увеличением в объеме ткани ЩЖ .
Хирургическое вмешательство будет правильным в случае узлового зоба, то есть наличия узла (тем более, нескольких узлов) в щитовидной железе, которые при сцинтиграфии окажутся «холодными» (не накапливающие радиофармпрепарат).
Естественно, прежде чем, выбирать тот или иной метод лечения, необходимо убедиться в доброкачественной природе данных узловых образований, что достигается путем выполнения тонкоигольной аспирационной биопсии (ТАБ). Золотой стандарт - проведение ТАБ под контролем ультразвука, из нескольких мест, а также соответствие описания биопсии международному протоколу Tirads.
В каких случаях радиойодтерапия будет являться лучшим выбором?
- небольшой объем щитовидной железы (в нашей практике объемы до 45 мл удается подавить с первого раза);
- отсутствие узловых образований;
- усиленный кровоток (васкуляризация ткани) при УЗИ щитовидной железы;
- отсутствие признаков эндокринной офтальмопатии;
- длительность анамнеза: безусловно, чем раньше начато лечение с момента дебюта (выявления) заболевания - тем лучше. Хотя, в нашей практике, мы сталкивались и с весьма успешным лечением тиреотоксикоза, который лечили медикаментозно очень долго (от 10 до 17 лет).

По нашей статистике, при условии, что пациент подготовлен к приему капсулы радиойода I131 правильно и качественно, успешность лечения тиреотоксикоза методом радиойодтерапии выше 95%. Это очень хороший показатель.
Мы принимаем самое непосредственное участие в подготовке пациентов к данной процедуре. Через наш эндокринологический отдел успешно прошло несколько тысяч человек. И нам очень приятно получать отзывы о том, что жизнь наладилась, что наши пациентки смогли забеременеть, родить и не одного ребенка, состояния удушья в горле перестали беспокоить, наладился менструальный цикл, восстановился сон и трудоспособность. Кто-то вышел замуж, кто-то родил долгожданного ребенка, а кто-то получает уже второе (третье) высшее образование.
- при объеме щитовидной железы свыше 45 мл есть риск, что одного лечения будет недостаточно. Так и было - у молодого мужчины, общий объем щитовидной железы приближался к 100 мл и загрудинное расположение создавало технические трудности для операции. Было принято решение о радиойодтерапии, с интервалом в полгода. Теперь - объем не превышает 5 мл, пациент принимает заместительную терапию, жалоб у него нет.
- диффузный - токсический зоб с эндокринной офтальмопатией (общий объем железы изначально был около 60 мл). Сама пациентка отказывалась от хирургического лечения и мы оговаривали многоступенчатую терапию I131 также с интервалом в 6 месяцев, под прикрытием глюкокортикоидной терапии, в целях защиты глазных яблок от возможного усиления симптомов ЭОП. Нам удалось со 2 раза добиться устойчивого гипотиреоза, симптомы ЭОП были смягчены. И тем не менее, в случае, когда у пациента выявлено данное осложнение со стороны глаз -мы рекомендуем хирургический метод лечения.
- индивидуальная особенность пациента, когда уровень аутоиммунного процесса сильно выражен (часто мы говорим про такую железу «маленькая, но злючая»)
Следует отметить, что наши пациенты после радиойодтерапии и пройденного этапа реабилитации ведут активный образ жизни: занимаются спортом, фитнессом, активно путешествуют, работают, воспитывают детей. Можно проводить время на свежем воздухе, на южных курортах, купаться в море и не испытывать никаких ограничений.
Необоснованные страхи набора лишнего веса НЕ страшны человеку, ведущему активный образ жизни и регулярно принимающему именно нужную ему дозировку Л-тироксина.
Беременность мы рекомендуем рассматривать через 1 год после прохождения РЙТ. И в нашей практике много примеров и историй успешных беременностей с рождением здоровых детей.
Страхи в отношении облучения при РЙТ также сильно преувеличены. Зная физические параметры I131 - период полураспада радиойода (8 суток), низкодозную нагрузку на окружающие органы, не поглощающие радиойод (в силу отсутствия соответствующих рецепторов), точечное лечение - позволяет отнести метод радиойодтерапии к наиболее перспективным в лечении диффузного-токсического зоба (тиреотоксикоза). Неспроста в странах Европы и США уже расширяют показания и снижают возрастную границу, при которой рассматривается РЙТ в качестве лечения первого выбора.
Что необходимо для успешной радиойодтерапии?
Безусловно, для того, чтобы лечение прошло максимально эффективно - необходимо выявить те факторы, которые могут помешать лечению:
- Необходимо грамотно интерпретировать данные УЗИщитовидной железы (зачастую при длительном тиреотоксикозе имеется тенденция к формированию «псевдоузлов», которые легко можно спутать с узлами;
- Необходимо уметь оценивать глазные симптомы, имеющиеся при эндокринной офтальмопатии (зачастую, можно ошибочно поставить диагноз ЭОП в то время, как у пациента имеется только отек век и легкое слезотечение);
- Необходимо понимать в какие сроки следует отменить тиреостатическую терапию перед проведением радиойодтерапии (так как, несвоевременная отмена может, с одной стороны, усилить симптомы и вызвать яркий гиперметаболизм - лечение будет менее эффективным). Или, если поздно отменить тиреостатики - железа будет долго заблокированной и это может привести к ошибочному расчету необходимой дозировки I131.
- В некоторых случаях требуется удлинение интервала соблюдения низкойодистой диеты, в том числе и после проведенного РЙТ;
- Зачастую врачи пропускают симптомы надпочечниковой недостаточности, которые могут сопровождать сильно выраженный тиреотоксикоз (если не обращать на данное состояние должного внимания и не лечить параллельно - можно ожидать неудовлетворительного эффекта от лечения).
- как избежать осложнений;
- как правильно подготовиться к беременности (если есть такой запрос);
- какая схема гормональной терапии будет наиболее приемлемой.
Кроме того, тех, кто решил сразу после радиойодтерапии провести реабилитационные мероприятия под непосредственным контролем врача вне дома, мы приглашаем в наш Реабилитационный центр "Раменское".
В новых, уютных корпусах пансионата, расположенного в тихом лесном массиве Раменского района Подмосковья, созданы все необходимые условия для проведения программ реабилитации после радиойодтерапии.
Нам очень приятно, что за более чем 15 лет работы мы смогли помочь нескольким тысячам пациентов, которые обрели красивую внешность здорового человека, создали /сохранили семью, родили здорового ребенка и продолжают делиться с нами своими успехами в жизни.
Радиойодтерапия: лечение рака ЩЖ
Необходимыми условиями к проведению радиойодтерапии I131 в качестве адъювантного (дополнительного) метода лечения при диагнозе «высокодифференцированный рак щитовидной железы» являются:
- Проведение тотальной тиреоидэктомии. От качества выполненного оперативного вмешательства во многом зависит возможность и эффективность проведения терапии радиоактивным йодом.
- Оптимальные сроки проведения терапии радиоактивным йодом - 4-6 недель после операции.
- Уровень ТТГ перед радиойодаблацией - не менее 30 мЕд/мл. Для этого следует отменить прием принимаемого Л-тироксина за 25-30 дней. Возможно также применение Тирогена.
- За 14 дней до проведения радиойодтерапии следует придерживаться диеты, обедненной йодом.
Пациентам:
1. Виды рака:
Виды рака щитовидной железы
По гистологическому строению новообразований рак ЩЖ имеет свою классификацию.
Папиллярный рак
Другие названия - папиллярная аденома, злокачественная папиллома, папиллярная цистаденома относится к наименее злокачественным формам рака щитовидной железы. Чаще всего обнаруживают у лиц до 40 лет.
Прогнозы на выживание при данной разновидности рака ЩЖ относительно благоприятные.
Гистологически опухоль состоит из разветвляющихся стеблей, имеющих васкуляризированную соединительнотканную основу и покрытых кубическим или цилиндрическим эпителием. Митозы наблюдаются редко. Папиллярные раки нередко имеют смешанное папиллярно-фолликулярное строение. Опухоль почти никогда не имеет капсулы. Выражена наклонность к кистозной дегенерации и кальцификации. Рост инвазивный.
Клинически папиллярный рак проявляется в виде бессимптомного, плотного, «холодного» узла в ЩЖ. Рост медленный. Опухоль годами может не выходить за пределы железы, с возрастом имеет тенденцию становиться более злокачественным . На рентгенограмме могут быть выявлены участки кальцификации.
Папиллярный рак обычно метастазирует в соседние участки ткани ЩЖ и регионарные лимфоузлы. На поздних стадиях возможны метастазы в легких. Иногда метастазы в регионарные лимфатические узлы обнаруживают раньше первичной опухоли — так называемая аберрантная струма.
Фолликулярный рак
Зачастую развивается на фоне острого дефицита йода в организме.
Фолликулярный рак (метастазирующая аденома, атипичная аденома, инкапсулированная ангиоинвазивная карцинома, злокачественная аденома). Встречается обычно после 40-летнего возраста.
Опухоль в большинстве случаев инкапсулирована. Преобладает фолликулярная структура. Фолликулы мелкие, часто неправильной формы, содержат незначительное количество коллоида. В отдельных местах — тубулярные и папиллярные элементы. Опухоль имеет выраженную наклонность к метастазированию гематогенным путем, чаще в кости и легкие. Фолликулярный рак и его отдаленные метастазы обычно хорошо захватывают йод, поддаются лечению радиойодтерапией и способны продуцировать тиреоидные гормоны.
Клинически фолликулярный рак проявляется в виде очень плотного округлого и подвижного при глотании узла в ЩЖ. Узел может быть «холодным», «теплым» или «горячим». Рост опухоли медленный.
Метастазы в регионарные лимфатические узлы наблюдаются редко, имеют папиллярное строение. Характерны отдаленные метастазы в кости, легкие и реже — в мозг пли печень. Костные метастазы проявляются болями и патологическими переломами. У отдельных больных продукция тиреоидных гормонов опухолевой тканью приводит к развитию тиреотоксикоза.
Вариантом фолликулярного рака является опухоль из клеток Гюртле (оксифильноклеточный рак), которая характеризуется присутствием крупных клеток с розовой цитоплазмой, содержащей множество митохондрий. Подробнее здесь.
Медуллярный рак
Опухоль крайне опасна по причине своей склонности к метастазированию в клетки печени, кости, надпочечников, легких или лимфатических узлов еще до того, как будет диагностирована. Встречается у лиц среднего и пожилого возраста, обычно старше 50 лет. Рост инфильтративный.
Клинически проявляется узловым увеличением ЩЖ. Узел может иметь различную консистенцию - от мягкой до каменисто-плотной, контурируется как «холодный».
Почти в 80% медуллярный рак ЩЖ возникает спорадически; остальные 20% имеют семейный характер, который может быть трояким:
- семейный медуллярный рак без сопутствующих эндокринных заболеваний;
- синдром МЭН IIА, включающий, помимо Медуллярного рака ЩЖ, феохромоцитому и гиперпаратиреоз;
- синдром МЭН IIБ - Медуллярный рак ЩЖ, феохромоцитома и множественный невромы слизистых. Различают также вариант синдрома МЭН IIА с папулезным амилоидозом кожи (зудящими высыпаниями в верхней части спины). В основе этих семейных синдромов лежат мутации протоонкогена ret (гена рецепторной тирозинкиназы — RЕТ). Чаще всего обнаруживаются мутации в экзонах 10, 11 и 16 этого протоонкогогена.
При выявлении медуллярного рака щитовидной железы (в ходе операции или с помощью ТАБ) необходимо проводить анализ ДНК на мутации протоонкогена ret. Отрицательные результаты такого анализа почти всегда свидетельствуют о спорадической природе опухоли, и в таких случаях обследование членов семьи больного не требуется. При обнаружении соответствующих мутаций необходимо обследовать всех членов данной семьи.
Недифференцированный (анапластический) рак щитовидной железы
Опухоль крайне злокачественна и дает отдаленные метастазы.
Анапластический рак капсулы не имеет. Гистологическая картина полиморфна. Преобладают веретенообразные и гигантские клетки. Обилие митозов. Закономерно наблюдаются некрозы центральных участков опухоли, вызванные недостатком ее кровоснабжения
Клинически опухоль проявляется локальным увеличением ЩЖ, нередко болезненным при пальпации. Опухоль быстро увеличивается в размерах, прорастает в соседние ткани и органы. Кожа над опухолью может быть теплой на ощупь. Регионарные лимфатические узлы увеличены. Рано появляются отдаленные метастазы. Ни первичная опухоль, ни метастазы радиоактивный йод не аккумулируют.
К недифференцированным опухолям ЩЖ относятся мелкоклеточные, гигантоклеточные и веретеноклеточные образования. Такие опухоли встречаются обычно у пожилых больных с длительным анамнезом зоба, у которых внезапно (за недели или месяцы) железа увеличивается настолько, что сдавливает окружающие ткани, приводя к дисфагии или к парезу голосовых связок. Больные погибают через 6-36 месяцев после установления диагноза от массивных местных поражений. Недифференцированные опухоли плохо поддаются лечению.
Лимфома
Еще одна разновидность патологии - лимфома ЩЖ. Эта опухоль формируется из лимфоцитов. Она может возникать как одно из осложнений аутоиммунного тиреоидита, либо же развиваться в качестве самостоятельной, первичной, патологии.
Лимфома ЩЖ может быть первичной или отражать генерализованный патологический процесс. В первом случае опухоль почти всегда возникает у больных с давним тиреоидитом Хашимото и гистологически ее трудно отличить от хронического тиреоидита. Дифференциальной диагностике помогает тот факт, что при лимфоме лимфоциты накапливаются в фолликулах и стенках сосудов, а не в интерстициальной ткани. В отсутствие поражений других органов эта опухоль легко поддается лучевой терапии.
Метастазы рака в щитовидную железу
К опухолям, дающим метастазы в ЩЖ, относятся рак молочной железы и почки, бронхогенный рак и меланома. Локализация первичного очага обычно известна. Иногда диагноз устанавливают с помощью ТАБ или открытой биопсии быстро растущего «холодного» узла ЩЖ. Прогноз зависит от характера первичной опухоли. Подробнее здесь.
Симптомы рака ЩЖ
Опасность рака ЩЖ заключается в том, что этот патологический процесс в течение долгого времени ничем себя не выдает.
По мере прогрессирования онкологического заболевания, появляются следующие симптомы:
- чувства сдавливания в горле;
- осиплости голоса;
- проблем с глотанием;
- головных болей, которые трудно купируются с помощью обезболивающих препаратов;
- общей слабости;
- повышенной потливости;
- одышки;
- приступов беспричинного кашля;
- болей в горле;
- потери или снижения аппетита.
Помимо вышеперечисленных симптомов, для рака ЩЖ характерно внезапное и безосновательное снижение массы тела. Это один из клинических признаков, который возникает тогда, когда болезнь уже перешла на поздний этап развития. Поэтому появление ранее описанной симптоматики должно насторожить, и заставить пациента как можно раньше обратиться за помощью к врачу.
Диагностика
Диагностические методы включают в себя:
- Врачебный осмотр щитовидной железы эндокринологом: врач может определить наличие зоба, его степень, нащупать узлы, подсчитать их количество, оценить текстуру ЩЖ, ее подвижность, состояние периферических лимфоузлов.
- Лабораторные исследования.
- Инструментальная диагностика.
- Цитологическое исследование — тонкоигольная биопсия с последующим анализом биоптата.
Лабораторные методики исследования щитовидной железы
Для полноценной диагностики состояния щитовидной железы важны анализы крови, в ходе которых определяют присутствие и количество тех или иных гормонов, онкомаркеров, микроэлементов и витаминов.
Чаще всего для оценки функции ЩЖ врачи назначают анализ крови на:
- тиреотропный гормон гипофиза;
- тироксин и трийодтиронин (свободный и общий);
- тиреоглобулин;
- антитела к тиреоглобулину, тиреопероксидазе, рецепторам ТТГ, микросомам тироцитов.
Инструментальные методы диагностики
- УЗИ. Основной инструментальный метод исследования ЩЖ из-за доступности, высокой информативности, простоты выполнения, безболезненности для пациента. Позволяет оценить анатомическую структуру и размеры железы, выявить узлы, кистозные образования, изучить кровоток в органе.
- Рентгенография органов шеи. Применяется редко, так как на сегодня существуют более информативные методики исследования. С помощью рентгена можно определить смещение органов шеи из -за зоба или опухоли щитовидной железы, выявить метастазы.
- КТ и МРТ. Это современные методики диагностики, которые позволяют с большой точностью изучить анатомическое строение ЩЖ, оценить ее расположение и связь с соседними органами и тканями, выявить узлы или кисты, точно определить их размер.
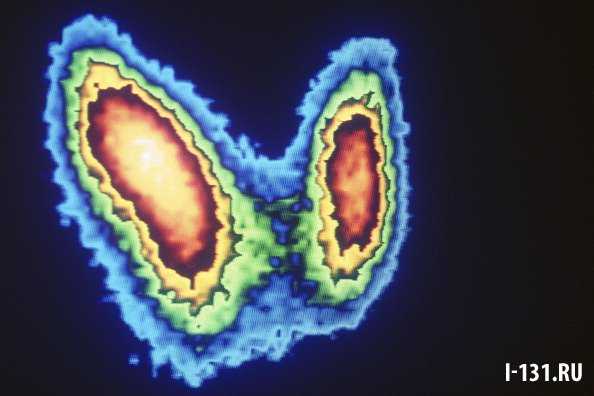
- Сцинтиграфия. Это радиоизотопное исследование, которое позволяет оценить не только структуру органа, но и его функцию. По активности накопления радиоактивного йода можно судить о функциональной активности железы в целом и отдельных ее участков, узлов.
- Биопсия. Только биопсия с дальнейшим цитологическим и морфологическим исследованием биоптатов позволяет подтвердить или исключить диагноз злокачественной опухоли. Также такое исследование дает возможность верифицировать любой диагноз (аутоиммунный тиреоидит, диффузный зоб, токсическая аденома и пр.).
Кому показана пункция щитовидной железы

Биопсия ЩЖ проводится далеко не всем пациентам. Показанием служат узлы или опухоли диаметром больше 1 см. При наличии у пациента генетической предрасположенности к раку или доброкачественной онкологии ЩЖ, пункция может быть назначена и при опухоли с диаметром, не достигающим 1 см.
- При узлах или опухолях до 1 см процедура выполняется однократно.
- При обнаружении новообразований больше 1 см манипуляцию проводят несколько раз с равными промежутками времени.
- обнаруженное новообразование не накапливает радиоактивный йод;
- обнаружение метастазов в других органов или в ЩЖ (вследствие ракового поражения любых других внутренних органов);
- появление множественных узловых новообразований;
- образование кисты;
- подозрение на злокачественную природу опухоли;
- внутри узла было зафиксировано активное кровообращение;
- опухоль локализуется в зоне перешейка ЩЖ;
- кровные родственники пациента страдали/страдают от рака ЩЖ;
- вблизи от патологического узла произошло увеличение лимфатических узлов;
- больной жалуется на болезненность в одной части шеи, возникающую при пальпации;
- узел не имеет капсулы с четкими контурами;
- новообразование содержит кальцинаты или другое «наполнение»;
- пациент ранее пребывал в регионах, подвергшихся радиоактивному излучению.
Однако, не только наличие узловых образований в щитовидной железе является основанием для проведения пункции. Так, манипуляция необходима при тиреоидите, зобе или рецидиве аденомы (зоба, карциномы, папиллярного, медуллярного или другого рака ЩЖ). Перед назначением процедуры врач обязательно изучает анамнез пациента, поскольку пункция щитовидной железы тоже имеет свои противопоказания к выполнению.
Лечение рака щитовидной железы
Общая схема лечения:
- Тотальная или субтотальная тиреоидэктомия (должна выполняться опытным хирургом, чтобы свести к минимуму осложнения операции).
- После удаления органа назначается супрессивная, заместительная гормональная терапия.
- Радиойодтерапия - применение радиоактивного йода необходимо для разрушения остатков тиреоидной ткани после тиреоидэктомии и профилактики рецидива рака. Остатки тиреоидной ткани разрушаются при введении I131 в дозах 30-50 мкКи, но при инвазивном или метастазирующем раке требуются большие дозы — 100-200 мкКи.
- Лечение после РЙТ - реабилитационные программы.
Дифференцированный рак щитовидной железы
Поскольку клетки и папиллярного, и фолликулярного рака реагируют на ТТГ и накапливают йод, эти виды рака часто объединяют общим названием «дифференцированный рак ЩЖ». Больных можно условно разделить на группы низкого и высокого риска. К группе низкого риска относят больных моложе 45 лет с опухолью меньше 2 см и отсутствием признаков ее распространения как внутри, так и за пределы железы. В таких случаях, как правило, рекомендуют тотальную тиреоидэктомию, хотя достаточным, вероятно, может быть и удаление одной только пораженной доли железы (лобэктомия). Всех остальных больных следует причислять к группе высокого риска, и им показана тотальная тиреоидэктомия, а при поражении регионарных лимфоузлов — и футлярно-фасциальное иссечение шейных лимфоузлов.
Многим больным группы низкого риска и всем без исключением больным группы высокого риска после операции показана радиойодтерапия.
Медуллярный рак щитовидной железы
Ведение больных с медуллярным раком ЩЖ отличается от лечения других видов рака только тем, что маркерами его рецидива являются повышенный уровень кальцитонина или КЭА, а применение I 131 для разрушения остатка тиреоидной ткани лишено смысла. Членов семьи больного с мутациями онкогена ге1 обследуют, как указано на схеме:
Метастазирующий медуллярный рак ЩЖ не поддается радиойодтерапии. Поэтому необходима максимально радикальная операция. Химиотерапия неэффективна. Супрессивная терапия Т4 не показана, так как такие опухоли прогрессируют независимо от ТТГ. При появлении метастазов можно использовать наружное облучение.
Медуллярный рак ЩЖ наиболее агрессивно протекает у больных с синдромом МЭН IIБ, медленнее — при спорадической опухоли и наименее агрессивно, - у больных с синдромом МЭН IIА и семейным Медуллярным раком щитовидной железы. Лучший метод лечения - ранняя радикальная хирургическая операция.
После появления метастазов любые методы малоэффективны, хотя некоторые виды Медуллярного рака щитовидной железы прогрессируют очень медленно
Недиффиринцированный рак щитовидной железы
Прогноз анапластического рака щитовидной железы очень плохой. Химиотерапия малоэффективна. В некоторых случаях диссеминированного неоперабельного рака, не поддающегося ни супрессивной терапии Т4, ни лучевой терапии, может помочь введение доксорубицина в дозе 75 мг/м2 (однократно или дробно по 1 инъекции в день в течение трех дней) с 3-недельными интервалами. Это вещество очень токсично и вызывает повреждение миокарда, лейкопению, облысение и желудочно-кишечные расстройства. Анапластический рак обычно приводит к смерти больных в течение 1 года.
Эффективность лечения диффузного токсического зоба в зависимости от расчетной терапевтической активности радиоактивного йода
Пациенты с диффузным токсическим зобом получили лечение радиоактивным йодом в дозе 5,3-30,0 мКи. Для расчета оптимальной терапевтической активности (TA) использовалась специальная формула, в которой учитывался объем щитовидной железы и захват диагностической активности радиоактивного йода через 24 ч. В результате удельная терапевтическая активность (УТА) коррелировала с удельной активностью (УA) и объемом щитовидной железы. Установлено, что высокий процент (33,3) отсутствия эффекта от радиойодтерапии (РИТ) наблюдался, когда рассчитанная УТА была менее 0,3 мКи/мл, и сокращался до 11,1% при назначении большей активности. Назначение стандартной активности радиоактивного йода (10 мКи) при объеме щитовидной железы до 40 мл по сравнению с рассчитанной по формуле приводит к схожей частоте отсутствия эффекта РИТ тиреотоксикоза при меньшей частоте эутиреоза.
Ключевые слова
Для цитирования:
For citation:
Для лечения диффузного токсического зоба (ДТЗ) 131 1 используются различные методы расчета его терапевтической активности (ТА). Так, например, применяют фиксированную ТА в диапазоне от 6 до 20 мКи [5, 7, 11]. Или подсчитываютТА, исходя из объема щитовидной железы (ЩЖ) и захвата 131 1 железой [4, 8, 13]. Или же определяют поглощенную ЩЖдозу |3, 1 при диагностическом исследовании и, исходя из нее, высчитывают необходимую ТА [1, 3, 9, 10]. Вместе с тем, несмотря на различные подходы при расчете ТА 131 1, в 12—15% случаев эффект от лечения отсутствует [2, 4, 6, 9, 11].
В нашем исследовании использована формула расчета ТА по удельной активности (УА), эффективность которой оценивали с точки зрения оптимизации ТА |3| 1 для лечения ДТЗ.
Материалы и методы
Радиойодтерапию (РИТ) тиреотоксикоза получили 48 больных с ДТЗ (42 женщины и 6 мужчин). В обследованной группе преобладали лица среднего возраста — 45,4 ± 13,0 года. Медиана периода с момента установления диагноза до проведения РИТ составила 45 [24; 60] мес. Большинство — 47 (98%) человек в качестве тиреостатических препаратов получали мерказолил, 1 (2%) больной — про- пицил. 3 (6%) пациентов были прооперированы ранее по поводу ДТЗ. Тиреотоксикоз тяжелого течения диагностирован у 5 (10,4%) больных, у остальных 43 (83,6%) был тиреотоксикоз средней степени тяжести.
Для определения степени захвата 131 1 ЩЖ пациенту назначалась диагностическая активность ,31 1 (5 мкКи) и измерялся процент накопления |3, 1 над поверхностью ЩЖ через 2, 4, 24, 48 и 72 ч.
Ультразвуковое исследование ЩЖ проводилось при помощи аппаратов Aloka SSD 500 или Toshiba 260 А с линейным датчиком 7,5 МГц. Объем ЩЖ (Г) рассчитывался по формуле J. Brunn (1981):
где Д, Ш, В — длина, ширина и высота соответственно правой (п) и левой (л) долей.
Гормоны крови (ТТГ, свободный Т4) исследовали в венозной крови натощак иммунохемилюми- несцентным методом с использованием набора Abbott (США) на автоматическом анализаторе ("Architex", США). Нормальные показатели ТТГ — 0,4—4,0 мкМЕ/мл, свободный Т4 — 10,3—24,5 пмоль/л.
За 10 дней до назначения ТА 131 1 тиреостатиче- ские препараты, которые получали пациенты, были отменены. ТА 131 1 представлял собой раствор йодида натрия, который больной принимал однократно перорально.
Статистический анализ данных проводился при помощи программ Statistica 6,0 и Biostat. Использовались критерии Фридмана для множественного сравнения результатов лечения, Крускала—Уоллиса и критерий Данна для множественных сравнений групп. Для сравнения качественных показателей применялся двусторонний вариант критерия Фишера. Для корреляционного анализа использовался расчет коэффициента ранговой корреляции Спирмена (г). Данные в тексте представлены в виде М ± SD (где М — среднее арифметическое, SD — среднеквадратичное отклонение) или Me [25; 75] (где Me — медиана, 25 и 75 — 1-й и 3-й квартили). Критический уровень значимости р 0,05.
Результаты и их обсуждение
Расчет терапевтической активности радиоактивного йода.
ТА рассчитывали по формуле, в которой учитывался объем ЩЖ, захват диагностической активности 131 1 по истечении 24 ч (Q и 4 коэффициента (Ял), с помощью которых врач мог дополнительно корректировать рассчитанную активность:
Та = МЛС/И1 • 100, (1)
где Ап — коэффициент, который может иметь одно из четырех значений (А, = 0,15; Л2 = 0,2; А3 = 0,25 и А4 = 0,3) и выбирается врачом в зависимости от определенных клинических показателей течения ДТЗ (см. ниже).
Для того чтобы предложенный расчет стал очевиден, необходимо обратить внимание на то, что в формулу (1) включена так называемая удельная функциональная активность ЩЖ (УА), т. е. процент захвата диагностической активности 131 1 на объем ЩЖ:
Следовательно, с учетом формулы (2) формула (1) преобразуется в вид
Таким образом, в нашем случае ТА, рассчитываемая по формуле (3), обратно пропорциональна УА: чем более активно функционирует ЩЖ, тем назначаемая ТА дозы ,3, 1 меньше. Логика, лежащая в основе такой зависимости, базируется на допущении, что чем более активно функционирует ЩЖ, тем быстрее она накапливает |3| 1, повреждающий тиреоидные клетки. Вместе с тем следует заметить, что на эффект лечения |3| 1 влияют и другие факторы, которые в вышеуказанной формуле игнорируются для простоты расчетов.
Формула (3) позволяет назначать в определенном смысле сопоставимые по повреждающему эффекту ТА 13| 1, так как учитывает функцию ЩЖ. В результате расчетная активность, которую получали наши больные, была в диапазоне 5,3—30,0 мКи (12,3 ± 5,6 мКи).
Поскольку УА вычисляется из отношения процента захвата диагностической активности 131 1 (Q и объема ЩЖ, то необходимо установить, не являются ли эти параметры взаимозависимыми, что и было нами сделано на примере группы обследованных больных с ДТЗ. Оказалось, что объем ЩЖ не коррелирует с захватом диагностической активности 131 1 (г = 0,16, р = 0,25) и поэтому нельзя исключить из формулы (1) и (3) один из этих параметров, как зависимый от другого. Это и понятно, так как небольшая по размерам ЩЖ может быть функционально очень активна и интенсивно захватывать для синтеза тиреоидных гормонов йод (в том числе и 131 1), а с другой стороны, функция ЩЖ больших размеров может быть, например, существенно подавлена тиреостатиками, что и выразится в низком захвате 131 1.
Вместе с тем ТА, полученная больным, очень сильно и обратно пропорционально коррелировала с УА (см. рисунок), что и следовало ожидать с учетом вида формулы (3).
Однако она оказалась не линейной, а параболической: в диапазоне низкого захвата диагностической активности ( < 1) и высокого (>4) наблюдается отчетливое отклонение от прямой вверх. Это означает, что при близких к максимальным и особенно минимальным значениям захвата 13| 1 больной получает несколько большую ТА 131 1, чем при средних значениях захвата.
Исходя из формулы (3), параболическая зависимость, скорее всего, связана с влиянием на ТА коэффициента Ап. Для проверки этого предположения формула (3) была нормирована — обе ее части разделены на Ап, т. е. она была приведена к виду:
Далее для каждого обследуемого значения левой и правой частей формулы (4) вычислили и проверили их взаимозависимость. Нормирование левой и правой частей формулы (3) по отношению к А„ (фактически удаление Ап из формулы) трансформировало зависимость ТА и УА из параболической в линейную, что и доказывает нелинейность воздействия коэффициента А„.
Выбор одного из четырех коэффициентов А„ зависел в определенной степени от объема ЩЖ — при очень больших объемах выбирается минимальная активность из-за риска сдавления органов шеи при выраженном лучевом тиреоидите после РИТ.
Вместе с тем, когда объем ЩЖ не превышает 40 мл, никакой зависимости между ее объемом и А„ нет (г = -0,03, р = 0,8). В этом случае выбор осуществляется только между значениями Ап, равными 0,25 и 0,3 мКи, которые оказываются практически случайными. А при объеме ЩЖ, превышающем 40 мл, выявлена отчетливая отрицательная зависимость между объемом ЩЖ и значениями А„ (г = -0,9, р = 0,0001), т. е. при объеме ЩЖ более 40 мл с его увеличением значение коэффициента, подставляемого в формулу (3), снижается.
Клиническая эффективность рассчитанной ТА ,3 Ч. В случае, когда не определяется поглощенная доза, клиническую эффективность РИТ можно оценивать в зависимости от активности |3| 1, которая приходится на единицу объема ЩЖ (в нашем случае на 1 мл). Таким образом, удельная ТА (УТА) рассчитывалась по формуле
Утл = ТдЛ = А/С (в мКи/мл). (5)
Как видно из табл. 1, чем больше был объем ЩЖ, тем меньшая Ута назначалась больному. Это связано с тем, что УТА в конечном счете зависит только от двух параметров - Ли С; см. формулу (5). При этом параметр С от объема ЩЖ не зависит, а коэффициент А находится по отношению к объему ЩЖ в обратной зависимости. Отсюда зависимость УТА определяется только параметром А, которую и отражает обратная зависимость Ута от объема ЩЖ.
Несмотря на то что больные с ббльшими объемами ЩЖ получают меньшую дозу радиоактивности, ее объем в процентном отношении сокращается заметно больше в 1-м случае, чем во 2-м, особенно в первые 1,5 мес. За счет этого статистически значимое различие в объеме ЩЖ между группами до лечения исчезает уже через 1,5 мес. Следовательно, можно полагать, что расчетная формула, которая использовалась радиологами в нашем исследовании, оптимально модулирует дозу радиоактивности в зависимости от объема ЩЖ. Следует заметить, что у 2 больных, получивших УТА 0,4—0,5 мКи/мл, через 1,5 мес после проведения РИТ объем ЩЖ был несколько больше, чем до проведения РИТ (на 6 и 3,8% соответственно). К 3-му месяцу после РИТ объем ЩЖ сократился у одной больной на 37%, а у второй оставался таким же, как и к 1,5 мес.
Уровень ТТГ до проведения РИТ у большинства больных (66,6%) был ниже нормы и не имел различий между группами (р > 0,05). Таким образом, несмотря на то, что больные находились перед РИТ в состоянии клинического эутиреоза, полной ремиссии заболевания не было достигнуто. После проведения РИТ уровень ТТГ возрастал и к 3 месяцу после проведения РИТ был заметно выше по сравнению с таковым, определявшимся как до, так и через 1,5 мес после лечения. Однако достоверные различия наблюдались только у больных, получивших УТА 0,3—0,4 и 0,4—0,5 мкИ/мл (т. е. в первом случае уровень ТТГ возрос от 0,05 до 6,2 мкМЕ/мл через 3 мес после РИТ, а во втором случае — от 0,03 до 13,4 мкМЕ/мл; р = 0,007 и р = 0,0001 соответственно). Таким образом, если ориентироваться на уровень ТТГ, то полного устранения тиреотоксикоза можно скорее ожидать у тех больных, которые получили Ута, превышающую 0,3 мКи/мл.
По уровню свободного Т4 как до, так и после проведения РИТ группы были идентичными (р > 0,05). При этом различий не наблюдалось и в пределах каждой из групп (р > 0,05). Отсутствие различий по уровню свободного Т4 как между группами, так и в пределах одной группы можно объяснить тем, что при изменении этого показателя (повышение, снижение) сразу же назначалась необходимая терапия (либо тиреостатиче- ская, либо заместительная) и уровень свободного Т4 поддерживался в пределах нормальных значений.
В связи с этим больные через 3 мес после назначения 13, 1 разделялись на 3 группы в зависимости от того, как у них поддерживалось состояние эутиреоза (табл. 2): 1-я — больные с сохраняющимся тиреотоксикозом, когда эутиреоз поддерживался только на фоне тиреостатической терапии; 2-я — больные с гипотиреозом, когда эутиреоз поддерживался тироксином, и 3-я — больные с эутиреозом, когда не требовалась ни тиреостатическая, ни заместительная терапия.
Таблица 1 .Динамика объема ЩЖ в зависимости от полученной Ута
Читайте также:
