Цистиноз у детей. Синдромы Лоу и Фанкони
Добавил пользователь Morpheus Обновлено: 27.01.2026
Цистиноз — это редкое заболевание, характеризующееся накоплением свободного цистина в лизосомах разных тканей организма. Это приводит к появлению кристаллов цистина в роговице, конъюнктиве, костном мозге, лимфатических узлах, лейкоцитах и внутренних органах. Известны три формы болезни: инфантильная (нефропатическая), обусловливающая развитие синдрома Фанкони и почечной недостаточности в течение первых 10 лет жизни, ювенильная (промежуточная), при которой поражение почек проявляется в течение второго 10-летия жизни, и взрослая (доброкачественная), характеризующаяся отложениями цистина в роговице, но не в почках.
Этиология и патогенез. Главный дефект при цистинозе заключается в нарушении оттока цистина из лизосом, а не в нарушении его распада. Этот отток представляет собой активный АТФ-зависимый процесс. При инфантильной форме содержание цистина в тканях может превышать норму более чем в 100 раз, а при взрослой форме — более чем в 30 раз. Внутриклеточный цистин локализуется в лизосомах и не обменивается с другими внутри- и внеклеточными пулами аминокислоты. Концентрация цистина в плазме и моче существенно не увеличивается.
Степень накопления кристаллов цистина у разных больных варьирует в зависимости от формы заболевания и способов обработки проб ткани. Накопление цистина в почках при инфантильной и ювенильной формах болезни сопровождается почечной недостаточностью. Почки становятся бледными и сморщенными, их капсула сливается с паренхимой, исчезает граница между корковым и мозговым слоем. При микроскопии обнаруживается нарушение целостности нефрона; клубочки гиалинизированы, прослойка соединительной ткани увеличена, нормальный эпителий канальцев замещен кубовидными клетками. Сужение и укорочение проксимальных канальцев обусловливает их деформацию в виде лебединой шеи, что характерно, но не патогномонично для цистиноза. При инфантильной и ювенильной формах болезни иногда отмечают очаговую депигментацию и дегенерацию периферических отделов сетчатки глаз. Кристаллы цистина могут откладываться также в конъюнктиве и сосудистой оболочке глаз.
Любая форма цистиноза наследуется, по-видимому, как аутосомный рецессивный признак. Облигатные гетерозиготы по внутриклеточному содержанию цистина занимают промежуточное положение между здоровыми и больными, но клинические симптомы у них отсутствуют.
Клинические проявления. При инфантильной форме болезни нарушения проявляются обычно в возрасте 4—6 мес. Рост ребенка задерживается, у него появляются рвота, лихорадочное состояние, присоединяются резистентный к витамину Dрахит, полиурия, дегидратация и метаболический ацидоз. Генерализованная дисфункция проксимальных канальцев (синдром Фанкони) приводит к гиперфосфатурии и гипофосфатемии, почечной глюкозурии, общей аминоацидурии, гипоурикемии и зачастую к гипокалиемии. На прогрессирование клубочковой недостаточности могут влиять пиелонефрит и интерстициальный фиброз. Смерть от уремии или случайной инфекции наступает обычно в возрасте до 10 лет. В течение нескольких первых лет жизни отмечается фотофобия из-за отложений цистина в роговице, еще раньше может проявиться дегенерация сетчатки.
В отличие от этого при взрослой форме болезни развивается лишь глазная патология. К основным симптомам относятся фотофобия, головная боль и чувство жжения или зуда в глазах. Функция клубочков и канальцев почек, а также целостность сетчатки сохраняются. Признаки ювенильной формы болезни занимают промежуточное положение между этими крайними формами. У этих больных в процесс вовлекаются как глаза, так и почки, но последние незначительно страдают до второго 10-летия жизни. Однако, хотя почки страдают меньше, чем при инфантильной форме болезни, больные умирают в конце концов именно от почечной недостаточности.
Диагностика. Цистиноз следует подозревать у любого ребенка с резистентным к витамину D рахитом, синдромом Фанкони или клубочковой недостаточностью. Гексагональные или прямоугольные кристаллы цистина можно обнаружить в роговице (при исследовании с помощью щелевой лампы), в лейкоцитах периферической крови или костного мозга или в биоптатах слизистой оболочки прямой кишки. Диагноз подтверждают путем количественного определения цистина в лейкоцитах периферической крови или в культуре фибробластов. Инфантильная форма болезни диагностируется пренатально по повышенному уровню цистина в культуре клеток амниотической жидкости.
Лечение. Взрослая форма протекает доброкачественно и не требует лечения. Симптоматическое лечение при болезни почек при инфантильной или ювенильной форме цистиноза не отличается от такового при других видах хронической почечной недостаточности: обеспечение адекватного потребления жидкости во избежание дегидратации, коррекция метаболического ацидоза и потребление дополнительных количеств кальция, фосфата и витамина D, что направлено на борьбу с рахитом. Эти мероприятия могут в течение определенного времени поддерживать рост, развитие и хорошее самочувствие больных детей. Предпринимались попытки использования двух видов более специфического лечения, но они не сопровождались большим успехом. Обедненная цистином диета не предотвращала прогрессирования почечной патологии. Точно так же применение сульфгидрильных реагентов (пеницилламин, димеркапрол) и восстановителей (витамин С) не сопровождалось долговременным эффектом.
Наиболее перспективным видом лечения нефропатического цистиноза служит пересадка почки. Этот метод был применен при лечении более чем 20 детей с последней стадией почечной недостаточности. У больных, перенесших операцию и избежавших иммунологических проблем, функция почки нормализовалась. В трансплантированных почках не развивались типичные для цистиноза функциональные нарушения (например, синдром Фанкони или клубочковая недостаточность). Однако в них иногда вновь накапливалось некоторое количество цистина, вероятно, из-за миграции интерстициальных или мезангиальных клеток организма-хозяина.
Анемия Фанкони ( Врожденная панмиелопатия Фанкони , Наследственная панмиелопатия )
Анемия Фанкони - это генетическое заболевание, которое передается по аутосомно-рецессивному типу и характеризуется нарушением кроветворения, формированием злокачественных новообразований, пороками развития, ломкостью хромосом. Проявляется частыми кровотечениями, кровоподтеками на коже, вялостью, бледностью, склонностью к инфекциям. Диагностика проводится лабораторными методами, назначаются цитогенетическое, молекулярно-генетическое и клиническое исследования крови, миелограмма. Основные способы лечения - пересадка костного мозга, медикаментозное поддержание кроветворения, переливание крови.
МКБ-10
Общие сведения
Синонимичные названия анемии Фанкони - врожденная панмиелопатия Фанкони, наследственная панмиелопатия. Заболевание названо по фамилии швейцарского педиатра Гвидо Фанкони, который в 1927 году описал врожденную апластическую патологию на основе симптомов у трех братьев. Анемия Фанкони является редкой генетической болезнью, наследуется согласно аутосомно-рецессивному принципу. Эпидемиологические показатели низкие - 1 больной ребенок на 350 тысяч новорожденных. Распространенность одинакова среди представителей женского и мужского пола, выше в сообществах с разрешенными близкородственными браками, например, у некоторых южноафриканских народов.
Причины
Заболевание является наследственным, развивается при передаче дефектного гена от родителей к ребенку. Выявлено 15 генов, мутации которых проявляются анемией Фанкони. Из них 14 расположены в аутосомах и являются рецессивными, 1 тип гена находится в X-хромосоме (сцепленной с полом). Все эти гены отвечают за производство определенного фермента, участвующего в репарации ДНК.
Аутосомно-рецессивное наследование подразумевает, что и отец, и мать должны быть носителями патологической генетической информации. При этом сами они, как правило, здоровы. Вероятность рождения больного ребенка в такой паре составляет 25%. Генетическая панмиелопатия диагностируется у детей и взрослых, получивших от каждого из родителей один и тот же измененный ген. В крайне редких случаях анемия провоцируется передачей дефектной Х-сцепленной хромосомы. Женщины могут быть носительницами мутации, заболевание проявляется только у мальчиков. Риск развития патологии у сына при наличии у матери мутированного гена - 50%.
Патогенез
В норме в клетках организма существуют специальные ферментные системы, которые исправляют разрывы молекул ДНК, поврежденных в процессе биосинтеза или воздействия химических, физических реагентов. При анемии Фанкони обнаруживается генетический дефект в кластере белков, ответственных за репарацию ДНК, что приводит к повышенной ломкости хромосом. В итоге у пациентов развиваются нарушения функций костного мозга - неоплазии и апластическая анемия. Онкологические заболевания чаще всего представлены острым миелоидным лейкозом - злокачественной опухолью миелоидного ростка крови, провоцирующей накопление измененных белых клеток, подавляющих рост эритроцитов, тромбоцитов и нормальных лейкоцитов. При апластической анемии в результате дисплазии костного мозга резко угнетается рост и созревание всех трех видов клеток крови.
Симптомы анемии Фанкони
Более чем у половины пациентов наблюдаются врожденные аномалии развития внутренних органов и скелета. Костные деформации проявляются специфическим внешним видом: больные низкорослые, с уменьшенным размером головы, отсутствием или заметным укорочением большого пальца на руках, недоразвитием лучевой кости, врожденным вывихом бедра и/или наличием шейного ребра, косолапостью, недоразвитым подбородком («птичьим лицом»). Характерна гиперпигментация кожи в виде светлых и коричневатых пятен.
Неврологические расстройства представлены косоглазием, недоразвитием одного или двух глаз, опущением верхнего века, глазным дрожанием, глухотой, умственной отсталостью. Больные зачастую имеют незрелые половые органы, у них отсутствует одно или оба яичка. К распространенным аномалиям строения органов относятся пороки мочевыделительной системы: удвоение мочеточников или лоханки, подковообразные почки, почечные кисты, смещенное наружное отверстие уретры (гипоспадия). Врожденные пороки сердца включают атрезию трехстворчатого клапана, дефект межпредсердной перегородки, митральный стеноз, дефект межжелудочковой перегородки. Пациенты страдают от почечной и сердечной недостаточности.
Ключевые симптомы связаны с постепенным нарастанием нарушений в работе костного мозга. Чаще они дебютируют в детском возрасте (в 5-10 лет). Из-за снижения количества тромбоцитов развивается повышенная кровоточивость: при ранениях кровь долго не сворачивается, легко возникают носовые кровотечения, выделения при менструациях обильны, на теле обнаруживается много «беспричинных» кровоподтеков. Уменьшение числа эритроцитов проявляется анемией с характерной слабостью, быстрой утомляемостью, головокружениями, обмороками, бледностью кожи, учащенным сердцебиением и одышкой. Недостаток лейкоцитов способствует ухудшению сопротивляемости инфекциям. Впоследствии формируется лейкоз, миелодиспластический синдром, онкологические болезни.
Осложнения
Наиболее распространенным осложнением считаются частые инфекционные заболевания. У пациентов развивается ОРВИ, ангина, ринит, бронхит, грипп, тиф, герпес. Рецидивирующий характер болезней и их тяжелое течение приводят к деструкции органов, сопровождаются риском сепсиса. Другим осложнением наследственной анемии являются злокачественные новообразования - лейкемия, эпителиальные опухоли органов шеи и головы, половых органов. Рак у таких больных тяжело поддается лечению из-за повышенной ломкости и сниженной репарации ДНК. Это явление ограничивает применение лучевой терапии, цитотоксических препаратов. Нарушение свертываемости становится причиной больших кровопотерь.
Диагностика
Обследование больных проводят онкологи, гематологи, педиатры, врачи-генетики. Диагностика начинается с анализа анамнестических данных и жалоб. Врач выясняет, имеется ли данное наследственное заболевание у близких родственников, уточняет время появления первых признаков болезни, ранние обращения к врачам. При осмотре оценивает общее состояние пациента, выявляет наличие аномалий развития, гиперпигментированных пятен, кровотечений, кровоподтеков. В большинстве случаев не составляет труда обнаружить типичные деформации костей, недоразвитие глаз. Для подтверждения диагноза и различения анемии Фанкони с приобретенной анапластической анемией проводится ряд лабораторных исследований:
- Клинический анализ крови. Характерны изменения клеточного состава крови. На ранних этапах нарушения кроветворения диагностируется тромбоцитопения и лейкопения, на более поздних - панцитопения (резкое снижение объема эритроцитов, лейкоцитов и тромбоцитов). Возможен умеренный гемолиз без гипербилирубинемии, но с ретикулоцитозом. Значение СОЭ увеличено до 60-80 мм/ч.
- Цитогенетическое исследование клеток. Выполняется проба с диэпоксибутаном, митомицином C, указывающая на частоту и спектр хромосомных аберраций. В пользу генетической анемии рассматриваются показатели ДЭБ-теста более 45%, пограничный уровень - 11-45% (процент клеток с хромосомными разрывами).
- Молекулярно-генетический анализ. Исследуются гены, мутации в которых могут привести к развитию заболевания. В 60-70% случаев мутации обнаруживаются в паре генов FANCA, в 14% - в аллели FANCC, в 10% - в генах FANCG. Частота мутаций в других парах - 0,2-3%.
- Миелограмма. По данным исследования определяется увеличение количества плазматических клеток и макрофагов, фагоцитирующих жиры. Содержание недифференцированных клеток - в пределах нормы. Снижена концентрация клеток миелоцитарного ростка, увеличен показатель лимфоцитов.
Лечение анемии Фанкони
Основная терапия направлена на восстановление процесса кроветворения. Методы лечения подбираются индивидуально, зависят от тяжести заболевания, возраста пациента, наличия и выраженности врожденных аномалий. Дополнительно проводится лечение инфекций и онкопатологий, осуществляются реабилитационные мероприятия. Для устранения анемии используются следующие методы:
- ТКМ.Трансплантация костного мозга является наиболее эффективной в долгосрочной перспективе, но имеет противопоказания, нередко сопровождается развитием осложнений. Оптимальный возраст для проведения операции - до десяти лет. Донорами могут выступать здоровые сестра и братья, подходящие по критериям совместимости. Предварительная интенсивная терапия (кондиционирование) связана с риском токсического воздействия на органы. После трансплантации сохраняется высокая вероятность острого или хронического иммунного конфликта между клетками донора и реципиента.
- Медикаментозная стимуляция кроветворения. При невозможности проведения трансплантации пациентам показано консервативное лечение, временно улучшающее их состояние. Выработка кровяных клеток стимулируется андрогенами (мужскими половыми гормонами) и гематопоэтическими факторами роста - эритропоэтином, фактором стволовых клеток, интерлейкинами-1-12. Параллельно применяются иммунодепрессанты. Медикаментозная терапия способна на протяжении многих лет поддерживать высокое качество жизни больных, но ее эффективность постепенно снижается.
- Переливание компонентов крови. При выраженных побочных эффектах или противопоказаниях к этиотропной терапии (трансплантации, стимуляции кроветворения) назначаются процедуры гемотрансфузии. Переливаются отмытые эритроциты - донорские красные кровяные тельца, освобожденные от поверхностных белков. При кровотечениях и снижении уровня тромбоцитов пациентам вводится тромбоцитарная масса.
Прогноз и профилактика
Продолжительность жизни больных определяется степенью нарушения функции костного мозга. Иногда пациенты доживают до 40 лет без лечения, но нередко умирают в детстве от тяжелой анемии или онкологических заболеваний. Прогноз наиболее благоприятен при своевременном проведении аллогенной трансплантации костного мозга, после которой есть шанс полного восстановления нормального кроветворения и увеличения срока жизни. Поскольку заболевание генетическое, предотвратить его развитие невозможно. Профилактика сводится к медико-генетической консультации супружеских пар из групп риска, планирующих беременность, а также к проведению пренатальной диагностики патологии, в ходе которой из пуповинной вены плода производится забор крови и выполняется ДЭБ-тест. При его положительном результате рассматривается вопрос о прерывании беременности.
1. Генетическая диагностика анемии Фанкони. Обзор литературы/ Панферова А.В. Тимофеева Н.М. Ольшанская Ю.В.// Онкогематология. - 2016.
3. Свободнорадикальный статус клеток крови и костного мозга у детей с острыми лейкозами и анемией Фанкони: Автореферат диссертации/ Чивилева И.Ю. - 1996.v
Нефронофтиз Фанкони
Нефронофтиз Фанкони - наследственное заболевание почек, характеризующееся поражением эпителия дистальных канальцев и петли нефрона, что приводит к нарушению выделительных функций и многочисленным вторичным патологиям. Симптомами этого состояния являются полиурия гипотонического характера, гипохромная анемия, поражения скелета, на терминальных этапах развивается азотемия. Диагностика нефронофтиза Фанкони включает в себя ультразвуковое исследование почек, анализы крови и мочи, молекулярно-генетические методы определения. Специфического лечения данного состояния не существует, используют паллиативную терапию, показана трансплантация почек.
Нефронофтиз Фанкони (нефронофтиз 1-го типа, ювенильный нефронофтиз) - генетическое заболевание, которое поражает почки (петли нефронов и дистальные канальцы) с развитием прогрессирующего нарушения выделительной функции данных органов. Впервые эта патология была описана в 1951-м году швейцарским педиатром Фанкони, после этого за все время наблюдений было выявлено несколько сотен случаев подобного состояния. Таким образом, нефронофтиз Фанкони является достаточно редким заболеванием, его встречаемость не определена. Кроме того, поражение почек, абсолютно идентичное данной патологии, встречается при ряде других генетических заболеваний - таких как синдром Жубера или синдром Сеньора-Локена 1-го типа. Однако при этих состояниях нарушения со стороны почек сочетаются с расстройствами функций других органов и систем (сетчаткой глаза, легких и пр.) - как удалось выяснить врачам-генетикам, схожесть патологий обусловлена тем, что их причиной выступают различные мутации одного и того же гена. Механизм наследования нефронофтиза Фанкони аутосомно-рецессивный, болезнь с одинаковой частотой встречается у мальчиков и у девочек. По разным оценкам, это заболевание является причиной 2-10% от всех случаев хронической почечной недостаточности в детском возрасте.
Причины нефронофтиза Фанкони
Нефронофтиз Фанкони обусловлен мутацией гена NPHP1, располагающегося на 2-й хромосоме. Продуктом экспрессии данного гена является особый белок под названием нефроцистин-1, функции которого в настоящее время остаются предметом бурных дискуссий. Согласно наиболее распространенной точке зрения, нефроцистин-1 входит в состав ресничек многих клеток - эпителия петель и канальцев почек и легких, содержится в сетчатой оболочке глаза и ряде других органов. В результате мутации NPHP1 нарушается структура данного протеина, что пагубно отражается на работе ресничек клетки, поэтому такие функции, как всасывание жидкости и растворов солей, а также активный транспорт различных ионов значительно нарушаются. Было установлено, что нефроцистин-1 способен связывать ряд других белков и ферментов, изменение его структуры, возможно, нарушает и эти процессы, приводя к развитию нефронофтиза Фанкони, синдромам Жубер или Сеньора-Локена.
По причине малоизученности функций белка нефроцистин-1 патогенез нефронофтиза Фанкони (как и других наследственных патологий, обусловленных дефектами гена NPHP1) также не совсем ясен. В частности, неизвестно, что больше нарушает процессы транспорта ионов и воды и образования мочи при этой патологии - изменение активности ресничек или неспособность нефроцистина-1 присоединять к себе другие белковые молекулы. Только начинает изучаться вопрос, какие мутации приводят к изолированному нефронофтизу Фанкони, а какие - к комплексным нарушениям. Достоверно известно, что первичными аномалиями при этом состоянии являются изменения в петлях нефрона и дистальных канальцах почек, все остальные симптомы (гипокальциемия, анемия, пороки развития скелета) считаются вторичными.
В результате дефекта гена NPHP1 в петлях нефрона и дистальных канальцах нарушаются процессы реабсорбции воды и неорганических солей, что приводит к увеличению объема образуемой мочи. По причине полиурии организм теряет огромное количество кальция и других ионов, что вызывает ответную реакцию паращитовидных желез (вторичный гиперпаратиреоз), гормон которых начинает вымывать кальций и фосфор из костной ткани. Элементы скелета становятся хрупкими, в них развиваются рахитоподобные изменения, которые очень часто составляют часть клинической картины нефронофтиза Фанкони. Патологические процессы затрагивают и юкстагломерулярный аппарат, в результате чего у больных развивается гипохромная анемия. Со временем нефронофтиз Фанкони приводит к прогрессирующей хронической почечной недостаточности, которая проявляется азотемией и другими сопутствующими нарушениями.
Симптомы нефронофтиза Фанкони
В большинстве случаев нефронофтиз Фанкони никак себя не проявляет в первые годы жизни ребенка, первые симптомы могут возникать в возрасте 2-3-х лет - наблюдаются полиурия и никтурия (увеличение доли ночного диуреза), в результате потери жидкости часто регистрируется жажда (полидипсия). Эти проявления выражены слабо и могут сохраняться на протяжении нескольких лет. Ухудшение при нефронофтизе Фанкони отмечается в возрасте 6-10 лет, когда вышеперечисленные симптомы становятся более выраженными и к ним присоединяются рахитоподобные изменения скелета, иногда - судороги, становится заметным отставание ребенка в физическом развитии. Часто обнаруживаются анемические проявления: бледность, тахикардия, головокружения и ряд других.
В дальнейшем при нефронофтизе Фанкони начинают нарастать признаки почечной недостаточности по тубулярному типу. По мере увеличения задержки азотистых продуктов обмена веществ в организме усиливается запах аммиака изо рта и от тела, развивается вторичный гиперпаратиреоз, обусловленный потерей значительного количества солей (в особенности, ионов кальция) с мочой. Все более выраженными становятся полиурия, полидипсия и другие нарушения работы почек. В конечном итоге нефронофтиз Фанкони приводит к тяжелой почечной недостаточности, требующей регулярного гемодиализа или трансплантации донорской почки. Иногда это состояние сочетается с врожденной глазодвигательной апраксией Когана, проявляющейся невозможностью движений глаз в горизонтальной плоскости у детей младше 2-3 лет.
Диагностика нефронофтиза Фанкони
Для определения нефронофтиза Фанкони применяют общие и биохимические анализы крови и мочи, ультразвуковое исследование почек, изучение наследственного анамнеза больного, молекулярно-генетические методы диагностики. Большое количество важной в диагностическом отношении информации дают такие методы, как определение клиренса эндогенного креатинина (проба Реберга), экскреторная урография, компьютерная томография почек с контрастом. При нефронофтизе Фанкони у больных выявляют увеличение суточного диуреза (что может быть установлено в ходе анализа мочи по Зимницкому), при этом плотность мочи снижена и в большинстве случаев равняется осмолярности плазмы крови (изостенурия). Из других показателей общего анализа мочи чаще всего регистрируют незначительную протеинурию (не более 1 г/сут), иногда возможна микрогематурия. На фоне этого у больных нефронофтизом Фанкони регистрируется сильная жажда, обусловленная потерей значительного объема жидкости.
Картина крови при нефронофтизе Фанкони включает в себя гипохромную анемию, гипокальциемию и значительное снижение концентрации других неорганических ионов, что является следствием так называемого сольтеряющего синдрома. Клиренс эндогенного креатинина неуклонно снижается по мере развития заболевания. На УЗИ почек у больных нефронофтизом Фанкони в начальной стадии наблюдается нарушение дифференцировки и разграничения коркового и мозгового вещества, в последнем возможно образование кист диаметром 2-8 миллиметров. В дальнейшем почки несколько уменьшаются в размерах, в них можно выявить признаки интерстициального фиброза.
При изучении наследственного анамнеза больного нередко обнаруживаются схожие клинические проявления у родственников, благодаря этому можно доказать аутосомно-рецессивный характер наследования. Генетическая диагностика нефронофтиза Фанкони производится методом прямого секвенирования гена NPHP1 для выявления мутаций (как правило, делеций или точечных). Кроме того, эта методика помогает дифференцировать заболевание от других комплексных синдромов, также обусловленных дефектами данного гена (например, синдрома Жубера). Методы современной генетики способны выявить скрытое носительство дефектного гена NPHP1, что может использоваться в рамках медико-генетического консультирования семьи перед зачатием ребенка.
Лечение и прогноз нефронофтиза Фанкони
Специфического лечения нефронофтиза Фанкони не существует, любые поддерживающие меры неспособны значительно увеличить выживаемость пациентов - как правило, эта патология приводит к тяжелой почечной недостаточности в возрасте до 20-ти лет. Единственным эффективным методом лечения заболевания является трансплантация почки, причем произведенная как можно раньше, до появления значительных необратимых вторичных нарушений. До момента проведения операции производят симптоматическое лечение нефронофтиза Фанкони, включающее солесодержащие растворы, обильное питье, препараты кальция. Для устранения анемии необходимо использовать экзогенные эритропоэтины - например, эритропоэтин-альфа. Если нефронофтиз Фанкони стал причиной почечной недостаточности, назначают гемодиализ, особую диету и сбалансированный водно-солевой режим.
Прогноз заболевания зависит от перспектив проведения трансплантации почки - при невозможности этой операции исход неблагоприятен, большинство больных умирает до 20-ти лет от нарастающей почечной недостаточности. Поддерживающая и симптоматическая терапия, а также использование гемодиализа, по мнению большинства специалистов, способны увеличить продолжительность жизни больного еще на несколько лет. Однако дать шанс на жизнь пациенту с нефронофтизом Фанкони способна только трансплантация почки. При принятии решения об операции оценивается множество факторов: общее состояние организма больного, наличие и выраженность вторичных нарушений, сопутствующие заболевания. После проведенной пересадки патологические изменения в донорской почке, аналогичные нефронофтизу Фанкони, не развиваются.
Цистиноз
Цистиноз - это наследственное заболевание, относящееся к группе лизосомных болезней накопления и характеризующееся нарушениями метаболизма аминокислоты цистина, что приводит к формированию его кристаллов в клетках различных органов. Выраженность симптомов этого заболевания зависит от формы патологии, основными проявлениями являются признаки метаболических расстройств (рвота, полиурия), рахит, резистентный к назначению витамина D, нарушение работы почек, патология зрения. Диагностика цистиноза производится на основании данных биохимического анализа крови, определения уровня цистина в различных тканях, офтальмологического исследования, молекулярно-генетических анализов. Лечение цистиноза производится средствами, улучшающими метаболизм данной аминокислоты, также применяют симптоматические мероприятия, в тяжелых случаях назначают трансплантацию почек.
Цистиноз - аутосомно-рецессивное наследственное заболевание, характеризующееся нарушением метаболизма аминокислоты цистина с развитием ее накопления и нарушением работы многих органов. Впервые подобное заболевание было описано еще в 1903-м году швейцарским врачом и биохимиком Е. Абдергальденом, который также указал на его наследственную природу. Некоторое время цистиноз отожествляли с синдромом де Тони-Дебре-Фанкони (или просто синдром Фанкони), но дальнейшие исследования показали, что этиология этих состояний различна. Их объединяет между собой поражение почечных канальцев, что влечет за собой схожие нарушения, но причина повреждения почек в этом случае различна.
Встречаемость цистиноза составляет примерно 1 случай на 200 000 населения, существует несколько клинических типов этого заболевания, все они наследуются по аутосомно-рецессивному механизму. Половое распределение этого заболевания не имеет каких-либо особенностей. Цистиноз является одним из немногих генетических патологий, в отношении которой возможно специфическое лечение, однако при этом важна своевременная диагностика этого заболевания, чтобы избежать необратимого поражения внутренних органов (главным образом, почек).
Причины цистиноза
Как показывают исследования последних лет, основной причиной цистиноза являются мутации в гене CTNS, расположенном на 17-й хромосоме, всего при этом заболевании выявлено свыше ста различных дефектов гена. Продуктом экспрессии CTNS является трансмембранный белок цистинозин, расположенный в лизосомах практически всех клеток организма, его единственной функцией является транспорт цистина из лизосом, где он образуется в результате гидролиза белков, в цитоплазму клетки.
Мутации гена CTNS приводят к изменению конформации или даже отсутствию этого белка, в результате чего происходит постепенное накопление аминокислоты в лизосомах, что и вызывает развитие цистиноза. Цистин плохо растворяется в воде, поэтому при увеличении его концентрации он формирует кристаллы, хорошо заметные при микроскопии или даже невооруженным взглядом (например, в роговице).
Тип мутации гена CTNS имеет большое влияние на клиническое течение цистиноза и прогноз этого заболевания. Так, при гомозиготной нонсенс-мутации образование цистинозина в организме больных совершенно не происходит, что приводит к тяжелым проявлениям заболевания начиная с раннего детства (ранняя инфантильная форма).
Другие виды цистиноза (детская и взрослые типы) наблюдаются, как правило у больных, являющихся компауд-гетерозиготами - одна аллель гена CTNS поражена нонсенс, а другая - миссенс мутацией, которая просто изменяет конформацию цистинозина, снижая его активность. Многие врачи-генетики отмечают, что при наличии в обеих аллелях CTNS миссенс-мутаций не приводит к развитию цистиноза, но при лабораторных исследованиях можно выявить незначительное увеличение концентрации цистина в тканях.
Классификация
В настоящий момент выделяют три основные клинические формы цистиноза :
- раннюю инфантильную;
- ювенильную (промежуточную);
- взрослую (доброкачественную).
Причины развития той или иной разновидности заболевания лежат в молекулярно-генетических аспектах данной патологии - типе мутации гена CTNS. Отличия в клиническом течении различных форм цистиноза затрагивают возраст развития заболевания, тяжесть симптомов, дальнейший прогноз и выбор тактики лечения.
Симптомы цистиноза
Инфантильная форма
Является наиболее распространенной разновидностью патологии, обуславливающей до 95% всех случаев заболевания. Проявления метаболических нарушений при этом развиваются уже в возрасте 4-7-ми месяцев - возникает рвота, диспептические расстройства, ребенок часто становится беспокойным, плохо спит, у него наблюдается жажда и полиурия. Больные данной формой цистиноза отстают в физическом развитии от сверстников, у них также возникают симптомы рахита (нарушения зарастания родничков на черепе, деформации костей конечностей, искривление позвоночника).
Назначение традиционных доз витамина D и препаратов кальция и фосфора при этом не приводит к заметному улучшению состояния больных. У детей также отмечается светобоязнь, рези и зуд глаз, роговица может быть отечной. Как правило, при такой форме цистиноза к 7-10 годам у больных развивается хроническая почечная недостаточность и сахарный диабет, осложнения которых и являются причиной летального исхода. В некоторых случаях может развиваться слепота, обусловленная помутнением роговицы и дегенерацией сетчатки.
Ювенильная форма
Характеризуется намного более благоприятным течением. В раннем детстве никаких проявлений этого заболевания не отмечаются, первые симптомы возникают у детей старше 10-ти лет. Основные проявления цистиноза такого типа тождественны инфантильной форме, однако поражение роговицы, почек и поджелудочной железы развивается намного медленнее, что приводит к меньшей выраженности симптомов и, иногда, к более поздней диагностике.
Взрослая форма
Является довольно редкой, но ряд специалистов связывают это обстоятельство с малой выраженностью симптомов и, как следствие, частой неправильной диагностикой этого состояния. Этот тип заболевания характеризуется накоплением клинически значимых количеств цистина в тканях роговицы глаза, что приводит к светобоязни, болезненности и другим офтальмологическим симптомам. При лабораторных исследованиях могут выявляться незначительные отложения кристаллов цистина и в других тканях, однако к типичной клинической картине цистиноза с поражением почек и иных органов это не приводит.
Отложения цистина в различных органах приводит к развитию их дисфункции - наиболее часто этот явление регистрируется в почках, роговице глаз, кишечнике, лимфатических узлах, поджелудочной железе, печени. При тяжелом течении цистиноза отложения аминокислоты в эпителии канальцев со временем вызывает нарушение реабсорбции некоторых ионов и низкомолекулярных соединений - калия, кальция, фосфат-ионов, глюкозы, карнитина и ряда других. Это приводит к развитию полиурии, обезвоживанию организма, рахиту по причине потери кальция и фосфора, нарушению кислотно-основного равновесия крови.
При дальнейшем течении цистиноза развивается клубочковая недостаточность почек и интерстициальный нефроз, что влечет за собой уремию и другие осложнения. Отложения цистина в тканях глаза может привести к дегенерации сетчатки, светобоязни, воспалительным проявлениям. Как правило, отложения данной аминокислоты при цистинозе в других органах также выявляется лабораторными исследованиями, но при этом не приводит к заметным и выраженным клиническим проявлениям. Исключением является только поджелудочная железа - при длительном течении заболевания отложения цистина в ней могут стать причиной развития сахарного диабета.
Постановку диагноза производят при помощи общего осмотра больного, на основании результатов биохимических анализов крови и мочи, офтальмологического обследования, молекулярно-генетических исследований:
- Гистологическое и гистохимическое исследование. Микроскопическое изучение некоторых тканей организма (биоптатов печени, почек, костного мозга) выявляет внутри клеток данных органов плоские кристаллы шестиугольной формы, обладающие двойным светопреломлением. Биохимические пробы подтверждают, что в состав этих внутриклеточных включений входит аминокислота цистин.
- Биохимические анализы крови. При инфантильной и манифестирующей детской формах цистиноза в крови наблюдается резкое снижение уровня неорганических ионов - калия, кальция, хлора, фосфора. Определяется гипопротеинемия, возможна компенсаторная гиперлипидемия, анемия по причине недостатка белков и нарушения работы почек.
- Биохимические пробы мочи. В анализах мочи выявляется значительное увеличение концентрации низкомолекулярных соединений и белков, что приводит к глюкозурии, гиперфосфатурии, гиперпротеинурии. Суточный диурез резко увеличивается на фоне снижения плотности мочи. Иногда, на фоне проводимого лечения цистиноза и уменьшения основных проявлений заболевания, достаточно резко возникает полиурия и полидипсия - часто это свидетельствует о присоединении сахарного диабета. Увеличение в биохимическом анализе крови уровня азотистых соединений (например, мочевины) говорит о нарастающей почечной недостаточности и уремии.
- Офтальмологическое обследование. Производятся осмотр глазного дна и роговицы при помощи щелевой лампы - в роговице при этом могут определяться продолговатые кристаллы цистина.
- Молекулярно-генетическая диагностика. Производится прямого секвенирования гена CTNS с целью выявления мутаций. При этом возможно также выявление носительства патологического гена и определения типа его мутации, что также влияет на прогноз заболевания.
- Дородовая диагностика.Пренатальная диагностика цистиноза возможна посредством генетических или биохимических (определение уровня цистина в клетках ворсин хориона) методик.
Лечение цистиноза
Специфическая терапия
Лечение цистиноза производится как специфическими, так и поддерживающими препаратами. Практически единственным средством, способным значительно улучшать состояние больных является цистеамин, который облегчает выход цистина из лизосом в цитоплазму клеток, где он включается в общий метаболизм. Это уменьшает степень накопления данной аминокислоты и способствует снижению выраженности проявлений цистиноза.
Так, при своевременном назначении цистеамина в случае инфантильной формы заболевания, развитие уремии замедляется примерно в два раза, а жизнь больных увеличивается до 20-23-х лет. Намного более выраженный эффект от приема этого средства наблюдается при промежуточной форме цистиноза - больные этим заболеванием могут доживать до преклонного возраста. Используется цистеамин и при офтальмологических нарушениях, сопровождающих доброкачественную или взрослую форму заболевания - в этом случае необходимость в системном приеме препарата нет, применяют только закапывание его раствора в глаза.
Неспецифическая терапия
Поддерживающее и симптоматическое лечение при цистинозе инфантильного и промежуточного типов сводится к приему больших доз витамина D, строжайшему соблюдению правильного питьевого режима, компенсации электролитов и белков, теряющихся с мочой. Также назначается высоко витаминизированная диета, прием препаратов карнитина, который также выводится через почки.
В случае развития уремии и почечной недостаточности применяют традиционный гемодиализ. Возможна также трансплантация почки, что значительно улучшает состояние больного и способствует заметному увеличению продолжительности жизни при инфантильном цистинозе. В случае развития сахарного диабета разрабатывается специальная низкоуглеводная диета и назначаются гипогликемические препараты.
Прогноз цистиноза зависит от формы и типа этого состояния - так при, инфантильной разновидности патологии перспективы заболевания часто неблагоприятные. Больные без своевременного лечения умирают в возрасте 7-12-ти лет из-за явлений уремии и других сопутствующих нарушений, применение цистамина и гемодиализа может увеличить этот показатель до 20-23-х лет. Лишь трансплантация почки может значительно улучшить прогноз этой формы цистиноза. Доброкачественная же разновидность заболевания характеризуется благоприятным прогнозом.
Профилактика цистиноза возможна только в качестве выявления носительства мутантной формы гена CTNS и при его наличии у обоих родителей - медико-генетического консультирования перед зачатием ребенка. Возможна также пренатальная диагностика посредством амниоцентеза с последующим генетическим и биохимическим исследованием.
Нефропатический цистиноз. Как распознать и вести пациентов.
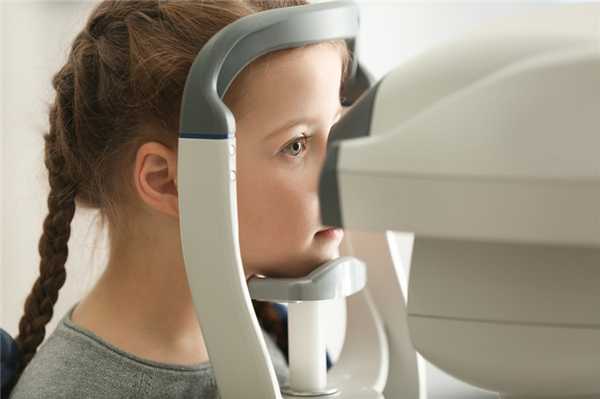
Цистиноз. Недооцененная проблема детской нефрологии.

Алексей Николаевич Цыгин, специалист по цистинозу,
Национальный научно-практический
центр здоровья детей, Москва
В списке орфанных заболеваний немного болезней с преимущественным поражением почек и цистиноз есть среди них. Долгие годы цистиноз, как диагноз в нашей стране не устанавливался из-за недостатка информированности врачей и несовершенной диагностической базы. В настоящее время эту тенденцию удалось переломить и в общей сложности диагноз цистиноз был установлен более, чем у двух десятков детей. Данная цифра по-прежнему ниже ожидаемой на основании мировых эпидемиологических данных, утверждающих что распространенность цистиноза достигает 1:200 000.
От того, насколько рано будет распознана болезнь цистиноз, зависит своевременность и эффективность коррекции тяжелых водно-электролитных расстройств и нарушений костно-минерального метаболизма, свойственных заболеванию, а также своевременность назначения цистеамина битартрата, единственного препарата, способного корригировать нарушение транспорта цистина.
Цистиноз - аутосомно-рецессивное генетическое заболевание, связанное с мутацией гена CTNS, приводящей к избыточному накоплению цистина, нормальной аминокислоты в лизосомах различных клеток, что приводит к их повреждению. Наиболее типично поражение клеток почечных канальцев, эндокринной и нервно-мышечной систем, роговицы глаза.
Цистиноз. Проявления.
Первые проявления болезни регистрируются обычно в 6-месячном возрасте в виде формирования синдрома ДеТони-Дебре-Фанкони - генерализованной дисфункции проксимальных почечных канальцев. В первую очередь обращают на себя внимание полиурия, мышечная слабость, анорексия и задержка роста и моторных навыков. Лабораторное исследование демонстрирует основные составляющие синдрома Де Тони-Дебре-Фанкони:
· Метаболический ацидоза счет потери бикарбоната с мочой
· Полиурия с возможным обезвоживанием
Длительная персистенция гипофосфатемии и метаболического ацидоза вызывают резорбцию костной ткани с развитием рахита, резистентного к обычным дозам витамина D.
Фенотипической особенностью больных цистинозом часто являются светлые кожа и волосы и голубые глаза.
Пациенты требуют интенсивного возмещения потерь воды, калия, фосфата и бикарбоната, а также применения гидроксилированных форм препаратов витамина D. Для коррекции гипотиреоза обычно назначается тироксин, для улучшения мышечного метаболизма - карнитин. Необходима интенсивная нутритивная поддержка, иногда с применением назогастрального зонда или гастростомы.
В результате отложения кристаллов цистина в роговице, визуализировать которые с помощью щелевой лампы можно к 1,5 годам, в последующем развивается специфический кератоконъюнктивит с фотофобией, без лечения способный привести к потере зрения. Офтальмологическое исследование больных с синдромом ДеТони-Дебре-Фанкони является важным диагностическим инструментом подтверждения цистиноза.
Уточнение диагноза возможно с помощью молекулярно-генетического исследования и определения концентрации цистина в лейкоцитах периферической крови, проводящихся в нашей клинике.
Не показательны для диагностики цистиноза определение цистина в моче и нефробиопсия.

Профессор Цыгин с маленькими пациентами
Цистиноз. Лечение.
Единственным препаратом, способствующим выведению цистина из лизосом является цистеамина битартрат. Он способствует существенному замедлению почечного повреждения и улучшению роста и развития больных, не устраняя, однако, проявлений синдрома Де Тони-Дебре-Фанкони. Местное лечение глазных поражений успешно осуществляется с помощью глазных капель или геля цистеамина гидрохлорида.
У больных цистинозом не отмечается возврата первичного заболевания в трансплантат и выживаемость его выше, чем при других причинах ХПН. Вместе с тем после трансплантации сохраняются системные проявления болезни, что требует продолжения терапии цистеамином.
В заключение хочется еще раз привлечь внимание педиатров к выявлению больных цистинозом путем раннего распознавания синдрома Де Тони-Дебре-Фанкони, кристаллов в роговице, нарушения почечной функции и прочих симптомов. Показано направление пациентов в специализированную нефрологическую клинику. С учетом имеющегося опыта и диагностических возможностей, Национальный научно-практический центр здоровья детей осуществляет функции базового учреждения в диагностике и лечении цистиноза.
Читайте также:
- Барий. Водорастворимое контрастное вещество. Анализы крови в абдоминальной хирургии.
- Синдром Гольтца-Горлина (Goltz-Gorlin)
- Топография сосудов и нервов в дельтовидной области. Топография сосудисто-нервного пучка в дельтовидной области.
- Синдром Савилла (Savill)
- Пример множественного рака толстой кишки. Метахронный рак толстой кишки
