Цитокиновый шторм - причины, симптомы, диагностика и лечение
Добавил пользователь Alex Обновлено: 21.01.2026
Воспаление — это важный защитный механизм, предусмотренный природой и обеспечивающий иммунный ответ на внедрение вируса. Он необходим для удаления микроорганизма и поврежденных им клеток.
Успешное излечение от инфекционных заболеваний без воспаления невозможно!
Воспаление при COVID-19 включает несколько чередующихся этапов:
концентрацию вокруг места его внедрения специфических иммунных клеток;
удаление его остатков, а также разрушенных клеток и тканей;
восстановление кровотоков и нормальной работы органа.
Как говорил средневековый врач и философ Парацельс о лечении: «Все — яд, все — лекарство; то и другое определяет доза», так и воспаление может быть во благо, а может принести непоправимый вред.
Хорошо, когда иммунная система больного адекватно отвечает на COVID-19 инфекцию. В таких случаях заболевание протекает в легкой форме (в 80% случаев) или средней тяжести (в 15% случаев). Но в ряде случаев (около 5% заболевших) иммунная система дает чрезмерно сильный и неадекватный ответ, (гипервоспаление), он сопровождается массивным лавинообразным высвобождением цитокинов.
Что такое цитокины
Цитокины — это очень активные специфические белки, которые продуцируются преимущественно клетками иммунной системы человека, чаще всего лимфоцитами.
В малейших концентрациях они воздействуют на ткани или органы человека и влияют на их межклеточные взаимодействия, выживаемость, рост, функциональную активность и саморазрушение. Цитокины — это «дирижеры жизни» ткани, которые обеспечивают дружную и правильную работу иммунной, эндокринной и нервной систем в норме и при патологии, например воспалении. Цитокины бывают провоспалительными (усиливающими воспаление), противовоспалительнями (ослабляющими воспаление), регулирующими и т. д. (всего более 20 видов), но главное — они находятся в гармоничном равновесии и четко выполняют свои функции.
При тяжелом течении COVID-19 инфекции цитокины сначала «включаются в работу» как запрограммировано природой, но в результате ряда причин, гармония их работы нарушается и это сопровождается лавинообразным ростом повреждения внутренней выстилки сосудов и прогрессирующим нарушением функции тканей и органов, чаще всего легких. Это состояние и называется «цитокиновый шторм». «Цитокиновый шторм» — это мощное и бесконтрольное высвобождение цитокинов, свойственное некоторым инфекционным и неинфекционным заболеваниям, которое приводит к гипервоспалительной реакции организма. Последствия «цитокинового» шторма влекут за собой неблагоприятный клинический прогноз. «Цитокиновый шторм» — это не диагноз. Это особенность течения заболевания, которое вызывает и сопровождает его тяжелую клиническую форму.
Своевременное обращение за медицинской помощью, наблюдение за течением заболевания, госпитализация при наличии рисков, назначение специального обследования и лечение позволит своевременно определить развитие таких осложнений как «цитокиновый шторм» и заблаговременно начать его лечение.
При развитии «цитокинового шторма» чем раньше пациенты начнут получать специфическое лечение, тем более благоприятным будет его результат.
«Цитокиновый шторм» не встречается, если пациент получил прививку от COVID-19 или ранее переболел коронавирусной инфекцией.
Цитокиновый шторм при различных вариантах течения COVID-19

В декабре 2019 года в городе Ухань, Китай, был обнаружен новый штамм коронавируса, вызывающий тяжелый острый респираторный синдром — коронавирус 2 (SARS-CoV-2). Наряду с SARS-CoV и коронавирусом, ассоциированным с ближневосточным респираторным синдромом — (MERS-CoV), SARS-CoV-2 является третьим коронавирусом, вызывающим тяжелые респираторные заболевания у людей, объединенных под названием «коронавирусная болезнь 2019 года» (COVID-19). Эта вспышка была признана Всемирной организацией здравоохранения (ВОЗ) в марте 2020 года пандемией и оказала значительное влияние на экономику и здравоохранение во всем в мире.
Хотя ситуация развивается стремительно, тяжелое течение заболевания, проявляющееся лихорадкой и пневмонией, приводящее к острому респираторному дистресс-синдрому (ОРДС), было описано в 20 % случаев COVID-19. Это напоминает течение ОРДС, вызванного синдромом выброса цитокинов (цитокиновый шторм), и вторичный гемофагоцитарный лимфогистиоцитоз, наблюдаемый у пациентов с SARS-CoV и MERS-CoV, а также у пациентов с лейкемией, получающих Т-клеточную терапию. Учитывая этот опыт, необходимо создание терапевтических средств, основанных на подавлении синдрома выброса цитокинов, таких как тоцилизумаб, которые прошли клинические испытания для лечения COVID-19.
SARS-CoV-2 — это бета-коронавирус, который наиболее тесно связан с SARS-CoV. Оба вируса используют рецептор ангиотензинпревращающего фермента, связанный с карбоксипептидазой (ACE2), чтобы проникнуть в клетки. Этот рецептор повсеместно экспрессируется в сердечной и легочной ткани, а также в некоторых кроветворных клетках, включая моноциты и макрофаги. Ключевой особенностью инфекции COVID-19 является лимфопения (низкий уровень лимфоцитов в крови), которая коррелирует с клинической тяжестью процесса. При SARS-CoV инфицируются моноциты и дендритные клетки, тогда как при MERS-CoV инфицируются моноциты и Т-клетки через дипептидилпептидазу 4 (DPP4). Возможно, что SARS-CoV-2 также поражает дендритные клетки. Апоптоз и истощение пула Т-клеток в результате нарушения процессов активации из-за дисфункции дендритных клеток может способствовать патологии иммунной системы при COVID-19. Однако лимфопения не является специфическим биомаркером неблагоприятного прогноза при COVID-19, поскольку она также является биомаркером, который коррелирует с летальным исходом в пандемии гриппа A (H1N1) 2009 года.
Было установлено, что цитокиновый шторм является основным фактором тяжелого течения SARS-CoV и MERS-CoV у пациентов. Повышенные сывороточные концентрации интерлейкина-6 (IL-6) и других провоспалительных цитокинов являются признаками тяжелого течения инфекции MERS-CoV. Синдром высвобождения цитокинов часто встречается у пациентов с COVID-19, а повышенный уровень IL-6 в сыворотке коррелирует с дыхательной недостаточностью, ОРДС и неблагоприятными клиническими исходами. Повышенный уровень C-реактивного белка (CРБ),экспрессия которого стимулируется IL-6, также является биомаркером тяжелой бета-коронавирусной инфекции.
Инфицирование бета-коронавирусом моноцитов, макрофагов и дендритных клеток приводит к их активации и секреции IL-6 и других провоспалительных цитокинов. IL-6 обладает выраженными провоспалительными свойствами (см. рис. 1). IL-6 может передавать сигналы по двум основным путям, которые называются классической цис-передачей или транс-передачей. При передаче цис-сигналов IL-6 связывается с мембраносвязанным рецептором IL-6 (mIL-6R) в комплексе с gp130; нисходящая сигнальная трансдукция опосредуется, в свою очередь, JAKs (Janus kinases) и STAT3 (сигнальный преобразователь и активатор транскрипции-3). Связанный с мембраной комплекс gp130 экспрессируется повсеместно, в отличие от mIL-6R, экспрессия которого ограничена в основном иммунными клетками. Активация передачи сигналов в рамках цис-передачи приводит к плейотропным эффектам на приобретенный иммунитет (В- и Т-клетки), а также врожденную иммунную систему [нейтрофилы, макрофаги и естественные клетки-киллеры (NK)], которые могут вносить вклад в возникновение цитокинового шторма.
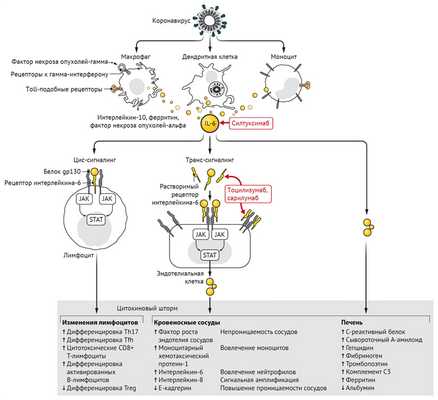
Коронавирусная инфекция приводит к активации моноцитов, макрофагов и дендритных клеток. Позже высвобождение IL-6 запускает каскад амплификации, который приводит к цис-передаче сигналов с дифференцировкой Т-лимфоцитов в TH-17, помимо других лимфоцитарных изменений, и к транс-передаче сигналов во многих типах клеток, таких как, например, эндотелиальные клетки. Обусловленное этим увеличение выработки системных цитокинов вносит вклад в патофизиологию тяжелого течения COVID-19, включая гипотензию и острый респираторный дистресс-синдром (ОРДС), которые можно лечить антагонистами IL-6, такими как тоцилизумаб, сарилумаб и силтуксимаб.
При передаче сигналов высокие концентрации циркулирующих IL-6 связываются с растворимой формой IL-6R (sIL-6R), образуя комплекс с димером gp130 на всех клеточных поверхностях. В результате сигнальный каскад IL-6-sIL-6R-JAK-STAT-3 активируется в клетках, которые не экспрессируют mIL-6R, таких как эндотелиальные клетки. Это приводит к системному «цитокиновому шторму», включающему секрецию сосудистого эндотелиального фактора роста (VEGF), хемоаттрактантного белка моноцитов-1 (МСР-1), IL-8 и дополнительного IL-6, а также снижение экспрессии E-кадгерина на эндотелиальные клетки. VEGF и пониженная экспрессия E-кадгерина способствуют проницаемости сосудов, которые участвуют в патофизиологии гипотонии и легочной дисфункции при ОРДС.
Вторичный гемофагоцитарный лимфогистиоцитоз — это гипервоспалительный синдром, характеризующийся высвобождением цитокинов, цитопенией (низкое количество клеток крови) и полиорганной недостаточностью (включая печеночную). У взрослых вторичный гемофагоцитарный лимфогистиоцитоз чаще всего связан с тяжелыми вирусными инфекциями, но также встречается у пациентов с лейкемией, получающих специальную Т-клеточную терапию. В дополнение к повышенным уровням цитокинов для вторичного гемофагоцитарного лимфогистиоцитоза характерны высокие уровни ферритина в сыворотке крови. Экспрессирующие CD163 макрофаги выступают в качестве источника ферритина. Учитывая их роль в передаче сигналов ретикулоэндотелиального железа, вторичный гемофагоцитарный лимфогистиоцитоз известен также как синдром активации макрофагов. Ретроспективное исследование пациентов с COVID-19 показало, что повышение сывороточного ферритина и IL-6 коррелировало с уровнем выживаемости и наблюдалось у погибших.
У пациентов, получающих CART-терапию (лечение Т-клетками химерного рецептора антигена (chimeric antigen receptor — CAR)), также могут развиться как цитокиновый шторм, так и вторичный гемофагоцитарный лимфогистиоцитоз. CART-терапия включает перепрограммирование Т-лимфоцитов пациента с целью повышения экспрессии на них молекул CAR, которые распознают антигены на опухолевых клетках. При переливании этих перепрограммированных клеток обратно пациенту они нацеливаются на опухолевые клетки, тем самым активируя противоопухолевый иммунный ответ. Эмили Уайтхед, первый пациент, получивший CD19-нацеленные Т-клетки CAR-19 с целью лечения острого лимфобластного лейкоза в 2012 году, побочным эффектом получила тяжелую форму цитокинового шторма и вторичного гемофагоцитарного лимфогистиоцитоза, что привело к развитию ОРДС, полиорганной недостаточности и гипотонии, которая была невосприимчива к стандартному лечению стероидами. Из-за значительного повышения сывороточного IL-6 у этой пациентки эмпирически было принято решение о начале терапии тоцилизумабом, антагонистом IL-6R, одобренным в то время для лечения ревматических состояний, таких как ювенильный идиопатический артрит. Она получала однократную дозу тоцилизумаба на 7-й день после введения CARТ-лимфоцитов. Спустя несколько часов у пациентки снизилась температура, после чего было принято решение об отмене лечения гипотонии и отказ от поддержки ИВЛ после разрешения ОРДС. В настоящее время тоцилизумаб с подтвержденной эффективностью и минимальными побочными эффектами у сотен пациентов одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для лечения заболеваний, протекающих с синдромом цитокинового шторма, вызванного CARТ-терапией.
Эффективность антагонистов IL-6-IL-6R для лечения цитокинового шторма и вторичного гемофагоцитарного лимфогистиоцитоза подчеркивает центральную роль передачи сигналов IL-6 в патофизиологии цитокин-управляемых гипервоспалительных синдромов. Тяжелые случаи COVID-19 можно лечить как раз путем ингибирования пути IL-6, учитывая связанные с цитокиновым штормом и подобным вторичному гемофагоцитарному лимфогистиоцитозу повышения цитокинов в сыворотке крови. Действительно, предварительные результаты исследования 21 пациента с COVID-19, получавшего тоцилизумаб в Китае, обнадеживают: лихорадка спадала у всех пациентов в течение первого же дня приема тоцилизумаба. Потребность в кислороде была снижена у 75 % пациентов.
Во всем мире проводятся контролируемые клинические испытания с целью тестирования эффективности антагонистов IL-6 и IL-6R для лечения пациентов с COVID-19 с тяжелыми респираторными осложнениями. Один вопрос, который необходимо решить, заключается в том, будет ли иметь место дифференциальная эффективность между антагонистами IL-6 и антагонистами IL-6R. Относительно этого поднимается вопрос, что ингибиторы IL-6R могут подавлять как цис-, так и транс-передачу сигналов, а также транс-презентацию, недавно описанный третий способ передачи сигналов. Транс-презентация включает связывание IL-6 с mIL-6R, экспрессируемым на иммунной клетке, которая образует комплекс с gp130 на клетках T-хелпера-17 (TH17), что приводит к передаче сигналов Т-клеток вниз по каскаду, который может приводить к ОРДС. Однако ингибиторы IL-6 могут подавлять только цис- и транс-передачу сигналов. Непосредственная цель применения антагонистов IL-6 состоит в том, чтобы облегчить течение тяжелых случаев COVID-19 и свести к минимуму потребности в интенсивной терапии данных пациентов. Долгосрочная цель должна заключаться в разработке противовирусных препаратов и вакцин, которые предотвращают инфекцию или облегчают ее течение.
Есть ряд предостережений, которые необходимо брать во внимание, учитывая глобальную потребность в терапии COVID-19. При сепсис-ассоциированном ОРДС часто назначают кортикостероиды. Однако применение кортикостероидов у пациентов с SARS и MERS не улучшило показатели выживаемости и не привело к каким-либо изменениям вирусного клиренса. В результате консенсус экспертов-инфекционистов из профильных институтов и ВОЗ рекомендует клиницистам избегать системных кортикостероидов у пациентов с COVID-19 в настоящее время. Теоретическая возможность состоит в том, что подавление воспаления антагонистами IL-6 может задержать выведение вируса из организма. Однако блокада IL-6 также приводит к быстрому снижению сывороточного IL-10, иммуносупрессивного цитокина, секретируемого макрофагами, что может смягчить опасения по поводу продления клиренса вируса. Более того, одна или две дозы антагониста IL-6 вряд ли приведут к таким осложнениям, как грибковые инфекции или остеонекроз челюсти, возникающие у пациентов, которым ежемесячно вводят эти препараты для лечения хронических состояний, например, ревматоидного артрита. Примечательно, что тоцилизумаб был впервые одобрен для лечения ревматических заболеваний, а затем — цитокинового шторма у пациентов, получающих CARТ-терапию, и в настоящее время подвергается «перепрофилированию» для борьбы с пандемией COVID-19. Вполне возможно, что направленная на IL-6 терапия будет использоваться в лечении пациентов на случай будущих пандемий, вызванных другими вирусами, таких как грипп и лихорадка Эбола.
Цитокиновый шторм при коронавирусе

Цитокиновый или кининовый шторм — основная причина летального исхода при заболевании COVID-19. Чаще возникает как ответ на вирусные инфекции, онкозаболевания, трансплантацию органов или сепсис. Характеризуется чрезмерной активностью иммунной системы, которая начинает атаковать здоровые клетки собственного организма, вызывая полиорганную недостаточность — нарушений функций органов. Первой под удар попадает дыхательная система, возникает острый респираторный дистресс-синдром или ОРДС. Состояние чревато появлением жидкости и отеком легких с последующей гипоксией.
Рассказывает специалист РЦ «Лаборатория движения»
Дата публикации: 29 Октября 2021 года
Дата проверки: 30 Ноября 2021 года
Содержание статьи
Цитокиновый шторм при коронавирусе - что это?
Цито шторм или гиперцитокнемия при коронавирусе — патологическая циклоидно развивающаяся форма иммунного ответа на воздействие вируса. Патология ковид-19 сопровождается поражением легких и дисфункцией дыхания. На фоне прогрессирующей пневмонии кининовый шторм вызывает тяжелую легочную недостаточность и летальный исход в 50% клинических случаев.
Лечение цитокинового шторма при коронавирусе возможно исключительно в условиях хорошо оснащенной больницы. Состояние сопряжено высоким риском, требует неотложной реанимационной помощи.
Как возникает
Развитию признаков цитокинового шторма при коронавирусе предшествует высокая интенсивность восприятия рецепторов иммунных клеток. Под влиянием чужеродных антигенов вырабатывается повышенное количество цитокинов — медиаторов воспалительного процесса, выполняющих регуляторные функции. Которые в свою очередь продуцируют повышенное образование интерлейкина-6, активацию Т-лимфоцитов и других иммунных клеток и их миграцию.
При увеличении уровня цитокинов происходит возрастание проницаемости и повреждения сосудистых стенок капилляров, нарушение микроциркуляции крови, тромбообразование и закупорка кровеносных сосудов. Это влечет кислородную недостаточность, упадок сил и энергии, последующую гипоксию.
Причина развития цитокинового шторма досконально не выявлена. По мнению медиков, развитие циклонического генерализованного процесса вызывает генетическая предрасположенность, пониженное содержание в сыворотке крови противовоспалительных цитокинов.
Какие признаки цитокинового шторма?
Как распознать симптомы цитокинового шторма при коронавирусе? Основные проявления включают:
- повышение частоты, затрудненность и шумность дыхания
- интерстициальное поражение легких, одышка, сухой кашель
- повышение фебрильной температуры до 39 °C, не сбивается стандартными препаратами
- головокружение, цефалгия, помутнение сознания, включая потерю;синюшный оттенок кожи
- суставные и мышечные боли, болевой симптом различной интенсивности в области поясницы
- сильная слабость
Респираторные симптомы постепенно ухудшаются до острого респираторного дистресс-синдрома (ОРДС), требующего кислородной терапии. В особо тяжелых случаях пациенту необходимо подключение к аппарату искусственной вентиляции легких (ИВЛ).
Пациентам, перенесшим ковид, необходимо следить за показателями давления и пульса. При обнаружении указанных симптомов необходимо обратиться к кардиологу и пройти обследование.
Диагностика
Диагноз устанавливают на основе КТ легких и лабораторных анализов крови.
ПЦР-анализ на обнаружение возбудителя.
Компьютерная томография показывает области затемнения по типу «матового стекла». Общий анализ крови — характерно снижение уровня лейкоцитов.
Биохимический — увеличение показателей печеночных трансаминаз, креатинина, билирубина, мочевины.
Электрохемилюминесцентный анализ — высокая концентрация цитокинов. Коагулограмма, показатели как Д-димера, частичное тромбопластиновое и протромбиновое время.
Газовый анализ крови, выявление снижения парциального давления кислорода, ацидоза.
Чем раньше диагностирован цитокиновый шторм и начато лечение, тем меньше шансов летального исхода.
Можно ли остановить цитокиновый шторм?
Механизм развития цитокинового шторма можно остановить только в условиях клиники. Происходит образование сильных воспалительных процессов — поражения легких, почек, печени, необратимые патологические изменения тканей.
Прогнозировать и предотвратить развитие гиперцитокинемии нельзя, все зависит от индивидуальных особенностей организма, наличия сопутствующих заболеваний, принимаемых при терапии ковида лекарственных средств. Важно выявление ранних предвестников для эффективности медикаментозного лечения. При появлении тревожных симптомов при Covid-19 необходима срочная госпитализация.
Цитокиновый шторм ( Гиперцитокинемия , Цитокиновая буря )
Цитокиновый шторм - это особая тяжелая форма системной воспалительной реакции, характеризующаяся избыточной активацией иммунокомпетентных клеток, выработкой большого количества воспалительных цитокинов. Может развиться при сепсисе, вирусных инфекциях (грипп, коронавирусная инфекция, лихорадка Эбола), отторжении пересаженного органа и пр. Основные клинические проявления включают лихорадку, боли в голове, поясничной области, затрудненное дыхание. Диагноз устанавливается при обнаружении высокой концентрации в сыворотке цитокинов - ФНО-α, ИЛ-6, ИФН-γ. В качестве лечения применяются моноклональные антитела, блокаторы интерлейкинов, иммуноглобулин.

Общие сведения
Термин «цитокиновый шторм» (син. цитокиновая буря, гиперцитокинемия) был впервые применен американским гематологом-онкологом Джеймсом Феррара в 1993 году при изучении реакции отторжения трансплантата. В большинстве случаев гиперцитокинемия несет в себе гораздо более серьезную опасность для жизни человека, чем болезнь, на фоне которой она развилась. Гиперцитокинемия ассоциируется с тяжелыми формами заболеваний и сама по себе считается предиктором неблагоприятного прогноза. Цитокиновый шторм - явление достаточно редкое, точные эпидемиологические данные о его распространенности отсутствуют.
Причины
На сегодняшний день, несмотря на многочисленные исследования, точный этиологический фактор, запускающий каскад патологических реакций цитокинового шторма, не установлен. Предполагается, что непосредственная причина выброса цитокинов заключается в активации Toll-подобных рецепторов (TLR) мононуклеарных клеток.
Не исключается роль генетической предрасположенности (например, избыточная экспрессия рецепторов на поверхности иммунных клеток). Ниже приведены заболевания и состояния, при которых может возникнуть потенциально фатальная гиперцитокинемия:
- Вирусные инфекции. Довольно часто цитокиновый шторм встречается при затяжных осложненных формах птичьего гриппа (H5N1), свиного гриппа (H1N1). Наиболее актуальныой проблемой в настоящее время является гиперцитокинемия при тяжелой форме коронавирусной инфекции COVID-19, протекающей с пневмонией и дыхательной недостаточностью. Именно с развитием цитокинового шторма связаны летальные случаи этого заболевания.
- Сепсис и септический шок. Возрастание уровня цитокинов считается одним из основных звеньев патогенеза при генерализации бактериальных, грибковых инфекций - стафилококковых, стрептококковых, кандидозных.
- Онкологические заболевания. Цитокиновый шторм может наблюдаться на терминальных стадиях онкогематологических болезней - лейкозов, лимфом.
- Трансплантация органов. Гиперцитокинемия лежит в основе отторжения трансплантированного органа, реакции «трансплантат против хозяина» при пересадке гемопоэтических стволовых клеток костного мозга.
- Экстракорпоральное оплодотворение. Активация Т-лимфоцитов, NK-клеток с чрезмерной продукцией цитокинов может наблюдаться после искусственного оплодотворения (имплантации эмбрионов в стенку матки) и вызывать выкидыши или преждевременные роды.
- Другие причины: острый панкреатит с панкреонекрозом, печеночная энцефалопатия, тяжелые формы бронхиальной астмы, резистентной к терапии глюкокортикоидами и бронходилалаторами. При данных заболеваниях цитокиновая буря встречается крайне редко.
Патогенез
Цитокины представляют собой белки, которые синтезируются иммунными клетками (лимфоцитами, макрофагами, NK-клетками). Они выполняют регуляторную функцию, контролируют процессы воспаления, иммунного ответа на чужеродные антигены, также принимают участие в гемостазе, в поддержании микроциркуляции. Однако их избыточное количество оказывает крайне токсический эффект практически на все органы и ткани.
В развитии цитокинового шторма принимает участие большое число цитокинов, провоспалительных медиаторов, но ведущую роль в патогенезе играют фактор некроза опухолей альфа ФНО-α, гамма-интерферон ИФН-γ, интерлейкин-6 (ИЛ-6). Нет единого мнения о каскаде патологических реакций при цитокиновом шторме, среди специалистов и исследователей до сих пор ведутся активные дискуссии.
При контакте с чужеродным антигеном, макрофаги и эндотелиальные клетки начинают продуцировать интерлейкин-6, который вызывает активацию Т-лимфоцитов и других иммунных клеток, их миграцию в очаг воспаления. Активированные лимфоциты, в свою очередь, синтезируют ФНО и интерферон. Также под влиянием интерлейкина запускается образование коллагеназ, металлопротеиназ, нейтральных протеаз.
В результате нарастания уровня цитокинов происходит увеличение сосудистой проницаемости, повреждение сосудистой стенки, клеточных мембран, системное нарушение микроциркуляции и внутрисосудистое тромбообразование. В клетках подавляется выработка аденозинтрифосфата, из-за чего наступает гипоэнергетическое состояние.
«Порочный круг» заключается в механизме положительной обратной связи, т.е. образование цитокинов и активация иммунокомпетентных клеток приводит к активации других клеток иммунной системы, синтезу других цитокинов. Процесс принимает генерализованный характер, что часто вызывает полиорганную недостаточность. Другие исследователи развитие цитокинового шторма связывают с пониженным содержанием в сыворотке больных противовоспалительных цитокинов (ИЛ-1Ra, ИЛ-10) и активацией рецепторов лимфоцитов пероксисомами (PPAR).
Симптомы цитокинового шторма
Клиническая картина достаточно яркая и разнообразная. Симптомы возникают довольно быстро. Сначала появляются неспецифические признаки - высокая лихорадка, головная боль, миалгии. Затем присоединяются тошнота, рвота, диарея. Пациенты становятся беспокойными. Учащается сердцебиение, снижается артериальное давление. У больных с вирусной инфекцией дыхательных путей сухой кашель усугубляется и приобретает изнуряющий характер. Значительно затрудняется дыхание.
Характерный симптом - увеличение размеров шеи за счет отека подкожной жировой клетчатки, который связан с резким повышением сосудистой проницаемости. Некоторые больные жалуются на ноющие или тупые боли в пояснице, уменьшение объема мочеиспускания. Возможны кожные высыпания. У части пациентов развивается спутанность сознания, галлюцинации, эпилептиформные припадки.
Осложнения
Цитокиновая буря имеет широкий спектр неблагоприятных последствий. Наиболее часто страдает дыхательная система - у подавляющего числа больных при тяжелых формах COVID-19 и гриппа возникает острый респираторный дистресс-синдром с дыхательной недостаточностью, требующей немедленного подключения к аппарату ИВЛ. За счет выраженного повреждения почек, печени развивается почечная недостаточность, печеночная недостаточность с энцефалопатией.
Возможен инфаркт миокарда и острая сердечная недостаточность и кардиогенным шоком. У некоторых пациентов наблюдается одновременное поражение нескольких органов - полиорганная недостаточность. Нередким осложнением выступает синдром диссеминированного внутрисосудистого свертывания, который характеризуется сочетанием тромбообразования и массивных кровотечений.
Ввиду тяжелого соматического статуса больные с цитокиновым штормом курируются врачами-реаниматологами. Также по основному заболеванию эти пациенты наблюдаются инфекционистами, терапевтами. Заподозрить данное состояние помогает сочетание клинической картины, анамнестических сведений. Лабораторными предикторами наступления цитокинового шторма являются запредельно высокие сывороточные маркеры воспаления - скорость оседания эритроцитов, С-реактивный белок, ферритин.
Пациентам с нарушением дыхания, особенно при симптомах COVID-19, обязательно проводится аускультация и перкуссия легких, измеряется уровень насыщения крови кислородом (сатурация) с помощью пульсоксиметра. Также назначается дополнительное обследование, включающее:
- Анализы крови. В общем анализе крови отмечается снижение общего уровня лейкоцитов, абсолютная лимфопения, возможны анемия, тромбоцитопения. В биохимическом анализе часто обнаруживается увеличение содержания печеночных трансаминаз (АЛТ, АСТ), общего билирубина, мочевины, креатинина. При сепсисе измеряются показатели прокальцитонина, пресепсина.
- Определение цитокинов. Методом электрохемилюминесцентного анализа обнаруживаются высокие концентрации ИЛ-6, ФНО-α, ИФН-γ.
- Идентификация возбудителя. При подозрении на вирусное инфекционное заболевание проводится забор мазка из зева и полости носа для дальнейшего ПЦР-анализа и определения РНК SARS-CoV-2, РНК вируса гриппа. Для подтверждения сепсиса выполняется 3-кратный бактериологический посев крови.
- Коагулограмма. Могут выявляться изменения как в сторону гиперкоагуляции, так и гипокоагуляции (в зависимости от стадии ДВС-синдрома). Исследуются такие показатели как Д-димер, протромбиновое время, активированное частичное тромбопластиновое время.
- Газовый анализ крови. У многих пациентов отмечается снижение парциального давления кислорода (PaO2) в артериальной крови (гипоксемия), смещение pH крови в кислую сторону (ацидоз).
- Лучевая диагностика. При рентгенографии или компьютерной томографии органов грудной клетки обнаруживаются инфильтраты в легких, области затемнения, картина «матового стекла».
Цитокиновый шторм имеет схожий патогенез и клиническое течение с некоторыми состояниями, от которых его нужно отличать. К ним относятся гемофагоцитарный лимфогистиоцитоз (синдром активации макрофагов), который развивается у ревматологических больных, особенно при ювенильном ревматоидном артрите, и синдром высвобождения цитокинов - ятрогенное состояние, возникающее как ответная реакция на введение генно-инженерных биологических лекарственных препаратов.
Лечение цитокинового шторма
Все больные должны быть госпитализированы в палату интенсивной терапии либо реанимационное отделение. При низком уровне сатурации проводится подключение пациента к искусственной вентиляции легких. Для снижения частоты летальных исходов, независимо от причины, используются следующие лекарственные средства, позволяющие уменьшить степень выраженности цитокинового шторма:
- Таргетная терапия. Наиболее эффективными в подавлении мультиорганного поражения, вызванного гиперцитокинемией, считаются моноклональные антитела к ИЛ-6 - тоцилизумаб, сарилумаб. Также действенными оказались ингибиторы янус-киназ (JAK-киназ) - барицитиниб, тофацитиниб. При их неэффективности применяются антагонисты ИЛ-6 и ИЛ-1 - олокизумаб, RPH-104.
- Глюкокортикостероиды. С целью снижения чрезмерной активации иммунной системы в схему лечения добавляются глюкокортикоиды (дексаметазон, метилпреднизолон)
- Внутривенный иммуноглобулин. Обладающий иммуносупрессивным действием человеческий иммуноглобулин для внутривенного введения способен подавить биологические эффекты цитокинов.
Следует помнить, что данные препараты оказывают ингибирующее действие на несколько звеньев иммунной системы, поэтому их применение ассоциировано с повышением риска присоединения вторичной инфекции, чаще всего бактериальной. Помимо «антицитокинового лечения» проводится следующая терапия:
- Противовирусная. При гриппе назначаются ингибиторы нейраминидазы - осельтамивир. Для лечения COVID-19 используются ЛС для лечения ВИЧ-инфекции и вирусных гепатитов - рекомбинантный интерферон, лопинавир, ритонавир.
- Антибактериальная. При сепсисе рекомендуется комбинация 2 или 3 антибиотиков из разных групп - амоксициллин, гентамицин, левофлоксацин.
- Коррекция ДВС-синдрома. В случае гиперкоагуляции для предотвращения тромбообразования необходимы антикоагулянты - гепарин, ривароксабан. При гипокоагуляции назначаются гемостатики (аминокапроновая кислота, этамзилат) и переливание свежезамороженной плазмы.
- Борьба с гипотензией и шоком. При выраженном снижении давления пациенту вводятся вазопрессоры (норадреналин, допамин) и кардиотоники (добутамин).
Прогноз и профилактика
Цитокиновый шторм является крайне тяжелым состоянием, характеризующимся высокой летальностью. При COVID-19 больше 70% смертельных исходов наступает вследствие данного расстройства. Основными причинами смерти становятся острая дыхательная или полиорганная недостаточность, тромботические осложнения в рамках ДВС-синдрома.
Ввиду того, что этиологический фактор, провоцирующий возникновение цитокиновой бури не установлен, эффективных методов профилактики не существует. Основные меры по предотвращению гиперцитокинемии сводятся к своевременной диагностике и грамотному лечению тех заболеваний, при которых данное состояние развивается. Чтобы снизить фатальность, необходимо применять таргетную терапию как можно раньше.
1. Молекулярные механизмы “цитокинового шторма” при острых инфекционных заболеваниях/ Шипилов М.В.// Лечебное дело. - 2013.
2. Уровень цитокинов в секрете ротой полости у детей бронхиальной астмой/ Абаджиди М.А., Лукушкина Е.Ф., Мадинская И.В.//Цитокин и воспаление. - 2002. - №3.
3. Hypercytokinemia in severe COVID-19/ John B.Moore., Carl H.June// Science.-2020., Vol.368, Issue 6490.
4. Tne trinity of COVID-19: immunity, inflammation and intervention/ Matthew Z.T., Chek Meng Poh., Laurent Renia., Paul A.MacAry., Lisa F.P.Ng// Nature Reviews Immunology. - 2020.
Постковидный синдром ( Лонг-ковид , Постковид )
Постковидный синдром - это долгосрочные патологические проявления, сохраняющиеся в течение трех и более месяцев после новой коронавирусной инфекции. Основные признаки включают выраженную слабость, тяжесть в грудной клетке, ощущение неполного вдоха, головные, суставные и мышечные боли, нарушения сна, депрессию, снижение когнитивных функций, расстройство терморегуляции и др. Синдром диагностируется клинически с учетом предшествующего инфекционного анамнеза. Лечение включает симптоматическую фармакотерапию, реабилитацию (ЛФК, дыхательная гимнастика, поливитамины, физиотерапия).
МКБ-10
Постковидный синдром (постковид, лонг-ковид) - новый, еще малоизученный феномен в современной терапевтической практике. Однако, несмотря на это, данная нозология уже признана мировым медицинским сообществом и заняла свое место в МКБ-10. По статистике, признаки постковидного синдрома испытывают на себе 10-20% людей, переболевших COVID-19. Различные симптомы у них сохраняются до 3-6 месяцев после перенесенной инфекции. Некоторые исследователи разделяют постковид и лонг-ковид, считая первый осложнениями излеченного COVID-19, а второй - хронической персистенцией вируса в организме.
Этиология постковидного синдрома непосредственно связана с перенесенной коронавирусной инфекцией. По данным ВОЗ, клиническое выздоровление при легком течении COVID-19 наступает примерно через 2 недели, а при средне-тяжелом и тяжелом - через 3-6 недель. Однако было замечено, что определенная симптоматика у больных сохраняется спустя несколько недель и даже месяцев после того, как инфекция разрешилась, а ПЦР-тест на коронавирус стал отрицательным. Предполагается, что постковидный синдром может быть связан с:
- остаточным воспалением (реконвалесцентная фаза);
- длительной персистенцией SARS-CoV-2 в скрытых очагах (латентная инфекция, подобно герпесу или ВИЧ);
- ПИТ-синдромом (длительная иммобилизация, ИВЛ);
- социальной изоляцией.
Факторы риска
Согласно наблюдениям, имеющимся на сегодняшний день, наиболее подверженными развитию постковидного синдрома являются следующие группы пациентов:
- взрослые старше 50 лет;
- лица, перенесшие тяжелую форму ковидной инфекции и длительную вентиляцию легких;
- люди с хроническими заболеваниями: ХСН, легочными патологиями, артериальной гипертензией, ожирением, сахарным диабетом, аутоиммунными заболеваниями.
Корреляция между тяжестью клинического течения COVID-19 и частотой и/или тяжестью постковидных симптомов прослеживается не всегда. Поствирусные синдромы характерны для периода реконвалесценции после других коронавирусов (в частности, SARS-CoV-1 и вызываемого им ТОРС), а также гриппа, инфекционного мононуклеоза, лихорадки Q, бруцеллеза и др.
Механизм постковидного синдрома, предположительно, связан с хроническим тромбоваскулитом, который преимущественно поражает нервную систему (центральную, периферическую, вегетативную), легкие, почки, кожу. SARS-CoV-2 инфицирует эндотелий сосудов, оказывая прямое повреждающее действие и нарушая его антикоагуляционные свойства. В результате возникают условия для образования микротромбов в микроциркуляторном русле.
Кроме этого, может иметь место иммунокоплексный ответ, связанный с отложением в сосудистых стенках внутренних органов иммунных депозитов, активацией системы комплемента, вызывающих аутоиммунное воспаление. Свою лепту в постковидный синдром, наряду с тромботической микроангиопатией и васкулитом, вносит венозная тромбоэмболия, тканевая гипоксия и ишемия органов.
Также нельзя не учитывать нейтротропность SARS-CoV-2, который попадая в ЦНС периваскулярно и трансневрально (через обонятельный нерв), напрямую поражает гипоталамус, лимбический комплекс, мозжечок, стволовые структуры.
Воздействие на ЦНС сопровождается нарушением терморегуляции, обоняния, слуха, сна, депрессивными состояниями. Поражение вегетативной НС проявляется дизавтономией, которая приводит в лабильности пульса, АД, дыхания, расстройствам пищеварения. Реакция периферической нервной системы выражается нарушениями чувствительности.
Симптомы
Четкой и однозначной клинической картины постковидного синдрома не существует, т. к. у разных пациентов набор симптомов варьируется в широких пределах. У одних выздоровевших долгосрочные симптомы напоминают те, которые они испытывали во время заражения, у других - появляются новые признаки. Такая вариабельность объясняется индивидуальным преморбидным фоном, поражением различных органов, предшествующим лечением и медицинскими вмешательствами.
В 80% случаев постковидный сидром сопровождается приступами резчайшей слабости. Многие пациенты буквально не могут подняться с кровати, не способны выполнять привычную повседневную физическую нагрузку. Более чем у половины страдающих постковидом нарушаются нормальные ритмы жизнедеятельности: развивается бессонница по ночам, дневная сонливость, изменяется режим сна и бодрствования. Часто больные сообщают о том, что видят необычные яркие сновидения.
Около 45% переболевших отмечают ночную и дневную потливость, периодический субфебрилитет или гипотермию, приступы познабливания. Примерно столько же сообщают о дыхательных нарушениях: чувстве заложенности в груди, бронхоспазме, кашле, нехватке воздуха. Депрессивные состояния, лабильность настроения, плаксивость присутствуют у 45-60% постковидных больных. Более чем в 40% наблюдений беспокоят цефалгии, кардиалгии, тахикардия. Нарушения регуляции АД сопровождаются гипертоническими кризами (30%), реже - эпизодами гипотонии и ортостатической гипотензии (15%).
Порядка 30% пациентов указывают на выпадение волос, ощущение жжения кожи. Кожные васкулиты сопровождаются вазоспазмом, папулезно-геморрагической сыпью. Характерны расстройства функции органов чувств: нарушения зрения, слуха, потеря вкусовых ощущений, аносмия. У четверти переболевших сохраняется диарея. Около 20% предъявляют жалобы на появление узелков и болезненности по ходу вен (флебиты), кожных сыпей.
Также может наблюдаться шаткость походки, диффузные миалгии, тремор конечностей, трудности с концентрацией внимания и памятью. У женщин нередки менструальные нарушения. У 75% больных симптомы постковидного синдрома носят волнообразный характер, у четверти - постоянный.
Постковидный синдром вызывает существенное снижение качества повседневной жизни. 30-35% людей спустя 3-4 месяца после заражения все еще не могут осуществлять полноценный уход за собой и детьми, вернуться к работе, нормальному ритму жизни. Треть переболевших, ранее занимавшихся спортом, не способны продолжать свои ежедневные упражнения в течение как минимум 6 месяцев.
Психиатрические последствия SARS-COV-2 ассоциированы с затяжными депрессиями (отмечаются у 60% переболевших) и суицидальными мыслями (20%). Исследования показывают увеличение числа случаев посттравматических стрессовых расстройств (ПТСР), панических атак, обсессивно-компульсивных расстройств на фоне COVID-19 по сравнению с прединфекционным уровнем.
В отдаленном периоде повышен риск тромбозов, тромбоэмболий, внезапной сердечной смерти. Неврологические осложнения включают ишемические инсульты, миелиты, полинейропатии, редко ‒ синдром Гийена-Барре. Реальные долгосрочные последствия новой коронавирусной болезни для популяционного здоровья еще предстоит оценить в ближайшие годы.
Диагностика постковидного синдрома во многом носит субъективный характер и основывается в основном на жалобах больных. В зависимости от превалирующих симптомов лечение может осуществлять врач-терапевт, невролог или кардиолог. Рекомендуемые исследования:
- Лабораторная диагностика. Для подтверждения факта перенесенного COVID-19 (если он не был лабораторно верифицирован ранее) следует сдать анализ на антитела к SARS-CoV-2. С целью оценки остаточных воспалительных изменений исследуют ОАК, СОЭ, СРБ, прокальцитонин, для выявления коагуляционных нарушений важны показатели Д-димера, фибриногена, РФМК.
- Инструментальная диагностика. При длительно сохраняющихся жалобах со стороны ССС необходимо пройти ЭКГ, мониторирование АД, ЭхоКГ. Если преобладают симптомы дыхательной дисфункции, целесообразно проведение спирометрии, по показаниям ‒ КТ легких. При других признаках постковида может потребоваться УЗИ ОБП и почек, УЗДС вен нижних конечностей, ЭЭГ, полисомнография.
- Психодиагностика. Больным с тревожными и депрессивными симптомами, когнитивными нарушениями необходима консультация клинического психолога или психотерапевта с проведением патопсихологической диагностики.
Лечение постковидного синдрома
Существенное негативное влияние синдрома на качество жизни диктует необходимость разработки стратегии постковидной реабилитации. В настоящее время клинические рекомендации по лечению постковида не разработаны. В основном терапия носит симптоматическую и общеукрепляющую направленность. Пациентам, испытывающим постковидные симптомы, рекомендуется:
- Фармакотерапия. Для купирования неврологических симптомов назначаются комбинированные препараты (магний+пиридоксин), глицин, валериана. При тахикардии и кардиалгии обосновано применение бета-блокаторов. Некоторым выздоровевшим пациентам показан пролонгированный прием глюкокортикоидов и прямых антикоагулянтов. Рекомендован прием витаминов С, D, добавок цинка и селена.
- Физкультура. Расширение физической активности должно быть постепенным, но систематическим. В постковидном периоде полезны дозированные занятия лечебной физкультурой, дыхательной гимнастикой, ходьба, плавание.
- Физиотерапия. В рамках комплексных программ постковидной реабилитации используются физиотерапевтические процедуры: магнитотерапия, импульсные токи, электрофорез, небулайзерная терапия. Обосновано применение оздоровительного массажа, галотерапии, рефлексотерапии.
- Психотерапия. Для коррекции психоэмоциональных расстройств используется когнитивно-поведенческая терапия, мотивационное интервьюирование.
Среднесрочные и долгосрочные последствия COVID-19 для здоровья переболевших на данный момент неизвестны. Течение постковидного синдрома может быть волнообразным, растягиваться на многие месяцы. В большинстве случаев в течение полугода постковидный синдром постепенно регрессирует или исчезает полностью. У некоторых пациентов сохраняются длительные полиорганные нарушения, развиваются осложнения.
Следует избегать действия триггеров, которые могут провоцировать обострения постковидной симптоматики: значительных физических нагрузок, переутомления, стрессовых ситуаций, инсоляции. Женщинам и мужчинам репродуктивного возраста, перенесшим коронавирусную инфекцию, на протяжении полугода не рекомендуется планировать зачатие. Также всем переболевшим в течение этого периода следует воздержаться от любой плановой иммунизации.
1. Коронавирусный синдром: профилактика психотравмы, вызванной COVID-19/ Соловьева Н.В., Макарова Е.В. , Кичук И.В. // РМЖ. - №9. - 2020.
2. Into the looking glass: Post-viral syndrome post COVID-19/ R. Perrin, L. Riste, M. Hann - Nov., 2020.
3. Post-COVID-19 Fatigue: Potential Contributing Factors/ Thorsten Rudroff, Alexandra C. Fietsam, Justin R. Deters, Andrew D. Bryant, John Kamholz// Brain Sci. - 2020, №10.
4. Needs to Prepare for «Post-COVID-19 Syndrome»/ Robert L. Klitzman// The American Journal of Bioethics. ‒ 26 Oct. 2020.
Читайте также:
- Принципы операции при неполнослойном разрыве вращательной манжеты плечевого сустава
- Жировая ткань эмбриона. Образование хряща у плода
- Антигены аденовирусов. Патогенез поражений аденовирусов. Клиника, диагностика, лечение и профилактика аденовирусных инфекций.
- Воспаление придатков
- Программы дифференцированной терапии миелодиспластического синдрома (МДС)
