Действие анестетиков на конечный и промежуточный мозг. Периферическое действие анестетиков
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Боль является наиболее частой и сложной по субъективному восприятию жалобой пациентов. В 40% всех первичных обращений к врачу боль является ведущей жалобой. Большая распространенность болевых синдромов оборачивается значительными материальными, социальными и духовными потерями.
Как уже говорилось выше, комитет по классификации Международной ассоциации по изучению боли определяет боль как «неприятное сенсорное и эмоциональное переживание, связанное с существующим или возможным повреждением ткани или описываемое в терминах такого повреждения» [37]. В этом определении подчеркивается, что ощущение боли может возникать не только при повреждении ткани, но даже при отсутствии какого-либо повреждения, что указывает на важную роль психических факторов в формировании и поддержании боли.
Классификация боли
Боль - понятие клинически и патогенетически сложное и неоднородное. Она различается по интенсивности, локализации и по своим субъективным проявлениям. Боль может быть стреляющей, давящей, пульсирующей, режущей, а также постоянной или периодической. Все существующее многообразие характеристик боли во многом связано с самой причиной, вызвавшей ее, анатомической областью, в которой возникает ноцицептивный импульс, и очень важно для определения причины боли и последующего лечения [3].
Одним из наиболее существенных факторов в понимании этого феномена является разделение боли на острую и хроническую (рис. 8).
Рис. 8. Боль: острая и хроническая. Главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения.
Острая боль всегда указывает на конкретную проблему или угрозу для человека. В этом ее биологический смысл и «польза». Хроническая боль является во всех случаях патологическим состоянием, приводящим к дезадаптации и снижению качества жизни пациента. А для общества хроническая боль оборачивается огромными экономическими потерями.
Острая боль - это сенсорная реакция с последующим включением эмоционально-мотивационных вегетативных и других факторов при нарушении целостности организма. Развитие острой боли связано, как правило, с вполне определенными болевыми раздражениями поверхностных или глубоких тканей и внутренних органов, нарушением функций гладкой мускулатуры. Острый болевой синдром развивается в 80% случаев, имеет защитное, предупредительное значение, так как свидетельствует о «повреждении» и вынуждает человека предпринять меры для выяснения причины боли и ее устранения. Длительность острой боли определяется временем восстановления поврежденных тканей и/или нарушенной функции гладких мышц и обычно не превышает 3 месяцев. Острая боль обычно хорошо купируется анальгетиками.
В 10-20% случаев острая боль переходит в хроническую, которая длится более 3-6 месяцев. Однако главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения. Хроническая боль не носит защитного характера. Хроническая боль в последние годы стала рассматриваться не только как синдром, но и как отдельная нозология. Ее формирование и поддержание зависит в большей степени от комплекса психологических факторов, нежели от характера и интенсивности периферического ноцицептивного воздействия. Хроническая боль может сохраняться после завершения процессов заживления, т.е. существовать вне зависимости от повреждения (наличия ноцицептивного воздействия). Хроническая боль не купируется анальгетиками и часто приводит к психологической и социальной дезадаптации пациентов.
Одной из возможных причин, способствующих хронификации боли, является лечение, неадекватное причине и патогенезу болевого синдрома. Устранение причины острой боли и/или максимально эффективное ее лечение - залог профилактики трансформации острой боли в хроническую.
Важное значение для успешного лечения боли имеет определение ее патогенеза. Наиболее часто встречается ноцицептивная боль, возникающая при раздражении периферических болевых рецепторов - «ноцицепторов», локализованных практически во всех органах и системах (коронарный синдром, плеврит, панкреатит, язва желудка, почечная колика, суставной синдром, повреждения кожи, связок, мышц и т.д). Нейропатическая боль возникает вследствие повреждения различных отделов (периферической и центральной) соматосенсорной нервной системы [9].
Ноцицептивные болевые синдромы чаще всего являются острыми (ожог, порез, ушиб, ссадина, перелом, растяжение), но могут носить и хронический характер (остеоартроз). При этом виде боли фактор, вызвавший ее, как правило, очевиден, боль обычно четко локализована (обычно в зоне повреждения). Описывая ноцицептивную боль, пациенты чаще всего пользуются определениями «сжимающая», «ноющая», «пульсирующая», «режущая». В лечении ноцицептивной боли хороший терапевтический эффект можно получить при назначении простых анальгетиков и НПВП. При ликвидации причины (прекращении раздражения «ноцицепторов») ноцицептивная боль проходит [9].
Причинами нейропатической боли могут быть повреждения афферентной соматосенсорной системы на любом уровне, начиная от периферических чувствительных нервов и заканчивая корой больших полушарий, а также нарушения в нисходящих антиноцицептивных системах. При поражении периферической нервной системы боли называют периферическими, при поражении центральной нервной системы - центральными (рис. 9).
Нейропатическая боль, возникающая при повреждении различных участков нервной системы, характеризуется пациентами как жгучая, стреляющая, холодящая и сопровождается объективными симптомами раздражения нервов (гиперестезия, парестезия, гипералгезия) и/или нарушения их функции (гипестезия, анестезия). Характерным симптомом нейропатической боли является аллодиния - феномен, характеризующийся возникновением боли в ответ на действие безболевого стимула (поглаживание кисточкой, ватой, температурного фактора).
Рис. 9. Периферическая и центральная нейропатическая боль.
Нейропатическая боль характерна для хронических болевых синдромов разной этиологии. При этом их объединяют общие патофизиологические механизмы формирования и поддержания боли.
Нейропатическая боль плохо поддается лечению стандартными анальгетиками и НПВП и часто приводит к выраженной дезадаптации пациентов.
В практике невролога, травматолога, онколога встречаются болевые синдромы, в клинической картине которых наблюдаются симптомы как ноцицептивной, так и нейропатической боли - «смешанная боль» (рис. 10). Такая ситуация может возникать, например, при компрессии опухолью нервного ствола, раздражении межпозвонковой грыжей спинномозгового нерва (радикулопатии) или при компрессии нерва в костном или мышечном канале (туннельные синдромы). В лечении смешанных болевых синдромов необходимо воздействие на оба, ноцицептивный и нейропатический, компоненты боли.
Рис. 10. Представленность различных типов боли.
Ноцицептивная и антиноцицептивная системы
Сегодняшние представления о формировании боли основаны на представлениях о существовании двух систем: ноцицептивной (НС) и антиноцицептивной (АНС) (рис. 11).
Ноцицептивная система (является восходящей) обеспечивает проведение боли от периферических (ноцицептивных) рецепторов до коры головного мозга. Антиноцицептивная система (является нисходящей) предназначена для контроля над болью [17, 18].
На первом этапе формирования боли происходит активация болевых (ноцицептивных) рецепторов. К активации болевых рецепторов может привести, например, воспалительный процесс. Это вызывает проведение болевых импульсов к задним рогам спинного мозга.
На сегментарном спинальном уровне происходит модуляция ноцицептивной афферентации, которая осуществляется влиянием нисходящих антиноцицептивных систем на различные опиатные, адренергические, глютаматные, пуриновые и другие рецепторы, расположенные на нейронах заднего рога. Этот болевой импульс затем передается в вышележащие отделы центральной нервной системы (таламус, кора головного мозга), где происходит обработка и интерпретация информации о характере и локализации боли.
Рис. 11. Современные представления о боли: ноцицептивная (НС) и антиноцицептивная системы (АНС).
Однако итоговое восприятие боли в значительной степени зависит от активности АНС. АНС головного мозга играют ключевую роль в формировании боли и изменении реакции на боль. Очевидна их широкая представленность в головном мозге и включение в различные нейротрансмиттерные механизмы (норадреналин, серотонин, опиоиды, дофамин). АНС работают не изолированно, а, взаимодействуя между собой и с другими системами, они регулируют не только болевую чувствительность, но и сопряженные с болью вегетативные, моторные, нейроэндокринные, эмоциональные и поведенческие проявления боли. Это обстоятельство позволяет рассматривать их как важнейшую систему, определяющую не только характеристики болевого ощущения, но и его многообразные психофизиологические и поведенческие корреляты [3]. В зависимости от активности АНС боль может усиливаться или уменьшаться.
Препараты для лечения боли
Препараты для лечения боли назначают с учетом предполагаемых механизмов боли. Понимание механизмов формирования болевого синдрома позволяет проводить индивидуальный подбор лечения. При ноцицептивной боли с наилучшей стороны зарекомендовали себя нестероидные противовоспалительные препараты (НПВП) и опиоидные анальгетики. При нейропатической боли обоснованным является применение антидепрессантов, антиконвульсантов, местных анестетиков, а также блокаторов калиевых каналов.
Нестероидные противовоспалительные препараты
Если в патогенезе болевого синдрома ведущую роль играют механизмы воспаления, то наиболее целесообразно в этом случае применение НПВП. Их использование позволяет подавить синтез альгогенов в поврежденных тканях, что предотвращает развитие периферической и центральной сенситизации [26]. Помимо болеутоляющего эффекта препараты из группы НПВП оказывают противовоспалительное и жаропонижающее действие.
Современная классификация НПВП предполагает разделение этих средств на несколько групп, отличающихся селективностью в отношении ферментов циклооксигеназы 1 и 2 типа, которые участвуют в ряде физиологических и патологических процессов (рис. 12).
Рис. 12. Селективные и неселективные НПВП.
Считается, что противоболевой эффект препаратов из группы НПВП связан в основном с их влиянием на ЦОГ2, а желудочно-кишечные осложнения обусловлены их влиянием на ЦОГ1. Однако исследования последних лет обнаруживают и другие механизмы анальгетического действия некоторых препаратов из группы НПВП. Так, было показано, что диклофенак (Вольтарен) может оказывать противоболевое действие не только через ЦОГ-зависимые, но и другие периферические, а также центральные механизмы [15].
Местные анестетики
Ограничения поступления ноцицептивной информации в ЦНС можно достичь при применении различных местных анестетиков, которые могут не только предотвратить сенситизацию ноцицептивных нейронов, но и способствовать нормализации микроциркуляции в зоне повреждения, уменьшению воспаления и улучшению обмена веществ. Наряду с этим местные анестетики расслабляют поперечно-полосатую мускулатуру, устраняют патологическое напряжение мышц, которое является дополнительным источником боли [26].
К местным анестетикам относят вещества, вызывающие временную потерю чувствительности тканей в результате блокады проведения импульсов в нервных волокнах. Наибольшее распространение среди них получили лидокаин, новокаин, артикаин и бупивакаин. Механизм действия местных анестетиков связан с блокированием Na + -каналов на мембране нервных волокон и торможением генерации потенциалов действия.
Антиконвульсанты
Длительно существующее раздражение ноцицепторов или периферических нервов приводит к развитию периферической и центральной сенситизации (гипервозбудимости).
Существующие сегодня антиконвульсанты, применяемые для лечения боли, имеют различные точки приложения. Дифенин, карбамазепин, окскарбазепин, ламотриджин, вальпроаты, топиромат действуют главным образом, подавляя активность потенциал-зависимых натриевых каналов, предотвращая спонтанную генерацию эктопических разрядов в поврежденном нерве. Эффективность этих препаратов доказана у пациентов с тригеминальной невралгией, диабетической невропатией, фантомно-болевым синдромом.
Габапентин и прегабалин тормозят вход ионов кальция в пресинаптическую терминаль ноцицепторов, тем самым уменьшая выброс глутамата, что приводит к уменьшению возбудимости ноцицептивных нейронов спинного мозга (уменьшает центральную сенситизацию). Эти препараты также модулируют активность NMDA-рецепторов и снижают активность Na + -каналов.
Антидепрессанты
Антидепрессанты и препараты из группы опиоидов назначают с целью усиления антиноцицептивных влияний. При лечении болевых синдромов в основном используют препараты, механизм действия которых связан с блокадой обратного захвата моноаминов (серотонина и норадреналина) в ЦНС. Обезболивающий эффект антидепрессантов может быть частично обусловлен и непрямым анальгетическим действием, так как улучшение настроения благоприятно сказывается на оценке боли и уменьшает болевое восприятие. Кроме того, антидепрессанты потенцируют действие наркотических анальгетиков, повышая их сродство к опиоидным рецепторам [26].
Мышечные релаксанты
Мышечные релаксанты применяют в случаях, когда вклад в формирование боли вносит мышечный спазм. Следует отметить, что мышечные релаксанты оказывают воздействие на уровне спинного мозга, а не на уровне мышц.
В нашей стране для лечения болезненных мышечных спазмов используются тизанидин, баклофен, мидокалм, а также препараты из группы бензодиазепинов (диазепам). В последнее время с целью расслабления мышц в лечении миофасциальных болевых синдромов применяются инъекции ботулинотоксина типа А [22]. У представленных препаратов - разные точки приложения. Баклофен является агонистом ГАМК-рецепторов, ингибирует активность вставочных нейронов на спинальном уровне.
Толперизон блокирует Na + -и Ca 2+ -каналы интернейронов спинного мозга и уменьшает выброс болевых медиаторов в нейронах спинного мозга. Тизанидин относится к мышечным релаксантам центрального действия. Основная точка приложения его действия находится в спинном мозге. Стимулируя пресинаптические a2-рецепторы, он подавляет высвобождение возбуждающих аминокислот, которые стимулируют рецепторы к N-метил-D-аспартату (NMDA-рецепторы). Вследствие этого на уровне промежуточных нейронов спинного мозга происходит подавление полисинаптической передачи возбуждения. Поскольку именно этот механизм отвечает за избыточный мышечный тонус, то при его подавлении мышечный тонус снижается. В дополнение к миорелаксирующим свойствам, тизанидин оказывает также центральный умеренно выраженный анальгезирующий эффект.
Исходно тизанидин был разработан для лечения мышечного спазма при различных неврологических заболеваниях (при травматических повреждениях головного и спинного мозга, рассеянном склерозе, инсульте). Однако в скором времени после начала его применения были выявлены анальгетические свойства тизанидина. В настоящее время применение тизанидина в монотерапии и в комплексном лечении болевых синдромов получило широкое распространение [11].
Селективные активаторы нейрональных калиевых каналов (SNEPCO)
Принципиально новым классом препаратов для лечения болевых синдромов являются селективные активаторы нейрональных калиевых каналов - SNEPCO (Selective Neuronal Potassium Channel Opener), оказывающие воздействие на процессы сенситизации нейронов заднего рога за счет стабилизации мембранного потенциала покоя.
Первый представитель этого класса лекарственных средств - флупиртин (Катадолон), обладающий широким спектром ценных фармакологических свойств, выгодно отличающих его от других обезболивающих препаратов.
В последующих главах подробно изложены сведения о фармакологических свойствах и механизме действия Катадолона, представлены результаты исследований его эффективности и безопасности, рассказывается об опыте применения препарата в разных странах мира, даны рекомендации по применению Катадолона при различных болевых синдромах.
Местные анестетики
В периферической нервной системе различают афферентную и эфферентную её части. Нервные волокна, которые проводят возбуждение от органов и тканей к центральной нервной системе (ЦНС), называются афферентными, а волокна, проводящие возбуждение от ДНС к органам и тканям - эфферентными.
Вещества, влияющие на афферентную иннервацию
К афферентной иннервации относятся чувствительные нервные окончания и чувствительные нервные волокна. Чувствительные нервные окончания (чувствительные рецепторы) расположены в органах и тканях и способны воспринимать разного рода раздражения. Существуют болевые рецепторы, температурные рецепторы, рецепторы осязания (тактильные), обоняния, вкуса.
Глава 5. Вещества, угнетающие чувствительные нервные окончания или препятствующие действию на них раздражающих средств
К веществам, снижающим чувствительность окончаний афферентных волокон, относятся местные анестетики, а к веществам, препятствующим действию на них раздражающих средств, вяжущие и адсорбирующие средства.
Местные анестетики
Местные анестетики - вещества, которые способны временно, обратимо блокировать чувствительные рецепторы. В первую очередь блокируются болевые рецепторы, а затем - обонятельные, вкусовые, температурные и тактильные.
Кроме того, местные анестетики нарушают проведение возбуждения по нервным волокнам. Прежде всего нарушается проведение по чувствительным нервным волокнам. В более высоких концентрациях местные анестетики способны блокировать и двигательные волокна.
Механизм действия местных анестетиков обусловлен блокадой Na + -каналов в мембранах нервных волокон. В связи с блокадой Na + -каналов нарушаются процессы деполяризации мембраны нервных волокон, возникновение и распространение потенциалов действия.
Места связывания местных анестетиков находятся в цитоплазматической части Na + -каналов. Местные анестетики - слабые основания. Неионизированная (непротонированная) часть молекул вещества проникает внутрь нервных волокон и воздействует на цитоплазматическую часть Na + -каналов. В кислой среде местные анестетики значительно ионизируются и не проникают в нервные волокна. Поэтому в кислой среде, в частности при воспалении тканей, действие местных анестетиков ослабляется.
По химической структуре местные анестетики представлены амидами или эфирами.
Амиды (лидокаин, тримекаин, бупивакаин, мепивакаин, артикаин, ропивакаин) метаболизируются в печени под влиянием изоэнзимов цитохрома Р450 (оксидазы смешанных функций).
Эфиры(прокаин, тетракаин, кокаин) гидролизуются холинэстеразой плазмы крови, и поэтому более пригодны в качестве местных анестетиков у больных с заболеваниями печени.
Местные анестетики оказывают угнетающее влияние на сократимость миокарда, расширяют кровеносные сосуды (прямое действие, связанное с блокадой Na + -каналов, а также угнетающее влияние на симпатическую иннервацию), снижают артериальное давление.
Исключение составляет кокаин, который усиливает и учащает сокращения сердца, суживает сосуды, повышает артериальное давление.
При резорбтивном действии местных анестетиков может проявиться их влияние на центральную нервную систему. В этом случае местные анестетики могут вызывать головокружение, головную боль, тошноту, мелькание «мушек» перед глазами, шум в ушах, сонливость, эйфорию, беспокойство. В тяжёлых случаях возможны тремор, клоникотонические судороги, падение артериального давления, сердечные аритмии, угнетение дыхания, потеря сознания. При судорогах внутривенно вводят диазепам, для повышения артериального давления - эфедрин.
Наиболее ценным свойством местных анестетиков является их способность блокировать болевые рецепторы и чувствительные нервные волокна. В связи с этим их используют для местного обезболивания (местной анестезии) при хирургических операциях и болезненных диагностических манипуляциях.
Виды анестезии. Поверхностная анестезия (терминальная, аппликационная анестезия) - в основном анестезия слизистых оболочек (глаз, носа, носоглотки и т. д.). При нанесении анестетика на слизистую оболочку она утрачивает чувствительность, так как анестетик блокирует чувствительные нервные окончания (терминали) в слизистой оболочке.
Поверхностную анестезию используют в глазной практике (например, при удалении инородных частиц из роговицы), в отоларингологии (при операциях на слизистой оболочке носа, носоглотки), а также при интубации, введении бронхоскопов, эзофагоскопов и др.
Местные анестетики применяют в виде растворов, мазей, кремов, гелей.
При нанесении местных анестетиков на слизистые оболочки возможно частичное всасывание веществ и проявление их резорбтивного токсического действия. Для уменьшения всасывания анестетиков к их растворам добавляют сосудосуживающие вещества, например адреналин (эпинефрин).
Предупреждение всасывания анестетиков не только уменьшает их токсичность, но и удлиняет их действие.
В офтальмологии для анестезии конъюнктивы, роговицы (например, при удалении инородной частицы) применяют растворы тетракаина (0,3 %), лидокаина (2-4 %), бумекаина (0,5 %).
Для анестезии слизистой оболочки носа используют растворы тетракаина (0,5 %), лидокаина (2-4 %), бумекаина (1-2 %).
Для анестезии слизистой оболочки полости рта, носоглотки, гортани, дыхательных путей, пищевода, прямой кишки, мочевыводящих путей, влагалища применяют растворы лидокаина (2 %) или бумекаина (0,5-2 %).
Проводниковая анестезия (регионарная анестезия). Если раствор местного анестетика ввести в ткань, окружающую нерв, который содержит чувствительные волокна, то в месте введения анестетика происходит блокада чувствительных нервных волокон. В связи с этим вся область, иннервируемая данным нервом, утрачивает чувствительность. Такой вид местного обезболивания носит название проводниковой анестезии (блокада нервных проводников).
Так как при этом виде анестезии местный анестетик вводится в ткани и частично попадает в общий кровоток, возможно его резорбтивное действие. Поэтому для проводниковой анестезии нельзя использовать токсичные анестетики (например, тетракаин). Для уменьшения всасывания и удлинения действия местных анестетиков к их растворам добавляют сосудосуживающие вещества (адреналин и др.). Проводниковую анестезию используют для проведения хирургических операций на конечностях, в зубоврачебной практике и т. п.
Для проводниковой анестезии применяют 1-2 % растворы прокаина, лидокаина, тримекаина, а также растворы артикаина (2 %), бупивакаина (0,25-0,5 %).
Разновидностью проводниковой анестезии является эпидуральная анестезия. Раствор анестетика вводят в эпидуральное пространство (между твёрдой мозговой оболочкой и внутренней поверхностью спинномозгового канала). При этом происходит блокада чувствительных волокон корешков спинномозговых нервов. Эпидуральную анестезию используют при операциях на нижних конечностях, органах малого таза. В частности, эпидуральную анестезию применяют при кесаревом сечении.
Для эпидуральной анестезии используют растворы лидокаина (2 %), тримекаина (2 %), бупивакаина (0,5-0,75 %), ропивакаина (0,75 %).
Субарахноидальная анестезия (спинальная анестезия, спинномозговая анестезия). Раствор анестетика вводят в спинномозговую жидкость на уровне поясничного отдела спинного мозга. При этом происходит блокада чувствительных волокон, поступающих в пояснично-крестцовый отдел спинного мозга, и развивается анестезия нижних конечностей и нижней половины туловища, включая и внутренние органы. Субарахноидальная анестезия используется обычно при операциях на органах малого таза и нижних конечностях.
Для субарахноидальной анестезии применяют растворы лидокаина (5 %), тримекаина (5 %), бупивакаина (0,5 %).
Инфильтрационная анестезия. Раствор местного анестетика невысокой концентрации (0,25-0,5 %), но в больших количествах (200-500 мл) под давлением вводят в ткани: кожу, подкожную клетчатку, мышцы, ткани внутренних органов. Происходит «пропитывание» (инфильтрирование) тканей раствором анестетика. При этом блокируются чувствительные нервные окончания и чувствительные нервные волокна, которые находятся в зоне действия анестетика.
Инфильтрационную анестезию используют при хирургических операциях, в том числе при операциях на внутренних органах. Так же, как и для проводниковой анестезии, для инфильтрационной анестезии нельзя использовать токсичные анестетики, так как они попадают в общий кровоток и могут оказывать резорбтивное токсическое действие.
Растворяют анестетики для инфильтрационной анестезии обычно в гипотоническом (0,6 %) или изотоническом (0,9 %) растворах натрия хлорида. Для уменьшения всасывания анестетиков и удлинения их действия к их растворам обычно добавляют адреналин (эпинефрин).
Для инфильтрационной анестезии используют растворы прокаина (0,25-0,5 %), лидокаина (0,5 %), тримекаина (0,125-0,25 %), бупивакаина (0,25 %).
Разумеется, для проводниковой, спинномозговой и инфильтрационной анестезий используют только стерильные растворы анестетиков.
Для поверхностной анестезии применяют кокаин, тетракаин, бензокаин, проксиметакаин, оксибупрокаин, бумекаин, мепивакаин.
Кокаин (Cocaine) - алкалоид кустарника Erythroxylon Соса, произрастающего в Южной Америке, был первым местноанестезирующим средством. Растворы кокаина иногда применяют для поверхностной анестезии. Однако в настоящее время кокаин в значительной степени вытеснен более активными и менее токсичными анестетиками.
Кокаин нарушает обратный нейрональный захват норадреналина в норадренергических синапсах. Это ведёт к активации норадренергической передачи возбуждения. В дофаминергических синапсах кокаин нарушает обратный нейрональный захват дофамина. Со стимуляцией дофаминергических синапсов в ЦНС связывают эйфорию, вызываемую кокаином.
Резорбтивное действие кокаина проявляется в возбуждении ЦНС. Способность кокаина возбуждать ЦНС, повышать настроение, вызывать ощущение бодрости, прилива сил оказалась причиной злоупотребления этим веществом. При систематическом приёме кокаина у человека возникает сильная потребность к повторному применению препарата, тогда как при его отсутствии появляется ощущение вялости, разбитости, резко снижается настроение, то есть развивается лекарственная зависимость (кокаинизм).
Периферическое действие кокаина проявляется активацией влияний симпатической (норадренергической) иннервации: повышаются частота и сила сокращений сердца; суживаются кровеносные сосуды; повышается артериальное давление. В больших дозах кокаин вызывает тремор, судороги, гиперпирексию; возбуждающее действие сменяется угнетением ЦНС (смерть при отравлении кокаином наступает вследствие паралича дыхательного центра).
Тетракаин (Tetracaine; дикаин) - активный и токсичный местный анестетик. В связи с высокой токсичностью тетракаин используют в основном для поверхностной анестезии: анестезии слизистых оболочек глаз (0,3 %), носа и носоглотки (0,5-1 %). Высшая разовая доза тетракаина при анестезии верхних дыхательных путей - 3 мл 3 % раствора. Длительность действия тетракаина 2-3 ч.
При передозировке препарата, даже при местном применении, тетракаин может всасываться через слизистые оболочки и оказывать резорбтивное токсическое действие. При этом развивается возбуждение ЦНС, которое в тяжёлых случаях сменяется её параличом; смерть наступает от паралича дыхательного центра. Для уменьшения всасывания тетракаина к его растворам добавляют адреналин (эпинефрин).
Бензокаин (Benzocaine; анестезин), в отличие от других местных анестетиков, мало растворим в воде; растворим в спирте, жирных маслах. В связи с этим применяют бензокаин исключительно для поверхностной анестезии в масляных растворах (например, при остром воспалении среднего уха, болях в области наружного слухового прохода), мазях, пастах (5 %), присыпках (например, при кожных заболеваниях, сопровождающихся сильным зудом), ректальных суппозиториях и масляных растворах при поражениях прямой кишки (геморрой, трещины). Внутрь бензокаин назначают при повышенной чувствительности пищевода, болях в желудке, рвоте.
Проксиметакаин (Proxymetacaine) и оксибупрокаин(Oxybuprocaine; инокаин) используют в офтальмологии для проведения кратковременных манипуляций (анестезия конъюнктивы, анестезия роговицы при определении внутриглазного давления, удалении инородных частиц).
Бумекаин (Bumecaine; пиромекаин) применяют в качестве местного анестетика в офтальмологии (0,5 % раствор), а также для поверхностной анестезии слизистой оболочки полости рта (1-2 % растворы), носа, носоглотки, гортани, пищевода, прямой кишки, дыхательных и мочевыводящих путей. В стоматологии применяют также 5 % мазь бумекаина.
Мепивакаин (Mepivacaine) применяют местно в стоматологии, а также для анестезии при интубации трахеи, бронхоскопии, эзофагоскопии, тонзиллэктомии.
Для проводниковой и инфильтрационной анестезии применяют прокаин, бупивакаин, артикаин.
Прокаин(Procaine; новокаин) - активный анестетик, действие которого продолжается 30-60 мин (гидролизуется холинэстеразой плазмы крови). Препарат хорошо растворим в воде и стерилизуется обычными методами. При определенных мерах предосторожности (добавление раствора адреналина, соблюдение дозировки) токсичность прокаина невелика.
Растворы прокаина применяют для инфильтрационной (0,25-0,5 %), проводниковой и эпидуральной (1-2 %) анестезии. Чтобы предупредить всасывание прокаина, к его растворам добавляют 0,1 % раствор адреналина (эпинефрин). Иногда прокаин используют для спинномозговой анестезии (5 %), а в высоких концентрациях (10 %) - для поверхностной анестезии.
Бупивакаин(Bupivacaine; маркаин) - один из наиболее активных и длительно действующих местных анестетиков амидного типа. Для действия бупивакаина характерен латентный период (до 20 мин). При инфильтрационной анестезии используют 0,25 % раствор, для проводниковой анестезии - 0,25-0,5 % растворы, для эпидуральной анестезии - 0,75 % раствор, а для спинальной анестезии - 0,5 %. Длительность эпидуральной или спинальной анестезии 3-4 ч.
Резорбтивное действие бупивакаина может проявляться такими симптомами, как головная боль, головокружение, нарушение зрения, тошнота, рвота, желудочковые тахиаритмии, атриовентрикулярный блок.
Артикаин (Articain; ультракаин) - местный анестетик амидного типа. Применяется при инфильтрационной, проводниковой, эпидуральной и субарахноидальной анестезиях; действует 1-2 ч.
Ропивакаин(Ropivacain; наропин) - амид. Применяют в основном для эпидуральной анестезии (в частности, при кесаревом сечении, для купирования острого болевого синдрома), а также для проводниковой и субарахноидальной анестезий. Ропивакаин отличается длительностью действия; при эпидуральной анестезии обезболивающий эффект сохраняется 6-12 ч.
Для всех видов анестезииприменяют лидокаин(Lidocaine; ксикаин, ксилокаин) - местный анестетик амидного типа. В виде глазных капель используют 2 и 4 % растворы лидокаина. Для поверхностной анестезии слизистой оболочки полости рта, носоглотки, гортани, пищевода, прямой кишки, дыхательных и мочевыводящих путей используют 1-2 % растворы, для инфильтрационной анестезии - 0,25-0,5 %, для проводниковой анестезии - 1-2 %, для эпидуральной анестезии - 2 % раствор, для спинальной анестезии - 5 %. В стоматологии, отоларингологии, а также при эндоскопии используют 10 % дозированный аэрозоль лидокаина, который распыляют на слизистые оболочки.
Токсичность лидокаина несколько выше, чем прокаина, особенно при его применении в высоких концентрациях (1-2 %). Для уменьшения резорбтивного действия лидокаина к его растворам добавляют адреналин (эпинефрин).
Лидокаин применяют также как противоаритмическое средство[1].
Тримекаин(Trimecaine) по химической структуре, показаниям к применению и применяемым концентрациям растворов сходен с лидокаином. Действует более продолжительно.
Кроме указанных препаратов для местной анестезии применяют этилхлорид(Ethyl chloride; хлорэтил) - летучую жидкость, выпускаемую в ампулах. При нанесении на кожу этилхлорид быстро испаряется. При этом происходят охлаждение тканей и утрата чувствительности.
Применяют этилхлорид для обезболивания при малых операциях на коже, при ушибах, растяжениях связок, сухожилий (например, во время спортивных соревнований), при невритах, радикулитах.
Быстрая последовательная индукция и интубация
Быстрая последовательная индукция (БПИ, англ. «rapid sequential induction» — RSI) и интубация — анестезиологическая техника, которая применяется у пациентов с высоким риском аспирации желудочного содержимого. Цель данной техники — снижение риска аспирации путем максимального уменьшения времени манипуляции, когда дыхательные пути не защищены (от начала индукции до постановки эндотрахеальной трубки (ЭТТ)). Сама концепция БПИ родилась после введения в клиническую практику сукцинилхолина в 1951 году и приема Селлика в 1961 году. Первая публикация, включающая все основные приемы техники БПИ, появилась в 1970 году.
Традиционные компоненты БПИ:
- преоксигенация;
- быстрое введение начальной дозы тиопентала натрия;
- введение сукцинилхолина;
- осуществление давления на перстневидный хрящ (прием Селлика);
- отказ от вентиляции с положительным давлением до постановки ЭТТ.
После появления новых лекарственных средств и улучшения технического обеспечения современная техника БПИ в анестезиологии претерпела некоторые изменения. Стоит отметить, что у новорожденных данная техника не применяется, т. к. для подготовки к оперативному вмешательству данного контингента пациентов используется совершенно иной подход (концепция мультимодальной анальгезии). Современная БПИ проводится по схеме-правилу «7П»: подготовка, преоксигенация, премедикация, плегия, протекция, положение трубки, постинтубационное ведение (рис. 1).
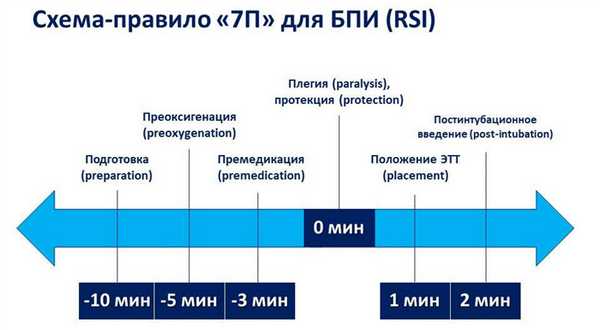
Рисунок 1 | Правило «7П»
Преоксигенация
Первым этапом БПИ является преоксигенация пациента. Целью данного этапа является удаление азота из функционально мертвого пространства и замещение его кислородом, что увеличивает кислородный резерв пациента на период апноэ. Беременные, тучные пациенты, дети, а также пациенты с заболеваниями, вызывающими растяжение кишечника, имеют меньший кислородный резерв, в результате чего снижение SpO2 протекает быстрее.
Варианты преоксигенации:
А. 3-5 минут дыхания 100 % кислородом;
Б. 4 максимально глубоких вдоха в течение 30 секунд;
В. 8 максимально глубоких вдоха в течение 60 секунд.
По возможности должен использоваться вариант А, но при необходимости сокращения времени до интубации возможно использование вариантов Б и В (данные режимы менее эффективны у пожилых пациентов).
Стоит отметить, что в последние годы появилось несколько новых способов преоксигенации, которые проводятся с помощью носовых или носоглоточных канюль, один из них — трансназальная быстрая инсуфляция увлажненным кислородом (THRIVE).
Давление на перстневидный хрящ
Барри Селлик в 1961 году предложил применять давление на перстневидный хрящ для уменьшения риска аспирации желудочного содержимого. Данная техника сразу же была принята, т. к. другой альтернативы на тот момент не было. Селлик предлагал использовать давление силой около 44 Ньютонов (Н), или 4,45 кг. Однако оказалось, что правильное анатомическое использование перстневидного давления выполнить намного сложнее, чем ожидалось. После проведения ряда исследований данные об эффективности и целесообразности данного маневра остаются противоречивыми.
На данный момент рекомендуется давление 10 Н/1 кг для пациентов в сознании и 30 Н/3 кг для пациентов без сознания. Но такое действие указано не как способ защиты от аспирации, а в качестве внешнего воздействия на гортань при трудной интубации трахеи для облегчения визуализации — «BURP»-прием (англ. «back, upward, right lateral, pressure» — назад, вверх, вправо, надавите).
В период апноэ желательно использование мягкой масочной вентиляции: данная манипуляция вряд ли повысит риск аспирации, именно поэтому она была рекомендована в недавних гайдлайнах Общества трудных дыхательных путей (DAS). При адекватном давлении на перстневидный хрящ и использовании низких значений положительного давления на вдохе (PIP) раздувания желудка не произойдет. По сравнению с описанной выше техникой, использование масочной вентиляции только после снижения сатурации увеличивает риск раздувания желудка и предикторов срыгивания. Некоторое количество исследований продемонстрировало успешное использование разных типов ларингеальных масок, таких как LMA Classic. Также по результатам исследований рекомендуется вентиляция маской с ограничением по давлению на вдохе Pmax 20 см вод. ст.; интубация должна проводится оротрахеально (ЭТТ № 7,0-8,0). Однако не упоминалось, что желательно использовать ларингеальные маски второго поколения, с портом для желудочного зонда.
Премедикация
Премедикация проводится с целью предотвращения рефлекторной симпатической реакции на ларингоскопию (RSRL), проявляющейся повышением внутричерепного давления (ВЧД), внутриглазного давления (ВГД), развитием кашля и ларингоспазма, тахикардии и артериальной гипертензии. Ларингоскопия и интубация трахеи вызывают рефлекторную симпатическую стимуляцию и связаны с повышенным уровнем катехоламинов.
Есть некоторые анатомо-физиологические особенности, о которых хотелось бы напомнить. Учитывая сложную иннервацию гортани, рефлекторная вегетативная реакция на интубацию у взрослых и детей может различаться. Подробно процесс интубации трахеи будет описан ниже. У взрослых интубация трахеи изогнутым клинком Макинтоша часто сопровождается активацией симпатической ВНС. Связано это с тем, что фарингеальная часть надгортанника, включая грушевидную ямку, иннервируется ветвями языкоглоточного нерва. У детей интубация трахеи прямым клинком Миллера чаще всего сопровождается активацией парасимпатического отдела ВНС, что связано с непосредственным соприкосновением клинка с надгортанником, иннервирующимся ветвями блуждающего нерва. Поэтому в педиатрической практике частым осложнением интубации трахеи является рефлекторная остановка сердца или бронхоспазм. Во избежание RSRL возможно применение следующих лекарственных средств (общепринятый акроним LOAD претерпел некоторые изменения, лидокаин уступил лидирующее место фентанилу):
- фентанил — 2-5 мкг/кг — улучшает условия для интубации, предотвращая выброс катехоламинов в кровь, также можно использовать ремифентанил и альфентанил;
- атропин — 0,02 мг/кг в/в (минимально 0,1 мг), гликопирролат — 0,005 мг/кг в/в для детей и 0,2-0,4 мг в/в для взрослых (прим. редактора — в отличие от детей, у взрослых атропин не является неотъемлемой частью премедикации; абсолютным показанием для назначения на данный момент остается гемодинамически значимая брадикардия, относительным показанием может, например, быть использование кетамина в качестве гипнотика);
- лидокаин — 1,5 мг/кг в/в — уменьшает бронхоспазм и препятствует быстрому повышению ВЧД;
- прекураризация — введение дефасцикуляционной дозы недеполяризующих миорелаксантов (1/20 дозы для интубации или 1/10 ЕД95*).
*ЕД95 — «эффективная доза» — доза МР, которая необходима для 95 % подавления сократительной реакции отводящей мышцы большого пальца в ответ на раздражение локтевого нерва.
У новорожденных детей премедикация может не выполняться, т. к. часто такие пациенты уже находятся на ИВЛ (возможно с рождения) и медикаментозно седатированы. В случае необходимости премедикация может включать в себя в/в введение опиоидов (1-5 мкг/кг), атропина (0,01 мг/кг) для снижения длительности и количества попыток интубации трахеи.
Внутривенные анестетики для БПИ
Следующим этапом является введение внутривенных анестетиков. После введения индукционного агента необходимо осуществлять непрерывное давление на перстневидный хрящ до постановки эндотрахеальной трубки.
На сегодняшний момент для БПИ применяются следующие внутривенные анестетики:
Индукция с помощью ингаляционных анестетиков
Индукция ингаляционными препаратами чаще всего проводится у детей. Одним из наилучших средств является севофлуран. Также существуют показания для проведения последовательной индукции ингаляционными анестетиками и во взрослой практике:
- трахеостомическая или эндотрахеальная канюли;
- тяжелая дисфункция печени и/или почек;
- деформация верхних дыхательных путей;
- короткая шея;
- морбидное ожирение.
Одним из основных параметров при проведении индукции ингаляционными препаратами является минимальная альвеолярная концентрация (МАК) — концентрация анестетика, при которой 50 % пациентов не реагируют на разрез кожи.
Таблица 1 | Значения МАК севофлурана для взрослых и детей с учетом возраста
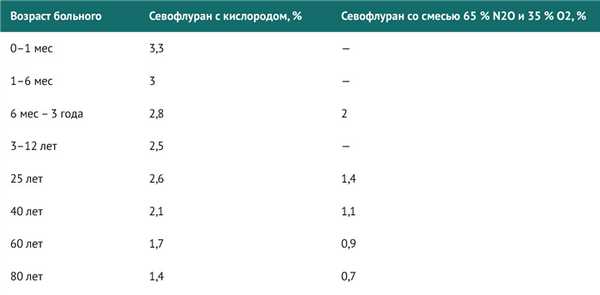
С возрастом МАК снижается. Средняя концентрация севофлурана, обеспечивающая МАК для пациента в возрасте 80 лет, составляет примерно 50 % от таковой у 20-летнего пациента.
У новорожденных для индукции, как правило, используется диазепам 0,5 мг/кг в/в; фентанил 5 мкг/кг; атракурия безилат 0,6 мг/кг.
Нейромышечная блокада
Наиболее часто для нейромышечной блокады используется деполяризующий миорелаксант короткого действия суксаметоний, однако при наличии противопоказаний к нему могут использоваться недеполяризующие миорелаксанты. В последнее время в качестве альтернативы рассматривается недеполяризующий миорелаксант — рокуроний, который в высоких дозах показал такое же время до начала действия и условия интубации, как и суксаметоний.
Суксаметония хлорид (Листенон®) или суксаметония йодид (Дитилин®)
Стандартная доза суксаметония для интубации — 1 мг/кг в/в, при проведении прекураризации доза суксаметония увеличивается до 1,5 мг/кг в/в.
Суксаметоний имеет ряд побочных эффектов, вот некоторые из них:
- Аритмии: суксаметоний может вызывать синусовую брадикардию, АВ-узловые ритмы, в редких случаях — асистолию, а также катехоламин-индуцированные аритмии.
- Гиперкалиемия: введение суксаметония в стандартных дозах вызывает увеличение уровня калия в плазме на 0,5 ммоль/л.
- Повышение ВГД.
- Повышение ВЧД.
- Повышение внутрижелудочного давления и давления нижнего пищеводного сфинктера — в совокупности риск регургитации не увеличивается.
- Злокачественная гипертермия.
Ввиду вышеперечисленных побочных реакций суксаметоний противопоказан при:
- гиперкалиемии;
- ожогах более 10 % поверхности тела;
- массивных повреждениях мягких тканей;
- повреждениях спинного мозга и черепно-мозговых травмах (ЧМТ);
- повреждениях периферических нервов;
- нейромышечных заболеваниях;
- абдоминальном сепсисе;
- злокачественной гипертермии.
Частота некоторых побочных эффектов может быть снижена проведением премедикации и прекураризации. У детей применение суксаметония ограничено ввиду быстрого развития гиперкалиемии, ацидоза, возможности наличия нераспознанного нейромышечного заболевания и, крайне редко, рабдомиолиза.
Проблемы, наиболее часто ассоциированные с применением лекарственных средств данной группы:
- влияние на гемодинамику (снижение артериального давления);
- стимуляция высвобождения гистамина;
- аккумуляция препарата в организме у пациентов с нарушениями функции почек и/или печени.
Рокурония бромид (Эсмерон®)
Доза для интубации — 0,6 мг/кг в/в, при применении для БПИ — 1,2 мг/кг в/в. Начало действия 60-90 секунд, длительность 30-40 минут.
Атракурия безилат (Тракриум®)
Доза для интубации — 0,5-0,6 мг/кг в/в. Начало действия 60-90 секунд, длительность 15-35 минут.
У новорожденных детей используются: пипекурония бромид 10-20 мкг/кг/час; атракурия безилат 0,3-0,6 мг/кг/час; рокурония бромид 0,3-0,6 мг/кг/час.
Интубация трахеи
Стандартной техникой, рекомендованной для интубации, является прямая ларингоскопия. Во взрослой практике для интубации чаще всего используется ларингоскопы с клинками Макинтоша (изогнутые), в неонатальной практике пользуются клинками Миллера (прямые), в педиатрической практике используют и те, и другие в зависимости от возраста и предпочтений врача. У взрослых и новорожденных практически всегда используется оротрахеальная интубация. В педиатрической практике предпочитают назотрахеальную интубацию, для которой дополнительно необходимо использование щипцов Мейнджила.
ЭТТ тоже различаются по своей форме и структуре. Существуют армированные ЭТТ (не изменяет внутреннего просвета при любом сгибании), с заранее сформированным полярным изгибом (так называемые «северные» и «южные»), двухпросветные интубационные трубки (Карленса для левого бронха, Уайта для правого бронха) и т. п. Взрослые и педиатрические ЭТТ имеют на дистальном конце манжету для раздувания, для новорожденных следует применять ЭТТ без манжеты (т. к. при раздувании манжеты чрезвычайно большой риск повреждения трахеи).
Размеры эндотрахеальной трубки для взрослых пациентов варьируют от 6,5 до 9,5; для детей рассчитывается по формуле:
Глубина постановки ЭТТ у мужчин — 22-24 см, у женщин — 20-22 см, для детей рассчитывается по формуле: глубина (см) = 12 + возраст (в годах)/2. Для назотрахеальной интубации глубина постановки ЭТТ (см) = 15 + возраст (в годах)/2.
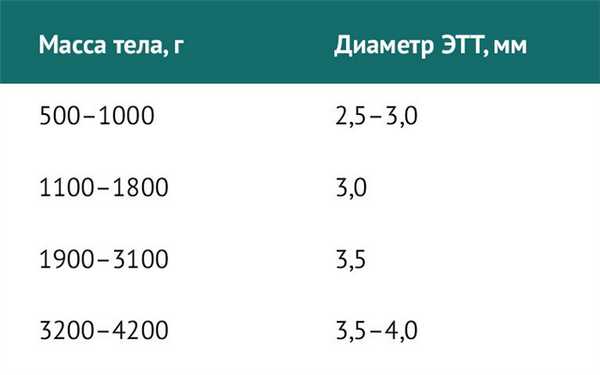
Для новорожденных детей существуют отдельные требования. Диаметр ЭТТ в зависимости от массы тела при рождении представлен в таблице 2.
Таблица 2 | Диаметр ЭТТ у новорожденных детей в зависимости от массы тела
Глубина постановки ЭТТ у новорожденных вычисляется по формуле: масса тела (кг) + 6 см.
Перед интубацией рекомендуется привести пациента в положение «принюхивания» (кроме того существуют классическое джексоновское положение, улучшенное положение Джексона и т. п. при отсутствии признаков повреждения шейного отдела позвоночника). Интубация должна быть проведена максимально быстро.
Верификация положения ЭТТ
Важно убедиться, что ЭТТ не находится в пищеводе и не опустилась в один из главных бронхов. С этой целью возможно использования правила DOPE:
- Displaced in Right mainstem bronchus or esophageus (смещение ЭТТ в правый главный бронх или пищевод);
- Obstruction (обструкция ЭТТ — перекручивание, закусывание);
- Pneumothorax (пневмоторакс);
- Equipment problem or in Esophagus (проблемы с оборудованием или ЭТТ в пищеводе).
Существует множество методов, которыми необходимо пользоваться для верификации положения ЭТТ.
Механизмы действия и виды анестетиков

Анестетики разделяют на:
- Местные
- Общие:
а) ингаляционные - летучие жидкости и газы
б) неингаляционные (внутривенные)

Таблица 1
1. Местные анестетики
Местные анестетики обратимо снижают возбудимость чувствительных нервных окончаний и блокируют проведение афферентных импульсов в нервных стволах в зоне непосредственного применения, используются для устранения боли.
Первый препарат этой группы — кокаин, был выделен в 1860 г. Альбертом Ньюманом из листьев южноамериканского кустарника Erythroxylon coca. Ньюман, как многие химики прошлого, попробовал новое вещество на вкус и отметил онемение языка. Профессор Военно-медицинской академии Санкт-Петербурга Василий Константинович Анреп в 1879г. подтвердил способность кокаина вызывать анестезию. В экспериментах на лягушках он обнаружил, что кокаин влияет «парализующим образом» на окончания чувствительных нервов. В. К. Анреп исследовал действие кокаина на себе: инъекция кокаина в дозе 1 — 5 мг под кожу сопровождалась полной анестезией — укол булавкой, прижигание тлеющей спичкой не вызывали боли. Аналогичный эффект наблюдался при закапывании раствора кокаина в глаз и нанесении его на слизистую оболочку языка.
Местные анестетики классифицируют на сложные эфиры (анестезин, дикаин, новокаин) и замещенные амиды (лидокаин, тримекаин, бупивакаин). Местные анестетики — сложные эфиры подвергаются гидролизу псевдохолинэстеразой крови и действуют в течение 30 — 60 мин. Их эффект пролонгируют антихолинэстеразные средства (прозерин). Продукт гидролиза — n-амино-бензойная кислота ослабляет бактериостатическое влияние сульфаниламидов. Замещенные амиды кислот инактивируются монооксигеназной системой печени в течение 2 — 3 ч. Бупивакин вызывает местную анестезию продолжительностью 3 — 6 ч, после ее прекращения длительно сохраняется анальгетический эффект.
С точки зрения практического применения анестетики подразделяют на следующие группы:
- Средства, применяемые для поверхностной (терминальной) анестезии: Кокаин, Дикаин, Анестезин, Пиромекаин
- Средства, применяемые преимущественно для инфильтрационной и проводниковой анестезии: Новокаин, Бупивакаин
- Средства, применяемые для всех видов анестезии: Лидокаин, Тримекаин
Механизм действия
Местные анестетики представляют собой третичные азотистые основания. Они состоят из гидрофильной и липофильной частей, соединенных эфирной или амидной связями. Механизм действия определяет липофильная часть, имеющая ароматическую структуру. Для нанесения на слизистые оболочки и кожу и парентерального введения применяют водные растворы хлористоводородных солей местных анестетиков. В слабощелочной среде тканей (рН=7,4) соли гидролизуются с освобождением оснований. Основания местных анестетиков растворяются в липидах мембран нервных окончаний и стволов, проникают к внутренней поверхности мембраны, где превращаются в ионизированную катионную форму.
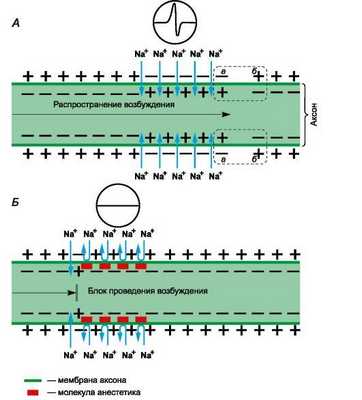
Рисунок 1 | Механизм действия местных анестетиков
Рецепторы для местных анестетиков локализованы в S6-сегменте IV домена внутриклеточной части натриевых каналов. Связываясь с рецепторами, катионы местных анестетиков пролонгируют инактивированное состояние натриевых каналов, что задерживает развитие следующего потенциала действия. Местные анестетики не взаимодействуют с закрытыми каналами в период потенциала покоя. Таким образом, в зоне нанесения местных анестетиков не развиваются потенциалы действия, что сопровождается блоком проведения нервных импульсов. Избирательное влияние местных анестетиков на чувствительные афферентные нервы обусловлено генерацией в них длительных (более 5 мс) потенциалов действия с высокой частотой.
В первую очередь местные анестетики блокируют безмиелиновые С и миелиновые Аδ и Аβ волокна (афферентные пути, проводящие болевые и температурные раздражения; вегетативные нервы). На волокна, окруженные миелиновой оболочкой, местные анестетики действуют в области перехватов Ранвье. Толстые миелиновые волокна (афферентные пути, проводящие тактильные раздражения; двигательные нервы) слабее реагируют на местные анестетики. Кроме того, устойчивость двигательных нервов к анестезии обусловлена низкочастотными короткими (менее 5 мс) потенциалами действия. В очаге воспаления в условиях ацидоза нарушаются диссоциация хлористоводородных солей местных анестетиков и образование их свободных липидорастворимых оснований, поэтому обезболивающее влияние утрачивается. Например, местная анестезия может оказаться неэффективной при удалении зуба в случае тяжелого периодонтита.
2. Общие анестетики
2.1. Ингаляционные анестетики
2.1.1 Летучие жидкости
Теории механизма действия общих анестетиков
Эффекты ингаляционных анестетиков не могут быть объяснены одним молекулярным механизмом. Скорее всего многокомпонентное действие каждого анестетика реализуется через множество мишеней. Тем не менее, эти эффекты сходятся на ограниченном числе изменений, лежащих в основе физиологических эффектов. На данный момент существуют липидная и белковая теории анестезии, но ни одна из них пока не описывает последовательность событий, происходящих от взаимодействия молекулы анестетика и ее мишеней до физиологических эффектов.

Рисунок 2 | Ингаляционные анестетики
Активность ингаляционных анестетиков оценивают по минимальной альвеолярной концентрации (МАК). Доза, создающая 1 МАК, предотвращает у половины пациентов движения в ответ на хирургическое вмешательство. Сила общих анестетиков коррелирует с их растворимостью в жирах, что говорит о важности взаимодействия с гидрофильными мишенями. В частности, обнаружение связи между силой анестетика и его липофильностью (правило Мейер-Овертона) дало начало липидной теории механизма действия анестетиков. Липидная теория анестезии утверждает, что анестетики растворяются в двойном липидном слое биологических мембран и вызывают анестезию, достигая критической концентрации в мембране. Наиболее усложненные версии липидной теории требуют, чтобы молекулы анестетиков вызывали пертурбацию (изменение свойств) мембраны.

Рисунок 3 | Правило Мейер-Овертона

Рисунок 4 | В 20 веке было показано, что сила общих анестетиков коррелируют с их способностью ингибировать активность растворимого фермента люциферазы, который физиологически не является мишенью анестетиков, но служит в качестве безлипидной модели белковой молекулы для связывания анестетика.
Современные факты позволяют утверждать, что белки в большей степени, чем липиды, являются молекулярными мишенями для действия анестетиков. Взаимодействие анестетиков с гидрофобными участками белков также объясняет правило Мейер-Овертона. Прямое взаимодействие молекул анестетиков с белками позволяет объяснить исключения из этого правила, так как любые участки связи с белком определяются как размером и формой молекулы, так и растворимостью. Многочисленные физические методы (рентгенодифракция, ЯМР-спектроскопия) подтверждают, что общие анестетики действуют путем непосредственного связывания с амфифильными полостями белковых молекул, а размер связанного участка объясняет эффект «обрубания» свойства (более длинные спирты теряют свойства анестетика).
Таким образом, общие анестетики изменяют физико-химические свойства липидов мембран нейронов и нарушают взаимодействие липидов с белками ионных каналов. При этом уменьшается транспорт в нейроны ионов натрия, сохраняется выход менее гидратированных ионов калия, в 1,5 раза возрастает проницаемость хлорных каналов, управляемых ГАМК-А рецепторами. Итогом этих эффектов становится гиперполяризация с усилением процессов торможения. Общие анестетики подавляют вход в нейроны ионов кальция, блокируя Н-холинорецепторы и NMDA-рецепторы глутаминовой кислоты; снижают подвижность Са 2+ в мембране, поэтому препятствуют кальций-зависимому выделению возбуждающих нейромедиаторов. Наиболее чувствительны к действию общих анестетиков полисинаптические системы ЦНС — кора больших полушарий (10 13 - 10 14 синапсов), таламус, ретикулярная формация, спинной мозг. К наркозу устойчивы дыхательный и сосудодвигательный центры продолговатого мозга.
Летучие ингаляционные анестетики:
- постсинаптически усиливают тормозящую передачу путем потенциирования лиганд-управляемых ионных каналов, активируемых ГАМК и глицином;
- экстрасинаптиески путем усиления ГАМК-рецепторов и ионных токов утечки;
- пресинаптически за счет повышения базального высвобождения ГАМК.
Ингаляционные анестетики подавляют возбуждающую синаптическую передачу путем снижения высвобождения глутамата и постсинаптически путем ингибирования ионотропных глутаматных рецепторов. Парализующий эффект местных анестетиков включает действие на спинной мозг, в то время как седация/наркоз и амнезия включают супраспинальные механизмы памяти, сна и сознания.
2.1.2. Газовый наркоз
В анестезиологии широко применяют ингаляционный газовый анестетик азота закись (N2O). В конце 1980-х гг. в зарубежную анестезиологическую практику вошел инертный газ ксенон.
Азота закись представляет собой бесцветный газ характерного запаха, хранится в металлических баллонах под давлением 50 атм в жидком состоянии, не горит, но поддерживает горение. Ее смеси с анестетиками группы летучих жидкостей в определенных концентрациях взрывоопасны. В субнаркотических концентрациях (20 — 30 %) азота закись вызывает эйфорию (веселящий газ) и сильную анальгезию. В концентрации 20 % обеспечивает обезболивание в такой же степени, как 15 мг морфина. Закись азота на ГАМК-А рецепторы не влияет. Используется только в комбинациях, так как МАК составляет 104 %.
Инертный газ ксенон считают лучшей альтернативой азота закиси, так как он обладает более выраженным наркозным действием, индифферентностью и экологической безопасностью. Способность ксенона вызвать наркоз была открыта в связи с практикой глубоководных погружений и развитием гипербарической физиологии. Ксенон бесцветен, не горит и не обладает запахом, при соприкосновении со слизистой оболочкой рта создает на языке ощущение горьковатого металлического вкуса. Отличается низкой вязкостью и высокой растворимостью в липидах, выводится легкими в неизмененном виде. Разработана технология ксенонсберегающей анестезии с включением минимального потока и системы рециклинга для повторного многократного использования газа. Такая технология успешно решает важную в практическом отношении проблему дефицита и дороговизны ксенона. В механизме наркозного эффекта ксенона имеют значение блокада циторецепторов возбуждающих нейромедиаторов — Н-холинорецепторов, NMDA-рецепторов глутаминовой кислоты, а также активация рецепторов тормозящего нейромедиатора глицина. При взаимодействии с циторецепторами ксенон выступает как протонсвязывающий кластер и образует комплексы с катионами НСО + , NH2 + , HNCH + . Ксенон проявляет свойства антиоксиданта и иммуностимулятора, снижает выделение гидрокортизона и адреналина из надпочечников.
2.2. Неингаляционные (внутривенные) наркозные средства подразделяют на три группы:
Препараты короткого действия (3 — 5 мин)
- пропанидин (эпонтол, сомбревин)
- пропофол (диприван, рекофол)
Препараты средней продолжительности действия (20 — 30 мин)
- кетамин (калипсол, кеталар, кетанест)
- мидазолам (дормикум, флормидал)
- гексенал (гексобарбитал-натрий)
- тиопентал-натрий (пентотал)
Препараты длительного действия (0,5 — 2 ч)

Рисунок 5 | Общие анестетики для внутривенного введения
Наиболее широко используемым внутривенный анестетиком является пропофол. Его механизм действия связан с увеличение хлорной проводимости ГАМК рецепторов.
Метогекситал по скорости наступления и выхода из наркоза близок к пропофолу.
Барбитураты использовались для анестезии до введения в практику пропофола. Тиопентал вызывает быстрое наступление и быстрый выход из наркоза при разовом введении, но он быстро накапливается при повторном или пролонгированном введении и таким образом замедляет выход из анестезии. Барбитураты являются лигандами барбитуратных рецепторов. В малых дозах они аллостерически усиливают действие ГАМК на ГАМК А-рецепторы . При этом удлиняется открытое состояние хлорных каналов, возрастает вход в нейроны анионов хлора, развиваются гиперполяризация и торможение. В больших дозах барбитураты прямо повышают хлорную проницаемость мембран нейронов. Кроме того, они тормозят высвобождение возбуждающих медиаторов ЦНС — ацетилхолина и глутаминовой кислоты, блокируют АМРА-рецепторы (квисквалатные рецепторы ) глутаминовой кислоты. Барбитураты обладают церебропротективными свойствами и могут быть использованы с такой целью.
Бензодиазепины используются в основном как анксиолитики и для седации с сохранением сознания.Все бензодиазепиновые рецепторы аллостерически усиливают кооперацию ГАМК с ГАМК А-рецепторами, что сопровождается повышением хлорной проводимости нейронов, развитием гиперполяризации и торможения. Реакция с бензодиазепиновыми рецепторами происходит только в присутствии ГАМК. Ремимазолам - самый молодой бензодиазепин, имеет очень короткое время действия из-за быстрой нейтрализации эстеразами плазмы.
Кетамин химически является производным фенциклидина. Синаптические механизмы действия кетамина многообразны. Он является неконкурентным антагонистом возбуждающих медиаторов головного мозга глутаминовой и аспарагиновой кислот в отношении NMDA-рецепторов. Эти рецепторы активируют натриевые, калиевые и кальциевые каналы мембран нейронов. При блокаде рецепторов нарушается деполяризация. Кроме того, кетамин стимулирует освобождение энкефалинов и β-эндорфина; тормозит нейрональный захват серотонина и норадреналина. Последний эффект проявляется тахикардией, ростом АД и внутричерепного давления. Кетамин расширяет бронхи. При выходе из кетаминового наркоза возможны бред, галлюцинации, двигательное возбуждение (эти нежелательные явления предупреждают введением дроперидола или транквилизаторов).Важным терапевтическим эффектом кетамина является нейропротективный. Как известно, в первые минуты гипоксии мозга происходит выброс возбуждающих медиаторов — глутаминовой и аспарагиновой кислот. Последующая активация NMDA-рецепторов, увеличивая во внутриклеточной среде концентрацию ионов натрия и кальция и осмотическое давление, вызывает набухание и гибель нейронов. Кетамин как антагонист NMDA-рецепторов устраняет перегрузку нейронов ионами и связанный с этим неврологический дефицит.
Самым новым внутривенным анестетиком является дексмедетомидин. Это высокоселективный агонист а2-адренорецепторов с седативными, симпатолитическими, снотворными и анальгетическими эффектами. Его основное действие - в качестве агониста на а2 рецепторы в голубом пятне.
Читайте также:
