Диагностика аномального дренажа легочных вен. Лечение аномального дренажа легочных вен.
Добавил пользователь Morpheus Обновлено: 28.01.2026
ФГБУ "Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
ФГБУ "ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова, Москва
ФГБУ «НМИЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва, Россия
Семейная форма частичного аномального дренажа легочных вен
Журнал: Кардиология и сердечно-сосудистая хирургия. 2019;12(1): 53‑59
Частичный аномальный дренаж легочных вен (ЧАДЛВ) — это врожденный порок сердца, характеризующийся тем, что одна или более (но не все) легочные вены впадают в правое предсердие, либо в полые вены, либо в их основные ветви. В данной статье представлен клинический случай семейной формы ЧАДЛВ. Причины возникновения ЧАДЛВ могут быть связаны с хромосомными аномалиями. Отклонения в эмбриогенезе, наличие врожденного порока сердца у ближайших родственников увеличивают вероятность возникновения этой аномалии.
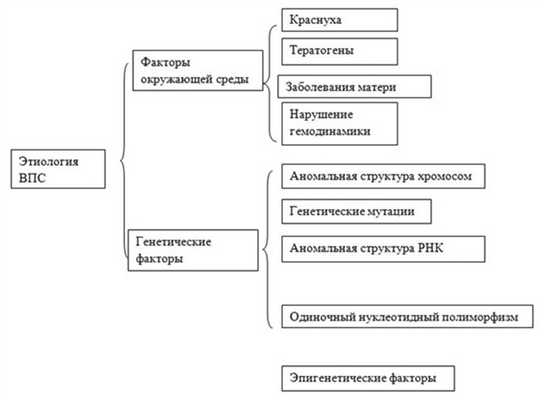
В настоящее время выявлены этиологические факторы многих генетических синдромов и семейных врожденных пороков сердца (ВПС), но генетические основы большинства «спорадических» ВПС до сих пор остаются неизвестными. Ведущие причины развития ВПС представлены на рис. 1. Рис. 1. Этиология ВПС [3].
Определены многие гены, связанные с развитием сердца. Установлено, что ряд отдельных ВПС и генетических синдромов ассоциируется с мутациями в различных единичных генах [1].
Многие гены, кодируемые посредством транскрипционных факторов или сигнальных молекул, в настоящее время ассоциированы с ВПС у человека. Транскрипционные факторы являются белками, которые содержат ДНК-связывающие домены и играют фундаментальную регулирующую роль, контролируя экспрессию генов. Сигнальными молекулами являются белки, которые позволяют клеткам реагировать на их окружение и таким образом участвуют в регуляции многих важных биологических функций.
Фенотипы ВПС варьируют от небольших септальных дефектов, которые могут остаться незамеченными на протяжении всей жизни, до гемодинамически значимых аномалий, которые проявляются клинической симптоматикой. К ним относятся аномалии в диапазоне от персистенции фетального кровообращения (например, открытый артериальный проток) до сложных пороков, таких как транспозиция магистральных сосудов, единый желудочек, синдром гипоплазии левых отделов сердца и другие варианты гетеротаксии. В соответствии с патогенетической классификацией врожденных пороков сердечно-сосудистой системы существуют 6 причинных механизмов: аномалии миграции эктомезенхимальной ткани (аномалии дуги аорты), дефекты внутрисердечного кровотока (септальные дефекты и обструктивные пороки левых или правых отделов сердца), аномалии, связанные с гибелью клеток (септальные дефекты и аномалии клапанов), аномалии экстрацеллюлярного матрикса (дефекты атриовентрикулярного канала), аномальный рост (частичная или полная мальформация легочного венозного возврата и трехпредсердное сердце) и неправильная позиция и перекручивание, что включает нарушение лево-правой асимметрии [2].
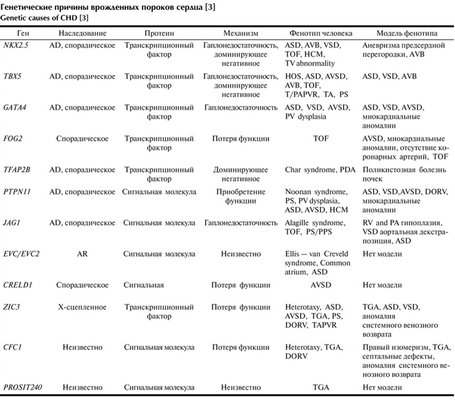
Например, homeobox — содержащие белки, кодируемые генами группы NKX-2,5, играют важную роль в регулировании тканеспецифической экспрессии генов, необходимых для дифференцировки тканей, а также для определения временных и пространственных моделей развития. Исследования показали, что в последнее время несиндромные ВПС могут быть результатом дефекта одного гена. Исходя из этого, можно сделать вывод, что предрасположенность к ВПС является результатом одиночных нуклеотидных полиморфизмов или мутаций ключевых генов, которые при взаимодействии с факторами окружающей среды нарушают нормальный морфогенез сердца, что приводит к развитию врожденных сердечных аномалий (см. таблицу) Генетические причины врожденных пороков сердца [3] [3].
Частичный аномальный дренаж легочных вен (ЧАДЛВ) — это врожденный порок сердца, характеризующийся тем, что одна или более (но не все) легочные вены впадают в правое предсердие, либо в полые вены, либо в их основные ветви [4].

Существуют четыре анатомические формы ЧАДЛВ, в основу которых положена локализация места впадения легочных вен: супракардиальный, интракардиальный, инфракардиальный и смешанный. Аномальный дренаж правых легочных вен встречается в 2 раза чаще, чем левых. Правые легочные вены могут дренироваться в верхнюю полую вену, что часто сочетается с дефектом венозного синуса (рис. 2, а), Рис. 2. Схема вариантов ЧАДЛВ. а — дренирование правых легочных вен в ВПВ с дефектом венозного синуса; б — в НПВ; в — впадение левых легочных вен в безымянную вену; г — коронарный синус. a — right pulmonary veins drainage into SVC with sinus venosus ASD; b —into IVC; c — connection of left pulmonary veins with innominate vein; d — coronary sinus. или впадать в нижнюю полую вену (см. рис. 2, б) с интактной предсердной перегородкой и бронхолегочной секвестрацией. Левые легочные вены чаще дренируются в безымянную вену (см. рис. 2, в) или в коронарный синус (см. рис. 2, г). Дефект межпредсердной перегородки обычно сопровождается аномальным дренажем левых легочных вен [5].
Впервые порок был описан Winslow в 1739 г. При патологоанатомическом исследовании был обнаружен аномальный дренаж вены верхней доли правого легкого в верхнюю полую вену. Наиболее полно анатомию и клинику этого порока изучил Brody (1942 г.). Систематизировали анатомические варианты (типы) порока R. Darling и соавт. [4] в 1957 г.
Первая успешная операция коррекции частичного аномального дренажа с использованием закрытого метода «атриосептопексии» была выполнена W. Neptune в 1953 г. В 1956 г. J. Kirklin и соавт. [4] сообщили о 5 успешных операциях коррекции порока по полуоткрытому методу Гросса.
Конкретные причины возникновения ЧАДЛВ неизвестны. Они могут быть связаны с хромосомными аномалиями, выявляемыми при кариотипировании более чем у 1/3 больных с ВПС. Чаще всего это трисомия по 21, 18 и 13-й парам хромосом. Помимо болезни Дауна, существует около 20 наследственных синдромов, в большинстве случаев сопровождающихся различными ВПС. В общей сложности синдромальная патология обнаруживается у 6—36% больных. Моногенная природа ВПС доказана в 8% наблюдений; около 90% наследуются многофакторно, т. е. являются результатом сочетания генетической предрасположенности и воздействия факторов окружающей среды. Последние выступают в качестве провоцирующих, выявляющих наследственную предрасположенность при превышении порога их совместного действия [6, 7].
По данным различных исследований [8—10], частота встречаемости ЧАДЛВ среди всех врожденных пороков сердца находится в пределах от 0,7 до 9,4%. Из всех случаев аномального дренажа легочных вен около 2/3 из них приходится на ЧАДЛВ. Чаще в процесс вовлечены правые легочные вены. Верхняя полая вена является наиболее частым местом впадения аномальных правых легочных вен (35—57% от всех случаев ЧАДЛВ). Реже легочные вены впадают в непарную вену, крайне редкий вариант — впадение одной или всех легочных вен в безымянную или добавочную левую вену.
Второе место по частоте занимает интракардиальный тип правостороннего ЧАДЛВ. Аномальный дренаж левых легочных вен встречается крайне редко, при этом легочные вены впадают в коронарный синус или непосредственно в правое предсердие.
При инфракардиальном типе порока вены (чаще средней и нижней долей правого легкого) впадают в нижнюю полую вену (НПВ) сразу под диафрагмой [11].
ЧАДЛВ может также входить в состав более сложных ВПС. Около 20% пациентов с ЧАДЛВ имеют сопутствующие пороки сердца, например, тетраду Фалло, дефект межпредсердной (ДМПП) или межжелудочковой перегородки (ДМЖП), единый (общий) желудочек, общее предсердие, транспозицию магистральных сосудов и синдром гипоплазии левых отделов сердца [12]. Однако чаще всего ЧАДЛВ встречается в комплексе с ДМПП (более 50% случаев) [9].
Между 4-й и 5-й неделями эмбриогенеза в дорсальном мезокарде начинают формироваться легочные вены, исходящие из среднеглоточного эндотелиального стебля [13]. Формирование ЧАДЛВ происходит в результате атрезии крупной ветви общей легочной вены. Как только правая или левая часть общей легочной вены становится атрезированной, то персистенция легочно-системной венозной связи на этой стороне создает этиологическую основу для ЧАДЛВ [12].
Факторами риска развития ЧАДЛВ являются возраст матери выше 40 лет, токсикоз и угроза прерывания беременности в I триместре, наличие мертворождения в анамнезе, наличие детей с врожденными пороками развития у родителей и ближайших родственников [14].
Следует отметить, что у ближайших родственников пациента с аномалиями сердца частота ВПС в 2—5 раз выше [14]. Однако в доступной нам литературе семейной формы ЧАДЛВ описано не было.
Гемодинамика и клинические признаки при ЧАДЛВ соответствуют таковым при ДМПП. При рентгенологическом обследовании можно выявить расширение тени верхней полой вены (ВПВ) и корня правого легкого при аномальном дренаже в ВПВ. При впадении легочных вен в ВПВ в переднезадней проекции на фоне нижней доли правого легкого выявляется тень аномально идущего сосуда в виде «турецкой сабли» (С. Dolter, 1949). Увеличение сосудистого пучка влево позволяет заподозрить аномальное впадение левых легочных вен в левую безымянную вену [15].
В настоящее время эхокардиография (ЭхоКГ) является основным диагностическим методом исследования у пациентов с ЧАДЛВ, однако только компьютерная томография (КТ) с внутривенным контрастированием позволяет установить окончательный диагноз, уточнить анатомию врожденного порока и определить дальнейшую хирургическую тактику [16, 17].
Существует несколько описанных техник коррекции частичного правого аномального дренажа легочных вен: простая туннелизация (переключение легочных вен в левое предсердие заплатой), туннелизация с расширением ВПВ заплаткой, туннелизация с иссечением ВПВ и ее перемещением в правое предсердие (как правило, в ушко предсердия) [18].
Различий в результатах трех техник нет. Выбор техники оперативного вмешательства зависит от типа аномального дренажа и клиники порока [18].
Представляем клиническое наблюдение пациентки А., 18 лет, поступившей в кардиохирургическое отделение с диагнозом: ВПС, ДМПП. Частичный аномальный дренаж правых верхних легочных вен в верхнюю полую вену. Легочная гипертензия I ст. Недостаточность кровообращения IIa степени, II функциональный класс.
На момент осмотра пациентка предъявляла жалобы на одышку и слабость при умеренных физических нагрузках. Из анамнеза известно, что диагноз ДМПП установлен в ноябре 2017 г. в возрасте 17 лет по данным ЭхоКГ. В январе 2018 г. выполнена мультиспиральная КТ (СКТ) сердца с в/в контрастированием, выявлены вторичный ДМПП без верхнего края, частичный аномальный дренаж правых легочных вен в ВПВ, расширение правых камер сердца.
По данным СКТ, три вены от верхней, средней и частично нижней правых легочных вен единым коллектором (диаметром 17 и 11 мм) от средней доли впадают в нижнюю треть ВПВ (рис. 3, 4). Рис. 3. Пациентка А., 18 лет. СКТ с в/в контрастированием. 1 — ДМПП. CT-scan. 1 — atrial septal defect. Рис. 4. Пациентка А., 18 лет. СКТ. Коллектор верхней, средней и частично нижней правых легочных вен, впадающий в ВПВ (указан стрелкой). CT-scan. Partial anomalous pulmonary venous return into SVC (arrow). Расстояние от верхнего края коллектора до уровня впадения ВПВ в правое предсердие составило 17 мм. Также вена от средней доли правого легкого диаметром 5,5 мм впадала в зону ДМПП. Определялся ДМПП без верхнего края размером 25×18 мм. Правая нижняя легочная вена, а также левые легочные вены впадают в левое предсердие.
Состояние пациентки при осмотре средней степени тяжести. АД 110/70 мм рт.ст., ЧСС 70 уд/мин. Тоны сердца ясные, ритмичные. Во втором межреберье слева выслушивается систолический шум. На ЭКГ отмечалась атриовентрикулярная блокада 1-й степени (интервал PQ 0,22 с), а также неполная блокада правой ножки пучка Гиса.
По данным ЭхоКГ, отмечались увеличение правых отделов сердца, дискинезия межжелудочковой перегородки, легочная гипертензия до 40 мм рт.ст. В области верхней трети МПП определялся сброс слева направо диаметром 12—13 мм.
Поступившая в наше отделение пациентка была оперирована. Интраоперационно: сердце увеличено в размерах за счет правых отделов. Экстраперикардиально визуализирован коллектор из трех легочных вен от верхней и средней долей правого легкого диаметром 4, 6 и 7 мм (рис. 5), Рис. 5. Интраоперационное фото. Коллектор верхней, средней и частично нижней правых легочных вен, впадающий в ВПВ (указан стрелкой). Partial anomalous pulmonary venous return into SVC (arrow). впадающий в ВПВ на расстоянии 17 мм от ее устья, высота коллектора 14 мм. Вена от нижней доли правого легкого впадает в левое предсердие. Левые легочные вены также впадают в левое предсердие. При ревизии МПП отмечались дефект без верхнего края 2,5×1,8 см и открытое овальное окно. Нижний край дефекта соединен с открытым овальным окном с образованием ДМПП 3,5×2 см (рис. 6). Рис. 6. Интраоперационное фото. 1 — ДМПП без верхнего края; 2 — открытое овальное окно. 1 — secundum atrial septal defect; 2 — primum atrial septal defect.
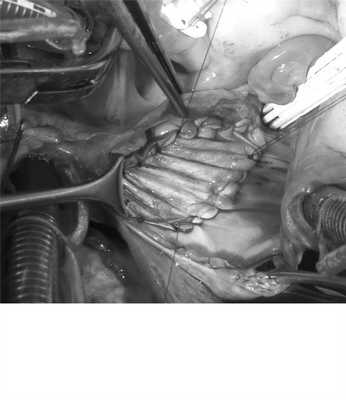
Была выполнена пластика дефекта туннелевидной заплатой из ксеноперикарда (рис. 7). Рис. 7. Туннелевидная заплата из ксеноперикарда на ДМПП с перемещением устьев правых легочных вен в ЛП. МПП герметична. IAS is sealed.
Из анамнеза известно, что у отца пациентки в возрасте 15 лет также были выявлены ЧАДЛВ и ДМПП. Он был оперирован, и интраоперационно обнаружено аномальное впадение верхней правой легочной вены в устье ВПВ. Пациенту была выполнена пластика ДМПП с перемещением легочной вены от верхней доли правого легкого в левое предсердие.
Кроме того, двоюродная сестра пациентки была прооперирована в возрасте 8 мес по поводу ВПС. Были выявлены центральный дефект межпредсердной перегородки диаметром 15 мм и аномальный дренаж верхней правой легочной вены в правое предсердие, дефект закрыт заплатой из ксеноперикарда с перемещением устья легочной вены в левое предсердие.
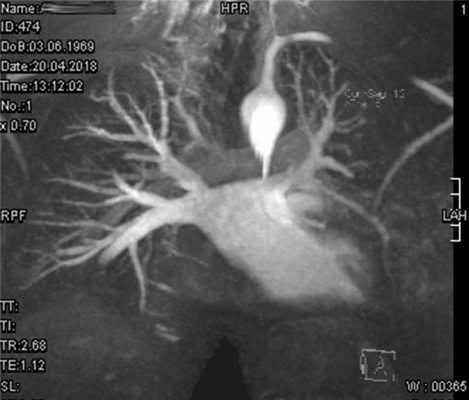
В нашем центре им было выполнено МРТ сердца для визуализации анатомического строения и контроля отдаленных результатов операционного лечения пациентов (рис. 8), Рис. 8. Пациент А. (отец пациентки). МРТ сердца. Верхние легочные вены, впадающие в левое предсердие у устья ВПВ (указаны стрелкой). MRI. Partial anomalous pulmonary venous return (arrow). по результатам которой у отца пациентки визуализирован коллектор правых легочных вен, впадающий в левое предсердие. Данных за реканализацию ДМПП, другие дополнительные патологические сбросы или обструкцию кровотока по легочным венам не выявлено в обоих случаях. Особенностью этих операций является наличие нижнепредсердного ритма с адекватной частотой, что связано с наложением швов в проекции синусового узла.
Предрасположенность к ВПС обусловливается результатом одиночных нуклеотидных полиморфизмов или мутаций ключевых генов, которые при взаимодействии с факторами окружающей среды нарушают нормальный морфогенез сердца, что приводит к развитию врожденных сердечных аномалий. Конкретные причины возникновения ЧАДЛВ неизвестны. Отклонения в эмбриогенезе и наличие ВПС у ближайших родственников увеличивают вероятность возникновения аномалии в развитии сердца. В приведенном выше клиническом наблюдении отмечено наличие ЧАДЛВ у отца пациентки и у двоюродной сестры. ЧАДЛВ чаще встречается в комбинации с ДМПП и зачастую представлен одной или несколькими аномально впадающими правыми легочными венами. По данным отдаленных результатов, оперативное вмешательство в виде туннелизации (перемещения устьев легочных вен в левое предсердие заплатой) является надежным и эффективным методом лечения ЧАДЛВ. В доступной литературе мы не встретили описания семейной формы ЧАДЛВ.
Лучевые методы исследования для диагностики врожденных аномалий легочных вен: приоритетные подходы при детализации анатомии
Материалы и методы.
В данное исследование включено 45 пациента с тотальным аномальным дренажем легочных вен (ТАДЛВ) (возраст от 3 дней до 11 месяцев) и 55 пациентов с частичный аномальный дренаж легочных вен (ЧАДЛВ) (возраст от 7 месяцев до 21 года). Для диагностики использовали ЭХОКГ с применением стандартных и модифицированных проекций. Для уточнение анатомии впадения легочных вен применяли КТ- ангиографию и ангиокардиографию (АКГ) с измерением давления в полостях сердца.
Результаты.
Из 45 пациентов с ТАДЛВ по данным ЭХОКГ, диагностическая АКГ была выполнена у 27 человек (60%), у 2(5%) - только КТ-ангиография. На основании данных ЭХОКГ были прооперированы 15 пациентов (33%). Во всех случаях ЭХОКГ-диагноз интаракардиальной и инфракардиальной формы ТАДЛВ был подтвержден. В одном случае супракардиальная форма ТАДЛВ по данным ЭХОКГ была расценена как смешанная. Смешанная форма вызвала наибольшие затруднения, и лишь в одном случае ЭХОКГ-диагноз был подтвержден. КТ- ангиография в 100% случаев позволила определить анатомию порока. Стеноз коллектора по данным АКГ выявлен у 14 (31%), ЭХОКГ не выявила стеноз у 2 (4%). При сложных ВПС (единственный желудочек) ТАДЛВ был выявлен у 5 пациентов - у 2-х - в ВПВ и у 3-х в ПП. При ЭхоКГ исследовании у двух пациентов с АЛА с ДМЖП не был диагностирован ТАДЛВ инфракардиальной формы. Из 55 пациентов с ЧАДЛВ ЭХОКГ - диагноз у 40 (80%) больных полностью подтвержден интраоперационно. Набольшие затруднения при ЭхоКГ диагностике вызвал ЧАДЛВ с интактной МПП, что потребовало проведение КТ у 4 из 6 (11%); 2 пациента с данной аномалией были прооперированы только по данным ЭХОКГ. Все варианты аномального дренажа левых легочных вен (13%) вызывали затруднения ЭхоКГ визуализации их места впадения, что потребовало выполнения АКГ или КТ. У одного пациента с аномальным дренажем левых легочных вен в коронарный синус по данным ЭхоКГ порок расценили как ДМПП без нижнего края.
Выводы.
Современная ЭхоКГ позволяет выявить ТАДЛВ и ЧАДЛВ с высокой точностью. Имеют место сложности визуализации с помощью ЭхоКГ места впадения легочных вен при смешанной форме ТАДЛВ и левых легочных вен при ЧАДЛВ. При сложных ВПС ЭхоКГ критерии сопутствующего АДЛВ могут быть «замаскированы», что приводит к диагностическим неточностям. КТ с контрастом и АКГ являются оптимальными методами детализации АДЛВ в предоперационном диагностическом алгоритме.
Комментарии посетителей
Комментарии могут отправлять участники данного мероприятия или члены Ассоциации.
Преимущества членства в ассоциации
Десятилетний опыт хирургического лечения тотального аномального дренажа легочных вен у новорожденных пациентов, оперированных в детской городской больнице №1 города Санкт-Петербург
Яковлева А. Н., Мовсесян Р. Р., Федорова Н. В., Шихранов А. А., Болсуновский В. А., Каган А. В.
ДГБ №1 (Санкт-Петербург, Россия);
Цель: провести анализ хирургического лечения ТАДЛВ у новорожденных детей, прооперированных в Детской городской больнице г. Санкт-Петербурга с 2006 по 2015г.
Результаты: отсроченное закрытие грудины потребовалось 5 пациентам. Среднее время искусственной вентиляции легких составило 80 часов, среднее время нахождения в реанимации 8 суток. Госпитальная летальность отсутствовала. В отдаленном периоде у одного ребенка была проведена повторная операция по устранению обструкции оттока из легочных вен. Других осложнений отдаленного периода не отмечалось, все дети имели полностью компенсированную гемодинамику.
Выводы: Хирургическое лечение ТАДЛВ может сопровождаться низкой летальностью и хорошими отдаленными результатами даже у пациентов находящихся в критическом состоянии предоперационном периоде.
Аномальный дренаж легочных вен
Аномальный дренаж легочных вен - это врожденная патология сердца, морфологическую основу которой составляет аномальное впадение легочных вен в правое предсердие либо входящие в него полые вены. Аномальный дренаж легочных вен проявляется утомляемостью, отставанием в физическом развитии, болями в сердце, одышкой, повторными пневмониями. Для диагностики аномального дренажа легочных вен проводится рентгенография, ЭКГ, УЗИ сердца, зондирование сердца, ангиопульмонография, атрио- и вентрикулография, МРТ. Варианты хирургической коррекции аномального дренажа легочных вен различаются в зависимости от типа порока.
МКБ-10



Общие сведения
Аномальный дренаж легочных вен - врожденный порок сердца, при котором имеет место впадение устьев всех или отдельных легочных вен в правое предсердие, венечный синус или полые вены. Аномальный дренаж легочных вен составляет 1,5-3% всех ВПС в кардиохирургии с преобладанием у лиц мужского пола.
Чаще всего аномальный дренаж легочных вен сочетается с дефектом межпредсердной перегородки (ДМПП) и открытым овальным окном; в 20% случаев - с общим артериальным стволом, ДМЖП, транспозицией магистральных сосудов, тетрадой Фалло, стенозом легочной артерии, гипоплазией левых отделов сердца, единственным желудочком сердца, декстрокардией. Из экстракардиальной патологии у пациентов с аномальным дренажом легочных вен встречаются дивертикулы кишечника, пупочные грыжи, поликистоз почек, гидронефроз, подковообразная почка, а также различные пороки развития костной и эндокринной систем.

Причины
Общие причины, формирующие аномальный дренаж легочных вен, не отличаются от таковых при других ВПС. Непосредственное разобщение легочных вен с левым предсердием может быть связано с двумя факторами:
- отсутствием их соединения;
- ранней атрезией общей легочной вены.
В первом случае под воздействием неблагоприятных условий левопредсердный вырост не связывается должным образом с венозными сплетениями зачатка легкого, что приводит к формированию аномального венозного дренажа. При ранней атрезии имеет место первоначальное соединение общей легочной вены и легочного сосудистого ложа, однако в дальнейшем происходит облитерация их просвета, поэтому венозный легочный возврат начинает осуществляться через другие доступные коллатеральные пути.
Патогенез
В антенатальном периоде порок обычно не имеет гемодинамических проявлений, поскольку внутрисердечное кровообращение у плода подразумевает поступление крови из правого предсердия в левое (через открытое овальное окно) и в боталлов проток. После рождения выраженность гемодинамических нарушений определяют форма (полная или частичная), вариант аномального дренажа легочных вен, а также сочетание порока с другими дефектами сердца.
При частичной форме аномального дренажа легочных вен гемодинамические нарушения аналогичны таковым при межпредсердных дефектах. Определяющая роль среди них принадлежит патологическому артерио-венозному сбросу крови, приводящему к увеличению объема крови в легочном круге кровообращения.

Классификация
При впадении устьев всех легочных вен в венозную систему большого круга кровообращения или правое предсердие говорят о полном (тотальном) аномальном дренаже легочных вен. Если в правое предсердие или большой круг дренируется одна или несколько легочных вен, такая форма порока называется частичной. Чаще всего (в 97% случаев) аномально дренируются вены, отходящие от правого легкого.
На основании уровня впадения легочных вен аномальный дренаж классифицируется на 4 анатомических типа (варианта).
- I вариант - супракардиальный (надсердечный). Легочные вены общим коллектором или по-отдельности дренируются в верхнюю полую вену или ее ветви (непарную вену, левую безымянную либо добавочную верхнюю полую вену).
- II вариант - интракардиальный (сердечный). Аномальный дренаж легочных вен происходит в правое предсердие или венечный синус.
- III вариант - субкардиальный, инфракардиальный (подсердечный). Легочные вены впадают в нижнюю полую или воротную вену (редко - в лимфатический проток).
- IV вариант - смешанный. Аномальный дренаж легочных вен в венозную систему осуществляется на различных уровнях в разных сочетаниях.
Симптомы
В основе клинических проявлений аномального дренажа легочных вен лежат анатомо-гемодинамические особенности: уровень общелегочного сопротивления, степень обструкции венозного возврата, размеры межпредсердной коммуникации, функционирование миокарда правого желудочка. При отсутствии дефекта в межпредсердной перегородке или его чрезвычайно маленьком размере порок несовместим с жизнью - в этом случае спасти ребенка позволяет только экстренная эндоваскулярная баллонная атриосептостомия по Рашкинду.
У детей с аномальным дренажом легочных вен отмечаются частые повторные пневмонии и ОРВИ, малая прибавка в массе, одышка, легкий цианоз, кашель, быстрая утомляемость, отставание в физическом развитии, боли в сердце, тахикардия. При выраженной легочной гипертензии уже в раннем детстве развиваются выраженный цианоз, сердечный горб и сердечная недостаточность.
Диагностика
Аускультативная картина аномального дренажа легочных вен напоминает ДМПП и характеризуется негрубым систолическим шумом в проекции легочной артерии, расщеплением II тона. После консультации кардиохирурга проводится:
- Электрокардиография. Данные ЭКГ свидетельствуют о перегрузке правых отделов, неполной блокаде правой ножки пучка Гиса; ЭОС отклонена вправо. Фонокардиография соответствует всем признакам ДМПП.
- Рентген. При анализе результатов рентгенографии грудной клетки обращает внимание расширение границ сердца вправо, выбухание дуги легочной артерии, усиление легочного рисунка. Достоверным признаком аномального дренажа легочных вен в нижнюю полую вену является симптом «турецкой сабли».Правая атриография, вентрикулография, ангиопульмонография, флебография ВПВ позволяют проследить движение контраста через малый круг кровообращения в правое предсердие или полые вены.
- УЗИ сердца. По данным ЭхоКГ устья легочных вен в левом предсердии не обнаруживаются; выявляется дилатация правого желудочка, уменьшенные размеры левых отделов сердца и другие косвенные признаки аномального дренажа легочных вен. Старшим детям и взрослым проводится чреспищеводная ЭхоКГ.
- Инвазивная диагностика. При зондировании полостей сердца катетер из правого предсердия или полой вены проводится в легочную вену. На данном этапе диагностики возможно установить локализацию впадения и количество аномально дренирующихся легочных вен.
У пациентов с аномальным дренажом легочных вен в дифференциально-диагностическом плане необходимо исключить атрезию митрального или аортального клапана, митральный стеноз, изолированный ДМПП, трехпредсердное сердце, стеноз легочных вен, транспозицию магистральных сосудов, лимфангиоэктазию.

Лечение аномального дренажа легочных вен
Прогноз
Естественное течение тотального аномального дренажа легочных вен неблагоприятно: 80% детей погибает в первый год жизни. Пациенты с частичным дренажом легочных вен могут дожить до 20-30 лет. Гибель больных связана с тяжелой сердечной недостаточностью или легочными инфекциями. Результаты хирургической коррекции аномального дренажа легочных вен удовлетворительные, однако среди новорожденных интра- и послеоперационная летальность остается высокой.
2. Сравнительный анализ отдаленных результатов коррекции частичного аномального дренажа правых верхних легочных вен в верхнюю полую вену/ Связов Е.А.// Сибирский журнал клинической и экспериментальной медицины. - 2017.
3. Восстановление синусового ритма после коррекции частичного аномального дренажа легочных вен/ Сабирова Д.Р.// Казанский медицинский журнал. - 2009.
Врожденные пороки развития легких у детей
Врожденные пороки развития легких (ВПРЛ) - это стойкие морфологические изменения легких и бронхов, выходящие за пределы вариаций их строения и возникающие внутриутробно в результате нарушений развития зародыша, плода или, иногда, после рождения ребенка, как следствие нарушения дальнейшего формирования органов [1,5].
Пользователи протокола: педиатры, врачи общей практики, детские пульмонологи.
Класс I - польза и эффективность диагностического метода или лечебного воздействия доказана и/или общепризнаны
Класс III - имеющиеся данные или общее мнение свидетельствуют о том, что лечение неполезно/неэффективно и, в некоторых случаях может быть вредным
В - результаты одного рандомизированного клинического исследования или крупных нерандомизированных исследований
С - общее мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию:
• рентгенография органов грудной клетки.
• биохимический анализ крови (определение уровня общего белка, калия, натрия, АЛТ, АСТ, железа, креатинина, остаточного азота, глюкозы);
• частый, длительный кашель (приступообразный или ежедневный, часто продолжающийся целый день, изредка только ночью);
• на одышку (прогрессирующая, постоянная, усиливающая при физической нагрузки, усиливающая при ОРВИ).
• сведения о течении беременности и родов (прием матерью лекарств, алкоголя, профессиональные вредности);
• наличие рецидивирующего обструктивного синдрома первых 3 лет жизни, не поддающийся «быстрой» коррекции.
• дыхательная недостаточность обусловленной нарушением проходимости дыхательных путей или уменьшения объема вентилируемых отделов легких;
• ОАК: При наслоении бактериальной инфекции могут быть нейтрофилез, лейкоцитоз, ускорение СОЭ в периферической крови;
• Исследование мокроты - при бактериологическом исследовании выявляют возбудителя заболевания и чувствительность к антибиотикам.
• Консультация врача анестезиолога - перед бронхологическим исследованием для назначения премедикационной терапии.
Дифференциальный диагноз
Дифференциальный диагноз [1.5]
Лечение
Режим соблюдение санитарно гигиенического режима (проветривание помещений, исключение контакта с инфекционными больными, чистое нательное и постельное белье и др.).
• Увлажненный кислород 1-2 л\мин до стабилизаций сатурации кислорода.
Другие виды лечения, оказываемые на этапе скорой неотложной помощи: не проводятся.
• при изолированных односторонних поражениях: кистозная гипоплазия, кистозные бронхоэктазы - операция торакотомия.
В соответствии с рекомендациями ВОЗ, первичная профилактика врожденных пороков развития включают следующие меры:
• улучшение питания женщин на протяжении всего репродуктивного периода путем обеспечения надлежащего потребления витаминов и минералов;
• планирование семьи, женщинам планировать беременность и проводить витаминную профилактику врожденных пороков развития плода;
• устранение воздействия веществ-тератогенов (тяжелых металлов, пестицидов, некоторых лекарственных препаратов);
• улучшение соматического здоровья женщины (борьба с инсулинорезистентностью, профилактика гестационного диабета, снижение избыточной массы тела и др.);
• совершенствование учебной работы с медицинскими работниками, причастными к укреплению профилактических мер в отношении пороков развития.
• ограничение контактов с больными и вирусоносителями, особенно в сезоны повышения респираторной заболеваемости;
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
Препараты (действующие вещества), применяющиеся при лечении
| Амброксол (Ambroxol) |
| Аминофиллин (Aminophylline) |
| Ацетилцистеин (Acetylcysteine) |
| Гентамицин (Gentamicin) |
| Ипратропия бромид (Ipratropium bromide) |
| Кислород (Oxygen) |
| Преднизолон (Prednisolone) |
| Сальбутамол (Salbutamol) |
| Флуконазол (Fluconazole) |
| Цефепим (Cefepime) |
| Цефтазидим (Ceftazidime) |
| Цефуроксим (Cefuroxime) |
Госпитализация
• неэффективность проводимой терапии при обострении рецидивирующей инфекции нижнего отдела респираторного тракта с целью верификации диагноза.
Информация
Источники и литература
- Протоколы заседаний Экспертной комиссии по вопросам развития здравоохранения МЗ РК, 2014
- 1) Review Article. Montasser Nadeem, Basil Elnazir, and Peter Greally. Congenital Pulmonary Malformation in Children. J. Scientifica. Volume 2012, Article, P.1- 7. May 2012. 2) S. Ceran, B. Altuntas, G. Sunam, and I. Bulut, “Congenital lobar emphysema: is surgery routinely necessary,” African Journal of Paediatric Surgery, vol. 7, no. 1, pp. 36-37, 2010. 3) Бородулин Б.Е., Гелашвили П.А., Бородулина Е.А., Подсевалова Н.В. 4) Пороки развития и наследственные заболевания легких /Учебное пособие. - Самара - 2003. - 113 с. 5) Королев Б.А., Шахов Б.Е., Павлунин А.В. Аномалии и пороки развития легких // Н.Новгород. 2000. 300 с. 6) Розинова Н.Н., Лев Н.С. Захаров П.П. Бронхоэктатическая болезнь у детей // Пульмонология 2007. - 4. - 91 -94.
Информация
1) Иманкулова Кульзия Джалешовна - кандидат медицинских наук РГКП «Научный центр педиатрии и детской хирургии» МЗСР РК заведующая отделением пульмонологии, врач высшей категории, главный внештатный детский пульмонолог МЗСР РК.
2) Наурызалиева Шамшагуль Тулеповна - кандидат медицинских наук РГКП «Научный центр педиатрии и детской хирургии» МЗСР РК, старший научный сотрудник отделения пульмонологии , врач высшей категории.
Рецензенты:
Садибекова Лейла Данигалиевна - кандидат медицинских наук АО «Национальный научный центр материнства и детства» руководитель отдела педиатрии.
Указание условий пересмотра протокола: пересмотр протокола через 3 года и/или при появлении новых методов диагностики/ лечения с более высоким уровнем доказательности.Читайте также:
- Влияние тимидинкиназы и лактатдегидрогеназы (ЛДГ) на течение и прогноз хронического лимфолейкоза (ХЛЛ)
- Устройство солнечно-воздушной площадки. Солярии
- Влияние скорости на дорожный травматизм. Превышение скорости как причина травматизма
- Ганглионеврома средостения на рентгенограмме, КТ, МРТ
- УЗИ при синдроме черносливого живота у плода
