Диагностика и лечение аномального отхождения левой коронарной артерии.
Добавил пользователь Alex Обновлено: 22.01.2026
Б.М. Тодуров, А.В. Хохлов, Хоррам Сохраб Мохаммад Али, А.А. Максаков, М.В. Шиманко.
Киевская городская клиническая больница "Киевский городской центр сердца".
Аномальное отхождение ствола левой венечной артерии (СЛВА) от правого коронарного синуса (ПКС) - очень редкая врожденная аномалия, которая встречается у 0,01-0,03 % пациентов, которым проводится коронарная ангиография [1, 6, 7, 10, 14]. Аномальное отхождение СЛВА является причиной внезапной сердечной смерти (ВСС) во время или после физической нагрузки, особенно у молодых атлетов [2, 4]. Она может также вызывать стенокардию и инфаркт миокарда в отсутствие атеросклероза [2].
Патофизиологический механизм этих явлений до конца не изучен. Тем не менее, механическая компрессия СЛВА одновременно аортой сзади и легочным стволом спереди является логичным объяснением [1]. В. Kaku и соавторы [9] считают спазм сдавливаемого сегмента артерии причиной ишемических событий.
Независимо от причин, вызывающих эти явления, по данным исследования А.J. Taylor и соавторов [13], 25 % пациентов с аномальным отхождением венечных артерий погибают от ВСС и в большинстве случаев бессимптомно. В другом исследовании они показали, что риск возникновения ВСС уменьшается только у лиц старше 30 лет [13].
Исследования показали, что нормальная электрокардиограмма (ЭКГ) в 12 отведениях и даже отрицательный тест с дозированной физической нагрузкой (ДФН) ни в коем случае не исключают аномального отхождения СЛВА и его угрозы для жизни [2]. Эту аномалию можно диагностировать при проведении трансторакальной или череспищеводной эхокардиографии с использованием цветового допплера и компьютерной томографии [5, 11]. Коронарография остается золотым стандартом для оценки отхождений и хода артерии [6, 14].
Относительно тактики лечения этой аномалии существуют различные мнения.
Некоторые авторы предлагают проводить реваскуляризацию миокарда при всех аномальных отхождениях такого типа. Среди других тактик лечения можно называть такие:
- медикаментозная терапия с использованием бета-адреноблокаторов [9];
- хирургическое лечение - транслокация СЛВА к аорте (имплантация СЛВА к левому коронарному синусу (ЛКС) аорты) [3].
Однако отдаленная эффективность этих методов еще не доказана.
Приводим собственное наблюдение.
Пациент Д., 59 лет, поступил в Киевский городской центр сердца 26.08.2009 г. Диагноз: Ишемическая болезнь сердца. Стабильная стенокардия напряжения III функционального класса (ФК). Атеросклеротический и постинфарктный (острый инфаркт миокарда (ОИМ) перенесенный в 2007 г.) кардиосклероз. Атеросклероз аорты, венечных артерий. Состояние после стентирования венечных артерий - 3 балла (2008, 2009). Гипертоническая болезнь III стадии, сердечная недостаточность (СН) IIА стадии, ФК - II. Сахарный диабет 2-го типа, стадия декомпенсации.
У пациента были жалобы на давящие боли в области сердца при нагрузке в течение последних 2 нед, купирующиеся после приема нитроглицерина под язык.
Больному были проведены стандартные обследования согласно протоколу (общие анализы крови и мочи, биохимический анализ крови, анализ крови на наличие вирусов гепатита В, С и на сифилис, рентген органов грудной клетки, ЭКГ, эхокардиография, эзофагогастродуоденоскопия, допплерография брахиоцефальных и сонных артерий, УЗИ органов брюшной полости).
ЭКГ-исследование показало синусовый, регулярный ритм с частотой сокращений сердца (ЧСС) 71-75 в 1 мин и рубцовый постинфарктный кардиосклероз в области задней стенки левого желудочка. Эхокардиографическое исследование показало умеренную гипертрофию левого желудочка и незначительное увеличение размера левого предсердия.
При объективном исследовании пациента выявлено незначительное увеличение уровня печени и умеренные периферические отеки. Лабораторные исследования показали умеренное увеличение уровня глюкозы при биохимическом анализе венозной крови.
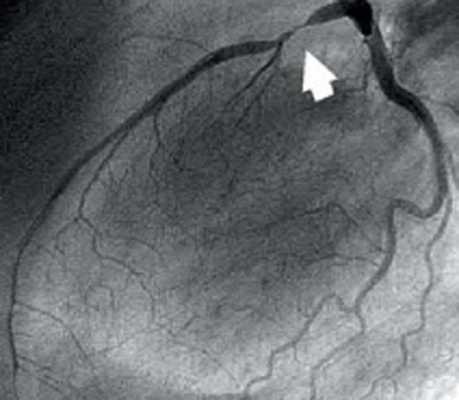
При селективной коронарографии (26.08.2009 г.) левая венечная артерия (ЛВА) не обнаружена в ее типичном месте - ЛКС. При катетеризации ПВА выявлено аномальное отхождение СЛВА от ПКС отдельным стволом. Проксимальная часть СЛВА проходила между аортой сзади и легочным стволом спереди, дальше переходя на переднюю стенку левого желудочка. В бассейне ЛВА наблюдали обнаружен эксцентрический стеноз передней межжелудочковой ветви (ПМЖВ) ЛВА в проксимальной трети - 80 %. В бассейнеПВА - внутристентовый рестеноз в средней трети - 70 % и стеноз в проксимальной трети ПВА - 50 %.
До поступления в нашу клинику пациент обращался за лечением в различные больницы и медицинские центры, где ему отказали в помощи.
В одну сессию с коронаровентрикулографией, больному было проведено стентирование ПМЖВ ЛВА, был имплантирован элютинг-стент (Cypher, Cordis, J&J, США) длиной 33 мм на баллоне-катетере диаметром 2,75 мм и под давлением в баллоне 14 атм. Непосредственный ангиографический результат был хорошим. Магистральный кровоток в бассейне ЛВА был восстановлен полностью.
Затем в место внутристентового рестеноза в дистальной трети ПВА был имплантирован элютинг-стент (Cypher, Cordis, J&J, США) длиной 28 мм на баллоне-катетере диаметром 3,5 мм и под давлением в баллоне 16 атм.
Контрольная коронарограмма показала полное раскрытие стента. Кровоток в бассейне ПВА был восстановлен полностью.
Пациент был выписан на следующий день (27.08.2009 г.) в удовлетворительном состоянии.
В период госпитализации у больного не выявлено осложнений в результате вмешательства, рецидивов стенокардии или нарушения ритма.
Несмотря на то, что эта аномалия встречается крайне редко, очень важно распознавать ее при коронарографии.
Роль аномального отхождения СЛВА в развитии атеросклеротической ишемической болезни сердца остается спорной, но существует мнение, что она ускоряет ее развитие.
Наличие такой аномалии затрудняет диагностику и лечение ишемической болезни сердца. Тем не менее, своевременная диагностика и лечение этой аномалии спасают пациента от стенокардии и ВСС.
Наряду с другими методами лечения (медикаментозный, хирургический), интервенционный метод занимает достойное место в лечении ишемической болезни сердца при этой аномалии.
Синдром Бланда-Уайта-Гарланда
Синдром Бланда-Уайта-Гарланда - это врожденная аномалия коронарного русла, характеризующаяся отхождением венечных артерий (чаще левой) от легочной артерии, вследствие чего значительный участок миокарда получает венозное кровоснабжение. Клинические проявления синдром Бланда-Уайта-Гарланда включают тахипноэ, утомляемость, удушье, бледность, потливость. Синдром Бланда-Уайта-Гарланда диагностируется с помощью данных аускультации, ЭКГ, УЗИ сердца, рентгенографии, аортографии, коронарографии, вентрикулографии, МРТ и КТ. Для коррекции синдрома Бланда-Уайта-Гарланда предложено несколько типов операций - реимплантация левой коронарной артерии в аорту, шунтирование артерии, перевязка устья левой венечной артерии и др.

Общие сведения
Синдром Бланда-Уайта-Гарланда (СБУГ, синдром BWG) - аномальное ответвление коронарных артерий, кровоснабжающих сердечную мышцу, от легочного ствола. В кардиологии синдром Бланда-Уайта-Гарланда составляет 0,5% от всех врожденных пороков сердца. Клинические признаки порока были изучены и описаны в 1933 г. американскими кардиологами E. Bland, P. White, J. Garland, в честь которых данная аномалия получила название «синдром Бланда-Уайта-Гарланда». Синдром Бланда-Уайта-Гарланда в 2 раза чаще наблюдается у девочек, чем у мальчиков.
Синдром Бланда-Уайта-Гарланда обычно встречается в изолированном виде, однако может сочетаться с другими пороками: дефектом межпредсердной перегородки (ДМПП), дефектом межжелудочковой перегородки (ДМЖП), тетрадой Фалло, коарктацией аорты, открытым артериальным протоком, транспозицией магистральных сосудов.

Причины
Синдром Бланда-Уайта-Гарланда формируется вследствие неправильной эмбриональной закладки венечных артерий. Предложено несколько гипотез, объясняющих эмбриогенез порока:
- отхождение коронарных сосудов начинается от легочной части артериального ствола вследствие неправильного формирования аортолегочной перегородки;
- зачаток левой венечной артерии с самого начала формируется в области легочной артерии;
- отхождение коронарной артерии формируется в области аортального и легочного клапанов. В норме в дальнейшем зачатки легочной артерии регрессируют, а развиваются только два зачатка аорты. В некоторых случаях коронарный зачаток легочной артерии сохраняется и разрастается, обусловливая аномальное отхождение коронарных сосудов от легочного ствола.
Факторы риска, предрасполагающие к развитию синдрома Бланда-Уайта-Гарланда, на сегодняшний день неизвестны; четкая связь и с какими-либо генетическими нарушениями не выявлена.
Патогенез
В норме левая коронарная артерия берет начало от левого синуса Вальсальвы, а при синдроме Бланда-Уайта-Гарланда отходит от корня легочного ствола. Ее дальнейшее ветвление, как правило, остается нормальным. Особенности внутрисердечного кровообращения при синдроме Бланда-Уайта-Гарланда, прежде всего, определяются соотношением давлений в аорте и легочной артерии.
Во внутриутробном периоде давление в легочном стволе и насыщение крови кислородом сопоставимы с аортой, поэтому аномальная левая венечная артерия обеспечивает нормальный кровоток и адекватное кровоснабжение сердечной мышцы. При рождении происходит снижение давления в легочной артерии, в результате чего часть миокарда, кровоснабжаемая аномально расположенной коронарной артерией, получает недостаточный объем слабо оксигенированной крови. Снижение коронарной перфузии сопровождается тяжелой ишемией миокарда, дисфункцией и прогрессирующим повреждением участка сердечной мышцы.
Вместе с этим, постепенно формируются межкоронарные анастомозы, обусловливающие поступление крови в аномальный сосуд не только из легочной артерии, но и из правой коронарной артерии, отходящей от аорты. По мере увеличения количества межкоронарных анастомозов направление тока крови в аномальной артерии изменяется, формируется сброс из венечного русла в легочную артерию, что приводит к развитию «феномена обкрадывания», т. е. ухудшению кровоснабжения миокарда в бассейне нормально расположенной правой коронарной артерии. Это сопровождается дальнейшим ишемическим повреждением миокарда и усугублением его дисфункции.
Характер коронарной гемодинамики может существенно изменяться при наличии сопутствующих ВПС, протекающих с легочной гипертензией (ДМПП, ДМЖП и др.). Это в известной мере затрудняет прижизненную диагностику синдрома Бланда-Уайта-Гарланда.
Таким образом, в течении синдрома Бланда-Уайта-Гарланда различают 3 патофизиологические фазы.
- Первая фаза характеризуется адекватным кровенаполнением левой венечной артерии, обусловленным высоким давлением в легочном стволе.
- Вторая фаза (критическая) обусловлена падением давления в легочной артерии и развитием анастомозов между правой и левой коронарными артериями.
- Третья фаза наступает с развитием ретроградного тока крови из левой коронарной артерии в легочный ствол и ведет к усугублению ишемии миокарда.
При аутопсии у лиц, страдавших синдромом Бланда-Уайта-Гарланда, обнаруживается увеличенное сердце шарообразной формы, резкая дилатация левого желудочка, выраженный фиброэластоз миокарда, гипертрофия и деформация папиллярных мышц, аневризмы левого желудочка, нередко - трансмуральные или субэндокардиальные инфаркты миокарда левого желудочка.
Классификация
Различают четыре анатомических варианта синдрома Бланда-Уайта-Гарланда: аномальное отхождение левой, правой, обеих или добавочной венечных артерий от ствола легочной артерии. Статистически чаще встречается неправильное ответвление левой коронарной артерии. Также принято выделять два типа синдрома, различающиеся клинической картиной:
- инфантильный (с плохо развитым коллатеральным кровоснабжением);
- взрослый (с хорошо развитым коллатеральным кровоснабжением).
Симптомы
Клинические проявления синдрома Бланда-Уайта-Гарланда, прежде всего, зависят от его варианта. Инфантильный тип обычно заявляет о себе в возрасте 2-3 месяцев. При этом отмечаются затруднения при кормлении ребенка (так называемая стенокардия кормления): учащенное храпящее дыхание, одышка, потливость, бледность кожных покровов, цианоз губ, кашель, регургитация, рвота. Приступы также могут провоцироваться дефекацией, криком, любым физическим усилием, интеркуррентными инфекциями.
Дети вялые, быстро утомляются, медленно увеличивают массу тела. Объективно определяется расширение границ сердца, глухость сердечных тонов, тахикардия, систолический шум и ритм галопа, увеличение печени, влажные хрипы в легких. Позже присоединяются отеки подкожной клетчатки, гидроторакс, асцит. Синдрома Бланда-Уайта-Гарланда является наиболее частой причиной развития инфаркта миокарда у детей. Более 90% детей с инфантильным типом погибают в течение первого года жизни от тяжелой сердечной недостаточности, нарушений ритма и проводимости сердца.
При взрослом типе синдрома межартериальные коллатерали обеспечивают достаточное коронарное кровоснабжение и относительно благоприятное развитие заболевания. Длительное время состояние больных может сохраняться стабильным. Клинические проявления могут развиваться в возрасте 3-25 лет и даже позже, характеризуясь стенокардией напряжения и стенокардией покоя, признаками сердечной недостаточности, тяжелыми аритмиями и блокадами. Иногда первым проявлением синдрома Бланда-Уайта-Гарланда служит внезапная коронарная смерть. Редким исключением является малосимптомное течение порока и его случайное выявление при плановой электрокардиографии или коронарографии в связи с инфарктом миокарда.
Диагностика
Диагностика синдрома Бланда-Уайта-Гарланда осуществляется с помощью электрокардиографии, эхокардиографии, рентгенографии грудной клетки, коронарографии, аортографии, левой вентрикулографии, зондирования полостей сердца, МРТ и МСКТ сердца.
На рентгенограммах у пациентов с синдромом Бланда-Уайта-Гарланда выявляется кардиомегалия, застой крови в легочном круге кровообращения. Характерными ЭКГ-признаками служат гипертрофия миокарда левого желудочка и его ишемическое поражение, блокада левой ножки пучка Гиса. ЭхоКГ обнаруживает систолическую дисфункцию миокарда левого желудочка с зонами гипо- и акинезии. Допплерэхокардиография нередко позволяет регистрировать турбулентный поток крови из аномальной венечной артерии в легочный ствол.
Наиболее точные сведения в отношении синдрома Бланда-Уайта-Гарланда дают аортография и селективная коронарография (КТ-коронарография, МСКТ-коронарография). При этом на ангиограммах визуализируется разветвленная правая и аномально расположенная левая коронарные артерии, ретроградный сброс контраста в легочный ствол.
В заключительной фазе развития синдрома Бланда-Уайта-Гарланда катетеризация сердца обнаруживает повышенную артериализацию крови на уровне легочного ствола, обусловленную выраженным лево-правым сбросом крови. Левая вентрикулография выявляет дилатацию полости желудочка, признаки митральной недостаточности. С помощью МРТ и МСКТ сердца определяется местоположение венечных артерий, выявляется сопутствующая патология сердца и сосудов.
Лечение синдрома Бланда-Уайта-Гарланда
Больные с синдромом Бланда-Уайта-Гарланда нуждаются в консультации кардиохирурга и тщательном обследовании с целью определения показаний и противопоказаний к оперативному лечению. Различные хирургические методы коррекции синдрома Бланда-Уайта-Гарланда направлены на обеспечение адекватного кровоснабжение миокарда в бассейне левой венечной артерии.
В случае хорошо развитого коллатерального кровообращения производится перевязка устья аномальной коронарной артерии (лигирование фистулы коронарной артерии). В этом случае всю нагрузку по кровоснабжению миокарда берет на себя нормальная правая коронарная артерия.
Другим вариантом коррекции синдрома Бланда-Уайта-Гарланда является шунтирование аномально отходящей левой коронарной артерии с помощью внутригрудных артерий (маммарокоронарное шунтирование). При синдроме Бланда-Уайта-Гарланда возможно проведение транслокации устья левой коронарной артерии в аорту, соединение левой венечной артерии и аорты с помощью тоннеля внутри легочного ствола.
Прогноз
Естественное течение синдрома Бланда-Уайта-Гарланда ассоциировано с высоким риском смерти в раннем детском (инфантильный тип) или молодом возрасте (взрослый тип). Отхождение правой коронарной артерии от ствола легочной артерии встречается крайне редко, не приводит к каким-либо клинически значимым поражениям сердца и совместимо с нормальной жизнью. Случаи отхождения обеих венечных артерий от легочного ствола прогностически неблагоприятны и приводят к гибели больных в течение первых 2-х недель жизни.
Существенно улучшается прогноз при своевременном выявлении и адекватной кардиохирургической коррекции синдрома Бланда-Уайта-Гарланда.
Коронарная фистула
Коронарная фистула — это один из вариантов коронарных аномалий впадения, при котором происходит дренирование крови из венечного сосуда в сердечные камеры или крупные сосуды. В раннем возрасте состояние проявляется потливостью, медленным набором веса, синюшностью кожных покровов. У взрослых при сосудистой аномалии возникают признаки сердечной недостаточности. Основные методы диагностики — ЭхоКГ, селективная коронарография и МСКТ, также применяется ЭКГ и рентгенография грудной клетки. Радикальное лечение порока предполагает транскатетерную окклюзию коронарной фистулы или хирургическую коррекцию аномалии.
МКБ-10



Другая теория образования фистул указывает на пороки развития дистальных сегментов коронарных артерий. При этом вместо нормальных сосудов, которые питают сердечную мышцу, появляются аномальные шунты между венечными сосудами и полостями желудочков. Этиологическим фактором коронарной сосудистой аномалии служат различные варианты обструкции кровотока — например, при атрезии легочной артерии.
Основной патофизиологический механизм заболевания — развитие синдрома обкрадывания в участках миокарда, которые расположены дистальнее фистулы. В пораженном венечном сосуде постепенно снижается кровоток и диастолическое давление, что обусловлено сбросом большей части крови в полость с более низким давлением. Чтобы компенсировать это состояние, диаметр коронарной артерии увеличивается, а ее устье расширяется.
С течением времени венечный сосуд дилатируется до такой степени, что становится неспособным обеспечить адекватное кровоснабжение сердечной мышцы. Дистальные отделы миокарда страдают от ишемии сначала при физической нагрузке, а затем при повседневной активности и в покое. В артериях коронарной сети появляются дегенеративные изменения, изъязвление и точечные разрывы интимы.
В клинической кардиологии существует множество классификаций коронарной аномалии впадения. Все фистулы подразделяются на 2 группы:
Клиническое значение имеет тип дренирования фистулы, обуславливающий тяжесть симптоматики. Кардиолог и кардиохирург Ганс Банкл (Австрия) выделяет 2 типа фистул:
- Артериовенозные соустья. Такие коронарные аномалии составляют около 90%, в основном являются врожденными. Происходит анастомозирование коронарной артерии с правыми отделами сердца, коронарным синусом либо легочным стволом.
- Артерио-артериальные фистулы. Данный тип порока включает анастомозы сосудов, питающих миокард, с левым предсердием или желудочком. Наблюдается у 10% больных.
Более 50% мальформаций образуются в правой венечной артерии, 46% — в левой, 4% составляют билатеральные фистулы в обоих коронарных сосудах. Также выделяют одиночные и множественные патологические сосудистые анастомозы. По диаметру сформировавшегося шунта различают малые коронарные фистулы с размером устья менее 2 мм и большие, которые имеют входное отверстие больше 2 мм.
Симптомы коронарной фистулы
Большинство малых венечных аномалий протекает бессимптомно. При большой коронарной фистуле у детей грудного возраста отмечаются приступы повышенной нервной возбудимости, потливость. У младенцев после 2-3 месяцев жизни наблюдается быстрая утомляемость при кормлении, плохая прибавка в весе. При крике кожные покровы вокруг рта приобретают синюшный оттенок. Иногда слышно свистящее дыхание во сне.
У пациентов взрослого возраста постепенно нарастают симптомы сердечной недостаточности. Одними из первых признаков становятся одышка и сердцебиение, которые возникают при физических нагрузках. Характерны постоянная слабость, снижение работоспособности. Больные замечают отеки ног, которые усиливаются к вечеру. Иногда беспокоит боль в прекардиальной области, которая напоминает приступ стенокардии.
Осложнения
Маленькие фистулы редко дают осложнения, но со временем они дилатируются, что повышает риск формирования аневризмы коронарного сосуда. Большие недиагностированные шунты связаны с повышенным риском внезапной сердечной смерти у молодых людей в возрасте 20-35 лет. Частота осложнений увеличивается с возрастом. У 80-90% больных постепенно развивается хроническая ишемия миокарда, которая при отсутствии лечения приводит к ишемической кардиомиопатии.
Опасным осложнением является разрыв аневризматического расширения фистулы, который сопровождается гемоперикардом и сердечной тампонадой. Хроническая перегрузка сердца объемом крови вызывает застойную сердечную недостаточность. Коронарные фистулы у 20-30% пациентов служат предрасполагающим фактором для раннего начала атеросклероза венечных артерий. Иногда возникает инфаркт миокарда вследствие тромбоза фистулы.
Обследованием детей занимается педиатр совместно с детским кардиологом, взрослым больным требуется консультация терапевта-кардиолога. При малых аномалиях отсутствуют объективные симптомы заболевания. При больших фистулах выявляются патологические сердечные шумы, приглушенность тонов. Для подтверждения порока развития используют инструментальные исследования:
- Эхокардиография. УЗИ сердца — «золотой стандарт» диагностики, который показывает дилатацию пораженной коронарной артерии и наличие патологического шунта. Для измерения объемного кровотока через фистулу проводят картирование.
- Электрокардиография. Специфические изменения отмечаются при анастомозах большого диаметра. На перегрузку левого предсердия и желудочка указывает двугорбый зубец Р, отклонение электрической оси сердца влево. Изредка на кардиограмме регистрируются признаки ишемии миокарда.
- КТ. Мультиспиральная компьютерная томография (МСКТ) — лучший неинвазивный метод для трехмерной реконструкции сердца и питающих его сосудов. В ходе исследования обнаруживаются даже дистально расположенные коронарные фистулы.
- Коронарография. Селективная коронарная ангиография с контрастным веществом позволяет осмотреть ход венечного сосуда, степень его расширения и диаметр фистулы. Для оценки характера кровотока дополнительно проводится катетеризация сердца.

КТ-коронарография. А - коронарная фистула, исходящая из правой коронарной артерии (RCA), заканчивающаяся в коронарном синусе (CS). В - объемная трехмерная реконструкция изображения, демонстрирующая свищевой сосуд, соединенный с коронарным синусом.
Лечение коронарной фистулы
Консервативная терапия
Пациентам с фистулами малого размера без клинических проявлений рекомендован диспансерный учет. При появлении симптомов коронарной недостаточности во время физической активности показано симптоматическое лечение. С учетом ведущих клинических симптомов назначают несколько групп препаратов: диуретики, бета-адреноблокаторы, вазодилататоры и др.
Хирургическое лечение
Оперативное вмешательство — метод радикального лечения коронарной фистулы с устьем более 2,0 мм, а также при расширении венечного сосуда более 5,0 мм. При выборе оптимальной хирургической методики учитывают число фистульных отверстий, степень гемодинамических нарушений и локализацию коронарной аномалии. Основные виды оперативных вмешательств:
Прогноз и профилактика
Качество жизни больных с малыми фистулами коронарных артерий не нарушается, риск осложнений минимальный. После успешной хирургической коррекции больших шунтов прогноз также благоприятный. Учитывая врожденный характер заболевания, меры первичной профилактики не разработаны. Для предупреждения осложнений требуется диспансерное наблюдение пациентов со случайно обнаруженными бессимптомными сосудистыми аномалиями.
1. Коронарные фистулы/ В.М. Субботин, Ю.М. Белозеров, Л.В. Брегель // Российский вестник перинатологии и педиатрии. - 2015.
2. Опыт лечения врожденных коронарно-сердечных фистул в сочетании с нарушениями ритма сердца/ Л.А. Бокерия, О.Л. Бокерия, М.Б. Биниашвили и соавт.// Анналы аритмологии. - 2013.
3. Эхокардиографическая диагностика коронарных фистул у детей с шумами над областью сердца/ Н.Ф. Прийман, Д.О. Иванов, Ю.В. Петренко// Вопросы практической педиатрии. - 2015.
Коронароангиография

В университетскую программу первых курсов входит изучение строения сердца и его коронарных сосудов. Но чаще всего авторы учебников ограничиваются описанием только крупных сосудов. Клиницисты же используют совершенно иную, но также международную номенклатуру. Коронароангиография и имплантация стентов требуют более подробного описания сосудов сердца, что нашло применение и в международной практике.
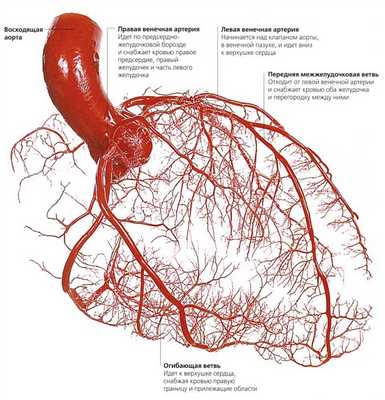
Из курса анатомии каждый узнал, что от аорты отходят две артерии, кровоснабжающие само сердце: левая и правая коронарные артерии. Утолщения на корне аорты, из которых и выходят эти артерии, называются соответственно левым и правым коронарными синусами.
Выделяют следующие части левой коронарной артерии (LCA, left coronary artery): главный ствол, который делится на переднюю межжелудочковую ветвь (ramus interventricularis anterior, RIVA или left anterior descending, LAD), а также огибающую артерию (left circumflex coronary artery, LCх).
Главный ствол этой артерии длиной редко превышает 1 см, а далее делится на две свои конечные ветви. Передняя межжелудочковая ветвь располагается на передней поверхности сердца вплоть до его верхушки. На своем протяжении от этой артерии отходят передние желудочковые ветви (диагональные ветви, RD/R.Diag) и передние перегородочные ветви. В коронароангиографии с целью топического указания места поражения предложено делить коронарное русло на сегменты.
Проксимальный сегмент ПМЖВ начинается своим ответвлением от ствола и продолжается до места отхождения от нее первой перегородочной или первой RD, средняя часть — до ответвления второй перегородочной ветви или второй RD, дистальная — до верхушки сердца/после отхождения второй RD.
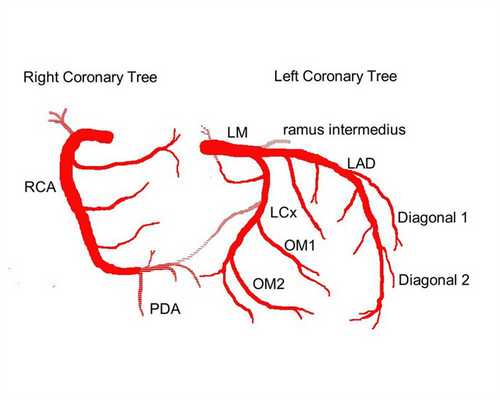
Огибающая артерия всегда располагается на задней поверхности сердца. В ее проксимальной части от нее отходит ветвь тупого края (obtuse marginal artery, obtuse marginal branch, OMB). В зависимости от места этого ответвления различают проксимальную и дистальную части огибающей ветви. Очень редко от главного ствола между передней межжелудочковой ветвью и огибающей ветвью посередине отходит еще одна ветвь, берущая начало непосредственно из общего ствола — промежуточная артерия (RIM, ramus intermedius).
Выделяют следующие три части правой коронарной артерии (RCA): проксимальную (от устья до первого ее поворота, обычно располагающегося горизонтально), среднюю (от первого до второго поворота) и дистальную (после второго ее поворота до разделения артерии на ветви у «креста» сердца (crux cordis) — места пересечения задней межжелудочковой и атриовентрикулярной борозд сердца). Иногда непосредственно после самого устья от сосуда отходит маленькая ветвь — ветвь артериального конуса (ramus coni arteriosi, CB), а также много мелких ветвей к правому предсердию.
Самой главной из этих ветвей является артерия синоатриального узла (S-A node artery, SNA). Она часто располагается под правым ушком сердца. В редких случаях ветвь артериального конуса имеет собственное устье. Этот вариант всегда следует учитывать, поскольку при коронароангиографии можно принять эту артерию за главный ствол правой коронарной артерии. Перекрыв вход в эту артерию катетером, можно вызвать локальную ишемию и, как следствие, нарушения ритма вплоть до трепетания камер сердца. В передней части венечной борозды, в области острого края сердца, от правой коронарной артерии отходит ветвь острого края (acute marginal artery, AMB), чаще от одной до трех, которая в большинстве случаев достигает верхушки сердца.
Итак, перечислим еще раз все сокращения:
Левая коронарная артерия — left coronary artery (LCA):
— Передняя межжелудочковая ветвь (ПМЖВ), или передняя нисходящая артерия — left anterior descending artery (LAD); иначе — ramus interventricularis anterior (RIVA/RIA);
— Диагональные артерии (ветви) — ДА; ramus diagonalis (RD/Diag);
— Огибающая ветвь (ОВ) левой коронарной артерии, огибающая артерия — left circumflex coronary artery (LCх));
— Ветвь тупого края, obtuse marginal artery, obtuse marginal branch, (OMB);
— Перегородочные межжелудочковые ветви, ramus septalis (RSA);
— Промежуточная артерия, ramus intermedius (RIM).
Правая коронарная артерия — right coronary artery (RCA):
— Ветвь острого края, acute marginal artery, (AMB);
— Артерия синоатриального узла — ramus nodi sinuatrialis (S-A node artery, SNASA/RNS);
— Задняя межжелудочковая ветвь (ЗМЖВ), или задняя нисходящая артерия — posterior descending artery (PDA); иначе — ramus interventricularis posterior (RIVP/RIP).
И еще раз для повторения (важное задание для диагностики локализации ишемии при инфаркте миокарда): LAD/RIVA, LCx кровоснабжает левую камеру спереди и сбоку, а RCA — сзади. Левое предсердие кровоснабжают LCx, RCA. Перегородку — RSA от LAD. Правую камеру сзади — RCA, спереди — RCA, LAD. Правое предсердие — RCA.
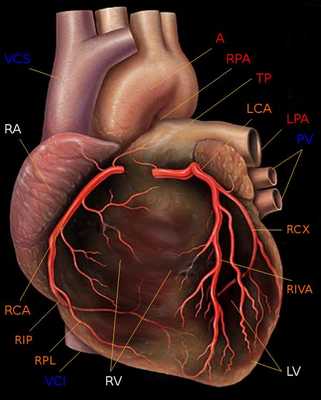
Следует также напомнить о доминантности кровоснабжения миокарда. При так называемом правом типе кровоснабжения сердца, наблюдающемся у 70 % людей, задняя нисходящая артерия (PDA) отходит от правой коронарной артерии. При левом типе кровоснабжения сердца (10 % людей) огибающая артерия (LCx) достигает уровня задней межжелудочковой борозды и образует заднюю нисходящую артерию (PDA). При еще более редком, так называемом смешанном содоминантном типе (20 % людей), имеются две задних желудочковых ветви (RIVP/RIP), отходящих от правой венечной и огибающей артерий.
Для понимания принципа работы ЭКГ необходимо повторить строение проводящей системы сердца. Синоатриальный узел находится в стенке правого предсердия, его импульсы поступают к атриовентрикулярному узлу (также располагается в стенке правого предсердия). Далее импульс распространяется по волокнам пучка Гиса, который делится в межжелудочковой перегородке на две ножки - правую и левую (иногда называются ножками Тавары). К эндокарду сигнал поступает посредством волокон Пуркинье. Иногда встречаются и дополнительные пути передачи возбуждения, как, например, по волокнам Кента. Такие пути часто располагаются между предсердиями и желудочками и идут в обход атриовентрикулярного узла. Из-за этого мускулатура миокарда часто сокращается преждевременно, что становится заметно на ЭКГ, а такие пациенты предрасположены к тахикардии (WPW-синдром).
Электрокардиограмма представляет собой не что иное, как запись распространяемых электрических потенциалов сердца, фиксируемых электродами на конечностях и грудной стенке. ЭКГ включает в себя три стандартных отведения по Эйнтховену (I, II, III), и три усиленных по Гольдбергу (aVR, aVL, aVF). Прикрепление еще шести грудных электродов по Вильсону (V1-V6) позволяет зарегистрировать распространение возбуждение по сердечной стенке в горизонтальной проекции. В зависимости от изменений в этих отведениях еще на догоспитальном этапе при помощи ЭКГ можно предположить локализацию инфаркта и возможную «проблемную» артерию.
Например, при инфаркте правых отделов сердца (задней стенки) часто особенно сильно поражается правый желудочек. Чаще всего это происходит из-за тромба в RCA. Правые отделы сердца не способны сокращаться должным образом, что приводит к снижению преднагрузки левой камеры сердца, поскольку таким образом снижается объем крови, транспортируемый к левому предсердию. Сниженный сердечный выброс сердце пытается компенсировать увеличением частоты сокращений. При инфаркте же левых отделов сердца основным осложнением является кардиогенный шок.
Специально для наших подписчиков мы сделали таблицу, в которой показаны изменения ЭКГ в зависимости от локализации возможного повреждения коронарных артерий.

Стоит также повторить и классификацию острых коронарных синдромов:
- Нестабильная стенокардия без повышения тропонина. Эта форма классифицируется по Браунвальду на 3 класса в зависимости от выраженности клинических признаков:
I — недавно возникшая боль за грудиной (менее 2-х месяцев, более 3-х раз в день);
II — боль за грудиной в покое (минимум один раз за прошедший месяц, но не в течении последних 48 часов);
III — боль за грудиной в покое (минимум один раз за последний 48 часов).
Нестабильную стенокардию классифицируют на 3 группы по причинам возникновения:
А — вторичная нестабильная стенокардия (инфаркт миокарда, анемия, повышение температуры, гипотензия, тахиаритмия, тиреотоксикоз, дыхательная недостаточность);
B — первичная нестабильная стенокардия;
C — нестабильная стенокардия после инфаркта (минимум 2 недели после инфаркта).
- Инфаркт миокарда без элевации сегмента ST (NSTEMI) с повышением концентрации кардиального тропонина в крови.
ПБКА и стентирование
При ПБКА баллонный катетер с помощью проводника вводится вплоть до места стеноза. Баллон раздувается и тем самым «сплющивает» атеросклеротические бляшки, растягивая сосудистую стенку. Мелкие повреждения интимы во время раздувания баллона часто не имеют последствий, однако иногда именно в этих местах позже начинается пролиферация тканей, что в 30-40 % случаев приводит к рестенозам и рецидивам в течение последующих трех месяцев. Частота экстренных операций по созданию шунтов (bypass) составляет менее 0,5 %. С помощью имплантации стента сосудистая стенка стабилизируется. Существовала также техника primary stenting — имплантация стента без предшествующего дилатирования сосудов баллоном, однако ныне она используется крайне редко и только на начальных этапах сужения просвета сосуда. Исследования последних лет показали, что при значительных сужениях просвета сосуда, у таких пациентов в первые часы после ангиопластики наблюдалась ишемия миокарда, что требовало немедленного повторного хирургического вмешательства или повторной дилатации. Это осложнение возникает вследствие отрыва бляшки от эндотелия. Обнажение поверхности гладкомышечных клеток приводит к тромбообразованию за счет высвобождения молекул коллагена и тканевых факторов, запускающих каскад свертывания крови. Во избежание развития тромбов и рестеноза в настоящее время чаще всего ангиопластику совмещают с имплантацией стентов на месте стеноза.
Первую имплантацию стента провел Sigwart в 1987 году. Тогда стенты монтировались непосредственно на баллон самим врачом. Сейчас же вся конструкция идет в комплекте, что позволило снизить риск потери стента в кровеносном русле при его недостаточной фиксации.

Появились и новые типы самих баллонов. Некоторые из них имеют на своей поверхности режущие зубцы, что расположены параллельно оси сосуда, а также баллоны из нитинола и нейлона хеликальные или же параллельные оси сосуда. Эти конструкции позволяют создать идеальную площадку для имплантации будущего стента. Сперва в процессе исследований ученые не заметили разницы между такими баллонами и стандартными, однако недавно выяснилось, что такие надсекающие баллоны, покрытые лекарственными средствами, показывают лучшие результаты.
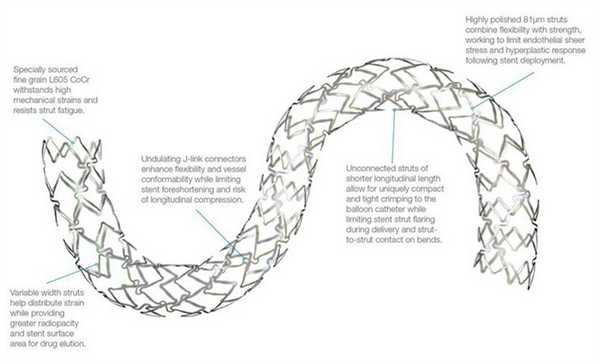
Различают два типа металлических стентов: саморасширяющиеся и прикрепленные к дилатирующему баллону. Исследования показывают, что применение первого типа стентов чаще вызывает развитие неоинтимальной гиперплазии. Поэтому в настоящее время часто используются стенты второго типа. Как правило, они состоят из металлической трубочки, в которой с использованием различных техник создаются отверстия. После расширения сосуда баллонным катетером в его просвете создается сеть, обволакивающая его стенки изнутри. Прототипом такого типа стентов являлся стент Palmaz-Schatz, который сейчас уже не применяется.
Исследование 1994 года не показало разницы между имплантацией такого стента и обычной ангиопластикой. Развитие этого направление позволило разработать новые типы стентов. Чаще всего они состоят из нескольких модулей, соединенных коннекторами. Изначально их производили из стали, однако сейчас в качестве материала для изготовления стентов используется платина, кобальт, нитинол (никель-титан), а также только титан. Из-за этого они стали существенно меньше и легче. РКИ выявили преимущества стентов с толстым каркасом перед таковыми с тонким. Предполагают, что они меньше травмируют сосуды, предотвращая таким образом реэндотелизацию.
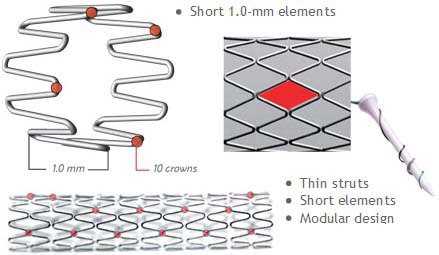
Существуют также стенты с особым покрытием, создающим непроницаемый для крови барьер. К таким вещества относят политетрафторэтилен и полиэтилен. Сперва их использовали для экстренного закрытия небольших перфораций коронарных артерий, однако сейчас их применяют в профилактике коронарных аневризм и артериовенозных фистул.
Drug-eluting-stents (DES) покрыты специальными веществами, подавляющими пролиферацию клеток эндотелия, таким образом препятствуя рестенозированию сосуда, чаще всего развивающемуся в течение 4-8 месяцев после имплантации.
Стенты - ферромагнетики, плотно устанавливающиеся в сосудистом русле не являются противопоказанием для проведения МРТ.
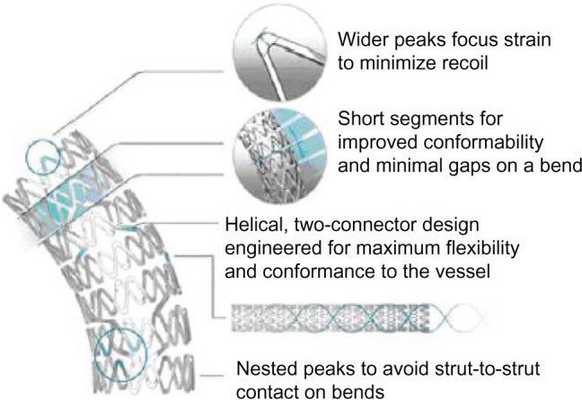
Существуют специальные стенты для позиционирования их в устьях и разветвлениях сосудов. Как и любой инородный объект в кровеносном русле, стенты являются дополнительным фактором тромбообразования. Поэтому после самой процедуры пациенту всегда назначают ДААТ или ТАТ.
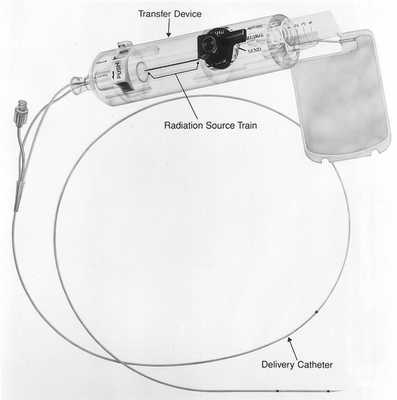
Брахитерапия
Этот метод основан на радиоактивном облучении коронарных артерий при рецидивах после имплантации стентов. Для этого используется бета-излучение, поскольку оно способно проникать лишь на несколько миллиметров внутрь толщи ткани. При этом методе катетер вводят в место стеноза, который прежде был дилатирован баллоном. С помощью этого катетера зону определенное количество времени (3-5 минут) облучают рассчитанной дозой. Васкулярная брахитерапия используется с 1996 года. В феврале 2005 года прекратила свое существование фирма, разрабатывающая аппараты для брахитерапии коронарных сосудов (Beta-Cath-System).
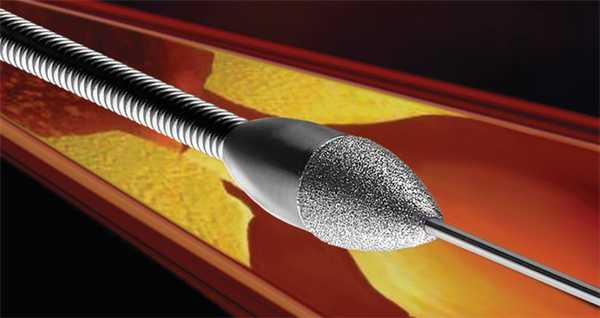
Ротаблационная пластика
Этот метод используется с 1989 года. В сосуд вводится алмазный бор, способный вращаться с частотой 190 000 об. в минуту. С его помощью удаляются ткани в месте рестенозирования. Величина таким образом измельченных частиц составляет 5-10 микрометров (длина эритроцита — 7,5 микрометров). Образуемый канал очень небольшой в диаметре, но достаточный для проведения ПТКА. Как правило, метод используют в случае образования на месте рестеноза кальцификатов. Диаметр головки бора варьируется от 1,25 до 2,5 мм. Поскольку кабель для ротаблационного бора плохо проходит место стеноза, успех операции составляет 80-95 %. К осложнениям относят спазмы сосудов, возникающие чаще (5 %), чем при ПТКА.
Интраваскулярный ультразвук
Еще одним инструментом кардиолога является метод интраваскулярного ультразвука (IVUS). В сосуд вводят ультразвуковой зонд.
Порядок манипуляций напоминает таковой при ПТКА: после позиционирования проводника зонд проводят к месту стеноза. Ультразвук позволяет просмотреть 1 мм тканей на расстоянии от излучателя. Всего на верхушке катетера используется 64 таких кристалла (пьезоэлемента). С помощью этого метода возможно определить состав бляшек и их фибринные, липидные и кальциевые составляющие. Чаще всего к ультразвуку прибегают при неоднозначности ангиографической картины, используя как дополнительный метод обследования.

Всех нас на физиологии мучили графиками давления в сосудах. Мало кто на младших курсах мог подумать, что эти данные действительно используются в диагностике. При каждой коронароангиографии исследуют давление в коронарных артериях и его изменения в зависимости от наличия стенозированных участков. Для этого к исследуемому участку подводят детектор диаметром 0,014 дюймов. Этот катетер продвигают до самого конца коронарной артерии. Потом его тянут обратно. Таким образом фиксируется давление на всем протяжении артерии. На мониторе врачи наблюдают изменение давления; в месте наибольшего его перепада чаще всего и оказывается самый стенозированный участок. Постепенное изменение давления является свидетельством диффузного заболевания сосудов. Важно откалибровать детектор до самого исследования. После аппликации аденозина наблюдается гиперемия, то есть увеличение циркуляции крови, что симулирует состояние нагрузки. После этого давление на протяжении сосуда измеряется еще раз, что позволяет определить, являются ли места стенозирования важными, вызывают ли именно они боли у пациента при физических нагрузках. Аденозиновый тест не является безопасным: возможно развитие нарушений сердечного ритма, однако из-за короткого периода полувыведения аденозина лишь кратковременно.
Спазмы коронарных сосудов и ацетилхолиновый тест
Спазмы коронарных артерий часто являются причиной болей за грудиной в ночное время суток у пациентов без видимых изменений коронарных сосудов. Таким пациентам также назначают коронароангиографию и проводят вышеуказанный провокационный тест, чтобы исключить психогенные или некардиальные причины таких симптомов. Сейчас у каждого человека, уже сдавшего физиологию, должна промелькнуть мысль: «Почему ацетилхолин?». Если вы не находите ответа, возможно, придется снова открыть учебник. Дело в том, что эндотелий сердца при аппликации ацетилхолина вырабатывает NO, что приводит к расширению сосудов. Ацетилхолин оказывает вазоконстрикторное действие на гладкомышечные клетки сосудов в результате прямой их стимуляции, если эндотелий поврежден. Таким образом можно отличить здоровый эндотелий от поврежденного. Здоровые сосуды реагируют на ацетилхолин расширением, поврежденные же сужаются. При сужении сосудов более чем на 75 % по сравнению с аппликацией нитроглицерина внутрикоронарно говорят о коронарном спазме.
Аневризма коронарной артерии
Аневризма коронарной артерии - это расширение просвета венечного сосуда на 50% и более по отношению к его проксимальному сегменту. Ведущими причинами патологии выступают атеросклероз, системный васкулит, врожденные аномалии, травмы и ятрогенные вмешательства. Заболевание длительное время протекает бессимптомно, боли в сердце и другие клинические проявления наблюдаются в случае развития ИБС. Для диагностики сосудистой аномалии проводят ангиографию, ЭКГ и УЗИ сердца, комплекс лабораторных исследований. Кардиохирургическое лечение (стентирование, аневризмэктомия) показано при крупных аневризмах и наличии осложнений.



Распространенность аневризм коронарных артерий (АКА) в популяции составляет от 0,3% до 5,3%. Разбег в статистических данных обусловлен отсутствием клинической симптоматики заболевания и его поздней диагностикой. Патология распространена во всех возрастных группах, в том числе у детей. Мужчины болеют чаще женщин. Клиническая значимость коронарных аневризм остается дискутабельным вопросом среди ученых и врачей, поскольку в одних случаях сосудистая аномалия никак себя не проявляет, в других - становится причиной острых кардиоваскулярных событий.
Основным фактором риска признан атеросклероз, который вызывает до 50% АКА. При отложении липидных бляшек в коронарных сосудах и прогрессирующих изменениях сосудистой стенки возможно локальное расширение и выбухание участка артерии. Патология чаще развивается у людей с длительным стажем атеросклероза, наличием сопутствующей гипертонической болезни, наследственной предрасположенности к сердечно-сосудистым болезням. Другие причины аневризм:
- Системные васкулиты. До 20% случаев заболевания связано с воспалительными изменениями в сосудистых стенках при болезни Кавасаки, гранулематозе Вегенера, артериите Такаясу. Такие патологии могут быть причиной аневризматического расширения сосудов у детей и молодых людей.
- Врожденные аномалии. Патология связана с разнообразными нарушениями формирования сердца и сосудистого русла во внутриутробном периоде. Предрасполагающие факторы такого состояния не установлены, нередко оно сочетается с фибромускульной дисплазией.
- Механические повреждения. Патологическое расширение венечного сосуда наблюдается у некоторых пациентов после травм грудной клетки. Еще одной причиной выступают ятрогенные травмы — повреждения сосудов при выполнении аортокоронарного шунтирования, установки стентов без лекарственного покрытия.
- Кокаиновая наркомания. Кокаин оказывает прямое повреждающее действие на эндотелий коронарных артерий, нарушает кровоток и способствует развитию сосудистых аномалий. Дополнительным фактором риска являются повторные эпизоды вазоконстрикции и гипертензии во время наркотического опьянения.
При сочетанных аневризмах коронарных артерий, аорты и других магистральных сосудов диагностируется аневризматическая болезнь. Такая патология характерна для пациентов, имеющих сразу несколько групп факторов риска: генетические (наличие аневризм у ближайших родственников), сердечно-сосудистые (перенесенный инфаркт миокарда, сердечная недостаточность, стеноз сонных артерий), атеросклеротические (высокий уровень ЛПНП, аполипопротеина А1).
Патологическое расширение на участке артериального русла связывают с сочетанным действием нескольких факторов: хронического воспаления, атеросклеротических дегенеративных изменений, усиления скорости кровотока и повышения кровенаполнения коронарной артерии. Большое значение в патогенезе АКА придается изменению уровня тканевых металлопротеиназ, сопряженному с нарушением целостности сосудистых стенок.
Сосудистая аномалия провоцирует локальные нарушения кровообращения в пораженном участке, турбулентные токи крови, повышенный риск тромбообразования. При отрыве тромба или нестабильной бляшки возможны тромбоэмболические осложнения. Еще одним негативным моментом АКА является неэффективность коллатерального кровообращения, что вызывает серьезные опасения при сопутствующем атеросклеротическом поражении другой венечной артерии.

Для постановки диагноза и выбора рациональной тактики лечения в практической кардиологии используется несколько вариантов систематизации коронарных аневризм. Классификация заболевания проводится по следующим признакам:
- Форма. Аневризматические расширения артерий делятся на 2 большие группы: мешотчатые (сакулярные), которые бывают однокамерными и многокамерными, и веретенообразные (фузиформные).
- Количество. Единичные аневризмы чаще наблюдаются у пациентов с атеросклерозом или перенесенным вмешательством на коронарных сосудах. Множественные патологии характерны для системных воспалительных процессов.
- Размер. По внутреннему диаметру АКА подразделяются на мелкие (до 5 мм), средние (5-8 мм), гигантские (свыше 8 мм).
- Локализация. Более 40% аномалий расположено в правой венечной артерии, реже наблюдается поражение огибающей и нисходящей ветвей левой коронарной артерии. Расширение общего ствола левой венечной артерии и трехсосудистое поражение относятся к казуистическим случаям.
Симптомы аневризмы коронарной артерии
При единичной сосудистой аномалии клинические проявления отсутствуют. Установление диагноза чаще всего происходит у пациентов среднего и пожилого возраста, которым назначают ангиографическое исследование венечных артерий при наличии признаков стенокардии. Множественные коронарные аневризмы проявляются приступами загрудинных сжимающих болей, которые возникают в связи с эмоциональным потрясением или физической нагрузкой.
Наличие аневризмы коронарной артерии признано многими специалистами фактором повышенного риска инфаркта миокарда. Ситуация осложняется сопутствующим атеросклерозом, артериальной гипертензией, метаболическим синдромом. При гигантских сосудистых аномалиях возможен обширный трансмуральный инфаркт с кардиогенным шоком. В редких случаях наблюдается спонтанный разрыв пораженного сосуда с формированием гемоперикарда и тампонады сердца.
Во ходе физикального осмотра врачом-кардиологом специфические признаки аневризмы не обнаруживаются. При наличии у пациента ИБС или артериальной гипертонии определяются акценты сердечных тонов, функциональные и органические внутрисердечные шумы, другие симптомы кардиоваскулярной патологии. Дополнительно проводится измерение антропометрических показателей и расчет ИМТ для оценки риска висцерального ожирения. Для постановки диагноза АКА назначаются следующие методы:
- Коронарография. Рентгенологическое исследование коронарных артерий с контрастированием - «золотой стандарт» для определения наличия, вида и размеров аневризмы. Диагностика проводится всем больным с подозрением на АКА и симптомами стенокардии. По показаниям методику дополняют высокоинформативной КТ-ангиографией.
- УЗИ с допплерографией. Исследование показывает сократительную способность миокарда, характер кровообращения и состояние магистральных сосудов. Ультразвуковая диагностика не позволяет визуализировать коронарную аневризму, однако она необходима для комплексной оценки состояния сердечно-сосудистой системы.
- ЭКГ. Результаты электрокардиографии важны для диагностики ишемических поражений сердечной мышцы, выявления острого коронарного синдрома как типичного осложнения аневризмы коронарной артерии. По данным кардиограммы можно обнаружить признаки гипертрофии левого желудочка, возникшей вследствие артериальной гипертензии.
- Лабораторные анализы. Для выявления первопричины аневризмы проводится липидограмма с определением общего холестерина и фракций липопротеидов. Повышение острофазовых показателей указывает на системный васкулит. При эпизодах загрудинных болей назначаются анализы на тропонин и другие миокардиальные маркеры.
Дифференциальная диагностика
При выявлении типичной ангиографической картины постановка диагноза не оставляет сомнений. Сложности возникают при дифференцировке разных причин АКА, необходимости исключить системные васкулиты, другие аутоиммунные и идиопатические формы сосудистого поражения. Для уточнения предпосылок формирования коронарной аневризмы может потребоваться консультация ревматолога, рентгенография легких, расширенные иммунологические исследования.

Лечение аневризмы коронарной артерии
При небольшом размере АКА и отсутствии симптоматики показано динамическое наблюдение. Для контроля размера аневризмы и состояния коронарных артерий проводится ежегодная коронарография, УЗИ сердца, ЭКГ. Поскольку заболевание зачастую сочетается с атеросклерозом, таким больным назначается низкохолестериновая диета и гиполипидемическая терапия. При развитии АКА на фоне васкулита показано этиопатогенетическое лечение по протоколам.
Показаниями к хирургическому вмешательству при аневризме коронарной артерии служат ее гигантские размеры, критические нарушения кровотока в венечных сосудах, нестабильная стенокардия и высокая вероятность инфаркта миокарда. В таком случае выполняется аневризмэктомия или пластика аневризмы в сочетании с различными видами шунтирующих операций. Также возможно эндоваскулярное лечение - установка стенка с лекарственным покрытием.
Большинство случаев АКА имеют благоприятное течение и выявляются случайно при кардиологическом обследовании. Менее оптимистичный прогноз для пациентов со множественными гигантскими аневризмами, рефрактерной дислипидемией, прогрессирующими системными васкулитами. Профилактика коронарных аневризм заключается в своевременной диагностике и лечении заболеваний, вызывающих сосудистые аномалии.
1. Аневризма левой коронарной артерии: клиническое наблюдение/ Р.Е. Калинин// Наука молодых. - 2021. - №4.
2. Гигантская аневризма коронарной артерии/ П.В. Чумаченко, М.А. Афанасьев, И.Е. Галанкина, Л.Н. Ильина, А.Ю. Постнов// Архив патологии. - 2017. - №5.
3. Случай успешного эндоваскулярного лечения множественных гигантских аневризм коронарных артерий/ А.Ю. Краснов, И.В. Фаянс, А.В. Ягода, О.И. Боева, В.Н. Колесников// Медицинский вестник Северного Кавказа. - 2013. - №4.
4. Аневризмы коронарных артерий: три клинических случая/ С.А. Абугов, В.А. Сулимов, А.Е. Удовиченко// Международный журнал интервенционной кардиоангиологии. - 2004. - №6.
Читайте также:
- Иммунитет. Иммунная система при легочной патологии
- Психологический портрет будущего идеального мужа. Какой он идеальный мужчина?
- Свободные жирные кислоты. Транспорт свободных жирных кислот
- Техника аппаратного промывания желудка. Чем промывать желудок при отравлении?
- Пример артроскопической реконструкции сухожилия подлопаточной мышцы с замещением отделов вращательной манжеты кожным трансплантатом
