Доступ и ход операции мезоатриального шунтирования
Добавил пользователь Дмитрий К. Обновлено: 01.02.2026
Принцип этой непростой операции был разработан советским учёным и врачом Владимиром Демиховым, под его же авторством в 1960 вышел первый трактат по трансплантологии, который практически сразу перевели на английский. Коронарные артерии носят своё название из-за «венчающего» расположения их соединения с сердцем.
При проводившихся в 1507 году Леонардо да Винчи незаконных вскрытиях трупов в целях изучения анатомии, учёный заметил, что причиной смерти могут служить пробки в этих артериях. Склеротические бляшки чаще всего появляются в ближайшем к миокарду участке левой из них, вызывая стенокардию и даже инфаркт.
Идея обеспечивать сердце кровью обходным путём пришла Демихову во время Великой Отечественной Войны, когда молодого физиолога мобилизовали в качестве патологоанатома в госпиталь при фронте. План заключался в переносе грудной внутренней артерии к сердцу и сшивании её с коронарной в области ниже образования пробки, этот трансплантат зовётся шунтом.
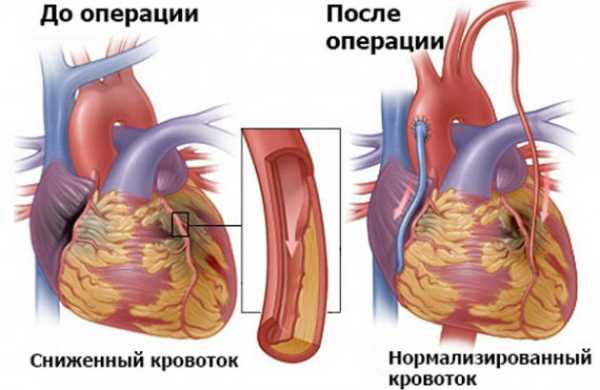
В современном шунтировании выполняется и сшивание с лучевой артерией руки и большой ножной подкожной веной. Первые операционные опыты проводились с расчётом того, чтобы не превысить крайне сжатое допустимое для сердца время без подачи крови.
В нынешнее время применяется аппарат, обеспечивающий искусственное питание сердца, малоинвазивный метод, либо же оперируется бьющееся сердце.
На ранних этапах закупорку сосудов и артерий лечат медикаментами, координацией образа жизни и лечебными процедурами. Шунтирование сердца - это распространённая по всему миру высокоэффективная операция на артериях и сердечной мышце для возобновления питания сердца обходным путём подачи крови, применяемая в запущенных случаях.
Не следует путать его со стентированием, заключающемся в установке в суженные сосуды и тракты расширяющего каркаса.
Аортокоронарное шунтирование делится на такие виды как:
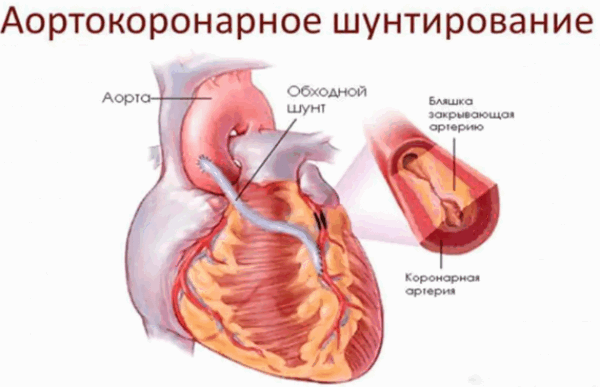
Приведённые цены являются приблизительными, стоимость операции устанавливает ценовая политика выполняющей её организации.
Как выполняется АКШ?
Коронарное шунтирование заключается в том, чтобы с помощью шунта создать дополнительный обходной путь от аорты к артерии, который позволяет миновать участок, где произошла закупорка, и восстановить кровоток к сердцу. Шунтом чаще всего становится грудная артерия. Благодаря своим уникальным особенностям, она имеет высокую сопротивляемость атеросклерозу и долговечность в качестве шунта. Однако может быть использована большая подкожная вена бедра, а также лучевая артерии.
АКШ бывает одиночным, а также двойным, тройным и т.д. То есть если сужение произошло в нескольких коронарных сосудах, то вставляют столько шунтов, сколько необходимо. Но их количество не всегда зависит от состояния пациента. Например, при ишемической болезни выраженной степени может понадобиться только один шунт, а ИБС меньшей степени выраженности, наоборот, потребует двойное, или даже тройное, шунтирование.
Для налаживания кровоснабжения сердца при сужении артерий есть несколько альтернативных методов:
- Лечение лекарственными препаратами (например, бета-блокаторами, статинами);
- Коронарная ангиопластика - нехирургический метод лечения, когда к месту сужения подводится специальный баллон, который раздуваясь, открывает суженный канал;
- Стентирование - в пораженный сосуд вводится металлическая трубочка, которая увеличивает его просвет. Выбор метода зависит от состояния коронарных артерий. Но в некоторых случаях показано исключительно АКШ.
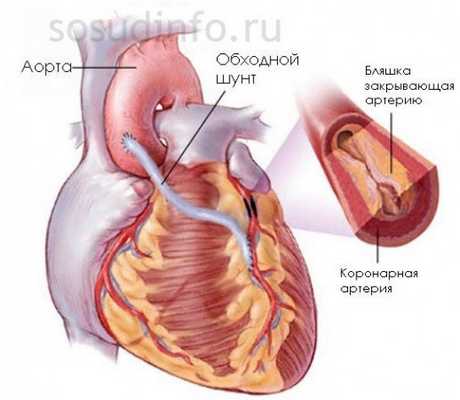
Операция выполняется под общим наркозом на открытом сердце, ее длительность зависит от сложности и может продолжаться от трех до шести часов. Хирургическая бригада выполняет обычно лишь одну такую операцию в день.
Существует 3 вида аортокоронарного шунтирования:
- С подключением аппарата ИК (искусственного кровообращения). В этом случае сердце пациента останавливают.
- Без ИК на работающем сердце - данный метод уменьшает риск возникновения осложнений, сокращает длительность операции и позволяет пациенту быстрее восстановиться, но требует от хирурга большого опыта.
- Относительно новая техника - миниинвазивный доступ с применением ИК или без него. Преимущества: меньшая кровопотеря; уменьшение числа инфекционных осложнений; сокращение времени пребывания в стационаре до 5-10 дней; более скорое выздоровление.
Любая операция на сердце включает определенный риск осложнений. Но благодаря проработанным техникам проведения, современному оборудованию и широкой практике применения, АКШ имеет очень высокие показатели положительных результатов. И все-таки прогноз всегда зависит от индивидуальных особенностей заболевания и сделать его может только специалист.
Шунтирование сердца: сколько длится операция, подготовка, основные этапы и возможные осложнения
Перед операцией АКШ необходимо выполнить специальные подготовительные процедуры.
Прежде всего, перед операцией последний прием пищи осуществляется вечером: пища должна быть легкой, сопровождается негазированной питьевой водой. В зонах, где будут осуществляться надрезы и забор шунта, волосы должны быть тщательно выбриты. Перед операцией кишечник очищают. Необходимые лекарственные препараты принимают сразу после ужина.
Накануне операции (обычно за день до проведения) оперирующий хирург рассказывает детали шунтирования, проводит осмотр пациента.
Специалист по дыхательной гимнастике рассказывает о специальных упражнениях, которые придется выполнять после операции для ускорения реабилитации, поэтому выучить их надо заранее. Требуется сдать медсестре на временное хранение свои личные вещи.
Этапы проведения
На первом этапе операции АКШ анестезиолог вводит специальный препарат в вену пациента, чтобы он уснул. В трахею вставляется трубка, которая позволяет контролировать дыхательные процессы во время операции. Вставляемый в желудок зонд предотвращает возможные забросы содержимого желудка в легкие.
На следующем этапе раскрывается грудная клетка пациента, чтобы обеспечить необходимый доступ к области операции.
На третьем этапе сердце пациента останавливают, подключая искусственное кровообращение.
Во время подключения искусственного кровотока второй хирург извлекает шунт из другого сосуда (или вены) пациента.
Доступ и ход операции портокавального … Доступ и ход операции портокавального … Доступ и ход операции портокавального … Доступ и ход операции портокавального … Доступ и ход операции портокавального …
Шунт вставляется таким образом, чтобы кровоток, обходя поврежденный участок, позволил полностью обеспечить поступление питательных веществ к сердцу.
После того, как работу сердца восстанавливают, хирурги проверяют работоспособность шунта. Затем полость грудной клетки зашивается. Пациента отвозят в отделение реанимации.
Сколько длится операция по шунтированию сердца? Как правило, процесс занимает от 3 до 6 часов, однако возможна и другая продолжительность операции. Длительность зависит от количества шунтов, индивидуальных особенностей пациента, опыта хирурга и т.д.
Можно спросить хирурга о предполагаемой длительности операции, но точную продолжительность данного процесса вам смогут сообщить только после окончания.
Как правило, возможные осложнения проявляются уже после выписки пациента домой.
Эти случаи довольно редки, однако необходимо сразу же обратиться к лечащему врачу, если заметили следующие признаки:
- послеоперационный рубец покраснел, из него выходят выделения (цвет выделений не важен, поскольку самих выделений в принципе быть не должно);
- высокая температура;
- озноб;
- сильная утомляемость и одышка без видимых причин;
- быстрая прибавка в весе;
- резкое изменение пульса.
Главное — не паниковать, если заметили один или несколько симптомов у себя. Вполне возможно, что за данными симптомами стоит обычная усталость или вирусное заболевание. Выявить точный диагноз сможет только врач.
Обезболивание при операции
Перекрестное бедренно-бедренное шунтирование проводится чаще всего под спинномозговой или эпидуральной анестезией.
Для этого анестезиолог делает укол в области поясницы и вводит анестезирующий препарат в область позвоночника. На несколько часов это вызывает устранение чувствительности нижних конечностей. Для обезболивания в послеоперационном периоде применяется установка специального катетера в область позвоночника. Это называется продленной перидуральной анестезией.
С целью контроля над жизненно-важными функциями к пациенту подключается следящий монитор, регистрирующий пульс и электрокардиограмму. Для этого на груди больного закрепляются датчики, а на руке манжета аппарата измерения давления.
Операция может проводится под местной, спинальной или эпидуральной анестезией. В нашей клинике используется преимущественно эпидуральная анестезия, так как эпидуральный катетер позволяет проводить эффективное обезболивание в послеоперационном периоде.
Катетер устанавливается в область поясницы с помощью укола специальной иглой. После проведения катетера в перидуральное пространство вводится небольшое количество анестетика, а пациент рассказывает о своих ощущениях. Постепенно доза увеличивается и отключается чувствительность в ногах, а затем и движения.
Во время операции доктор подключает к пациенту следящий монитор, который измеряет давление, с помощью манжеты на плече и снимает ЭКГ в трех отведениях. Кроме того, на палец кисти надевается специальный датчик — пульсоксиметр, который измеряет пульсовую волну и насыщение крови кислородом (сатурацию).
Восстановление
Период реабилитации пациента после оперативного вмешательства непродолжительный. Если шунтирование прошло успешно, уже через неделю вам снимут швы на ноге, кровообращение нормализуется, а общее состояние пациента значительно улучшится.
Как правило, через 10-14 дней пациент уже может выписываться из больницы и отправляться домой. В некоторых случаях после шунтирования наблюдаются осложнения, которые проявляются:
- Повышением температуры тела в области поврежденной конечности;
- Покраснением и воспалением шва;
- Выделениями из раны;
- Общей слабостью и ухудшением самочувствия.
Если у пациента наблюдается один или несколько из перечисленных выше тревожных симптомов, медики назначают дополнительное обследование и медикаментозное лечение.
Доступ и ход операции портокавального … Доступ и ход операции портокавального … Доступ и ход операции портокавального … Доступ и ход операции портокавального … Доступ и ход операции мезоатриального …
Существует несколько правил, которых обязательно должен придерживаться пациент после шунтирования. Обязательно запомните рекомендации врачей, и активно используйте их в повседневной жизни.
- Если прооперированная конечность через несколько недель после шунтирования начала вас беспокоить, появилась болезненность, покраснение и воспаление, незамедлительно обратитесь к врачу.
- Регулярно делайте обследование конечности и кровеносной системы, чтобы контролировать процесс ремиссии заболевания. Особенно это правило касается пациентов с атеросклерозом.
- Принимайте выписанные доктором медикаменты, которые защищают ваши сосуды от образования новых бляшек, разжижают кровь. Чтобы избежать инфицирования и воспаления прооперированного участка конечности, медики иногда назначают больным антибиотики.
- Пересмотрите свой рацион питания . От варикоза и атеросклероза чаще всего страдают люди избыточным весом. Откажитесь от вредных продуктов, содержащих много жира и холестерина.
- Ведите активный образ жизни. Умеренные физические нагрузки помогут вам быстрее восстановиться после операции, ускорят кровообращение. Однако предварительно нужно обязательно проконсультироваться с врачом, ведь неправильно подобранная система тренировок может, наоборот, навредить вашему здоровью.
- Откажитесь от вредных привычек - курения, употребления крепких алкогольных напитков.
Первый месяц после операции очень важен. На протяжении этого периода времени пациенту рекомендуется включить в рацион питания продукты, способствующие снижению уровня холестерина в крови - цитрусовые, ягоды и фрукты с большим содержанием витамина С.
Рекомендуется употреблять жирную морскую рыбу, капусту, мед, отвар шиповника . Соблюдение всех вышеперечисленных правил в период реабилитации позволит минимизировать риск развития каких-либо осложнений после процедуры шунтирования.
Противопоказания и возможные осложнения
Неожиданности во время или после шунтирования возникают крайне редко и обычно связаны либо с фоновыми заболеваниями, либо с общим неудовлетворительным состоянием организма.
Врачу и пациенту следует быть готовым к возникновению таких проблем, как:
- Тромбоз шунта. Закупорка может случиться как в процессе операции, так и через долгое время после. Это значит, что остальные сосуды нижних конечностей нездоровы. Резкое ухудшение кровоснабжения сопровождается болью и является показанием к срочной операции. В редких случаях, когда шунтирование невозможно, ногу спасти не удается.
- Чрезмерная потеря крови. Назначается переливание и повтор процедуры.
- Проблемы с сердцем. Наркоз и постороннее вмешательство добавляет сердцу нагрузки, что может быть фатальным при поражениях сердечных сосудов. Такие больные уже после проводят несколько дней в реанимации.
- Почечная недостаточность. Сама по себе возникает крайне редко. Обычно фоном идут уже имеющиеся заболевания. Хирург решает проблему диализом.
- Лимфорея. Паховая область богата на лимфатические сосуды, функция которых - обеспечить вены межтканевой жидкостью. Истечение лимфой грозит возникновением на месте разреза очаговых инфекций. Процесс может длиться до нескольких недель и лечится локально.
- Отечность. После вмешательства приток крови к ноге усиливается и провоцирует появление отека.
- Нарушение кожной чувствительности. Операционный порез травмирует нервные окончания в кожных покровах, что приводит к частичному онемению верха бедра, а также прооперированных зон. Обычно со временем проходит само и никак не влияет на способность двигаться.
- Гной и нарушение целостности швов замедляет выздоровление и способствует образованию неэстетичных рубцов.
Коронарное шунтирование сердца: как делают?
АКШ оказывается эффективным не только при поражении одной коронарной артерии, но и нескольких. Коронарное шунтирование сосудов сердца заключается в том, что параллельно артериям с нарушенным кровотоком подшиваются новые сосуды - шунты. Для последних используются участки здоровых сосудов пациента, взятые обычно из ноги, поскольку там самые длинные сосуды. Но может использоваться и грудная артерия, которая уже соединена с аортой — тогда требуется лишь подшить её противоположный конец к сердечной артерии. Один конец вены пришивается к отверстию в аорте, а другой к артерии. После операции кровоток направляется по новым сосудам, в обход участков блокировки или стеноза. Таким образом, АКШ приводит к нормализации кровотока и обеспечению миокарда питанием.
Показания для мезоатриального … Доступ и ход операции мезоатриального … Доступ и ход операции мезоатриального … Лабораторная диагностика Портальная гипертензия Общие сведения Еще в
Доступ и ход операции мезоатриального шунтирования
РНЦХ им. акад. Б.В. Петровского РАМН
Первый МГМУ им. И.М. Сеченова;
Московский НИИ педиатрии и детской хирургии
Отделение кардиохирургии клиники аортальной и сердечно-сосудистой хирургии Первого МГМУ им. И.М. Сеченова
Кафедра сердечно-сосудистой хирургии и инвазивной кардиологии Первого МГМУ им. И.М. Сеченова (зав. — д.м.н. Р.Н. Комаров), Российский научный центр хирургии им. акад. Б.В. Петровского (дир. — акад. РАН Ю.В. Белов), Москва, Россия
Как я делаю это: коронарное шунтирование с применением операционного микроскопа
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2018;(6): 101‑105
Ишемическая болезнь сердца занимает одно из ведущих мест в структуре причин инвалидизации и смерти населения трудоспособного возраста в развитых странах [1]. Хирургическое лечение ишемической болезни сердца и ее осложнений — одна из главных задач современной сердечно-сосудистой хирургии, на решение которой работают крупнейшие научно-исследовательские организации по всему миру. Улучшение непосредственных и отдаленных результатов коронарного шунтирования — важная составляющая успеха в комплексном подходе лечения ИБС.
С момента первых операций коронарного шунтирования в 60-е годы XX века и до настоящего времени различные факторы расценивали как наиболее важные для обеспечения оптимального результата операции. Среди этих факторов, которые остаются актуальными и сейчас, особое место занимают:
— оптимальная медикаментозная терапия;
— отказ пациента от вредных привычек.
Хирургическая реваскуляризация миокарда составляет от 50 до 90% от общего количества операций на сердце в кардиохирургических центрах в зависимости от специализации (трансплантационные центры, аортальные центры, центры по лечению врожденных и/или приобретенных пороков сердца и т. д.) [2—6].
Коронарное шунтирование — операция, которую чаще всего выполняют молодые хирурги в процессе обучения кардиохирургии, но ювелирная работа с сосудами малого диаметра — очень ответственная процедура.
Наложение коронарных анастомозов требует от хирурга высокого технического мастерства, микрохирургического инструментария, миниатюрных игл, тончайшего шовного материала и, конечно, опыта.
Основная задача коронарного шунтирования — формирование обходных путей мест гемодинамически значимого сужения коронарных артерий больного с использованием аутоартериальных или аутовенозных шунтов.
Основной эффект операции коронарного шунтирования будет напрямую зависеть от того, насколько правильно выбрано место наложения анастомоза, от совершенства оперативной техники, шовного материала, действий ассистента при подготовке кондуитов и непосредственно при выполнении коронарных анастомозов.
Последние десятилетия в коронарной хирургии отмечается снижение требований к качеству и диаметру коронарных артерий пациентов, идущих на операцию, что обусловлено возрастом пациентов, сахарным диабетом, длительным анамнезом заболевания и, конечно, предыдущим опытом интервенционного лечения [9—15].
В сложившихся реалиях все сложнее технически выполнить полную реваскуляризацию миокарда у пациентов с артериями малого калибра (менее 1,5 мм), диффузно пораженных и кальцинированных, но именно полная реваскуляризация зачастую — залог хорошего непосредственного, а может, и отдаленного результата операции.
Показания для оперативного лечения ИБС хорошо известны [7—8], и мы позволим себе не останавливаться на их перечислении, лишь отметим, что стандартный пациент с ИБС приходит на операцию со следующим «букетом» заболеваний и патологических состояний, а часто их сочетанием:
— сахарный диабет до 25%;
— избыточная масса тела до 30%;
— возраст старше 70 лет, до 25%;
— коронарное стентирование в анамнезе, до 30%;
— сопутствующие заболевания сердца и сосудов, до 15%.
Коронарное шунтирование в условиях искусственного кровообращения (ИК) и кардиоплегии и без ИК в различных клиниках выполняют в непредсказуемых соотношениях и не всегда аргументированно обосновывают применяемый способ, но мы выступаем за дифференцированный подход.
Коронарное шунтирование в условиях ИК и кардиоплегии с 1968 г. стало «золотым стандартом» в реваскуляризации миокарда — на «сухом», остановленном сердце возможно выполнение идеальных по качеству анастомозов [16—20].
Реваскуляризация миокарда без искусственного кровообращения несколько сложнее и требует большего опыта и напряжения всей операционной бригады, но иногда позволяет избежать негативных эффектов ИК у пациентов с тяжелыми сопутствующими заболеваниями при сопоставимых непосредственных и среднеотдаленных результатах (если таковое возможно).
По нашему мнению, у всех пациентов следует выполнять полную реваскуляризацию миокарда, отказ от шунтирования гемодинамически значимо стенозированных магистральных коронарных артерий ввиду малого диаметра или качества стенки сосуда является неприемлемым.
Стандартным, которое обычно используют хирурги для коронарного шунтирования, является увеличение в 2,5—6,0 раз; возрастание кратности увеличения недоступно для систем, использующих оправы или налобное крепление.
В такой ситуации на помощь может прийти использование операционного микроскопа для уверенного наложения анастомозов высокого качества с артериями пограничного (менее 1,5 мм) и малого (менее 1,0 мм) диаметра.
Зачастую хирурги избегают выполнять шунтирование сосудов малого диаметра ввиду высокого риска развития ранней дисфункции шунта и, как следствие, периоперационного инфаркта миокарда, предпочитая остановиться на неполной реваскуляризации миокарда, а в случае возникновения ишемических эпизодов в этой области снять с себя ответственность за произошедшее — инфаркт в не- шунтированной зоне.
Сложно переоценить важность применения операционного микроскопа при выполнении коронарной эндартерэктомии; хорошая визуализация дистального края атеросклеротической бляшки, полное удаление интимы и отсутствие любых дефектов в этой зоне — необходимые условия успеха эндартерэктомии из коронарной артерии [21, 22].
Особенно требовательны к технике выполнения эндартерэктомии передняя и задняя межжелудочковые артерии, которые имеют большое количество боковых и септальных ветвей и нередко диффузно поражены атеросклерозом.
Применение операционного микроскопа позволяет выполнить шунтирование коронарных артерий малого диаметра, прямую коронарную эндартерэктомию и любую сложную реконструкцию коронарной артерии с хорошими непосредственными и отдаленными результатами.
Операционный микроскоп
Операционный микроскоп — сложный оптический прибор, позволяющий манипулировать в оптимально освещенном операционном поле с увеличением объекта от 6,0 до 25 крат.
Среди технических характеристик операционных микроскопов, на которые следует обратить внимание при выборе, остановимся на самых важных:
— фокусное расстояние — дистанция от объекта до линзы микроскопа, для использования в коронарной хирургии подойдет прибор с фокусным расстоянием от 200 мм;
— глубина резкости — параметр, указывающий на расстояние по вертикальной оси от объекта до линзы микроскопа, в пределах которого изображение в окулярах будет в фокусе, очень сильно зависит от выбранного увеличения и может колебаться от 0,3 до 1,0 см;
— изменяемое фокусное расстояние (вариофокус) — способность операционного микроскопа давать четкое изображение объекта («в фокусе») в пределах изменяемой дистанции от линзы микроскопа до объекта, например — от 300 до 400 мм;
— увеличение, плавная регулировка увеличения — параметры, позволяющие судить о линейном размере объекта видимого в окуляры микроскопа к линейным размерам того же объекта, видимого невооруженным глазом с расстояния 25 см, возможность его динамической подстройки в зависимости от интраоперационной ситуации и потребностей хирурга;
— поле зрения — область с объектом операции, видимая в окуляры микроскопа; размеры поля зрения зависят от степени увеличения: чем больше увеличение, тем меньше поле зрения.
С точки зрения подачи в операционную рану и удобства позиционирования и настройки, оптимальным выбором являются операционные микроскопы с фиксацией рабочей части электромагнитными замками — управляемыми с ручек-джойстиков непосредственно хирургом, имеющие изменяемое фокусное расстояние и плавную регулировку увеличения, например — Carl Zeiss OPMI Vario или Carl Zeiss Pentero 900.
Первый опыт работы на коронарных артериях с операционным микроскопом в СССР группы академика Р.С. Акчурина и наш ранний опыт свидетельствуют о том, что использование даже самых простых моделей (Carl Zeiss OPMI6, 1984 г.) может значительно улучшить визуализацию коронарных анастомозов и их качество, а основные неудобства связаны исключительно с эргономикой приборов (фиксированное фокусное расстояние, управление педалями и т. д.), оптическая часть всех операционных микроскопов, на которых доводилось работать, превосходна и безупречна независимо от года выпуска.
Дистальный анастомоз с коронарными артериями малого диаметра
Операция коронарного шунтирования с использованием операционного микроскопа до момента наложения дистальных анастомозов не имеет никаких отличий по этапам от обычного коронарного шунтирования. Срединная стернотомия, мобилизация кондуитов, подключение аппарата ИК и кардиоплегия по стандартной схеме, принятой в РНЦХ им. акад. Б.В. Петровского.
После проведения кардиоплегии в рану со спины оперирующего хирурга подают рабочую часть микроскопа с предварительно одетым стерильным чехлом. Хирург управляет микроскопом с помощью джойстиков, выбирая оптимальную позицию, увеличение, настраивая фокус и яркость света.
Для минимизации подстройки фокуса в процессе наложения анастомозов при использовании операционного микроскопа мы рекомендуем использовать вакуумный стабилизатор миокарда, который надежно фиксирует выбранный фрагмент сердца, исключая любые, даже минимальные смещения.
Увеличение, с которым работает хирург при использовании операционного микроскопа, обычно варьирует от 6,0 до 12,0 и в среднем оно составляет 9,0. Не стоит стремиться работать с максимальным увеличением без необходимости, это может сильно ограничивать глубину резкости и размеры операционного поля, что затрудняет работу хирурга и ассистента. В случае необходимости в наиболее ответственные моменты наложения анастомоза всегда можно сделать увеличение больше.
Одна из принципиальных особенностей работы с операционным микроскопом — выполнение всех действий при наложении анастомоза хирургом и ассистентом только под контролем зрения через окуляры микроскопа. Отсюда же вытекает одно из преимуществ — единое поле зрения хирург-ассистент.
Диссекцию коронарной артерии выполняем абсолютно стандартно, по возможности сохраняя нетронутыми все рядом расположенные структуры (вены, миокард и т. д.).
Длина анастомоза обычно определяется диаметром коронарной артерии и составляет примерно 2,5 диаметра, т. е. при диаметре артерии 1,0—1,5 мм длина анастомоза может быть около 3,0—3,5 мм.
Артериотомию выполняем скальпелем с лезвием № 11, не повреждая заднюю стенку артерии, далее обязательно расширяем разрез стенки артерии в продольном направлении дистально и проксимально микроножницами.
Шунт должен лежать под углом 30—45° в направлении параллельно коронарной артерии. Конфигурация и размер среза шунта должны максимально соответствовать длине артериотомии, нежелательно выполнение анастомозов между заведомо неравнозначными сосудами. Соотношение 1,2:1 в размерах кондуита и коронарной артерии на наш взгляд оптимально.
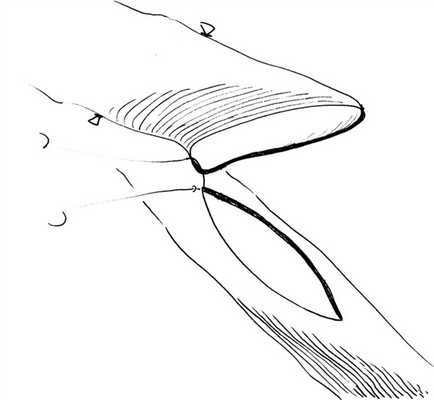
Шить анастомоз мы начинаем с «пятки», фиксация и низведение кондуита на первый шов с узлом (рис. 1), Рис. 1. Фиксация «пятки» коронарного анастомоза. с последующим непрерывным обвивным швом по всей окружности анастомоза. Ассистент «ведет» нитку и держит ее в натяжении между стежками, но при этом очень деликатно, не повреждая и не заламывая ее.
Для наложения анастомозов рекомендуем короткую (около 10,0 см) полипропиленовую нить 8/0 с иглой 6,5 мм, в отдельных случаях допустимо использовать полипропиленовую нить 9/0 на игле 5,0 мм.
Направление проведения иглы через сосуды может быть снаружи—внутрь или наоборот для кондуита и коронарной артерии, мы же предпочитаем проводить иглу с кондуита на коронарную артерию для исключения риска расслоения артерий сердца.
Шаг стежков анастомоза зависит от состояния стенки артерии, используемого кондуита и всегда индивидуально подбирается хирургом для каждой конкретной ситуации.
Очень важным моментом при выполнении коронарного анастомоза являются равномерность и симметричность стежков, симметричность отступа от края артерии и кондуита, правильность затягивания нити ассистентом и предупреждение прорезывания стенки и интерпозиции краев.
По завершению наложения анастомоза желательно провести гидравлическую пробу, проходить через анастомоз бужом соответствующего диаметра в дистальном направлении обычно нет необходимости, ввиду превосходного визуального контроля. Завязывать нить следует после расправления анастомоза жидкостью на давлении 70—100 мм рт.ст.
Наложение дополнительных швов при работе с операционным микроскопом на коронарные анастомозы обычно не требуется, всегда надо помнить, что это крайне нежелательно может привести к деформации анастомоза.
После окончания наложения всех дистальных анастомозов ход операции также не отличается от обычного коронарного шунтирования.
Коронарная эндартерэктомия и шунт-пластика коронарных артерий
В случае тотального поражения коронарной артерии, весь просвет которой представлен атеросклеротической бляшкой, в ряде случаев возможно выполнить коронарную эндартерэктомию.
Наиболее оправдано выполнение эндартерэктомии из передней межжелудочковой ветви (ПМЖВ) и задней межжелудочковой ветви (ЗМЖВ) правой коронарной артерии (ПКА), в других коронарных артериях обычно не составляет труда найти дистальный участок хотя и небольшого диаметра, но с приемлемым качеством стенки для наложения анастомоза.
Выполнение изолированной шунт-пластики коронарной артерии обычно мы не рекомендуем ввиду заведомой компрометации места дистального анастомоза атеросклеротической бляшкой с высоким риском периоперационного тромбоза.
Выполняя эндартерэктомию из коронарной артерии с применением операционного микроскопа, следует придерживаться тактики открытой эндартерэктомии: продлить разрез на коронарной артерии до неизмененной части в дистальном направлении, микрошпателем (лопаткой) войти в слой между бляшкой и стенкой артерии и полностью под контролем зрения выполнить тромбэндартерэктомию (рис. 2). Рис. 2. Протяженная открытая коронарная эндартерэктомия. В дистальном отделе необходимо убедиться в отсутствии флотирующих фрагментов интимы и материальных эмболов. Пластику образовавшегося дефекта лучше всего выполнить заплатой из аутоартерии, но допустимо и использование аутовены с последующим шунтированием в проксимальной части заплаты.
Если возможно выполнить первично длинный анастомоз эндартерэктомированной коронарной артерии с аутоартерией (или аутовеной) без использования заплаты — это оптимальный выбор, особенно учитывая ограничения по времени ишемии миокарда.
В периоперационном периоде и после выписки пациенты с эндартерэктомией из коронарных артерий должны получать агрессивную антикоагулянтную и антиагрегантную терапию, обычно это клопидогрель в сочетании в варфарином в течение 1 года после операции.
Подводя итоги в описании оперативной техники наложения анастомоза с коронарными артериями и применением операционного микроскопа, остановимся на основных моментах, которые мы стараемся неукоснительно соблюдать в нашей ежедневной работе:
1. Применение оптического увеличения операционного поля в 6—12 раз и более в зависимости от интраоперационной ситуации.
2. Использование шовного материала и игл минимально возможного размера и диаметра (полипропиленовая нить 8/0 на игле 6,5 мм или 9/0 на игле 5,0 мм).
3. Фиксация «пятки» анастомоза на первый шов с узлом снаружи и в дальнейшем непрерывный обвивной шов на весь анастомоз.
4. Проведение иглы строго «снаружи—внутрь» на шунте и «изнутри—наружу» на коронарной артерии.
5. Проведение иглы через ткани по ее кривизне, плавное и контролируемое.
6. Постоянный двойной (хирург-ассистент) визуальный контроль всех действий.
7. Затягивание нити на расправленном гепаринизированной кровью анастомозе для исключения кисетирования анастомоза.
Применение операционного микроскопа может снизить потребность в выполнении коронарной эндартерэктомии за счет возможности наложения коронарных анастомозов с артериями небольшого диаметра дистальнее выраженно измененного участка, что зачастую быстрее и безопаснее, особенно это касается артерий, расположенных на боковой и заднебоковой поверхностях сердца и не имеющих крупных ветвей в толще миокарда.
Использование операционного микроскопа, кроме возможного положительного влияния на исход и результаты операции для пациента, также оказывает благоприятное влияние на хирурга и ассистента. Отсутствие необходимости длительного стояния в вынужденной позе с опущенной вниз головой значительно снижает вероятность болевого синдрома в шейном отделе позвоночника у членов операционной бригады.
Одним из полезных свойств операционного микроскопа с точки зрения обучения и контроля можно считать возможность видеофиксации всего микрохирургического этапа операции, что может быть очень полезно в случае возникновения осложнений или любых спорных ситуаций в периоперационном периоде.
ФГБУ ВО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия;
ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», Новосибирск, Россия
Государственная новосибирская областная клиническая больница
ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия;
ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», Новосибирск, Россия
ГБУЗ НСО «Новосибирская государственная областная клиническая больница», Новосибирск, Россия
Мезентерико-кавальное шунтирование у больной с внепеченочной портальной гипертензией на фоне эритремии
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2010;(9): 68‑70
Поршенников И.А., Макарова О.В., Чикинев Ю.В., Юданов А.В., Лютин Д.А., Ким И.Н., Качесов И.В. Мезентерико-кавальное шунтирование у больной с внепеченочной портальной гипертензией на фоне эритремии. Хирургия. Журнал им. Н.И. Пирогова. 2010;(9):68‑70.
Porshennikov IA, Makarova OV, Chikinev YuV, Iudanov AV, Liutin DA, Kim IN, Kachesov IV. Mesenterico-caval by-pass in patient with portal hypertension and erythremia. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2010;(9):68‑70. (In Russ.).
Внепеченочная окклюзия воротной вены и ее притоков - вторая по частоте после цирроза печени причина синдрома портальной гипертензии, следствием которой являются 5-10% наблюдений кровотечений из варикозно-расширенных вен верхних отделов желудочно-кишечного тракта [5]. Эта форма портальной гипертензии более характерна для детского возраста, когда она возникает в результате врожденных мальформаций воротной вены, омфалита или катетеризации пупочной вены. У взрослых пациентов наиболее часто портальный тромбоз возникает вследствие цирроза печени, опухолей гепатопанкреатодуоденальной зоны, воспалительных заболеваний и операций на органах брюшной полости [1]. Миелопролиферативные заболевания являются весьма редкой причиной портальной гипертензии. Мы представляем наблюдение эритремии (истинной полицитемии) у 49-летней женщины, манифестировавшей тромбозом воротной и селезеночной вен с синдромом портальной гипертензии, успешно корригированным путем мезентерико-кавального шунтирования.
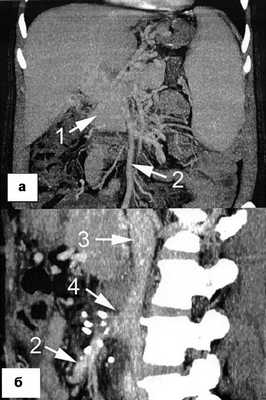
Больная Р., 49 лет, госпитализирована в Государственную новосибирскую областную клиническую больницу в связи с выявленным асимптомным варикозным расширением вен пищевода. За год до поступления при скрининговом ультразвуковом исследовании было обнаружено гиперваскулярное образование в области ворот печени, а при последующей компьютерной томографии в другом стационаре в области ворот печени визуализировано мягкотканное образование с нечеткими контурами размером 5×5×4 см (рис. 1, а), Рисунок 1. Спиральная компьютерная томограмма до (а) и после (б) мезентерико-кавального шунтирования. 1 - портальная кавернома, первоначально принятая за опухоль ворот печени; 2 - верхняя брыжеечная вена; 3 - нижняя полая вена, 4 - мезентерико-кавальный анастомоз. расцененное как опухоль ворот печени. При этом больная не предъявляла каких-либо жалоб, не было изменений в биохимическом анализе крови, гемограмме и отсутствовали характерные для опухолей данной локализации проявления механической желтухи. Месяцем позже в другом лечебном учреждении была выполнена лапароскопия, во время которой не найдено признаков неопластического процесса в брюшной полости, но обращено внимание на наличие спленомегалии и множества расширенных вен в области малого сальника и брыжейки тонкой кишки. Тогда же была произведена биопсия печени, а после гистологического исследования получено заключение о формирующемся микронодулярном циррозе. В течение 11 мес пациентка наблюдалась и лечилась в различных гастроэнтерологических отделениях с диагнозом криптогенного цирроза печени, во время последней госпитализации эндоскопически было выявлено варикозное расширение вен пищевода.
Общее состояние при поступлении удовлетворительное. Кожные покровы обычной окраски. Периферических отеков нет. Масса тела 60 кг, рост 166 см. Пульс 80 в 1 мин, АД 130/70 мм рт.ст. Тоны сердца ясные, ритмичные, патологических шумов нет. Дыхание везикулярное, хрипов нет. Живот не вздут, при пальпации мягкий, безболезненный во всех отделах, патологических образований, асцита не определяется. Печень не увеличена, селезенка выступает из-под реберной дуги на 7 см, плотноэластической консистенции, безболезненная.
Все показатели биохимического исследования крови в пределах нормы. Показатели гемограммы: Hb 10 9 г/л, эр. 6,17·10 12 /л, л. 18,8·10 9 /л, Ht 34,9%, тр. 657·10 9 /л, средний объем эритроцитов 56,6 фл, среднее содержание гемоглобина в эритроците 17,6 пг, пойкилоцитоз, лейкоцитарная формула не изменена. Показатели гемостаза: АЧТВ 39,3 с, MHO 1,3, фибриноген 6380 мг/л. Исключены дефекты в системах протеинов С, S, нарушение резистентности Va-фактора к активированному протеину С, антифосфолипидный синдром, гипергомоцистеинемия. Значения онкомаркеров (АФП, СА 19-9, РЭА) в пределах нормы.
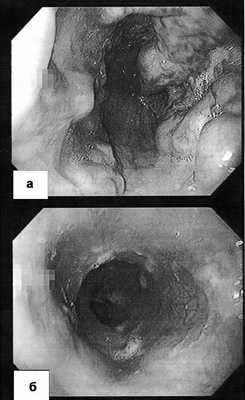
Из-за отсутствия признаков печеночной недостаточности при клиническом и лабораторном обследовании уже при поступлении наличие цирроза печени вызывало сомнения, было высказано предположение о внепеченочной портальной гипертензии, причиной которой явился тромбоз воротной вены вследствие заболевания крови. Мы выполнили эзофагогастродуоденоскопию, при которой в средней и нижней третях пищевода выявлены бугристые и извитые вены (варикозное расширение IV степени по классификации К. Paquet [2]), выступающие в просвет на 7-9 мм, с множественными эрозиями и «красными пятнами» - маркерами высокого риска кровотечения (рис. 2, а). Рисунок 2. Эзофагоскопия до (а) и после (б) мезентерикокавального шунтирования. Объяснения в тексте. Поэтому первым этапом мы выполнили эндоскопическое лигирование вен пищевода.
Уточнить уровень блока портального кровотока нам позволили такие исследования:
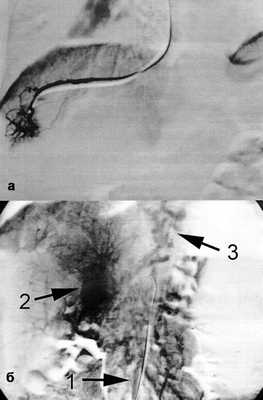
1) веногепатография - контрастное вещество, введенное посредством заклиненного в печеночной вене катетера, хорошо проходит через синусоидальное русло, что исключает синусоидальный блок портального кровотока (рис. 3); Рисунок 3. Веногепатограмма (а) и мезентерикопортограмма (б) перед операцией. 1 - верхняя брыжеечная вена; 2 - кавернозная трансформация воротной вены; 3 - варикозное расширение вен пищевода.
2) мезентерикопортография - визуализирована верхняя брыжеечная вена диаметром 8 мм, проходимая до места слияния с селезеночной веной, воротная вена кавернозно трансформирована, сброс контрастного вещества через вены пищевода (рис. 3, б);
3) компьютерная томография - визуализированы описанные ранее изменения в области печеночно-двенадцатиперстной связки и ворот печени, верхняя брыжеечная вена проходима, воротная и селезеночная вены тромбированы (см. рис. 1, а).
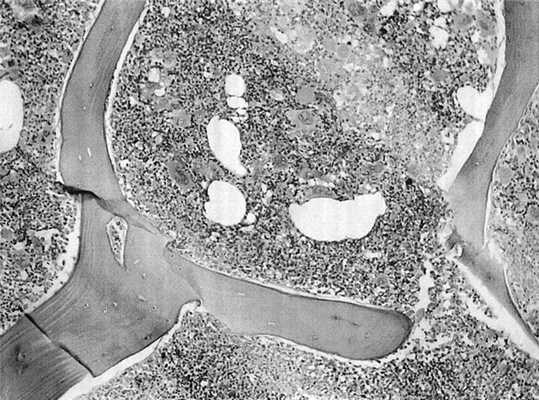
Для верификации диагноза с учетом выявленных гематологических изменений была выполнена трепанобиопсия из гребня подвздошной кости. При гистологическом исследовании обнаружены выраженная трехростковая пролиферация кроветворения с омоложением и дисплазией клеточных форм, скопления мегакариоцитов, незначительный очаговый перитрабекулярный, периваскулярный фиброз в строме (рис. 4). Рисунок 4. Микрофотография. Ув. 100. Трепанобиоптат: трехростковая пролиферация кроветворения. Окраска гематоксилином и эозином. Данная морфологическая картина соответствует эритремии (истинной полицитемии).
Таким образом, на основании выполненных обследований установлен диагноз: эритремия II стадии (развернутая). Тромбоз и кавернозная трансформация воротной вены, тромбоз селезеночной вены. Синдром портальной гипертензии. Варикозное расширение вен пищевода IV степени. Начата терапия гидроксикарбамидом 1500 мг/сут перорально. Учитывая высокий риск кровотечения из варикозно-расширенных вен пищевода и принимая во внимание паллиативный характер эндоскопической коррекции варикозного расширения вен, а также необходимость антиагрегантной терапии, решили выполнить портосистемное шунтирование с целью коррекции портальной гипертензии. Единственным сосудом портального бассейна, который в данной ситуации возможно было использовать для шунтирования, явилась верхняя брыжеечная вена.
Больная экстубирована через 4 ч после операции при нормальных показателях газообмена и гемодинамики. Послеоперационный период осложнился развитием на первые сутки диффузного коагулопатического кровотечения из забрюшинного пространства, что потребовало релапаротомии, во время которой исключен магистральный характер кровотечения и с большими трудностями в течение 4 ч достигнут гемостаз. Антикоагулянтная и антиагрегантная терапия отменена. На 3-и сутки имело место желудочное кровотечение из множественных острых язв и эрозий, остановленное консервативными мероприятиями. Дальнейший послеоперационный период протекал без осложнений, пациентка выписана в удовлетворительном состоянии через 17 сут после операции без признаков постшунтовой энцефалопатии.
При эзофагогастродуоденоскопии перед выпиской отмечена хорошая редукция варикозно-расширенных вен пищевода (рис. 2, б), при компьютерной томографии через 1 мес после выписки визуализирован проходимый мезентерико-кавальный анастомоз (рис. 1, б). Во время контрольного осмотра через 3 мес состояние пациентки удовлетворительное, принимает кардиомагнил по 75 мг/сут, доза гидроксикарбамида снижена до 1000 мг/сут. Показатели гемограммы: Hb 107 г/л, эр. 5,04·10 12 /л, л. 9,6·10 9 /л, Ht 32,9%, тр. 505·10 9 /л, средний объем эритроцитов 65 фл, среднее содержание гемоглобина в эритроците 21,3 пг, лейкоцитарная формула не изменена.
Эритремия (истинная полицитемия, или болезнь Вакеза) - хроническое миелопролиферативное заболевание, характеризующееся гиперпродукцией эритроцитов и в меньшей степени тромбоцитов и лейкоцитов. Тромботические и геморрагические осложнения являются довольно частыми признаками этого заболевания, однако точные данные о частоте тромбоза такой необычной локализации, как вены портального бассейна, при эритремии отсутствуют [4]. Согласно исследованию Н. Janssen и соавт. [1], миелопролиферативные заболевания являются причиной 14% наблюдений тромбозов воротной вены во взрослой популяции, половина этих наблюдений представлена эритремией. У ряда больных тромботические осложнения могут возникать при нормальном гематологическом профиле, точная диагностика причины тромбоза бывает крайне затруднительной [3]. При анализе литературы нам встретились лишь единичные клинические наблюдения портальной гипертензии вследствие эритремии, корригированной путем шунтирующих операций, в русскоязычной литературе подобных публикаций мы не нашли. Наше наблюдение демонстрирует эффективность мезентерико-кававального шунтирования для коррекции варикозного расширения вен пищевода даже при наличии тромбоза селезеночной вены.
Коронарное шунтирование: об операции и реабилитации
Решения относительно собственного здоровья, особенно такого масштаба, как операции на сердце, даются тяжело. Чтобы преодолеть это, мы стараемся рассказывать о том, чем занимаемся — и почему в Клинике Сердца используем сложные, редкие и затратные по времени методы.
История пациента
Николай Фёдорович — первый пациент, которому в Клинике Сердца провели аортокоронарное шунтирование. В шортах и рубашке с коротким рукавом он ждет близких перед выпиской: «Это я специально так оделся, чтобы показать: вот так выглядит пациент на шестой день после операции». Николай Фёдорович не скрывает повязок на руке и ноге, откуда во время операции забирали материал для шунтов, и явно доволен тем, как проходит процесс восстановления: «На шестой день я свободно могу ходить — без всяких ходунков, и чувствую уверенность. А слабости большой не чувствую, хотя срок после операции прошел короткий».
С обширным поражением сердца пациент столкнулся в довольно молодом возрасте — 57 лет. А обнаружил его благодаря тому, что регулярно проходил медосмотры, будучи преподавателем в автодорожном колледже. Одышка и прижимание в груди мучили пациента продолжительное время, поэтому стало ясно, что пора искать хорошего кардиохирурга. С тех пор Николай Федорович был в разных одесских центрах, намеревался ехать в Киев, пока, по его словам, не узнал, что кардиохирургический центр, где проводят уникальные операции, есть в Одессе, а из окна палаты видно его собственный дом.
Формула изобретения
1. Способ портокавального шунтирования при циррозе печени с синдромом портальной гипертензии, включающий забор крови из мезентериальной вены и реинфузию ее в венозное русло до полного регресса и стабилизации портальной гемодинамики, отличающийся тем, что забор и реинфузию крови осуществляют через полностью имплантируемую инфузионную венозную порт-систему, которую устанавливают в подкожной клетчатке, при этом проводят лапароскопию с последующей катетеризацией и установкой рабочего конца катетера в мезентериальной вене путем ее венесекции, имплантацию катетера к прямой мышце за манжетку, соединение его с портом, подключают к порт-системе систему для трансфузии, проведенную через инфузомат, венозный конец системы для трансфузии соединяют с подключичной веной, а аутогемореинфузию проводят со скоростью 5-10 мл в минуту, дробно по 300-500 мл с интервалом в 5-15 мин, ежедневно в объеме 1,2-1,5 л.
Показания для мезоатриального … Показания для портокавального … Доступ и ход операции мезоатриального … Доступ и ход операции мезоатриального … Доступ и ход операции мезоатриального …
2. Способ по п.1, отличающийся тем, что при необходимости курс аутогемореинфузии повторяют 3-5 раз с недельным интервалом.
В каких случаях показано хирургическое вмешательство?
К аортокоронарному шунтированию прибегают в следующих случаях:
- Сужение или закупорка коронарных (венечных) артерий, кровоснабжающих сердце, на 70% и более.
- Нарушение кровотока в трех и более коронарных сосудах. Если поражено менее трех венечных артерий, можно установить в них стенты — полые цилиндрические каркасы с сетчатой стенкой, которые расширят их просвет и восстановят кровоток.
- Если стентирование оказалось неэффективным, и после него снова возникло сужение коронарных артерий.
Решение о необходимости операции в каждом случае принимают индивидуально. Для того чтобы оценить состояние сердца и венечных артерий, проводят ЭКГ, ЭХО-кардиографию (УЗИ сердца), стресс-тесты (оценивают, как меняется работа сердца после физических нагрузок или введения медикаментозных препаратов), коронарографию (рентгенографию с введением в коронарные артерии контрастного раствора).
Реабилитация после шунтирования
«Соблюдение этапности лечения в 4 раза снижает риск повторных операций, в 6 раз — повторных госпитализаций, в 2,5 раза — смертность в результате рецидива болезни… Экономия расходов на лечение рецидивов — 30-40%»
, главный кардиолог Санкт-Петербурга и Северо-западного ФО, Президент Российского кардиологического общества.
Грамотная реабилитация после коронарного шунтирования помогает:
Эффективная реабилитация подразумевает комплексный подход к физическому и психологическому состоянию больного. Длится, в среднем, от 6 до 12 месяцев и включает в себя этапы стационарного отделения, кардиологического санатория и амбулаторного наблюдения.
Стационарное отделение реабилитации
Задача первого этапа реабилитации — контроль и стабилизация состояния организма после хирургического вмешательства, физическая активация и психологическая адаптация к проведенной операции.
Минимальное время пребывания пациента в стационаре — 7-10 дней, конкретный срок определяется индивидуально, в зависимости от сложности послеоперационных осложнений.
В этот период пациент получает следующую медицинскую помощь:
- Медикаментозное лечение — контроль болевых симптомов, нагрузок на сердечную мышцу и образования тромбов в шунтах.
- Восстановление физической активности — обучение тому, как правильно поворачиваться в кровати, когда можно садиться, вставать с постели и ходить. Важно: если не уделять время физической активности с первых дней после операции, увеличивается риск развития осложнений.
- Психологическая адаптация подразумевает работу со страхом слабости сердца и настроем на возвращение боли. Данные статистики показывают: 60% пациентов после шунтирования боятся остаться без постоянного контроля врачей. Многие считают, что сердце может не выдержать, помня о том, что малейшая нагрузка до операции вызывала стенокардию.
По окончании стационарного этапа реабилитации пациент проходит обследование сердца, а также, во многих случаях, велоэргометрический тест, с помощью которого определяется переносимость физических нагрузок. На основании полученных данных составляется план дальнейшей реабилитации.
Реабилитационный центр кардиологического санатория
Контроль и реабилитация состояния после шунтирования и выписки из стационара продолжается на этапе кардиологического санатория. Он необходим, чтобы закрепить результат и эффект лечения, стабилизировать физическое и психологическое состояние больного, подготовить его к возвращению к нормальной жизни: бытовым нагрузкам, социально-активной и трудовой деятельности.
В этот период пациент проходит:
- индивидуально составленную программу лечения, тренировок и ЛФК, с учетом необходимого темпа восстановления, а также возможностей организма
- программу нормализации психоэмоционального состояния — анализ реакции на болезнь, психологическую поддержку
- вторичную профилактику для предупреждения осложнений основного заболевания и устранения факторов риска.
Амбулаторная реабилитация
Только осознанное и ответственное отношение к здоровью после основных этапов реабилитации поможет сохранить эффект от лечения на как можно более долгий срок. Поэтому, после выписки из кардиологического санатория, необходимо:
- Встать на учет к кардиологу по месту жительства и проходить наблюдение 1 раз в 3 месяца. Прием у кардиохирурга обязательно проходить 1 раз в год
- Отказаться от вредных привычек — курение сокращает срок службы шунтов минимум в половину, а алкоголь увеличивает нагрузку на сердце
- Целенаправленно увеличивать количество физической активности — пеших прогулок, подъемов по лестнице, гимнастики без активного участия рук и плеч. При этом важно помнить, что болевого синдрома быть не должно.
Кардиологический санаторий «Черная речка» специализируется на реабилитации пациентов, перенесших инфаркт миокарда и операции по шунтированию, стентированию и замене клапанов. За 60 лет работы нашего центра мы помогли восстановить здоровье и трудоспособность более 650 000 пациентов. Прочитайте подробнее о программе реабилитации и как на нее попасть, чтобы мы могли помочь и вам!
Операция внутрипечёночного портосистемного шунтирования
содержание
Показанием для проведения внутрипеченочного портосистемного шунтирования является портальная гипертензия, для которой характерно устойчиво повышенное кровяного давление в воротной вене. Воротная вена является основным каналом доставки крови от кишечника к печени.
Если портальную гипертензию не лечить, развиваются тяжёлые осложнения, связанные с варикозным расширением вен органов пищеварения, а также печёночная энцефалопатия (наиболее опасное осложнение, при котором угнетаются нормальные функции печени).
Следствием высокого портального давления также становится увеличение селезёнки в размерах. Возникает высокий риск кровотечений из расширенных вен, проходящих в желудке и пищеводе.
Наиболее современная и эффективная методика лечения портальной гипертензии - трансъюгулярное внутрипеченочное портосистемное шунтирование. Возможности медицинских технологий позволяют проводить такую операцию эндоскопически. Суть лечения заключается в создании сосуда (шунта), проходящего через печень и соединяющего воротную вену с одним из трёх соединяющих печень с сердцем сосудов.
Поддержание просвета имплантированного сосуда в открытом состоянии обеспечивается помещением в него стента. В результате шунт принимает на себя часть кровяного потока. Некоторый объём крови, постоянно «сбрасываемый» через имплантат обеспечивает эффект декомпрессии всей портальной системы, снижая кровяное давление в воротной вене. Риск кровотечений и варикоза существенно снижается.
и противопоказания к внутрипечёночному портосистемному шунтированию
Наиболее частыми показаниями к имплантации шунта в портальную систему печени являются:
- острые кровотечения пищевода и желудка, связанные с варикозным расширением вен, не устраняемым терапевтически и не поддающимся другим методам лечения;
- профилактика при высоком риске кровотечений на фоне варикоза вен желудка и пищевода;
- портальная гастропатия (застой венозной крови в стенках желудка, угрожающий кровотечениями);
- гепаторенальный синдром;
- синдром Бадда-Киари (образование тромба в одной из вен, проходящих от печени к сердцу);
- рефрактерный асцит (скопление жидкости в брюшной полости);
- профилактическая хирургия после трансплантации печени при угрозе развития портальной гипертензии.
Ограничением к проведению портосистемного шунтирования могут стать тяжёлые печёночные нарушения, которые могут усугубиться после имплантации шунта.
Кроме того, следует учитывать, что попадание продуктов метаболизма, из кишечника в общее кровяное русло, минуя печень, может вызвать специфическое поражение нервной системы - портосистемную энцефалопатию.
Врач тщательно взвешивает и опирается на анамнестические сведения, оценивая существующую склонность к проявлениям энцефалопатии. Иногда побочный эффект от занесения в кровь неотфильтрованных печенью токсических веществ можно усранить посредством диеты или перестановкой стента.
Стоит также упомянуть общие противопоказания для всех видов оперативного лечения:
- инфекционные заболевания в острой стадии;
- нарушения функции почек, сердечной деятельности;
- тяжёлые системные и психические заболевания.
Эти ограничения относительны, поэтому при наличии указанных обстоятельств в каждом конкретном случае решение о проведении операции принимается на медицинском консилиуме.
проведения и риски операции внутрипеченочного портосистемного шунтирования
Современное медицинское оборудование позволяет проводить шунтирование печени малоинвазивно. Все манипуляции производятся под контролем мониторинга эндоскопически.
Тем не менее, операционная должна быть укомплектована и готова к проведению экстренных реанимационный мероприятий, поскольку любые вмешательства на печени несут риск кровотечений, и других стремительно развивающихся осложнений.
При необходимости (сопутствующих патологиях или трудностях оперативного доступа) шунтирование проводится путём открытой полостной операции. Такой подход удлиняет восстановительный период, но может быть оправдан в ряде случаев.
Успешность операций внутрипечёночного портосистемного шунтирования составляет 90%, однако в ходе разработки плана операции врач всегда учитывает возможные риски:
Читайте также:
