Доступ и ход резекции селезенки при травме
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Число пострадавших в автоавариях, от стихийных бедствий и терроризма ежегодно увеличивается и является основной причиной смерти лиц до 40 лет, опережая летальность от сердечно-сосудистых и онкологических заболеваний [1, 3-6, 10, 17, 20-22, 25].
Закрытые повреждения живота при сочетанной травме выявляются у 19-40% пострадавших [6-9, 12, 14, 18, 19, 22, 23]. Разрывы селезенки при закрытой травме живота встречаются в 17-23% при сочетанных и в 11-13% наблюдений при изолированных повреждениях [11, 13, 15, 16, 24]. Травмированная селезенка подвергается хирургическому удалению в 99% наблюдений. Методы достижения гемостаза в зонах повреждений органа даже при использовании современных технологий не исключают высокого риска рецидива кровотечения и релапаротомии, которые резко ухудшают прогноз выживаемости [2, 5, 11, 13, 15]. В то же время удаление селезенки способствует развитию синдрома постспленэктомического гипоспленизма, который манифестирует увеличением гнойно-септических и плевролегочных осложнений. В отдаленном периоде наиболее опасны развитие молниеносного сепсиса с летальностью 50-70%, а также активное снижение антибластической резистентности и выраженный астенический синдром [2, 5, 20, 23, 24]. В связи с этим выбор альтернативного спленэктомии (СЭ) метода сохранения иммунокомпетентного органа остается актуальным.
Материал и методы
Мы представляем результаты хирургического лечения 383 больных, оперированных с 1987 по 2012 г. по поводу сочетанной (n=273) и изолированной (n=110) травмы живота с разрывом селезенки. Произведено 228 СЭ и 155 органосохраняющих операций с лигированием селезеночной артерии (ОСО+ЛСА), из них 34 эндохирургические. Самому молодому пациенту было 16 лет, самому пожилому- 56 лет. Соотношение мужчин и женщин 6,2:1. Средний возраст составил 30,7±14,8 года.
Основная группа представлена 155 пострадавшими, которым была выполнена ОСО на поврежденной селезенке. У 63 пострадавших травма живота была изолированной, у 92 - сочетанной.
Контрольная группа состояла из 228 больных, которым при закрытой травме живота с повреждением селезенки была выполнена СЭ. При этом у 47 больных селезенка удалена при изолированной травме живота, у 181 - при сочетанной.
К причинам изолированной травмы живота отнесены: избиение - 69 (62,73%), автодорожная травма - 29 (26,37%), падение с высоты - 1 (0,90%), прочие - 11 (10%). Среди сочетанных повреждений были автодорожная травма у 184 (67,39%) пострадавших, избиение у 58 (21,25%), падение с высоты у 10 (3,67%) и прочие у 21 (7,69%) пострадавшего.
В течение первых 6 ч с момента получения травмы поступило наибольшее количество больных - 305 (79,63%), в интервале 6-12 ч - 61 (15,92%), более чем через 12 ч - 17 (4,43%). Более 86% пострадавших госпитализированы в состоянии шока. Более 89% СЭ и 98% ОСО выполнены пациентам при наличии повреждений тяжелой степени (балл ВПХ-МТ 1,2-12,2) [6].
В состоянии алкогольного опьянения в момент поступления оказались 150 (39,2%) пострадавших. Для более корректного сравнения результатов хирургического лечения из исследования были исключены лица с циррозом печени, вирусным гепатитом, наркоманией, ВИЧ-инфекцией.
Закрытая травма живота с повреждением селезенки наиболее часто сочеталась с травмой груди, преимущественно левых отделов - 99 (25,84%) и черепно-мозговой травмой - 64 (16,71%) пострадавших. Одномоментное повреждение трех и более анатомических областей наблюдалось у 111 (28,98%) пациентов. У всех оперированных больных отмечался гемоперитонеум. Сочетание травмы более двух органов брюшной полости и забрюшинного пространства имело место в 292 (76,24%) наблюдениях. Острая кровопотеря составляла от 600 мл до 4,5 л.
Общая летальность составила 11,74% (умерли 45 из 383 пострадавших), при этом в 1-е сутки - 30 (7,83%).
Основной причиной смерти 25 (55,55%) из 45 умерших явился отек головного мозга как следствие черепно-мозговой травмы. Среди них в 1-е сутки умерли 14 больных (летальность составила 31,11%). Острая массивная кровопотеря, шок послужили причиной смерти 14 (31,11%) пострадавших. Все случаи смерти констатированы в первые часы (сутки) с момента поступления в стационар. После 6 сут пребывания в стационаре умерли 11 (24,45%) больных в связи c нарастанием отека головного мозга и 6 (13,33%) больных от легочно-сердечной недостаточности.
Результаты
Методика сохранения поврежденной селезенки описана нами ранее [2] и заключается в лапаротомном или лапароскопическом доступе в брюшную полость, лигировании (клипировании) селезеночной артерии, аспирации крови для аутогемотрансфузии, окончательной остановке кровотечения в зонах разрыва селезенки, санации и дренировании брюшной полости.
При торакоабдоминальном повреждении лапароскопию выполняли только после дренирования плевральной полости, что жизненно необходимо, так как создание карбоксиперитонеума при дефекте диафрагмы сопровождается напряженным пневмотораксом, вызывая риск смещения органов средостения с рефлекторной остановкой сердца. В этих ситуациях предпочтителен лапаротомный доступ.
Важно подчеркнуть, что во время операции ни в одном наблюдении мы не отметили продолжающегося кровотечения в момент ревизии (см. рис. 1 и далее на цв. вклейке). Рисунок 1. Данные видеолапароскопии. Этапы операции. а - осмотр зоны поперечного разрыва тела селезенки со сгустком до лигирования селезеночной артерии. Селезенка увеличена, капсула ее напряжена. Рисунок 1. Данные видеолапароскопии. Этапы операции. б - наложение клипсы на селезеночную артерию. Рисунок 1. Данные видеолапароскопии. Этапы операции. в - осмотр зоны коагуляции разрыва тела «спавшейся» селезенки после лигирования селезеночной артерии. Селезенка спавшаяся, без напряжения. Кровотечение из мест разрывов селезенки возобновлялось только после удаления фиксированных сгустков.
Сначала мы лигировали селезеночную артерию, считая это необходимым условием для дальнейшего сохранения селезенки. В ходе операции эта манипуляция позволяет уменьшить размер органа, снять эффект напряженности ее капсулы, что создает для хирурга условия безопасности выполнения дальнейших действий. Следующим этапом удаляли сгустки из зоны разрыва с окончательной остановкой кровотечения путем ушивания или коагуляции.
Селезенка находится в состоянии «покоя» с момента лигирования артерии, т.е. не меняет интраоперационный размер в сроки от 7 дней до 3,5 нед [2], это условие является достаточным для заживления зон разрыва органа и предотвращения послеоперационных кровотечений.
К объективным критериям оценки эффективности органосохраняющего метода относятся УЗИ для оценки в динамике состояния мест разрывов селезенки, восстановление сократительной функции органа в сроки до 3,5 нед, МСКТ-ангиография с мультипланарными и трехмерными реконструкциями, позволяющая оценить состояние ретроградного кровотока в селезеночной артерии. Ультразвуковая ангиография (в 3D/4D-режимах) дополняет данные КТ с визуальной оценкой зоны вмешательств и развития коллатерального кровообращения ворот селезенки.
С учетом улучшения технического обеспечения до- и послеоперационного обследования 10 пострадавшим выполнена МСКТ-ангиография.
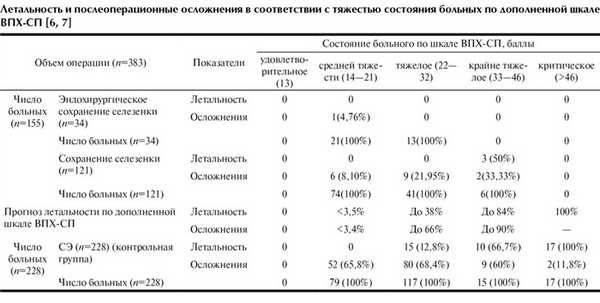
Сохранение поврежденной селезенки способствует снижению летальности и осложнений (см. таблицу). Так, в группе перенесших СЭ в состоянии средней тяжести (по шкале ВПХ-СП) количество больных с осложнениями составило 65,8% и уменьшилось при ОСО+ЛСА до 7,29% (7 из 96), из них при лапаротомном доступе до 8,1% (6 из 74) и при лапароскопии до 4,76% (1 из 21) (р<0,03). В группе больных в исходно тяжелом состоянии летальность снижалась с 12,8% при СЭ до 0 при ОСО+ЛСА. Частота осложнений уменьшилась соответственно с 68,4 до 21,95% и 0 (р<0,003). У пострадавших в исходно крайне тяжелом состоянии летальность снижалась с 66,7 до 50% (р<0,05), а частота послеоперационных осложнений - с 60 до 33,33%. Пострадавшим в критическом состоянии (n=17) выполняли только СЭ. Летальность обусловлена травмой, несовместимой с жизнью. При этом 15 пострадавших умерли в 1-е сутки, 2 - в поздние сроки при развитии осложнений.
Послеоперационные гнойно-септические осложнения развивались преимущественно с 5-7-х суток и имели место у 149 (65,4%) из 228 пострадавших после СЭ и у 18 (11,61%) из 155 после ОСО+ЛСА. К ним относили нагноение операционной раны, образование абсцессов в брюшной полости и распространенный перитонит, а также легочно-плевральные воспалительные процессы.
Наибольшее количество осложнений - 69 (18,01%) составили плевролегочные. Это обусловлено сопутствующей травмой груди и развитием в 1-2-е сутки острого респираторного дистресс-синдрома, травматического пневмонита с последующим присоединением пневмонии. У больных, перенесших СЭ, плевролегочных осложнений было больше, они возникли у 55 (24,12%) из 228 пострадавших, после ОСО+ЛСА - у 13 (8,38%) из 155, соотношение составило 2,9:1. Плевролегочные осложнения после ОСО+ЛСА встретились после традиционной СЭ у 12 (7,74%) из 155 больных и после лапароскопической у 1 (0,64%) из 155. После СЭ у 39 (17,1%) пациентов образовались абсцессы в левом поддиафрагмальном пространстве у ложа удаленной селезенки. Из них у 3 (1,3%) абсцесс сочетался с левосторонней плевропневмонией. После ОСО+ЛСА подобных осложнений не было. У 6 (2,63%) из 228 больных после СЭ и ушивания тонкой кишки по поводу травматического нарушения ее целостности отмечался послеоперационный перитонит с нагноением раны. Всего нагноение операционной раны после СЭ отмечалось у 43 (18,9%) больных, после ОСО+ЛСА - лишь у 5 (3,22%).
Таким образом, число летальных исходов и послеоперационных гнойно-септических осложнений прямо пропорционально исходной степени тяжести травмы и тяжести состояния пострадавших и статистически достоверно снижалось при ОСО+ЛСА (более чем в 5 раз).
Результаты клинических наблюдений и МСКТ-ангиографии в ближайшем послеоперационном периоде у больных после ОСО позволили отметить неосложненное заживление мест повреждений органа за счет эффективного развития естественного коллатерального кровообращения.
В отдаленном периоде для изучения коллатерального кровообращения нами была использована неинвазивная методика трехмерной (3D-режим) ультразвуковой ангиографии селезенки с определением показателей кровотока. Были обследованы
26 пациентов в сроки от 2 до 9 лет после ОСО на селезенке, 11 из них после лапароскопических и 15 после традиционных (лапаротомных) органосохраняющих вмешательств. Контрольную группу составили 13 здоровых добровольцев, ранее не оперированных.
Результаты первого этапа исследования в режиме серой шкалы и цветового допплеровского картирования позволили уточнить, что у пациентов после ОСО+ЛСА селезенка имела ровные контуры, средние размеры, однородную эхоструктуру, не отличимую от таковых в группе неоперированных здоровых людей (рис. 3, а). Рисунок 3. Ультрасонограммы. а - в режиме серой шкалы селезенка с ровными четкими контурами размером 10,5×7,2 см через 8 лет после ОСО+ЛСА по поводу закрытой травмы живота с повреждением селезенки; б - в режиме цветового допплеровского картирования селезеночная артерия с четко визуализированным местом лигирования. В селезеночной артерии выявлялось место лигирования (рис. 3, б). Рисунок 3. Ультрасонограммы. б - в режиме цветового допплеровского картирования селезеночная артерия с четко визуализированным местом лигирования.
Трехмерная ультразвуковая реконструкция сосудов селезенки (рис. 4, а, б) Рисунок 4. Ультразвуковые ангиограммы. а - вид сосудов селезенки в режиме 3D-реконструкции после ОСО+ЛСА (06.09.02). Рисунок 4. Ультразвуковые ангиограммы. б - вид сосудов селезенки неоперированного добровольца, страдающего язвенной болезнью двенадцатиперстной кишки в режиме энергетической допплерографии (3D-режим). у больных после ОСО+ЛСА показала хорошо развитое магистральное артериальное дерево, отделение сегментарных сосудов от селезеночной артерии, их взаимоотношение между собой и деление на мелкие трабекулярные сосуды.
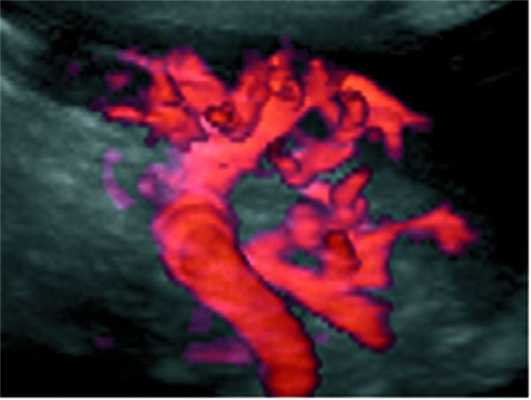
При сравнении данных ультразвуковой ангиографии, проведенной у здоровых неоперированных людей (рис. 4, в), Рисунок 4. Ультразвуковые ангиограммы. не получено отличий от пациентов, перенесших ОСО+ЛСА (см. рис. 4, в), возможно, лишь визуально сосуды оперированных пациентов были более разветвлены.
Таким образом, изучение артериального кровоснабжения селезенки до и после ОСО+ЛСА с использованием МСКТ с внутривенным болюсным трехфазным контрастированием в ближайшем послеоперационном периоде и ультразвуковой ангиографии в отдаленном периоде в режимах трехмерной реконструкции достоверно подтверждало тот факт, что при данном методе лечения не создавалось ишемии в зоне кровоснабжения тела и хвоста поджелудочной железы и в воротах селезенки и отмечалось хорошее заживление зон повреждения органа за счет естественного коллатерального кровообращения.
Число летальных исходов и послеоперационных гнойно-септических осложнений было прямо пропорционально исходной степени тяжести травмы и тяжести состояния пострадавших и статистически достоверно снижалось при сохранении травмированной селезенки более чем в 5 раз.
Снижение интраоперационной кровопотери и отсутствие рецидивов послеоперационного кровотечения позволяют предполагать, что метод органосохраняющей операции с лигированием селезеночной артерии является эффективной и безопасной альтернативой не только спленэктомии, но и другим методикам органосохраняющих операций при травме селезенки.
Доступ и ход резекции селезенки при травме
Представлен обзор литературы, посвященный хирургическому лечению повреждений селезенки. Особое внимание отводится хирургическому лечению, направленному на сохранение этого органа с помощью лазерной техники. Показано, что практика использования операций, направленных на сохранение селезенки при ее травме прошла несколько этапов. Применение таких хирургических вмешательств во многом зависит от технического оснащения операционного блока.
Значение селезенки в организме была описана Аристотелем (382-322 до н.э.). Несмотря на многочисленные научные исследования, некоторые функции селезенки до настоящего времени остаются невыясненными. Известно, что селезенка не относится к жизненно важным органам. Однако ей принадлежит ряд важных функций, таких как:
1) удаление микроорганизмов и антигенов из кровотока;
2) синтез иммуноглобулина и пропердина;
3) осуществление деструкции истощенных и патологически измененных эритроцитов;
4) участие в эмбриональном гемопоэзе, который при некоторых заболеваниях может выступать в качестве экстрамедуллярного гемопоэза [64, 87].
Повреждения селезенки при механической травме встречаются в 15-50 % от числа всех пострадавших с травмой живота [20, 45, 50, 53, 66]. Они занимают 2-3-е место после повреждений печени и кишечника [19, 29, 32, 44, 62]. При этом летальность достигает 25 % [25, 32]. Среди механизмов развития закрытых травм селезенки преобладают прямые удары в область левого подреберья, сдавления нижних отделов грудной клетки, сила инерции при падении с высоты [45]. Отмечено, что хрупкость селезеночной паренхимы обусловливает значительное внутрибрюшное кровотечение даже при небольших повреждениях капсулы. По данным П.Н. Зубарева и В.П. Еременко [26], D.E. Fri [66], 42-59 % больных с закрытой травмой селезенки госпитализируют в состоянии тяжелого геморрагического шока. При этом внутрибрюшная кровопотеря в среднем составляет 1685 мл [87].
Органосохраняющие операции при повреждениях селезенки пропагандируются лишь в отдельных публикациях [33, 35, 48]. При этом чаще других упоминается спленорафия, впервые выполненная Тиффани в 1894 году.
Вместе с тем вплоть до настоящего времени отношение к органосохраняющим операциям неоднозначно. Так, по мнению Р.Ш. Байдулатова [10], T.H. Ragsdale et al. [80], органосохраняющие операции часто оказываются сложными, не всегда гарантирующими от рецидива кровотечения. Из-за этого при большинстве травм селезенки авторы рекомендуют спленэктомию. В качестве относительного противопоказания к органосохраняющей операции некоторые ученые относят перитонит [22, 34, 37].
Зарубежные авторы [64, 87] разработали методику выбора того или иного органосохраняющего вмешательства в зависимости от морфологических типов нарушения целостности селезенки. Они различают 4 морфологических типа:
1. Первый тип - разрывы капсулы без нарушения целостности паренхимы.
2. Второй тип - разрывы капсулы селезенки сочетаются с нарушением целостности паренхимы.
3. Третий тип - разрывы распространяются на ворота органа.
4. Четвертый тип - фактически полное разрушение селезенки.
При повреждениях первого типа авторы накладывают швы нитью 3-0 из рассасывающегося материала. В подобных ситуациях ими используются также аппликации биологического клея или порошкообразного коллагена.
Повреждения второго типа, по мнению авторов, требуют иссечения размозженных тканей с последующим наложением глубоких швов (нить 3-0) с дополнительным укреплением их прядью сальника на ножке.
При повреждениях третьего типа выполняется резекция селезенки, или, выражаясь словами автора, - «частичная спленэктомия». К образующейся раневой поверхности фиксируют участок сальника, прибегают к аппликации биологического клея или порошкообразного коллагена.
Четвертый тип повреждения, естественно, требует удаления органа.
Массивные внутрибрюшные кровотечения, возникающие при повреждениях селезенки, нередко затрудняют выполнение органосохраняющих операций [36]. При глубоких разрывах паренхимы авторами предложена остановка кровотечения методом эмболизации, а при поверхностных разрывах - внутриартериального введения лекарственных веществ. Причем, это может быть использовано как с целью предоперационной подготовки больного, так и в качестве основного метода лечения.
При небольших повреждениях селезенки предложен метод гемостаза, заключающийся в заклеивании разрыва капсулы участком ксенобрюшины клеями МК-8 или МК-7. Ксенобрюшину используют также при разрывах в области полюсов органа, фиксируя ее непрерывным кетгутовым швом в виде колпачка. При ранениях в области ворот органа предложен метод «бинтования» ксенобрюшиной [13].
В случае разрыва селезенки на две части с сохранением их кровоснабжения используется методика, при которой раневые поверхности коагулируются, покрываются сеткой или гемостатической губкой, фиксируемых матрацными швами [60]. Авторами предложены следующие виды швов:
1. Горизонтально-матрацный - викриловой нитью с подкладкой из тефлона.
2. Матрацный - хромированным кетгутом.
4. Обычный - хромированным кетгутом с применением сетки.
Экспериментальными работами J.W. Alexander et al. [56], обосновано использование фибриновой пленки с целью гемостаза. Пленка, содержащая концентрированный фибриноген, обеспечивает хорошую системную и местную совместимость. Она может быть применена при паренхиматозных кровотечениях, что позволяет использовать минимальное количество травмирующих орган швов, способствует оптимальному заживлению ран селезенки.
Использование вышеописанных клеев не нашло широкого применения. Более эффективными оказались фибриновые клеи, клей Лигамент-Филанеду, принцип действия их заключается в воспроизведении конечных этапов свертывания крови [18, 42, 67].
Решая вопрос об оставлении фрагмента селезенки, не связанного с основными питающими сосудами ворот, при отсутствии других технических средств, В.В. Дибижев [24], накладывал зажим на сосудистую ножку. Отсутствие изменения цвета или пульсирующего кровотечения (за счет коротких желудочных или диафрагмальных сосудов) служили основанием к оставлению этого фрагмента в брюшной полости.
Возможна резекция селезенки с использованием сшивающего аппарата [7, 43, 86].
S. Frederic et al. [65], C.A. Steward [82], В.Н. Бордуновский [13], считают показанной резекцию при возможности сохранения 25 % органа.
Несомненно, перспективен метод гемостаза, предложенный В.С. Савельевым с соавт. [45], и Е.И. Бреховым с соавт. [14]. Метод разработан в экспериментальных условиях и заключается в использовании плазменных потоков для резекции, поврежденной селезенки. При воздействии на «сухое» операционное поле было отмечено значительное повышение гемостатических свойств. «Сухость» операционного поля достигается временным пережатием сосудов ворот селезенки или сдавливанием краев раны. При этом время воздействия уменьшалось со 100-120 до 60-80 с [14]. Е.И. Брехов с соавт. [14], и А.Д. Толстой с соавт. [49], сообщили об успешной остановке кровотечения из ран селезенки при ее интраоперационном повреждении.
Несомненный интерес представляют публикации, в которых в сравнительном аспекте содержатся некоторые сведения о применении лазерного скальпеля. Так, R. Orda et al. [78], выявили, что после резекции селезенки лучом СО2-лазера через 21-30 суток процессы организации заканчиваются включением в сформированный рубец инкапсулированных частиц, гигантских клеток и глыбок гемосидерина. Полное заживление после применения лазера наступало за три недели.
В.Н. Кошелев с соавт. [28], выполнили СО2-коагуляцию ран селезенки травматического происхождения у 24 больных с сохранением органа.
В результате многолетних исследований были определены противопоказания к применению СО2-лазера при травматических повреждениях. К ним относятся: тяжелое состояние больного, обусловленное шоком или сопутствующими повреждениями, отрыв селезенки от сосудистой ножки, полное размозжение органа, периспленит, разрыв патологически увеличенного органа. Кроме вышеописанных факторов, авторы подчеркивают, что для проведения подобных операций должна быть «настроенность» всего коллектива на сохранение органа [28].
Основными противопоказаниями к сохранению селезенки служат тяжелый шок с нестабильной гемодинамикой, значительное повреждение паренхимы, отрыв селезенки от сосудистой ножки [13,21,55,61].
С.А. Афендулов [8], F.P. Angelecu N. et al. [57], C.I.C. Nei et al. [76] считают, что выполнение органосохраняющих операций менее уместно в случаях шока, при одновременных повреждениях других органов брюшной полости, массивном загрязнении брюшной полости при проникающих ранах, при неконтролируемом артериальном кровотечении, при тяжелых нарушениях системы свертывания крови, при ожирении и преклонном возрасте.
Важно подчеркнуть, что добиться выполнения органосохраняющих операций в ста процентах наблюдений невозможно. Поэтому, в случае невозможности сохранения селезенки, альтернативой такой операции может быть аутолиентрансплантация [15, 41, 48, 54, 70, 85].
Начало экспериментальной разработки этого метода относится к 20-м годам ХХ века, а интенсивные исследования проблемы началось только в 60-е годы.
В настоящее время предложены многочисленные способы аутолиентрансплантации. К ним относят помещение фрагментов селезенки в большой сальник, в карман брыжейки [16, 76] или в мышечный массив забрюшинного пространства [85], кроме того, предложены способы аутолиентрансплантации в брыжейку тонкой кишки, толстой кишки [22].
Среди всех предложенных методик аутолиентрансплантации можно выделить 2 группы, используемые для подготовки селезеночной ткани к имплантации. К ним относится имплантация «кусочков ткани» с сохранением гистологической структуры и без сохранения структуры - имплантация пульпы или клеточной взвеси селезеночной ткани [8, 35].
При имплантации фрагментов ткани селезенки нарезают небольшие фрагменты органа, определенного размера, погружают в жидкость для удаления излишков крови и помещают в брюшную полость. С целью улучшения приживаемости аутолиентрансплантата Н.И. Батвинников и соавт. [11], предлагают промывать кусочки селезенки в физиологическом растворе с добавлением антибиотиков. Операция не занимает много времени [4, 6, 29, 46].
Имплантация пульпы ткани селезенки требует тщательного ее измельчения и обработки в биологически активных жидкостях, что значительно усложняет операцию [1, 2, 23, 30, 38].
И.И. Бабич и соавт. [9], разработали в эксперименте и применили в клинике оригинальный метод геторотопической аутолиентрансплантации в поперечную мышцу живота с прикрытием трансплантата прядью сальника на ножке. Н.А. Кущ и соавт. [30], предложили реплантацию гомогената пульпы селезенки, для приготовления которой использовали специальное устройство.
В работе А.А. Матиненко [35], показано, что процессы регенерации в ткани селезенки проходят три фазы: некробиотическую, восстановительную и структурной регенерации. Вновь образованная ткань селезенки имеет морфологически органо-типическую функцию [4, 41].
Использование гетеротопической аутолиентрансплантации селезеночной ткани у детей в разволокненную поперечную мышцу живота с перитонизацией прядью большого сальника на ножке позволило предупредить тяжелые осложнения и купировать синдром гипоспленизма [9]. Данная методика, по мнению авторов, обладает некоторыми преимуществами: оптимальными условиями питания селезеночной ткани в различные периоды реваскуляризации трансплантата, локализацией его в функциональном месте с участием в портальном кровообращении, перспективой роста «новой селезенки». В то же время получены сведения, что структурные повреждения в аутолиентрансплантате, изменения в его массе и кровообращении могут оказать отрицательное влияние на фагоцитарную активность [81].
В эксперименте было проведено исследование реваскуляризации фрагментов ткани селезенки в серозно-мышечно-подслизистом лоскуте желудка на сосудистой ножке [12]. При этом выявлена хорошая приживаемость имплантата. Авторы полагают, что селезеночная ткань не только замещает функционирующий орган, но и, в определенной степени, стимулирует адаптационно-компенсаторные процессы после спленэктомии, что проявляется реактивной гиперплазией лимфатических узлов уже с первых дней послеоперационного периода. Авторы считают, что имплантант начинает функционировать через 1-2 месяца.
Реимплантированная ткань селезенки в большинстве случаев хорошо адаптируется, о чем можно судить по тому, что тельца Жолли в эритроцитах, появляющиеся в ближайшее время после операции, перестают определяться к концу второй недели после операции [39]. Авторы показывают, что через 1,5-2 месяца трансплантат начинает визуализироваться при сцинтиографическом и ультразвуковом исследовании. В дальнейшем аутолиентрансплантат функционирует нормально, повышенной наклонности к инфекционным заболеваниям у оперированных больных не отмечается [63]. Вместе с тем оценки жизнеспособности и функциональной активности трансплантатов, высказанные после обследования пациентов, перенесших аутолиентрансплантацию, противоречивы. Так, М.М. Абакумов и соавт. [3], И. Фурка и соавт. [51] расценивают жизнеспособность трансплантатов полной. В то же время P. Klaune et al. [68], эффективность ее оценивают как сомнительную.
Существует точка зрения, что аутолиентрансплантация в сальник уменьшает смертность, повышает выживаемость экспериментальных животных [74]. При этом в клиренсе бактерий большую роль играет масса трансплантата и объем перфузионной ткани [83].
В раннем послеоперационном периоде осложнений не было, при этом авторы отмечают нормализацию иммунного статуса, связанную с регенерацией перенесенной ткани селезенки. К сожалению, отсутствуют сведения об отдаленных результатах этой процедуры (инфекционные осложнения, качество жизни, прогрессирование онкопроцесса, долговременная выживаемость). Негативным фактором следует считать возможные воспалительные осложнения самой аутоспленотрансплантации, которые в неотложной и гнойной хирургии могут достигать 30 % при экстраперитонеальном размещении фрагментов селезенки [5].
E. Kunz et al. [69], произвели 35 реимплантаций ткани селезенки в клинике, пересаживая 35-50 % от массы органа. Через год после операции при помощи сцинтиографии подтверждали наличие селезеночной ткани. При радиоизотопном исследовании с помощью эритроцитов, меченных 99 Тс, уже через две недели отмечалось накопление изотопов в зоне трансплантата [58, 84].
Радионуклидное исследование, выполненное J.C. Orlando et al. [79], показало нарастание функциональной активности селезенки, начиная со 2-й до 3-й недели. В то же время гистологические исследования обнаружили начало клеточной пролиферации с 5-й недели, восстановление структуры ткани к 7-й неделе, массы имплантированной ткани к 24-30-й неделе.
Однако, по мнению М.Х.A. Frederic [65], оценка функционального состояния фрагментов селезенки по степени включения в него радиофармопрепарата ( 99 Тс) не является исчерпывающей. В связи со сказанным, очевидно, что требуются более сложные иммунологические исследования.
К противопоказаниям для аутолиентрансплантации относят: наличие остаточных очагов ткани (спленоз, добавочная селезенка) после иссечения органа, тотальное поражение пульпы гнойно-деструктивным процессом, старческий (более 70 лет) возраст пациента [22].
Необходимо отметить, что в последнее время широкое применение нашла спленэктомия с использованием лапароскопической техники. По мнению К.В. Пучкова и соавт. [40], лапароскопическая спленэктомия является альтернативой открытой спленэктомии при гематологических заболеваний, и ее применение позволяет снизить частоту интра- и послеоперационных осложнений, уменьшить послеоперационный койко-день и улучшить качество жизни пациентов. Б.Ю. Цветков и соавт. [52], в качестве абсолютных противопоказаний для проведения таких операций у гематологических больных, относят увеличение размера селезенки более 30 см, гнойное поражение селезенки. Применив данный вид операции у 18 пациентов, авторы сообщают о двух осложнениях гнойно-септического характера, проявляющихся развитием абсцессов брюшной полости. Широкое использование лапароскопической спленэктомии при гематологических заболеваниях отмечено в детской практике [31]. При этом, по мнению А.Ф. Дронова и соавт. [31], применение данной методики позволяет получить отличные функциональные и косметические результаты при отсутствии интра- и послеоперационных осложнений.
Таким образом, вышеизложенное показывает, что практика использования органосохраняющих операций при травматических повреждениях селезенки прошла несколько этапов. Применение таких хирургических вмешательств во многом зависит от технического оснащения операционного блока. Следует подчеркнуть, что, несмотря на большое количество предложенных органосохраняющих операций, до настоящего времени основным вмешательством остается спленэктомия. При этом как альтернатива полному удалению органа все шире применяется аутолиентрансплантация.
Тупая травма живота, открытые повреждения живота
Категории МКБ: Другие и неуточненные травмы живота, нижней части спины и таза (S39), Размозжение и травматическая ампутация части живота, нижней части спины и таза (S38), Травма кровеносных сосудов на уровне живота, нижней части спины и таза (S35), Травма органов брюшной полости (S36), Травма тазовых органов (S37)
Общая информация
Краткое описание
Абдоминальная травма или травма живота - это нарушение анатомической целостности или функционального состояния тканей или органов брюшной полости, забрюшинного пространства и таза, вызванное внешним воздействием [1, 9].
ATLS - Advanced Trauma Life Support (протокол оказании помощи пострадавшим при травме тренировочного курса для врачей)
ЭРХПГ - эндоскопическая ретроградная холангиопанкреатография
Пользователи протокола: хирурги, акушеры-гинекологи, урологи, травматологи, анестезиологи-реаниматологи, врач общей практики, врачи/фельдшеры скорой медицинской помощи.
Уровень I - Доказательства, полученные в ходе проспективного, рандомизированного, двойного слепого исследования.
Уровень II - Доказательства, полученные в ходе проспективного, рандомизированного, не слепого исследования.
Класс А - Рекомендации, которые были одобрены по согласованию по крайней мере 75% процентов мультисекторной группы экспертов.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
• сочетанная травма: в сочетании с травмой головы, позвоночника, спинного мозга, шеи, груди, опорно-двигательного аппарата.
Открытая травма (раны): колотые, резаные, рубленые, рваные, ушибленные и их сочетания, огнестрельные (пулевые, осколочные, минно-взрывные)
• с повреждением органов БП (одиночные или множественные): повреждение полых органов, повреждение паренхиматозных органов, повреждение сосудов.
• органов брюшной полости: повреждение полых органов, повреждение паренхиматозных органов, повреждение сосудов;
• забрюшинного пространства: повреждение полых органов, повреждение паренхиматозных органов, повреждение сосудов.
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
• биохимический анализ крови (определение глюкозы крови, билирубина и фракций, АСТ, АЛТ, тимоловой пробы, креатинина, мочевины, щелочной фосфатазы, амилазы крови);
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: не проводится.
Основные (обязательные) диагностические обследования, проводимые на стационарном уровне (при экстренной госпитализации проводятся диагностические обследования непроведенные на амбулаторном уровне):
Дополнительные диагностические обследования, проводимые на стационарном уровне (при экстренной госпитализации проводятся диагностические обследования непроведенные на амбулаторном уровне):
• лапароцентез «шарящим катетером» (диагностический перитонеальный лаваж) с лабораторным исследованием полученной жидкости
• боли в ране и (или) в животе различной локализации, интенсивности и ир-радиации. При повреждении печени боли отдают в надплечье справа, при травме селезенки - слева;
• на сухость языка, тошноту, рвоту, задержку газов, отсутствие стула, затруднение при мочеиспускании;
Для выявления тупой травмы большое значение имеет высота, с которой произошло падение, либо скорость транспортного средства, на которой произошла авария.
При проникающих ранениях важны расстояние, с которого был сделан выстрел, вид оружия и пули, длина ножа.
В бессознательном состоянии следует выяснить анамнез по возможности у сопровождающих лиц.
• при проникающем ранении живота оно может означать повреждение печени, селезенки или магистрального сосуда;
• при тупой травме вздутие живота может быть обусловлено паралитической кишечной непроходимостью, которая возникает при повреждении органов забрюшинного пространства (особенно — поджелудочной железы) и спинного мозга;
• вздутие живота, асимметрия, исчезновение дыхательных экскурсий передней брюшной стенки наблюдаются у пострадавших с разлитым гнойным перитонитом, доставленных более чем через 12 часов после травмы полых органов;
• симптом Грея Тернера (цианоз боковой поверхности живота) и симптом Каллена (цианоз пупочной области) указывают на забрюшинную гематому;
• прямые признаки травмы - раны, ссадины, кровоподтеки, кровоизлияния. В то же время отсутствие их на брюшной стенке не исключает наличия тяжелой травмы внутренних органов! При проникающих ранениях находят входное и выходное отверстия, перед рентгенографией отмечают их скрепками для бумаг.
При наличии раны, выпадение из раны внутренних органов и тканей (чаще - пряди большого сальника, реже - петли тонкой кишки), истечение из раны кишечного содержимого, желчи, мочи с соответствующим окрашиванием повязки (белья) и запахом являются прямыми признаками проникающего ранения.
Косвенные признаки проникающего ранения: симптомы общей кровопотери, интоксикации и перитонита, а также пневмоперитонеум (исчезновение печеночной тупости при перкуссии), гидроперитонеум (притупление в отлогих местах), которые выявляются при перкуссии живота.
• при пальпации живота отмечают объемные образования, болезненность, напряжение мышц передней брюшной стенки, крепитацию над костями таза и нижними ребрами;
• диффузное напряжение мышц передней брюшной стенки и болезнен-ность ее при пальпации - признаки повреждения внутренних органов, но этот же симптом является характерным и для изолированной травмы прямых мышц передней брюшной стенки;
• положительный симптом Щеткина-Блюмберга указывает на развитие перитонита, но может отсутствовать в первые часы после травмы;
• положительный симптом Куленкампфа - болезненность и положительные симптомы раздражения брюшины при отсутствии напряжения передней брюшной стенки характерны для гемоперитонеума;
• укорочение перкуторного звука в боковых отделах живота указывает на скопление в брюшной полости свободной жидкости (кровь, экссудат, транссудат, кишечное содержимое, гной, моча и т.д.);
• симптом Джойса: укорочение перкуторного звука, границы которого не меняются при изменении положения тела (поворот на бок) - характерный признак забрюшинной гематомы;
• исчезновение «печеночной тупости» (зоны укорочения перкуторного звука над областью печени) указывает на разрыв полого органа в брюшной полости, когда свободный газ скапливается под правым куполом диафрагмы. Отсутствие данного признака не исключает разрыва полого органа.
Отсутствие перистальтических шумов при одновременном отсутствии резкого вздутия указывает на травму внутренних органов. Вздутие и отсутствие перистальтических шумов может наблюдаться при забрюшинной гематоме и в поздних стадиях перитонита. Отсутствие кишечных шумов в течение 5 мин - показание к диагностической лапаротомии, особенно при проникающих ранениях.
Ректальное исследование: если кровь выделяется из заднего прохода или остается на перчатке при пальцевом исследовании, для выявления повреждений прямой кишки проводят ректороманоскопию.
Назогастральный зонд и мочевой катетер обязательно устанавливаются всем пациентам с подозрением на травму живота. Присутствие крови в полученной жидкости - признак повреждения верхних отделов ЖКТ или мочевых путей.
• нарушения сознания (сопутствующая черепно-мозговая или спинномозговая травма), алкогольное и наркотическое опьянение значительно изменяют болевую чувствительность и затрудняют обследование;
• анальгетики (наркотические и ненаркотические) не назначают до постановки окончательного диагноза.
• показатели гемоглобина и гематокрита сразу при поступлении малоинформативно для оценки состояния больного и объема кровопотери, однако при продолжающемся кровотечении полученные данные служат отправной точкой для динамического наблюдения;
• лейкоцитоз свыше 20х109/л в отсутствие признаков инфекции свидетельствует о значительной кровопотере или о разрыве селезенки (ранний признак);
• повышение активности сывороточной амилазы - признак повреждения поджелудочной железы или разрыва кишки;
• гематурия у 75-90% больных с травмами почек. микрогематурия характерна для малых повреждений; микрогематурия в сочетании с шоком и макрогематурия - для больших повреждений почек. однако это правило соблюдается не всегда, у 24-34% больных с повреждениями почечной ножки и у 28% больных с огнестрельными и колотыми ранами почки гематурия вообще отсутствует;
• исследование промывной жидкости при диагностическом перитонеальном лаваже (лапароцентез «шарящим» катетером): содержание эритроцитов в промывных водах, свыше 108/л или лейкоцитов свыше 5х105/л расценивается как положительный тест на гемоперитонеум. ДПЛ не указывает на глубину повреждения, в 1%-2% случаев возможны осложнения метода, требующих лапаротомии (уровень доказательства - 2); данный метод в основном предназначен для быстрого и эффективного определения гемоперитонеума и имеет ограниченные возможности для диагностики повреждений кишки и диафрагмы, и фактически бесполезен для диагностики повреждений забрюшинно расположенных органов. [3].
Инструментальные исследования:
Первичная хирургическая обработка с ревизией раны - основной и наиболее информативный метод диагностики при открытых травмах живота. Позволяет установить проникающий характер ранения, определить тактику ведения пациента. Наличие дефекта брюшины, как правило, является показанием к широкой срединной лапаротомии.
Вульнерография - контрастная рентгенография раневого канала. При проникающем ранении контрастное вещество попадает в брюшную полость, растекаясь между петлями кишечника и вызывая болевые ощущения. При непроникающем ранении контраст в виде озера скапливается в мягких тканях. Отрицательные данные вульнерографии не позволяют абсолютно исключить проникающий характер ранения. Тем не менее, становится известным общее направление и длина раневого канала, что облегчает выполнение первичной хирургической обработки (при наличии показаний).
УЗИ - признаки наличия свободной жидкости в брюшной полости указывают на повреждение органов. Визуализируются подкапсульные и центральные гематомы паренхиматозных органов. Используется также для динамического наблюдения и решения вопроса о тактике ведения (тенденция к прорыву в брюшную полость).
УЗИ должно рассматриваться как первичный метод при ТТЖ для исключения гемоперитонеума, при негативном или неопределенном результате ДПЛ и КТ дополняющие друг друга методы (уровень доказательства - I, сила рекомендации - А) [5]. Противопоказание - нестабильная гемодинамика пациента.
КТ - диагностика повреждений паренхиматозных органов, аорты, очагов кровоизлияний в брюшной полости и забрюшинном пространстве. Использование рентгеноконтрастных веществ (в/в или внутрь) расширяет возможности КТ и позволяет одновременно визуализировать паренхиматозные и полые органы брюшной полости. Повреждения почек и забрюшинные гематомы выявляют с помощью КТ живота, которую нужно провести каждому больному с гематурией и стабильной гемодинамикой (Уровень рекомендации - C)[3]. Необходимость проведения ИВЛ пациенту не является противопоказанием к КТ. Противопоказание - нестабильная гемодинамика пациента. Когда имеется подозрение на повреждение печени/селезенки КТ позволяет исключить повреждения требующие экстренного оперативного вмешательства (Уровень рекомендации - В) [3]. КТ рекомендуется у гемодинамически стабильных пациентов с неоднозначными данными физикального осмотра, сочетанной неврологической травме или множественной экстраабдоминальной травме. При негативном результате КТ пациент госпитализируется для динамического наблюдения (уровень доказательства - I) [5]. КТ позволяет выбрать консервативную тактику ведения у пациентов с солидным характером повреждения внутренних органов (уровень доказательства - I) [5]. У гемодинамически стабильных пациентов ДПЛ и КТ являются дополняющими друг друга методами диагностики (уровень доказательства - I) [5]. КТ не может использоваться как единственный метод диагностики для исключения повреждений кишки, диафрагмы, поджелудочной железы (Уровень рекомендации - В) [3]. КТ БП достоверно идентифицирует гемоперитонеум у пациентов с ТТЖ (Уровень рекомендации - В)[3]. Пероральное введение контраста при КТне является обязательным при диагностике ТТЖ (Уровень рекомендации - В) [3].
Рентгенография брюшной полости с захватом диафрагмы - позволяет установить разрыв полого органа (свободный газ), жидкость в брюшной полости, переломы костей таза, позвоночника, повреждение диафрагмы. Свободный газ лучше всего выявляется при положении пострадавшего на левом боку и горизонтальном направлении рентгеновских лучей (латерографии). Свободная жидкость в брюшной полости выявляется в виде пристеночных лентовидных теней в латеральных каналах и расширении межпетлевых промежутков, особенно хорошо заметных на фоне пневматоза кишечника. Также признаками травмы являются: смещение газового пузыря желудка, измененное расположение кишечных петель, инородные тела. При переломах нижних ребер возможны повреждения печени, селезенки, почек.
Экскреторная урография - обязательна при нестабильной гемодинамике. Достаточно одного снимка через 5-10 мин после введения рентгеноконтрастного вещества. Контраст можно добавить к инфузируемым растворам. Если состояние больного позволяет, продолжают исследование, каждые 5 мин до полной визуализации почек, мочеточников и мочевого пузыря. При подозрении на сопутствующую черепно-мозговую травму экскреторную урографию следует отложить до проведения КТ головы, чтобы не исказить ее результаты.
Контрастная цистография - при переломах кистей таза необходимо исключать внутрибрюшинный и внебрюшинный разрывы мочевого пузыря.
Ангиография - для диагностики повреждений крупных сосудов. Исследование проводят также при подозрении на артериовенозный свищ или ложную аневризму артерий.
Лапароцентез «шарящим» катетером или диагностический перитонеальный лаваж - быстрый и эффективный метод. Позволяет обнаружить гемоперитонеум, содержимое полых органов, истекающих в брюшную полость при их повреждении (кишечное содержимое, желчь, моча). Для положительного результата этого теста достаточно получить 5-10 мл явной крови. В случае если жидкость не получена, в брюшную полость вводят 1 литр теплого физиологического раствора с последующим микроскопическим исследованием промывной жидкости (см. п.12.3). При использовании ДПЛ принятие тактического решения основывается на данных аспирации содержимого и микроскопическом анализе промывных вод (уровень доказательства - II) [5]. Противопоказан при резком вздутии живота, множественных послеоперационных рубцах передней брюшной стенки. При отсутствии опыта может привести к осложнениям (травме органов, сосудов) или ложному заключению.
Диагностическая лапароскопия позволяет визуально обследовать брюшную полость и оценить степень повреждений и тем самым окончательно решить вопрос о необходимости лапаротомии. Противопоказания: резкое вздутие живота, наличие множественных рубцов на передней брюшной стенке, крайне тяжелое состояние, обусловленное шоком, повреждением груди, головного мозга, а также при
Динамическое наблюдение (повторное УЗИ, либо КТ или ДПЛ) оправданно у гемодинамически стабильных пациентов с неопределенным результатом УЗИ (уровень доказательства - II) [5].
• консультация гинеколога: при выявлении или подозрении на травму наружных или внутренних половых органов у женщины;
• консультация реаниматолога: для определения показаний для лечения больного в условиях реанимационного отделения;
• консультация анестезиолога: для определения типа анестезия при оперативном вмешательстве, а также согласование тактики ведения предоперационного периода;
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
Закрытая травма живота. Повреждения селезенки. Часть 2
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2016;(2): 4‑10
В XXI веке травма приобрела характер пандемии. В систематическом обзоре литературы [63] приведены данные о том, что ежегодно от травмы погибают 5,8 млн человек, а к 2020 г. эта цифра может вырасти до 8,4 млн. Дорожно-транспортные происшествия являются самой частой причиной смерти людей в возрасте от 15 до 44 лет.
Среди закрытых повреждений органов брюшной полости травма селезенки, по данным разных авторов, составляет от 16 до 50%, занимая по частоте 1-2-е место [11, 14, 27, 57, 77].
Хирургия повреждений селезенки прошла несколько этапов. Спленэктомию выполняли в Китае во втором веке нашей эры [64], однако впервые она была описана в медицинской литературе в 1549 г. [43]. В 1581 г. Viard удалил часть селезенки, выпавшую через колото-резаную рану брюшной стенки [24]. В обоих случаях наступило выздоровление. До 80-х годов прошлого века спленэктомия была единственной операцией при травме селезенки. Так, в руководстве по оперативной хирургии написано: "В связи с этим обстоятельством, характеризующим паренхиматозный орган, кроме спленэктомии, то есть полного удаления селезенки, никакие иные вмешательства на ней не рекомендуются" [15]. Углубление знаний о многочисленных функциях селезенки [18], в том числе иммунной [7, 16, 17], привело к разработке органосохраняющих операций [2, 8, 10] и аутотрансплантации ткани селезенки [1, 19]. После успешного применения консервативной терапии повреждений паренхиматозных органов у детей эта тактика была распространена на взрослых [68].
Морфологические аспекты травмы селезенки, в том числе двухмоментного разрыва, исследованы в работах А.П. Вилька и соавт., М.А. Сапожниковой и I. Riezzo и соавт. [9, 20, 69].
Для повреждения селезенки, особенно патологически измененной, не требуется приложения большой силы. Хорошо известны случаи ее спонтанного разрыва при различных заболеваниях [25, 42, 46, 51, 74, 87]. Прочность селезенки на разрыв на 4 / 5 обеспечивается неповрежденной капсулой [73].

В настоящее время общепринятой является классификация повреждений (Organ Injury Scaling), The American Association for the Surgery of Trauma [58]. Раздел, посвященный повреждениям селезенки, опубликован в 1989 г. и пересмотрен в 1994 г. (см. таблицу ).
Повреждение селезенки можно предполагать, исходя из механизма травмы (удар в левую половину туловища), при наличии переломов VIII-XII ребер слева. K. Boris и соавт. [30] показали, что вероятность повреждения селезенки у пострадавших с переломом пяти и более ребер с левой стороны превышает таковую у пострадавших с переломом от одного до четырех ребер, однако тяжесть повреждения селезенки не коррелирует с количеством сломанных ребер. Клиническая картина разрыва селезенки характеризуется признаками внутрибрюшного кровотечения. Патогномоничным для травмы селезенки считают симптомы Kehr (френикус-симптом, т.е. боль в области левого надплечья и левого плечевого сустава) и ваньки-встаньки (усиление боли в горизонтальном положении больного), хотя они встречаются очень редко [3]. Следует помнить, что у пострадавшего с нарушением сознания и при сочетанной травме с доминирующими повреждениями в других областях тела клиническая картина может быть завуалирована [79]. Следовательно, любому пострадавшему с травмой живота показано инструментальное обследование и клиническое наблюдение.
Возможности и ограничения различных диагностических методов (УЗИ, КТ, лапароцентез и лапароскопия) были обсуждены в предыдущей лекции. По данным анкетирования, более 80% швейцарских хирургов начинают инструментальное обследование при абдоминальной травме с УЗИ [72], и автор лекции поддерживает эту точку зрения. Поскольку методика FAST имеет низкую чувствительность в определении травмы селезенки [35], у гемодинамически стабильных пострадавших при УЗИ необходимо осматривать органы брюшной полости и забрюшинного пространства. Подозрение на травму органов брюшной полости на основании данных УЗИ (в том числе жидкость в брюшной полости и забрюшинное кровоизлияние) является показанием к проведению КТ.
КТ - наиболее точный диагностический способ, позволяющий установить тяжесть повреждения селезенки и обнаружить признаки продолжающегося кровотечения [70]. Использование КТ при травме, по данным F. Swaid и соавт. [77], способствовало существенному уменьшению количества диагностических лапаротомий. Обязательным является внутривенное контрастное усиление и сканирование в артериальную, портальную венозную и отсроченную фазы [31]. В артериальную фазу лучше выявляются повреждения артерий [80], в венозную и отсроченную - продолжающееся кровотечение и разрыв паренхимы. Ложная артериальная аневризма, наличие зоны повышенного накопления контрастного вещества в паренхиме (blush), большое количество жидкости в брюшной полости служат признаками продолжающегося кровотечения [32]. Учитывая риск повторного кровотечения у пострадавших, которых лечат консервативно, многие исследователи рекомендуют выполнять повторную КТ в сроки от 48 часов [55] до 7 сут [60] после травмы.
Лапароцентез и диагностический перитонеальный лаваж в последние годы применяют реже, чем неинвазивные методы диагностики. Показанием к применению лапароцентеза и перитонеального лаважа является неинформативность УЗИ и невозможность выполнить КТ. Считаем необходимым напомнить, что лапароцентез и лапароскопия не позволяют диагностировать центральную гематому селезенки и, следовательно, проводить адекватную этому состоянию терапию. В таких ситуациях интенсивное внутрибрюшное кровотечение при двухмоментном разрыве селезенки оказывается полной неожиданностью как для пострадавшего, так и для хирурга.
Все исследователи считают основным фактором, влияющим на выбор тактики при травме селезенки, показатели гемодинамики [48, 49, 53, 86, 89].
Пострадавшие с нестабильной гемодинамикой и большим количеством жидкости в брюшной полости, по данным УЗИ или положительным результатом лапароцентеза, требуют немедленной лапаротомии [75].
Операция при интенсивном внутрибрюшном кровотечении направлена на спасение жизни, поэтому должна выполняться настолько быстро, насколько это возможно. Автор лекции, имеющий 25-летний опыт экстренной хирургии, в основном хирургии повреждений, считает необходимым напомнить неукоснительную последовательность действий во время лапаротомии у пострадавшего с абдоминальной травмой. Как уже было сказано в предыдущей лекции, универсальным доступом при абдоминальной травме является верхняя средне-срединная лапаротомия.
Лапаротомия, снимая тампонирующий эффект, может приводить к гипотонии. Если снижение давления имеет выраженный или критический характер, а ревизия органов брюшной полости затруднена или невозможна вследствие большого гемоперитонеума, целесообразно прижать кулаком аорту к позвоночнику сразу ниже диафрагмы. Этот прием позволяет добиться некоторой стабилизации гемодинамики, дает дополнительное время на инфузионную терапию и аспирацию крови, которую целесообразно выполнять с использованием аппаратов для реинфузии.
После эвакуации крови из брюшной полости выполняют ее полноценную и быструю ревизию. При необходимости опорожнить желудок устанавливают назогастральный зонд. Тонкую кишку эвентрируют из брюшной полости, а поперечную ободочную оттягивают каудально - это улучшает обзор верхнего отдела брюшной полости. Осматривают и пальпируют органы брюшной полости в следующем порядке: диафрагмальная поверхность правой доли печени и правая половина диафрагмы; висцеральная поверхность правой доли печени и желчный пузырь; диафрагмальная и висцеральная поверхности левой доли печени; левое поддиафрагмальное пространство (селезенка и левая половина диафрагмы). Каждый этап осмотра заканчивают тампонадой правого поддиафрагмального, подпеченочного и левого поддиафрагмального пространств. Затем осматривают абдоминальный отдел пищевода, переднюю стенку желудка с малым сальником, видимую через брюшину часть двенадцатиперстной кишки. После этого проводят ревизию ободочной кишки в направлении от слепой к сигмовидной с одновременным осмотром брюшины латеральных каналов и пальпацией почек. Переместив поперечную ободочную кишку каудально, последовательно, от связки Трейтца до илеоцекального перехода, осматривают тонкую кишку, ее брыжейку и оба брыжеечных синуса. На поврежденные артерии накладывают зажимы Бильрота или сосудистые - в зависимости от необходимости реконструктивной сосудистой операции, сквозные разрывы органов желудочно-кишечного тракта изолируют салфетками, смоченными антисептиком.
После окончания ревизии брюшной полости тампоны удаляют. Промокание тампона кровью свидетельствует о продолжающемся кровотечении и указывает на его возможный источник. Следует подчеркнуть, что полноценная ревизия органов брюшной полости предшествует восстановительному этапу операции. Типичная ошибка молодых хирургов заключается в том, что сначала ушивают то повреждение, которое первым бросилось в глаза, затем продолжают ревизию и снова прерывают ее для репарации другого обнаруженного повреждения и т.д. При такой неправильной последовательности действий травма аорты или нижней полой вены будет обнаружена последней со всеми вытекающими последствиями. О показаниях к ревизии забрюшинного пространства и методах ее выполнения будет рассказано в одной из следующих лекций.
Итак, травма селезенки обнаружена. Что делать? Ключом к любой операции на селезенке являются ее мобилизация и выведение на уровень лапаротомной раны. В отличие от больных с гематологическими заболеваниями, это удается сделать у большинства пострадавших. Попытки выполнить операцию на селезенке в глубине левого поддиафрагмального пространства чреваты дополнительной кровопотерей, плохим гемостазом и травмой хвоста поджелудочной железы. Предложены два способа мобилизации селезенки, условно их можно назвать "передний" и "задний".
"Задний" способ применяют при мобильной селезенке, его легче выполнить у худощавых пациентов и при наличии широкого реберного угла. Мобилизацию начинают со смещения селезенки в сторону лапаротомной раны и пересечения селезеночно-почечной связки. Проникнув указательным пальцем правой руки, а затем и кистью в жировую клетчатку, хирург расслаивает ее, мобилизуя этим селезенку с хвостом поджелудочной железы [5]. Следует подчеркнуть, что во время этого маневра необходимо тыльной поверхностью пальца или кисти ощущать переднюю поверхность почки, это свидетельствует о нахождении "в слое", что исключает дополнительную травму селезенки и поджелудочной железы. Ротация селезенки и смещение ее к лапаротомной ране позволяют быстро наложить зажимы и остановить кровотечение. Поскольку при таком способе мобилизации зажимы нередко накладывают одновременно на "ножку" селезенки и желудочно-селезеночную связку, нужно быть очень внимательным, чтобы не захватить в зажим хвост поджелудочной железы и большую кривизну желудка. Перевязкой и пересечением селезеночно-ободочной и желудочно-селезеночной связок (если это не было выполнено на предыдущем этапе) заканчивают операцию.
Некоторые хирурги [4, 22] считают, что лигирование селезеночной артерии можно сочетать с органосохраняющей операцией на селезенке и это не приводит к увеличению послеоперационных осложнений в виде панкреатита и ишемии селезенки. Другие авторы [86] пишут: ". те селезенки, которые мы раньше могли сохранить во время операции, сейчас мы лечим без операции", поэтому если пострадавшему с травмой селезенки показана операция, то это всегда спленэктомия [90]. В пользу этого свидетельствует также то, что при закрытой травме в отличие от колото-резаного ранения объем внутриорганного повреждения неизвестен и чаще всего больше, чем его наружные проявления.
В своей практической деятельности мы поступаем следующим образом. Если по результатам осмотра принято решение о спленэктомии, кровотечение неинтенсивное, а анатомические условия сложные, мобилизацию проводим по "переднему" способу. Если кровотечение интенсивное и доступ к селезенке технически прост, выбираем "задний" способ. Если предполагается органосохраняющая операция, то селезеночную артерию не перевязываем, а берем на турникет, который снимаем после окончания оперативного приема на селезенке.
Пострадавшим со стабильной гемодинамикой и признаками травмы органов брюшной полости по данным УЗИ проводят КТ и уточняют возможность консервативной терапии. В травматологических центрах первого уровня в 50-75% наблюдений при травме селезенки начинают консервативную терапию [55, 61, 66]. Необходимыми организационными условиями консервативной терапии являются повторные осмотры, лабораторные и инструментальные методы обследования, постоянная доступность операционной и анестезиологической службы [76].
Эндоваскулярная эмболизация - это важная составляющая консервативной терапии [47, 59, 65, 75], хотя ее применяют менее чем в 10% наблюдений [38]. Показания к ангиографии и ее эффективность остаются предметом дискуссий. Большинство авторов полагают, что ангиография показана при IV-V степени повреждения селезенки, продолжающемся кровотечении (blush) [29], сосудистых повреждениях [56]. Некоторые авторы считают дополнительными показаниями к ангиографии гипотонию, не корригируемую инфузионной терапией, и необходимость в повторных гемотрансфузиях [34].
Показанием к эндоваскулярной операции служит обнаружение при ангиографии экстравазации контрастного вещества (в брюшную полость или интрапаренхиматозно), ложной артериальной или артериовенозной аневризмы. Косвенными показаниями являются "обрыв", спазм или тромбоз ветви селезеночной артерии. Существует три метода эмболизации. При проксимальной эмболизации осуществляют окклюзию ствола селезеночной артерии после отхождения от нее ветвей к поджелудочной железе (дорсальной панкреатической артерии). Дистальная (суперселективная) эмболизация предполагает идентификацию и окклюзию только поврежденного сосуда. Сочетание двух методов называют комбинированной эмболизацией. К каждому методу существуют свои показания, однако формат лекции для хирургов не позволяет обсудить этот вопрос. Проксимальная эмболизация более надежна и выполняется быстрее, но после нее чаще возникают осложнения, хотя J. Frandon и соавт. [44], B. Schnüriger и соавт. [71] c этим не согласны. К "большим" осложнениям эмболизации относят повторное кровотечение [88], абсцесс [78] селезенки и сепсис, панкреатит [62], тотальный инфаркт селезенки, к "малым" - инфаркт части селезенки [50]. Общие осложнения ангиографии (повреждение сосуда, нефропатия и пр.) в настоящей лекции также не обсуждаются.
По данным метаанализа J. Requarth и соавт. [66], включившего 10 157 пострадавших, консервативная терапия была успешной в 91,7% наблюдений. Очевидно, что чем строже критерии отбора пострадавших для проведения консервативной терапии, тем лучше ее результаты. Более успешна консервативная терапия повреждений селезенки в травматологических центрах первого уровня, университетских клиниках, стационарах, регулярно использующих ангиографию [28].
Предикторами неудачи консервативной терапии F. Carvalho и соавт. [36] считают общую тяжесть травмы и степень повреждения селезенки. В 2000 г. G. Velmahos и соавт. [81, 82] отмечали, что консервативная терапия при травме селезенки III и более степени и необходимости в переливании 1 л крови менее успешна, к 2010 г. они несколько изменили свое мнение [83] и называли такими факторами уже V степень травмы селезенки и черепно-мозговую травму.
Что делать при неудаче консервативной терапии? Если клиническая картина кровотечения очевидна, альтернативы открытой операции нет. Если продолжающееся кровотечение проявляется увеличением количества жидкости в брюшной полости по данным УЗИ, а гемодинамика продолжает оставаться стабильной, то целесообразно выполнить лапароскопическую спленэктомию [23, 26].
Остановку кровотечения из разрыва селезенки осуществляют с использованием швов, химического (Tachocomb, SURGICEL, 3% раствора натрия тетрадецил сульфата) или физического (ультразвукового, электрического, аргоно-плазменного) воздействия, однако в связи с крайней редкостью подобных наблюдений в этой лекции мы их не рассматриваем.
Аутотрансплантацию фрагментов [19, 45] или ткани [6, 12, 54] селезенки, довольно распространенную в 90-е годы XX века, в настоящее время применяют гораздо реже, поскольку доказать ее практическую пользу не удалось.
Послеоперационные осложнения и осложнения при проведении консервативного лечения пострадавшего с травмой селезенки включают повторное кровотечение, травматический панкреатит, инфильтрат и абсцесс левого поддиафрагмального пространства. Ятрогенная травма большой кривизны желудка может привести к некрозу его стенки, формированию абсцесса и желудочного свища. Лечение этих осложнений осуществляют по общим принципам хирургии. Автор лекции убежден, что тщательное соблюдение всех этапов операции сводит появление таких осложнений к минимуму.
Специфическое осложнение спленэктомии - overwhelming postsplenectomy infection (OPSI), или подавляющая постспленэктомическая инфекция, было описано H. King и H. Shumaker [52] у детей, оперированных по поводу различных гематологических заболеваний. Подавляющую постспленэктомическую инфекцию вызывают инкапсулированные микроорганизмы (пневмококки и менингококки), инфекция развивается очень быстро и приводит к летальному исходу в 50% наблюдений. Подавляющая постспленэктомическая инфекция у взрослых пациентов, оперированных по поводу травмы, в отличие от педиатрической популяции, является казуистикой [37]. J. Wang и соавт. [85] провели телефонный опрос 889 пациентов, перенесших спленэктомию, и обнаружили, что подавляющая постспленэктомическая инфекция имела место у одного из них, что составило 0,1%.
Во многих странах существуют рекомендации для пациентов после спленэктомии или с нефункционирующей селезенкой, которые включают обязательную вакцинацию, информирование и обучение пациентов и антибактериальную терапию, по требованию или постоянную [40], однако проверки показывают, что эти рекомендации плохо соблюдают и врачи, и пациенты [33, 41, 84].
Подводя итог, считаем нужным сказать, что тщательное следование изложенным принципам диагностики и лечения пострадавших с закрытой травмой селезенки позволяет снизить летальность и количество осложнений до минимальных значений. Так, в течение последних 25 лет в Научно-исследовательском институте скорой помощи им. Н.В. Склифосовского смерть больного с закрытой изолированной травмой селезенки является казуистикой.
Читайте также:
- Сердце при сужении артериального конуса. Морфология закрытой вальвулотомии по Броку
- Рентгенограмма, КТ, УЗИ при подковообразной почке
- Лечение ревматической лихорадки. Физиология системы дыхания
- Диагностика опухолей придатков матки после климакса (менопаузы)
- Значение иммунохимического анализа в диагностике парапротеинемий
