Эффективность раннего обнаружения рака шейки матки.
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Рак шейки матки (РШМ) занимает ведущее место в структуре женской онкологической заболеваемости и смертности в развивающихся странах и стабильное третье-четвертое место (после рака молочной железы, рака яичников, рака эндометрия) в экономически развитых странах [1]. В целом по распространенности РШМ занимает второе место после рака молочной железы. По данным ВОЗ ежегодно в мире регистрируется около 450 тыс. новых случаев РШМ [2]. Ежегодно только в странах Европейского сообщества отмечается более 25 тыс. новых случаев заболеваний и около 12 тыс. летальных исходов, связанных с РШМ [3]. В последние годы в экономически развитых странах отмечен рост заболеваемости РШМ среди женщин молодого и среднего возраста [2].
В России в настоящее время ежегодная заболеваемость РШМ составляет 14,9 на 100 тыс. женщин [5]. В Санкт-Петербурге среди злокачественных новообразований женских гениталий РШМ занимает третье место после рака эндометрия и рака яичников, тогда как в России в целом остается на втором, уступая только раку эндометрия [6]. Более 40% женщин с установленным диагнозом инвазивного РШМ умирают от прогрессирования заболевания в течение первых 5 лет с момента установления диагноза [7].
В сложной и разветвленной проблеме РШМ центральное место занимают три основных направления:
- разработка патогенетически обоснованных методов ранней диагностики и профилактики;
- усовершенствование методов лечения и прогнозирования течения предопухолевых заболеваний шейки матки и преинвазивного рака;
- повышение эффективности лечения инвазивного рака.
Особенно актуальным для РШМ является первое положение. Для РШМ, как ни для какого вида опухолей, разработаны методы скрининговой диагностики, позволяющие диагностировать неопластические процессы уже на самых ранних стадиях. При этом развитие одного из самых важных - цитологического метода - позволило еще в 60-е годы утверждать, что в ближайшем будущем женщины не должны умирать от РШМ, поскольку неопластические процессы будут выявляться на самых ранних доинвазивных стадиях.
Важной предпосылкой для реализации этого положения является разработка и внедрение вирусологических и молекулярно-биологических методов диагностики, позволяющих определить онкогенные папилломавирусы.
Большое внимание в последние годы уделяется и иммунологическим аспектам возникновения РШМ, поскольку одной из основных функций иммунной системы является элиминация опухолевых клеток.
В настоящее время считается общепризнанной роль онкогенных папилломавирусов (HPV) в этиопатогенезе РШМ. При многочисленных мультицентровых обследованиях женщин, страдающих РШМ, инфицированность онкогенными папилломавирусами наблюдалась более чем в 95% случаев [8, 9].
Онкогенный потенциал папилломавирусов существенно варьирует. По способности инициировать диспластические (предраковые) процессы и рак аногенитальной области папилломавирусы условно разделены на группы «высокого» (16, 18, 45, 30), «среднего» (31, 33, 35, 51, 52, 58) и «низкого» (6, 11, 42, 43, 44) риска. При этом основную роль играют HPV 16 и 18 типов, встречающиеся в 50-70% и 10-20% случаев РШМ соответственно [10].
Теоретические и экспериментальные исследования, посвященные роли HPV в развитии РШМ, дали толчок для разработки практических подходов, связанных с использованием молекулярно-биологическх методов ранней диагностики РШМ. К ним, прежде всего, относятся полимеразная цепная реакция (ПЦР) с типоспецифическими и видоспецифическими праймерами и так называемая молекулярная гибридизация II поколения (Hybrid Capture II).
Основным принципом ПЦР является многократное копирование определенного участка вирусной ДНК, что позволяет визуализировать продукты реакции в электрофорезе в полиакриламидном или агарозном геле при окраске бромистым этидием и подсветке ультрафиолетом.
Основным принципом Hybrid Capture II является формирование специфических ДНК-ДНК гибридов, улавливаемых антителами, фиксированными на лунках планшета. Использование хемилюминесцентной метки позволяет проводить не только качественную, но и количественную оценку результатов.
Полученные нами данные, представленные в табл. 1, свидетельствуют о разной чувствительности этих методов [12].
Таблица 1.
Частота инфицирования онкогенными типами HPV по данным обследования методом Hybrid Capture II и ПЦР.
| Метод диагностики | Hybrid Capture II | ПЦР | ||
|---|---|---|---|---|
| Группы больных | Количество больных | HPV (+) | Количество больных | HPV (+) |
| 1 группа | 413 | 119 (28,8%) | 181 | 66 (36,5%) |
| 2 группа | 57 | 4 (7%) | 78 | 9 (11,5%) |
| Всего: | 470 | 123 (26,2%) | 259 | 75 (28,9%) |
Наш опыт использования молекулярно-биологических методов для выявления папилломавирусов позволяет дать их сравнительную оценку. Так, ПЦР, обладая большей чувствительностью, несколько чаще дает так называемые ложно-позитивные результаты. В то же время, молекулярная гибридизация II поколения при большей ее технологичности до настоящего времени остается весьма дорогостоящим методом, так и не получившим широкого распространения в нашей стране.
Перспективным для изучения различных генов папилломавирусов, участвующих в злокачественной трансформации, является так называемый «real time» ПЦР метод. Его принцип заключается в количественной оценке экспрессии тех или иных генов, что может иметь важное прогностическое значение.
Одним из ключевых положений, характеризующих молекулярные механизмы опухолевой трансформации при инфицировании онкогенными папилломавирусами, является оценка экспрессии генов Е2 и Е6 [13]. Использование количественной ПЦР в реальном времени с целью анализа физического состояния ДНК HPV позволило высказать следующее допущение:
- после интеграции преимущественное разрушение Е2 генов приводит к отсутствию последовательностей Е2 генов в продуктах ПЦР;
- количество копий обоих генов должно быть одинаковым в эписомальной форме;
- в конкоминантной форме количество копий Е2 генов должно быть меньше, чем Е6 генов.
Несмотря на несомненную теоретическую и диагностическую ценность молекулярно-биологических методов диагностики папилломавирусной инфекции, «золотым стандартом», безусловно, остается цитологический метод. Профилактика и ранняя диагностика РШМ шейки матки включает два этапа:
- массовое цитологическое обследование женщин на профилактических осмотрах;
- углубленная диагностика при выявлении патологии (кольпоскопия, биопсия).
Успех цитологического скрининга рака шейки матки зависит от его организации. До настоящего времени не решен вопрос о возрастном составе населения, подлежащего цитологическому скринингу, и периодичности его проведения. В различных странах интервалы между скринингами колеблются от 1 года до 5 лет. По нашему мнению, интервал между цитологическими скринингами не должен превышать 2-3 лет, и обследование должны проходить все женщины с возраста начала половой жизни, оптимально - с 20 до 65 лет.
В определенной степени цитологический и молекулярно-биологический методы сближает иммуноцитохимический (ИЦХ) метод, основанный на определении капсоидных белков HPV с помощью моноклональных антител S33 и Т16. Распознаваемый моноклональным скрининговым антителом S33 эпитоп консервативен и дает возможность идентификации почти всех типов HPV. Эпитоп, распознаваемый моноклональным антителом Т16, напротив, консервативен для HPV 16 и 18 типов, имеющих склонность к злокачественной трансформации эпителия. Эффективность иммуноцитохимического исследования для оценки активной фазы папилломавирусной инфекции была сопоставлена нами с помощью еще одного молекулярно-биологического метода - так называемой обратно транскриптазной ПЦР (ОТ ПЦР) (табл. 2).
Для пациенток с положительными результатами иммуноцитохимического исследования прогрессия CIN более вероятна, чем элиминация HPV и регрессия дисплазии.
Таким образом, определение активной фазы папилломавирусной инфекции может служить дополнительным критерием прогрессирования дисплазий и поводом для более энергичных методов терапии [16].
Следует отметить, что развитие РШМ - вероятностный процесс, зависящий не только от инфицирования онкогенными папилломавирусами но и от целого ряда экзо- и эндогенных факторов. Безусловно, среди эндогенных сопутствующих факторов важнейшее значение имеет фоновая патология шейки матки, предрасполагающая к персистированию папилломавирусов. Полученные нами данные свидетельствуют о высокой ее частоте у женщин, инфицированных онкогенными типами папилломавирусов (табл. 3) [17].
Таблица 2.
Оценка эффективности ИЦХ и ОТ ПЦР при определении репродуктивной фазы HPV-инфекции.
| Группы | Скрининг | HPV 16/18 | ||||
|---|---|---|---|---|---|---|
| ПЦР (+) | ИЦХ (+) | ОТ ПЦР(+) | ПЦР (+) | ИЦХ (+) | ОТ ПЦР (+) | |
| Без атипии | 3 (7,5%) | 1 (33,3%) | 2 (66,7%) | 2 (28,6%) | 1 (50,0%) | 1 (50,0%) |
| CIN I | 17 (42,5%) | 5 (29,4%) | 9 (53,0%) | 15 (45,5%) | 5 (33,3%) | 6 (40,0%) |
| CIN II | 8 (20,0%) | - | - | 5 (45,5%) | - | - |
| CIN III | 4 (10,0%) | - | - | 3 (37,5%) | - | - |
| Ca in situ | 8 (20,0%) | - | - | 7 (70,0%) | - | - |
| Всего | 40 (100,0%) | 6 (15,0%) | 11 (27,5%) | 32 (46,4%) | 6 (18,75%) | 7 (21,9%) |
Таблица 3.
Характер фоновой цервикальной патологии у обследованных женщин.
| Фоновая цервикальная патология | ОТ ПЦР (+)(n=215) | ОТ ПЦР (-)(n=170) | P | ||
|---|---|---|---|---|---|
| n | M±m% | n | M±m% | ||
| Эндоцервицит | 49 | 22,8±5,6% | 40 | 23,5±6,4% | >0,1 |
| Эрозированный эктропион | 147 | 68,4±6,2% | 90 | 52,9±7,5% | |
| Лейкоплакия | 12 | 5,6+3,2% | 7 | 4,1±2,9% | >0,1 |
| Всего: | 208 | 96,7±2,3% | 137 | 80,6±5,6% | |
Все большее внимание в последние годы уделяется состоянию иммунной системы при различных формах онкологической патологии, а также разработке методов терапии, основанных на использовании надзорных функций иммунитета. К сожалению, следует признать, что эти исследования в большинстве случаев все еще остаются в экспериментальной стадии. И даже наиболее перспективные из них, например, создание противоопухолевых вакцин на основе дендритных клеток, еще ожидает долгий путь внедрения в клиническую практику. Вместе с тем, нельзя отрицать важную прогностическую ценность изучения некоторых параметров иммунной системы, имеющих отношение к противоопухолевому иммунитету. Среди них, конечно, в первую очередь следует упомянуть систему интерферонов и цитотоксических клеток.
Полученные нами данные свидетельствуют о существенных изменениях цитотоксической активности так называемых NK-клеток (натуральных киллеров). У женщин, инфицированных онкогенными папилломавирусами, наблюдалось прогрессирующее снижение цитотоксического индекса NK-клеток, коррелирующее со степенью изменений цервикального эпителия и максимально выраженное при раке шейки матки.
Еще более показательными были изменения интерферонового статуса, характеризующиеся снижением способности к продукции как α/β, так и γ-интерферонов.
Таблица 4.
Состояние системы интерферона у обследованных женщин.
| Группа больных | HPV (+) (n=77) | HPV (-) (n=45) | ||||||
|---|---|---|---|---|---|---|---|---|
| n | IFN | IFN-α/β | IFN-γ | n | IFN | IFN-α/β | IFN-γ | |
| Гинекологически здоровые | 4 | 19,7 | 185,3 | 93,9 | 8 | 20,5 | 172,6 | 107,7 |
| Экстрацервикальная патология | 22 | 21,6 | 169,3 | 78,6 | 23 | 20,5 | 156,6 | 81,3 |
| Фоновая цервикальная патология | 31 | 22,5 | 171,2 | 76,3 | 12 | 22 | 149,2 | 61,2 |
| Предраковая патология | 6 | 22,7 | 142,9 | 50 | 2 | 24,2 | 112,5 | 42,8 |
| Раковая патология | 14 | 25,3 | 113,7 | 49,2 | 0 | - | - | - |
Следует отметить, что оценка интерферонового статуса может служить не только дополнительным прогностическим критерием прогрессирования патологии шейки матки, но и основанием для назначения вспомогательной иммуноориентированной терапии, в частности с использованием генно-инженерных интерферонов и индукторов интерферонов [17].
В заключение нам бы хотелось представить алгоритм обследования женщин с целью профилактики и раннего выявления РШМ (схема 1).
Необходимо обратить внимание на пациенток с дисплазиями по данным цитологического исследования и отсутствием HPV в ПЦР. Эта группа женщин всегда должна настораживать специалистов в плане возникновения преинвазивного и инвазивного рака, т.к. отрицательные результаты определения папилломавируса даже высокочувствительными лабораторными методами не всегда свидетельствуют о его отсутствии в макроорганизме. Причиной указанного феномена может быть погрешность в заборе материала, возникновение дисплазии, обусловленной редкими серотипами HPV, не идентифицирующимися в используемых тест-системах.
Особое внимание заслуживают пациентки с латентными формами папилломавирусной инфекции, вызванной онкогенными серотипами (без онкоцитологических признаков дисплазии РШМ). Основной задачей, на наш взгляд, в этом случае является оценка активности папилломавирусной инфекции по тестам, определяющим репликацию, а также по количественному тесту, оценивающему вирусную нагрузку. Известно, что возникновению интегрированных форм и запуску онкогенеза всегда предшествует репликация вирусного генома. Поэтому эта группа больных требует иммуномодулирующей терапии для стабилизации системы иммунитета и перевода инфекции в неактивную латентную форму. Хотелось бы обратить внимание на высокую значимость определения интеграции вирусного генома в клеточный геном эпителия шейки матки.
Схема 1. Алгоритм обследования с целью профилактики и раннего выявления РШМ
Таким образом, профилактика РШМ базируется на своевременном выявлении и лечении предраковых патологических процессов на шейке матки, определении группы риска по папилломавирусной инфекции, играющей одну из главных ролей в канцерогенезе, а также тщательном диспансерном наблюдении за указанным контингентом больных.
Список литературы:
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Рак шейки матки - причины, симптомы, диагностика, методы лечения и прогноз
Мой опыт составляет более 400 лапароскопических операций при раке шейки матки с положительными результатами. Ежегодно я провожу мастер-классы для гинекологов и онкологов по проблемам хирургического лечения рака шейки матки.
Актуальность проблемы рака шейки матки.
Рак шейки матки — злокачественное заболевание, возникающее в шейке матки. Различают две его основные разновидности: аденокарцинома и плоскоклеточный рак. В настоящее время, считается доказанной связь заболеваемости вирусом папилломы человека и риском развития рака шейки матки.
По данным ВОЗ в мире выявляется около 500 000 впервые заболевших раком шейки матки.
Причины и механизмы возникновения рака шейки матки
В настоящее время основной причиной возникновения рака шейки матки является вирус папилломы человека.
Инфекция вызывает нарушение морфологической структуры шейки матки воспалительным процессом, а также угнетение местного и системного иммунитета.
Большую роль играет травма шейки матки при родах, медицинских абортах и внутриматочных оперативных вмешательствах.
Не мало важное значение имеет наследственность.
Факторы риска развития рака шейки матки
- Раннее начало половой жизни (до 18 лет)
- Роды в возрасте до 20 лет и после 40 лет
- Неоднократные аборты и травмы шейки матки в анамнезе
- Частая смена половых партнеров
- Наличие папилломавирусной инфекции
- Отсутствие половой гигиены
- Курение
- Отягощенная наследственность
- Иммунодефицитные состояния
- Длительный прием оральных контрацептивов
Клинико-морфологическая классификация (Бохман Я.В., 1976)
- Фоновые заболевания: эктопия (псевдоэрозия, эндоцервикоз), лейкоплакия, эритроплакия, полип, остроконечные кондиломы; посттравматические изменения: деформация шейки матки, эктропион, фистулы;
- Предраковый процесс - дисплазия: слабая, умеренная, тяжелая; лейкоплакия с атипией.
- Преинвазивный рак - внутриэпителиальный рак (Ca in situ, внутриэпителиальный рак);
- Микроинвазивный рак;
- Инвазивный рак: плоскоклеточный ороговевающий, плоскоклеточный неороговевающий, аденокарцинома, железисто-плоскоклеточный (мукоэпидермоидный), низкодифференцированный.
Международная классификация болезней Х пересмотра (1995г.)
N86 Эрозия и эктропион шейки матки
N87 Дисплазия шейки матки N87.0 Слабовыраженная дисплазия шейки матки
N87.1 Умеренная дисплазия шейки матки
N87.2 Резко выраженная дисплазия шейки матки, не классифицированная в других рубриках
N88.0 Лейкоплакия шейки матки
N84.1 Полип шейки матки
D06 Карцинома in situ шейки матки
С53 Злокачественные новообразования шейки матки
Рекомендации к проведению скрининга на рак шейки матки
Все женщины должны проходить скрининг на рак шейки матки через 3 года после начала половой жизни, но не позже 21 года. Скрининг нужно проводить ежегодно с исследованием мазков из шейки матки.
Начиная с 30-летнего возраста, женщины, имевшие три последовательных отрицательных результата при исследовании мазков из шейки матки, могут проходить скрининг каждые 2-3 года. Женщины с ВПЧ или ослабленной иммунной системой в результате трансплантации, химиотерапии или длительного применения стероидных гормонов, должны продолжить ежегодный скрининг.
Женщины 70 лет и старше, с тремя и более нормальными результатами исследования мазков из шейки матки за последние 10 лет, могут не участвовать в скрининге.
Женщины, перенесшие удаление матки и шейки матки, могут не участвовать в скрининге, если операция была выполнена не по поводу рака или предракового состояния шейки матки.
Женщины, которым произведено удаление матки без удаления шейки матки, должны продолжать участие в скрининге.
Для скринингового исследования я использую метод жидкостной цитологии, так как он является наиболее информативным на данный период времени. При этом полученный из шейки матки материал помещается в пробирку со специальной жидкостью, обладающей свойствами консерванта и стабилизатора. При подозрении на ВПЧ или его наличии в прошлом из этого же материала можно дополнительно получить уточняющие сведения о вирусе: наличие в данный момент, тип и количество, - что позволит отслеживать процесс лечения в динамике.
Клиническая картина рака шейки матки проявляется следующими симптомами:
- патологические выделения из половых путей (бели);
- сукровичные или контактные кровянистые выделения
- нарушение менструальной функции;
- боль;
- нарушение функции соседних органов.
Диагностика рака шейки матки
Современные методы диагностики рака шейки матки включают:
- Клинический
- Кольпоскопия
- Морфологический:
- цитологический (чувствительность 60-83%)
- гистологический
Методы выявления HPV:
- цитологический (койлоцитоз)
- иммуноцитохимический
- молекулярно-биологический (PCR, Hybrid Capture II)
- оптическая когерентная томография
Онкогенные серотипы вируса папилломы человека
- Высокий онкогенный риск - 16, 18, 31, 33, 39, 50, 59, 64, 68, 70
- Средний онкогенный риск - 30, 35, 45, 52, 53, 56, 58
- Низкий онкогенный риск - 3, 6, 11, 13, 32, 34, 40, 41, 42, 43, 44, 51, 61, 72, 73
Молекулярно-биологические методы диагностики
- PCR - многократное копирование определенного участка вирусной ДНК
- Hybrid Capture II - формирование специфических ДНК-ДНК гибридов, улавливаемых антителами, фиксированными на лунках планшета
- Обратно-транскриптазная PCR
Иммуноцитохимические методы диагностики
- определении капсоидных белков HPV с помощью моноклональных антител S33 и Т16
- Окраска на ингибитор циклинзависимой киназы p16INK4a
Диагностический алгоритм обследование пациентки при подозрении на рак шейки матки включает два этапа:
I этап - первичное обследование: анамнез, общий осмотр, гинекологический осмотр в зеркалах, простая кольпоскопия (осмотр шейки под микроскопом), цитологическое исследование соскоба из шейки матки
II этап - углубленное обследование:
- расширенная кольпоскопия: осмотр под микроскопом с обработкой шейки маткираствором уксусной кислоты (VIA), раствором Люголя (VILI)
- обследование на ВПЧ
- УЗИ органов малого таза
- исследования крови на онкомаркер SCC
- прицельная биопсия подозрительных участков шейки матки с последующим выскабливанием слизистой цервикального канала и проведением гистологического исследования
- цервикогистероскопия с раздельным диагностическим выскабливанием (по показаниям)
- цистоскопия - при наличии опухоли шейки матки более 4 см, при переходе на передний свод влагалища, при наличии жалоб
- ректороманоскопия - при наличии опухоли шейки матки более 4 см, переходе на задний свод влагалища, наличии жалоб
- МРТ органов малого таза с внутривенным контрастированием - для оценки глубины инвазии опухоли, перехода на тело матки, параметрий и смежные органы
- КТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием
- КТ органов грудной клетки
- ПЭТ/ПЭТ-КТ (по показаниям - для выявления метастатического поражения лимфатических узлов и отдаленных метастазов)
- Остеосцинтиграфия (при подозрении на метастатическое поражение костей скелета)
- МРТ/КТ головного мозга с внутривенным контрастированием (при подозрении на метастатическое поражение)
Показания для направления на кольпоскопию
- Высокая степень аномалий, выявленных при цитологии.
- Постоянная низкая степень или неудовлетворительные результаты цитологии.
- Цитология показала наличие AGUS (атипичных гландулоцитов неопределенной значимости).
- Подозрительный вид шейки матки при визуальном осмотре.
Основные инструменты для кольпоскопии
- Кольпоскоп, увеличивающий в 6-16 раз
- Яркое освещение с регулируемым положением
- Фокусное расстояние длиной 250 мм для инструментов
- Растворы:
- физиологический раствор, 3-5% уксусная кислота, раствор Люголя
Клинические группы по цитологии и тактика лечения:
Цитология без особенностей - обычный осмотр, лечение и контроль по показаниям
Воспалительный тип мазка - противовоспалительное лечение, цитологический и бактериальный контроль
Воспаление, легкая дисплазия - противовоспалительное лечение, затем цитологический, бактериальный, кольпоскопический контроль:
- при отсутствии изменений: цитологическое исследование и расширенна кольпоскопия каждые 3 месяца в течение 1 года, затем ежегодно;
- при сохраняющихся изменениях - обследование на ВПЧ, биопсия шейки матки.
Умеренная дисплазия - обследование на ВПЧ, биопсия шейки матки. Лечение (по результатам биопсии), цитологический и кольпоскопический контроль через 3 месяца в течение 1 года, затем ежегодно.
Выраженная дисплазия - обследование на ВПЧ, биопсия шейки матки. Лечение (по результатам биопсии), цитологический и кольпоскопический контроль через 3 месяца в течение 1 года, затем ежегодно.
Подозрение на рак - углубленное обследование и лечение в стационаре.
Рак - направление в стационар для специального лечения.
Коническая «ножевая» биопсия
Конизация шейки матки
Лечение дисплазии
В этой ситуации показано хирургическое удаление измененных тканей с последующим гистологическим исследованием, позволяющим достоверно оценить степень и глубину поражения шейки и определить тактику ведения.
Первым этапом проводится процедура электрохирургической петлевой эксцизии (LEEP) поражения внешней части шейки матки при одноразовом пропуске при визуально определяемой зоне трансформации и последующим выскабливанием слизистой цервикального канала.
При нахождении зоны трансформации в глубине цервикального канала необходимо проводить циркулярную (конусовидную) биопсию, так как изменения слизистой в виде дисплазии в большинстве случаев определяются именно в зоне перехода плоского эпителия в цилиндрический; затем также проводят выскабливание слизистой цервикального канала. Циркулярная (конусовидная) биопсия отличается от конизации объемом удаляемых тканей - в первом случае производится удаление минимальной необходимой части шейки, необходимой для подтверждения диагноза. Обосновывается более чадящий подход тем, что дисплазию хоть и относят к предраковым состояниям, все же она является доброкачественным состоянием. Вторым этапом проводится терапия, направленная на улучшение регенерации тканей и элиминацию вируса.
Конусовидная электроэксцизия шейки матки (конизация)
Применяется при тяжелой дисплазии и внутриэпительальном раке шейки матки. Большой катет конизатора вводится точно по оси шеечного канала до внутреннего маточного зева. Вся операция выполняется одним плавным вращением конизатора. Конизация должна быть достаточно широкой и высокой. Ее следует считать радикальной, если удаленный препарат содержит всю патологически измененную ткань эктоцервиса, со здоровыми тканями в пределах 1 см и ¾ эндоцервикса. После конизации проводят выскабливание слизистой оставшейся части цервикального каналаи по показаниям - полости матки. Материал направляется на гистологическое исследование. При отсутствии опухолевых клеток в краях резекции и соскобе из оставшейся части цервикального канала объем проведенной операции считается адекватным.
Среднее время прогрессии дисплазии шейки матки
Преинвазивный рак - 5-8 лет
Микроинвазивный рак - 7-10 лет
Клинический рак - 10-15 летКлассификация Международного противоракового союза (TNM) и международной федерации акушеров и гинекологов (FIGO)
ЛЕЧЕНИЕ РАКА ШЕЙКИ МАТКИ
- у пациенток репродуктивного возраста выполняется высокая и широкая конизация шейки матки с последующим выскабливание слизистой оставшейся части цервикального канала и по показаниям - полости матки;
- при наличии сопутствующей патологии матки и отсутствии необходимости сохранения репродуктивной функции возможно выполнение экстрафасциальной экстирпация матки I типа (шейка матки удаляется по краю влагалища, лобково-пузырно-шеечная фасция не отделяется от шейки и удаляется вместе с ней).- выполняется модифицированная расширенная экстрафасциальная экстирпация матки II типа (удаление запирательных, срединной группы наружных подвздошных лимфоузлов и лимфоузлов в области бифуркации общей подвздошной артерии, а также верхней трети влагалища);
- при необходимости сохранить детородную функцию, крайне редко, но возможно выполнение широкой конизации шейки матки с экстраперитонеальной или лапароскопической тазовой лимфаденэктомией либо расширенной трахелэктомии (удаление шейки матки с параметральной клетчаткой и верхней третью влагалища, двусторонняя тазовая лимфаденэктомия и наложение анастомоза между телом матки и влагалищем).
- при наличии противопоказаний к оперативному лечению - лучевая терапия.- Расширенная экстрафасциальная экстирпация матки III типа - операция Вертгейма-Мейгса (с придатками матки, верхней третью влагалища, подвздошно-тазовой лимфаденэктомией). При наличии метастазов в тазовых лимфоузлах обязательно выполнение поясничной лимфаденэктомии. Адъювантное лечение проводится в зависимости от наличия факторов прогрессирования.
- Химиолучевая терапия по радикальной схеме.
- Первым этапом проводится неоадъювантная химиотерапия препаратами, содержащими платину, вторым этапом - операция Вертгейма-Мейгса. Адъювантное лечение проводится в зависимости от наличия факторов прогрессирования.
Особенности лечения рака шейки матки
При каждой стадии заболевания выбор тактики определяется для каждого пациента консилиумом 3 врачей: хирурга-онколога, химиотерапевта и радиолога с учетом индивидуальных особенностей, таких как возраст, общее состояние, наличие сопутствующей патологии.
При возможности радикального оперативного лечения предпочтение отдается операции. Пациенткам репродуктивного возраста я стараюсь проводить максимально органосохраняющее лечение, при необходимости проведения лучевой терапии предварительно провожу транспозицию яичников. Стоит отметить, что это лечение выполняется по очень строгим показаниям и ограниченному кругу лиц.
Пациенты, у которых диагностировано онкологическое заболевание зачастую пребывают в состоянии депрессии, они спрашивают о прогнозах их заболевания и очень волнуются перед предстоящей операцией. Большой объем оперативного вмешательства, особенно если оно проводится полостным доступом (с широким разрезом передней брюшной стенки) с установкой дренажных трубок добавляет к имеющимся психоэмоциональным переживаниям физические страдания. Все это в комплексе не ускоряет процесс реабилитации. Постоянная работа с большим количеством таких пациентов помогла мне решить задачи по улучшению качества их жизни и самочувствия: я провожу оперативное вмешательство лапароскопическимдоступом, благодаря чему активизация пациентки происходит уже в день операции.Для максимального и при этом бережного удаления окружающей органы клетчатки, несущей в себе лимфатические узлы и сосуды, я использую аппарат Thunderbeat(Olympus, Япония), сочетающий в себе ультразвуковую и биполярную энергии, за счет чего удается добиться абсолютно сухого поля. Во время операции я использую и другие электрохирургические аппараты, например, LigaSure (Covidien, Швейцария). Выбор инструмента зависит от ткани, на которой происходит работа в данный момент, и поставленных задач. Благодаря лапароскопическому доступу и использованию самого современного оборудования мне удается добиться максимальной эффективности, безопасности и быстроты выполнения вмешательства, отсутствует потребность в установке дренажей, в результате техника операции получается максимально щадящей, а реабилитация - ускоренной. Ну и конечно, весь окружающий медицинский персонал старается максимально окружить пациентов заботой и вниманием, смягчить их душевные страдания, а в случаях, когда пациенты хотят получить профессиональную психологическую помощь рядом всегда есть доктор-психотерапевт, который поможет настроиться на правильный лад. Благодаря комплексному подходу - разработке системы Fast Track хирургии - хирургии быстрого восстановления, - удается добиться снижения стрессорных реакций организма и сократить стационарный этап лечения.
Регионарные лимфатические узлы на пути метастазирования
наружные подвздошные, внутренние подвздошные, запирательные
общие подвздошные
поясничныеЭффективность раннего обнаружения рака шейки матки.
1 ФГБОУ ВО «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации
В статье представлен обзор современной литературы по скринингу рака шейки матки. Рак шейки матки является одним из заболеваний, которое необходимо подвергать обязательному популяционному скринингу, так как данная патология относится к мировой проблеме здравоохранения. Скрининг данного заболевания имеет важное клиническое значение в связи с длительностью течения (считается, что переход от преинвазивного рака до инвазивного в среднем составляет около 10 лет), хорошей диагностикой в доклинической стадии и благоприятным ответом на проводимую терапию. В настоящее время благодаря внедрению в диагностику таких методов исследования как цитология (мазок по Папаниколау, жидкостная цитология), тест на вирус папилломы человека, кольпоскопия появилась тенденция к постепенному снижению общей заболеваемости женщин в мире. Однако большую опасность на сегодняшний день представляет омоложение данной патологии (увеличилась частота встречаемости рака шейки матки у женщин до 30 лет), связанной с вирусом папилломы человека, что представляет собой социальный аспект проблемы. В статье излагаются основные моменты популяционного скрининга рака шейки матки, преимущества и недостатки каждого из методов, а также краткие рекомендации авторов по каждому из них.
![]()
1. Абакарова П.Р. Значение скрининга в диагностике предрака и рака шейки матки // Эффективная фармакотерапия. - 2014. - № 23. - С.6-9.
2. Каприн А.Д. Скрининг рака шейки матки - нерешенные проблемы // Исследования и практика в медицине. - 2015. -Т. 2. - № 1. - С. 36-41.
4. ACOG. Practice Bulletin: clinical management guidelines for obstetrician-gynecologists. Cervical cytology screening. Obstet. Gynecol. - 2013. - Vol. 102. - P. 417-427.
5. Dalstein V. Human papillomavirus testing for primary cervical cancer screening // Basel: Karger. - 2011. - Vol. 8. - P. 103-119.
7. Роговская С.И. Папилломавирусная инфекция у женщин и патология шейки матки. - М.: ГЭОТАР-Медиа, 2011. - С. 192.
8. Boon M.E. Efficacy of screening for cervical sguamous and adenocarcinoma // The Dutch experience. Cancer (Philad.). - 2012. - Vol. 59. - P. 862-866.
9. Бахлаев И.Е. Рак шейки матки в Карелии. Министерство образования и науки Российской Федерации. - Петрозаводск: Изд-во ПетрГУ, 2012. - С. 200-203.
12. Brinton L.A. Risk Faktors for Cervical Cancer by Hystology // Gynecol. Oncol. - 2012. - Vol. 51. - P. 301-306.
14. Петров Ю.А. Клинико-морфологическая характеристика и онкологические аспекты применения внутриматочных контрацептивов: автореф. дис…. канд. мед. наук. - Краснодар, 1984.
15. Петров Ю.А. Оценка онкологического риска внутриматочной контрацепции на основе цитологических исследований эндометрия // Вопросы онкологии. - 1985. - № 12. - С. 53.
16. Петров Ю.А., Ковалева Э.А. Пролиферативные изменения слизистой оболочки тела и шейки матки у женщин, применяющих внутриматочные контрацептивы // Вопросы онкологии. - 1986. - № 3. - С. 49.
17. Lоrincz A.T. Screening for cervical cancer: new alternatives and research // Salud Pulica Mex. - 2013. - Vol.45. - P. 5376-5387.
18. Walboomers J.M. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide // J. Pathol. - 2013. - Vol. 189. - P. 12.
19. Koutsky L. Epidemiology of genital human papillomavirus infection.// Am J. Med. - 2011. - Vol. 102(5A). - P. 3-8.
20. G. Y. F. Ho HPV 16 and cigarette smoking as risk factor for high-grade cervical intraepithelial dysplasia // Int. J. Cancer. - 2012. - Vol. 78. - P. 281-285.
21. Ferenczy A., Franco E.L. Prophylactic Human Papillomavirus Vaccines: Potential of Sea Change // Expert Rev Vaccines. - 2012. - Vol. 6(4). - P. 511-552.
22. Goldhaber-Fiebert J.D., Stout N.K., Salomon J.A. Cost-effectiveness of cervical cancer screening with human papillomavirus DNA testing and HPV-16, 18 vaccination // J. Natl. Cancer Inst. - 2013. - Vol. 100. - P. 308-320.
23. Quadrivalent Human Papillomavirus Vaccine Recommendations of the Advisory Committee on Immunization Practices (ACIP). - 2012. - Vol. 56. - P. 2.
24. ECDC (European Centre for Disease Prevention and Control): Guidance for the introduction of HPV Vaccines in EU Countries. Guidance Report. Stockholm, January 2011.
25. Obradovic M. Cost-effectiviness analysis of HPV-vaccination alongside cervical cancer screening programme in Slovenia / Eur. J. of Public Health. - 2012. - Vol. 20. - P. 415.
В настоящее время рак шейки матки (РШМ) относят к одному из наиболее значимых аспектов онкогинекологии. По статистике он занимает третье место в мировой структуре раковых опухолей у женщин [1]. Согласно ВОЗ каждый год в мире обнаруживается 530 тыс. новых случаев РШМ, при этом более 270 тыс. женщин умирают от данной патологии. В Российской Федерации на основании данных смертность от РШМ женщин в возрасте 30-39 лет составляет около 24 %, а женщин 40-49 лет 13,7 % [2].
В последние годы отмечается рост заболеваемости РШМ среди женщин 20-40 лет почти вдвое (41,2 %). Увеличение количества заболевших женщин с тенденцией к омоложению данного заболевания обуславливает социально-экономическую значимость данной проблемы [3].
Скрининговые программы играют немаловажную роль в своевременной диагностике, профилактике, а также правильно подобранной терапии рака шейки матки [1].
Очень важно дифференцировать раннюю диагностику и скрининг. Так, при ранней диагностике патология обнаруживается при обращении лиц с уже имеющимися жалобами и появившимися симптомами заболевания. При этом скрининг преследует за собой цель - выявление признаков РШМ в доклинической стадии, то есть еще до появления первых симптомов заболевания для последующего его лечения более щадящими методами, что позволяет избежать травматичных радикальных операций, снижающих работоспособность и приводящих к инвалидизации больных [1].
История скрининговой диагностики начинается в 1928 г., когда французский эмигрант Георгиос Папаниколау впервые заявил о возможности определения злокачественных клеток с ШМ путем цитологического метода исследования. Методика, позже получившая название ПАП-теста, была признана во всем мире только в 1940 г. 4.
После внедрения цитоскрининга в мировой статистике наблюдалось снижение заболевших раком шейки матки женщин [2, 6]. Так, к примеру, в СССР после создания централизованных цитологических лабораторий (ЦЦЛ), произошло значительное уменьшение числа заболевших и умерших женщин от РШМ. Имеются статистические данные скрининг-диагностики лечебных организаций Октябрьской железной дороги (1965-1984 гг.), согласно которым отмечалась тенденция к значительному снижению числа заболевших женщин на 74,3 %. Однако после роспуска ЦЦЛ в 90-х годах в стране обращает на себя внимание возобновление роста заболеваемости и смертности от РШМ [2, 6].
По данным А.Д. Каприна, скрининг РШМ состоит из следующих этапов: первый - популяционный, при котором на основании осмотра формируются две основные группы - «здоров» и «не здоров» (во вторую группу также входят женщины с факторами риска); второй этап - так называемый диагностический скрининг, при котором на основании результатов дополнительных методов исследования происходит деление второй группы на следующие подгруппы: фоновые процессы, предраковые состояния и рак шейки матки; третий этап - формирование групп для диспансерного наблюдения с целью дальнейшего мониторирования больных [2, 7].
Во многих работах выделяют факторы риска развития РШМ. Считается, что данные факторы не являются причиной патологии, а лишь повышают вероятность ее появления [1]. Согласно многочисленным эпидемиологическим и клиническим исследованиям было выделено множество факторов риска. К основным из которых относятся:
1) начало половой жизни в 14-18 лет;
2) ранняя первая менструация;
3) ранняя первая беременность;
4) два и более абортов;
5) множество половых партнеров и частая их смена;
6) длительные воспалительные процессы в женских половых органах;
7) вредные привычки: алкоголь и курение [2, 6-8].
Многие авторы отводят большое значение курению как фактору риска по развитию РШМ. Считается, что никотин и другие компоненты дыма, такие как оксид и диоксид углерода, антрацен, бензопирен и другие, оказывают канцерогенное влияние на организм целом, и в том числе на шейку матки, вызывая в ней злокачественную трансформацию эпителия. Имеются данные [9, 10], в которых отмечается, что в шеечной слизи активных и пассивных курильщиц, больных РШМ, были найдены составляющие сигаретного дыма.
Также к неблагоприятным факторам необходимо отнести избыток эстрогенов, так как считается, что последние в противовес прогестерону содействуют канцерогенезу [11, 12]. В ряде клинико-статистических данных приводится взаимосвязь между применением оральных контрацептивов и риском возникновения аденокарциномы, что, по мнению некоторых авторов, может быть обусловлено как гормональным влиянием препаратов, так и отсутствием барьерных методов защиты (ИППП, в том числе ВПЧ) [13]. Особый интерес вызывают исследования о выявляемости рака шейки матки у женщин с внутриматочными контрацептивами, нити которых выходят из цервикального канала и свисают на шейку матки, что может травмировать ее и приводить к раку [14]. Ю.А. Петров [15, 16] доказал безопасность внутриматочной контрацепции в плане возникновения РШМ.
В работах L.A. Brinton указано на то, что гены и наследственность в этиопатогенезе РШМ не имеют никакого существенного значения, однако могут определять тип течения заболевания [13].
Одну из самых высоких групп риска по заболеванию РШМ отводят иммунодефицитным состояниям, при которых происходит инфицирование и персистирование папилломовирусной инфекции (ПВИ) [17]. Со второй половины девятнадцатого года было выдвинуто предположение о роли ВПЧ в генезе раковой трансформации ШМ. Но лишь в конце двадцатого века с помощью современных технологий, таких как гибридизация, были получены подтверждения этиологической роли вируса в развитии РШМ [18]. Патогенез ПВИ заключается в том, что вирусы включают в свой генетический материал специфические участки, ответственные за синтез белков Е6 и Е7, последние в свою очередь, обуславливают злокачественные изменения эпителия ШМ 20.
По данным European Centre for Disease Prevention and Control считается, что у половины женщин после инфицирования вирусом папилломы человека вырабатываются антитела, которые справляются с инфекцией и ПВИ носит транзиторный характер. То есть в течение двух лет вирус полностью может элиминироваться из организма. Однако в некоторых случаях, вирус может приобрести латентное течение или быть реактивирован в форме персистирующей инфекции [22]. Существуют кофакторы, которые могут способствовать персистированию ПВИ. К ним относятся: тип и количество вируса (онкогенными являются 16 и 18 типы), сочетание с другими инфекциями, передающимися половым путем и др. [18, 22, 23]. Таким образом, для возникновения РШМ необходимо обязательное условие - персистирование ПВИ.
Общеизвестно, что скрининг РШМ включает в себя цитологический метод исследования. На сегодняшний день в силу доказанности ВПЧ в генезе РШМ в скрининг включены также ПЦР и digene HPV тест.
Вместе с тем в цервикальном скрининге РШМ «золотым стандартом» является цитологическое исследование - мазок (тест) по Папаниколау и жидкостная цитология. [3].
ПАП тест, разработанный Георгиосом Папаниколау - это традиционный мазок на стекло с влагалищной части ШМ и цервикального канала (ЦК) [8]. Преимущества данного метода заключаются в диагностике РШМ на ранней стадии и исследовании процесса в динамике, а также безопасности и отсутствии болезненности при взятии материала. Однако недостаток его заключается в том, что он не позволяет обнаружить инфильтративный раковый процесс в ШМ.
Оценка качества взятого материала является неотъемлемой частью при исследовании мазков для ПАП-теста. «Удовлетворительный мазок» - мазок, при котором определяется нужное количество плоскоклеточного эпителия, и, соответственно, «неудовлетворительный мазок» - означающий недостаточное количество исследуемых клеток. Если в мазке были выявлены патологически измененные клетки, то мазок именуется удовлетворительным [7].
По данным литературы [12], чувствительность цитологических мазков по Папаниколау находится в пределах 30-80 %, при этом специфичность колеблется от 86 до 100 %. Достаточно часто в практике встречаются ложноотрицательные результаты [5]. Полагают, что только в трети всех случаев причиной полученных ложноотрицательных тестов при цитологических исследованиях является неправильная трактовка результатов, а в остальных случаях зачастую это обусловлено неполноценным взятием материала [11]. Именно поэтому правильное получение мазка для цитологического исследования является важнейшим этапом в скрининговой диагностике РШМ. При взятии мазка с ШМ и ЦК необходимо следовать следующим правилам: мазок берется с поверхности влагалищной части ШМ, переходной зоны и цервикального канала не ранее 48 часов после полового контакта, обязательно при отсутствии менструации [1]. При этом рекомендуется использовать специализированные цитощетки, а не инструменты (зонды, ложка Фолькмана, шпатели и др.), так как использование последних часто искажает полученные результаты [5].
Также известно, что на сегодняшний день большую популярность приобрела новая технология получения цитопрепаратов - так называемая жидкостная цитология [1]. Она базируется на помещении материала не на стекло, а в специальной жидкости, в которой транспортируется. Данная методика имеет более высокую чувствительность, чем обычный мазок на стекло [3].
Имеются свидетельства и о других преимуществах жидкостной цитологии: клетки не теряют генетических, иммунохимических и структурных признаков в транспортной жидкости; мазок имеет тонкий слой, то есть в нем отсутствует кровь и воспалительный экссудат; имеется возможность одновременного использования нескольких дополнительных методов исследования (ВПЧ-тест, обнаружение онкомаркеров) [1].
Для трактовки данных, полученных в результате цитологического исследования, применяют классификацию цитологических картин по Папаниколау и по Бетесда [2].
Установлено, что вирус папилломы играет основную роль в развитии РШМ в 99 % случаев. Доказана роль ВПЧ в генезе кондилом, диспластических изменений шейки матки, а также в пре- и инвазивном раке. Объектом поражения онкогенных типов вируса является переходная зона ШМ, где располагаются активно делящиеся клетки. Процесс развития РШМ от заражения до клинической симптоматики может занимать от года до десяти лет. Именно поэтому диагностика ПВИ наряду с цитологическим методом относится к важнейшим элементам скрининга и профилактики [9].
Скрининг папилломавирусной инфекции предусматривает ПЦР диагностику и digene HPV тест. В России большую популярность приобрел Digene тест, представляющий собой метод, при котором выявляются участки ДНК ВПЧ. Данная методика получила название: «метод гибридного захвата».
При соотнесении цитологического метода скрининга и теста на ВПЧ можно заметить, что чувствительность последнего значительно выше (88-98 %), однако специфичность немного уступает цитологическому методу, что объясняется транзиторным характером ПВИ у некоторых женщин [5, 9]. При этом важно, что цитоскрининг позволяет обнаружить РШМ только в субклинической и клинической стадиях, тогда как ВПЧ-тестирование дает возможность выделить группу риска женщин с ПВИ с целью дальнейшего наблюдения, однако не исключает гипердиагностику в связи с носительством ВПЧ. Имеются данные о том, что если результат на тест по Папаниколау и тест на ВПЧ были отрицательными, то риск развития РШМ будет минимальным по сравнению с тремя последовательно повторяющимися результатами традиционного мазка [17].
Таким образом, в каждом методе скрининга отмечаются свои преимущества и недостатки, поэтому только сочетание методов увеличивают точность скрининга и позволяет на ранних стадиях диагностировать интраэпителиальную неоплазию.
Так, например, в клинике Кливреда в США имеется четкий порядок скрининговой диагностики пациенток, в котором указано, что сам по себе тест на ВПЧ не гарантирует наличие у женщины злокачественного процесса в ШМ, а должен обязательно дополниться цитологическим методом [24].
Вместе с тем одним из существенных вопросов в скрининге РШМ является возраст начала и окончания диагностики, а также интервал между исследованиями.
По рекомендациям ВОЗ женщины от 25 до 65 лет должны обязательно проходить цервикальный скрининг первые два года ежегодно, далее - раз в три года при отрицательных результатах. Однако из-за участившихся случаев предраковых изменений ШМ у женщин до 25 лет некоторые страны привлекают к обследованию женщин и раньше. Так, например, в США согласно рекомендациям ACS (американской раковой ассоциации), ACOG (американского колледжа акушеров и гинекологов), USPSTF (целевой группы профилактического сервиса) женщины должны проходить скрининг в 21 год независимо от начала половой жизни или через 3 года после первого полового контакта [7].
В данный момент в нашей стране нет государственных программ по всеобщему скринингу РШМ у женщин. Однако в 2013 г. в программу диспансеризации были включены мероприятия по диагностике патологии ШМ, в которых рекомендуется обследовать женщин от 25 до 65 лет с периодичностью в три года моложе 50 лет и в пять лет - старше 50 лет. При этом обязательному цервикальному обследованию подлежат женщины после перенесенной тотальной и субтотальной гистерэктомии, а также имеющие неблагоприятный преморбидный фон в анамнезе [3].
Что касается возраста прекращения скрининга, то ВОЗ предлагает окончание обследования женщин старше 65 лет при двух последовательных отрицательных результатах и отсутствии изменений в мазках с ШМ и ЦК за последние 10 лет [1, 7].
Таким образом, подводя итог всему вышеизложенному, можно обозначить основные цели массового обследования женщин на РШМ:
1) уменьшение статистических показателей заболеваемости и смертности от данного заболевания;
2) обязательная периодическая диагностика женщин из групп риска;
3) организация своевременных и рациональных лечебных мероприятий [4].
Правильная организация скрининговой диагностики является первым этапом профилактики РШМ. Так как в основе РШМ лежит персистирование инфекции, то и профилактика, соответственно, как и при большинстве инфекционных заболеваний, состоит в вакцинировании [8].
Разработаны два основных типа вакцин при ПВИ: квадри- и бивалентная - Гердасил и Цервивакс соответственно. Однако существует еще множество дискуссионных вопросов по поводу возраста начала вакцинопрофилактики, контингента, дозы и т.п. [24, 25].
Качественный и эффективный скрининг должен преследовать за собой следующие цели: быть бюджетным, удобным, безвредным и быстрым, а также охватывать большие популяции женщин. Помимо организационных моментов, важно стандартизировать техсредства и трактовку полученных при скрининге результатов.
Для решения поставленных задач необходимо распространение в практике сочетания метода жидкостной цитологии и теста на ВПЧ, а при возможности с дополнением иммуноцитологическими методами; обучение работников, повышение их квалификации, формирование единого банка интерпретации данных, а также внедрение дистанционного консультирования через специальное телеоборудование [8].
Московский научно-исследовательский онкологический институт им. П.А. Герцена
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
Взгляд онкогинеколога на скрининг рака шейки матки
Журнал: Российский вестник акушера-гинеколога. 2014;14(5): 39‑43
Новикова Е.Г., Каприн А.Д., Трушина О.И. Взгляд онкогинеколога на скрининг рака шейки матки. Российский вестник акушера-гинеколога. 2014;14(5):39‑43.
Novikova EG, Kaprin AD, Trushina OI. An oncogynecologist's view of cervical cancer screening. Russian Bulletin of Obstetrician-Gynecologist. 2014;14(5):39‑43. (In Russ.).Наиболее высокая заболеваемость РШМ зафиксирована в развивающихся странах (Южной и Центральной Америке, Африке, Южной и Центральной Азии), на долю которых приходится 78% случаев. При этом как в странах Северной Америки и Западной Европы, где на государственном уровне действуют массовые скрининговые программы, позволяющие диагностировать предраковые состояния и ранние формы рака, заболеваемость РШМ и смертность от него значительно снизились за последнее десятилетие (его доля составляет 4,4% от числа всех злокачественных новообразований у женщин) [1]. По прогностическим оценкам экспертов (с учетом роста населения и увеличения ожидаемой продолжительности предстоящей жизни), к 2020 г. в развивающихся странах рост заболеваемости и распространенности РШМ составит 40%, а в экономически развитых странах - 11%. И если сегодня не проводить своевременные мероприятия по профилактике и лечению РШМ, то после 2050 г. ежегодно в мире РШМ будут заболевать 1 млн женщин [2]. Таким образом, оставаясь наиболее частой онкогинекологической патологией, РШМ является серьезной проблемой здравоохранения во всем мире.
![]()
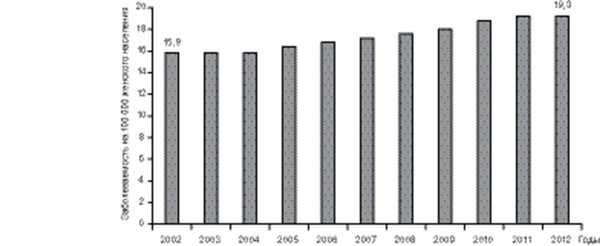
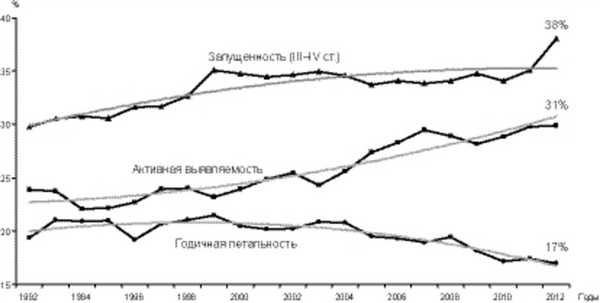
Не исключением является и наша страна, поскольку заболеваемость злокачественными опухолями шейки матки, к сожалению, не имеет тенденции к снижению. В течение последнего десятилетия отмечается постепенный рост заболеваемости РШМ: среднегодовой прирост составил 2,35%, общий - 26,94% (рис. 1). Рисунок 1. Динамика «грубых» показателей заболеваемости РШМ, 2002-2012 гг. Среди органов репродуктивной системы РШМ занимает третье место (14%) после РМЖ (54,5%) и эндометрия (19,3%). По-прежнему остаются высокий удельный вес запущенных стадий (38%) и первогодичная смертность (17,0%) [4]. Такой статистический показатель, как летальность больных в течение года с момента установления диагноза злокачественного новообразования, достоверно свидетельствует, в первую очередь, о фактической запущенности опухолевого процесса, а также качестве лечения.
Ежегодно регистрируются до 15 тыс. впервые заболевших РШМ и умирают ежегодно более 6000 пациенток [4]. Жизнь многих из этих женщин можно было бы сохранить, так как РШМ является одной из нозологических форм, удовлетворяющих всем требованиям популяционного скрининга, а именно: заболевание является проблемой здравоохранения, имеет длительный период развития от преинвазивной стадии до инвазивного рака (до 10 лет), надежно распознается в преклинической фазе, поддается эффективным методам лечения и, наконец, обладает высокоэффективным цитологическим скрининг-тестом [14].
![]()
Выявление заболевания в преклинической фазе дает возможность излечить больных «сберегающими» методами, сократить сроки их лечения, снизить случаи инвалидизации и смертности, т.е. получить и значительный экономический эффект. Однако в нашей стране показатель активного выявления РШМ, характеризующий степень охвата населения профилактическими осмотрами, остается недопустимо низким для новообразований визуальных локализаций (31%), вследствие чего по-прежнему остается высоким удельный вес запущенных стадий (III-IV) (38%) и первогодичной смертности (17%) (рис. 2). Рисунок 2. Показатели состояния онкологической помощи больным раком шейки матки, Россия, 1992-2012 гг.
Частота развития РШМ зависит, прежде всего, от различий в организации и эффективности профилактических программ, изменений демографического компонента (общая численность и распределение по полу и возрасту). Влиянием этих факторов на заболеваемость РШМ объясняются различные его значения во многих регионах страны. При этом РШМ является весьма социально значимым заболеванием, часто поражающим женщин детородного и трудоспособного возраста.
Особенно заметно интенсивное повышение заболеваемости в группе женщин моложе 30 лет, в которой эта патология занимает первое место среди всех онкогинекологических заболеваний, при этом поздние стадии регистрируются в 18% случаев, а прирост заболеваемости за последние 20 лет составил 200%. В возрастной группе женщин 25-40 лет инвазивные формы РШМ составляют около 30%, а смертность занимает 2-е место после РМЖ [12].
В настоящее время диагностической доктриной раннего выявления РШМ является широкое внедрение цитологического скрининга, с помощью которого можно диагностировать начало малигнизации клеток, т.е. распознать предраковую патологию и злокачественный процесс на самых ранних стадиях развития, когда еще нет клинических проявлений [7]. Следовательно, любой случай РШМ следует считать последствием упущенных возможностей диагностики начальных атипических изменений в эпителии шейки матки, которые хорошо поддаются лечению, а следовательно, предотвращению прогрессирования заболевания до инвазивных форм.
После классических работ Дж. Папаниколау и других авторов было доказано, что цитологический метод исследования является весьма чувствительным в диагностике CIN, карциномы in situ, микроинвазивного и скрытого инвазивного рака [16]. Теоретические обоснования цитологического скрининга РШМ были сформированы еще в 40-х годах прошлого столетия. К этому периоду стало ясно, что при распространенном РШМ эффективное лечение возможно лишь у небольшого числа больных, тогда как методы ранней диагностики и профилактики РШМ могут способствовать существенному изменению ситуации [11].
Задачами цитологического скрининга являются следующие:
- выявление предопухолевых заболеваний, ранних стадий рака, в первую очередь, рака in situ;
- изменение структуры заболеваемости РШМ за счет увеличения числа начальных стадий и уменьшения распространенных и запущенных форм;
- снижение смертности и годичной летальности, инвалидизации женского населения [13]. Решение этих задач может быть достигнуто только при преемственности смотровых кабинетов, женских консультаций и онкологических учреждений.
Хорошо известно, что эффективность цитологического скрининга РШМ оценивается на основании таких критериев, как уменьшение смертности от рака среди населения, подвергшегося скринингу, снижение заболеваемости и изменение ее структуры за счет увеличения числа ранних стадий рака и уменьшения запущенных форм [8]. Выделяют организованный (систематический) и неорганизованный (спорадический) скрининг. Наиболее эффективным и менее дорогостоящим из них является организованный, когда определяется популяция женщин скринингового возраста, устанавливается его периодичность и женщины активно приглашаются принять участие в поэтапном обследовании, в ходе которого происходит деление на подгруппы «здоров/болен» и формируются группы по степени онкологического риска для дальнейшего мониторинга и коррекции по нозологическому принципу [15].
Скрининг РШМ предусматривает три этапа:
- I этап (популяционный скрининг) - деление на подгруппы «здоров/болен» на основании визуальных осмотров;
- II этап - формирование групп диспансерного наблюдения для мониторинга (диагностический скрининг) - деление на подгруппы по степени онкологического риска на основании данных дообследования: фоновые заболевания, предрак, рак;
- III этап - формирование групп диспансерного наблюдения для мониторинга и коррекции по нозологическому принципу [19].
Скрининг обеспечивает достаточную защиту, если повторяется регулярно. В настоящее время используются три морфологические классификации цервикальных мазков: 1) по Папаниколау (Пап-тест); 2) классификация ВОЗ; 3) система Bethesda System [16]. После широкого распространения, основанного на взятии мазка с шейки матки скрининг-теста, разработанного в 1950 г. Дж. Папаниколау и получившего известность как Пап-тест, количество смертных случаев от РШМ в странах, применявших этот тест, снизилось приблизительно в 10 раз. В данном тесте выделяют 5 классов гинекологических мазков: I класс - нормальные клетки; II класс - воспалительный тип мазка; III класс - дискариоз, морфологические изменения эпителиальных клеток; IV класс - атипические клетки, подозрительные в отношении злокачественности; V класс - злокачественные изменения клеток. Классификация ВОЗ (Cervical intraepithelial neoplasia) включает в себя CIN I ( легкая дисплазия), CIN II (умеренная дисплазия), CIN III (тяжелая дисплазия) [9].
В связи с появлением новых знаний о роли вируса папилломы человека (ВПЧ) в патогенезе РШМ и с целью более эффективной передачи информации из лаборатории врачам, повышения воспроизводимости результатов цитологической диагностики и обеспечения стандартизации лечения выявленных нарушений в 1988 г. была разработана Терминологическая система Бетесда (Terminology Bethesda System, TBS), которая включает следующие показатели: ASC - атипичные клетки плоского эпителия, ASC-US - атипичные клетки плоского эпителия неясного значения, ASC-H - атипичные клетки плоского эпителия, не позволяющие исключить HSIL, CIN I, II, III; CIS - рак in situ, HSIL - высокая степень плоскоклеточного интраэпителиального поражения, LSIL - низкая степень плоскоклеточного интраэпителиального поражения [21], TBS соответствует биологии цервикального канцерогенеза, и в настоящее время внедрена в большинстве стран мира, в том числе в России.
В настоящее время диагностической доктриной раннего выявления РШМ является широкий охват цитологическим скринингом женского населения (75-90%). Результатом, подтверждающим эффективность такого режима скрининга, является стабилизация смертности [14]. За последние 30 лет смертность от РШМ более чем в 2 раза снизилась в Австрии, США, Англии, Нидерландах, Канаде именно за счет реализации государственных скрининговых программ. В России смертность не меняется с 2000 г. В 2012 г. стандартизированный показатель смертности составил 5,12 на 100 тыс. женского населения [4]. Следует отметить, что из-за длительного периода развития РШМ частота проведения раундов цитологического скрининга оказывает значительно меньшее влияние на его эффективность по сравнению с широтой охвата. Информативность цитологического метода при интраэпителиальных дисплазиях и ранних формах РШМ варьирует от 50 до 87%, поэтому важность обследования с использованием других методов очевидна [6]. Подтверждение этиологической роли ВПЧ в развитии РШМ привело к тому, что тестирование на ВПЧ ввиду его гораздо более высокой чувствительности по сравнению с цитологическим исследованием для выявления CIN высокой степени стало рассматриваться как важнейший элемент скрининга этого заболевания [5]. Международными экспертными организациями были сформулированы следующие рекомендации по применению ВПЧ-теста в скрининге РШМ: в первичном скрининге у женщин старше 30 лет в сочетании с цитологическим исследованием или в качестве самостоятельного теста; при ведении пациенток с неопределенными результатами цитологического исследования; для мониторинга терапии цервикальных поражений высокой степени (CIN II-III) [19].
Особая роль отводится периодичности, возрасту начала и окончания цервикального скрининга. До сих пор остается открытым вопрос о периодичности проведения скрининга в связи с тем, что в разных странах приняты различные межскрининговые интервалы. По расчетам специалистов, эффективность скрининга РШМ при интервалах между обследованиями один раз в 3 года лишь незначительно уступает эффективности ежегодного скрининга - не более 2% [3]. Таким образом, оптимальным межскрининговым интервалом считают 3-5 лет при охвате населения в пределах 75-80%. В странах с ограниченными ресурсами ВОЗ рекомендует организовывать хотя бы одноразовый скрининг всех женщин в возрасте 35-40 лет, а при наличии бо`льших возможностей частоту скрининга можно увеличить до одного раза в 10 или в 5 лет для женщин 35-55 лет, хотя ясно, что этого явно недостаточно для полноценного скрининга. В идеале ВОЗ рекомендует подвергать скринингу женщин в возрасте 25-65 лет ежегодно первые 2 года, а затем при отрицательных результатах - каждые 3 года [17].
В США впервые женщин привлекают к обследованию в возрасте 21 года, но не ранее. Большинство стран Европы (Великобритания, Бельгия, Франция, Италия и др.) приняли прагматичное решение начинать скрининг с 25 лет. В некоторых странах Европы (Финляндия, Нидерланды, Эстония, Литва) на обследование женщин впервые приглашают в возрасте 30 лет [20].
В нашей стране цитологический метод исследования при массовых профилактических гинекологических осмотрах стали применять с 1964 г., а с 1977 г. на основании приказа Минздрава СССР №1253 от 30.12. 76 была создана сеть централизованных цитологических лабораторий (ЦЦЛ). Однако за последние десятилетия мы наблюдаем прирост заболеваемости РШМ в России: с 12,4 на 100 тыс. населения до 19,2 на 100 тыс. населения в 2012 г. Возрос и удельный вес больных с запущенными стадиями заболевания РШМ с 24,8 на 100 тыс. населения в 1982 г. до 42,2 на 100 тыс. в 2012 г. [4], что является недопустимо высоким при диагностике новообразований локализаций, доступных визуальному исследованию. Летальность в течение первого года с момента установления диагноза в 2012 г. составила 20,9%, т.е. от РШМ в течение первого года умирает практически каждая пятая заболевшая женщина.
Такие удручающие показатели объясняются тем, что до 90-х годов прошлого века в России отмечалось постепенное снижение заболеваемости РШМ за счет регулярного проведения гинекологических осмотров женского населения с обязательным цитологическим исследованием мазков с шейки матки. Однако после 1990 г. программа скрининга РШМ по социальным и экономическим причинам была свернута, что сразу отразилось на росте заболеваемости и годичной летальности, значительном увеличении числа женщин с запущенными стадиями.
Более того, согласно Приказу МЗ РФ №808н от 02.10.09 «Об утверждении Порядка оказания акушерско-гинекологической помощи» гл. VI пункт 49 при проведении профилактических осмотров необходимо проводить цитологический скрининг на наличие атипических клеток шейки матки; при этом не указываются возраст женщин, с которого необходимо начинать цитологический скрининг и периодичность его выполнения. Таким образом, неуклонный рост числа женщин со злокачественными новообразованиями шейки матки и тенденция к омоложению болезни, несомненно, характеризуют РШМ как важную медицинскую и социальную проблему.
Высокие заболеваемость и смертность от этого грозного заболевания свидетельствуют о необходимости широкого внедрения цервикального скрининга по всей территории России. Остаются актуальными проблемы стандартизации скрининговых программ по раннему выявлению онкопатологии шейки матки как в классическом варианте, так и с использованием новых технологий, которые, однако, имеют определенные ограничения и требуют привлечения значительных ресурсов. Если сегодня не проводить активный скрининг РШМ, заболеваемость и смертность от РШМ никогда не уменьшатся.
Читайте также:
- Влияние аборта на течение рака молочной железы
- Выявление противовирусных антител ( AT ) в сыворотке крови. РТГА. РСК. РИФ. Иммуносорбционные методы выявления противовирусных антител.
- Рентгенография височной кости. Функциональное исследование уха
- Признаки опухоли, гемангиомы на КТ глаза и орбиты
- Поддержка дыхания при БАС. Нейронопатия. Ишемическая компрессионная нейропатия.