Поддержка дыхания при БАС. Нейронопатия. Ишемическая компрессионная нейропатия.
Добавил пользователь Алексей Ф. Обновлено: 01.02.2026
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского, Москва
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», Москва, Россия
Центральная клиническая больница РАН, Москва
ГБУЗ МО "Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского", Москва
Диабетическая асимметричная проксимальная нейропатия
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(1): 59‑62
Цель исследования. Изучение распространенности, особенностей клинических проявлений, диагностики и лечения диабетической асимметричной проксимальной нейропатии (ДАПН). Материал и методы. Обследовали 445 пациентов с сахарным диабетом (СД), 257 женщин и 188 мужчин (средний возраст — 47,6±0,5 года); 163 из них страдали СД 1-го типа, 282 — СД 2-го типа. Результаты и заключение. Дистальная симметричная сенсомоторная полинейропатия была выявлена у 62% пациентов, вегетативная нейропатия — у 25,6%, краниальные и соматические мононейропатии — у 28,5%, ДАПН — у 7,9%. ДАПН наблюдалась чаще у пациентов с СД 2-го типа (9,6%) при неудовлетворительном контроле гликемии и длительности СД более 5 лет. Ведущими признаками ДАПН являются боль и парестезии в зоне иннервации нескольких корешков и нервов, амиотрофии, выходящие за пределы определенного миотома. Показана эффективность двойной терапии нейропатической боли (прегабалин и дулоксетин) и препаратов витаминов группы В. Обсуждается также роль в терапии глюкокортикоидов и нормального человеческого иммуноглобулина.
Распространенность сахарного диабета (СД) в популяции постоянно возрастает, и частота поражений нервной системы следует за этим ростом [1—3]. Диабетическая нейропатия (ДН) — одно из наиболее частых осложнений СД, которое может вовлекать любой отдел периферической нервной системы и проявляться изолированно или в комплексе с другими осложнениями. Частота Д.Н. повышается с увеличением длительности и тяжести течения СД 1-го и 2-го типов. К факторам риска ДН относят возраст, продолжительность СД, недостаточный контроль гликемии, уровень холестерина/триглицеридов, артериальную гипертензию, микрососудистые нарушения и курение [4, 5].
Гистологически ДН характеризуется утратой как больших, так и мелких миелинизированных и немиелинизированных нервных волокон, что сопровождается различной степенью демиелинизации, пролиферации соединительной ткани, утолщением базальной мембраны капилляров и их облитерацией. Механизмы, приводящие к развитию ДН, обусловлены гипергликемией и другими метаболическими нарушениями, сопровождающими абсолютную (при СД 1-го типа) или относительную (при СД 2-го типа) инсулиновую недостаточность. В результате развиваются активация полиолового пути метаболизма глюкозы, гликирование белков, снижение активности внутриклеточных механизмов антиоксидантной защиты, ишемия и гипоксия тканей, нарушения продукции ростовых факторов нервов, иммунные нарушения.
Среди клинических форм ДН наиболее часто обнаруживается дистальная симметричная полинейропатия (ДПНП), в то время как другие формы (мононейропатии краниальных, межреберных и длинных нервов конечностей, плексо- и радикулопатии, асимметричная проксимальная нейропатия) считаются редкими [6—8].
Цель настоящего исследования — изучение распространенности, особенностей клинической картины, диагностики и лечения диабетической асимметричной проксимальной нейропатии (ДАПН).
ДАПН, называемая также синдромом Брунса—Гарланда, получила название по имени описавших ее врачей: L. Bruns в 1890 г. впервые описал пациентов с СД и асимметричной слабостью и болями в проксимальных отделах конечностей, а H. Garland в 1955 г. для обозначения таких нарушений использовал термин «диабетическая амиотрофия». В настоящее время этот термин не применяется, поскольку подразумевает первичность страдания мышц, в то время как их атрофия обусловлена неврологическим расстройством — мультифокальным поражением нервных корешков, сплетений, периферических нервов, а иногда в процесс вовлекается и спинной мозг [9]. Нам кажется неправомерным также использование терминов «диабетическая радикулопатия», «диабетическая плексопатия», «диабетическая амиотрофия», поскольку в основе страдания лежит демиелинизация корешков и лишь вторичное страдание формирующихся из них сплетений и нервов. Поражение носит мультифокальный характер как в случаях локальной компрессии определенного спинномозгового корешка, так и при отсутствии компримирующего фактора.
Материал и методы
Результаты и обсуждение
ДПНП была выявлена у 62% пациентов, вегетативная нейропатия — у 25,6%, краниальные и соматические мононейропатии — у 28,5%, ДАПН — у 7,9%.
Таблица 1. Распределение больных СД 1-го типа по формам ДН и длительности заболевания Примечание. Здесь и в табл. 2 число больных превышает указанное выше, что связано с наличием сочетанных поражений.
В табл. 2 приведены соответствующие данные, касающиеся пациентов с СД 2-го типа. У этих больных ДПНП также была наиболее часто выявляемой формой ДН — у ¾ обследованных, т. е. почти в 2 раза чаще, чем при СД 1-го типа. ДАПН выявлялась также в 2 раза чаще — у 9,6% пациентов.
Таблица 2. Распределение больных с СД 2-го типа по формам ДН и длительности заболевания
Обследование 35 пациентов (8 — при СД 1-го типа и 27 — при СД 2-го типа) с ДАПН позволило выявить у всех из них проявления ДПНП. Лишь у 1 пациента боль и амиотрофии локализовались в области плечевого, у остальных 34 — тазового пояса. При осмотре у них выявлялись односторонняя слабость мышц сгибателей (подвздошно-поясничная мышца и др.) и разгибателей (большая ягодичная мышца), приводящих мышц бедра, сгибателей и разгибателей коленного сустава, реже страдали мышцы голени. У 12 пациентов было отмечено менее выраженное вовлечение мышц противоположной стороны. При отсроченном начале (спустя 2—4 нед) терапии выявлялась выраженная атрофия мышц ягодичной области и бедра. При осмотре обнаруживалось поражение мышц различных корешков или сплетений, слабость и атрофия обязательно вовлекали мышцы, иннервируемые не одним нервом или спинномозговым корешком. Так, при преимущественном поражении четырехглавой мышцы бедра, иннервируемой корешками L3—L4, при осмотре выявляли слабость большой ягодичной мышцы, иннервируемой корешками L5—S1—S2, а при «паралитическом ишиасе» с нарушением тыльного сгибания стопы (слабость перонеальных мышц, иннервируемых малоберцовым нервом, корешками L4—S1) обнаруживали слабость мышц задних групп бедра и голени, иннервируемых волокнами тех же корешков, но проходящих в составе большеберцового нерва или коротких ветвей седалищного нерва. Асимметричное выпадение или значительное снижение коленного и/или ахиллова рефлексов были постоянной находкой. Чувствительный дефицит, как правило, ограничивался проявлениями ДПНП.
ЭНМГ показала наличие признаков радикулярной демиелинизации L4—L5—S1 со снижением СРВ до 34—35 м/с, причем у ½ пациентов подобные изменения были обнаружены с обеих сторон. У большинства больных имелся блок Н-рефлекса с икроножной мышцы.
При МРТ пояснично-крестцового отдела позвоночника выявлялись признаки спондилеза, спондилоартроза, протрузии межпозвонковых дисков, однако фораминальных грыж, наличие которых могло бы послужить причиной острого развития выраженного болевого синдрома, выявлено не было. Отметим также, что наличие локального одностороннего сужения межпозвонкового канала не могло объяснить большую распространенность как боли, парестезий, так и амиотрофий, вовлекающих несколько соседних сегментов. У части пациентов изменения на МРТ не соответствовали локализации боли и амиотрофий.
Основой терапии у всех пациентов было достижение устойчивой нормогликемии. На начальном этапе проводили оптимизацию сахароснижающей терапии: изменение доз и режима приема пероральных сахароснижающих препаратов, у ½ больных — переход на введение инсулина. В качестве обезболивающего лечения использовали прегабалин в дозе 300—600 мг или дулоксетин 60—120 мг/сут, у части пациентов при недостаточном эффекте монотерапии прегабалином в течение 1 нед переходили на двойную терапию с включением дулоксетина. Габапентин и амитриптилин использовали как препараты второй линии. При отсутствии значимых признаков кардиальной вегетативной нейропатии в первые 3—5 сут для усиления аналгезии использовали лидокаин. Эффективным оказалось включение в комплекс лечения кокарнита, в состав которого входят кокарбоксилаза, цианокобаламин, никотинамид и трифосаденина динатрия тригидрат (АТФ). Препарат назначали с первого дня госпитализации по 2,0 мл внутримышечно ежедневно в течение 9 дней, затем по 2,0 мл 2 раза в 1 нед на срок до 2—4 нед. Снижение выраженности болевого синдрома отмечали к 3—5-му дням лечения, при этом оценка выраженности боли по визуально-аналоговой шкале (ВАШ) снижалась с исходных 7—10 до 4—6 баллов. После существенного регресса боли к 7—10-м суткам к лечению добавляли физиотерапию (лазер-, магнитотерапия, синусоидальные модулированные токи, ультрафонофорез гидрокортизона). Для восстановления двигательных функций применяли лечебную физкультуру, роботизированную механотерапию, по показаниям — антихолинэстеразные средства. У большинства пациентов удалось достичь положительного эффекта, при этом непреложным условием было достижение стойкой нормогликемии.
Считается, что ДАПН является редким осложнением СД и встречается менее чем у 1% больных С.Д. Однако в нашем исследовании ДАПН наблюдалась у 7,9% больных С.Д. Причем существенно чаще — у пациентов с СД 2-го типа (9,6%); была отмечена также зависимость частоты возникновения ДАПН от продолжительности заболевания.
ДАПН чаще возникает у пациентов с СД 2-го типа, имеет подострое течение, часто вовлекает пояснично-крестцовую область и проявляется резкими болями, амиотрофиями и другими симптомами нейропатии проксимальных отделов нижних конечностей. При неэффективности терапии происходит хронизация процесса с прогрессированием двигательных нарушений с двусторонним поражением проксимальных отделов конечностей, расстройством чувствительных и вегетативных функций [10].
Важное значение для диагностики ДН имеет ЭНМГ. Исследование скорости проведения импульса у больных с ДАПН позволило выявить паттерн аксонального поражения со снижением амплитуд и замедлением проведения по моторным и сенсорным волокнам. Нейропатические изменения были мультифокальны и асимметричны, выявлялись в нескольких миотомах, в том числе в клинически неповрежденных мышцах [11—13].
У большинства пациентов в начале болезни диагностировалась вертеброгенная люмбалгия, и только стойкое течение и неэффективность общепринятой терапии приводили к пересмотру диагноза, причем наличие изменений при МРТ позвоночника не противоречило диагнозу ДАПН. Отличия ДАПН от вертеброгенных болевых синдромов: боль наблюдается в покое и при движении, продолжается ночью, отсутствует анталгическая поза, боль и амиотрофии не укладываются в зону иннервации отдельного корешка или нерва.
В настоящее время локально возникающие на шейном, грудном или поясничном уровнях нейропатии с вовлечением корешков и сплетений (англ.: radiculoplexus neuropathy — радикулоплексонейропатия) рассматриваются как иммуномодулируемые заболевания, при которых микроангиопатия приводит к ишемическому поражению корешков, сплетений и проксимальных отделов длинных нервов конечностей, причем ДАПН рассматривается лишь как проявление радикулоплексонейропатии у больных СД [14—16]. Такой подход диктует использование в терапии глюкокортикоидов, внутривенного введения иммуноглобулина или плазмаферез, причем эффективность метилпреднизолона доказана в двойном слепом рандомизированном контролируемом исследовании [17]. Наш опыт показал, что предпочтение следует отдавать терапии нормальным человеческим иммуноглобулином.
Обязательным условием успешной терапии ДАПН является также жесткий контроль гликемии. Отмечена неэффективность нестероидных противовоспалительных средств. Учитывая характер побочных эффектов, целесообразной стартовой терапией при выраженном болевом синдроме была двойная терапия — прегабалином и дулоксетином, в первые 3—5 сут было необходимо назначать трамадол и/или лидокаин. Терапия витаминами группы В сокращала болевой период и предупреждала развитие амиотрофий (в нашем исследовании применялся кокарнит по 2,0 мл внутримышечно в течение 1-й недели ежедневно, а затем — через день).
Невропатия (нейропатия) - симптомы и лечение
Что такое невропатия (нейропатия)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Алексеевича Григория Васильевича, невролога со стажем в 16 лет.
Над статьей доктора Алексеевича Григория Васильевича работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Невропатия, или нейропатия (Neuropathy) — повреждение одного или нескольких нервов периферической нервной системы. К ней относятся черепные и спинальные нервы, а также нервы и сплетения вегетативной нервной системы [2] [3] . Невропатия проявляется нарушением чувствительности, болью в поражённом участке, судорогами, мышечной слабостью и затруднением движений. Выделяют две основные группы невропатий:
- мононевропатия — повреждение отдельного нерва, например срединного.
- полинейропатия — множественные повреждения нервов при диабетической полинейропатии, диффузной нейропатии, полирадикулопатии, плексопатии.
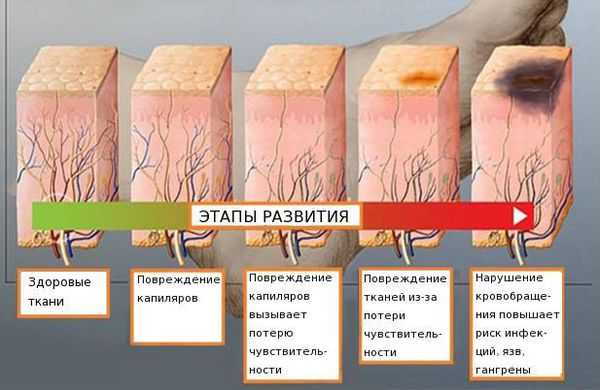
Распространённость нейропатии среди населения составляет 2-7 %. Риск развития заболевания увеличивается с возрастом: в 40 лет патология встречается в 15 % случаев [4] [5] [6] .
Повреждение периферических нервов может вызывать множество причин. Даже после комплексного обследования выявить их удаётся не всегда. К основным факторам, приводящим к заболеванию, относят:
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы невропатии
Несмотря на то, что нейропатию вызывают различные причины, основные симптомы заболевания схожи [9] [14] [15] [16] [17] :
- Двигательные нарушения, слабость мышц. Пациент с трудом выполняет действия, связанные с мелкой моторикой, например застёгивание пуговиц. Возникают проблемы с ходьбой — больной может упасть из-за слабости мышц стопы.
- Сенсорные нарушения — онемение, повышенная тактильная чувствительность, резкая стреляющая боль, подобная удару электрическим током.
- Снижение и выпадение сухожильных рефлексов. Появляются трудности при выполнении повседневных действий, таких как надевание одежды, перемещение предметов.
- Расстройства сердечно-сосудистой системы. Выражается в нестабильности артериального давления и его снижении при резком вставании, проявляется головокружением и потемнением в глазах .
- Расстройства желудочно-кишечного тракта — запоры и кишечная непроходимость, вызванные ухудшением тонуса мышц кишечника.
- Боли в кистях и стопах.
- Нарушение равновесия и координации движений.
- Повышенная потливость.
- Задержка мочеиспускания.
- Сексуальная дисфункция.
При нейропатии могут поражаться не только нервы конечностей, но и черепно-мозговые нервы:
- невропатия зрительного нерва (оптическая нейропатия) приводит к нечёткости, затуманенности зрения, нарушению цветового восприятия, слепоте;
- поражение глазодвигательного нерва проявляется опущением верхнего века и параличом глазных мышц;
- патология отводящего нерва вызывает сходящееся косоглазие, опущение верхнего века, двоение в глазах;
- лицевого нерва — паралич мимических мышц;
- преддверно-улиткового (слухового нерва) — потерю слуха;
- языкоглоточного нерва — нарушение подвижности языка;
- гортанного нерва — дыхательную недостаточность [15] .
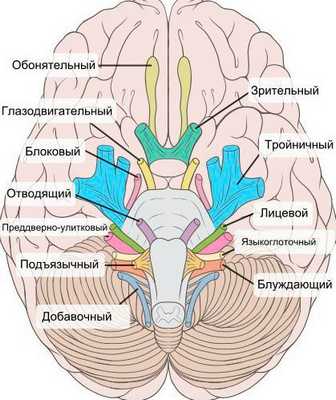
На начальных стадиях двигательные расстройства могут не проявляться. Но в дальнейшем нейропатия значительно ограничивает физическую активность пациента [5] [7] [16] [17] .
Для повреждения периферической нервной системы характерны основные синдромы:
- Поражение переднего корешка спинного мозга — приводит к ослаблению или параличу мышц. Возможны судороги и подёргивания.
- Поражение заднего корешка спинного мозга — проявляется повышенной тактильной чувствительностью, жжением, нарушением спинальных рефлексов, болью в области поражения.
- Поражение межпозвоночного узла — вызывает жжение, покалывание, снижение болевого порога, интенсивные жгучие боли, обострение герпесвирусной инфекции.
- Поражение спинального нерва — приводит к расстройствам чувствительности и двигательным нарушениям.
- Поражение сплетения периферических нервов — вызывает боль, но менее интенсивную, чем при повреждении корешков [16] .
Патогенез невропатии
К нейропатии могут приводить нарушения обмена веществ и иммунной системы, генетические факторы, инфекционное и токсическое воздействие [1] .
Развитие заболевания при обменных нарушениях, например при сахарном диабете, вызвано чрезмерным накоплением глюкозы в клетке. Гипергликемия приводит к отложению в нервных клетках продукта обмена — сорбитола. Избыток сорбитола нарушает функции клеток периферических нервов. При этом уменьшается выработка мио-инозитола — соединения, влияющего на передачу сигналов в мозге и защиту нервных клеток от повреждения. Всё это приводит к ухудшению регенеративных способностей нервной ткани и снижению её проводимости [9] .
В развитии нейропатии важная роль принадлежит митохондриям (органеллам, обеспечивающих клетку энергией) . Они повреждаются при гипергликемии и приёме противоопухолевых препаратов: паклитаксела, бортезомиба, оксалиплатина. Эти лекарства влияют и на другие внутриклеточные структуры (например микротрубочки, поддерживающие форму клетки ), негативно воздействуют на клеточные процессы и в результате активируют запрограммированную гибель нейронов [9] [15] [18] . Схожие нарушения возникают и у ВИЧ-инфицированных пациентов, принимающих антиретровирусные препараты [9] [15] .
Классификация и стадии развития невропатии
Попытки систематизировать различные виды нейропатии предпринимались многократно как отечественными, так и зарубежными авторами. Но ни одна из классификаций не удовлетворяет всем потребностям клиницистов. Это связано с тем, что к развитию заболевания приводит множество сложных и до конца не изученных факторов [16] .
По одной из классификаций, нейропатии разделяют на следующие группы: [19]
I. Мононевропатии (поражение одного нерва).
- Травматические мононевропатии — возникают при травмах, ранениях, электротравмах, химических повреждениях.
- Туннельные синдромы — это ущемление нерва при длительном сдавлении и травматизации в костно-мышечных каналах. К ним относятся: синдром карпального канала (сдавление нерва в области запястья), пронаторный синдром (поражение нерва в плече), синдром кубитального канала (в локте), синдром тарзального канала (сдавление большеберцового нерва), синдром ложа Гийона (сдавление глубокой ветви локтевого нерва) и др.
II. Множественные нейропатии (поражение нескольких отдельных нервов).
- Моторная мультифокальная нейропатия с блоками проведения — аутоиммунное заболевание, проявляющееся слабостью мышц стоп и кистей.
- Моторно-сенсорная невропатия с блоками проведения — вызывает поражение не только моторных, но и сенсорных волокон.
- Множественная невропатия при васкулитах.
III. Полиневропатии (множественные поражения нервной ткани).
1. Наследственные полиневропатии: Шарко — Мари — Тута, синдром Руси — Леви, Дежерина — Сотта и др.
2. Приобретённые полиневропатии.
2.1. Аутоиммунные полиневропатии — возникают при сбое в работе иммунной системы (синдром Гийена — Барре, синдром Миллера — Фишера, хроническая воспалительная демиелинизирующая полинейропатия, парапротеинемические полиневропатии, паранеопластические полинейропатии).
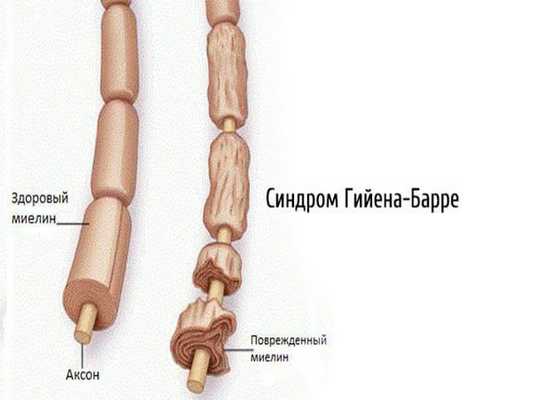
2.2. Метаболические полинейропатии — диабетическая, уремическая, печёночная, при системных заболеваниях. Наиболее часто встречается диабетическая нейропатия.
2.2 Вызванные дефицитом витаминов В1, В6, В12.
2.3 Токсические полинейропатии — вызванная алкоголем, лекарствами, отравлением тяжёлыми металлами. Препараты, способные приводить к нейропатии:
- — крайне нейротоксичное средство. Развитие острой нейропатии возникает в 90 % случаев, а хронической — в 50 %. Приём оксалиплатина приводит к жжению, покалыванию, онемению рук, ног и области вокруг рта.
- Таксен (Палитаксел,Доцетаксел) — вызывает нарушение чувствительности, слабость и боль в мышцах, возможны редкие вегетативные симптомы.
- Препараты на основе алкалоидов барвинка (Винбластин, Винорелбин, Виндезин, Винкристин) — нарушают функции мочевого пузыря и кишечника, влияют на чувствительность в руках и ногах, ухудшают мелкую моторику, приводят к мышечной слабости и резкому снижению артериального давления.
- Бортезомиб — нарушает чувствительность, приводит к боли и вегетативным симптомам.
- Иммуномодулирующие препараты (Талидомид) — провоцирует сенсорные нарушения, преимущественно в нижних конечностях, лёгкие двигательные, желудочно-кишечные и сердечно-сосудистые расстройства [15][16][18] .
2.4 Инфекционно-токсические — после гриппа, кори, дифтерии, мононуклеоза, поствакцинальные, при ВИЧ-инфекции, лепре.
IV. Поражения сплетений (шейного, верхнего плечевого, нижнего плечевого, пояснично-крестцового).
V. Вертеброгенные поражения нервных корешков (радикулиты).
Несмотря на многообразие причин, вызывающих полинейропатии, по участкам поражения их можно разделить на два вида:
- Аксональные — вовлечены нервы с наиболее длинными отростками (аксонами), к ним относится большинство токсических полинейропатий, аксональный тип наследственной моторно-сенсорной полинейропатии. Характеризуются мышечными атрофиями.
- Демиелинизирующие — вызваны разрушением миелиновой оболочки, окружающей отростки нервных клеток. Проявляются выпадением сухожильных рефлексов, развитием мышечной слабости без мышечных атрофий [19] .
Осложнения невропатии
Зачастую нейропатия уже является осложнением какого-либо заболевания, например сахарного диабета. У некоторых пациентов, страдающих диабетом, может развиваться диабетическая амиотрофия — асимметричное поражение проксимальных (близких к туловищу) отделов ног с развитием болей и слабости в мышцах [16] [17] [19] .
Если лечение не начато вовремя, нейропатия стремительно прогрессирует. В результате снижается тонус мускулатуры, наступает атрофия мышц и инвалидность. На фоне мышечной слабости случаются падения и травмы. Пациенты утрачивают способность ходить и обслуживать себя. Иногда последствиями полинейропатии становятся полный паралич конечностей или дыхательная недостаточность.
Диагностика невропатии
Неврологи используют различные шкалы для оценки тяжести нейропатии. Универсального опросника, соответствующего всем потребностям клиницистов, не существует. Это связано с различным прогнозом, проявлениями и причинами нейропатии [21] .
Во время обследования оценивают проводимость нерва, учитывая временную динамику [17] . Для диагностики применяют следующие методы:
- Электромиография (ЭМГ) — регистрация электрической активности в мышце при её сокращении. Позволяет определить характер двигательных расстройств, уточняет степень разрушения нерва и выявляет заболевание до появления симптомов. ЭМГ позволяет провести дифференциальную диагностику невропатии с миастенией, миотонией, миоплегией, полимиозитом [16][17] .
- Электронейромиография (ЭНМГ) — оценивает прохождение импульса по нервному волокну. ЭНМГ поможет не только выявить расположение поражённых участков, но и определить момент начала патологического процесса [17] .
- УЗИ — распространённый метод визуализации периферических нервов. Ультразвук поможет выявить нарушения, которые незаметны при электродиагностике. Оценивается изменение диаметра нерва, непрерывность и ухудшение звукопроводимости. УЗИ позволяет обнаружить опухоли периферических нервов, травматические невромы, разрывы, воспаление, демиелинизирующие процессы.
- МРТ — визуализирует нервы и структуру мягких тканей, выявляет злокачественные опухоли и предоставляет информацию о мышечной атрофии и поражении нервов. МРТ выявляет повреждение нерва в областях, которые трудно исследовать при помощи электродиагностики или ультразвука.
Согласно статистике, УЗИ выявляет мононевропатии или плечевые плексопатии чаще, чем МРТ [20] .
Лечение невропатии
Выбор методов лечения нейропатии зависит от вызвавших её причин:
- Метаболические нейропатии, в частности диабетическую нейропатию лечат препаратами альфа-липоевой кислоты. Перспективный препарат для терапии диабетических невропатий — канитин. Однако основное лечение при сахарном диабете заключается в контроле уровня глюкозы [6] .
- При комплексной терапии применяют препараты с витаминами. Высокие дозы принимают не более месяца.
- При возникновении болевого синдрома используют противосудорожные препараты, трициклические антидепрессанты. Их противоболевое действие связано с блокированием болевого импульса в головном мозге и устранением болевой «памяти». К физическим методам воздействия относят магнитотерапию, лазеротерапию, электрофорез с прозерином, элетростимуляцию ослабленных мышц, иглотерапию [17][16] .
- Для лечения хронической демиелинизирующей полирадикулониейропатии применяют иммуносупрессивные препараты. Иногда при терапии на первый план выходит уменьшение боли.
- При синдроме Гийена — Барре необходима госпитализация в многопрофильную больницу с отделением реанимации и интенсивной терапии, в тяжёлых случаях — вентиляция лёгких, мониторинг ЭКГ и артериального давления, введение гепарина для предупреждения тромбоза глубоких вен и лёгочной эмболии. При выраженных болях вводят опиоидные анальгетики, антиконвульсанты, проводят лечебную физкультуру, организуют рациональное (зондовое) питание. Патогенетическая терапия включает использование плазмафереза, введение иммуноглобулинов, кортикостероидную терапию. При синдроме Гийена — Барре иммунотерапия ускоряет выздоровление, но не влияет на окончательный прогноз [16][17] .
- Для достижения долгосрочной ремиссии при системном васкулите, не связанном с вирусами, применяют кортикостероиды и циклофосфамид. Продолжительность терапии кортикостероидами может быть более двух лет [1][17] .
- Лечение нейропатий, вызванных приёмом противоопухолевых препаратов, является сложной задачей. Общепризнанной профилактической или лечебной стратегии до сих пор не существует [15][18] .
Прогноз. Профилактика
Невропатия зачастую развивается достаточно медленно. Пациенты сообщают о неврологических проявлениях врачу спустя годы после её формирования. О симптомах симметричной полинейропатии лечащий врач узнаёт в среднем через 39 месяцев. В таком случае лечение может быть запоздалым, а повреждение нерва необратимым [5] .
При синдроме Гийена — Барре прогноз ухудшают пожилой возраст, быстрое развитие заболевания, потеря аксонов. Восстановление может занять несколько месяцев и быть неполным. Приблизительно у 15 % пациентов с синдромом Гийена — Барре сохраняются остаточные параличи [16] [17] .
Васкулитная нейропатия развивается с разной скоростью. Заболевание может протекать как в прогрессирующей хронической форме, так и в рецидивирующей с длительными периодами ремиссии.
Прогноз при сахарном диабете зависит от поддержания оптимального уровня сахара в крови. Приверженность лечению позволяют замедлить развитие нейропатии.
Прогноз после травмы периферической нервной системы плохой. При повреждении эндоневральной трубки (внешнего слоя соединительной ткани, окружающей периферические нервы) пациенты редко восстанавливаются полностью [17] .
После терапии противоопухолевыми средствами нейропатия может сохраняться несколько лет [18] . Обратимость патологии остаётся под вопросом, особенно при приёме противораковых препаратов на основе платины и таксанов. Для уменьшения тяжести симптомов онкологи могут снизить дозировку или прекратить применение нейротоксических противоопухолевых препаратов [15] [18] .
Не все нейропатии можно предотвратить. Однако часть нарушений возможно избежать или отсрочить их появление на несколько лет. Это в первую очередь относится к эндокринным нейропатиям, например диабетической, и нейропатии, вызванной дефицитом витаминов в организме.
Поддержка дыхания при БАС. Нейронопатия. Ишемическая компрессионная нейропатия.
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Первый Московский государственный медицинский университет им. И.М. Сеченова, Москва
ФГБУ «Первый МГМУ им. И.М. Сеченова», клиника нервных болезней, ул. Россолимо, 11, Москва, Россия, 119021
Проблемы диагностики и лечения компрессионной нейропатии срединного нерва: анализ типичной врачебной практики
Цель исследования. Анализ типичных врачебных ошибок при диагностике и лечении компрессионной нейропатии срединного нерва в запястном канале (синдром запястного канала — СЗК). Материал и методы. Проанализирован анамнез (предшествующая диагностика и лечение) 85 пациентов (14 мужчин и 71 женщина) в возрасте от 36 до 84 лет (средний возраст 62±10,6 года) с СЗК, оперированных в клинике нервных болезней. Результаты. Ошибочный диагноз первично был установлен у 60% пациентов. Наиболее распространенными ошибочными диагнозами были «остеохондроз шейного отдела позвоночника» (45,8%) и «диабетическая полинейропатия» (5,8%). Пациентам не проводился специализированный неврологический осмотр (с использованием проб Тинеля и Фалена), часто необоснованно осуществлялась МРТ шейного отдела, не использовалась электронейромиография. При установленном диагнозе СЗК необоснованно назначались нестероидные противовоспалительные препараты, витамины группы В, редко использовалось местное введение глюкокортикостероидов, не рекомендовались на ранней стадии заболевания ношение ортеза, на поздней стадии — декомпрессивные хирургические операции. Представлено клиническое наблюдение пациентки с СЗК, которой в течение длительного времени не удавалось установить правильный диагноз. Несмотря на длительный анамнез заболевания, хирургическая декомпрессия привела к регрессу симптомов и полной профессиональной реабилитации. Заключение. Необходимо информирование врачей о проявлениях, диагностике и эффективных методах лечения компрессионной нейропатии срединного нерва.
Компрессионная нейропатия срединного нерва (синдром запястного канала — СЗК) развивается наиболее часто на уровне запястного канала вследствие сдавления нерва под поперечной связкой запястья. СЗК — самая распространенная туннельная нейропатия верхних конечностей [1], которая встречается приблизительно у 3,8% населения [2]. Каждый 5-й пациент, который предъявляет жалобы на боль, парестезии и онемение в верхней конечности, страдает СЗК [3]. У женщин компрессионная нейропатия срединного нерва развивается в 5—6 раз чаще, чем у мужчин, с пиком заболеваемости в возрасте от 40 до 60 лет [4, 5].
Диагностика компрессионной нейропатии срединного нерва основывается на типичной клинической картине, заключающейся в нарушенной чувствительности в области ладонной поверхности I—III пальцев кисти, онемении и боли в области запястья и I—III пальцев кисти, преимущественно в ночное время, что приводит к частым пробуждениям пациентов, а также неловкости или слабости кисти [6]. Специфические провокационные пробы позволяют с высокой вероятностью установить диагноз СЗК, даже в отсутствие инструментальных методов диагностики [7]. В связи с высокой распространенностью заболевания во многих странах принято использовать специализированные опросники для установления диагноза и определения степени выраженности симптомов при СЗК [6]. Инструментальные методы исследования, такие как электронейромиография (ЭНМГ) и ультразвуковое исследование (УЗИ) срединных нервов, помогают подтвердить диагноз [8]. По данным ряда авторов [9, 10], пациентам с компрессионной нейропатией срединного нерва необоснованно назначается выполнение МРТ шейного отдела позвоночника, при которой нередко обнаруживаются его дегенеративные изменения, что часто служит причиной ошибочного диагноза.
Лечение СЗК консервативное и хирургическое. На начальной стадии заболевания (обычно в течение первых 6 мес от появления симптомов) показано консервативное лечение — ношение ортеза в ночное время в нейтральном положении кисти и введение глюкокортикостероидов (ГКС) внутрь запястного канала [11—13]. По данным рандомизированных клинических исследований [7, 11, 14] отмечается достоверное уменьшение выраженности симптомов на фоне этой терапии по сравнению с плацебо.
У пациентов с тяжелым течением заболевания, длительностью симптомов более 6 мес и при неэффективности консервативного лечения целесообразна хирургическая декомпрессия срединного нерва, которая применяется с 1950 г. [15]. По данным рандомизированных клинических исследований [16], при выраженной клинической картине заболевания хирургическое лечение эффективнее, чем ношение ортеза и внутриканальное введение ГКС. Успешные результаты хирургического лечения отмечаются более чем в 75% случаев [17].
Цель исследования — анализ типичной врачебной практики, ошибок диагностики и тактики лечения при компрессионной нейропатии срединного нерва.
В исследование включали пациентов в возрасте 18 лет и старше с СЗК, которым была выполнена декомпрессия срединного нерва на уровне запястья в 2016—2017 гг. в Клинике нервных болезней им. А.Я. Кожевникова Первого Московского государственного медицинского университета им. И.М. Сеченова. В исследование вошли 85 пациентов (14 мужчин и 71 женщина) в возрасте от 36 до 84 лет (средний возраст 62±10,6 года).
При сборе анамнеза регистрировали пол, возраст, анализировали характер профессиональной и прочей деятельности пациента, уточняли наличие сопутствующих заболеваний, принимаемые препараты. Проводили анализ предшествующих обращению пациента в Клинику нервных болезней диагностики и лечения. Оценивали общий соматический и неврологический статус, а также проводили специфические пробы Тинеля и Фалена, позволяющие установить компрессию срединного нерва. Пробу Тинеля считали положительной в случае, если при перкуссии в проекции срединного нерва в области борозд запястья возникали иррадиация боли и покалывание в пальцах. Пробу Фалена считали положительной в случае возникновения парестезий в пальцах рук при максимальном сгибании кистей в лучезапястных суставах и подъеме вверх рук на протяжении 1 мин [18].
Проводили анкетирование пациентов по Бостонскому опроснику Boston Carpal Tunnel Questionnaire (BCTQ), позволяющему оценить степень выраженности симптомов заболевания и функционального дефицита. Интенсивность болевого синдрома оценивали по визуальной аналоговой шкале (ВАШ). Из инструментальных методов обследования пациентам выполняли ЭНМГ верхних конечностей и УЗИ срединных нервов на уровне запястья. Диагноз устанавливали на основании жалоб пациентов, клинических симптомов и результатов инструментальных исследований.
Лечение пациентов заключалось в хирургической декомпрессии срединного нерва на уровне запястья путем полного рассечения поперечной связки.
Статистическую обработку данных выполняли с использованием программы Statistica 10.0
Результаты
Все пациенты, обследованные и оперированные в нашей клинике, ранее обращались за консультацией в другие лечебные учреждения, однако в 60% случаев был установлен ошибочный диагноз. Шейный остеохондроз диагностирован у 39 (45,8%) больных, диабетическая полинейропатия — у 5 (5,88%), остеоартроз мелких суставов кисти — у 3 (3,53%), ревматоидный артрит — у 2 (2,35%), синдром Рейно — у 1 (1,17%), токсическая полинейропатия — у 1 (1,17%). Следует отметить, что у всех пациентов наблюдалась характерная клиническая картина СЗК.
Тщательный неврологический осмотр с определением зон нарушенной чувствительности, оценкой силы кисти и выполнением специализированных проб Тинеля и Фалена в других лечебных учреждениях был проведен лишь 17 (20%) пациентам. У 21 (24,7%) пациента выполнена МРТ шейного отдела позвоночника, при которой обнаружены дегенеративные изменения, что привело к ошибочной диагностике вертеброгенной природы патологических проявлений.
Было проанализировано предшествующее лечение пациентов с компрессионной нейропатией срединного нерва. Было выяснено, что 51 (60%) пациенту назначались нестероидные противовоспалительные препараты (НПВП), витамины группы В и вазоактивные препараты. Из них лишь 7 (8%) больных отмечали незначительное снижение выраженности симптомов на период менее 3 мес. Внутриканальное введение ГКС было выполнено 18 (21%) пациентам, лишь 3 из них инъекции проводились в других лечебных учреждениях. Положительный эффект от введения ГКС получен у 15 (18%) пациентов, однако длительность его не превышала 4 мес, 15 (18%) больным лечение не было назначено. Ношение ортеза в ночное время и снижение нагрузки на запястье не было рекомендовано ни одному пациенту. Физиотерапевтическое лечение на область шейного отдела позвоночника и запястья получили 33 (39%) больных, 5 (6%) пациентам было предложено выполнение хирургического вмешательства на шейном отделе позвоночника с целью устранения выявленных на МРТ дегенеративных изменений межпозвоночных дисков.
В качестве примера типичной врачебной практики и ошибок диагностики приводим следующее наблюдение.
Пациентка С., 60 лет, предъявляла жалобы на постоянное чувство онемения, жжения, покалывания в области I—III и половине IV пальца правой кисти, слабость I—III пальцев правой кисти, простреливающую боль в области запястья и I—III пальцев правой кисти. Впервые преходящее чувство онемения в ночное время появилось в I—III пальцах около 8 лет назад. Пациентка обратилась за медицинской помощью в поликлинику по месту жительства, где ей была назначена МРТ шейного отдела позвоночника, на основании результатов исследования установлен диагноз: остеохондроз шейного отдела позвоночника, грыжи межпозвоночных дисков СV—СVII, радикулопатия корешков СV—СVI справа. С указанным диагнозом на протяжении 5 лет с частотой 2—3 курса в год проходила лечение НПВП, витаминами группы В, нейрометаболическими препаратами, получала физиотерапевтическое лечение на область шейного отдела позвоночника без существенного эффекта. В течение последних 2 лет онемение приобрело постоянный характер, появилось чувство жжения, покалывания в пальцах, увеличилось количество ночных пробуждений от боли и парестезий в пальцах, отмечались нарастание слабости в I—III пальцах, сложности при захватывании мелких предметов (трудности при удержании ручки, художественной кисти, застегивании пуговиц), в связи с чем была вынуждена прекратить свою профессиональную деятельность.
В сентябре 2016 г. пациентка обратилась в клинику нервных болезней А.Я. Кожевникова. Из анамнеза стало известно, что пациентка в течение 40 лет работает художником-декоратором, увлекается вязанием и шитьем. В неврологическом статусе обнаружено снижение силы в правой кисти до 4 баллов, снижение температурной, тактильной, болевой чувствительности в I—III и половине IV пальца правой кисти, положительный симптом Тинеля и положительная проба Фалена справа, атрофия мышц группы thenar справа.
По результатам ЭНМГ правого срединного нерва выявлено грубое поражение двигательных и чувствительных волокон в области запястья. По данным УЗИ правого срединного нерва обнаружены признаки компрессионной нейропатии срединного нерва на уровне запястья.
Пациентке установлен клинический диагноз: компрессионно-ишемическая нейропатия правого срединного нерва. Синдром запястного канала справа. С учетом длительности заболевания рекомендовано хирургическое лечение. Однако на момент осмотра пациентка отказалась от него по семейным обстоятельствам. Для уменьшения выраженности симптомов заболевания ей было рекомендовано ношение ортеза в ночное время, выполнена инъекция новокаина и дексаметазона в проекции правого запястного канала, после чего пациентка отметила уменьшение чувствительных нарушений, длительность эффекта составила около 2 мес. В дальнейшем в связи с возвращением прежних симптомов заболевания проведена декомпрессия правого срединного нерва с использованием минимально инвазивного доступа. Через 1 мес после хирургического лечения пациентка отметила полный регресс боли как в дневное, так и в ночное время, исчезновение парестезий, улучшение чувствительности и мелкой моторики правой кисти. Через 3 мес пациентка смогла без затруднений пользоваться художественной кистью и вернулась к профессиональной деятельности.
В представленном наблюдении у пациентки с компрессионной нейропатией срединного нерва симптомы заболевания были расценены как проявление шейного остеохондроза и корешкового синдрома уровня СV—СVI, вследствие чего она более 5 лет не получала адекватного лечения. Показательно, что уменьшение выраженности симптомов при проведении блокады с ГКС в проекции запястного канала и регресс после декомпрессивной операции были достигнуты, несмотря на длительный анамнез заболевания. Тщательный сбор анамнеза, данные осмотра и результаты обследования позволили установить верный диагноз и назначить лечение, которое привело к полной профессиональной реабилитации.
Диагноз СЗК является клиническим, и часто для его установления дополнительные обследования не требуются [6, 8]. У большинства пациентов, обратившихся в нашу клинику, диагностика компрессионной нейропатии не вызывала затруднений. Клиническая картина заболевания была представлена типичными нарушениями чувствительности в кистевой зоне иннервации срединного нерва (ладонная поверхность I—III и половины IV пальца кисти), наличием парестезий и боли в области первых 3 пальцев и запястья, преимущественно в ночное время, а также слабостью приведения I пальца кисти. Нередко компрессионная нейропатия срединного нерва встречается при других патологических состояниях, таких как сахарный диабет, ревматоидный полиартрит, гипотиреоз, ожирение, заместительная терапия эстрогенами [19]. У многих из наших пациентов СЗК сочетался с каким-либо из перечисленных состояний.
Большинству пациентов с СЗК, обследованных в других лечебных учреждениях, не был проведен тщательный неврологический осмотр с определением зон нарушенной чувствительности, исследованием силы кисти. Специфические провоцирующие тесты (пробы Тинеля и Фалена) не проводились, что скорее всего связано с неосведомленностью специалистов о данных пробах. Чувствительность и специфичность пробы Фалена составляют 68—70 и 73—83% соответственно, пробы Тинеля — 20—50 и 76—77% соответственно [20]. Чувствительность теста Дуркана находится в пределах 87—91%, а специфичность — 90—95% [21]. При этом показатели чувствительности и специфичности указанных проб существенно повышаются с учетом длительного анамнеза и тяжести заболевания. Чувствительность и специфичность проб Тинеля и Фалена у пациентов, направленных на декомпрессию срединного нерва, достигают 88—100% [5].
Результаты нашего исследования свидетельствуют, что многим пациентам с компрессионной нейропатией срединного нерва было рекомендовано выполнение МРТ шейного отдела позвоночника. Такая тактика ведения связана с распространенным представлением о том, что чувствительные расстройства и болевые феномены в верхних конечностях практически всегда связаны с дегенеративным поражением межпозвонковых дисков и компрессионной радикулопатией. При этом в качестве возможной причины не рассматривается широко распространенное в популяции поражение нервов в анатомических туннелях [22]. Выявленные в результате МРТ протрузии дисков, которые в большинстве случаев носят бессимптомный характер, на практике нередко переоцениваются врачами. Пациентам вместо существующей у них компрессионной нейропатии срединного нерва устанавливаются ошибочные диагнозы остеохондроза позвоночника, грыжи межпозвонкового диска и, как следствие, проводится лечение выявленных дегенеративных изменений позвоночника [23]. В качестве лечения таким пациентам необоснованно назначается большое количество физиотерапевтических процедур на шейный отдел позвоночника. В отдельных случаях установление ошибочного диагноза приводит к тому, что пациенту рекомендуется хирургическое удаление грыжи межпозвонкового диска (6% в нашем исследовании).
Электрофизиологические методы исследования были назначены лишь 25 (29,4%) пациентам до обращения в нашу клинику. При этом как метод инструментальной диагностики ЭНМГ признана «золотым стандартом» для СЗК. Она позволяет не только объективно исследовать нервную проводимость, но и оценить прогноз и степень тяжести СЗК [24—26]. Не менее важно ультразвуковое сканирование. Оно позволяет визуализировать срединный нерв с окружающими его структурами и установить возможные причины компрессии нерва. УЗИ отличается простотой выполнения и высокой специфичностью [27].
В небольшой группе пациентов, которым первично был установлен диагноз СЗК еще до обращения в клинику, не была назначена эффективная консервативная терапия. Использовались преимущественно НПВП, витамины группы В, нейрометаболические препараты. Однако указанные средства, а также физиотерапевтическое лечение, мануальная терапия и рефлексотерапия при СЗК неэффективны [16, 17, 28].
Наиболее эффективный метод консервативной терапии — иммобилизация пораженной кисти в нейтральном положении (ношение ортеза), а также снижение нагрузки на область запястья. Эффективность данной методики доказана и подтверждена результатами многочисленных исследований [13, 16, 29]. Однако ни одному из пациентов не было рекомендовано ношение ортеза, из чего можно сделать вывод, что этот метод лечения незнаком большому числу специалистов.
Инъекции ГКС в просвет запястного канала были выполнены лишь 18 (21,17%) пациентам, причем 15 из них в нашем учреждении. Практически у всех пациентов был достигнут положительный эффект, однако он был краткосрочным — в среднем около 4 мес. Полученные результаты согласуются с данными других исследований [29, 30] о том, что инъекции ГКС эффективны лишь для временного уменьшения выраженности симптомов, вызванных СЗК.
Результаты опроса пациентов в анализируемой нами группе показывают, что даже после установления диагноза СЗК многие врачи и на поздних стадиях заболевания предпочитают консервативные методы лечения хирургическим, а это нередко приводит к прогрессированию компрессионной нейропатии срединного нерва и нарастающей инвалидизации пациентов.
Таким образом, отмечена плохая информированность врачей о симптомах, диагностике и эффективных методах лечения компрессионной нейропатии срединного нерва. Пациентам не проводится специализированный неврологический осмотр (с использованием проб Тинеля и Фалена). Назначение МРТ нередко приводит к установлению ошибочных диагнозов, вследствие чего пациентам не назначается адекватное лечение. Для улучшения результатов лечения необходимо информирование врачей о проявлениях СЗК, диагностических пробах, возможностях инструментальных методов диагностики (ЭНМГ, УЗИ срединных нервов). Своевременное выявление СЗК и его лечение эффективно у большинства пациентов.
Ишемическая нейропатия зрительного нерва
Ишемическая нейропатия зрительного нерва - поражение зрительного нерва, обусловленное функционально значимым расстройством кровообращения в его интрабульбарном или интраорбитальном отделе. Ишемическая нейропатия зрительного нерва характеризуется внезапным снижением остроты зрения, сужением и выпадением полей зрения, монокулярной слепотой. Диагностика ишемической нейропатии требует проведения визометрии, офтальмоскопии, периметрии, электрофизиологических исследований, УЗДГ глазных, сонных и позвоночных артерий, флюоресцентной ангиографии. При выявлении ишемической нейропатии зрительного нерва назначается противоотечная, тромболитическая, спазмолитическая терапия, антикоагулянты, витамины, магнитотерапия, электро- и лазерстимуляция зрительного нерва.
Общие сведения
Ишемическая нейропатия зрительного нерва обычно развивается в возрасте 40-60 лет, преимущественно у лиц мужского пола. Это серьезное состояние, которое может вызывать значительное снижение зрения и даже слепоту. Ишемическая нейропатия зрительного нерва не является самостоятельным заболеванием органа зрения, а служит глазным проявлением различных системных процессов. Поэтому проблемы, связанные с ишемической нейропатией, изучаются не только офтальмологией, но и кардиологией, ревматологией, неврологией, эндокринологией, гематологией.
Классификация
Поражение зрительного нерва может развиваться в двух формах - передней и задней ишемической нейропатии. Обе формы могут протекать по типу ограниченной (частичной) или тотальной (полной) ишемии.
При передней ишемической нейропатии зрительного нерва патологические изменения обусловлены острым расстройством кровообращения в интрабульбарном отделе. Задняя нейропатия развивается реже и связана с ишемическими нарушениями, возникающими по ходу зрительного нерва в ретробульбарном (интраорбитальном) отделе.
Причины
Передняя ишемическая нейропатия патогенетически обусловлена нарушением кровотока в задних коротких ресничных артериях и развивающейся вследствие этого ишемией ретинального, хориоидального (преламинарного) и склерального (ламинарного) слоев ДЗН. В механизме развития задней ишемической нейропатии ведущая роль принадлежит расстройству кровообращения в задних отделах зрительного нерва, а также стенозам сонных и позвоночных артерий. Локальные факторы острого нарушения кровообращения зрительного нерва могут быть представлены как функциональными расстройствами (спазмами) артерий, так и их органическими изменениями (склеротическими поражениями, тромбоэмболиями).
Этиология ишемической нейропатии зрительного нерва мультифакторная; заболевание обусловлено различными системными поражениями и связанными с ними общими гемодинамическими нарушениями, локальными изменениями в сосудистом русле, расстройствами микроциркуляции. Ишемическая нейропатия зрительного нерва наиболее часто развивается на фоне общих сосудистых заболеваний - атеросклероза, гипертонической болезни, височного гигантоклеточного артериита (болезни Хортона), узелкового периартериита, облитерирующего артериита, сахарного диабета, дископатий шейного отдела позвоночника с нарушениями в вертебробазилярной системе, тромбоза магистральных сосудов. В отдельных случаях ишемическая нейропатия зрительного нерва возникает вследствие острой кровопотери при желудочно-кишечных кровотечениях, травмах, хирургических вмешательствах, анемии, артериальной гипотонии, болезнях крови, после наркоза или гемодиализа.
Симптомы
При ишемической нейропатии зрительного нерва чаще поражается один глаз, однако у трети больных могут наблюдаться двусторонние нарушения. Нередко второй глаз вовлекается в ишемический процесс спустя некоторое время (несколько дней или лет), обычно в течение ближайших 2-5 лет. Передняя и задняя ишемическая нейропатия зрительного нерва часто сочетаются между собой и с окклюзией центральной артерии сетчатки.
Оптическая ишемическая нейропатия, как правило, развивается внезапно: часто после сна, физического усилия, горячей ванны. При этом резко снижается острота зрения (вплоть до десятых долей, светоощущения или слепоты при тотальном поражении зрительного нерва). Резкое падение зрения происходит в период от нескольких минут до часов, так что пациент четко может указать время ухудшения зрительной функции. Иногда развитию ишемической нейропатии зрительного нерва предшествуют симптомы-предвестники в виде периодического затуманивания зрения, боли за глазом, сильной головной боли.
При данной патологии в том или ином варианте всегда нарушается периферическое зрение. Могут отмечаться отдельные дефекты (скотомы), выпадения в нижней половине поля зрения, выпадения височной и носовой половины поля зрения, концентрическое сужение полей зрения.
Период острой ишемии продолжается в течение 4-5 недель. Затем постепенно спадает отек ДЗН, рассасываются кровоизлияния, наступает атрофия зрительного нерва различной степени выраженности. При этом дефекты полей зрения сохраняются, но могут значительно уменьшаться.
Диагностика
Для выяснения характера и причин патологии пациенты с ишемической нейропатией зрительного нерва должны быть обследованы офтальмологом, кардиологом, эндокринологом, неврологом, ревматологом, гематологом.
Комплекс офтальмологического обследования включает проведение функциональных тестов, осмотра структур глаза, ультразвуковых, рентгенологических, электрофизиологических исследований.
Проверка остроты зрения выявляет его снижение от незначительных величин до уровня светоощущения. При обследовании полей зрения определяются дефекты, соответствующие повреждению тех или иных участков зрительного нерва.
При офтальмоскопии выявляется бледность, ишемический отек и увеличение ДЗН, его проминация в стекловидное тело. Сетчатка вокруг диска отечна, в макуле определяется «фигура звезды». Вены в зоне сдавления отеком узкие, на периферии, напротив, полнокровные и расширенные. Иногда выявляются очаговые кровоизлияния и экссудация.
Ангиография сосудов сетчатки при ишемической нейропатии зрительного нерва выявляет ретинальный ангиосклероз, возрастной фиброз, неравномерный калибр артерий и вен, окклюзию цилиоретинальных артерий. При задней ишемической нейропатии зрительного нерва офтальмоскопия в остром периоде не выявляет никаких изменений в ДЗН. При УЗДГ глазных, надблоковых, сонных, позвоночных артерий нередко определяются изменения кровотока в данных сосудах.
Электрофизиологические исследования (определение критической частоты слияния мельканий, электроретинограмма и др.) демонстрируют снижение функциональных порогов зрительного нерва. При исследовании коагулограммы обнаруживаются изменения по типу гиперкоагуляции; при определении холестерина и липопротеидов выявляется гиперлипопротеинемия. Ишемическую нейропатию зрительного нерва следует отличать от ретробульбарного неврита, объемных образований орбиты и ЦНС.
Лечение
Терапия ишемической нейропатии зрительного нерва должна быть начата в первые часы после развития патологии, поскольку длительное нарушение кровообращение вызывает необратимую гибель нервных клеток. Неотложная помощь при резко развившейся ишемии включает немедленное внутривенное введение раствора эуфиллина, прием нитроглицерина под язык, вдыхание паров нашатырного спирта. Дальнейшее лечение ишемической нейропатии зрительного нерва проводится стационарно.
Последующее лечение направлено на снятие отека и нормализацию трофики зрительного нерва, создание обходных путей кровоснабжения. Важное значение имеет терапия основного заболевания (сосудистой, системной патологии), нормализация показателей свертывающей системы и липидного обмена, коррекция уровня АД.
При ишемической нейропатии зрительного нерва назначается прием и введение мочегонных препаратов (диакарба, фуросемида), сосудорасширяющих и ноотропных средств (винпоцетина, пентоксифилина, ксантинола никотината), тромболитических препаратов и антикоагулянтов (фениндиона, гепарина), кортикостероидов (дексаметазона), витаминов групп В, С и Е. В дальнейшем проводится магнитотерапия, электростимуляция, лазерстимуляция волокон зрительного нерва.
Прогноз и профилактика
Прогноз ишемической нейропатии зрительного нерва неблагоприятен: несмотря на лечение, часто сохраняется значительное снижение остроты зрения и стойкие дефекты периферического зрения (абсолютные скотомы), обусловленные атрофией зрительного нерва. Повышения остроты зрения на 0,1-0,2 удается добиться лишь у 50% пациентов. При поражении обоих глаз возможно развитие слабовидения или тотальной слепоты.
Для профилактики ишемической нейропатии зрительного нерва важное значение имеет терапия общих сосудистых и системных заболеваний, своевременность обращения за медицинской помощью. Пациентам, перенесшим ишемическую нейропатию зрительного нерва одного глаза, необходимо диспансерное наблюдение офтальмолога и проведение соответствующей профилактической терапии.
Читайте также:
- Техника снятия слепков для изготовления коронок зубов. Рекомендации
- Лечение повреждения сухожилий разгибателей на тыле кисти и в пределах запястья
- Диагностика вестибулярной шванномы по КТ, МРТ
- Бедренный нерв ( n. femoralis ). Топография бедренного нерва. Ветви бедренного нерва.
- УЗИ при гиперплазии предстательной железы
