ЭхоКГ после операции по Фонтену
Добавил пользователь Валентин П. Обновлено: 01.02.2026
Принципы гемодинамической коррекции, разработанные Ф.Фонтеном около 40 лет тому назад, в настоящее время являются базовой моделью в лечении сложных пороков сердца, где невозможно восстановить его четырехкамерное строение. Операция Фонтена является альтернативой пересадке сердца. В статье приводится опыт Казанского Центра детской кардиохирургии.
Experience of the operations hemodynamic correction in patients with complex congenital heart defects
Principles of hemodynamic correction, developed F.Fonten about 40 years ago, are now the basic model in the treatment of complex heart defects, where it is impossible to restore its four-chambered structure. Fontan`s operation is an alternative to heart transplantation. The paper presents the experience of the Kazan Center for Pediatric Cardiac Surgery.
Операции гемодинамической коррекции кровообращения при сложных пороках сердца, где невозможно восстановление четырехкамерного строения сердца, являются методом выбора и значительно сокращают показания к пересадке сердца у детей. В 1968 году французский хирург Френсис Фонтен доказал возможность обхода правого желудочка, применив оригинальную методику у пациента с трикуспидальной атрезией. В настоящее время, с учетом осложнений отдаленного периода после операции, чаще всего применяют модификацию с использованием экстракардиального кавапульмонального кондуита. К настоящему времени накоплен большой опыт отдаленных наблюдений за больными, которых оперировали различными способами, и среди них с меньшим количеством осложнений лидирует вариант экстракардиального соединения нижней полой вены с легочной артерией. Коррекция, как правило, носит трехэтапный характер и в законченном виде не устраняет сложных внутрисердечных аномалий, но позволяет восстановить кровообращение в организме близкое к нормальному.
Цель исследования: анализ опыта выполнения операций гемодинамической коррекции у больных со сложными врожденными пороками сердца.
Материалы и методы: В отделении кардиохирургии ДРКБ МЗ РТ операции гемодинамической коррекции выполнены 48 пациентам. Больные были условно разделены на группы в соответствии с этапностью хирургического лечения. Пациентам I группы выполнялись паллиативные вмешательства, II группы — двунаправленный кавапульмональный анастомоз, III группы — операция Фонтена в модификации экстракардиального кондуита (Табл.1)
Операции гемодинамической коррекции
Пациенты всех групп на этапе диагностики подвергались ЭХО-КС, рентген- эндоваскулярным методам исследования, спиральной компьютерной томографии. Нозологическая структура представлена в таблице 2.
Нозологическая структура оперированных больных
количество случаев n
Распределение пациентов в связи с этапами хирургического лечения
Первый этап хирургического лечения был направлен на нормализацию легочного кровотока, декомпрессию правых камер сердца и профилактику возникновения критических состояний кровообращения и носил характер срочных и экстренных вмешательств. В случаях гипоплазии левого сердца основной задачей было восстановление баланса системного и легочного кровотока. Длину манжеты для суживания легочной артерии при операции Альберта — Мюллера рассчитывали по формуле Алекси-Месхишвилли В.В. и Trusler. Однако окончательную степень сужения легочной артерии необходимо контролировать измерением давления в легочной артерии и уровнем сатурации кислорода крови. Диаметр протеза (Gore- Tex) при создании системно- лёгочного шунта по Блелоку - Тауссиг соответствовал весу ребенка.
После первого этапа умерло 4 пациента: двое от сердечной недостаточности, 1 - от криза легочной гипертензии и 1 - от повреждений ЦНС, вызванных допущенной критической гипоксией.
Второй этап лечения проводили в сроки от 6 до 12-14 месяцев. Выполняли двунаправленный кавопульмональный анастомоз по Глену. Основным критерием отбора служило давление в системе легочной артерии и общее легочное сопротивление. В случаях, когда при катетеризации полостей сердца завести катетер в систему легочной артерии не представлялось возможным, замеры и расчеты проводили открытым способом в операционной.
Кавапульмональный анастомоз выполняли в условиях ИК, в основном без кардиоплегии, на работающем сердце. Легочный ствол при первых операциях просто лигировали, но с накоплением опыта стали пересекать с прошиванием. Правосторонние шунты отсекали по линии шва с легочной артерией, затем вовлекали эту область в линию шва кавапульмонального анастомоза.
После ДКПА умерло 2 пациента по причине декомпенсации кровообращения. В двух случаях своевременным назначением тромболитической терапии удалось вовремя остановить тромбоз в системе верхней полой вены с эпизодами легочной эмболии. В одном случае нарастающий синдром верхней полой вены привел к необходимости реоперации, которая заключалась в восстановлении верхней полой вены и системно-легочного шунта. В одном случае на фоне низкого насыщения — 65-70%, интраоперационно выявлено высокое легочное сопротивление, исключающее возможность ДКПА. Вопреки логике и от безысходности был наложен второй шунт, пациенту стало легче и через 6 месяцев был наложен ДКПА.
Пациентам последнего третьего этапа лечения проводили операцию Фонтена в модификации экстракардиального кондуита с учетом критериев отбора Chossat A. [1,3]. Возраст больных колебался от 4-х до 7 лет 2 мес. (в среднем 5,4 года). Масса тела пациентов варьировала от 10,3 до 18,5 кг(в среднем 13,48 кг). Насыщение периферической крови кислородом составило 80-84 %. В предоперационном периоде все больные подвергались катетеризции полостей сердца и сосудов с целью уточнения анатомических и гемодинамических особенностей порока, определения ОЛС и выявления возможных стенозов в области анастомозов. Среднее давление в легочной артерии составило 9-15 мм.рт.ст. Общее легочное сопротивление от 1,2 до 3,7 Ед/м 2 . Синусовая брадикардия на ЭКГ встретилась в 5-ти случаях. Недостаточность митрального клапана 1,5 - 2 ст. наблюдалась у пациентов с несбалансированной формой АВК. В послеоперационном периоде именно рецидивирующая недостаточность атриовентрикулярного клапана с нарастающей сердечной слабостью стали причиной смерти двух пациентов.
Хирургические вмешательства осуществляли через срединную продольную стернотомию по старому рубцу. Стандартное подключение АИКа с низкой канюляцией НПВ. Вспомогательное кровообращение. Во всех случаях в качестве экстракардиального кондуита использовались протезы фирмы «Gore-Tex» различных диаметров 16 -22 мм. Операции дополнены фенестрацией протеза и анастомозированием с полостью правого предсердия у всех больных.
Результаты: Летальность в представленной группе больных на всех прооперированных пациентов составила 16,6%. Но с учетом того, что 48 пациентам проведено 79 операций с 8 умершими, послеоперационная летальность — 10,1%. Частота и разнообразие нелетальных осложнений в наших наблюдениях не отличались от литературных данных, за исключением истощающих энтеропатий.
Длительность ИВЛ в послеоперационном периоде после операции Фонтена составила 12 часов. Инотропную поддержку осуществляли дофамином в дозе 12-5 мкг/кг/мин в течение 3-7 суток. Дигитализация потребовалась в 5-ти случаях. Плевральная экссудация была различной по срокам - от 3-х до 20 суток. Сатурация крови после операции составила 91-94%. Пациенты выписаны в удовлетворительном состоянии на фоне стандартной медикаментозной терапии.
Наш опыт показывает, что лечение пациентов со сложными пороками сердца методом этапной гемодинамической коррекции может успешно тиражироваться в условиях региональных центров с учетом строгого соблюдения показаний и противопоказаний к операции и адекватного реанимационного пособия. Принцип гемодинамической коррекции Фонтена, являясь альтернативой пересадке сердца, несет в себе не только хирургический смысл, но и общемедицинское значение, указывая нам на недостаточную осведомленность в вопросах резервных возможностей в данном случае детского организма.
Л.М. Миролюбов, П.Н. Гребнев
Казанский государственный медицинский университет
Детская республиканская клиническая больница МЗ РТ
Миролюбов Леонид Михайлович - доктор медицинских наук, профессор, заведующий кафедрой детской хирургии
Пациенты с функционально единственным желудочком сердца после операции Фонтена. Лекция для врачей
Операция Фонтена применяется для паллиативного оперативного лечения цианотических пороков с 1971 г. Фундаментальная основа разработки этого хирургического вмешательства была заложена в начале 40-х гг. XX в.
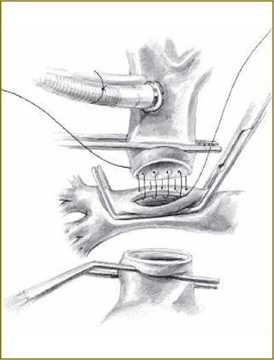
Рис. 1. Выполнение шва анастомоза между верхней полой веной и правой легочной артерией
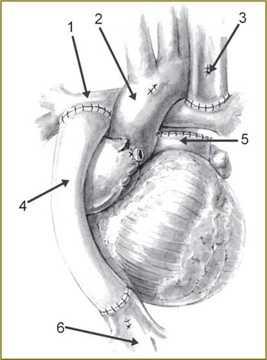
Рис. 2. Операция Фонтена, выполненная с экстракардиальным кондуитом; 1 — правая легочная артерия; 2 — аорта; 3 — верхняя полая вена; 4 — кондуит; 5 — культя легочного ствола; 6 — нижняя полая вена
Принципы кровообращения Фонтена. Чтобы представить кровообращение Фонтена, нужно исключить из нормальной циркуляции правый желудочек (в случае исправленной трикуспидальной атрезии), который в норме нагнетает кровь в легкие. Уникальность операции в том, что создаются гемодинамические условия эффективного функционирования легочного круга кровообращения в присутствии исправленного врожденного анатомического дефекта.
Энергия для продвижения крови в легкие при кровообращении Фонтена — это прежде всего результат насосной функции левого желудочка и сокращения правого предсердия. Кровь, получив от желудочка толчок, проходя по системным сосудам, возвращается в правое предсердие и течет в легкие. Раньше считалось, что для успешного результата операции Фонтена необходима достаточно разработанная камера правого предсердия, которая в основном встречается у сравнительно взрослых больных. В самом деле, длительная перегрузка этой камеры приводит к увеличению ее емкости, гипертрофии стенок и, как показывает опыт, в таком случае правое предсердие успешно выполняет функцию правого желудочка. Однако расширение предсердия способствует развитию аритмий и тромбозов с последующей эмболией.
Известно, что сопротивление сосуда замедляет и в конечном счете останавливает ток жидкости, вот почему для успешного результата операции нужно учитывать гемодинамические характеристики пациента. Например, если легочные сосуды толстостенные, с узким просветом, они окажут значительное сопротивление легочному кровотоку, который будет не осуществим без дополнительной силы.
Условия эффективного осуществления операции Фонтена. Существует несколько вариантов критериев операции Фонтена. Наиболее используемыми являются критерии С. van Doorn и M.R. de Leval, впоследствии уточненные [10]:
1. Минимальный возраст —
Минимальный возраст — менее 4 лет. Наименьший и оптимальный возраст для выполнения операции Фонтена неизвестен
2. Синусовый ритм
Желателен синусовый ритм
3. Нормальный дренаж полых вен
Желателен нормальный дренаж полых вен
4. Правое предсердие нормального объема
Маленькое правое предсердие — противопоказание для операции латерального тоннеля Фонтена
5. Среднее давление легочной артерии — менее 15 мм рт. ст.
Среднее давление легочной артерии — менее 15 мм рт. ст.
6. Легочное альвеолярное сопротивление — менее 4 ед./м 2
Легочное альвеолярное сопротивление — менее 4 ед./м 2
7. Отношение диаметров легочной артерии и аорты — более 0,75
Адекватные размеры легочного сосудистого русла, может быть полезным применение индексов МcСoon и Nacato
8. Нормальная вентрикулярная функция (фракция выброса более 0,6)
Сохраненные вентрикулярные систолическая и диастолическая функции
9. Компетентный левый атриовентрикулярный клапан
Компетентный левый атриовентрикулярный клапан
10. Отсутствие нарушающих эффектов предыдущих шунтов
Отсутствие нарушающих эффектов предыдущих шунтов
Распространены также критерии А. А. Choussаt (1977), хотя они мало отличаются от предыдущих [9]:
1) возрастные границы — более 4 и менее 15 лет;
2) нормальный синусовый ритм;
3) нормальный венозный возврат;
4) нормальный объем правого предсердия;
5) среднее давление легочной артерии — менее 15 мм рт. ст.;
6) легочное артериолярное сопротивление — менее 4 ед. Вуда на 1 м 2 площади поверхности тела;
7) соотношение диаметров легочной артерии и аорты — более 0,75;
8) фракция выброса левого желудочка — более 0,60;
9) компетентный митральный клапан;
10) отсутствие искажения легочных артерий.
Показания и противопоказания для операции Фонтена
Изначально эта операция была предложена для использования в случае отсутствия правого предсердно-желудочкового соединения, в настоящее время применяется в связи с расширением показаний для оперативного лечения многих сложных сердечных мальформаций с только одним хорошо развитым желудочком. Такие пороки включают правую или левую атриовентрикулярную клапанную атрезию, двуприточный желудочек, легочную атрезию с интактной вентрикулярной перегородкой, гипопластический правый или левый желудочек с дефектами межжелудочковой перегородки, с наличием или без вышерасположенного атриовентрикулярного клапана, отдельные случаи двойного отхождения магистральных сосудов от одного желудочка.
Выполнение операции Фонтена имеет только несколько абсолютных противопоказаний:
легочное сосудистое сопротивление — более 4 ед. Вуда на 1 м 2 ;
тяжелая гипоплазия легочных артерий;
тяжелая диастолическая дисфункция левого желудочка.
Возраст, при котором выполняется операция, значительно снизился — в некоторых клинических центрах эта операция выполняется в возрасте 2 лет и даже раньше у пациентов с подходящей анатомией и физиологией. Преимущество выполнения операции Фонтена в раннем возрасте — это повышение оксигенации, что позволяет улучшить соматический рост и исходы неврологического развития. Операция также снижает объемную нагрузку на единственный желудочек.
Считается, что операция должна выполняться после того, как ребенок начинает ходить или, по меньшей мере, ползать, с целью использования влияния мышечного сокращения на венозный возврат. Наличие дооперационного синусового ритма не является обязательным условием для успешного исхода операции, однако необходимо обеспечение темпа в непосредственном послеоперационном периоде. Аномальный венозный возврат не является абсолютным противопоказанием для выполнения операции, он считается совместимым с кровообращением Фонтена. Оценка вентрикулярной функции является трудной процедурой по причине неоднородной геометрии многих единственных желудочков. Магнитно-резонансное изображение позволяет осуществить точное измерение вентрикулярных объемов выброса и фракций регургитации, но до сих пор не ясно, имеется ли польза этих объемных определений как предсказательных факторов исхода после операции Фонтена.
Наличие регургитации атриовентрикулярных клапанов может быть следствием перегрузки объемом единственного желудочка, если пациент имеет системно-легочной шунт; регургитация может улучшиться, когда нагрузка объемом будет удалена.
В исследовании S. Ovrutski с соавт. [15] конечно-диастолическое системное вентрикулярное давление (КДСВД) более 10 мм рт. ст. и среднее давление в легочной артерии (СДЛА) выше 15 мм рт. ст. являются факторами риска. Однако авторы считают, что КДСВД, равное 12 мм рт. ст., и СДЛА, равное 17 мм рт. ст., являются приемлемыми показателями для выполнения операции Фонтена при адекватной функции желудочков.
Типы операции. Безусловно, целесообразность, тип операции и время ее выполнения должны определяться для каждого случая индивидуально, с учетом тех фактов,что двух одинаковых сердец и анатомии проводящей системы не бывает и каждый пациент имеет уникальные гемодинамические показатели, возможности адаптации к патологии и резервные силы перенести операцию.
Анализ литературных источников позволяет сделать несколько выводов, касающихся выбора типа операций исправления единственных желудочков различных форм. Во-первых, для несбалансированного (асимметричного) атриовентрикулярного канала операцией выбора является бивентрикулярная коррекция, или так называемая полуторажелудочковая модификация операции Фонтена с применением двунаправленного анастомоза Гленна, чтобы снизить количество крови, проходящей через относительно маленький правый желудочек и трикуспидальный клапан (другими словами, «разгрузить» его). Одножелудочковая коррекция необходима только в редких случаях, когда имеется значительная обструкция выходного отдела правого желудочка или маленький вентрикулярный компонент, а также у пациентов со значительным дисбалансом (асимметрией) общего атриовентрикулярного клапана над левым желудочком (severe unbalancing of the common AV limiting right ventricular flow), с целью ограничения притока крови к правому желудочку. Гипотетическими преимуществами полуторажелудочковой коррекции для несбалансированного (асимметричного) атриовентрикулярного клапана являются:
1) возможность избежания высоких системных давлений;
2) антеградный, пульсирующий кровоток, направляющийся к легочным артериям, инициирует потенциальный рост легочных артерий;
3) сниженный риск долгосрочных осложнений физиологии кровообращения Фонтена — непереносимости физических упражнений, предсердных аритмий и белково-дефицитной энтеропатии [16—18].
Диагноз трикуспидальной атрезии (как и митральной атрезии, и синдрома гипоплазии левых отделов сердца) является однозначным показанием к операции кавапульмонального анастомоза, причем анамнез выполнения предшествующих операций ассоциируется с более высокими показателями осложнений. Даже выполнение модификаций операции Фонтена с созданием полного кавапульмонального анастомоза после операций верхнего кавапульмонального анастомоза (геми-Фонтена и двунаправленного шунта Гленна) может увеличить частоту таких проблем, как аритмии, тромбоэмболии, плевральная транссудация, белково-дефицитная энтеропатия и обструктивный бронхит, центральные и периферические неврологические осложнения.
Yueh-Tze Lan с соавт. [19] сообщили о лучших отдаленных результатах у пациентов с единственным желудочком при наличии двойного входа (двуприточным желудочком), чем в случае трикуспидальной атрезии с транспозицией магистральных сосудов. Поздние аритмии и необходимость в пейсмейкере были выявлены как независимые факторы риска смерти. Обструкция системного выходного отдела, когда она распознается и исправляется рано, не имеет влияния на долгосрочные показатели выживаемости. Защита сосудистого русла натурально встречающимся легочным или подлегочным стенозом, а также выполненная посредством бандирования легочной артерии, ассоциировалась с лучшей выживаемостью.
Анатомическим диагнозом, для которого в литературе указан наилучший естественный (без хирургического вмешательства — операции Фонтена или альтернативного вмешательства — операции разделения [рис. 3]) исход, является единственный желудочек с двойным входом (double-inlet single ventricle), другими словами, двуприточный. Очевидно, что это должно учитываться перед направлением взрослого пациента на операцию Фонтена, для которой установлена в 65—85% случаев 10-летняя выживаемость, а риск послеоперационной смертности может достигать 30% и более.
Для клинически тяжелой аномалии Эбштейна вариантом операции одножелудочковой коррекции (как и для асимметричного атриовентрикулярного клапана) служит полуторажелудочковая коррекция. При этой патологии считается, что главными преимуществами включения гипоплазированного (легочного) желудочка для частичной поддержки легочного кровообращения являются:
1) возможность увеличить сердечный выброс;
2) адаптация к физическим упражнениям;
3) поддержание пульсирующего потока в легочной циркуляции;
4) гибкость в ответ на повышенное легочное сопротивление;
5) циркуляция при низких уровнях давления в системе нижней полой вены;
6) возможность гипоплазированного комплекса правых отделов сердца адекватно справляться со сниженной преднагрузкой
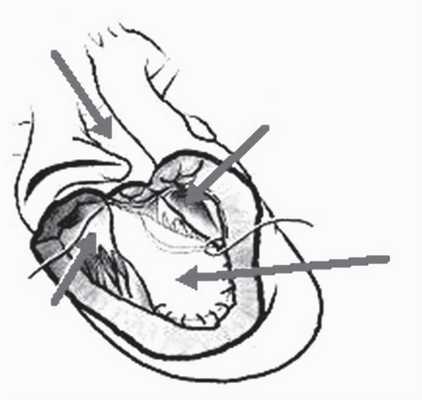
Рис. 3. Операция разделения (septation procedure) [20, 21]: 1 — легочный ствол; 2 — бульбовентрикулярное отверстие; 3 — трикуспидальный клапан; 4 — заплата
J.M. Stulak с соавт. [22] сообщают, что операция «один с половиной» применяется в тех случаях, когда правый желудочек считается неспособным поддерживать легочную циркуляцию. Исследователи считают, что полуторажелудочковая коррекция может служить альтернативой для пациентов с тяжелой аномалией Эбштейна и плохой функцией правого желудочка, которые могут подвергаться высокому риску при выполнении стандартного хирургического лечения. Помимо снижения нагрузки, по мнению исследователей, выполнение операции представляет преднагрузку для левого желудочка.
В случае оперативного лечения легочной атрезии, встречающейся в составе комплексных пороков, судя по литературным источникам, трудно однозначно судить об успехе одножелудочковой коррекции. H. Leonard с соавт. [23] сообщили об обследовании 57 из 129 родившихся с легочной атрезией в 1980—1995 гг. Авторы пришли к выводу, что результаты лечения неутешительны и пациенты, перенесшие бивентрикулярную коррекцию (см. рис. 3), имели лучшие показатели переносимости физической нагрузки, чем те, кто подвергся одножелудочковым операциям. Исследователи также сообщают о высоком уровне внезапной смерти у пациентов с легочной атрезией, которая составила 29/1000 пациентов лет. Однако D.D. Mair с соавт. [24], исследуя 860 операций Фонтена с 1973 по 1994 гг., пришли к заключению, что пациенты с легочной атрезией и интактной межжелудочковой перегородкой не могут быть кандидатами на традиционную бивентрикулярную операцию, если трикуспидальный клапан составляет по меньшей мере 70% от ожидаемого размера. У пациентов с его размерами в диапазоне 50—70% может быть выполнима лишь бивентрикулярная коррекция с двунаправленным анастомозом Гленна. У пациентов с размерами трикуспидального клапана и правого желудочка менее ожидаемых операция Фонтена обеспечивает «окончательную паллиацию» (definitive palliation), а ранние и поздние результаты этого подхода обнадеживают.
Экстракардиальный, внесердечный кондуит является в плане показаний гибкой операцией и может выполняться практически при всех анатомических ситуациях. Они включают случаи, при которых другие подходы могут быть трудными (например, у пациентов с синдромом гетеротаксии и аномалиями системного и легочного венозных дренажей).
Заключение. C момента разработки операции Фонтена показания к ее выполнению расширились в связи с созданием новых модификаций и изучением послеоперационных эффектов. Идеальная операция Фонтена еще не создана, хотя близкой к таковой является модификация C. Marcelletti. Нет однозначного мнения, с учетом индивидуальных гемодинамических показателей пациента и вариаций операций, является ли целесообразным выполнение фенестрации у больных, переносящих операцию Фонтена экстракардиальным кондуитом. Судя по литературе, предпочтительнее как можно более раннее вмешательство.
Анализ литературных данных позволяет говорить о перспективности дальнейшей разработки операции разделения единственного желудочка, а также указывает пути усовершенствования и других операций.
Литература
1. Бокерия Л.А., Подзолков В.П., Глянцев С.П., Кокшенев И.В. Операция кавапульмонального анастомоза. Часть 2. От воплощения к ее совершенствованию. Детские болезни сердца и сосудов 2005; 5: 7—13.
2. Baum C.V. Pediatric cardiac surgery: historical appreciation. Pediatric Anesthesia 2006 May: 1—12.
3. Bjork V.G. Fifty years of cardiac and pulmonary surgery. Scand J Thoracic Surgery Supplement 1998; 8: 142—149.
4. Galankin N.K. Cavapulmonary anastomosis. M: Medyt- sina; 1968; 350 p.
5. Vishnevsky A.A., Galankin N.K., Krymski L.D. Tetralogy of Fallot. M: Medytsina; 1969: 225 p.
6. Keirle A., Helmsworth J.A., Kaplan S., Ogden A. Experi¬ence with fnastomosis of superior vena cava to pulmonary artery glenn procedure. Circulation 1963 April; 24: 753—760.
7. Kirklin’s J., Barrat-B’s. Cardiac surgery. Wiley & Sons; 2005; 2583 p.
9. Wilkinson J.L. The Fontan simulation. Results, late Follow-up and management. Heart Views 2004; 4(4): 73—78.
10. Van Doorn C.A., de Leval M.R. The lateral tunnel Fontan. Oper Tech in Thorac and Cardiovasc Surg 2006; 11(2): 105—122.
11. Bradley S.M. Extracardiac Fontan procedure. Oper Tech in Thorac and Cardiovasc Surg 2006; 3(5): 123—140.
12. De Leval M.R. The Fontan circulation: a challenge to Wil-liam Harvey? Nature Clinical Practice Cardiovascular Med-icine 2005; 2: 202—208.
13. Hosein Riad B.M., Andrew J.B. Clarke, Simon P. McGuirk et al. Factors influencing early and late outcome following the Fontan procedure in the current era. The «Two Commandments»? Eur J Cardiothorac Surg 2007; 31; 344—353.
14. Uemura H, Yagihara T., Kawashima Y, Yamamoto F., Nishigaki K, Matsuki O, Okada K, Kamiya T., Ander¬son R.H. What factors affect ventricular performance after a Fontan-type operation? J Thorac Cardiovasc Surg 1995; 110(2): 405—415.
15. Ovrutski S., Alexi-Meskishvili, Ewert P., Nurnberg J.-H., Hetzer R., Lange P.E. Early and medium-term results after modified Fontan operation in adults. Eur J Cardiothorac Surg 2003; 23: 311—316.
16. Cohen M.S., Spray T.S. Surgical management of unbal-anced atrioventricular canal defect. Semin Thorac Cardiovasc Surg Pediatr Card Surg Ann 2007; 8: 135—144.
17. Corno A.F., Chassot P.G., Payot M., Sekarski N., Tozzi P., von Segesser L.K. Ebstein’s anomaly: one and a half ven-tricular repair. Swiss Med Wkly 2002; 132: 485—488.
18. Mitchell M.E., Litwin S.B., Tweddell J.S. Complex atrioven-tricular canal. Semin Thorac Cardiovasc Surg Pediatr Card Surg Ann 2007; 10: 32—41.
19. Yueh-Tze Lan, Ruey-Kang Chang, Hillel Laks, MD. Out¬come of patients with double-inlet left ventricle or tricuspid atresia with transposed great arteries. J Am Coll Cardiol 2004; 43: 113—119.
20. CTS files. Cardiac Surgery files; 2007.
22. Stulak J.M., Dearani J.A., Danielson G.K. Surgical man-agement of Ebstein’s anomaly. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2007; 10: 105—111.
23. Leonard H., Derrick G., O’Sullivan J., Wren C. Natural and unnatural history of pulmonary atresia. Heart 2000; 84(5): 499—503.
24. Mair D.D., Puga F.J., Danielson G.K. The Fontan pro¬cedure for tricuspid atresia: early and late results of a 25-year experience with 216 patients. J Am Coll Cardiol 2001; 37(3): 933—939.
25. Подзолков В.П., Чиаурели М.Р., Зеленикин М.М и др. Непосредственные и среднеотдаленные результаты операции Фонтена в модификации экстракардиального кондуита. Грудная и сердечно-сосудистая хирургия 2005; 4: 10—13.
Атрезия трехстворчатого клапана. Принцип операции Фонтена
Атрезия трехстворчатого клапана
В нормально развитом сердце соединяет правое предсердие с правым желудочком. При атрезии этот клапан не развился и на его месте имеется плотная мембрана, через которую поток крови пройти никак не может. Поскольку этот участок закрыт, то у плода не развился и тоже отсутствует весь приточный отдел правого желудочка, т.е. первый из двух конусов, образующих желудочек. Таким образом, измененным оказывается не только клапан, но и весь правый желудочек — у него отсутствует половина.
Однако, и плод, и родившийся ребенок могут с этим жить, во всяком случае, какое-то время. Шунтирование крови и ее смешивание в сердце происходит через дефекты в перегородках.
Из полых вен кровь попадает в нормальное правое предсердие. Но вход в желудочек — закрыт. Остается один путь: сквозь дефект межпредсердной перегородки — в левое предсердие. Затем через нормально развитый митральный клапан кровь поступает в левый желудочек. А вот здесь открыто два пути. Один — в аорту, другой — через дефект межжелудочковой перегородки — в оставшуюся часть правого желудочка (второй из конусов, который нормально развит) и отсюда — в легочную артерию и легкие.
Потоки крови в левом желудочке смешиваются — венозная кровь из полых вен, достигшая желудочка таким сложным путем, смешивается с артериальной кровью, пришедшей из вен легких.
Путь дальнейшего ее «распределения» зависит от того, куда легче идти основному потоку: в аорту или через дефект межжелудочковой перегородки — в легочную артерию и легкие. Кровь так и разделяется на два рукава, и разница в объеме двух потоков зависит от разницы сопротивления сосудов тела (т.е. большого круга кровообращения) и сопротивления, создаваемого дефектом перегородки.
В большинстве случаев существенно больший объем крови проходит в аорту и меньший — в легкие. Во-первых, значительная часть крови остается недонасыщенной, и у ребенка будет цианоз. Степень этого цианоза, однако, не столь выражена, как при полной транспозиции магистральных сосудов — ведь в желудочке все-таки происходит смешение артериальной и венозной крови. А, во-вторых, левый желудочек работает на оба круга, т.к. правого почти нет. Нагрузка, которая выпала на его долю — тяжелая, и очень она может быстро вызвать недостаточность кровообращения в большом круге — одышку, увеличение печени, отеки и т.д.
В сущности, и качество, и продолжительность жизни таких детей зависит от величины кровотока в легких, т.е. определяется размером дефектов в межжелудочковой и межпредсердной перегородках — этих, в данном случае, естественных шунтов «во спасение».
Со временем, по мере роста ребенка (и сердца) положение ухудшается, т.к. в легкие идет все меньше крови. Нарастает цианоз и около 90% детей не доживут до своего первого дня рождения, если им не оказать хирургическую помощь.
Оставшиеся 10% имеют достаточно большой дефект в перегородке, и кровоток в легкие у них нормальный, а иногда даже и усиленный. Они чувствуют себя неплохо, относительно нормально развиваются и почти не синюшные. Такие дети могут прожить более 10-15 лет, но у них постепенно будут развиваться признаки сердечной недостаточности и нарастать цианоз со всеми его осложнениями и последствиями.
Что же может быть сделано и — когда?
В лечении атрезии трехстворчатого клапана хирургия, особенно за последние два десятилетия, добилась значительных успехов и тактика лечения, выбор операции и времени ее проведения сегодня разработаны достаточно, чтобы добиться убедительных хороших результатов. Но нужно понимать, что, если у сердца изначально не было одного из четырех клапанов и большого участка одного из желудочков, то их сделать заново нельзя. Таких методов пока нет.
Поэтому весь процесс лечения сведется к созданию иных, более оптимальных путей для кровотока. Другими словами, лечение будет облегчающим, «паллиативным», и его нельзя выполнить в один раз, а надо постепенно готовить и сердце, и легкие к новым, более нормальным условиям кровотока, чем те, в которых они оказались при рождении.
Детям с выраженным цианозом в течение первых месяцев надо сделать операцию наложения анастомоза между большим и малым кругами кровообращения, как это описано для тетрады Фалло. Эта операция значительно улучшит их состояние на первых порах. Они начнут развиваться, будут выглядеть и вести себя соответственно возрасту, пройдет синюшность.
Но это — только первый, «жизнеспасающий» этап. Если больше ничего не делать, ребенок скоро снова станет очень больным и, чем хуже будет его состояние, тем более рискованными будут последующие этапы лечения.
Между первым и вторым годом жизни становится возможным выполнение второго этапа, а именно, снятие первого анастомоза и создание другого пути для венозной крови в легкие — прямое соединение верхней полой вены с легочной артерией, в обход правой половины сердца. Почему этого не делают сразу? Дело в том, что в первые месяцы жизни сопротивление сосудистого русла легких может оказаться слишком высоким. Подумайте, ведь давление в венах очень низкое — 5-7 мм ртутного столба, а мы хотим, чтобы оно было достаточным, чтобы без сердечного «насоса» кровь пассивно текла в легочную артерию. Для этого между венами и сосудами легких должна быть разница в сопротивлении и давлении, иначе кровь в легкие просто не потечет.
Бывают ситуации, и их довольно много, когда мы выполняем эту операцию — двунаправленный кавапульмональный анастомоз на первом году жизни, без ранее выполненного системно-легочного анастомоза. Данное клиническое решение принимает Ваш кардиолог и кардиохирург, вырабатывая таким образом наилучшую тактику лечения Вашего ребенка.
Дети обычно хорошо переносят операцию. Эта операция не только улучшит состояние ребенка, но и подготовит сердце и сосуды легких к третьей, заключительной стадии в процессе лечения — соединения нижней полой вены с легочной артерией.
Наилучшим моментом для выполнения третьей операции будет возраст 4-5 лет, хотя иногда ее делают и раньше этого срока.
Эта операция делается с искусственным кровообращением и заключается во вшивании большой заплаты или протеза в нижнюю полую вену одним концом и в легочную артерию — другим. Таким образом, теперь вся венозная кровь от всего организма идет в легкие, а окисленная в полном объеме — в левые отделы сердца, т.е. в его теперь единственный желудочек.
Эту операцию называют операцией Фонтена — по имени французского хирурга, который ее предложил.
Сегодня ее применяют не только при , но и при многих сложных врожденных пороках, когда хирургическое создание двух равноценных желудочков невозможно. Эта операция произвела революцию в лечении пороков, которые совсем недавно считались неоперабельными . Больным с такими пороками просто отказывали даже в самых лучших кардиоцентрах. Сегодня все изменилось, и благодаря операции Фонтена можно помочь и уже помогли тысячам больных. Сам принцип такого подхода — принцип Фонтена — однако, всего лишь паллиация, пусть и хорошо функционирующая. Операция Фонтена, т.е. заключительный этап хирургического лечения нельзя назвать «радикальной коррекцией» (как, например, при закрытии дефекта межпредсердной перегородки), к ней больше подходит название «постоянной паллиации», т.е. это не исправление порока, а последняя возможность максимальной в данном случае нормализации кровообращения. Человек живет без правого желудочка, а кровь пассивно течет в легкие из венозной системы. Здоров ли этот человек? Может ли он переносить те физические и психологические нагрузки, которые ожидают его в жизни? О том, что сегодня известно об этом, мы поговорим немного ниже, а сейчас вернемся к .
В каждом случае надо выбрать наиболее рациональный и безопасный способ помощи. Иногда следует вначале расширить межпредсердный дефект в рентгенохирургическом кабинете, иногда — наложить манжетку на легочный ствол, чтобы уменьшить легочный кровоток и предупредить развитие других осложнений. Сегодня все эти методы хорошо известны, но тактика лечения и последовательность — индивидуальны. Главное, чтобы ребенок сразу попал в специализированное учреждение, где есть соответствующий опыт.
Сможет ли ребенок долго и нормально жить, не имея одной из частей сердца — правого желудочка? Оказывается, сможет, и долго, и совсем неплохо. Сегодняшняя статистика говорит о том, что подавляющее большинство больных, живущих с «фонтеновским кровообращением», относятся к так называемому функциональному классу I-II степени, т.е. практически здоровы. Примерно четверти из них, оперированных 10 и более лет назад, потребовались повторные операции по замене ранее вшитых протезов, но сегодня по мере совершенствования техники операции, можно надеяться, что число таких случаев значительно уменьшится.
Главным осложнением в отдаленные сроки после операции является так называемая , выражающаяся в отеках, скоплении жидкости в полостях, потере белка. Оно поддается консервативному лечению. Так что будем оптимистами.
Понятно, что ребенок должен постоянно (минимум раз в полгода) наблюдаться у детского кардиолога, даже если нет видимых осложнений. Ребенок - не инвалид ни в коем случае, но наблюдать его должен квалифицированный и опытный врач.
В любом случае, вашему ребенку со сложнейшим ВПС было сделано все, что может предложить современная медицина, и это — такая же победа врачей, как и ваша.
Результаты операции
Вопрос о результатах операции волнует вас больше всего. Он тесно связан с вопросом: «А надо ли, стоит ли ее делать?». Вполне возможно, что вы столкнетесь с мнением: «Не ходите никуда, все равно ребенок будет инвалидом».
Здесь мы затронем вопросы, о которых всегда задумываются при лечении врожденных пороков, и не только — сердца. И попробуем доказать: сегодня лечить, оперировать врожденные пороки сердца можно и нужно.
Понятно, что в каждом конкретном случае, в каждой ситуации результаты могут быть разными. Но давайте сначала поговорим не об отдельных пороках, а о результатах в целом (и результаты эти во многом зависят и от вашего отношения к проблеме!).
Будем исходить из того, что сегодня в развитых странах мира ожидаемая продолжительность человеческой жизни равняется 70 годам. Мы нередко видим стариков 75-80 лет, и очень редко — 90-летних. Но, увы, мы часто теряем друзей и близких, которые уходят в 45-50 лет. И это — люди, не имевшие никаких врожденных пороков сердца, родившиеся совершенно здоровыми. Мы не будем касаться здесь причин ранней смертности — они многообразны и часто не имеют никаких объективных оправданий.
В хирургии принято оценивать результаты как ближайшие, средней продолжительности времени после операции и отдаленные.
Ближайшие — это как ребенок чувствует себя к моменту выписки из клиники, в каком состоянии он уходит домой. Средний период — это время от нескольких месяцев после операции — до 2-5 лет, а отдаленный — 5-10 и более лет. Такой разброс в годах наблюдения связан с отсутствием единого стандартного определения длительности каждого периода. Возможно, что оно и условно: скажем, почему пять лет, а не три года? Но даже такая оценка позволяет каким-то образом сравнивать результаты операций при разных пороках в разных лечебных учреждениях между собой и делать соответствующие выводы.
О хирургии
Слово «хирургия» впервые было применимо в I веке нашей эры римским врачом и ученым Корнелиусом Цэльсом. Этим словом обозначались способы лечения, требующие со стороны врача активных, агрессивных действий, чтобы помочь больному или - что было тогда гораздо чаще — раненому.
Как ни странно это сегодня звучит, но в течение многих веков хирурги не считались врачами. Они были объединены в одну ремесленную гильдию с парикмахерами. Только в XVII веке, т.е. всего немногим более трех веков назад, врачебная и хирургическая профессии соединились.
На протяжении веков уделом хирургии оставалось зашивание ран, лечение переломов, удаление зубов и видимых глазу опухолей. Только в конце XIX века, то есть совсем уж недавно, хирургия освоила такие операции, как удаление аппендикса или желчного пузыря, или устранение паховой грыжи, да и то достаточно безопасно это стало лишь в середине прошлого века. Мы и здесь постоянно говорим: «удаление», «зашивание». Львиную долю хирургической деятельности в общей хирургии, в урологии, гинекологии, онкологии занимают резекция, ампутация, экстирпация (то есть частичное или полное удаление органа). И, когда мы говорим о полном удалении опухоли или органа, пораженного болезнью, слово «радикальная» операция вполне применимо и правильно. К счастью, организм человека создан с огромным запасом прочности. Человек может вполне прожить долгую благополучную жизнь без аппендикса, желчного пузыря, одной почки, селезенки, без двух третей желудка, половины печени, значительной части тонкой и толстой кишки, одного легкого. Организм достаточно легко компенсирует отсутствие отдельного или одного из парных органов за счет того, что их функцию берет на себя оставшийся орган или его часть.
Паллиативные операции
Теперь поговорим об операциях не радикальных, а паллиативных, т.е. вспомогательных. Если мы скроем гнойник, выпустим гной, но не удалим источник, первопричину его образования, будь то заноза, воспалившийся ноготь или закупоренная кожная пора, у больного пройдет боль, снизится температура, но, когда все «заживет», гнойник образуется снова. В данном случае паллиативная операция — устранение боли, но не причины, ее вызвавшей.
В сегодняшней хирургии, особенно онкологии, паллиативные операции делаются тогда, когда убрать опухоль, т.е. сделать радикальную операцию — невозможно, т.е. опухоль проросла все окружающие ее ткани. Но можно, путем сшивания незатронутых процессом участков, например, кишечника или удаления жидкости из черепной коробки — уменьшить боль, снять симптомы и облегчить страдания больного, хотя дни его сочтены. Так что паллиация в таких случаях — это временная помощь.
В хирургии сердца это понятие имеет совершенно другой смысл, хотя слово — одно и то же. Хирургия сердца потому и стала истинным флагманом медицинской науки в конце двадцатого века, что она впервые предложила два принципиально новых пути. Первый — это операции внутри органа с целью прямого устранения имеющегося порока и второй, может быть, даже более важный, — искусственное создание другого порока, который облегчает больному сердцу осуществление его главной задачи — постоянную и полноценную доставку окисленной в легких крови ко всем органам и тканям организма в достаточном количестве. Ведь именно это нарушается при врожденных пороках и, в конечном счете, не так уж важно, какой ценой и каким образом это будет сделано.
В отличие от паллиации в других областях хирургии, у нас ситуация иная — хотя основной порок сердца остался, состояние ребенка улучшилось сразу и настолько, что мы даже иногда сомневаемся, надо ли лечиться дальше. Почему мы так детально говорим об этом?
Дело в том, что, как вы уже могли обратить внимание, хирургическое лечение наиболее сложных пороков сердца, даже сделанное в 2-3 этапа, не заканчивается, как хотелось бы, полным, идеальным восстановлением структуры обоих желудочков сердца, обоих магистральных сосудов, а направлено на нормализацию кровообращения в обоих кругах, и является, по сути дела, паллиативным в широком смысле этого слова. Однако пусть оно вас не пугает: результат, а значит, и качество жизни ребенка может быть отличным и стабильным в течение многих лет. Вместе с тем, наблюдение в специализированном учреждении — абсолютно необходимое условие. Почему?
Возможные осложнения, связанные с техническим выполнением самой операции — раннего закрытия созданного анастомоза, плохой его функции, отрыва заплаты внутри сердца — должны быть быстро диагностированы и решены рано или поздно, в зависимости от их угрозы для жизни.
Радикальные операции
Радикальные операции, сделанные хорошо и вовремя, поздними осложнениями не сопровождаются. Ребенок должен нормально расти и развиваться и вести абсолютно такой же образ жизни, какой ведут его сверстники. Больше того, так называемая «инвалидность детства», которая дается ему по справкам лечащего врача на основании того, что ему в детстве была выполнена операция на сердце, является полным абсурдом. Ведь все, что ему делали, делали именно для того, чтобы сделать его нормальным членом общества. Такие справки и всякого рода ограничения и «освобождения» часто вырабатывают спекулятивное у ребенка отношение к окружающим и не сказывается положительно на формировании его характера и привычек.
Паллиативные операции, которые делаются как первый этап, подготовка к радикальному лечению (процедура Рашкинда при транспозиции, анастомозы при цианотических пороках, сужение легочной артерии при большом сбросе слева направо), имеют целью временное улучшение состояния ребенка и создание условий для проведения радикальной операции. Этот окончательный этап сделает ребенка здоровым и к нему полностью относится все, что сказано выше для первичных радикальных коррекций. Больные, оперированные в детстве, ведут нормальный образ жизни, учатся, работают, рожают детей и, возможно, за исключением профессионального спорта, им можно делать все.
Чем раньше в жизни сделаны операции, тем быстрее проходят и для вас, и для ребенка все последствия.
Паллиативные операции, окончательной целью и возможностью которых является изменение условий кровообращения, стоят особняком. Больные после операции Фонтена как окончательной паллиации живут без правого желудочка вообще. Это — люди с единственным, левым, желудочком, и даже после отлично и вовремя сделанных всех этапов хирургического лечения все-таки абсолютно здоровыми не являются. Они постоянно должны принимать медикаменты, следить за здоровьем и наблюдаться у специалистов. Это не значит, что они не могут стать совершенно полноценными членами общества, но их выбор занятий и в детстве, и в отрочестве должен быть абсолютно индивидуальным: для каждого - свой, и предусматривать возможные ограничения физических нагрузок. Впрочем, в обществе достаточно занятий, где нагрузки особенно и не нужны. Надо только быть готовым к этому психологически, без трагедий, и точно понимать собственные возможности.
В любом случае, если речь идет о таком плановом двух- или трехэтапном лечении, вам объяснят, когда, как и почему его необходимо делать, в какие сроки, чтобы не упустить наилучший для ребенка момент, и — в каких лечебных центрах. Не стесняйтесь все это узнать. Просто опыт в крупных учреждениях может быть большим, а результаты - лучшими. Мы хотим заверить вас, что при точном выполнении всего комплекса лечебных и хирургических мер ваш ребенок, несмотря на предстоящее, поправится и будет расти и доставлять вам много радости.
Повторная операция
Повторная операция — это немного другое. По сути, это такая же операция, которая была сделана раньше, но по каким-то причинам сердце уже не в состоянии справляться с теми задачами, которые возникаю перед ним для выполнения своей неустанной и непрерывной работы, а эти причины хирургически вполне устранимы. Определение довольно широкое, но и повторные операции производятся по самому разнообразному поводу. Сюда входят и сужение ранее наложенных анастомозов, и частичный отрыв внутрисердечных заплат с возникновением нового шунта, и другие осложнения, связанные с самой техникой операции. Такие осложнения выявляются довольно скоро и вполне устранимы.
Но есть и другая группа операций, о которых нам хотелось бы поговорить. Это особенно касается пороков, частью которых является нарушение строения клапанов, пороков, при которых операция требует вшивания синтетических трубок — так называемых кондуитов, пороков, для коррекции которых требуется нанесение большой травмы внутрисердечным структурам.
Обычно, после первых коррегирующих операций, как правило, очень сложных, проходят годы. В течение этих лет дети растут, развиваются и, конечно, меняются. Вы регулярно показываете их кардиологам и, в одно из таких посещений вам могут сказать, что увеличился шум, или вырос градиент давления, или появился сброс. Не нужно впадать в панику и думать, что вам ужасно не повезло. Некоторые вещи, к сожалению, часты и закономерны.
Начнем с клапанов. Как мы уже говорили в разделе о строении сердца, и предсердно-желудочковые, и полулунные клапаны аорты и легочной артерии — нежнейшие и тончайшие структуры.
У детей грудного возраста они очень прочны, но прозрачны, как крылья бабочки, если пыльца на них стерлась.
Стенки магистральных сосудов — аорты и легочной артерии — тонкие, мягкие, эластичные трубочки, тоже почти прозрачные. Через створки их клапанов просвечивает стенка сосуда, в просвете которой они находятся. Даже тончайшие швы, которые должен наложить хирург, выглядят в сравнении с их структурой, как швартовые канаты. Но других пока — нет.
Эти швы, узлы, заплатки останутся внутри сердца навсегда. Через 2-3 недели после операции они покроются тонким слоем собственных клеток ребенка, и их станет почти невозможно увидеть глазом. Даже внутрисердечно вшитые заплаты, которые сегодня делают из синтетических или биологических материалов, через месяц вживаются в ткани сердца. Но ребенок растет, а вместе с ним сердце и его структуры увеличиваются в размерах. Участки, где наложены швы и заплатки, могут не успевать за этим ростом, и снова создавать препятствие кровотоку, или начать пропускать струйку крови, которая будет отрывать заплату все дальше, увеличивая отверстие и — сброс через него.
Все это может тянуться годами и не требовать никаких агрессивных, хирургических мероприятий, но может и стать большой помехой для нормальной жизни ребенка. Такая ситуация может потребовать повторной операции, показания к которой следует точно взвесить и подробно обсудить с кардиологами и кардиохирургами. Мы говорим пока о случаях, которые могут быть, но вероятность их невелика.
Мы говорим о результатах длительного, многолетнего наблюдения за больными, которым в раннем детстве были сделаны операции по поводу коарктации аорты, атрио-вентрикулярных коммуникаций, дефектов перегородок. Сегодня многие из осложнений, которые не так давно можно было устранить только повторной операцией, достаточно просто излечиваются рентгенохирургическими методами, т.е. закрытыми, позволяющими ее избежать.
Результаты экстренных операций
Но что делать, когда первая операция была экстренной, спасшей жизнь ребенка, устраняя смертельно опасное нарушение? Ведь нет ни времени, ни возможностей предусмотреть то, что будет потом, через несколько месяцев или, тем более, лет. Такая ситуация возникает при критических состояниях, вызванных пороками сердца.
В результате экстренного устранения, например, стенозов аортальных клапанов или клапанов легочной артерии, их створки, неправильно развитые первоначально, не приобретают нормальное строение, а лишь будут рассечены, чтобы срочно создать нужной величины отверстие для кровотока. Понятно, что в таких случаях повторная операция, скорее всего, будет необходимой рано или поздно. Вот мы подошли еще к одному очень важному вопросу, касающемуся повторных операций и их необходимости при некоторых пороках.
Наша жизнь, жизнь во времени — это процесс старения. В сущности, человек сразу после рождения начинает стареть. Он уже никогда не будет таким, как неделю назад. Стареет все в природе, кроме бегущего времени. Стареют камни, ледники, пустыни… И в организме человека процессы созревания и старения происходят непрерывно. В первые четверть века организм человека созревает, и это выражается не только в увеличении его роста — выше и выше — но и в развитии всех органов и тканей, увеличении их массы и размеров.
Период созревания достаточно короток, но обменные процессы идут с огромной интенсивностью и скоростью. Они, в том числе, очень агрессивно относятся к любым искусственным тканям и устройствам, которые по каким либо причинам оказались внутри организма.
Поэтому любой чужой протез или клапан, помещенный в кровоток, во время операции, будет подвергнут разрушению в растущем организма гораздо быстрее, чем это происходит при такой же операции у взрослого.
Механизмы этого разрушения — различны. Это может быть и постоянное зарастание клапанного отверстия, и сужение области ранее идеально наложенных швов, и закупорка синтетического протеза.
Какой бы ни была технически совершенной операция, сделанное ею было искусственно, и организм это понимает.
Поэтому детские кардиохирурги всегда стремятся по возможности избегать применения синтетических протезов, механических или биологических клапанов в периоде роста ребенка, особенно в раннем детском возрасте. Дело не только в размерах, которые неизбежно изменятся - дело в ускоренном процессе их разрушения.
Сегодня при таких ситуациях потребность в повторных операциях очевидна, и вам об этом обязательно скажут. Но наука движется вперед и приближается время, когда станет абсолютно реальным создание внутрисердечных протезов, клапанов и заплат, покрытых изнутри клетками самого ребенка. Тогда они могут работать всю жизнь, не подвергаясь разрушению, и это - устранит сегодняшнюю неизбежность многих повторных операций при ВПС.
Вернемся теперь к самому началу. Чего ожидать в конечном счете? Только хорошего. Не знаю, убедили ли мы вас или нет, но мы хотим, чтобы вы поняли: сегодня сам факт рождения и жизни ребенка, имевшего врожденный порок сердца, при условии своевременного оказания ему современной медицинской и хирургической помощи никаким образом не влияет на ожидаемую продолжительность жизни. Иными словами, он может и должен прожить длинную полноценную жизнь и уже от вас во многом зависит, будет ли эта жизнь радостной и счастливой.
Читайте также:
