Ведение больных с миастенией. Миастенический криз. Лечение миастенического криза.
Добавил пользователь Валентин П. Обновлено: 28.01.2026
ГКБ №51, Московский миастенический центр
Эффективность и целесообразность внутривенного введения человеческого иммуноглобулина в патогенетической терапии больных с генерализованной миастенией
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2011;111(6): 29‑32
Санадзе А.Г. Эффективность и целесообразность внутривенного введения человеческого иммуноглобулина в патогенетической терапии больных с генерализованной миастенией. Журнал неврологии и психиатрии им. С.С. Корсакова. 2011;111(6):29‑32.
Sanadze AG. Efficacy and practicability of using intravenous human immunoglobulin in the pathogenetic treatment of patients with generalized myasthenia. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2011;111(6):29‑32. (In Russ.).
Обследовали 12 пациентов с генерализованной миастенией. Терапия иммуноглобулином (IgG) привела к клиническому улучшению и практически не вызвала побочных эффектов. Наибольшая эффективность отмечалась у больных с угрозой или развившимся смешанным кризом, получавших высокие дозы IgG (0,4-0,5 г на 1 кг массы тела) в виде курса из 3-5 внутривенных капельных вливаний на фоне базисной терапии глюкокортикоидными и иммуносупрессорными препаратами. У пациентов, получавших IgG однократно и в меньших дозах (0,2-0,3 г на 1 кг массы тела) с целью стабилизации течения заболевания или ускорения выхода из периода обострения, клинический эффект был столь же отчетлив, но менее продолжителен. Проведенный курс IgG купировал миастенические кризы во всех случаях. Клиническая эффективность IgG не коррелировала с уровнем аутоантител к ацетилхолиновому рецептору.
Известно, что комплексное патогенетическое лечение больных миастенией, включающее высокие дозы глюкокортикоидных [1, 2, 4, 11, 20, 21] и иммуносупрессорных [3, 8, 16] препаратов, методы экстракорпоральной коррекции [4, 18] и хирургическое удаление вилочковой железы [2, 3, 10], приводит к улучшению состояния у 60-80% пациентов. Вместе с тем остается группа больных, у которых эффективность указанных выше методов лечения недостаточна. Эта «резистентная» группа неоднородна, в нее могут входить как пациенты с генерализованной миастенией, сочетающейся с тимомой, так и больные без образований тимуса с наличием или отсутствием антител к ацетилхолиновому рецептору и мышечной специфической тирозинкиназе [2, 3, 13]. Основной особенностью данной группы больных является склонность к часто повторяющимся смешанным кризам - тяжелым состояниям, проявляющимся нарушением витальных функций [1, 13].
Эффективным методом лечения кризов у больных миастенией явилось внутривенное введение высоких доз человеческого иммуноглобулина [6, 7, 18]. Опыт применения иммуноглобулинов в лечении аутоиммунных заболеваний, к которым относится и миастения, насчитывает 30 лет [15, 17]. Известно, что направленность действия различных видов патогенетического лечения на клеточный и гуморальный иммунитет существенно различается [3, 5]. Введение глюкокортикоидных препаратов приводит к уменьшению синтеза антител к ацетилхолиновым рецепторам (АХР) и ингибированию специфической CD4+ T-клеточной пролиферации [5, 16]. Помимо этого, высокие дозы глюкокортикоидных препаратов оказывают влияние непосредственно на процессы освобождения медиатора из терминали аксона [11]. Иммуносупрессоры ингибируют Т-клеточную реактивность [8, 15]. Применение иммуноглобулинов приводит к 1) конкуренции иммуноглобулинов с антителами к АХР за связывание с последними; 2) предотвращению взаимодействия Fc-положительных воспалительных клеток с Т- и В-лимфоцитами; 3) уменьшению синтеза антител к АХР [6, 7, 12, 13].
Учитывая, что терапевтический эффект иммуноглобулинов обусловлен нейтрализацией циркулирующих аутоантител, созданием конкуренции за места связывания с рецептором и уменьшением воспроизводства антител посредством влияния на активность В-клеток, существенный теоретический и практический интерес представляет выявление корреляции между эффективностью лечения и уровнем аутоантител к АХР.
Целью исследования явилось изучение эффективности лечения и определения тактической целесообразности использования высоких доз человеческого иммуноглобулина для внутривенного введения на разных этапах течения болезни у больных с тяжелой генерализованной миастенией.
Материал и методы
Обследовали 12 больных (4 мужчин, 8 женщин) с генерализованной миастенией в возрасте от 11 до 65 лет. Длительность болезни колебалась от 4 мес до 14 лет. Диагноз миастении подтверждался данными клинического исследования, электрофизиологическим тестированием нервно-мышечной передачи (декремент-тест) [9], тестом с введением прозерина и выявлением повышенного уровня аутоантител к ацетилхолиновому рецептору (у 2 пациентов выявлена серонегативная форма миастении). Все больные обследованы на фоне неизменной базовой терапии, включающей прием антихолинэстеразных, глюкокортикоидных и иммуносупрессорных препаратов, до и через 10 дней после внутривенного введения человеческого иммуноглобулина. Причиной, потребовавшей данного вмешательства, у 5 пациентов явилось развитие смешанного криза, у 2 - состояния, предшествующего кризу, и у 5 - стабильно тяжелого состояния, не изменяющегося на фоне длительного лечения.
7 больных получали препарат человеческого иммуноглобулина интратект в суммарной дозе 40-80 г - по 3-5 внутривенных капельных вливаний в дозе 0,4 г на 1 кг массы тела.
5 пациентов получали препараты интратект и интраглобин в суммарной дозе 10-20 г в виде 1-2 внутривенных капельных вливаний в дозе 0,2 г на 1 кг массы тела.
Для оценки эффективности лечения использовали количественную шкалу двигательных расстройств у больных генерализованной миастенией (QMGS). Диапазон шкалы составляет от 0 (отсутствие глазодвигательных и бульбарных нарушений, а также мышечной слабости - полная ремиссия) до максимально возможных 39 баллов (наибольшая выраженность глазодвигательных и бульбарных нарушений, а также мышечной слабости). Разница в балльной оценке до и после введения иммуноглобулина являлась отражением эффективности лечения.
Тяжесть клинических проявлений миастении оценивалась по 5-балльной шкале Международной клинической классификации (MGFA). Cтепень тяжести заболевания по данной шкале варьирует от группы I (изолированная слабость глазных мышц) до V (кризисные состояния). Изменение группы тяжести миастенических нарушений по MGFA также определяло эффективность терапии.
Концентрацию антител к АХР определяли радиоиммунологическим методом с помощью коммерческой тест-системы (DLD Diagnostika, Германия). Образцы сыворотки хранили при -20 °С. Перед анализом их размораживали, отбирали аликвоты по 5 мкл и помещали в пробирки. К пробам добавляли по 100 мкл 125 I-рецептора ацетилхолина (удельная активность - 342 Ci/ммоль), 50 мкл антител к IgG человека, перемешивали и инкубировали в течение 30 мин при комнатной температуре. Затем добавляли по 1 мл промывочного буфера, центрифугировали при 3000 g в течение 20 мин, надосадочную жидкость удаляли декантацией. Полученный осадок ресуспензировали и повторяли процедуру промывки. Определяли радиоактивность проб и вычисляли концентрацию антител, выражаемую в нмоль/л по формуле с использованием фактора, учитывающего дату изготовления набора и удельную активность метки, радиоактивность пробы и негативного контроля. Повышенным титром антител к АХР являлось значение, превышающее 0,50 нмоль/л.
Результаты и обсуждение
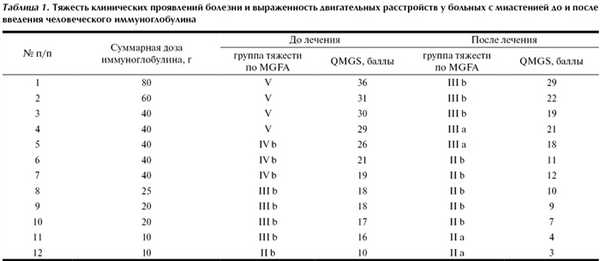
Сравнительный анализ изменений клинических показателей по QMGS и MGFA до и после введения иммуноглобулина представлен в табл. 1. Как видно из представленных данных, введение иммуноглобулина уменьшало тяжесть клинических проявлений миастении и двигательных расстройств у всех обследованных.
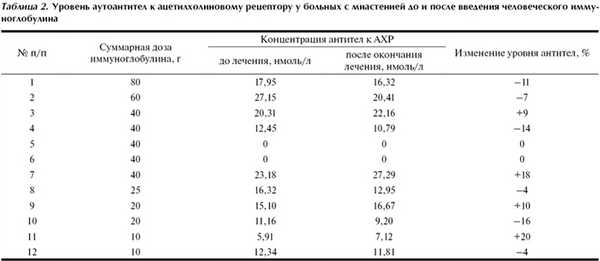
Динамика уровня антител к АХР представлена в табл. 2. Как видно из полученных результатов, у больных отмечались весьма незначительные и разнонаправленные изменения уровня аутоантител до и после введения иммуноглобулина.
Таким образом, улучшение состояния больных, определяемое динамикой тяжести клинических проявлений болезни и уменьшением выраженности двигательных нарушений, не коррелирует с уменьшением уровня аутоантител к АХР.
Незначительные побочные эффекты введения иммуноглобулина отмечались лишь у 3 пациентов и выражались в виде вегетативных пароксизмов (колебания артериального давления, несистемные головокружения, тошнота), не требовавших медикаментозной коррекции, и были, как правило, связаны с большой скоростью внутривенного введения препарата.
Результаты проведенных исследований позволяют не только обсудить механизмы патогенетической терапии, но и определить место человеческого иммуноглобулина для внутривенного введения в стратегии и тактике лечения миастении.
В основе патогенеза миастении лежит комплемент-опосредованный лизис постсинаптической мембраны, а также антиген-зависимое разрушение рецепторов посредством образования клеточных инфильтратов [3-5, 21]. Последние содержат аутоагрессивные Т-клетки, являющиеся специфичными для АХР и рецептора постсинаптической мембраны (PsmR/β-бунгаротоксинсвязывающий протеин). АХР и PsmR стимулируют СD8+ Т-клетки и индуцируют секрецию цитокинов IFNγ и IL4, а также фактора роста TGF . Мембранолитические (C5b-9) и иммунные комплексы способствуют процессу локального воспаления [5, 6, 14, 21].
Вместе с тем клиническое улучшение при миастении на фоне применения иммуноглобулинов, выявленное как в данном исследовании, так и другими авторами, не коррелирует с динамикой титра антител к АХР [12, 14]. Клинический эффект наиболее отчетливо ассоциируется со способностью АХР к связыванию с α-бунгаротоксином [14], вероятно, из-за улучшения функционального состояния ионных каналов и исчезновения эффекта десенситизации холинорецепторов.
Преимущество иммуноглобулинов перед традиционно применяемыми в лечении миастении препаратами состоит в быстром и эффективном восстанавлении жизненно важных функций у больных в период развития кризов [1, 19, 22, 23]. Кроме того, проведенное исследование показало целесообразность введения даже минимальных доз иммуноглобулина для коррекции ухудшения состояния на фоне адекватной базисной терапии, что открывает широкие перспективы для его применения у большего числа больных.
Миастения
Миастения - это аутоиммунное заболевание, вызывающее слабость мышц из-за нарушения в работе нервно-мышечной передачи. Чаще всего нарушается работа мышц глаз, лицевых и жевательных мышц, иногда - дыхательной мускулатуры. Это определяет характерные для миастении симптомы: опущение нижнего века, гнусавость голоса, нарушения глотания и жевания. Диагноз миастении устанавливается после прозериновой пробы и анализа крови на наличие антител к рецепторам постсинаптической мембраны. Специфическое лечение миастении заключается в назначении антихолинэстеразных препаратов, таких как амбенония хлорид или пиридостигмин. Эти средства восстанавливают нервно-мышечную передачу.
Общие сведения
Миастенией (или ложным/астеническим бульбарным параличом, или болезнью Эрба-Гольдфлама) называют заболевание, основным проявлением которого является быстрая (болезненно быстрая) утомляемость мышц. Миастения - это абсолютно классическое аутоиммунное заболевание, при котором клетки иммунной системы, по той или иной причине уничтожают другие клетки собственного же организма. Такое явление можно считать обычной реакцией иммунитета, только направлена она не на чужеродные клетки, а на свои.
Патологическая утомляемость мышц была описана клиницистами в середине XVI века. С тех пор заболеваемость миастенией стремительно растет и выявляется у 6-7 человек на каждые 100 тыс. населения. Женщины болеют миастенией в три раза чаще мужчин. Самое большое количество случаев развития заболевания наблюдается у людей в возрасте от 20 до 40 лет, хотя болезнь может развиться в любом возрасте или быть врожденной.
Причины миастении
Врожденная миастения является следствием генной мутации, из-за которой нервно-мышечные синапсы не могут нормально функционировать (такие синапсы - это что-то вроде "переходников", которые позволяют нерву взаимодействовать с мышцей). Приобретенная миастения встречается чаще врожденной, но легче поддается лечению. Существует несколько факторов, которые при определенных условиях могут стать причиной развития миастении. Наиболее часто патологическая мышечная утомляемость формируется на фоне опухолей и доброкачественной гиперплазии (разрастания тканей) вилочковой железы - тимомегалии. Реже причиной возникновения болезни становятся другие аутоиммунные патологии, например - дерматомиозит или склеродермия.
Описано достаточно случаев выявления миастенической слабости мышц у больных с онкологическими заболеваниями, например, с опухолями половых органов (яичников, предстательной железы), реже - легких, печени и др.
Как уже упоминалось, миастения - это заболевание аутоиммунной природы. Механизм развития болезни основан на выработке организмом антител к белкам-рецепторам, которые находятся на постсинаптической мембране синапсов, осуществляющих нервно-мышечную передачу.
Схематически это можно описать так: отросток нейрона имеет проницаемую мембрану, через которую могут проникать специфические вещества - медиаторы. Они нужны для передачи импульса от нервной клетки к мышечной, на которой есть рецепторы. Последние на мышечных клетках теряют способность связывать медиатор ацетилхолин, нервно-мышечная передача значительно затрудняется. Именно это и происходит при миастении: антитела разрушают рецепторы на "второй стороне" контакта между нервом и мышцей.
Симптомы миастении
Миастению называют "ложным бульбарным параличом" из-за того, что симптомы этих двух патологий действительно похожи. Бульбарный паралич - это повреждение ядер трех черепно-мозговых нервов: языкоглоточного, блуждающего и подъязычного. Все эти ядра располагаются в продолговатом мозге и их поражение крайне опасно. Как при бульбарном параличе, так и при миастении, возникает слабость жевательных, глоточных и лицевых мышц. В итоге это приводит к самому грозному проявлению - дисфагии, то есть нарушению глотания. Патологический процесс при миастении, как правило, первыми затрагивает мышцы лица и глаз, затем - губ, глотки и языка. При длительном прогрессировании заболевания развивается слабость дыхательных мышц и мышц шеи. В зависимости от того, какие группы мышечных волокон поражены, симптомы могут комбинироваться в разных вариантах. Есть и универсальные признаки миастении: изменение выраженности симптомов в течение дня; ухудшение состояния после длительного напряжения мышц.
При глазной форме миастении болезнь затрагивает только глазодвигательные мышцы, круговую мышцу глаза, мышцу, поднимающую верхнее веко. Как следствие, основными проявлениями будут: двоение в глазах, косоглазие, сложность в фокусировке взгляда; невозможность долго смотреть на объекты, расположенные очень далеко или очень близко. Кроме этого, почти всегда присутствует характерный симптом - птоз или опущение верхнего века. Особенность этого симптома при миастении заключается в том, что он появляется или усиливается к вечеру. Утром же его может не быть вовсе.
Патологическая утомляемость лицевой, жевательной мускулатуры и мышц, ответственных за речь, приводит к изменению голоса, трудностям с приемом пищи и речью. Голос у больных миастенией становится глухим, "носовым" (такая речь звучит примерно так же, как если бы человек просто говорил, зажав нос). При этом говорить очень тяжело: короткий разговор может настолько утомить больного, что ему необходимо будет несколько часов на восстановление. То же самое касается и слабости жевательных мышц. Жевание твердой пищи может оказаться для человека с миастенией физически непосильной задачей. Больные всегда стараются четко планировать время еды, чтобы принимать пищу в момент максимального действия принимаемых лекарств. Даже в периоды относительного улучшения самочувствия, больные предпочитают есть в первой половине дня, поскольку к вечеру симптомы усиливаются.
Поражение мышц глотки - более опасное состояние. Здесь проблема, напротив, состоит в невозможности принимать жидкую пищу. При попытке выпить что-то больные часто поперхиваются, а это чревато попаданием жидкости в дыхательные пути с развитием аспирационной пневмонии.
Все описанные симптомы заметно усиливаются после нагрузки на ту или иную группу мышц. Например, длительный разговор может стать причиной еще большей слабости, а жевание твердой пищи часто приводит к дополнительному ухудшению работы жевательных мышц.
И, наконец, несколько слов о самой опасной форме миастении - о генерализованной. Именно она обеспечивает стабильный 1% смертности среди больных данной патологией (за последние 50 лет показатель смертности снизился с 35% до 1%). Генерализованная форма может проявляться слабостью дыхательных мышц. Расстройство дыхания, которое возникает по этой причине, приводит к возникновению острой гипоксии и смерти, если больному вовремя не была оказана помощь.
Миастения со временем неуклонно прогрессирует. Темп ухудшения может существенно различаться у разных больных, возможно даже временное прекращение прогрессирования болезни (впрочем, это встречается достаточно редко). Ремиссии возможны: как правило, они возникают спонтанно и заканчиваются так же - "сами по себе". Обострения миастении могут носить эпизодический или длительный характер. Первый вариант называется миастеническим кризом, а второй - миастеническим состоянием. При кризе симптомы проходят достаточно быстро и полностью, то есть во время ремиссии никаких остаточных явлений не наблюдается. Миастеническое состояние - это длительно существующее обострение с наличием всех симптомов, которые, тем не менее, не прогрессируют. Продолжаться такое состояние может в течение нескольких лет.
Диагностика миастении
Наиболее показательное при миастении исследование, которое может дать неврологу массу информации о заболевании - это прозериновая проба. Прозерин блокирует работу фермента, расщепляющего ацетилхолин (медиатор) в пространстве синапса. Таким образом, количество медиатора увеличивается. Прозерин обладает очень мощным, но кратковременным эффектом, поэтому для лечения этот препарат почти не используется, а вот в процессе диагностики миастении прозерин необходим. При помощи последнего проводится несколько исследований. Сначала больного осматривают, чтобы оценить состояние мышц до пробы. После этого подкожно вводится прозерин. Следующий этап исследования производится через 30-40 минут после приема препарата. Врач повторно осматривает больного, выясняя тем самым реакцию организма.
Кроме того, подобная же схема применяется для электромиографии - регистрации электрической активности мышц. ЭМГ проводится дважды: до введения прозерина и через час после него. Исследование позволяет определить, действительно ли проблема заключается в нарушении нервно-мышечной передачи или нарушена функция изолированно мышцы или нерва. Если даже после ЭМГ остаются сомнения в природе заболевания, может понадобиться проведение ряда исследований проводящей способности нервов (электронейрографии).
Важно исследование анализа крови на наличие в ней специфических антител. Их обнаружение - достаточный повод для постановки диагноза миастении. При необходимости делают биохимический анализ крови (по индивидуальным показаниям).
Ценную информацию может дать компьютерная томография органов средостения. В силу того, что большой процент случаев миастении можно связать с объемными процессами в вилочковой железе, КТ средостения таким больным проводят достаточно часто.
В процессе диагностирования миастении необходимо исключить все прочие варианты - заболевания, которые имеют сходную симптоматику. В первую очередь это, конечно, уже описанный выше бульбарный синдром. Помимо этого, проводится дифференциальная диагностика с любыми воспалительными заболеваниями (энцефалит, менингит) и опухолевыми образованиями в области ствола мозга (глиома, гемангиобластома и др.), другой нейро-мышечной патологией (БАС, синдром Гийена, миопатии). В ряде случаев похожие на миастению симптомы может давать нарушение мозгового кровообращения (ишемический инсульт) в бассейне позвоночной артерии.
Лечение миастении
Цель лечения при миастении - увеличить количество ацетилхолина в нервно-мышечных синапсах. Это делается не путем увеличения синтеза этого вещества (это достаточно сложно), а путем угнетения его разрушения. Для этого в практической неврологии используются препараты из той же группы, в которую входит неостигмин. Для длительного лечения выбираются препараты другого типа: оптимальным вариантом здесь считается средство с мягким и длительным действием. Наиболее часто сейчас используются производные пиридостигмина и амбенония.
В случае тяжелого течения и стремительного прогрессирования болезни назначаются препараты, угнетающие иммунный ответ. Как правило, используют глюкокортикоиды, реже - классические иммунодепрессанты. При подборе стероидов всегда стоит проявлять максимальную осторожность. Больным с миастенией противопоказаны препараты, содержащие фтор, поэтому спектр лекарств для выбора оказывается не очень большим. Всем больным миастенией старше 69 лет проводится удаление вилочковой железы. Также к этому методу прибегают при обнаружении в тимусе объемного процесса и в случае резистентной к лечению миастении.
Препараты для симптоматического лечения подбираются индивидуально, исходя из особенностей каждого больного. Человек с миастенией должен соблюдать некоторые правила в своем образе жизни, чтобы ускорить выздоровление или продлить ремиссию. Не рекомендуется проводить слишком много времени под солнечными лучами и переносить излишние физические нагрузки. Перед тем, как самостоятельно начать принимать какое-либо лекарство, консультация с врачом абсолютно необходима. При миастении противопоказаны некоторые средства. К примеру, прием определенных антибиотиков, мочегонных средств, успокаивающих препаратов и лекарств, содержащих магний - последние могут значительно ухудшить состояние больного.
Прогноз и профилактика
Прогноз при миастении зависит от массы факторов: от формы, времени начала, типа течения, условий, пола, возраста, качества или наличия/отсутствия лечения и т. д. Легче всего протекает глазная форма миастении, тяжелее всего - генерализованная. На данный момент при строгом соблюдении рекомендаций врача почти все больные имеют благоприятный прогноз.
Так как миастения - это хроническое заболевание, то чаще всего больные вынуждены постоянно принимать лечение (курсами или непрерывно) для поддержания хорошего самочувствия, но качество их жизни от этого страдает не очень сильно. Очень важно своевременно диагностировать миастению и остановить ее прогрессирование до момента появления необратимых изменений.
Кризы при миастении
Кризы при миастении - это состояния острой декомпенсации патологии в виде пароксизмального нарушения витальных функций. Резкое усиление мышечной слабости сопровождается угнетением дыхания, бульбарными, сердечно-сосудистыми расстройствами. Чаще всего кризы сочетают в себе признаки миастенического и холинергического вариантов, что придает им более тяжелое течение. В диагностике используют клинические, лабораторные методы, электронейромиографию, КТ и МРТ органов грудной клетки. Неотложные состояния требуют ИВЛ, медикаментозной терапии, экстракорпоральной детоксикации, решения вопроса о хирургической коррекции.
МКБ-10
Кризы при миастении достаточно редки - в общей популяции регистрируется 50-400 случаев на 1 млн. населения. На протяжении жизни их испытывают 10-45% пациентов с мышечной слабостью, особенно в первые два года болезни. Ежегодный риск возникновения кризов находится в пределах 2-3%. Декомпенсация миастении может наступить в любом возрасте, но значительно чаще встречается среди людей 18-40 лет. В гендерной структуре пароксизмальных состояний практически пятикратное преимущество принадлежит женщинам репродуктивного периода. В пожилом возрасте существенно возрастает показатель распространенности среди мужчин, выравнивая соотношение с женщинами.
Причины кризов
Осложненное течение характерно для приобретенной генерализованной миастении или локальных форм, за исключением глазной. Хотя некоторые авторы указывают на роль наследственной предрасположенности, но врожденные варианты болезни крайне редко сопровождаются кризами. Возникновение тяжелой декомпенсации связано с рядом внешних и внутренних факторов. Значимыми триггерами выступают следующие состояния:
- Респираторные инфекции. Вирусные и бактериальные инфекции дыхательных путей являются наиболее распространенной причиной клинического ухудшения при миастении - на их долю приходится 30-70% случаев. Значение имеют как бронхолегочные заболевания, так и ОРВИ с поражением верхних отделов респираторного тракта. Отдельное место занимают аспирационная пневмония, сепсис.
- Операции. Частой причиной становятся оперативные вмешательства, выполняемые под общей анестезией, особенно тимэктомия. Декомпенсацию наблюдают при миастенических кризах в анамнезе, длительности заболевания свыше 3 месяцев, наличии бульбарных симптомов перед операцией. В зоне повышенного риска находятся пациенты, у которых экстубация была отложена более чем на 24 часа.
- Прием лекарств. Прямым или опосредованным влиянием на нервно-мышечную передачу обладают многие лекарства. Дебют миастении либо развитие криза могут провоцировать бензодиазепины, миорелаксанты, антидепрессанты. Так действуют антибиотики (аминогликозиды, макролиды, тетрациклины), йодсодержащие вещества, препараты магния. Важное значение имеет нарушение схемы приема кортикостероидов и антихолинэстеразных средств.
- Эндокринно-обменные нарушения. Миастения подвержена декомпенсации на фоне дисфункции щитовидной железы, сахарного диабета, ожирения. Риск кризов увеличивается вдвое при патологии тимуса (тимомах). Имеют значение гормональные сдвиги у женщин - при менструациях, климаксе, в период беременности, после родов. Усугубить мышечную слабость могут электролитные расстройства (гипокалиемия, гипофосфатемия).
Вероятность тяжелого пароксизмального течения увеличивается у пожилых людей с сопутствующей соматической патологией (гипертонической, ишемической болезнью), при травмах. Провоцирующим фактором могут стать тяжелые стрессовые ситуации, интенсивные физические нагрузки, перегревание. В группу риска попадают лица в возрасте до 18 и старше 60 лет, с ранней генерализацией миастении, длительно принимавшие антихолинэстеразные препараты. Более половины кризов ассоциируют с неправильным ведением пациентов, но в трети случаев явную причину определить не удается.
Патогенез
Основой патогенеза кризов при миастении является массивная аутоиммунная агрессия против структур мионеврального синапса. Патологический процесс сопровождается образованием антител к ацетилхолиновым рецепторам, белкам постсинаптической мембраны (MuSK, LRP4), что приводит к комплемент-связанной деструкции и резкому уменьшению их количества. В результате не происходит генерации потенциала действия на постсинаптической мембране, что проявляется курареподобным блоком нервно-мышечной проводимости.
Особый механизм развития присущ холинергическому кризу. Генез моторных и вегетативных расстройств связан с гиперполяризацией постсинаптических мембран, вызванной чрезмерным количеством ацетилхолина. Как результат, снижается чувствительность незатронутых аутоиммунным процессом никотиновых и мускариновых рецепторов. Во всех случаях появление криза обусловлено передозировкой антихолинэстеразных препаратов. Кроме мышечной слабости, он характеризуется комплексом холинергических эффектов.
Дыхательные расстройства во время кризов обусловлены феноменом генерализации мышечного утомления, распространяющегося на области, испытывающие функциональную нагрузку. Респираторные расстройства при осложненном течении патологии связаны со слабостью скелетной мускулатуры: диафрагмы, межреберий, брюшного пресса. Не последнюю роль в этом процессе играют нарушение функции надгортанника, накопление слизи в дыхательных путях при недостаточности кашлевого толчка.
Классификация
Согласно классификации миастении по степени тяжести, кризы относят к V классу, когда дыхательные и бульбарные нарушения достигают такого уровня, что без искусственной вентиляции легких и зондового питания не обойтись. Разделение же самих пароксизмов достаточно условно, поскольку один быстро переходит в другой. В практической неврологии выделяют следующие кризы:
- Миастенический. Возникает при неэффективности ингибиторов холинэстеразы. Встречаются парциальные (дыхательный, кардиальный) или генерализованные варианты.
- Холинергический. Обусловлен нерациональным использованием антихолинэстеразных средств. По клиническим формам схож с миастеническим, но протекает с мускариновыми и никотиновыми эффектами.
- Смешанный. Встречается чаще других. Представляет собой наиболее тяжелый вариант криза, который имеет две фазы - миастеническую и холинергическую.
Существует три типа дыхательных расстройств при декомпенсированной миастении - скелетно-мышечный, бульбарный, смешанный. Первый характеризуется поражением мышц грудной клетки и диафрагмы. Бульбарный вариант предполагает парез надгортанника и западение языка с развитием асфиксии. У большинства пациентов оба типа развиваются одновременно.
Симптомы кризов при миастении
Декомпенсация болезни возникает внезапно (за 12-48 часов), сопровождается резким ухудшением жизненно важных функций из-за прогрессирующей мышечной слабости. Иногда наблюдается подострое развитие, когда симптомы нарастают в течение 3-14 дней. У пятой части пациентов кризы являются первым проявлением миастении, что обычно наблюдается при ее поздней манифестации. Склонность к повторному развитию пароксизмов свидетельствует о крайне тяжелом течении основного заболевания.
Миастенический и холинергический кризы имеют ряд общих признаков, к которым относят нарастающую слабость скелетной и бульбарной мускулатуры, глазодвигательные нарушения, гипомимию. Наиболее грозный симптом - дыхательные нарушения, представляющие прямую угрозу жизни пациента. Оба варианта характеризуются психомоторным возбуждением с беспокойством, страхом, спутанностью сознания, обусловленными нарастающей гипоксией головного мозга.
Миастенический криз
Помимо описанных симптомов, миастенический криз сопровождается вегетативной дисфункцией - гипергидрозом, гиперсаливацией, бледностью и цианозом кожных покровов. Он развивается постепенно, так как необходимо время на вовлечение вспомогательной мускулатуры. Пациент принимает вынужденную позу - полусидя, держась за спинку кровати для фиксации плечевого пояса. При генерализованном приступе усиливаются общая слабость, птоз, ограничивается подвижность глазных яблок. Бульбарные нарушения сочетаются с расстройствами дыхания и деятельности сердца.
Одним из вариантов проявления парциального кардиального миастенического криза становятся приступы, схожие со стенокардическими: пациент ощущает дискомфорт в области сердца, перебои в его работе. Объективно выявляют гипотонию, тахикардию. Пароксизм обычно возникает в ночное время, проходит после приема антихолинэстеразных препаратов. Парциальные дыхательные кризы развиваются по бульбарному или спинальному типу с нарастанием слабости в соответствующих группах мышц.
Холинергический криз
Характеризуется парадоксальным снижением мышечной силы в ответ на введение антихолинэстеразных средств. В клинической картине присутствуют отчетливо выраженные мускариновый и никотиновый эффекты. Первый проявляется усилением секреции слюны и бронхиальной слизи, повышенной потливостью, сужением зрачков. Возникают абдоминальные боли, диспепсические явления (тошнота, рвота, понос), брадикардия. Активация никотиновых рецепторов сопровождается мышечными фасцикуляциями, судорогами.
Смешанный криз
Учитывая быструю трансформацию кризов при миастении, их разграничение затруднено, поэтому чаще констатируют смешанный вариант. Он сопровождается несостоятельностью бульбарных и дыхательных мышц при незначительном снижении силы в конечностях. Сопутствующие нарушения туловищной локализации остаются чувствительны к анитихолинэстеразным препаратам. Но в сочетании с холинергическими симптомами такой криз представляет существенную опасность для пациента.
Осложнения
Кризы угрожают остановкой дыхания и сердечно-сосудистой недостаточностью, повышающими летальность при миастении вдвое. У трети пациентов пароксизмы имеют тенденцию к рецидивированию. При миастеническом кризе возрастает риск экстубационной дыхательной недостаточности, частота которой составляет 27%. Поражение бульбарных мышц ведет к развитию аспирационных состояний (пневмонии, синдрома Мендельсона).
Диагностика
Важной задачей для врача-невролога является ранняя диагностика дыхательных нарушений с выявлением риска кризового течения миастении. Тяжесть процесса устанавливается по международной классификации, шкале мышечной силы. Клиническими критериями являются прогрессирующая мышечная слабость, дисфагия, респираторный дистресс (одышка, тахипноэ, вовлечение вспомогательных мышц). Для выявления факторов декомпенсации применяются методы лабораторного и инструментального контроля:
- Биохимический анализ крови. Определение концентрации антител, направленных против ацетилхолиновых рецепторов и мышечно-специфической тирозинкиназы (MuSK), проводится иммуноферментным анализом, радиоиммунологическим методом. Исследование газов артериальной крови при дыхательных расстройствах показывает гиперкапнию, гипоксию, снижение сатурации.
- Фармакологические пробы. При введении антихолинэстеразных ЛС наблюдается регресс симптоматики миастенического криза. Холинергическая форма сопровождается отрицательной прозериновой пробой, при которой симптомы не исчезают, а нарастают. Если же пациент нуждается в ИВЛ, то проводить ее для разграничения двух вариантов нет необходимости.
- Электрофизиологическое исследование. Ритмическая стимуляционная электронейромиография является наиболее чувствительным тестом для обнаружения нарушений в мионевральном синапсе. Электрофизиологическим предиктором развития криза признается генерализованное снижение М-ответа на первый вызванный электрический стимул в пораженной мышце.
- Томография.КТ-сканирование грудной клетки выполняется для исключения патологии вилочковой железы - тимомы. Исследование имеет гораздо более высокую информативность по сравнению с традиционной рентгенографией. Высокой точностью при выявлении мягкотканных образований обладает МРТ, ее выполнение увеличивает диагностическую ценность рентгенологического метода.
Дифференцировать кризы при миастении необходимо с другими тяжелыми состояниями, сопровождающимися респираторными расстройствами. В списке вероятных заболеваний могут присутствовать синдром Ламберта-Итона, ботулизм, полиомиелит. Необходимо учитывать врожденные миастенические состояния, острые нарушения мозгового кровообращения, синдром Гийена-Барре и прочие нарушения со схожей симптоматикой.
Лечение кризов при миастении
Консервативное лечение
Резкая декомпенсация мышечной слабости - это жизнеугрожающее состояние, требующее оказания ургентной помощи. Все пациенты поступают в отделение реанимации и интенсивной терапии, где проводится восстановление дыхания и сердечной деятельности. В терапии кризов практикуется последовательный междисциплинарный подход, включающий общие и патогенетические (специфические) мероприятия консервативной коррекции.
Купирование дыхательной недостаточности проводится путем санации ротоглотки и трахеобронхиального дерева, интубации трахеи, перевода пациента на ИВЛ. Объем респираторной поддержки определяется тяжестью нарушений. Одновременно отменяют препараты антихолинэстеразного ряда и другие, усугубляющие проведение нервных импульсов. К мероприятиям общего характера относят выявление и устранение инфекционных осложнений, профилактику тромбозов. Специфическое лечение при кризах включает:
- Введение иммуноглобулинов. Может рекомендоваться как метод первой линии при лечении тяжелой генерализованной миастении и кризов. Внутривенные иммуноглобулины G способны угнетать аутоиммунную агрессию, оказывая быстрый кратковременный эффект. Метод дает сопоставимые с плазмаферезом результаты, но более доступен и прост в применении, лучше переносится пациентами.
- Плазмаферез.Экстракорпоральная детоксикация считается эффективным методом лечения кризовых состояний при миастении, назначается перед и после тимэктомии. Обменный плазмаферез позволяет вывести из плазмы крови антитела, обеспечивая большинству пациентов позитивный эффект, сохраняющийся 1-2 месяца. Альтернативой является селективная иммуносорбция.
- Кортикостероидную терапию. Патогенетически обосновано применение пульс-терапии кортикостероидами (метилпреднизолоном), которая способна купировать проявления криза. У некоторых пациентов сопровождается кратковременным ухудшением состояния или резистентностью. Риск негативных явлений уменьшается при одновременном применении плазмафереза, иммуноглобулинов.
В комплексной терапии используются различные средства симптоматической и вспомогательной коррекции, действие которых направлено на усиление выработки ацетилхолина, улучшение мышечной функции, подавление побочных эффектов патогенетического лечения. Используются метаболические средства (метионин, глутаминовая кислота, витамины), препараты кальция, адаптогены. Профилактику кортикостероид-ассоциированного остеопороза осуществляют ретаболилом, фторидом натрия.
Хирургическое лечение
Своевременное удаление тимуса (тимэктомия) оказывает превентивный эффект - уменьшает частоту и тяжесть кризов при миастении, особенно при ранней декомпенсации. В послеоперационном периоде у 6-22% пациентов отмечаются рецидивы тяжелых пароксизмов, но риск отрицательных последствий снижается при использовании малоинвазивных техник: цервикотомии, частичной стернотомии, торакоскопии под видеоконтролем. Пациенты с тяжелыми бульбарными расстройствами нуждаются в трахеостомии.
Экспериментальное лечение
Для лечения кризов при миастении предлагают использовать другие иммуносупрессивные препараты - азатиоприн, мофетила микофенолат, циклоспорин. Их рассматривают в качестве альтернативы кортикостероидам при наличии противопоказаний или неадекватного терапевтического ответа. Но в силу отсроченного действия эти препараты обладают ограниченным применением. При злокачественном течении болезни отмечена эффективность моноклональных антител (ритуксимаба).
Своевременно оказанная медицинская помощь делает прогноз благоприятным, исход кризов может ухудшиться из-за сопутствующей патологии. Смертность от декомпенсации миастении составляет около 4%, но за счет активной респираторной поддержки и ранней интенсивной терапии ее удается избежать. Прогрессирование моторных нарушений оказывает инвалидизирующий эффект, снижая качество жизни. Для профилактики кризов проводят динамическое наблюдение за пациентами, рассматривают целесообразность тимэктомии, устраняют факторы риска, в том числе разъясняют важность правильного приема лекарств .
2. Особенности течения миастенического криза при позднем дебюте заболевания/ Лапшина О.В., Седышев Д.В., Беляков К.М., Антипенко Е.А., Густов А.В.// Современные проблемы науки и образования. - 2017. - № 4.
3. Миастения. Принципы диагностики и лечения, тактика ведения больных/ Малкова Н.А.// Медицина неотложных состояний. - 2008. - 1(14).
Миастения у детей
Миастения - это аутоиммунное заболевание, характеризующееся нарушением нервно-мышечной передачи и проявляющееся слабостью и патологической утомляемостью скелетных (поперечнополосатых) мышц.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
• Миастения, генерализованная форма, прогрессирующее течение, средняя степень тяжести, достаточная компенсация на фоне АХЭП.
• Миастения, локальная (глазная) форма, стационарное течение, легкая степень тяжести, хорошая компенсация на АХЭП.
• Миастения, генерализованная форма с дыхательными нарушениями, прогрессирующее тяжелое течение с недостаточной компенсацией на АХЭП.
Существует несколько классификаций миастении. Наиболее распространена в мире классификация по Оссерману (принята как международная в 1959г. в Лос-Анжелесе, модифицирована в 1971г. Оссерманом и Дженкиным).
2 - острое начало, более длительное (от 3 месяцев до 1 года) развитие синдрома, течение с ремиссиями, но неуклонным прогрессирование,
3 - постепенное начало, медленное развитие на протяжении нескольких лет и последующее медленно прогрессирующее течение,
В 1965 г. А.Г. Пановым, Л.В. Довгелем и В.С. Лобзиным разработана классификация миастении по локализации патологического процесса с учетом нарушения
а) лицевая форма (глазная, глоточно-лицевая), б) скелетно-мышечная форма: без нарушения дыхания и с нарушением дыхания.
Наиболее удобна для практического врача классификация, предложенная в 1965 г. Б.М. Гехтом. В ней учитывается характер течения заболевания, степень генерализации миастенического процесса, тяжесть двигательных расстройств и степень их компенсации на фоне ингибиторов ацетилхолинэстеразы (АХЭ), что помогает достаточно полно и точно сформулировать диагноз.
1. Миастенические эпизоды (однократный или ремиттирующее течение) - преходящие двигательные нарушения с полным регрессом (10-12%).
2. Миастенические состояния (т.е. стационарное течение) - стационарная непрогрессирующая форма в течение многих лет (13%).
4. Злокачественная форма - острое начало и быстрое нарастание нарушения функции мышц (25%).
- генерализованные процессы: генерализованные без бульбарных нарушений, генерализованные и генерализованные с нарушением дыхания.
Этиология и патогенез
По современным представлениям, основой патогенеза миастении является аутоиммунная реакция, вызванная связыванием антителами ацетилхолиновых рецепторов (АХР) постсинаптических мембран поперечнополосатой мускулатуры. Число этих рецепторов значительно снижено под воздействием этих аутоантител. В некоторых случаях при аутоиммунной миастении гравис (МГ) не выявляются антитела (АТ) к АХР, и такая форма получила название серонегативной миастении гравис (СН-МГ). Термин «серонегативная» является неточным по отношению к группе пациентов, включая детей, имеющих АТ класса IgG к мышечной специфической рецепторной тирозинкиназе (МуСК). Эта форма получила название МуСК-МГ. Хотя получены убедительные доказательства патогенности АХР АТ, патогенетическая роль МуСК АТ остается неясной. Могут выявляться и другие АТ, роль которых не установлена, в том числе к титину, рианодиновым рецепторам и внутриклеточному АХР-связанному протеину рапсину.
Механизм, запускающий выработку АТ, остается неизвестным. На роль вилочковой железы указывает сочетание АХР и лимфоидной гиперплазиии опухолей тимуса, а также эффективность тимэктомии. При МуСК-МГ если и выявляются, то лишь небольшие гистологические изменения тимуса. На наличие генетической предрасположенности указывает относительно часто наблюдающиеся клинические и электромиографические (ЭМГ) симптомы у родственников больного и часто встречающиеся отдельные группы антигенов главного комплекса тканевой совместимости человека (HLA).
Отмечается сочетание с другими аутоиммунными расстройствами, особенно с патологией щитовидной железы (гипер- или гипотиреоз), ревматоидным артритом, красной волчанкой и диабетом. По данным некоторых исследователей злокачественные опухоли отмечались у 5% детей.
Эпидемиология
Миастения - заболевание относительно редкое, хотя существует достаточно оснований считать, что наблюдают его значительно чаще, чем считали ранее. Наиболее предрасположены к заболеванию лица с фенотипом HLA-B3, HLA-B8, HLA-DW3. Распространенность миастении составляет 0,5 - 5 случаев на 100 тыс. населения, однако в настоящее время имеется тенденция к увеличению числа больных и составляет 10 - 24 случая на 100 тыс. населения. Миастения может дебютировать в любом возрасте, начиная с раннего детства (чаще у девочек и в подростковом возрасте) и заканчивая глубокой старостью. Дети и подростки до 17 лет составляют 9-15% больных миастенией. В детском возрасте чаще встречается ювенильная форма миастении. Приблизительно у 5-20% младенцев (по данным разных источников), рожденных больными миастенией матерями, развивается транзиторная неонатальная миастения (ТНМ), обусловленная переносом через плацентарный барьер антител к ацетилхолиновым рецепторам (АХР) от матери.
Наиболее высокая заболеваемость отмечается в 2-х возрастных категориях: 20-40 лет (в этот период чаще болеют женщины) и 65-75 лет (в этот период мужчины и женщины поражаются одинаково часто). Средний возраст начала болезни у женщин - 26 лет, у мужчин - 31 год.
При сборе анамнеза и жалоб обращают внимание на изменчивость симптомов в течение суток, связь их с нагрузкой, наличие частичных или полных ремиссий, обратимость симптомов на фоне приема ингибиторов АХЭ (на время их действия) и на фоне адекватной иммуносупрессивной терапии.
Клинический осмотр должен включать исследование общего неврологического статуса, а также проверку силы произвольных мышц лица, шеи, туловища и конечностей до и после нагрузки (оценка силы в баллах, где 0 - отсутствие силы, 5 - сила данной группы мышц здорового человека). Одним из самых важных клинических тестов для диагностики миастении является наличие синдрома патологической мышечной утомляемости: нарастание симптомов после нагрузки. Например, нарастание птоза, глазодвигательных нарушений при фиксации взора, после зажмуривания; снижение силы в отдельных группах мышц после повторных активных движений в исследуемой конечности, приседаний или ходьбы; появление или нарастание речевых нарушений при счете, чтении вслух и т.д. При этом не выявляется никаких симптомов органического поражения нервной и нервно-мышечной системы (при отсутствии сопутствующих заболеваний): нет нарушений в рефлекторной и координаторной сфере, сохранена чувствительность, в типичных случаях отсутствуют мышечные атрофии, сохранен мышечный тонус.
Симптомы болезни могут развиваться в любом возрасте старше одного года, но наиболее часто проявляются у девочек в подростковом возрасте. Начало болезни может быть постепенным или внезапным.
• поражением глазодвигательных мышц с диплопией, офтальмоплегией и птозом (могут быть симметричными, асимметричными или односторонними),
При обследовании детей с развившейся дыхательной недостаточностью при отсутствии легочной патологии необходимо учитывать возможность ЮМГ, даже если отсутствуют другие симптомы этого заболевания.
Первоначально мышечная сила может быть нормальной или почти нормальной, и поэтому мышечную силу нужно оценивать до и после физической нагрузки. Частота случаев, при которых поражение ограничено только глазодвигательными мышцами (глазная миастения), существенно отличается в различных публикациях, но, вероятно, составляет 20-50%, и до 80% у маленьких детей в Китае. МуСК-МГ чаще встречается у женщин, в клинической картине преобладает слабость глазодвигательных мышц и мышц черепа, отмечаются частые респираторные кризы. Различия между МуСК-МГ и АХР-МГ еще предстоит выяснить.
Преходящий миастенический синдром, проявляющийся у таких детей в первые дни жизни и продолжающийся в течение 1-1,5 мес., обусловлен переносом через плацентарный барьер антител к АХР от матери.
• сопутствующими заболеваниями, и являются отличительным признаком состояния, называемого сейчас ВМС с эпизодическим апноэ).
Таким образом, отличием всех симптомов миастении является динамичность в течение суток, усиление после нагрузки, обратимость или уменьшение степени их выраженности после отдыха.
Миастенический криз, при котором по разным причинам происходит резкое ухудшение состояния с нарушением витальных функций. Молекулярной основой миастенического криза, вероятно, является резкое уменьшение количества функционирующих АХР вследствие массированной атаки их аутоантителами. Часто миастенический криз провоцируется бронхолегочной инфекцией, а в ряде случаев на фоне криза развивается пневмония, и тогда нарушения дыхания могут носить смешанный характер.
Дифференцировать миастенический криз от других тяжелых состояний, сопровождающихся респираторными расстройствами, можно по наличию:
• слабости и утомляемости мышц конечностей и шеи (уменьшающихся в ответ на введение ингибиторов АХЭ).
Следует отличать миастенический криз от холинергического (Приложение Г2), который развивается при избыточной дозе ингибиторов АХЭ. Общими симптомами кризов является выраженная слабость произвольной мускулатуры с нарушением дыхания и бульбарным синдромом, психомоторное возбуждение и нарушение сознания (сопор, кома).
Смешанные (миастенический + холинергический) кризы встречаются у больных миастенией при неправильном приеме и / или изначально узком диапазоне терапевтических доз ингибиторов АХЭ, а также на фоне состояний, вызывающих общую или мышечную слабость различного генеза (интеркуррентные инфекции, соматические, гормональные нарушения, прием препаратов, влияющих на сократительную функцию произвольных мышц и др.).
Комментарии: Антитела к АХР выявляются у детей в пределах 60-80%. В препубертатном возрасте тест положителен примерно у 50% детей. Титр антител снижается у успешно пролеченных пациентов. Из серонегативных на антитела к АХР, около 40-50% серонегативны на антитела к МуСК. Более высокая частота наличия этих антител у детей точно не установлена, но они могут присутствовать при начале заболевания в раннем детском возрасте.
• Рекомендуется проведение итерационной стимуляции нерва (ИСН), что позволяет выявить электрическую нервно-мышечную блокаду.
Комментарии: Этот тест вызывает стресс, особенно у маленьких детей, и поэтому должен выполняться щадяще. Технические трудности у маленьких детей также составляют проблему, и поэтому перед тем, как объявлять тест положительным, нужно быть полностью уверенным, что снижение амплитуды происходит по миастеническому типу. Суммарные потенциалы действия мышцы фиксируются с поверхностных электродов, лучше над слабой мышцей; частота стимуляции нерва 3Гц и 5Гц. Снижение амплитуды более чем на 10% в промежутке с третьего по пятый потенциал считается положительным результатом. Одноволоконная ЭМГ, позволяющая выявить усиленное «дрожание» при сокращении пар волокон, является более чувствительным, чем классическая ИСН, но трудновыполнимым у детей методом. Нормальная ИСН не исключает диагноза ЮМГ.
• Рекомендуется в диагностически сложных случаях проводится морфологическое исследование мышечного биоптата (световая, электронная микроскопия, гистохимическое, иммуногистохимическое, иммунофлуоресцентное и другие виды визуального изучения нервно-мышечного соединения и окружающих его тканей).
Комментарии: Основные качественные и количественные изменения при миастении обнаруживаются в постсинаптической мембране, которая содержит АХР, и в стадии развернутой клинической картины число АХР снижается до 10-30% от нормальных значений, падает их плотность.
• Рекомендуется применение антихолинэстеразных препаратов - проба с ингибиторами АХЭ: неостигминаметилсульфат (код АТХ: N07AA01), пиридостигмина гидрохлорид (код АТХ: N07AA02). После введения одного из этих препаратов эффект наблюдается в одной или нескольких ослабленных мышцах. Наиболее часто проводится проба с неостигминаметилсульфатом. Доза подбирается индивидуально из расчета 0,125 мг/кг массы тела (ориентировочно: 1,5мл 0,05% раствора - при массе тела до 70кг и 2мл - при массе тела более 70кг или при выраженной генерализованной слабости мышц конечностей без учета массы тела). Можно избрать любой парентеральный путь введения препарата, но обычно делается подкожная инъекция. Оценивается действие препарата через 30-40 минут.
Комментарии: Положительной полной проба считается при восстановлении мышечной силы до 5 баллов с компенсацией бульбарных и глазодвигательных нарушений, положительной неполной - при нарастании силы на 1-2 балла, но без полного ее восстановления и (или) сохранении редуцированного бульбарного или глазодвигательного дефекта. Частичная компенсация заключается в избирательном действии ингибиторов АХЭ на отдельные группы мышц, как правило, с нарастанием силы произвольных мышц на 1балл. Выделяется сомнительная прозериновая проба, когда отмечается некоторая положительная динамика в отношении отдельных симптомов (уменьшение птоза на 1-2мм, некоторое увеличение объема движений глазных яблок, несколько более звонкий голос, впечатление о некотором нарастании силы мышц конечностей и т.д.
• Рекомендуется введение внутримышечное или подкожное неостигмина метилсульфата при подозрении на транзиторную неонатальную форму (миастения новорожденных).
Комментарии: Клинические симптомы позволяют поставить правильный диагноз, если известно о существовании миастении у матери, но заболевание матери может быть недиагностированным или протекать бессимптомно. Диагноз подтверждается при внутримышечном или подкожном введении Неостигмина метилсульфата (Код АТХ: N07AA01); ИСН также может выполняться для подтверждения диагноза, но ее проведение в этом возрасте технически затруднительно и болезненно. Для диагностики, а затем и для лечения, предпочтительнее применять Неостигмина метилсульфат (код АТХ: N07AA01, Прозерин), особенно перед кормлением, так как его эффект продолжается дольше, что дает больше времени для обследования (например, разовая доза 0,1 мг перед кормлением, а дополнительные дозы - по мере необходимости). Если диагноз миастении вызывает сомнения, требуется динамическое наблюдение, проведение пробного курса ингибиторов АХЭ (пиридостигмина гидрохлорид в сочетании с препаратами калия - только строго избегая холинергических реакций), повторное клиническое и электромиографическое (ЭМГ) обследование.
Антихолинэстеразный тест и ИСН не обладают высокой чувствительностью и специфичностью, тогда как наличие антител к АХР специфично для миастении гравис.
Читайте также:
