ЭхоКГ после операции по Растелли
Добавил пользователь Владимир З. Обновлено: 22.01.2026
ФГБУ "Федеральный центр сердечно-сосудистой хирургии" Минздрава России, Пенза
ФГБУ «Федеральный центр сердечно-сосудистой хирургии» Минздрава России, 440071, Пенза, Россия
КХО №4 ФГБУ "Федеральный центр сердечно-сосудистой хирургии" Минздрава России, Пенза
Выполнение модифицированной операции Nikaidoh при D-транспозиции магистральных сосудов с дефектом межжелудочковой перегородки и стенозе легочной артерии при помощи кондуита "на вырост"
Журнал: Кардиология и сердечно-сосудистая хирургия. 2014;7(1): 77‑78
Черногривов И.Е., Базылев В.В., Черногривов А.Е., Невважай Т.И. Выполнение модифицированной операции Nikaidoh при D-транспозиции магистральных сосудов с дефектом межжелудочковой перегородки и стенозе легочной артерии при помощи кондуита "на вырост". Кардиология и сердечно-сосудистая хирургия. 2014;7(1):77‑78.
Chernogrivov IE, Basylev VV, Chernogrivov AE, Nevvazhaĭ TI. Performing of the modified operation Nikaidoh in case of D-transposition of the great vessels with ventricular septal defect and pulmonary stenosis by using of conduit "for growth". Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2014;7(1):77‑78. (In Russ.).
Наиболее распространенными хирургическими подходами к хирургическому лечению больных с аномалиями желудочково-артериального соединения в сочетании с дефектом межжелудочковой перегородки (ДМЖП) и стенозом выводного отдела левого желудочка (ВОЛЖ) являются методики Rastelli, Lecompte (REV) и Nikaidoh. В настоящее время окончательного выбора в пользу какой-либо из предложенных методик нет. Выполнение операции Rastelli, как правило, не представляется возможным у детей первых месяцев жизни и сопровождается низкой выживаемостью в отдаленном послеоперационном периоде. Во время вмешательства REV нарушается состоятельность клапана легочной артерии, а сформированный при этом выводной отдел правого желудочка (ПЖ) не приобретает нормальной анатомии. Что касается операции Nikaidoh, то данная методика кажется перспективной, хотя до сих пор не накоплено достаточного количества отдаленных результатов. Наш случай демонстрирует возможность применения операции Nikaidoh при хирургическом лечении пациента грудного возраста, которому ранее была выполнена паллиативная операция по созданию системно-легочного анастомоза.
Приводим клиническое наблюдение.
В стационар поступил ребенок в возрасте 4 мес, массой тела 5,5 кг и площадью поверхности тела 0,31 м 2 с D-транспозицией магистральных сосудов (D-ТМС), ДМЖП и комбинированным стенозом легочной артерии после ранее выполненного в месячном возрасте модифицированного системно-легочного анастомоза по Blalock-Taussig слева. Несмотря на хорошую функцию анастомоза, насыщение крови кислородом оставалось низким (60%). При проведении коронарографии выявлено обычное расположение коронарных артерий (1-LAD, Cx, 2-R).
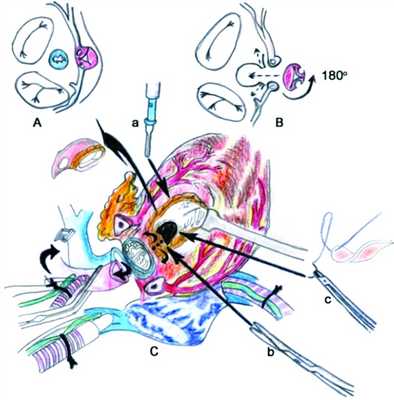
Операцию выполняли из срединного доступа в условиях искусственного кровообращения (ИК) и гипотермии (28 °C) с бикавальной канюляцией. После начала ИК системно-легочный анастомоз был клипирован и пересечен. Кардиоплегию выполняли антеградно в корень аорты раствором кустодиол. Левые отделы были дренированы через отверстие, созданное в межпредсердной перегородке. Аорта и легочная артерия пересечены над синусами. Клапан легочной артерии двухстворчатый, створки плотные, раскрытие недостаточное. В области ВОЛЖ отмечается стеноз за счет гипертрофированной конусной перегородки. Из аортальных синусов высечены на площадках правая и левая коронарные артерии. Аортальный клапан высечен отдельно единым блоком из миокарда ПЖ, створки клапана легочной артерии иссечены и полностью рассечена конусная перегородка. Дефект закрыт заплатой из ксеноперикарда. Затем аортальный аутографт ротирован вдоль продольной оси на 180° от своего изначального расположения и имплантирован в ВОЛЖ с фиксацией переднего края к ксеноперикардиальной заплате. В соответствующие отверстия в стенке аортального аутографта имплантированы левая, затем правая коронарные артерии. Выполнен прием Lecompte, после чего концы аорты анастомозированы между собой. В легочную позицию вшит легочный клапанный гомографт («свежеприготовленный») диаметром 25 мм. Выполнен дистальный анастомоз между гомографтом и бифуркацией легочной артерии (см. рис. 1 и далее на цв. вклейке). Рисунок 1. Схематическое изображение операции. A, B - иссечение корня аорты, его поворот на 180° с последующей реимплантацией коронарных артерий. Основные хирургические особенности (C): корень аорты выделяют из миокарда правого желудочка (а), рассекают суженное кольцо клапана легочной артерии и конусную перегородку (b), закрытие дефекта межжелудочковой перегородки при помощи ксеноперикардиальной заплаты (с).
По данным интраоперационной чреспищеводной эхокардиографии (ЭхоКГ), констатированы хорошая сократительная способность миокарда и отсутствие резидуальных сбросов на межжелудочковой заплате. Длительность ИК и пережатия аорты составила 227 и 147 мин соответственно. Пациент был экстубирован в операционной. Послеоперационный период протекал без осложнений и пациент был выписан через 7 дней после операции.
Через 7 мес после операции пациент чувствует себя хорошо, жалобы отсутствуют. При повторной трансторакальной ЭхоКГ патологии ВОЛЖ не выявлено, при цветовом допплеровском картировании турбулентного потока в камерах сердца не определялся. Регургитация на аортальном и легочном клапанах отсутствовала.
С целью предотвращения осложнений, сопровождающих выполнение операций Rastelli и процедуры REV, была предложена методика Nikaidoh [1, 2]. В данном случае мы не использовали классическую методику операции Nikaidoh, применив методику перемещения корня аорты (после полной мобилизации корня аорты) и реимплантации коронарных артерий с целью профилактики их перегиба или натяжения [2]. Перемещение корня аорты и коронарных артерий единым блоком в некоторых случаях является профилактической мерой по предотвращению стенозов устьев коронарных артерий в области их возможных анастомозов с неоаортой [4]. Другой возможной проблемой, которая решается выполнением маневра Lecompte, не предусмотренного классической операцией Bex-Nikaidoh, может быть стеноз правой ветви легочной артерии из-за ее сдавления смещенной кзади восходящей аортой. Кроме того, во время классической операции Nikaidoh большое внимание должно уделяться сохранению естественной геометрии ВОЛЖ без каких-либо деформаций транслоцируемого корня аорты [3]. Это немаловажно, так как при транслокации аорты вместе с коронарными артериями корень аорты смещается кзади на расстояние, равное сумме толщины конусной перегородки и диаметра клапана легочной артерии. Как и у ряда авторов [5], наши предпочтения отдаются полной мобилизации корня аорты и с реимплантацией коронарных артерий. Мы согласны с тем, что такая методика является технически более сложной, но она позволяет полностью реконструировать нормальную анатомию ВОЛЖ и тем самым обеспечить ламинарный кровоток через левый желудочек в аорту (см. рис. 2, на цв. вклейке). Рисунок 2. Результаты послеоперационного исследования. а - двухмерное эхокардиографическое и цветовое допплеровское исследование через 7 мес после операции: подтверждено отсутствие турбулентности в выходном тракте левого желудочка (LVOT), пиковая скорость потока и градиент для неоаортального клапана составили 1,3 м/с и 7 мм рт.ст. соответственно; б, в - компьютерная томография: широкий LVOT (черная звездочка): фронтальная проекция (б) и боковая проекция (в); отсутствуют признаки компрессии грудиной и перегиба аллотрансплантата (белая звездочка); г - данные двухмерной эхокардиографии и цветового допплеровского исследования через 7 мес после операции: отсутствие турбулентности в выводном тракте правого желудочка (RVOT) и в легочной артерии (PA); пиковая скорость кровотока и градиент для гомографта составили 0,5 м/с и 1 мм рт.ст. соответственно; трехмерное (д) и двухмерное (е) восстановленное изображение, полученные с помощью компьютерной томографии: широкий выводной тракт правого желудочка и легочного гомографта (отмечены черной звездочкой). LA - левое предсердие, LV - левый желудочек, RA - правое предсердие, AV - аортальный клапан, RV - правый желудочек.
Важно отметить, что в нашем случае удалось разместить гомографт большого размера в ортотопическую позицию пациенту 4-месячного возраста. Различные авторы показали, что использование кондуита небольшого диаметра является важным прогностическим фактором для его последующей замены [3, 8]. Кондуит описывается как «на вырост», если расчетное значение Z-score для него >3, но применение больших по диаметру кондуитов может привести к увеличению частоты их перегиба и компрессии грудиной [7]. Необходимо отметить, что компрессия грудиной имплантированного кондуита чаще возможна при выполнении операции Rastelli, тогда как при операции Nikaidoh это нетипично. Последняя методика позволяет переместить корень аорты назад, при этом бифуркация легочной артерии при маневре Lecompte переводится вперед, что и позволяет использовать оптимальный размер кондуита в позиции легочной артерии. Таким образом, наш пациент получил максимально «выгодный» размер аллографта (Z-score=13), при этом после имплантации не было никаких признаков компрессии грудиной. Ламинарность кровотока в последующем была оценена при помощи двухмерной и допплеровской ЭхоКГ, ширина легочного ствола была исследована при помощи компьютерной томографии (см. рис. 2, на цв. вклейке).
В заключение необходимо отметить важные преимущества операции Nikaidoh: после коррекции отсутствует уменьшение полости ПЖ, что характерно для операции Rastelli, обеспечивается «анатомический» выход из левого желудочка в аорту и ортотопическое размещение кондуита между ПЖ и системой легочной артерии без выполнения правой вентрикулотомии. Мы полагаем, что подобная модификация операции Nikaidoh с применением диаметра аллографта «на вырост» значительно улучшит отдаленные результаты лечения больных этой сложной категории.
Транспозиция магистральных сосудов
Транспозиция магистральных сосудов - тяжелая врожденная патология сердца, характеризующаяся нарушением положения главных сосудов: отхождением аорты от правых отделов сердца, а легочной артерии - от левых. Клинические признаки транспозиции магистральных сосудов включают цианоз, одышку, тахикардию, гипотрофию, сердечную недостаточность. Диагностика транспозиции магистральных сосудов основана на данных ФКГ, ЭКГ, рентгенологического исследования органов грудной клетки, катетеризации полостей сердца, вентрикулографии. Методами оперативной коррекции транспозиции магистральных сосудов служат паллиативные вмешательства (баллонная атриосептостомия) и радикальные операции (Мастарда, Сеннинга, Жатене, Растелли, артериального переключения).
Общие сведения
Транспозиция магистральных сосудов - врожденный порок сердца, анатомическую основу которого составляет неправильное расположение аорты и легочной артерии относительно друг друга и их обратное отхождение от желудочков сердца. Среди различных ВПС транспозиция магистральных сосудов составляет 7-15%; в 3 раза чаще встречается у мальчиков. Транспозиция магистральных сосудов входит в число «большой пятерки» - наиболее часто встречающихся врожденных аномалий сердца, наряду с дефектом межжелудочковой перегородки, коарктацией аорты, открытым артериальным протоком, тетрадой Фалло.
В кардиологии транспозиция магистральных сосудов относится к критическим порокам сердца синего типа, не совместимым с жизнью, поэтому требует хирургического вмешательства в первые недели жизни.
Причины транспозиции магистральных сосудов
Аномалии развития магистральных сосудов формируются в первые 2 месяца эмбриогенеза в результате хромосомных аберраций, неблагоприятной наследственности или отрицательных внешних воздействий. Экзогенными факторами могут выступать вирусные инфекции, перенесенные беременной (ОРВИ, краснуха, ветряная оспа, корь, эпидемический паротит, герпес, сифилис), токсикозы, радиоактивное облучение, лекарственные вещества, алкогольная интоксикация, полигиповитаминоз, заболевания матери (сахарный диабет), возрастные изменения в организме женщины старше 35 лет. Транспозиция магистральных сосудов встречается у детей с синдромом Дауна.
Непосредственные механизмы транспозиции магистральных сосудов до конца не изучены. По одной из версий, порок обусловлен неправильным изгибом аортально-пульмональной перегородки в процессе кардиогенеза. Согласно более современным представлениям, транспозиция магистральных сосудов является результатом неправильного роста субаортального и субпульмонального конуса при разветвлении артериального ствола. При закладке сердце в норме резорбция инфундибулярной перегородки приводит к формированию аортального клапана кзади и книзу от клапана легочной артерии, над левым желудочком. При транспоцизии магистральных сосудов процесс резорбции нарушается, что сопровождается расположением клапана аорты над правым желудочком, а клапана легочной артерии - над левым.
Классификация транспозиции магистральных сосудов
В зависимости от количества сопутствующих коммуникаций, выполняющих компенсирующую роль, и состояния малого круга кровообращения различают следующие варианты транспозиции магистральных сосудов:
1. Транспозиция магистральных сосудов, сопровождающаяся гиперволемией или нормальной величиной легочного кровотока:
- с дефектом межпредсердной перегородки или открытым овальным окном (простая транспозиция)
- с ДМЖП
- с открытым артериальным протоком и наличием дополнительных коммуникаций.
2. Транспозиция магистральных сосудов, сопровождающаяся уменьшением легочного кровотока:
- со стенозом выносного тракта левого желудочка
- с ДМЖП и стенозом выносного тракта левого желудочка (сложная транспозиция)
В 80% случаев транспозиция магистральных сосудов сочетается с одной или несколькими дополнительными коммуникациями; у 85-90% больных порок сопровождается гиперволемией малого круга кровообращения. Для транспозиции магистральных сосудов характерно параллельное расположение аорты относительно легочного ствола, тогда как в нормальном сердце обе артерии перекрещиваются. Чаще всего аорта находится впереди легочного ствола, в редких случаях сосуды располагаются в одной плоскости параллельно, или аорта локализуется кзади от легочного ствола. В 60% наблюдений обнаруживается D-транспозиция - положение аорты справа от легочного ствола, в 40%- L-транспозиция - левостороннее положение аорты.
Особенности гемодинамики при транспозиции магистральных сосудов
С позиций оценки гемодинамики важно различать полную транспозицию магистральных сосудов и корригированную. При корригированной транспозиции аорты и легочной артерии имеет место желудочково-артериальная и предсердно-желудочковая дискордантность. Другими словами, корригированная транспозиция магистральных сосудов сочетается с инверсией желудочков, поэтому внутрисердечная гемодинамика осуществляется в физиологическом направлении: в аорту поступает артериальная кровь, а в легочную артерию венозная. Характер и выраженность гемодинамических нарушений при корригированной транспозиции магистральных сосудов зависят от сопутствующих пороков - ДМЖП, митральной недостаточности и др.
Полная форма сочетает в себе дискордантные желудочково-артериальные взаимоотношения при конкордантном взаимоотношении других отделов сердца. При полной транспозиции магистральных сосудов венозная кровь из правого желудочка поступает в аорту, разносится по большому кругу кровообращения, а затем вновь поступает в правые отделы сердца. Артериальная кровь выбрасывается левым желудочком в легочную артерию, по ней - в малый круг кровообращения и вновь возвращается в левые отделы сердца.
Во внутриутробном периоде транспозиция магистральных сосудов практически не нарушает фетальное кровообращение, поскольку легочный круг у плода не функционирует; циркуляция крови осуществляется по большому кругу через открытое овальное окно или открытый артериальный проток. После рождения жизнь ребенка с полной транспозицией магистральных сосудов зависит от наличия сопутствующих коммуникаций между малым и большим кругом кровообращения (ООО, ДМЖП, ОАП, бронхиальных сосудов), обеспечивающих смешение венозной крови с артериальной. При отсутствии дополнительных пороков дети погибают сразу после рождения.
При транспозиции магистральных сосудов шунтирование крови осуществляется в обоих направлениях: при этом, чем больше размер коммуникации, тем меньше степень гипоксемии. Наиболее благоприятными являются случаи, когда ДМПП или ДМЖП обеспечивают достаточное смешивание артериальной и венозной крови, а наличие умеренного стеноза легочной артерии предотвращает чрезмерную гиперволемию малого круга.
Симптомы транспозиции магистральных сосудов
Дети с транспозицией магистральных сосудов рождаются доношенными, с нормальным или несколько повышенным весом. Сразу после рождения, с началом функционирования отдельного легочного круга кровообращения, нарастает гипоксемия, что клинически проявляется тотальным цианозом, одышкой, тахикардией. При транспозиции магистральных сосудов, сочетающейся с ОАП и коарктацией аорты, выявляется дифференцированный цианоз: синюшность верхней половины тела выражена в большей степени, чем нижней.
Уже в первые месяцы жизни развиваются и прогрессируют признаки сердечной недостаточности: кардиомегалия, увеличение размеров печени, реже - асцит и периферические отеки. При осмотре ребенка с транспозицией магистральных сосудов обращает внимание деформация фаланг пальцев, наличие сердечного горба, гипотрофия, отставание в моторном развитии. При отсутствии стеноза легочной артерии переполнение кровью малого круга кровообращения приводит к частому возникновению повторных пневмоний.
Клиническое течение корригированной транспозиции магистральных сосудов без сопутствующих ВПС длительное время бессимптомное, жалобы отсутствуют, ребенок развивается нормально. При обращении к кардиологу обычно выявляется пароксизмальная тахикардия, атриовентрикулярная блокада, шумы в сердце. При наличии сопутствующих ВПС клиническая картина корригированной транспозиции магистральных сосудов зависит от их характера и степени гемодинамических нарушений.
Диагностика транспозиции магистральных сосудов
Наличие у ребенка транспозиции магистральных сосудов обычно распознается еще в родильном доме. Физикальное обследование выявляет гиперактивность сердца, выраженный сердечный толчок, который смещен медиально, расширенную грудную клетку. Аускультативные данные характеризуются усилением обоих тонов, систолическим шумом и шумом ОАП или ДМЖП.
У детей в возрасте 1-1,5 месяцев по ЭКГ обнаруживаются признаки перегрузки и гипертрофии правых отделов сердца. При оценке рентгенографии грудной клетки высокоспецифичными признаками транспозиции магистральных сосудов являются: кардиомегалия, характерная конфигурация тени сердца яйцеобразной формы, узкий сосудистый пучок в переднезадней проекции и расширенный в боковой проекции, левое положение дуги аорты (в большинстве случаев), обеднение рисунка легких при стенозе легочной артерии или его обогащение при дефектах перегородки.
Эхокардиография показывает аномальное отхождение магистральных сосудов, гипертрофию стенок и дилатацию камер сердца, сопутствующие дефекты, наличие стеноза легочной артерии. С помощью пульсоксиметрии и исследования газового состава крови определяются параметры насыщения крови кислородом и парциальное давление кислорода: при транспозиции магистральных сосудов SО2 менее 30%, PaO2 - менее 20 мм рт.ст. При зондировании полостей сердца обнаруживается повышенное насыщение крови кислородом в правом предсердии и желудочке и пониженное в левых отделах сердца; одинаковое давление в аорте и правом желудочке.
Рентгеноконтрастные методы исследования (вентрикулография, атриография, аортография, коронарография) визуализируют патологическое поступление контраста из левых отделов сердца в легочную артерию, а из правых - в аорту; сопутствующие дефекты, аномалии отхождения венечных артерий. Транспозицию магистральных сосудов следует отличать от тетрады Фалло, атрезии легочной артерии, атрезии трикуспидального клапана, гипоплазии левых отделов сердца.
Лечение транспозиции магистральных сосудов
Всем пациентам с полной формой транспозиции магистральных сосудов показано экстренное оперативное лечение. Противопоказанием служат случаи развития необратимой легочной гипертензии. До операции новорожденным проводится медикаментозная терапия простагландином Е1, помогающим сохранить артериальный проток незаращенным и обеспечить адекватный кровоток.
Паллиативные вмешательства при транспозиции магистральных сосудов необходимы в первые дни жизни для увеличения размера естественного или создания искусственного дефекта между малым и большим кругами кровообращения. К такого рода операциям относятся эндоваскулярная баллонная атриосептостомия (операция Парка-Рашкинда) и открытая атриосептэктомия (резекция межпредсердной перегородки по Блелоку-Хенлону).
К числу гемокорригирующих вмешательств, выполняемых при транспозиции магистральных сосудов, относятся операции Мастарда и Сеннинга - внутрипредсердное переключение потоков артериальной и венозной крови с помощью синтетической заплаты. При этом топография магистральных артерий остается прежней, по внутрипредсердному туннелю из легочных вен кровь поступает в правое предсердие, а из полых вен - в левое.
Варианты анатомической коррекции транспозиции магистральных сосудов включают различные способы артериального переключения: операцию Жатене (пересечение и ортотопическую реплантацию магистральных сосудов, перевязку ОАП), операцию Растелли (пластику ДМЖП и устранение стеноза легочной артерии), артериальное переключение с пластикой МЖП. Специфическими послеоперационными осложнениями, сопровождающими коррекцию транспозиции магистральных сосудов, могут служить СССУ, стеноз устьев легочных и полых вен, стеноз выносящих трактов желудочков.
Прогноз транспозиции магистральных сосудов
Полная транспозиция магистральных сосудов - критический, несовместимый с жизнью порок сердца. При отсутствии специализированной кардиохирургической помощи половина новорожденных погибает в первый месяц жизни, более 2/3 детей - к 1 году от тяжелой гипоксии, недостаточности кровообращения и нарастания ацидоза.
Хирургическая коррекция простой транспозиции магистральных сосудов позволяет достичь хороших отдаленных результатов в 85-90% случаев; при сложной форме порока - в 67% случаев. После операций пациенты нуждаются в наблюдении кардиохирурга, ограничении физических нагрузок, профилактике инфекционного эндокардита. Важное значение имеет пренатальное выявление транспозиции магистральных сосудов с помощью фетальной ЭхоКГ, соответствующее ведение беременности и подготовка к родам.
Открытый общий атрио-вентрикулярный канал
Анатомически этот порок — отсутствие участка перегородок, разделяющих правое и левое предсердия в их нижнем отделе, а желудочки — в их верхнем отделе. Вместо нормального сращения межпредсердной и межжелудочковой перегородок образуется большое общее отверстие между всеми четырьмя камерами сердца. Дело еще осложняется тем, что именно тут находится зона прикрепления к перегородкам предсердно-желудочковых клапанов: в левом — митрального, в правом — трехстворчатого. Крепиться им некуда, и они срастаются друг с другом, образуя общие для обоих желудочков створки. Над ними остается дефект между предсердиями, а под ними — дефект между желудочками. Возникает так называемая «полная форма» АВК .
В отличие от дефектов межжелудочковой перегородки, самостоятельно закрытие АВК не произойдет никогда.
Поговорим вначале о неполной форме порока. Его называют первичным дефектом межпредсердной перегородки потому, что это только большой дефект в ее нижней части. Но к нему присоединяется еще одно внутрисердечное нарушение — «расщепление» передней створки митрального клапана, две половины которой не срастаются между собой (и между ними образуется щель). Возникает недостаточность митрального клапана, т.е. при каждом сокращении через это расщепление часть крови из левого желудочка забрасывается обратно в левое предсердие. То есть, помимо дефекта межпредсердной перегородки, появляется еще одна причина, увеличивающая остаточный объем крови в полостях сердца и нагрузку на все его отделы.
Жалобы и клиническая симптоматика очень похожи на те, которые описаны для изолированных дефектов межпредсердной перегородки, но развиваются они раньше и с большей скоростью. Обычно в возрасте первых 3-6 месяцев жизни уже есть прямые показания к хирургической операции. Некоторые больные попадают к хирургам уже вполне взрослыми, но вероятность того, что они будут страдать нарушениями ритма даже после полного устранения дефекта, достаточно высока.
С полной формой порока дело обстоит сложнее. Имеется несколько составляющих: дефект межпредесердной перегородки и дефект межжелудочковой перегородки, сливающиеся в одно огромное отверстие, и одно общее для обоих желудочков клапанное кольцо, регулирующееся двумя большими общими створками. Все отделы сердца работают с огромной перегрузкой, постоянно увеличенным объемом крови. Особенно оказывается переполненным малый круг. Давление в нем, естественно, повышается и, как и при больших ДМЖП , опасность быстрого развития необратимых изменений легочных сосудов очень высока.
Клинически порок протекает тяжело. Симптомы сердечной недостаточности появляются уже в первые месяцы жизни, и состояние ребенка требует постоянной лекарственной поддержки. Сердце быстро увеличивается в размерах — все его четыре камеры перегружены и с трудом справляются с работой. Ребенок очень болен, плохо ест и развивается, постоянно «подхватывает» простудные заболевания, часто заканчивающиеся воспалением легких. Состояние не критическое, но очень опасное. Операция необходима вскоре после точного установления диагноза.
При наличии условий для хирургического лечения можно устранить порок одномоментно в первые месяцы жизни, а если таких условий нет, можно разбить лечение на два этапа, т.е. вначале сузить легочную артерию (как при ДМЖП ), а через несколько месяцев сделать радикальную операцию.
Суть коррекции порока состоит вот в чем. В условиях «открытого сердца» рассекают общие створки клапана пополам, чтобы создать два отдельных входа в правый и левый желудочки. Затем с помощью заплаты закрывают дефект межжелудочковой перегородки. К этой заплате пришивают рассеченные ранее части общих створок, создавая тем самым правое и левое предсердно-желудочковые отверстия. Затем, отдельной заплатой закрывают межпредсердную часть бывшего дефекта.
Однако… Вечное это «однако» в медицине… Когда хирург работает на створках клапана, которые особенно у маленьких детей представляют собой тончайшие прозрачные лепестки, то любой, даже самый тонкий материал для швов, оказывается слишком грубым. Кроме того, ребенок будет расти, а сердце — и его клапанные отверстия — увеличиваться по мере роста. Поэтому, чем раньше сделана операция, тем более вероятно, что когда-нибудь его атрио-вентрикулярные клапаны, особенно митральный, будут работать несовершенно, т.е. появится их недостаточность. Это может произойти даже после идеально сделанной первой операции. В какой-то момент подростковой или уже взрослой жизни может быть поставлен вопрос об устранении недостаточности хирургическим путем: пластикой или протезированием клапана. Но это, если и будет, то гораздо позже. Здесь мы хотим подчеркнуть, что ребенка, удачно оперированного по поводу полной формы АВК надо регулярно показывать кардиологу и следить за функцией его клапанов, которая с годами может меняться.
Это совсем не означает, что нужно ограждать ребенка от физических нагрузок и внушать ему, что у него больное сердце, ни в коем случае. Но заниматься, например, большим спортом, который сегодня подразумевает нагрузки на грани возможностей здорового человека, ему, наверное, все-таки не стоит. Впрочем, наблюдение за ним грамотным детским кардиологом является залогом того, что все будет сделано вовремя.
Один из создателей кардиохирургии доктор Джон Кирклин однажды сказал: «По-моему, это самая красивая операция из всех, что делаются по поводу врожденных пороков сердца». И пусть она будет для вашего ребенка не только самой красивой, но и самой удачной.
Вариантов транспозиции может быть много: полная, неполная, корригированная, в сочетании с другими пороками.
Пока мы коснемся только полной транспозиции, т.е. ситуации, когда сосуды полностью переместились, поменялись своими местами. Аорта отходит от правого желудочка, а легочная артерия — от левого. Остальные отделы сердца, т.е. предсердия с впадающими в них венами, и желудочки, нормальны и не имеют никаких других пороков (иногда применяют термин «простая ТМС»). Как не трудно себе представить, но такое бывает с сердцем, и не так уж редко. Это как если бы там, где должна быть руки - выросли ноги, а там, где ноги — руки. К счастью, это не так страшно выглядит. Дети рождаются доношенными, совершенно нормальными, но, в отличие от тетрады Фалло, сразу очень синюшными. Становится очевидным, что ребенку сразу после рождения очень трудно просто — жить.
Венозная кровь, бедная кислородом, поступает в правое предсердие, в правый желудочек, а отсюда — снова в отходящую от него аорту и в большой круг кровообращения, так и не пройдя через легкие, не насытившись кислородом и не отдав углекислый газ. А кровь из легких по легочным венам идет в левое предсердие, в левый желудочек, и снова - в легочную артерию и в легкие, что с точки зрения ее насыщения кислородом бессмысленно, т.к. она уже насыщена. Образуется два разобщенных круга кровообращения.
И, если мы ранее условно изобразили взаимоотношение кругов кровообращения в виде восьмерки, лежащей на боку, то при транспозиции — это два замкнутых кольца, не связанных между собой.
Ясно, что такое положение дела просто несовместимо с жизнью. Но природа решает по-своему: оставляет открытым овальное окно (т.е. естественный дефект) в межпредсердной перегородке, через который происходит утечка части венозной крови в левые отделы, и потом — в легкие. Оба круга между собой связаны только этим шунтом.
Понятно, что количество крови, которое пройдет через дефект с каждым сердечным циклом, и от которого зависит ее насыщение, очень мало и никак не может обеспечить потребность организма. Если дефектов два, или добавляется еще дефект межжелудочковой перегородки - то это несколько лучше, т.к. количество окисленной крови в артериальной системе становится больше. Но все равно ее крайне недостаточно.
Дети, родившиеся с полной транспозицией магистральных сосудов, быстро впадают в критическое состояние , и, если им не помочь уже в первые дни жизни, они погибнут. Приступов одышки, как при тетраде Фалло, у них не будет, но цианоз появляется уже в первые часы, и малейшее физическое усилие — движения, сосание, плач — становится трудно или совсем невыполнимым. Что же необходимо делать? В первую очередь — расширить имеющийся дефект, увеличить его размер, чтобы сделать большим объем проходящей через него венозной крови.
Это достигается так называемой процедурой Рашкинда, суть которой сводится к тому, что в открытое овальное окно проводится катетер с баллончиком, который раздувают, тем самым разрывая межпредсердную перегородку и увеличивая дефект в диаметре. Процедура выполняется в кабинете рентгенохирургии и подготовка к ней включает все моменты, которые мы описали выше, когда говорили о зондировании сердца или о закрытии открытого артериального протока.
При полной транспозиции расширение дефекта должно быть сделано экстренно. Но это расширение — и увеличение потока смешанной крови — само по себе ничего не решает. Оно только немного улучшает состояние ребенка и продлевает ему жизнь, и надо что-то делать дальше, не откладывая. Эффект процедуры будет очень недолгим — всего несколько недель, а если ждать дольше, то ребенок может погибнуть от сердечной недостаточности и постоянного кислородного голодания.
Понятно, что идеальным методом лечения транспозиции является полное устранение этой «ошибки природы» — т.е. хирургическое перемещение аорты и соединение ее со «своим» левым желудочком (тогда как она сейчас отходит от правого), а легочной артерии - с правым желудочком.
Описание операции хирургического перемещения аорты и соединения ее со «своим» левым желудочком
После обычного введения ребенка в наркоз, открытия грудной клетки, соединения с аппаратом, начинают искусственное кровообращение, с помощью которого кровь одновременно охлаждают (это всегда делается и при других операциях, которые могут потребовать достаточно длительного времени — 1,5-2 часа и больше). Дело в том, что при охлаждении замедляются все обменные процессы (как у медведя в зимней спячке), а это - защита организма от всевозможных осложнений в последующем. С помощью аппарата охлаждение происходит быстро (как и согревание в завершающей стадии операции).
Аорта и легочная артерия рассекаются пополам. Коронарные артерии отрезаются от аорты и вшиваются в начало легочной артерии, которое будет потом устьем новой аорты. К этому участку подшивают отсеченную «свою» аорту, а затем из кусочка собственного перикарда делают трубку, которая вшивается в новую легочную артерию, восстанавливая и ее.
Таким образом, достигают истинной анатомической коррекции порока. Теперь все нормально: магистральные сосуды отходят от тех желудочков, от которых и должны отходить. Эта операция, как видим, сложная и длительная. Но сегодня ее делают достаточно успешно в нескольких кардиологических клиниках страны. Однако чтобы рассчитывать на успех, ее надо делать очень рано, т.е. в первые недели жизни.
Дело в том, что при рождении оба желудочка, правый и левый, хорошо развиты, имеют одинаковую мышечную массу и толщину стенок. При нормальном развитии у правого желудочка нагрузка оказывается меньше, чем у левого: ему не надо качать кровь в большой круг, т.е. по всему телу, и он довольно быстро привыкает к этому. Пройдет немного времени — и его стенка станет тоньше, и масса мышц уменьшится: зачем работать, если можно и не работать? То же самое происходит и при транспозиции — но с левым желудочком. При транспозиции желудочки новорожденного тоже изначально одинаковы, и то, что они работают против разных сопротивлений большого и малого кругов кровообращения, в первое время их никак не касается. Но потом левый желудочек истончается и теряет массу, а ведь после операции перемещения сосудов именно ему предстоит выполнять главную работу. И вот тут важно не упустить время, т.к. если ждать несколько месяцев, то даже в случае хорошего эффекта процедуры Рашкинда, радикальная коррекция будет уже невозможна. Наилучшее время для такой коррекции — первый месяц жизни.
Надо сказать, что такое лечение полной транспозиции применяется в течение уже 25 лет, а в последние годы становится стандартным. Понятно, что для успешного выполнения этой сложной операции необходима не только хорошо отработанная методика, но и безопасные для грудного ребенка методы обеспечения наркоза, искусственного кровообращения, ведения послеоперационного периода, т.е. всего того, что и приводит к окончательному успеху. Это может быть сделано только в крупных детских кардиохирургических центрах, имеющих большой опыт лечения врожденных пороков сердца.
Чего ждать после операции? В целом, результаты очень хорошие. Сегодня сотни оперированных больных ведут нормальный образ жизни, а продолжительность жизни некоторых детей, прооперированных одними из первых, уже насчитывает 20 и более лет. Конечно, наблюдение кардиолога, а иногда и подробные обследования, являются обязательными, т.к. по мере роста ребенка и самого сердца могут возникнуть проблемы. Однако, главные из этих проблем вполне можно устранить рентгенохирургическим путем, не прибегая к повторной операции.
К сожалению, радикальную операцию сделать можно не всегда. Главная из причин — позднее обращение к специалистам, когда время уже упущено. Нередко приходится видеть детей с полной транспозицией в возрасте одного-двух лет. Они очень синие и сильно отстают в физическом развитии. Их глаза — умные, страдающие, и как будто все понимающие — невозможно забыть никогда. Этим детям тоже можно и нужно срочно помочь, и такие методы есть, их применяют давно, и они хорошо себя зарекомендовали. Задолго до того, как хирургическая наука сделала возможным раннее и анатомически радикальное лечение транспозиции, был предложен другой, менее радикальный, но достаточно эффективный метод.
Идея заключается не в исправлении анатомии (тогда это было технически невозможно), а в изменении путей потоков крови, т.е. направлении крови из вен в легкие, в малый круг, а окисленной крови — в левый желудочек и в аорту, т.е. в большой круг.
Методы, известные как «внутрипредсердная коррекция» были долгое время единственными в лечение транспозиции, но они применяются и сегодня, когда по каким-то причинам нет возможности выполнить анатомическую коррекцию.
Суть операции сводится к рассечению правого предсердия, удалению всей межпредсердной перегородки и вшиванию внутри полости заплаты из собственных тканей ребенка (перикарда, или стенки предсердия) таким образом, что кровь из полых вен направляется в левый желудочек, от которого отходит легочная артерия, и затем — в легкие, а из легочных вен — в правый желудочек, в аорту и в большой круг кровообращения. Эти операции, известные по имени их авторов - Мастарда и Сеннинга, исправляют гемодинамику, но не сам порок. Сегодня в мире накоплен большой опыт таких операций, и судьба оперированных больных прослежена в течение уже нескольких десятков лет. У половины из них нормальная, достаточно активная и длительная жизнь. У другой части могут со временем возникать осложнения в виде нарушений ритма, недостаточности предсердно-желудочковых клапанов — ведь желудочки сердца остались на месте и работают не так, как предусмотрено природой. Люди, перенесшие такую операцию, иногда немного синюшные — особенно губы и ногти на руках и ногах. Остаются ограничения в физических нагрузках. Девочкам, достигшим зрелого возраста, могут не рекомендовать рожать детей, и не из-за того, что ребенок будет с пороком - это полное заблуждение, а из-за того, что беременность и роды могут оказаться чересчур большой физической нагрузкой. Но, как бы то ни было, методы внутрипредсердной коррекции спасли жизнь сотням детей. Так что, если и упущен момент для анатомической коррекции, выход есть, и хороший выход.
Тем более что в последние годы начали осуществлять операции перемещения сосудов с удалением старых внутрипредсердных заплат. Такое — не всегда возможно и необходимо, и, кроме как «высшим пилотажем» в кардиохирургии это нельзя и назвать. Но время идет вперед, и я только хочу, чтобы вы поверили: транспозиция магистральных сосудов сегодня — вполне излечимый порок, и ни один ребенок, родившийся с ним, погибать не должен. Но при этом его будущее зависит во многом и от вас, и от вашей веры в современные возможности медицины.
Случай успешного удаления миксомы левого предсердия
Для телемедицинской консультации в Научном центре сердечно-сосудистой хирургии им. А.Н. Бакулева поступила выписка на пациентку 52 лет из Смоленска с диагнозом:
Обледование по месту жительства
В последнюю неделю до поступления в стационар резко снизилась переносимость физических нагрузок. Пациентку стали беспокоить загрудинные боли без иррадиации, очень частый пульс и одышка в покое
В день поступления в поликлинике была потеря сознания с непроизвольным мочеиспусканием. За последний месяц трижды теряла сознание.
Проведенные исследования
Эхокардиография (ЭхоКГ) (Рис. 2): В левом предсердии объемное образование, D — 4,4×7,2 см. Фракция выброса (ФВ) — 58%, Левое предсердие — 5,5 см (5,5×7,3 см.), конечный диастолический размер — 5,5 см. Конечный систолический размер — 3,8 см. Недостаточность митрального клапана III-IV ст.
Рентгенография органов грудной клетки: Легочный рисунок несколько усилен за счет сосудистого компонента. Корни легких уплотнены, структурные, не расширены. Синусы боковые свободные. Тень сердца —увеличение отделов вправо и влево. Уплотнена дуга аорты.
Анализы крови и мочи без патологии.
Телемедицинская консультация в Центре Бакулева
Поликлиника НЦССХ
ЭКГ: фибрилляция предсердий, частота сердечных сокращений (ЧСС) = 87/мин. Вертикальное положение электрической оси сердца. Полная блокада правой ножки пучка Гиса.
Госпитализация в Центр Бакулева
Компьютерная томография
При мультифазном сканировании неинтенсивно накапливает контрастное вещество, преимущественно в артериальную фазу; образование не дифференцируется от межпредсердной стенки на протяжении 31х42х27мм, и во время диастолы интимно прилежит к передней митральной створке с пролабированием в полость левого желудочка на 12мм. Средостение: умеренно расширено, не смещено.
Послеоперационный период и выписка
ЭхоКГ:ФВ = 70%. Жидкости в полости перикарда нет. Недостаточность митрального клапана 1+.
Рентгенография:легкие расправлены. Свободной жидкости в плевральных полостях не выявлено.
Из реанимации переведена на вторые сутки после операции в удовлетворительном состоянии.
Не лихорадит. Кожные покровы чистые. В легких дыхание жесткое, хрипов нет. Сердечные тоны ритмичные, ясные, ЧСС = 85 уд/мин. Пульс на верхних и нижних конечностях удовлетворительный. АД = 120/80 мм рт ст. Печень +1см. Физиологические отправления в норме. Послеоперационная рана без признаков воспаления. В анализах крови и мочи патологии не выявлено.
Читайте также:
- Диагностика порэнцефалической кисты по КТ, МРТ
- Грыжи грудного отдела позвоночника. Оперативная тактика на грудном отделе позвоночника.
- КТ, МРТ оценка коленного сустава
- Переливание препаратов крови новорожденным. Мониторинг новорожденных до операции
- Анатомия: Соединительная оболочка глаза, tunica conjunctiva. Конъюктива глаза
