Эндофтальмит после операции на глазах. Профилактика
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
М.Т. АЗНАБАЕВ, Г.Я. ГАЙСИНА, Г.А. АЗАМАТОВА
Башкирский государственный медицинский университет, 450077, г. Уфа, ул. Ленина, д. 3
Представлен обзор литературы, посвященной проблеме послеоперационных воспалительных инфекционных осложнений в офтальмохирургии, из которых наиболее опасным является эндофтальмит. Рассмотрены этиология, факторы риска, частота возникновения, патогенез, клиника, диагностика, современные методы профилактики и лечения данной внутриглазной инфекции.
Ключевые слова: эндофтальмит, микроорганизм, воспаление, частота, профилактика.
M.T. AZNABAEV, G.Ya. GAYSINA, G.A. AZAMATOVA
Bashkir State Medical University, 3 Lenin St., Ufa, Russian Federation, 420077
Postoperative endophthalmitis
The article presents a review of literature, devoted to the problem of postoperative inflammatory infectious complications in ophthalmic surgery. The endophthalmitis is one of the most dangerous complications. We examined etiology, risk factors, incidence, pathogenesis, clinical features, diagnosis, current methods of prevention and treatment of this intraocular infection.
Key words: endophthalmitis, microorganism, inflammation, incidence, prevention.
В многочисленных работах отечественных и зарубежных авторов подчеркивается, что число случаев послеоперационного эндофтальмита неуклонно растет [9, 14, 22]. По результатам крупномасштабных исследований, послеоперационный эндофтальмит встречается от 0,05 до 1,77% [23-25, 9, 10]. Частота возникновения эндофтальмита в разных странах варьирует: в США — до 0,3% [9, 10, 14], Швеции — до 0,35% [26, 14], Великобритании — 0,14% [27, 14], Германии — 0,148% [14], Японии — 0,13% [28].
В литературе значительное внимание уделяется факторам риска развития послеоперационного эндофтальмита. Были определены такие способствующие факторы риска, как недостаточная антибиотикопрофилактика, возросшая лекарственная устойчивость микроорганизмов, многоразовый инструментарий, разрыв задней капсулы хрусталика, периоперационная связь со стекловидным телом, выпадение стекловидного тела, инфицирование ирригационного раствора и ИОЛ, наличие глубоких швов, плохое замедленное заживление операционной раны, возраст старше 85 лет, наличие сопутствующих заболеваний глаза [10, 15, 14].
Наиболее часто источником воспалительных инфекционных осложнений в хирургии глаза является собственная микрофлора поверхности глазного яблока, контаминированный хирургический инструментарий, среда операционной [29, 13, 14]. Исследования показывают, что при отсутствии профилактической предоперационной санации конъюнктивального мешка потенциальные возбудители гнойной инфекции обнаруживались до 78%, век — до 100% [30, 31].
По данным современных научных публикаций и EVS (Endophthalmitis Vitrectomy Study) [32], от 70 до 95% случаев послеоперационного эндофтальмита вызывается грамположительной микрофлорой, в частности грамположительными коагулазоотрицательными микрококками [9, 10, 30, 14]. Наиболее частыми возбудителями послеоперационного эндофтальмита являются Staphyllococcus epidermidis (75,0%), Staphylococcus aureus (14,1%), Streptococcus spp. (6,2%), Streptococcus hemophilis, Enterococcus spp. (3,1%), Pseudomonas aeuruginosa. [15, 31, 14]. Грамотрицательная флора встречается от 6 до 22 % случаев инфекционных осложнений [14, 30]. Анаэробная флора как возбудитель послеоперационного эндофтальмита выделяется реже.
Бактериальный эндофтальмит возникает в результате проникновения патогенных микроорганизмов (бактерий, грибов, простейших) в полость глазного яблока с последующим развитием воспаления внутренних оболочек и структур глаза. Пути проникновения инфекционного агента различны — через операционную рану с контаминированным инструментарием, интраокулярной линзой, ирригационными растворами, глазными каплями, применяемыми в послеоперационном периоде [33, 20].
Инфекционный процесс включает начальную фазу инкубации, фазу ускорения и фазу деструкции. В начальной фазе инкубации наблюдается пролиферация бактерий до критического уровня, проникновение их через гематоофтальмический барьер. Далее происходит экссудация фибрина и клеточная инфильтрация нейтрофильными гранулоцитами. Продолжительность этой фазы не менее 16-18 часов. В фазе ускорения отмечается первичная инфекция заднего сегмента, которая приводит к развитию воспаления в передней камере и иммунной реакции с участием макрофагов и лимфоцитов, инфильтрирующих стекловидное тело. Длительность этой фазы до 7 суток. Микроорганизмы, вызвавшие тяжелую внутриглазную инфекцию, начинают вырабатывать экзотоксины и эндотоксины, оказывающие разрушающее действие на клетки макроорганизма. Медиаторы воспаления, привлекая еще большее количество лейкоцитов, добавляют к деструктивным эффектам развитие повреждения сетчатки и витреоретинальную пролиферацию [6, 9, 15, 14].
Послеоперационный эндофтальмит может протекать остро, развиваясь в течение 6 недель после операции, либо хронически, развиваясь спустя 6 недель и более после полостных вмешательств на глазном яблоке. Клиническая картина острого эндофтальмита характеризуется резким снижением зрения, сильными болями. Объективно наблюдаются выраженная инъекция глазного яблока, отек век и конъюнктивы, отек роговицы, нередко с образованием абсцесса, клеточная реакция влаги передней камеры с выпадением фибрина и образованием гипопиона, инфильтрация стекловидного тела [32, 33, 15, 14,]. Для хронического эндофтальмита характерно рецидивирующее течение, медленное и прогрессирующие снижение зрительных функций, скудная симптоматика, с вовлечением в воспалительный процесс внутренних оболочек и структур глаза [32, 33, 34, 14]. Клинически хронический эндофтальмит манифестирует в виде постепенно развивающегося и рецидивирующего иридоциклита с крупными кератиновыми преципитатами, небольшим гипопионом. Отмечается легкий передний витреит и белесоватая бляшка в пределах капсулярного мешка [14]. Эндофтальмит позволяют диагностировать динамика зрительных функций, характерная клиническая картина, лабораторные, иммунологические, микробиологические исследования, данные ультразвукового сканирования и электрофизиологических исследований [33, 34, 14, 20]. Большое значение придается результатам бактериологических и иммунологических исследований. Исследуется аспираты передней камеры, интраокулярная линза, капсульный мешок, пунктаты стекловидного тела. Бактериоскопический метод в течение 1 ч. позволяет определить наличие микроорганизмов в исследуемом материале. Микробиологические исследования дают возможность идентификации бактерий с определением чувствительности к антибактериальным средствам, но в более длительные сроки [33, 20]. Неоценима роль ПЦР, позволяющая идентифицировать микроорганизмы на молекулярном уровне с высокой точностью [33, 14, 9, 10]. Проведение реакции возможно при минимальном объеме материала, что немаловажно в офтальмохирургии. В рамках исследования ESCRS (European Society Cataract and Refract Surgery) при послеоперационном эндофтальмите был использован в практике метод количественной ПЦР в режиме реального времени. Исследование проводилось с использованием флуоресцентных зондов, при котором уровень флуоресценции был пропорционален степени накопления двухцепочечных продуктов ПЦР. Данное исследование в режиме реального времени дает результаты количественного измерения микробной нагрузки через 90 минут [14].
Предполагаемый клинический диагноз послеоперационного эндофтальмита является неотложным состоянием, требующим лечения в пределах 1 часа после появления первых симптомов [13-15, 20]. Комплексное консервативное лечение эндофтальмита включает использование массивной общей и местной терапии антибиотиками широкого спектра действия в комбинации с сульфаниламидами, антигрибковых препаратов, противовоспалительную, осмотическую и дезинтоксикационную терапию [35, 13, 15, 18].
Различные экспериментально-клинические исследования показали высокую эффективность интравитреального введения антибактериальных препаратов при лечении эндофтальмита [35, 14], которая обеспечивает максимальную концентрацию лекарственного вещества в лечебной зоне. Однако высокое содержание препарата в целевой зоне сохраняется только в течение нескольких часов. По рекомендациям ESCRS [34, 14], при остром эндофтальмите к интравитреальному введению антибиотиков дополнительно применяется системная антибиотикотерапия теми же антибактериальными препаратами. Приведенная схема лечения поддерживает высокий уровень концентрации антибиотика на протяжении более длительного периода времени путем уравновешивания диффузии введенного лекарственного вещества из глаза. К тому же воспаление оболочек глаза способствует усилению проникновения препарата в глаз из системного кровотока [14]. Высокие системные дозы являются оптимальными, однако существует угроза в отношении риска развития системной токсичности. При отсутствии положительных сдвигов после повторного интравитреального введения антибиотика решается вопрос экстренного хирургического вмешательства [35, 14].
Результаты исследований некоторых авторов [13, 10, 14, 35] свидетельствуют в пользу комплексного хирургического лечения послеоперационных эндофтальмитов. Одним из главных принципов лечения внутриполостных гнойных процессов в общей хирургии является вскрытие гнойной полости, освобождение ее от накопившегося экссудата и обеспечение процесса дренирования. В офтальмологии способы лечения эндофтальмита, основанные на этом принципе, до сих пор применяются с осторожностью вследствие тонкого анатомического строения глазного яблока и в связи с этим большой опасностью повреждения внутренних тканей при операциях такого рода. Однако современное развитие микрохирургии позволяет снизить риск таких осложнений к минимуму.
Комплексное хирургическое лечение эндофтальмита заключается в следующем. В течение первых суток от начала воспаления начинают проводить интенсивную консервативную терапию с назначением антибиотиков широкого спектра действия и кортикостероидов парентерально и местно в виде инстилляций. Если по истечении суток нет положительной динамики, вводят 1 мг ванкомицина в полость стекловидного тела. При отсутствии стабилизации процесса через 1 сутки проводят субтотальную витрэктомию с повторным введением 1 мг ванкомицина. Если в течение трех суток после витрэктомии нарастают клинические симптомы эндофтальмита, производят повторную витрэктомию. В случаях наличия искусственного хрусталика его также удаляют. Консервативная терапия продолжается до полного стихания процесса воспаления [35]. Немедленное выполнение витрэктомии оказывает значительный положительный эффект у пациентов с остротой зрения, равной светоощущению (или худшей) в момент обращения [34, 14].
На сегодняшний день «золотым стандартом» лечения эндофтальмита во многих странах является полная витрэктомия с последующим введением антибиотиков в полость глаза. Данная операция позволяет с минимальными повреждениями эвакуировать содержимое задней камеры глаза (микроорганизмы и продукты их жизнедеятельности) с замещением стекловидного тела стерильными жидкостями (физиологический раствор, силикон, озонированные перфторуглероды) [20, 24, 33, 20, 35]. Последующее интравитреальное введение антибиотика обеспечивает максимальную концентрацию препарата в стекловидном теле.
Хронический эндофтальмит трудно поддается мощной противовоспалительной и антибактериальной терапии. При хронической форме внутриглазной инфекции микроорганизмы изолированы в капсулярном мешке и защищены биопленкой, они могут локализоваться также внутри макрофагов, где на них практически не оказывают действия даже антибиотики, успешно применяемые при острой форме эндофтальмита. Исследования, проведенные Warheker (1999) и Karia (2001), показывают, что кларитромицин оказывает положительный эффект в дозе 500 мг 2 раза в день в течение 2-4 недель. При добавлении промывания капсулярного мешка ванкомицином повышалась частота ответа на лечение в случаях инфекции, вызванной Propionibacterium [32, 34, 14]. По данным руководства ESCRS [14], существует несколько видов хирургических вмешательств при хроническом эндофтальмите: промывание антибиотиком капсулярного мешка при первичной пункции передней камеры, интравитреальная инъекция антибиотиков (ИВВ), витрэктомия pars plana (ВПП) c ИВВ, ВПП с частичной капсулэктомией и ИВВ, ВПП с тотальной капсулэктомией, ИВВ, извлечением интраокулярой линзы.
Антибактериальные препараты при эндофтальмите применяют местно в виде инстилляций, подконъюнктивальных, ретро- и парабульбарных инъекций [33]. На основании собственных исследований американские ученые при выборе эмпирической химиотерапии рекомендуют использовать только комбинацию антибактериальных препаратов [35]. Через 24-48 часов в зависимости от клинического ответа и профиля чувствительности выделенного микроорганизма проводят модификацию антибиотикотерапии.
Из противовоспалительных препаратов используют глюкокортикоиды. Применяют их как местно (в каплях, в субконъюнктивальных инъекциях), так и системно. Некоторые авторы предлагают вводить дексаметазон интравитреально в дозировке 400 мг на 0,1 мл. Более высокие дозы оказывают токсическое действие на сетчатку [33, 20, 32].
Несмотря на проводимое интенсивное комплексное лечение эндофтальмита, функции глаза удается сохранить в редких случаях. К сожалению, основным методом хирургического лечения эндофтальмита до сих пор является энуклеация глазного яблока [20, 35, 13, 18].
Для максимального снижения риска возникновения в послеоперационном периоде эндофтальмита, рекомендуется назначение пред- и послеоперационной антибактериальной терапии. В вопросе выбора метода антибиотикопрофилактики эндофтальмита после хирургии катаракты мнения специалистов различных странах мира разделяются. В США хирурги применяют метод инстилляции антибиотиков до и после операции. В Великобритании хирурги редко применяют антибиотики до операции, и чаще всего назначают препараты после хирургического вмешательства. В Австралии и Пакистане препараты в виде инстилляций и внутрикамерных инъекций используют редко, в основном инъекции под конъюнктиву. Офтальмологи в Швеции используют антибиотики исключительно внутрикамерно [19, 26]. По мнению зарубежных коллег, одним из эффективных вариантов профилактики операционных осложнений является введение антибиотиков (ванкомицин, цефалоспорины, аминогликозиды) в переднюю камеру глаза на заключительном этапе операции [9, 10, 26, 14]. Внутрикамерная инъекция антибиотика обеспечивает необходимую высокую концентрацию препарата во влаге передней камеры и быструю доставку в лечебную зону. Однако этот метод имеет свои недостатки. Многие исследователи подчеркивают опасность развития токсического синдрома переднего сегмента глаза (TASS) [10, 26, 14] и кистозного макулярного отека при внутрикамерной инъекции антибиотиков [10, 33, 14]. Кроме того, отсутствует информация об оптимальной концентрации, дозы и способа приготовления лекарственного препарата для внутрикамерного введения. Все вышесказанное обуславливает неоднозначное отношение к данному методу профилактики воспалительных осложнений [9, 17].
При выборе антибиотика для эффективной профилактики инфекционного воспаления необходимо учитывать чувствительность микрофлоры глаза к препарату. Количество устойчивых к антибиотикам штаммов микроорганизмов неуклонно растет, в связи, с чем осложняется профилактика и лечение внутриглазных инфекций [13, 15, 21, 30]. Широким спектром антимикробного действия обладают современные фторхинолоны, что позволяет успешно использовать их для профилактики воспалений. Фторхинолоны активны в отношении большинства возбудителей эндофтальмита, также против микроорганизмов, у которых выработалась резистентность к другим классам антибактериальных препаратов, включая макролидо- и пенициллинорезистентные пневмококки и b-лактамазопродуцирующие штаммы Haemophilus influenza. Эти препараты обладают способностью абсорбироваться на роговице и проникать во влагу передней камеры, создавая в ней высокие уровни концентрации [9, 16, 21, 22]. Фторхинолоны отличает низкий уровень частоты побочных эффектов и хорошая переносимость пациентами [21].
Лечение послеоперационного эндофтальмита является трудной задачей, лечебный эффект достигается только в части случаев, поэтому вопрос профилактики остается наиболее актуальной задачей современной офтальмохирургии.
Эндофтальмит
Эндофтальмит - это абсцедирующее воспаление внутренних структур глаза, приводящее к скоплению гнойного экссудата в стекловидном теле. При эндофтальмите отмечаются боли в глазном яблоке, отек и покраснение век и конъюнктивы, значительное понижение остроты зрения, гипопион. В диагностике эндофтальмита используется визометрия, исследование полей зрения, биомикроскопия глаза, диафаноскопия, офтальмоскопия, электроретинография, УЗИ глаза. Комплексное лечение эндофтальмита включает антибиотикотерапию, дезинтоксикационную, противовоспалительную, рассасывающую терапию; интравитреальные, парабульбарные или субконъюнктивальные инъекции, парацентез и промывание передней камеры; при тяжелом течении эндофтальмита - витрэктомию.
МКБ-10
Общие сведения
Гнойные воспаления тканей глазного яблока относятся к числу грозных состояний в офтальмологии, требующих оказания специализированной неотложной помощи. Гнойный процесс при эндофтальмите прогрессирует стремительно, иногда в течение нескольких часов приводя к развитию панофтальмита - тотального воспаления и расплавления всех оболочек глазного яблока и тканей орбиты. По различным данным, частота слепоты, функциональной и анатомической гибели глаза, приводящей к энуклеации, у пациентов с внутриглазной инфекцией достигает 28 - 89%. Данные обстоятельства ставят перед офтальмологами задачу своевременной профилактики, раннего выявления и адекватного лечения инфекций глазного яблока.
Причины эндофтальмита
Экзогенные причины
Экзогенные случаи инфицирования внутриглазных тканей преимущественно связаны со следующими факторами:
- проникающими ранениями глаз (95-97 %),
- операциями на глазном яблоке (2-4%),
- прободными гнойными язвами роговицы,
- инфицированными ожогами глаз.
В структуре механических повреждений глаз, сопровождающихся развитием эндофтальмита, преобладает детский травматизм (40 %), производственные (30%) и сельскохозяйственные (25-50%) травмы. Проникновение в глаз инородного тела значительно повышает риски возникновения эндофтальмита. Послеоперационный эндофтальмит чаще развивается вследствие экстракции катаракты с имплантацией заднекамерной ИОЛ.
При экзогенном инфицировании глаза выделяют первичную и вторичную микробную инвазию. В первом случае микробы попадают в глубокие структуры глаза в момент проникающего ранения или инвазивного вмешательства, а воспалительная реакция развивается уже в первые 2-3 суток. При вторичной микробной инвазии инфицирование развивается в поздние сроки вследствие неадекватной первичной обработки раны, ее зияния, размозжения краев и т. п.
Эндогенные причины
Эндогенный механизм развития эндофтальмита встречается в 1-2 % случаев и связан с гематогенным заносом микробных возбудителей в капилляры радужки и ресничного тела из отдаленных воспалительных очагов в организме при:
- фурункулах, абсцессах, флегмонах,
- синуситах, тонзиллите,
- пневмонии,
- остеомиелите,
- сепсисе,
- менингите,
- септическом эндокардите и др.
Возбудители экзогенного и эндогенного эндофтальмита многообразны. Наиболее часто при бактериологическом исследовании выявляются стафилококки, стрептококки, коринебактерии, протей, гемофильная палочка, синегнойная палочка, нейссерии, энтеробактерии, клебсиелла, пневмококки и различные полимикробные ассоциации. Опасную разновидность представляет грибковый эндофтальмит, который может вызываться более чем двадцатью разновидностями грибков (рода акремониум, кандида, аспергилл, цефалоспориум, нейроспора и др.).
Патогенез
Патогенез эндофтальмита при экзогенном инфицировании многоплановый. В случае нарушения целостности роговицы или склеры микроорганизмы проникают внутрь стекловидного тела, где беспрепятственно размножаются. Образуется внутриглазной очаг инфекции, который быстро распространяется на все оболочки глаза. В свою очередь, нарушение иммунологической изолированности глаза сопровождается аутоиммунной воспалительной реакцией, способствующей ослаблению сопротивляемости инфекции, и агрессивному течению эндофтальмита и панофтальмита.
Образующийся гнойный экссудат приводит к увеиту, расплавлению сосудистой и сетчатой оболочек, инкапсуляции с образованием шварт. Швартообразование в последующем вызывает тракции и отслойку сетчатки с исходом в гипотензию и атрофию глазного яблока.
Симптомы эндофтальмита
Эндофтальмит может протекать по типу отграниченного очага в глазу (абсцесса стекловидного тела) либо диффузного процесса; иногда встречается смешанная форма. По степени тяжести симптоматики выделяют легкую, среднюю и тяжелую степени эндофтальмита.
Экзогенный эндофтальмит развивается на 2-3 сутки после механического повреждения глаза. Прогрессирующее течение заболевания сопровождается болью в глазном яблоке, нарастающим снижением остроты зрения иногда до светоощущения, плавающими помутнениями в поле зрения. Внешние изменения глаза характеризуются умеренным отеком век и конъюнктивы, резкой смешанной инъекцией глазного яблока. Могут развиваться признаки иридоциклита. Характерной чертой эндофтальмита является формирование абсцесса в стекловидном теле, который просвечивает через зрачок желтоватым свечением.
Осложнения
При эндофтальмите тяжелой степени развивается выраженный хемоз, гипопион и гноетечение. Эндогенные эндофтальмиты, протекающие на фоне иммунодефицита или интоксикации, могут носить двусторонний характер. Прогрессирование эндофтальмита приводит к переходу в панофтальмит, что угрожает анатомической и функциональной гибелью глаза, риском развития менингита.
Диагностика
Комплексное офтальмологическое обследование при эндофтальмите позволяет оценить тяжесть процесса и выработать лечебную тактику. При подозрении на эндофтальмит проводится:
- Визометрия. Типичная офтальмологическая картина при эндоофтальмите характеризуется снижением остроты зрения: при легкой степени - частичным, при средней - выраженным, при тяжелой - значительным снижением или отсутствием зрения.
- Исследование полей зрения. Поле зрения сужено или отсутствует.
- Биомикроскопия. Проведение биомикроскопии выявляет смешанную инъекцию глазного яблока, наличие преципитатов на поверхности роговицы, гипопиона, гиперемию и инфильтрацию радужки, образование задних синехий
- Диафаноскопия глаза. Диафаноскопия глаза в проходящем свете позволяет обнаружить желтовато-серый зрачковый рефлекс, свидетельствующий об образовании абсцесса в стекловидном теле. При обратном развитии эндофтальмита ввиду формирования на месте гнойника соединительной ткани рефлекс приобретает молочно-белый оттенок.
- Офтальмоскопия. Проведение прямой и обратной офтальмоскопии при эндофтальмите затруднено и частично возможно только при легкой степени тяжести заболевания.
- Измерение ВГД. Внутриглазное давление при эндофтальмите обычно снижено.
- УЗИ глаза. Выявляет ограниченные или тотальные помутнения в стекловидном теле. Для верификации возбудителя проводится посев культуры из стекловидного тела и водянистой влаги.
- Элекрофизиологические исследования. Показатели электроретинографии могут соответствовать или быть близкими к норме (при очаговом эндофтальмите), значительно снижаться вплоть до исчезновения (при диффузном или смешанном эндофтальмите).
Последствия эндофтальмита у детей необходимо дифференцировать от злокачественной опухоли сетчатки - ретинобластомы.
Лечение эндофтальмита
Лечение эндофтальмита проводится в условиях отделения хирургической офтальмологии. Сразу же после установления диагноза назначается:
- Системная терапия: ударные дозы антибиотиков широкого спектра действия, сульфаниламиды, антимикотические средства, противовоспалительные препараты (НПВП, кортикостероиды), мощная дезинтоксикационная терапия, общеукрепляющая терапия (витаминотерапия, аутогемотерапия), рассасывающая терапия (ферменты).
- Внутриглазные инъекции. Для достижения максимальной концентрации антибактериальных препаратов внутри глаза проводится их внутривенное, внутримышечное, субконъюнктивальное, ретробульбарное, парабульбарное, супрахориоидальное, интравитреальное введение. Одновременно назначаются инстилляции противомикробных глазных капель и аппликации мазей.
- Пункция стекловидного тела. При витреите или гипопионе производится лечебно-диагностическая пункция стекловидного тела с забором экссудата для бактериального посева и введением антибиотика в стекловидное тело. При эндофтальмите возможно проведение внутриартериальной офтальмоперфузии лекарственных препаратов через надглазничную артерию. Для лечения эндофтальмита используются цефалоспорины, гликопептиды, пенициллины, аминогликозиды, фторхинолоны, макролиды и др.
При неэффективности интенсивной консервативной терапии эндофтальмита возникает необходимость хирургического удаления части стекловидного тела - витрэктомии. В послеоперационном периоде антибиотикотерапия должна быть продолжена.
Прогноз и профилактика
Своевременное комплексное лечение эндофтальмита, начатое в легкой стадии, позволяет сохранить зрительные функции. В более поздних стадиях зачастую удается сохранить глаз как анатомический орган, но спасти зрение практически невозможно. Исходом эндофтальмита чаще всего является субатрофия и атрофия глазного яблока. При прогрессировании эндофтальмита в панофтальмит приходится прибегать к энуклеации глазного яблока.
Профилактика экзогенного инфекционного эндофтальмита требует предупреждения травм глаза, проведения адекватной ПХО раны при проникающих ранениях, своевременного удаления инородных тел конъюнктивы и роговицы, грамотного проведения операций на структурах глаза. Для исключения развития эндогенного эндофтальмита необходима санация фокальных гнойных очагов и лечение общих септических состояний.
Послеоперационный эндофтальмит: современные методы профилактики и лечения
Ключевые слова: послеоперационный эндофтальмит, TASS-синдром, витрэктомия, антибиотики, стекловидное тело.
Эндофтальмит — (от греч. endo — внутри и ophthalmos — глаз) — это гнойное воспалительное заболевание внутренних оболочек глаза. Возникает вследствие инфицирования бактериями или грибами во время травмы, интраоперационно или в раннем послеоперационном периоде, в редких случаях — из-за распространения инфекции из эндогенных источников. Учитывая патогенез заболевания, время, необходимое для миграции патогенов в заднюю камеру глаза и накопления там медиаторов воспаления, составляет не менее 2 суток.
По механизму возникновения эндофтальмит подразделяют на:
- Острый послеоперационный (возникает в срок до 2 недель после выполненной операции)
Частота развития эндофтальмита после экстрации катаракты, по данным Европейского общества катаральных и рефракционных хирургов (ESCRS) [1], составляет 0,35 % без применения интракамерального введения цефуроксима, с применением — 0,05 %. В США, по данным Нила Шорстейна (Neal H. Shorstein) — 0,31 % и 0,014 % соответственно [8].
Этиология ипатогенез
По данным исследования Endophthalmitis Vitrectomy Study (EVS), основным источником инфицирования является микрофлора поверхности конъюнктивы пациента [7]. Самыми распространенными причинами развития острого послеоперационного эндофтальмита являются коагулазонегативные стафилококки, в частности Staphylococcus epidermidis (33-77 %); Staphylococcus aureus (10-21 %). При хроническом эндофтальмите наиболее вероятным возбудителем является Proprionibacterium acnes.
Микроорганизмы, часто встречающиеся при остром послеоперационном эндофтальмите [1]
Распространённость (%)
Виды микроорганизмов
КНС (коагулазонегативные стафилококки)
BHS (β-гемолитические стрептококки),
S. pneumoniae, ∂-гемолитические стрептококки, включая S. mitis и S. salivarius
Грамотрицательные бактерии, включая Ps. aeruginosa
Грибы (виды Candida, виды Aspergillus, виды Fusarium)
Микроорганизмы, часто встречающиеся при хроническом или позднем послеоперационном эндофтальмите [1]
К факторам риска развития эндофтальмита относятся:
- Увеличенное время операции у неопытного хирурга
- Повреждение задней капсулы хрусталика и стекловидного тела во время операции
- Наличие у пациента блефарита до операции
- Поверхность интраокулярных линз как среда для развития микроорганизмов
- Недостаточная стерилизация инструментов и операционного поля
Следует также отметить роль бесшовных оперативных методик в развитии послеоперационного эндофтальмита: использование туннельного бесшовного разреза роговицы способствует повышению частоты развития эндофтальмита после факоэмульсификации катаракты вследствие возможности всасывания в переднюю камеру слезной жидкости в раннем послеоперационном периоде.
По данным руководства ESCRS, у пациентов с роговичным туннелем вероятность развития эндофтальмита в 5,88 раз больше, чем при корнеосклеральном доступе [1].
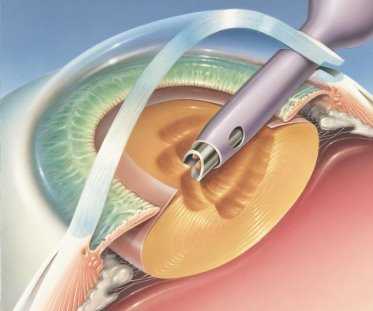
Рис. 1. Применение роговичного тоннельного доступа
В том же руководстве сообщается, что при имплантации силиконовых интраокулярных линз (ИОЛ) вероятность развития эндофтальмита в 3,13 раз выше в сравнении с линзами из акрила или другого материала, а хирургические осложнения сопровождались 4,95-кратным увеличением данного риска. Большинство имплантируемых ИОЛ на данный момент изготовлены из гидрофобного акрила, а силиконовые встречаются редко по причине инфекционных осложнений и риска повредить линзу при имплантации через разрезы менее 2,8 мм [15].
Клиника идиагностика
К основным клиническим проявлениям эндофтальмита, согласно исследованию EVS, относятся: нечёткость зрения (94 % пациентов), болевой синдром (74 %), отёк век (34 %), гипопион (80 %), покраснение глаза (82 %), помутнение сред глаза (74 %). Лизис стекловидного тела и замещение его гнойными массами вызывают жёлто-зелёный рефлекс с глазного дна.
По степени тяжести эндофтальмит может быть условно разделен на лёгкий, средней тяжести и тяжёлый:
- Лёгкий: слабо выраженный болевой синдром, умеренная инъекция глазного яблока, возможно проведение офтальмоскопии.
- Средней тяжести: выраженный болевой синдром и инъекция глазного яблока, невозможна офтальмоскопия, значительно снижена острота зрения, допускается наличие витреита, хемоза, отёка век.
- Тяжёлый: выраженный болевой синдром с иррадиацией в соответствующую половину черепа; выраженные: инъекция глазного яблока, хемоз, гипопион, витрит, отёк век; невозможна офтальмоскопия; снижение остроты зрения вплоть до светооощущения.
А. М. Южаков предложил классификацию в зависимости от формы развития:
- Очаговый эндофтальмит (абсцесс стекловидного тела), стадии I-II
- Диффузный эндофтальмит, стадии I-IV
- Смешанная форма, стадии I-IV
- Панофтальмит — конечный результат инфекционного процесса
При подозрении на послеоперационный эндофтальмит каждый час определяется острота центрального зрения, при ее резком снижении незамедлительно приступают к хирургическому лечению. Снижение зрительных функций до светоощущения является прогностически неблагоприятным фактором. Помимо визометрии, проводится биомикроскопия и офтальмоскопия для динамической оценки послеоперационного воспаления. Из инструментальных методов исследования обязательным является УЗИ (B-scan).
Дополнительно также проводятся периметрия и электрофизиологические исследования зрительного нерва и сетчатки (электроретинография). Снижение их показателей будет указывать на токсическое повреждение внутренних оболочек глаза и являться показанием для хирургического лечения.
Перспективным методом диагностики и контроля эффективности лечения является лазерная тиндалеметрия. Принцип работы основан на измерении интенсивности лазерного луча, отраженного от взвешенных во влаге передней камеры клеток и крупномолекулярных белков (альбуминов и макроглобулинов). Когда частица белка или клетка проходит через фокус лазера, происходит отражение излучения.
До начала лечения обязательным является предварительная пункция передней камеры глаза и биопсия стекловидного тела для проведения бактериологического анализа. Взятые пробы окрашивают по Граму (экспресс-метод) с дальнейшей идентификацией микроорганизмов и определением чувствительности к антибиотикам.
ПЦР с использованием праймеров широкого диапазона, нацеленных на высококонсервативные регионы эубактериальной 16S рДНК (18S рДНК для грибов), может выявлять и амплифицировать минимальные количества бактериальной ДНК, с их последующим секвенированием и идентификацией. Она обеспечивает намного лучшее выявление патогенов, особенно в случаях хронического эндофтальмита с малым количеством патогенов [9].
Дифференциальная диагностика сTASS-синдромом
Синдром токсического повреждения переднего сегмента глаза (TASS-синдром, экссудативно-воспалительная реакция) — состояние, сходное с эндофтальмитом по клиническим проявлениям, но имеющее другой патогенез. Синдром токсического повреждения переднего сегмента глаза (TASS-синдром) представляет собой стерильную послеоперационную воспалительную реакцию, вызываемую веществом неинфекционного происхождения, попавшим в передний сегмент глаза, что приводит к токсическому повреждению внутриглазных тканей.
Основные группы веществ, которые при попадании в передний сегмент могут вызвать TASS-синдром:
- Вещества извне, которые случайно проникают в переднюю камеру глаза во время или после операции (например, повидон-йод для местного применения).
- Продукты, вводимые в переднюю камеру глаза как часть хирургической процедуры, такие как сбалансированный солевой раствор из партии, произведенной с ошибочным рН или осмолярностью (или с лекарственными препаратами, добавленными в операционной) или анестетики (безопасным является только не содержащий консервантов 1 % лидокаин). Любой лекарственный препарат, вводимый в глаз, не должен содержать консервантов и должен использоваться в надлежащей концентрации, чтобы избежать развития токсических реакций.
- Раздражающие вещества на инструментарии, скопившиеся вследствие его неправильной очистки и/или стерилизации (например, денатурированные офтальмологические вискоэластики, оставшиеся на многоразовом инструментарии, стабильные к воздействию тепла эндотоксины, сульфатные примеси после автоклавирования паром).
К отличительным признакам TASS-синдрома относятся:
- Раннее начало (уже через 12-24 часа после операции)
- Отек роговицы от лимба до лимба, вторичный по отношению к распространенному повреждению слоя эндотелиальных клеток
- Повреждение радужной оболочки (фиксированный, расширенный или неправильной формы зрачок, дефекты просвечивания радужной оболочки)
- Высокое ВГД вследствие повреждения трабекулярной сети
- Отсутствие витрита (наиболее важная характеристика TASS-синдрома, поскольку он характеризуется главным образом воспалением переднего сегмента глаза, в то время как при эндофтальмите вовлекается задний сегмент).
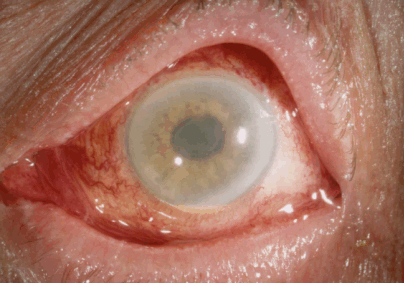
Рис. 2. Отёк роговицы, деформация зрачка и гипопион у пациента с TASS-синдромом [6]
Лечение TASS-синдрома включает в себя интенсивное применение местных кортикостероидов (и иногда пероральных).
Лечение острого послеоперационного эндофтальмита
Основными методами лечения являются витрэктомия и интравитреальное введение антибиотиков. ESCRS рекомендует при наличии витреоретинального хирурга и оснащенной операционной проводить стандартную трехпортовую центральную или полную витрэктомия по принципу «Ubi pus ibi evacuat» («Где гной, там очищай»). При центральной витрэктомии остается часть основы стекловидного тела, в то время как более полная витрэктомия сопровождается риском ятрогенного отслоения сетчатки, что является потенциальной катастрофой. Данный выбор остается за витреоретинальным хирургом.
После того, как витрэктомия выполнена, через один из разрезов склеры с использованием иглы диаметром 25-30G интравитреально вводятся антибиотики. В случае выполнения полной витрэктомии дозу следует уменьшить на 50 %. Данную инъекцию следует проводить медленно, в течение 1-2 минут, в середину стекловидного тела, направляя конец иглы вверх, подальше от макулы. Отдельные шприцы и отдельные иглы, для меньшей вероятности контаминации, вводятся через уже имеющееся отверстие. Затем интравитреально вводится дексаметазон (не содержащий консервантов).
Когда операцию «золотого стандарта» невозможно выполнить вследствие отсутствия витреоретинального хирурга и витреоретинальной операционной, приемлемым вариантом является проведение биопсии стекловидного тела с интравитреальным введением антибиотиков без последующей терапевтической витрэктомии («серебряный стандарт»). Поскольку простая аспирация с помощью иглы зачастую безуспешна, ее можно провести с помощью портативного витректора.
Дозы интравитреальных антибиотиков следует выбирать особо тщательно, потому что зазор для ошибки между терапевтической дозой и токсичностью является узким, особенно для аминогликозидов (гентамицин в дозе 200 мкг является эффективным, но в дозе 400 мкг может быть токсичным, вызывая макулярный инфаркт).
Комбинацией лекарственных средств первого выбора являются ванкомицин (1 мг) сцефтазидимом (2 мг).
Комбинация второго выбора: ванкомицин (1 мг) вкомбинации самикацином (0,4 мг), особенно у пациентов с чувствительностью к ß-лактамам. Несмотря на синергизм между ванкомицином и амикацином в отношении грамположительных микроорганизмов, многие хирурги избегают применения аминогликозидов для эрадикации грамотрицательных бактерий из-за риска ретинальной токсичности.
И. А. Фролычев предлагает введение раствора антибиотика в витреальную полость сочетать с тампонадой ПФОС [2], ввиду того, что раствор антибиотика активно перемещается с пузырем ПФОС в зависимости от положения тела пациента («на спине» — максимальное воздействие у зубчатой линии сетчатки, в положении стоя или сидя — воздействие на верхние отделы сетчатки, «на боках» — воздействие на назальную или височную половину сетчатки). При этом риск токсического локального воздействия растворов антибиотиков значительно снижается. При использовании ПФОС уменьшается риск токсического поражения макулярной зоны струей вводимого интравитреально АБ препарата. ПФОС, создавая противодействие вводимой струе препарата, препятствует токсическому повреждению макулы, освобождает хирурга от необходимости вводить раствор антибиотика медленно в течение 2-3 минут.
Тяжелый острый гнойный эндофтальмит следует лечить с использованием дополнительной системной антибиотикотерапии теми же лекарственными препаратами, которые используются для интравитреальной терапии. Такая схема лечения поможет поддерживать значимые интравитреальные концентрации лекарственного препарата на протяжении более длительного времени путем уравновешивания диффузии введенного препарата из глаза.
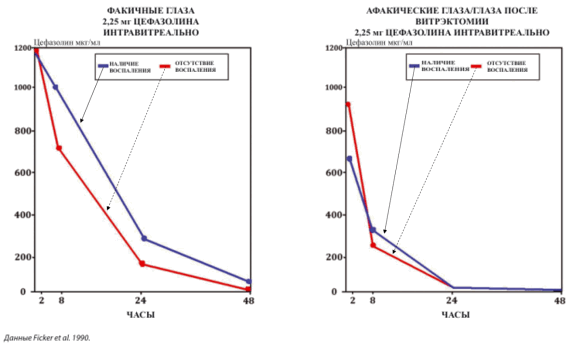
Рис. 3. Скорость выведения цефазолина из стекловидного тела [1]
Лечение хронического послеоперационного эндофтальмита
В отличие от острого послеоперационного эндофтальмита, представляющего собой неотложное состояние, в случае возможного хронического послеоперационного эндофтальмита имеется больше времени для правильной постановки диагноза и выбора вида лечения.
При хроническом эндофтальмите микроорганизмы изолированы в капсулярном мешке и защищены биопленкой; также они могут иметь внутриклеточную локализацию внутри макрофагов, где их не достигают антибиотики, часто используемые для лечения острого эндофтальмита. Однако некоторые антибиотики, такие как кларитромицин, хорошо абсорбируются при приеме внутрь, хорошо проникают в глаз, обладают антибиопленочными свойствами и концентрируются внутри нейтрофилов и макрофагов, где они в лучшей степени способны уничтожать внутриклеточные грамположительные бактерии.
Некоторые исследования [10,11] нашли применение кларитромицина эффективным и рекомендовали использовать дозу в 500 мг 2 раза в день на протяжении 2-4 недель. Добавление промывания ванкомицином капсулярного мешка повышало частоту ответа на лечение в случаях инфекции, вызванной видами Propionibacterium [13].
Для лечения хронического эндофтальмита существует несколько вариантов хирургических вмешательств:
- Промывание антибиотиком капсулярного мешка при первичной пункции передней камеры или при последующем вмешательстве в случаях положительного результата бакпосева
- Интравитреальная инъекция антибиотиков (ИИАБ)
- Витректомия рars plana (ВПП) с ИИАБ
- ВПП с частичной капсулэктомией (ЧК) и ИИАБ
- ВПП с тотальной капсулэктомией (ТК), ИИАБ, извлечением или заменой ИОЛ (зИОЛ)
Чем более агрессивным является лечение, тем ниже частота рецидивирования [14].
Профилактика
Основные этапы антисептики впредоперационном периоде
1. Обязательная обработка повидон-йодом роговицы и конъюнктивального мешка
2. Обязательная обработка повидон-йодом окологлазничной области
3. Использование медицинской спецодежды (халат, перчатки и пр.) и специального режима вентиляции в операционной
4. Обкладывание глаза салфетками,
заклеивание век и ресниц (не обрезать)
Основой профилактики послеоперационного эндофтальмита является соблюдение правил асептики и антисептики. Применение местных антибиотиков в каплях перед операцией не показано ввиду низкой эффективности и отсутствия доказательной базы [12].
Основные термины (генерируются автоматически): стекловидное тело, ESCRS, токсическое повреждение, EVS, передний сегмент глаза, антибиотик, выраженный болевой синдром, глазное яблоко, передняя камера глаза, лекарственный препарат.
Ключевые слова
Похожие статьи
Характер повреждения зрительного анализатора при алкогольной.
Глаза являются самой выразительной частью лица, и, как писал выдающийся русский писатель А. П. Чехов: «Глаза— это зеркало души».
Биомикроскопические исследования не выявили каких-либо особенностей в состоянии переднего отрезка глаза и стекловидного тела [3].
Современные подходы в лечении катаракты | Статья в журнале.
Деструкция стекловидного тела. Больные жалуются на постепенное снижение остроты зрения, как правило, возникающее на фоне воспалительных заболеваний глаза. При биомикроскопии хрусталик прозрачен, выявляется деструкция передних отделов стекловидноготела.
Влияние физических факторов окружающей среды на.
Передняя камера глаза — это пространство между роговицей и радужкой.
Стекловидное тело — гелеобразная прозрачная субстанция, расположенная в заднем отделе глаза.
Характер повреждения зрительного анализатора при алкогольной.
Дистрофия роговицы Когана: клиника, диагностика, лечение
5. Эндотелий является внутренней частью роговицы, обращенной в переднюю камеру глаза и омываемой внутриглазной жидкостью.
Симптоматическая клиника дистрофии связана с синдромом рецидивирующей эрозии роговицы и временным незначительным снижением.
Почему глаза двигаются вместе? | Статья в журнале.
Он находится в передней части глазного яблока. В преломлении света участвует также вещество, которым заполнена большая часть (2/3 объема) глазного яблока
Современные техники стабилизации изображения на сетчатке.
Первые способы фиксации стимуляции на сетчатке глаза включали в себя полное обездвиживание глаз [1]. Затем
Такие методы позволяли стабилизировать воспринимаемы объекты на глазном яблоке таким образом, что он перемещался вместе с движением взора с.
Клинические проявления, диагностика и исходы невритов.
Весь глаз по форме похож на шар и называется глазным яблоком (рис. 1). Рис. 1. Глазное яблоко. Когда свет достигает сетчатки, она
Основные термины (генерируются автоматически): поражение глаз, суставной синдром, ювенильный ревматоидный артрит, послеоперационный.
Офтальмологическая реабилитация больных ювенильным.
Деструкция стекловидного тела отмечалась у 9 (28 %), синехии почти у трети пациентов, катаракта — у 7 (22 %) больных.
Артикулярный синдром был вторичным по отношению к патологии глаз в 7 (22 %) случаях (артрит возник через 2-7 лет, в среднем 3,5 года).
Особенности течения и реабилитация больных ювенильным.
Артикулярный синдром был вторичным по отношению к патологии глаз в 7 (22 %) случаях (артрит возник через 2- 7 лет, в среднем 3,5 года).
Эндофтальмит после операции на глазах. Профилактика
Treatment of postoperative exudative inflammatory reaction in surgery of complicated cataracts
M.T. Aznabaev, M.A. Gizatullina, O.I. Orenburkina
Ufa NII of Eye Diseases
Purpose: To study the efficacy of antistaphylococcus human immunoglobulin and 0, 25% Derinate in complex treatment of exudative inflammatory reaction (EIR) in postoperative period.
Materials and methods: Results of treatment of 26 patients with EIR after complicated cataract extraction were analyzed. All patients in postoperative period received traditional treatment, including mydriatics, antibacterial and non steroidal anti-inflammatory drugs.
15 patients (main group) also received parabulbar injections of antistaphylococcus human immunoglobulin by 0,5 ml each day during 3-5 days and 0,25% Derinate instillations 4 times per day during 3-7 days.
Results: Combined treatment of EIR with antistaphylococcus human immunoglobulin and 0, 25% Derinate allows to stop inflammation in short terms, increase visual acuity and prevent spread of inflammation into the inner layers of the eye.
Conclusion: Combination of antistaphylococcus human immunoglobulin and 0, 25% Derinate in complex treatment of patients with exudative inflammatory reaction leads to significant improvement of clinical and functional indices of the eye.
Актуальность
Экссудативно-воспалительная реакция (ЭВР) после экстракции катаракты (ЭК) в настоящее время остается актуальной проблемой офтальмохирургии [2,5,12]. По данным разных авторов, частота ЭВР составляет от 2 до 20% случаев после ЭК с имплантацией интраокулярной линзы (ИОЛ) [4,10]. Факторами, определяющими ее возникновение, являются: большая длительность оперативного вмешательства, травматизация тканей во время операции, недостаточно тщательная отшлифованная поверхность ИОЛ, применение некачественных вискоэластиков.
Следует отметить, что появление современных технологий малых разрезов (факоэмульсификация, механическая факофрагментация), применение современных вискоэластиков из высокоочищенных биологических полимеров на основе натрия гиалуроната и хондроитинсульфата, использование мягких ИОЛ из гидрогеля и др. качественных материалов привело к сокращению времени оперативного вмешательства и уменьшению травматизации тканей, что, в свою очередь, сократило число ЭВР в послеоперационном периоде. Однако сопутствующие заболевания, снижающие иммунологическую активность организма - сахарный диабет, ревматизм, бронхиальная астма, коллагенозы и др; местные воспалительные заболевания глаз - увеит, кератит, конъюнктивит и т.д., а также источники фокальной инфекции - кариес, пародонтоз, синусит, отит и др., продолжают оставаться грозными факторами для возникновения ЭВР [1,3,6,11].
Исходами ЭВР могут являться: вторичная катаракта, вторичная глаукома, кератопатия, фиброз стекловидного тела, эндофтальмит, эктопия ИОЛ, отслойка сетчатки, субатрофия глазного яблока [7,8].
Существует несколько классификаций экссудативно-воспалительной реакции глаза. Одной из наиболее удобных и простых является классификация С.Н. Федорова с соавт. [9].
Медикаментозное лечение при ЭВР должно быть направлено как на купирование основных признаков воспаления, так и на профилактику возникновения рецидивов. При этом не следует забывать, что лечение должно быть комплексным.
Препарат иммуноглобулин человека антистафилококковый (утвержден Главным государственным санитарным врачом РФ 27.11.2001, выпускается ГУП «Иммунопрепарат» г. Уфа) представляет собой концентрированный раствор иммунологически активной белковой фракции плазмы крови здоровых доноров, содержащей антитела к антистафиллококковому экзотоксину.
Препарат Деринат 0,25% (РК-ЛС-5 №000887, производства ЗАО «Техномедсервис») оказывает иммуномодулирующее действие на клеточном и гуморальном уровнях, активизирует противовирусный, противогрибковый и противомикробный иммунитет, обладает противовоспалительным действием.
В связи с вышеизложенным целью настоящего исследования стало повышение функциональных результатов хирургии осложненных катаракт путем изучения эффективности препаратов иммуноглобулина человека антистафилококкового и Дерината 0,25% в комплексном лечении ЭВР в послеоперационном периоде.
Материал и методы исследования
Нами проанализированы клинические исходы у 26 больных (11 мужчин и 15 женщин), пролеченных в Уфимском НИИ глазных болезней за 2002-2004 гг., у которых после ЭК с имплантацией ИОЛ в послеоперационном периоде выявлены II и III степени ЭВР. Возраст больных - от 41 до 85 лет. Факоэмульсификация катаракты произведена у 16 (61,5%), механическая факофрагментация - у 10 больных (38,5%). Имплантировали следующие виды ИОЛ: Centerflex (Rayner) - у 17 (65,4%), Superflex - у 5 (19,2%), Acrysof (Alcon) - у 4 больных (15,4%). Из сопутствующей патологии сахарный диабет диагностирован у 12 больных (46,2%), болезнь Бехтерева - у 2 (7,7%), бронхиальная астма - у 4 (15,4%), хронический кератоувеит в стадии ремиссии - у 3 (11,5%), адгезивный отит - у 2 (7,7%), хронический мейбомиит - у 3 больных (11,5%).
ЭВР II степени диагностирована у 17 больных (65,4%), III степени - у 9 (34,6%) пациентов.
Все пациенты в послеоперационном периоде получали традиционную терапию, включающую мидриатики, антибактериальные, нестероидные противовоспалительные препараты.
15 человек (основная группа) дополнительно получали парабульбарные инъекции иммуноглобулина человека антистафилококкового по 0,5 мл ежедневно в течение 3-5 дней и инстилляции препарата Деринат 0,25% 4 раза в день 3-7 дней (приоритет по заявке на изобретение № 2004130974 от 21.10.04 г.) . Остальные 11 человек составили контрольную группу. Группы были сопоставимы по полу, возрасту, степени выраженности ЭВР. Эффективность лечения оценивалась по времени рассасывания фибрина и экссудативной пленки на ИОЛ, остроте зрения, наличию поздних осложнений. Всем больным проводилась визометрия, рефрактометрия, биомикроскопия, тонометрия.
Результаты и их обсуждение
В клинической картине ЭВР выявлены следующие признаки: смешанная инъекция глазного яблока, цилиарные боли. У 12 пациентов (46,2%) установлена умеренная офтальмогипертензия. ЭВР на второй день после операции возникла у 11 больных (42,3%), через 3-7 дней - у 15 (57,7%) пациентов. При исследовании остроты зрения с коррекцией при II степени ЭВР она составила в среднем 0,1±0,03, при III степени - 0,04±0,01.
Использование препаратов иммуноглобулина человека антистафилококкового и Дерината 0,25% в комплексной терапии больных с ЭВР способствовало существенному улучшению клинических и функциональных показателей органа зрения.
Так, явления иридоциклита в основной группе исчезали на 3,5±0,02 дня раньше, отек роговицы на 3,8±0,03 дня раньше, чем в контрольной группе. Экссудативная пленка рассасывалась в среднем на 4,2±0,03 дня быстрее, офтальмогипертензия купировалась - на 3,0±0,04 дня раньше в основной группе (табл. 1).
Кроме того, в основной группе наблюдалось повышение остроты при выписке в среднем до 0,57±0,04, в то время как в контрольной группе - до 0,3±0,03. Динамика остроты зрения в основной и контрольной группах в процессе лечения представлена в таблице 2.
Длительность стационарного лечения пациентов основной группы составила в среднем 6,7±0,04 дня, в контрольной группе - 10,4±0,06 дня.
Отдаленные результаты лечения больных с ЭВР в послеоперационном периоде прослежены в сроки от 6 мес. до 1 года. В основной группе пациентов острота зрения составила в среднем 0,72±0,04, в контрольной группе - 0,45±0,03. Формирование вторичной катаракты наблюдалось у 2 пациентов в основной группе (13,3%) и у 5 больных (45,6%) в контрольной, т.е. в 3,4 раза чаще. Вторичная глаукома диагностирована в основной группе у 1 пациента (6,6%), в контрольной группе - у 2 больных (18,2%), т.е. в 2,6 раза чаще. В основной группе в отдаленном периоде такие осложнения, как эндофтальмит, отслойка сетчатки, эктопия ИОЛ, кератопатия, не выявлены. В контрольной группе кератопатия наблюдалась у 1 пациента (9%), отслойка сетчатки также у 1 пациента (9%) (табл. 3).
Таким образом, сочетанное применение парабульбарных инъекций иммуноглобулина человека антистафилококкового и инстилляций препарата Деринат 0,25% по предложенной нами методике позволяет купировать воспалительную реакцию в короткие сроки, улучшить остроту зрения, предупредить распространение воспалительной реакции в глубжележащие ткани глаза, сократить сроки пребывания больного в стационаре.
Клинический пример
Больной К. 68 лет. Диагноз: OD артифакия, послеоперационный иридоциклит. Сопутствующее заболевание: хронический блефарит в стадии ремиссии. Объективно OD: глаз раздражен, роговица умеренно отечна, гиперемия радужки, передняя камера средней глубины, в области зрачка сгусток фибрина, ИОЛ в капсульном мешке, рефлекс с глазного дна ослаблен (рис. 1). Острота зрения 0,08 н.к. Дополнительно к основному курсу лечения (местные инстилляции мидриатических препаратов 2 раза в день, антибиотиков 4 раза в день, в/м инъекции антибиотиков) назначены парабульбарные инъекции иммуноглобулина человека антистафилококкового 0,5 мл N 3 и инстилляции препарата Деринат 0,25% 4 раза в день в течение 7 дней. После курса лечения: объективно OD глаз спокоен, роговица прозрачная, передняя камера средней глубины, влага чистая, ИОЛ в капсульном мешке, рефлекс с глазного дна розовый (рис. 2). Острота зрения 0,6 н.к. Время пребывания больного в стационаре 7 дней.
Литература
1. Азнабаев М.Т., Мамбеткулова Г.К. Циркулирующие иммунные комплексы в диагностике увеитов.- Актуальные проблемы инфекционной патологии глаз.- Уфа.- 1999.- С.83-84.
2. Балашевич Л.И., Пархомов С.Д. Лазерное лечение фибринозно - пластического иридоциклита. - Современные технологии хирургии катаракты.-2003 с.46-47.
3. Егоров Е.А., Астахов Т.В., Ставицкая Т.В., Даль Г.А. Опыт применения Декса - гентамицина для профилактики воспалительных процессов после экстракции катаракты. .- Клиническая офтальмология.- 2001.- Том 2.- №3.- с.116 -118.
4. Егорова Э.В., Иошин И.Э., Толчинская А.И., Власова Т.И. Иммунологические методы прогноза в хирургии осложненных катаракт.- Офтальмохирургия.- 1997.- №3.- с.25-32.
5. Керимов М.И. Клинико - иммунологические особенности воспалительной реакции в глазу при экстракапсулярной экстракции катаракты с имплантацией ИОЛ у больных сахарным диабетом.- Дисс. канд. мед.наук.- Одесса.- 1999.- 148 с.
6. Логай И.М., Леус Н.Ф., Георгиев Д.Д. Эффективность селективных ингибиторов синтеза простагландинов и лейкотриенов в снижении воспалительной реакции после экстракапсулярной экстракции катаракты с имплантацией ИОЛ.- Офтальмологический журнал.- 2002.- №3.- с.22-25.
7. Новодережкин В.В. Лазерная коррекция фибриноидного синдрома в послеоперационном периоде после экстракции катаракты.- Клиническая офтальмология.- 2001.- Том 2.- №3.- с.114 - 115
8. Папенко Е.Ю., Петросян В.И., Бакуткин В.В. Диагностика воспалительной реакции глаза при экстракции катаракты с имплантацией ИОЛ методом трансрезонансной топографии.- Современные технологии хирургии катаракты.-2004.- с.243-247.
9. Федоров С.Н., Егорова Э.В. Ошибки и осложнения при имплантации искусственного хрусталика.- М.: Медицина.- 1992.-174-175 с.
10. Федяшев Г.А., Васильев А.В. Сравнительная частота воспалительных реакций глаза после факоэмульсификации с имплантацией ИОЛ с жесткой оптической частью через различные виды разрезов.- Современные технологии хирургии катаракты.- 2004.- с.328-330.
11. Lin J.C., Rapuano C.J., Laibson P.R. Corneal melting associated with use of topical nonsteroidal after ocular surgery // Arch. Ophthalmol.-2000.- Vol.118.- №8.- P.1129-1132.
12. Moreno-Montanes J., sainz C., Maldonado M.J. Intraoperative and postoperative complications of Cionni endocapsular ring implantation // J.Cataract Refract. Surg.-2003.-Vol.29.- №3.- P.492-497.
Читайте также:
- Субъективные оценки эффективности лечения. Отношение к лечению при наркомании
- Эпидемиология рака век. Проблемы диагностики и лечения
- Специализированная медицинская помощь при ожоге. Дезинтоксикационная терапия при ожоговой токсемии.
- Диагностика синдрома Кернса-Сейра по КТ, МРТ головного мозга
- Как мыть голову, чтобы волосы не выпадали. Уход за волосами
