Эндотелий при лучевой болезни. Морфология сосудов после радиационного поражения
Добавил пользователь Владимир З. Обновлено: 08.01.2026
Хиросима, Нагасаки, Чернобыль - это черные страницы в истории человечества, связанные с атомными взрывами. Среди пострадавшего населения наблюдались негативные радиационные эффекты. Влияние ионизирующего излучения имеет острый характер, когда в течение короткого времени разрушается организм и наступает смерть, или хронический (облучение небольшими дозами). Третий вид влияния - долгосрочный. Он вызывает генетические последствия радиации.
Воздействие ионизирующих частиц бывает разное. В небольших дозах радиоактивное излучение применяют в медицине для борьбы с онкологией. Но почти всегда оно негативно влияет на здоровье. Малые дозы атомных частиц являются катализаторами (ускорителями) развития рака и поломки генетического материала. Большие дозы приводят к частичной или полной гибели клеток, тканей и всего организма. Сложность в контроле и отслеживании патологических изменений заключается в том, что при получении малых доз радиации симптомы отсутствуют. Последствия могут проявляться через годы и даже десятилетия.
Радиационные эффекты облучения людей имеют такие последствия:
- Мутации.
- Раковые заболевания щитовидной железы, лейкозы, молочной железы, легких, желудка, кишечника.
- Наследственные нарушения и генетического кода.
- Нарушение обмена веществ и гормонального равновесия.
- Поражение органов зрения (катаракта), нервов, кровеносных и лимфатических сосудов.
- Ускоренное старение организма.
- Стерильность яичников у женщин.
- Слабоумие.
- Нарушение психического и умственного развития.
Пути и степень облучения
Облучение человека происходит двумя путями - внешним и внутренним.
Внешняя радиация, которую получает организм, исходит от излучающих объектов:

- космос;
- радиоактивные отходы;
- испытания ядерного оружия;
- естественная радиация атмосферы и грунта;
- аварии и утечки на атомных реакторах.
Внутреннее облучение радиацией осуществляется изнутри организма. Радиационные частицы содержатся в пищевых продуктах, которые человек употребляет (до 97%), и в небольшом количестве в воде и воздухе. Для того чтобы понять, что происходит с человеком после облучения радиацией, нужно понимать механизм ее воздействия.
Мощное излучение вызывает в организме процесс ионизации. Это значит, что в клетках образуются свободные радикалы - атомы, у которых не хватает электрона. Чтобы восполнить недостающую частицу, свободные радикалы отбирают ее у соседних атомов. Так возникает цепная реакция. Этот процесс приводит к нарушению целостности молекул ДНК и клеток. Как результат - развитие атипичных клеток (раковых), массовая гибель клеток, генетические мутации.
Дозы облучения в Гр (грей) и их последствия:

- 0,0007-0,002 - норма получения организмом радиации за год;
- 0,05 - предельно допустимая доза для человека;
- 0,1 - доза, при которой риск развития генных мутаций удваивается;
- 0,25 - максимально допустимая однократная доза в чрезвычайных условиях;
- 1,0 - развитие острой лучевой болезни;
- 3-5 - ½ пострадавших от радиации погибает в течение первых двух месяцев из-за поражения костного мозга и, как следствие, нарушения процесса кроветворения;
- 10-50 - летальный исход наступает через 10-14 дней из-за поражения ЖКТ (желудочно-кишечный тракт);
- 100 - смерть наступает в первые часы, иногда через 2-3 дня из-за повреждения ЦНС (центральная нервная система).
Классификация поражений при радиационном облучении
Облучение радиаций приводит к повреждению внутриклеточного аппарата и функций клеток, что впоследствии вызывает их гибель. Наиболее чувствительны клетки, которые быстро делятся - лейкоциты, эпителий кишечника, кожа, волосы, ногти. Более устойчивы к радиации гепатоциты (печень), кардиоциты (сердце) и нефроны (почки).
Радиационные эффекты облучения
- острая и хроническая лучевая болезнь;
- поражение глаз (катаракта);
- лучевые ожоги;
- атрофия и уплотнение облученных участков кожи, сосудов, легких;
- фиброз (разрастание) и склероз (замена соединительной структурой) мягких тканей;
- уменьшения количественного состава клеток;
- дисфункция фибробластов (матрица клетки, основа при ее появлении и развитии).
- опухоли внутренних органов;
- злокачественные изменения крови;
- умственная отсталость;
- врожденные уродства и аномалии развития;
- рак у плода вследствие его облучения;
- сокращение продолжительности жизни.
- изменение наследственности;
- доминантные и рецессивные мутации генов;
- хромосомные перестройки (изменение числа и структуры хромосом).
Симптомы радиационного поражения
Симптомы облучения радиацией зависят в первую очередь от радиоактивной дозы, а также от площади поражения и продолжительности однократного воздействия. Дети более восприимчивы к радиации. Если у человека есть такие внутренние болезни, как сахарный диабет, аутоиммунные патологии (ревматоидный артрит, красная волчанка), это усугубит влияние радиоактивных частиц.
Однократная радиационная доза наносит большую травму, чем такая же доза, но полученная в течение нескольких дней, недель или месяцев.
При однократном воздействии большой дозы или при поражении обширной площади кожи развиваются патологические синдромы.
Цереброваскулярный синдром
Это признаки облучения радиацией, связанные с поражением сосудов головного мозга и нарушением мозгового кровообращения. Просвет сосудов сужается, поступление кислорода и глюкозы в мозг ограничивается.
- кровоизлияния в мозжечок - рвота, головная боль, нарушение координации, косоглазие в сторону поражения;
- кровоизлияние в мост - глаза не двигаются в стороны, расположены только посередине, зрачки не расширяются, реакция на свет слабая;
- кровоизлияние в таламус - полный паралич половины тела, зрачки не реагируют на свет, глаза опущены к носу, исход всегда летальный;
- кровоизлияние субарахноидальное - резкие интенсивные боли в голове, усиливающиеся при любых физических движениях, рвота, лихорадка, изменение ритмов сердца, скопление жидкости в мозге с последующим отеком, эпилептические припадки, повторные кровоизлияния;
- тромботический инсульт - нарушение чувствительности, отклонение глаз к очагу поражения, недержание мочи, нарушение координации и целенаправленности движений, психическая заторможенность, устойчивое повторение фраз или движений, амнезия.
Гастроинтестинальный синдром
- тошнота, снижение аппетита, рвота;
- вздутие живота, интенсивная диарея;
- нарушение водно-солевого баланса.
Впоследствии развивается некроз - омертвение слизистой кишечника, далее сепсис.
Синдром инфекционных осложнений
Это состояние развивается из-за нарушения формулы крови, как следствие, снижение естественного иммунитета. Возрастает риск экзогенной (внешней) инфекции.
Осложнения при лучевой болезни:
- ротовая полость - стоматит, гингивит;
- органы дыхания - тонзиллит, бронхит, пневмония;
- ЖКТ - энтерит;
- лучевой сепсис - усиливается гноеобразование, на коже и внутренних органах появляются гнойнички.
Орофарингеальный синдром
Это язвенное кровоточащее поражение мягких тканей ротовой и носовой полости. У пострадавшего отечная слизистая, щеки, язык. Десны становятся рыхлыми.
- сильная боль в ротовой полости, при глотании;
- продуцируется много вязкой слизи;
- нарушение дыхания;
- развитие пульмонита (поражение альвеол легких) - одышка, хрипы, вентиляционная недостаточность.
Геморрагический синдром
Определяет степень тяжести и исход лучевой болезни. Нарушается свертываемость крови, стенки сосудов становятся проницаемыми.
Симптомы - в легких случаях мелкие, точечные кровоизлияния во рту, в области заднего прохода, с внутренней стороны голеней. В тяжелых случаях радиационное облучение вызывает массивные кровотечения из десен, матки, желудка легких.
Радиационное поражение кожи
При небольших дозах развивается эритема - выраженное покраснение кожи из-за расширения кровеносных сосудов, позже наблюдаются некротические изменения. Спустя полгода после облучения появляется пигментация, разрастание соединительной ткани, появляются стойкие телеангиэктазии - расширение капилляров.
Кожа человека после радиации атрофируется, становится тонкой, легко повреждается при механическом воздействии. Лучевые ожоги кожи не поддаются лечению. Кожные покровы не заживают и очень болезненны.
Генетические мутации от воздействия радиации

Еще одни признаки радиационного облучения - это генные мутации, нарушение структуры ДНК, а именно одно его звена. Такое ничтожное, на первый взгляд, изменение приводит к серьезным последствиям. Генные мутации необратимо изменяют состояние организма и в большинстве случаев приводят к его гибели. Мутантный ген вызывает такие заболевания - дальтонизм, идиопатия, альбинизм. Проявляются в первом поколении.
Хромосомные мутации - изменение размеров, количества и организации хромосом. Происходит перестройка их участков. Они напрямую влияют на рост, развитие и функциональность внутренних органов. Носители хромосомных поломок погибают в детском возрасте.
Последствия облучения радиацией в глобальном масштабе:
- Падение рождаемости, ухудшение демографической ситуации.
- Стремительный рост онкологической патологии среди населения.
- Тенденция к ухудшению здоровья детей.
- Серьезные нарушения иммунного статуса среди детского населения, которое находится в зонах влияния радиации.
- Заметное сокращение показателей средней продолжительности жизни.
- Генетические сбои и мутации.
Значительная часть изменений, вызванная влиянием радиоактивных частиц, является необратимой.
Риск возникновения рака после облучения прямо пропорционален дозе облучения. Радиация даже в минимальных дозах негативно сказывается на самочувствии и работе внутренних органов. Люди часто списывают свое состояние на синдром хронической усталости. Поэтому после диагностических или лечебных мероприятий, связанных с облучением, необходимо принимать меры по ее выведению из организма и укреплять иммунитет.
Радиационный (постлучевой) некроз
Радиационный некроз твердых тканей зубов возникает после воздействия ионизирующего излучения в связи с лечением злокачественных новообразований, заболеваний крови,скелета и других органов и систем, а также от действия профессиональных факторов.
Патогенез (что происходит?) во время Радиационного (постлучевого) некроза:
До настоящего времени нет единого мнения о механизме и характере изменений в тканях зуба и полости рта в результате радиационного излучения. Одни исследователи склонны относить лучевые нарушения тканей зубов к некариозным поражениям. Другие считают, что после радиационного облучения активно развивается кариес зубов наряду с некариозными поражениями.
Патогенез лучевого поражения зубов до сих пор окончательно не выяснен. Обсуждаются данные о сосудистых, морфологических и дегенеративных нарушениях в пульпе. Предполагают влияние на зубы ксеросто-мии, развивающейся после лучевого воздействия. Не исключается иммунодепрессивное действие ионизирующего излучения. Некоторые исследователи полагают, что в облученном организме происходит специфическое подавление металлосодержаших ферментных систем (в первую очередь железосодержащих), участвующих в процессе тканевого дыхания в аэробной фазе. Нарушение аэробной фазы тканевого дыхания влечет за собой накопление в тканях организма, в том числе в пульпе зуба, недоокисленных продуктов метаболизма, а также стойкое нарушение их дальнейшего окисления.
Таким образом, в результате воздействия ионизирующего излучения именно эти процессы, происходящие в пульпе зуба, приводят к нарушению трофики и физиологических процессов реминерализации эмали и дентина. Особенно это выражено при сочетании с нарушением функции слюнных желез, вызываемой облучением, с последующим дисбалансом реминерализующих механизмов в среде эмаль - слюна.
Симптомы Радиационного (постлучевого) некроза:
Проявления постлучевого поражения зубов и тканей полости рта достаточно характерны. Прежде всего практически у всех больных отмечаются радиомукозит слизистой оболочки губ, щек, языка, потеря или извращение вкусовых ощущений, выраженная ксеростомия и соответственно сухость в полости рта.
Обычно спустя 3-6 мес после лучевого воздействия эмаль зубов утрачивает характерный блеск, становится тусклой, серовато-блеклой. Отмечаются ломкость, стертость жевательной и вестибулярной поверхностей зубов. На этом фоне появляются участки некроза, вначале локальные, а затем по типу циркулярного поражения зубов. Обычно они темного цвета, заполнены рыхлой некротической массой, безболезненные. Отсутствие болевого симптома - характерная особенность радиационного поражения зубов. Постепенно участки некроза расширяются и захватывают значительную часть зуба. Удаление некротических масс из очага поражения, как правило, безболезненное, поэтому делать это надо осторожно.
Без радикальных лечебных мероприятий через 1-2 года пораженными оказываются более 96 % зубов.
Интенсивность лучевого поражения зубов в известной степени зависит от зоны и дозы облучения. Эти поражения, напоминающие кариес, безболезненны даже при зондировании, показатель электроодонтометрии понижен до 15-25 мкА.
Образовавшиеся в зубах полости имеют неровные изъеденные края, которые в пределах эмали прозрачные и хрупкие. Располагаются полости на атипичных для кариеса поверхностях зубов. Кариозная полость обычно заполнена серой массой, удаление ее малоболезненно или безболезненно. Ранее и вновь поставленные пломбы выпадают.
Анамнез позволяет дифференцировать указанные поражения, наметить меры лечения и профилактики.
Лечение Радиационного (постлучевого) некроза:
При поражении твердых тканей коронки зуба лечение прово дят в несколько этапов. Вначале осто рожно удаляют некротические массы из дефектов зубов вручную экскава тором, чтобы не внедриться в полость зуба, а затем вводят кальцифицирующую пасту, состоящую из равных час тей порошка глицерофосфата кальция, оксида цинка и глицерина. Пасту накладывают тонким слоем на дно и стенки образовавшейся полости и закрывают временным пломбировоч ным материалом.
Следующий этап отсроченного лечения зубов проводят через 1-1,5 мес. Он состоит в удале нии нежизнеспособных, некротизированных тканей зуба при помощи бора до минерализованного участка дентина или эмали, после чего вновь накладывают кальцифицирующую пасту и пломбируют зубы стеклоиономерными цементами.
При более глубоких поражениях устраняют имеющиеся некротические дефекты стеклоиономерными цементами и через 3-4 мес, если этого требует косметическая реставрация передних зубов, часть стеклоиономера удаляют, а сверху накладывают композитный пломбировочный материал.
Профилактика Радиационного (постлучевого) некроза:
Для уменьшения прямого действия радиации на зубы изготавливают индивидуальную свинцовую каппу, которую больной надевает непосредственно перед каждой процедурой лучевой терапии. Необходимо также уменьшить опосредованное действие проникающей радиации путем предварительного (перед облучением) проведения месячного курса общей и местной реминерализующей терапии в сочетании с комплексом антиоксидантов.
Если профилактические мероприятия перед облучением не проводили, то после лучевой терапии необходимо провести весь курс комплексного лечения в течение 5-6 мес, сочетая его со стоматологическими вмешательствами.
Обычно через 3-4 нед комплексной реминерализующей и антиоксидантной терапии появляется гиперестезия дентина. Это хороший признак, свидетельствующий о восстановлении жизнеспособности пульпы зуба.
К каким докторам следует обращаться если у Вас Радиационный (постлучевой) некроз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Радиационного (постлучевого) некроза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Кардиопатии, обусловленные радиотерапией
Данная работа представляет собой систематический обзор литературы Национальной медицинской библиотеки США по теме «кардиопатии, обусловленные воздействием химиотерапии и лучевой терапии». В обзор включены все источники, найденные по ключевым словам: «cardiopathy-induced radiotherapy»
Введение
Совокупность изменений сердца под воздействием лучевой терапии получила название «радиационно-индуцированной болезни сердца», которая включает в себя целый комплекс изменений, возникающий в результате лучевого повреждения миокарда, перикарда, клапанного аппарата, коронарных артерий, проводящей системы сердца [21].
Таким образом, применение химиотерапии и лучевой терапии при лечении онкологических больных приводит к развитию хронической сердечной недостаточности (ХСН).
По результатам фармако — экономических анализов, на лечение ХСН в странах Европы и США ежегодно расходуется 1-2% всего бюджета здравоохранения, что в 5 раз превышает затраты, направленные на лечение всех форм злокачественных новообразований [Фомин И. В. и др. , 2006].
Кардиопатии, обусловленные радиотерапией
В последние десятилетия проблема поражений сердца вследствие радиотерапии приобрела новое значение, прежде всего в связи с существенным увеличением в современном мире числа лиц, подвергшихся радиационному воздействию, как локальному, так и общему. Это касается прежде всего пациентов с ходжскинской лимфой, для которых сердечно-сосудистые осложнения в последующие 30-40 лет после облучения являются основной причиной смерти, больных с раком лёгкого, молочной железы (чаще левостороннего), пациентов, перенёсших трансплантацию, сочетающиеся с тотальным облучением [1, 2, 21].
В настоящее время минимальный порог эффективной лучевой дозы безопасной для сердца не известен. В большинстве случаев стандартная суммарная доза облучения для пациентов с лимфомой Ходжкина составляет 30Гр, для пациентов с раком молочной железы 45-50Гр, и между величиной суммарного облучения и сердечной заболеваемостью последующие годы существует прямая пропорциональная зависимость. С дозой облучения напрямую связана продолжительность жизни больного, которая снижается в результате ускоренного прогрессирование коронароатеросклероза, фиброзных изменений клапанов (чаще левосторонних), перикарда с возникновение фибринозного, реже экссудативного плеврита, самого миокарда с развитием диастолической дисфункции и скорейшего развития терминальной ХСН. 4
В тоже время анализ заболеваемости ССЗ у людей, выживших после взрыва атомной бомбы и многолетнее наблюдения за ликвидаторами аварии на Чернобыльской АЭС показали, что даже малые дозы облучения 1 Гр и менее способны повлиять на состояние сердечной мышцы. Множество исследований показывают, что радиационное облучение области сердца в любой дозе представляет риск для возникновения сердечных событий [ 6].
Постлучевая кардиомиопатия — это гетерогенное заболевание, характеризующиеся дозозависимым прогрессирующим снижением сократительного резерва миокарда, снижением ФВ ЛЖ, повышением жёсткости сердца как за счёт миокарда, так и за счёт перикарда и преждевременной смертью [1].
Патогенез
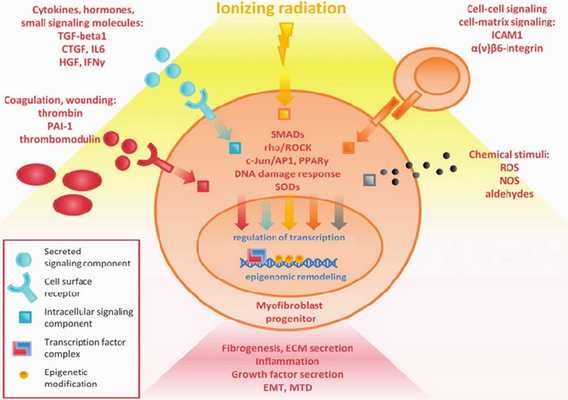
Механизм развития (Рисунок 3) постлучевых повреждений полностью не изучен, но известно, что ионизирующие облучение приводит к микроваскулярным нарушениям, повреждению эндотелия с повышением проницаемости сосудистой стенки, микротромбозу со снижением количества функционирующих капилляров — всё это является следствием запуска воспалительного ответа и причиной активации фиброзного замещения кардиомиоцитов. В миокарде увеличивается содержание коллагена I и III типов, которые вызывают снижение эластических свойств мышцы, повышая конечно-диастолическое давление [7].
Радиационные повреждения сердца включают в себя остро и хронически протекающие изменения. Сразу же после облучения повреждённые эндотелиоциты высвобождают факторы адгезии и пролиферации, активируются клетки воспаления с выделением провоспалительных цитокинов, таких как интерлейкины-1, 6, 8, фактор некроза опухоли-β, основной фактор роста фибробластов, инсулин-подобный фактор роста, соединительнотканный факторы роста, матриксные металлопротеазы разрушающие базальную мембраны сосудов, происходит активацию проонкогенов, c-myc и c-jun, которые поддерживают фиброз в тканях сердца [6, 21].
В позднем периоде происходят глубокие фибринозные изменения, протекающие десятилетия бессимптомно и приводящее в конечном счёте к развитию рестриктивной кардиопатией с умеренным снижением насосной функции ЛЖ или реже дилатационной с выраженными нарушениями показателей диастолической функции ЛЖ [8].
Важным моментом в развитии радио-индуцированной кардиопатии является её растянутое во времени развитие, что приближает её к антрациклинновой кардиопатии и предполагает наличие реорганизации многих белковых структур клетки, митохондриальных белков, повреждения митохондриальной ДНК и оксидативного стресса в её основе [9].
В патогенезе лучевой кардиопатии принимают участие уже известный гипоксия-индуцированный фактор1-α, интерлейкин-1, блокирование рецепторов которого как и в случае с воздействием Доксорубицина препятствует снижению ФВ, но при этом не оказывает влияние на процессы фиброза, ядерный фактор kappa B, представляющий собой белковый комплекс, регулирующий транскрипцию ДНК и участвующий в клеточном ответе на различные стрессовые воздействия, на оксидативный стресс в частности и выявленные недавно в качестве участников длительного асептического воспаления представители каликреин-кининновой системы, работающие посредством митоген-активируемых протеинкиназ [1].
Диагностика
При лучевом поражении сердца ЭКГ изменения обычно выражаются в неспецифических смещениях сегмента ST, низком вольтаже зубцов, появлении и прогрессировании нарушений ритма сердца, развитии внутрижелудочковых блокад, иногда атриовентрикулярных блокад, что, конечно, имеет лишь вспомогательное значения для диагностики кардиопатий.
Широко изучается выявление ЭХОКГ-признаков диастолической дисфункции, как наиболее ранних предвестников развития СН, однако в настоящее время отсутствуют практические руководства по раннему выявлению постлучевой кардиопатии с помощью показателей расслабления миокарда. Несмотря на это большинством экспертов поддерживает обязательное проведение ЭХОКГ спустя 10 лет после проведённой лучевой терапии в качестве мониторинга [2].
Натрий-уретические пептиды и тропонины могут быть использованы в качестве оценки степени лучевого повреждения миокарда, но опять-таки, определённых рекомендаций по их использованию в плане диагностики кардиопатий, обусловленных радиотерапией, не существует [117].
Главный приоритет в диагностике развивающегося интерстициального фиброза миокарда, основного морфологического проявления радиационного воздействия, принадлежит дорогостоящим методикам: МРТ с контрастным усилением, позволяющие выявить по эффекту задержки гадолиния признаки фиброза, происходящие после облучения средостения, перфузионная сцинтиграфия с 99mTс-МИБИ, однофотонная эмиссионная томография, способная визуализировать временные дефекты микроперфузии миокарда, попавшего под облучение, объём которых статистически коррелирует с лучевой нагрузкой 10.
В мировой литературе приводятся данные о применении радионуклиидной ангиографии, определение потребления миокардом кислорода в покое и при физической нагрузке в качестве скрининговых методов диагностики пациентов, прошедших радиотерапию, а также выявление радиационных повреждений сердца посредством обнаружения экстравазальных скоплений альбумина в миокарде [8, 13-17].
Радиопротекция и лечение
Современные методики лучевой терапии способствуют сокращению дозы облучения и уменьшению поля облучения, но неизвестно способствует ли это безопасности или просто оттягивает во времени проявление осложнений, так как, отсутствуют статистически достоверные данные, свидетельствующие об уменьшении долгосрочных событий.
К методикам, способствующим избежать повреждения сердца, относятся:
трёхмерное планирование облучения,
дыхательное стробирование с модуляцией интенсивности облучения,
использование свинцовых блоков для защиты сердца,
Техническое усовершенствование радиотерапевтической аппаратуры, развитие клинической дозиметрии, разработка предлучевой топометрии с использованием компьютерной техники служат основой повышения эффективности лучевой терапии при лечении опухолей. Наличие рентгеносимулятора, компьютерного томографа, возможность использования магнитно-резонансного и позитронного эмиссионного томографа позволяют весьма точно определить границы мишени, подлежащей облучению. Даже такая мелочь, как синхронизация лучевой терапии с дыханием, позволяет уменьшить дозу ионизирующего излучения в органах риска (сердце и лёгкие) и, тем самым, снизить вероятность развития лучевых осложнений.
Экспериментально на крысах были проведены попытки уменьшить лучевой воздействие на сердце путём синхронизации пучка облучения с сердечным циклом, тем самым оказывая воздействие в тот момент, когда миокард находится в состоянии относительной гипоксии [18].
На прогноз пациентов, подвергнутых радиотерапии, влияет возраст, так как известно, что риск поражения сердечно-сосудистой системы при радиационном облучении наиболее высок у лиц молодого возраста, перенесших радиотерапию до 40 лет облучение зоны средостения у детей и подростков, больных лимфогранулематозом, сопровождается ростом кардиальной смертности уже в течение первых пяти лет после облучения [10].
Сердечная смертность значительно увеличивается даже после облучения небольшой дозой в 5Гр в случае присоединения антракциклинов.
Несмотря на то, что радиационные поражения сердечно-сосудистой системы могут возникать в отсутствие факторов риска кардиологических заболеваний, необходимо помнить, что классические факторы риска (артериальная гипертензия, курение и гиперлипидемия) увеличивают риск прогрессирования радиационно обусловленных изменений сердца и требуют более агрессивной терапии [19].
Фармакологические методы предупреждения последствий лучевого воздействия в настоящее время не известны, но идут исследования в направлении препаратов, воздействующих на каликреин-кининовую систему. Так известно, что тучные клетки неожиданно оказывают протективную роль для сердца, посредством подавления активности эндотелина-1. Экспериментальные методы по использованию блокатора эндотелинновых рецепторов Бозентана в настоящее время не дали каких-либо положительных результатов. Также проводятся работы по изучению радиопротективных свойств Пентоксифиллина [4].
Описаны попытки экспериментального воздействия на процесс миокардиального фиброза и оксидативный стресс, индуцированные ионизирующей радиацией, с помощью статинов, гормона мелатонина, известного своими мощными кардиопротективными свойствами, витаминов С, Е, N-ацетилхолина. [20]
В эксперименте на мышах назначение Талидомида, известного седативного препарата, за которым были замечены возможности активировать созревание сосудистой стенки за счёт размножения перицитов, не приводило к защите сердца от радиационного повреждения [21].
В будущем должны быть проведены исследования по оценке эффективности профилактического приёма и-АПФ, ингибиторов минералкортикоидных рецепторов, аллопуринола.
Есть сведения о положительном лечебном эффекте пересадки мезенхимальных стволовых клеток пациенту с радиационной кардиопатией и перикардитом [22].
И наконец, пациенты с радио-индуцированной рестриктивной кардиопатией имеют наихудший прогноз после трансплантации сердца, им чаще требуется механическая поддержка в период ожидании трансплантанта с замещением функции правого желудочка и у них нередко почечная и дыхательная недостаточность вследствие лучевого повреждения соответствующих органов [23].
Однако, выживаемость таких пациентов, согласно данным клиники Мейо, после ортотопической трансплантации сердца в течение 1, 5, 10 лет составила 91, 7%, 75% и 46, 7% соответственно [24].
Таким образом, -радио-индуцированные кардиопатии, несмотря на низкую частоту развития, должны иметь должное внимание со стороны специалистов онкологии и кардиологии. В настоящее время существуют практические руководства, позволяющие уменьшить риск возникновения кардиопатии на фоне химиотерапии. В отношении профилактики радиационного повреждения миокарда ведутся дальнейшие работы.
Список литературы
Mawad R. , Gooley T. A. , Rajendran J. G. , Fisher D. R. et. al. Radiolabeled anti-CD45 antibody with reduced-intensity conditioning and allogeneic transplantation for younger patients with advanced acute myeloid leukemia or myelodysplastic syndrome. Biol Blood Marrow Transplant. 2014 Sep;20 (9): 1363-8. doi: 10. 1016/j. bbmt. 2014. 05. 014. Epub 2014 May 20.
Gyenes G. , Fornander T. , Carlens P. , Glas U. et. al. Myocardial damage in breast cancer patients treated with adjuvant radiotherapy: a prospective study. Int J Radiat Oncol Biol Phys. 1996 Nov 1;36 (4): 899-905.
Mezzaroma E. , Mikkelsen R. B. , Toldo S. , Mauro A. G. et. al. Role of interleukin-1 in radiation induced cardiomyopathy. Mol Med. 2015 Mar 26. doi: 10. 2119/molmed. 2014. 00243.
Lipshultz S. E. , et al; American Heart Association Congenital Heart Defects Committee of the Council on Cardiovascular Disease in the Young, Council on Basic Cardiovascular Sciences, Council on Cardiovascular and Stroke Nursing, Council on Cardiovascular Radiology. (2013) Long-term cardiovascular toxicity in children, adolescents, and young adultswho receive cancer therapy: pathophysiology, course, monitoring, management, prevention, and research directions: a scientific statement from the American Heart Association. Circulation. 128: 1927-95. doi: 10. 1161/CIR. 0b013e3182a88099
Jaworski C, Mariani JA, Wheeler G, Kaye DM. (2013) Cardiac complications of thoracic irradiation. J Am Coll Cardiol. 61: 2319-28. doi: 10. 1016/j. jacc. 2013. 01. 090.
Lipshultz SE, Adams MJ. (2010) Cardiotoxicity after childhood cancer: beginning with the end in mind. J Clin Oncol. 28: 1276-1281. doi: 10. 1200/JCO. 2009. 26. 5751
Taunk N. K. , Haffty B. G. , Kostis J. B. , Goyal S. Radiation-induced heart disease: pathologic abnormalities and putative mechanisms. Front Oncol. 2015 Feb 18;5: 39. doi: 10. 3389/fonc. 2015. 00039. ECollection 2015
Azimzadeh O. , Scherthan H. , Sarioglu H. , Barjaktarovic Z. et. al. Rapid proteomic remodeling of cardiac tissue caused by total body ionizing radiation. Proteomics. 2011 Aug;11 (16): 3299-311. doi: 10. 1002/pmic. 201100178.
Mezzaroma E. , Di X. , Graves P. , Toldo S. et. al. A mouse model of radiation-induced cardiomyopathy. Int J Cardiol. 2012 Apr 19;156 (2): 231-3. doi: 10. 1016/j. ijcard. 2012. 01. 038. Epub 2012 Feb 16.
Herrmann J. , Lerman A. , Sandhu N. P. , Villarraga H. R. et. al. Evaluation and management of patients with heart disease and cancer: cardio-oncology. Mayo Clin Proc. 2014 Sep;89 (9): 1287-306. doi: 10. 1016/j. mayocp. 2014. 05. 013.
Umezawa R. , Ota H. , Takanami K. , Ichinose A. et. al. MRI findings of radiation-induced myocardial damage in patients with oesophageal cancer. Clin Radiol. 2014 Dec;69 (12): 1273-9. Doi: 10. 1016/j. crad. 2014. 08. 010.
van Nimwegen F. A. , Schaapveld M. , Janus C. P. , Krol A. D. et. al. Cardiovascular Disease After Hodgkin Lymphoma Treatment: 40-Year Disease Risk. JAMA Intern Med. 2015 Apr 27. doi: 10. 1001/jamainternmed. 2015. 1180.
Dogan I. , Sezen O. , Sonmez B. , Zengin A. Y. et. al. Myocardial perfusion alterations observed months after radiotherapy are related to the cellular damage. Nuklearmedizin. 2010;49 (6): 209-15. doi: 10. 3413/nukmed-0315-10-05.
Burns R. J. , Bar-Shlomo B. Z. , Druck M. N. , Herman J. G. et. al. Detection of radiation cardiomyopathy by gated radionuclide angiography. Am J Med. 1983 Feb;74 (2): 297-302.
Lipshultz S. E, Adams M. J. Cardiotoxicity after childhood cancer: beginning with the end in mind. J Clin Oncol. 2010 Mar 10;28 (8): 1276-81. doi: 10. 1200/JCO. 2009. 26. 5751. Epub 2010 Feb 8.
Gladstone D. J. , Flanagan M. F. , Southworth J. B. , Hadley V. et. al. Radiation-induced cardiomyopathy as a function of radiation beam gating to the cardiac cycle. Phys Med Biol. 2004 Apr 21;49 (8): 1475-84.
Hong R. A. , Iimura T. , Sumida K. N. , Eager R. M. Cardio-oncology/onco-cardiology. Clin Cardiol. 2010 Dec;33 (12): 733-7. doi: 10. 1002/clc. 20823.
Wagdi P, Fluri M. , Aeschbacher B. , Fikrle A. , Meier B. Cardioprotection in patients undergoing chemo- and/or radiotherapy for neoplastic disease. A pilot study. Jpn Heart J. 1996 May;37 (3): 353-9.
Hoving S, Seemann I, Visser NL, te Poele JA, Stewart FA. Thalidomide is not able to inhibit radiation-induced heart disease. Int J Radiat Biol (2013) 89 (9): 685-91. doi: 10. 3109/09553002. 2013. 788797
Kursova L. V. , Konoplyannikov A. G. , Kal'sina S. Sh. , Baboyan S. B. Allogenic cardiomyoblasts raised from human mesenchymal stem cells in the therapy of radiation cardiomyopathy and pericarditis: case report. Bull Exp Biol Med. 2014 May;157 (1): 143-5. doi: 10. 1007/s10517-014-2510-4. Epub 2014 Jun 10.
Shah S. , Nohria A. Advanced heart failure due to cancer therapy. Curr Cardiol Rep. 2015 Apr;17 (4): 16. doi: 10. 1007/s11886-015-0570-3.
Saxena P. , Joyce L. D. , Daly R. C. et. al. Cardiac transplantation for radiation-induced cardiomyopathy: the Mayo Clinic experience. Ann Thorac Surg. 2014 Dec;98 (6): 2115-21. doi: 10. 1016/j. athoracsur. 2014. 06. 056
Эндотелий при лучевой болезни. Морфология сосудов после радиационного поражения

Острая лучевая болезнь
Острая лучевая болезнь (ОЛБ) - это острое заболевание вызванное ионизирующим излучением (гамма, нейтронное, рентгеновское) в дозе более 1 Грей (Гр), всего организма и ограничено по времени (от 2-х до 10-ти суток).
Форма и тяжесть острой лучевой болезни
| Доза | Форма | Тяжесть |
|---|---|---|
| 1-2 Гр | Костно-мозговая | Лёгкая (1) |
| 2-4 Гр | Костно-мозговая | Средняя (2) |
| 4-6 Гр | Костно-мозговая | Тяжёлая (3) |
| 6-10 Гр | Костно-мозговая | Крайне тяжёлая |
| 10-20 Гр | Кишечная | Крайне тяжёлая |
| 20-80 Гр | Сосудисто-токсемическая | Крайне тяжёлая |
| Более 80 Гр | Церебральная | Крайне тяжёлая |
Патогенез
Воздействие ионизирующего излучения на организм человека приводит к возникновению последовательных физико-химических процессов.
- Поглощение ионизирующего излучения.
- Превращение энергии излучения в химическую энергию (ионы и радикалы), радиолиз активно идет в тканях содержащих воду.
- Радиохимический этап взаимодействия ионов и радикалов с ферментами и белками приводящий к нарушению хода биохимических реакций (образуются токсические вещества: перекиси, хиноны и др.).
- Гибель клеток (различные ткани гибнут при разных дозах).
Радиоповреждаемость: прямо пропорциональна степени митотической активности и обратно пропорциональна степени дифференцировки клеток.
В порядке убывания радиоповреждаемости ткани распределены следующим образом:
- Кроветворная и лимфоидная ткань,
- Половые клетки,
- Эпителий слизистой желудочно-кишечного тракта (ЖКТ),
- Кожа,
- Эндотелий сосудов,
- Серозные оболочки,
- Паренхиматозные органы,
- Соединительная ткань,
- Нервная ткань.
Наиболее подвержены разрушению ионизирующим излучением клетки кроветворной системы и лимфоидной ткани, а наименее подвержены разрушению клетки нервной системы (НС).
Радиочувствительность (к функции системы органов):
- Нервная система
- Эндокринная система
- И др.
Синдромы ОЛБ
Гематологический
Изменение в периферической крови и кроветворных органах, повреждение стволовых клеток. Первыми снижаются в крови лимфоциты в течении первых 3-х суток и количество достигает минимума на нем останется до восстановления кроветворения (через 5 недель).
Тромбоциты тоже снижаются, но начало их снижения на 1 неделю позже чем гранулоцитов. Продолжается снижение тромбоцитов до периода восстановления крови.
Эритроциты снижаются через 2 недели после облучения.
Возникает в следствии снижение количества тромбоцитов, а это зависит от полученной дозы излучения. В начале петехиальная сыпь, далее спонтанные кровотечения. Так же уменьшается количество белков свертываемости крови.
Инфекционные осложнения
Угнетение иммунитета и снижение естественной микрофлоры организма. Снижение гранулоцитов ниже 1 Г/литр, провоцирует снижение иммунитета и развитие инфекций. (Начало с повышения температуры тела, ангина, пневмония, инфекция мочевыводящий путей и другие инфекционные заболевания). Особенностью инфекционных заболеваний является протекание из без выраженного нагноения, но при этом с выраженными некрозами тканей.
ЖКТ синдром
Синдром поражения ЖКТ протекает по разному в зависимости от полученной дозы излучения.
В начале развивается общая реакция на облучение, далее появляются симптомы инфекционного и геморрагического энтероколита, в финале развивается радиационный гастроэнтероколит.
- При легкой степени лучевого поражения. Появляется рвота, нарушение моторики кишечника, спастические боли и диарея. Рвота возникает в результате действия образующихся под действием радиации токсинов.
- При тяжелой форме лучевого поражения. Происходит активация микроорганизмов ЖКТ на фоне снижения иммунитета. Что проявляется диареей, выраженной болью, тенезмами или запорами.
При кишечной форме ОЛБ, в результате гибели кишечного эпителия, нарушаются обменные процессы в ЖКТ. Что приводит к развитию диареи, рвоты, кишечной непроходимости.
Неврологический синдром
При небольших дозах излучения изменения носят функциональный характер (поражается кора и периферические нервы). Нарушается регуляция артериального давления (АД), раздражение рвотного центра, нарушение терморегуляции. Все эти изменения обратимые.
При больших дозах полученного облучения развивается сосудисто-токсэмический отек головного мозга и шок.
При церебральной форме появятся симптомы связанные с гибелью нервных клеток: потеря сознания, кома, параличи и парезы.
При дозе полученного облучения более 1000 Гр - мгновенная гибель пострадавшего!
Клиническая картина ОЛБ
1-й период (первичная реакция на облучение)
Развивается первичная реакция на облучение. Но она начинается не во время облучения, клиника развивается после облучения спустя минуты и часы. Внезапно появляется рвота, головная боль, слабость, металлический привкус во рту, боли в животе, гиперемия кожи (она горячая и влажная на ощупь), повышение температуры тела. Тремор пальцев рук, тахикардия, вначале повышение АД, а затем снижение АД. В крови увеличивается количество нейтрофилов, снижается уровень лимфоцитов начиная с 3-го часа после облучения и длится 3-е суток. Далее симптоматики нет.
2-й период (скрытый)
Период относительного клинического благополучия. В клинике преобладают: снижение работоспособности, нарушение сна, снижение настроения. В анализах крови: снижение лимфоцитов, гранулоцитов, тромбоцитов и ретикулоцитов; показатели эритроцитов остаются в норме. В биохимическом анализе крови наблюдается диспротеинэмия, снижены белки свертываемости крови.
В зависимости от тяжести ОЛБ скрытый период длится:
- Легкая тяжесть ОЛБ - 30 дней,
- Тяжелая и крайне тяжелая ОЛБ - 3-е суток,
- При дозе более 10 Гр, скрытого периода не будет.
Влияет и физическая активность, чем она выше, тем короче будет скрытый период.
3-й период (разгара)
Период разгара ОЛБ совпадает с началом агранулоцитоза (при костной форме ОЛБ). Соответствует снижению лейкоцитов менее 1 Г/литр. Появляются инфекционный и геморрагический синдром.
В анализе крови: панцитопения. В красном костном мозге (ККМ) - нет пролиферирующих клеточных элементов, панмиелофтиз. Кровь не стерильна, нарушена её свертываемость, снижение общего белка плазмы крови. Со стороны нервной системы (НС): головные боли, угнетение сознания, снижение сухожильных рефлексов. Со стороны сердечно-сосудистой системы: тахикардия, снижение АД, изменения на ЭКГ.
В этот период заболевания может наступать летальный исход!
Продолжительность периода от 1-й недели до 4-х недель.
4-й период (восстановления)
Период восстановления начинается с возобновления кроветворения. В крови появляются ретикулоциты и за ними другие клеточные элементы крови. Проходят инфекционные и геморрагический синдромы. Отмечается улучшение самочувствия, но восстановление ЖКТ, НС и эндокринной системы продолжается в течении нескольких месяцев.
По окончании ОЛБ остаются остаточные явления: соматические и генетические.
Соматические - изменение в крови (анемия), неврологические расстройства (астенический синдром), повышается риск развития онкологии.
Генетические - повреждение генетического материала половых клеток приводит к рождению детей с пороками развития, увеличивается детская смертность.
Особенности течения ОЛБ в зависимости от тяжести
Лёгкая степень тяжести - I (доза облучения 1-2 Гр)
Первичная реакция на облучение развивается спустя 3 часа, длиться 3 часа. Отмечается однократная рвота, незначительная мышечная слабость, температура тела нормальная, нет гиперемии кожи, нет колебаний АД. Скрытый период длится 30 дней, не будет инфекционных осложнений. Будет вегетативно-сосудистая неустойчивость (колебания ЧСС в сторону тахикардии, колебания АД в сторону гипотензии). Нет выпадения волос, отдельные петехиальные высыпания на коже. Период разгара длиться 14 дней. Прогноз благоприятный, выздоровление в течении 2-х месяцев.
Средняя степень тяжести - II (доза облучения 2-4 Гр)
Первичная реакция на облучение возникает через 1-2 часа, длиться в течении 1-х суток. Отмечается повторная рвота, умеренная головная боль, повышается температура тела (но не выше 37,50С), гиперемия кожи лица, нет снижения АД. Скрытый период длиться 3-4 недели. К концу 4-й недели появляется агранулоцитоз, повышение температуры тела, ангина, пневмония, кровоизлияния на коже и слизистых, носовые кровотечения. Период разгара длиться 2-3 недели. Не все пациенты выздоравливают. Прогноз относительно благоприятный (летальный исход у каждого 3-го пострадавшего). Период восстановления длиться до 6 месяцев.
Тяжёлая степень - III (доза облучения 4-6 Гр)
Через 30 минут после облучения начинается первичная реакция, длиться до 2-х суток. Отмечается многократная рвота, выраженная слабость, выраженные головные боли, подъем температуры до 38,00С, гиперемия лица и плеч, снижение АД. Скрытые период длиться 1-2 недели. В разгаре к клиническая картина как при средней степени тяжести ОЛБ, добавляются сепсис и энтероколит. Прогноз при тяжелой степени ОЛБ сомнительный (из 3-х пациентов 2-е с летальным исходом). Период разгара длиться до 4-х недель. Восстановительный период занимает до 1 года.
Крайне тяжелая - IV (доза облучения 6-10 Гр)
Первичная реакция на облучение возникает через несколько минут, продолжается до 3-х суток. Возникает резкая головная боль, спутанность сознания, сильные боли в животе с диареей, гиперемия всей поверхности кожи, снижение АД, температуры выше 38,00С. Скрытый период до 3 суток. В период разгара превалируют инфекционный синдром к которому присоединяется орофарингеальный синдром, развивается обезвоживание. Гибель наступает в сроки до 2-х недель. При полученной дозе 10 Гр и более - прогноз абсолютно неблагоприятный!
Сводная таблица показателей крови
Лечебные мероприятия эффективны только при костномозговой форме ОЛБ. В начальном периоде - восстанавливаем работоспособность и купируем рвоту (этапиразин), при развитии сильной рвоты инъекции (латран, димепрозид). Необходимо ведение электролитов (физиологический раствор NaCl 0,9%, дополнительно 30-50 мл гипертонического раствора NaCl 10%). При снижении АД (кардиамин, мезатон). При падении АД до коллапса (норадреналин и преднизолон). Вводим в/в гемодез с целью дезинтоксикации. Выполняем промывание желудка.
В скрытый период - лечение минимальное. При легкой степени ОЛБ амбулаторное, при среднетяжелой ОЛБ лечение стационарное (сложно предугадать начало периода разгара). Проводятся курсы витаминов.
В период разгара - госпитализация в стационар и проведение комплексной терапии. Диета обогащенная продуктами с пектином, кисломолочные продукты, растительное масло, пища жидкая и протертая, вводятся кисели, соки. Питание поддерживается ферментными препаратами. При выраженной диарее применяются сорбенты.
При развитии инфекционного синдрома применяются антибиотики. Назначается 2 а/б препарата, один внутрь для подавления микрофлоры кишечника (канамицин), второй в/в в дозах для лечения сепсиса (цефалоспорины, фторхинолоны). За период лечения проводится неоднократная смена а/б. Применяются противогрибковые препараты и противопротозойные препараты. В качестве заместительной терапии вводятся в/в иммуноглобулины и интерфероны.
Для лечения геморрагического синдрома проводят переливание тромбоцитарной массы 1 раз в неделю, а так же другие противогеморрагические препараты (аминокапроновая кислота, викасол, этамзилат, транексам и др.).
Для укрепления сосудистой стенки (аскорутин).
При анемии применяется переливание эритроцитарной массы.
При дозе полученного облучения более 6 Гр применяется трансплантация костного мозга. Данный вид лечения эффективен в первые 5 дней после облучения, до развития сепсиса.
Назначаем препараты восстанавливающие кроветворение (витамин В5, витамин В1, фолиевая кислота, Железо, Гормоны).
В период восстановления проводится усиление питания, лечебная физкультура и общеукрепляющие мероприятия. По окончании периода восстановления производится постановка на диспансерный учет (возрастает риск развития онкологических заболеваний).
Лучевая болезнь: причины, проявления и лечение лучевой болезни

К сожалению, технический прогресс далеко не всегда благоприятно отображается на истории человечества. Так, настоящей «расплатой за цивилизацию» становятся серьезные техногенные катастрофы, которые вредят окружающей среде, а также здоровью и даже жизни людей. Прежде всего, в этом контексте стоит поговорить о лучевой болезни. Это заболевание крайне опасно и коварно, ведь его негативные последствия могут беспокоить человека в течение многих лет. Каковы же проявления лучевой болезни и есть ли возможность избежать развития осложнений?
Что такое лучевая болезнь и почему она возникает?
Лучевая болезнь — это совокупность ряда местных и системных нарушений, возникающих в работе организма вследствие влияния высоких доз радиации, точнее, ионизирующего излучения на клетки и ткани. При таком заболевании происходит поражение многих участков организма, в том числе кроветворной, нервной, пищеварительной и эндокринной систем.
Каждый день люди в большей или меньшей степени контактируют с ионизирующим излучением. Но малые дозы не несут никакой угрозы здоровью. Если же степень облучения превышает 1-2 куб. м в год, возрастает риск возникновения лучевой болезни.
Заболевание может развиться, если человек подвергается однократному облучению большой дозой радиации или постоянно находится под влиянием повышенного ионизирующего излучения. Однократное воздействие может быть следствием:
- техногенной катастрофы в сфере атомной энергетики;
- испытаний ядерного оружия;
- нарушений при проведении тотального облучения в онкологической или гематологической практике.
Хроническое длительное облучение может наблюдаться у работников отделений лучевой диагностики или интенсивной терапии.
Механизм развития лучевой болезни
Повреждающее влияние на организм оказывают альфа- и бета-частицы, нейтроны, а также гамма-лучи и рентгеновские лучи. Возможно одновременное влияние на организм сразу нескольких повреждающих факторов. Излучение приводит к возникновению патологических изменений на клеточно-молекулярном уровне. В частности, высокие дозы радиации приводят к возникновению множества продуктов распада липидов, углеводов, разных углеводных соединений. В результате этого развивается лучевая токсемия. Под удар, в первую очередь, попадают особо чувствительные структуры, к которым относятся костный мозг, клетки нервной системы, эндокринные железы, а также лимфоидная ткань.
Своевременная диагностика лучевой болезни может быть затруднена из-за отсутствия специфических маркеров. Тем не менее, в 2020 г. американские ученые опубликовали статью, в которой предложили идентифицировать данное заболевание в течение нескольких часов после облучения при помощи нового анализа крови. Такое исследование помогает определить степень радиационного облучения и оценить наличие токсичности, что является немаловажным для выбора дальнейшей стратегии лечения.
Основные проявления лучевой болезни в острой форме
Острая форма лучевой болезни развивается крайне быстро — в течение считанных минут (реже — часов) после значительной лучевой нагрузки. Симптомы включают:
- повышенную слабость;
- тошноту, переходящую во рвоту;
- сильную сухость во рту;
- нарушения зрения;
- нарушения в работе пищеварительного тракта (понос);
- потерю сознания.
Параллельно на коже может появиться синюшная эритема. Также возможно появление сыпи, зудящих участков и выраженного жжения слизистой.
Спустя некоторое время начинается фаза мнимого благополучия — самочувствие больного нормализуется. Но все анализы показывают множественные отклонения от нормы. Далее болезнь переходит в стадию развернутой клиники, что сопровождается:
- облысением;
- поражением почти всех органов и тканей;
- резким ухудшением самочувствия;
- усилением слабости;
- резким падением давления;
- разными кровотечениями (носовыми, желудочно-кишечными, внутримозговыми);
- дерматитом, эритемой, появлением пузырей на коже;
- эзофагитом, энтероколитом, а также гастритом и гепатитом.
Болезнь нередко осложняется присоединением бактериальной инфекции.
Симптомы хронической лучевой болезни
Проявления хронической формы болезни могут включать:
- неврологические нарушения (головные боли, психические расстройства, бессонницу);
- сбои в работе пищеварительного тракта (ухудшение аппетита, возникновение горького привкуса и пр.);
- нарушения менструального цикла;
- возникновение бесплодия;
- снижение либидо;
- появление многочисленных небольших кровоизлияний в слизистые.
Методы лечения и реабилитация

Если речь идет об острой форме лучевой болезни, больного госпитализируют в стерильный бокс. Ему показано:
- строгое соблюдение постельного режима;
- регулярная обработка кожи;
- промывание желудка и кишечника;
- детоксикационное лечение солевыми и глюкозозамещающими лекарствами;
- форсированный диурез;
- плазмаферез.
Если же лучевая болезнь носит хронический характер, необходимы переливания эритроцитарной или же тромбоцитарной массы. Для профилактики инфекционных осложнений медики используют антибиотики.
Все реабилитационные мероприятия проводятся в стационарных условиях. Пациентам необходимо посещать физиотерапевтические процедуры и лечебную гимнастику.
Дальнейшие прогнозы
Риск возникновения дальнейших осложнений, а также ожидаемая продолжительность жизни после лучевой болезни определяется, в первую очередь, интенсивностью и продолжительностью облучения. Немаловажную роль играет возраст пациента, а также присутствие у него прочих заболеваний (острых или хронических). Стоит отметить, что отдаленные последствия лучевой болезни могут проявляться даже у следующего поколения, вызывая мутации и уродства.
Читайте также:
