Эндотелий сосудов. Роль ( значение ) эндотелия в регуляции просвета сосудов.
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
В ответ на различные стимулы эндотелиоци-ты отвечают активацией и изменением направленности воздействия на гемостаз. Наиболее значимыми стимулами, активирующими эндотелиоци-ты, являются воспалительные цитокины, эндотоксины, тромбин, гистамин, гипоксия, свободные радикалы кислорода, турбулентные потоки крови, внутриклеточные инфекционные агенты, механические повреждения, иммунные комплексы и др.
У стимулированных эндотелиальных клеток появляются прокоагулянтные и провоспалитель-ные свойства:
Стимулированные эндотелиоциты могут представлять на своей поверхности тканевой фактор (ТФ). Этот процесс был исследован in vitro и частично подтвержден in vivo в сосу дах некоторых злокачественных опухолей.
На стимулированных эндотелиальных клет ках снижается количество тромбомодулина.
Они начинают секретировать ингибитор ак тиватора плазминогена.
Из пула хранения эндотелиоцитов (тельца Вейбла-Паллада) высвобождается фактор Виллебранда. Наиболее активными стимула ми высвобождения фактора Виллебранда яв ляются тромбин и гистамин.
Происходит изменение фосфолипидного со става наружной поверхности мембраны эндо телиальных клеток с появлением рецепторов для ферментных комплексов коагуляционно- го каскада.
В дополнение к ферментам классического коагуляционного каскада эндотелиальные клетки вырабатывают ряд дополнительных энзимов, в том числе гипоксия-индуцирован- ный активатор фактора X, липополисахарид- индуцируемый активатор протромбина. Помимо прямого влияния активированных
эндотелиальных клеток на гемостаз, существует
обратное влияние белков гемостаза на эндотелиальные клетки. Комплекс фактор VIIa - ТФ, тромбин, фактор Ха, возможно, и другие факторы передают сигналы на эндотелиоциты, вызывающие различные реакции со стороны клетки и выработку медиаторов, влияющих на глубокие слои сосудистой стенки, в частности на гладкомышечные клетки медии.
Роль эндотелия в регуляции сосудистого тонуса
В течение нескольких секунд после повреждения сосудистой стенки происходит сокращение поврежденного и соседних кровеносных сосудов, свободные края сосуда вокруг повреждения вворачиваются внутрь кровеносного русла, при этом кровоток в месте повреждения частично перекрывается. Ведущую роль в модуляции этих изменений выполняет эндотелии.
Эндотелии (ЕТ) - пептидный гормон, состоящий из 21 аминокислоты, относится к группе ци-токинов, имеет 3 изоформы (ЕТ-1, ЕТ-2 и ЕТ-3). Образуется эндотелии из предшественника пре-про-ЕТ (который иногда обозначается как большой эндотелии) при участии металлопептида-зы - эндотелинпревращающего фермента.
В низких концентрациях эндотелии действует на эндотелиальные рецепторы, вызывая высвобождение факторов релаксации, а в более высоких - активирует рецепторы на гладких мышечных клетках, стимулируя стойкую вазокон-стрикцию.
ЕТ-1 - наиболее сильный вазоконстриктор из всех известных факторов, доминирует в эндотелиальных клетках сосудов человека. Он также присутствует в небольших количествах в гладких мышечных клетках (ГМК) и кардиомиоцитах. ЕТ не хранится в клетках, а постоянно синтезируется de novo. Синтез ЕТ и освобождение его из эн-
дотелиальных клеток стимулируют тромбин, адреналин, ангиотензин, вазопрессин, некоторые цитокины.
Большая часть ЕТ секретируется внутрь сосудистой стенки, где расположены специфичные высокоаффинные рецепторы. ЕТ, секретируе-мый наружу, взаимодействует с собственными рецепторами на клеточной мембране, а также стимулирует ангиотензинпревращающий фермент (АПФ), который переводит неактивный ангиотензин I в вазоконстриктор ангиотензин II (рис. 11).
Рецепторы для эндотелина сопряжены с G-бел-ками, присутствуют в 2 формах: ЕТ-А и ЕТ-В. Рецепторы ЕТ-А характеризуются высокой аффинностью и постоянно экспрессированы в миокарде на ГМК сосудов. Они обеспечивают прямое вазоконстрикторное действие эндотелина за счет активации поступления Са 2+ в клетку через неселективные ионные каналы. Рецепторы ЕТ-В экспрессированы на эндотелиальных клетках и ГМК в отдельных сосудистых бассейнах. Стимуляция ЕТ-В сопровождается освобождением N0 (вазодилататор), тромбоксана (вазоконстриктор) и PGI2 (вазодилататор). Таким образом, один и тот же фактор реализует две противоположные сосудистые реакции (сокращение и расслабление), вызываемые различными химическими механизмами.
Доказано, что дисбаланс эндотелий-зависимой сократимости и релаксации сосудов при артериальной гипертензии может способствовать повышению общего периферического сопротивления сосудов (ОПС) и появлению сердечно-сосудистых осложнений. Характерно увеличение эндотелина крови с возрастом. Наиболее высокий уровень эндотелина отмечен при атеросклерозе, неспецифическом аортоартериите, облите-рирующем тромбангиите, т. е. при заболеваниях, протекающих с повреждением эндотелия. Поскольку эндотелии действует преимущественно местно, естественно предположить, что повышенное образование и поступление его в кровь может быть причиной возникновения и усугубления тяжести течения ИБС.
Мы исследовали чувствительность лабораторных тестов повреждения сердечно-сосудистой системы у пациентов с нестабильной стенокардией (п = 11, возраст 60,7 ± 9,9 года) в состоянии компенсации. Все пациенты в течение, по крайней мере, 1 года находились на низкокалорийной диете и корригирующей терапии гиполипидемически-ми препаратами, в том числе статинами. В группу сравнения входили практические здоровые люди (п = 13), средний возраст которых был 27,4 ± 1,5 года. Результаты измерений уровня эндотелина-1 и липидных показателей сыворотки представлены в табл. 2.
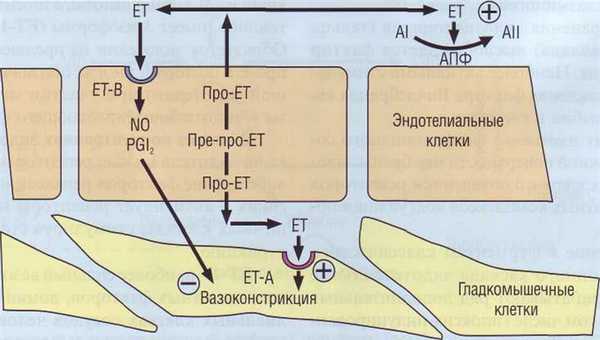
Рис. 11. Эндотелин - основной вазоконстриктор сосудистой стенки, вырабатывается и реализуется сосудистым эндотелием. ЕТ - эндотелии, AI и АII - ангиотензин I и II, АПФ - ангиотензинпревращающий фермент, ЕТ-А и ЕТ-В - рецепторы к эндотелину
Сравнительная характеристика эндотелина и липидов у пациентов с нестабильной стенокардией

Значения приведены из инструкции к набору Parameter-Human Endothelin-1 Assay производства R&D System Inc., США.
У пациентов с нестабильной стенокардией после длительного срока наблюдения и интенсивной терапии (более 1 года приема статинов) удалось достичь целевых уровней основных показателей липидограммы для вторичной профилактики сердечно-сосудистых заболеваний, хотя эти показатели были выше, чем у здоровых молодых людей. В то же время уровень ЕТ-1 у пациентов был выше не только показателей группы сравнения, но и рекомендуемого референтного значения. Это расценивается как свиде-
тельство того, что, несмотря на интенсивную терапию, у больных сохраняется активный процесс дисфункции эндотелия. Поэтому пациенты с нестабильной стенокардией, даже при условии нормализации показателей липидного обмена, должны быть под наблюдением кардиолога. В свою очередь, определение ЕТ-1 можно рекомендовать в качестве лабораторного теста активности процесса повреждения сосудистой стенки и, следовательно, прогноза течения болезни.
В состав субэндотелиальной базальной мембраны (рис. 12) входят различные типы коллагена, фибронектин, витронектин, ламинин, про-теогликаны, гликозаминогликаны, тромбо-спондин, фактор Виллебранда, а в местах повреждения и воспаления - фибрин. Большая часть этих компонентов синтезируется и секре-тируется эндотелиальными клетками, однако перициты и ГМК также вносят свой вклад в формирование внеклеточного матрикса. Внеклеточные белки субэндотелия играют важную роль в межклеточном взаимодействии, формировании скелета сосуда, процессе клеточной адгезии, репарации и росте сосудов.
Субэндотелий является стимулятором адгезии тромбоцитов и активации каскадной системы свертывания крови.
Прокоагулянтные свойства клеток субэндотелия (макрофагов, фибробластов, лейкоцитов и гладких мышечных клеток) обусловлены наличием на их поверхности тканевого фактора. Колла-
Рис. 12. Субэндотелий сосудистой стенки организован полимерными белками: коллагеном, эластином и другими, Субэндотелий обладает выраженным тромбогенным эффектом, стимулируя процессы свертывания крови
ген субэндотелия является субстратом для адгезии тромбоцитов. Связь коллагена с рецепторами тромбоцитов вызывает активацию последних. Помимо этого, коллаген, видимо, обладает свойством активировать белки системы контактной активации.
Эндотелий сосудов. Роль ( значение ) эндотелия в регуляции просвета сосудов.
предоставляем актуальную медицинскую информацию от ведущих специалистов, помогая врачам в ежедневной работе
Одной из важных задач антигипертензивной терапии становится коррекция дисфункции эндотелия (ДЭ), часто встречающейся при АГ.
Согласно современным представлениям, эндотелий представляет собой монослой клеток, выстилающий внутреннюю поверхность сосудов, который является аутокринным, паракринным и эндокринным органом с многочисленными регуляторными функциями. Общая масса эндотелия у человека колеблется в пределах 1600-1900 г, что больше массы печени. Эндотелий участвует в регуляции сосудистого тонуса, гемостаза, иммунного ответа, миграции клеток крови в сосудистую стенку, синтеза факторов воспаления и их ингибиторов, осуществляет барьерные функции [1]. Барьерная функция эндотелия в организме сводится к поддержанию гомеостаза путем регуляции равновесного состояния противоположных процессов: тонуса сосудов (вазодилатация/вазоконстрикция), анатомического строения сосудов (ремоделирование/ингибирование факторов пролиферации), гемостаза (синтез и ингибирование факторов фибринолиза и агрегации тромбоцитов), местного воспаления (выработка про- и противовоспалительных факторов). Таким образом, эндотелий регулирует не только тонус сосудов, но и другие важные функции. Дисфункция эндотелия - это прежде всего дисбаланс между продукцией вазодилатирующих, ангиопротективных, антипролиферативных факторов (простациклин, тканевой активатор плазминогена, С-тип натрийуретического пептида, эндотелиального гиперполяризующего фактора) и вазоконстриктивных, протромботических, пролиферативных факторов (эндотелин, супероксид-анион, тромбоксан А, ингибитор тканевого активатора плазминогена) [2].
Cреди биологически активных веществ, вырабатываемых эндотелием, важнейшим является NO. Открытие ключевой роли NO в генезе ССЗ было удостоено Нобелевской премии в 1998 г.
Было установлено, что в нормальных физиологических условиях NO служит не только мощным вазодилататором, но и тормозит процессы ремоделирования сосудистой стенки, предотвращает адгезию и агрегацию тромбоцитов, адгезию моноцитов, защищая, таким образом, сосудистую стенку от патологической перестройки с последующим развитием атеросклероза и атеротромбоза [3,4]. Таким образом, в нормальных физиологических условиях NO является антиатерогенным фактором. NO образуется из аминокислоты L-аргинина под действием фермента NO-синтазы. Непосредственно в эндотелии NO образуется из эндотелиальной NO-синтазы - еNOS.
При дефиците NO происходит не только ослабление вазодилатации, но и запускаются процессы ремоделирования сосудистой стенки, адгезии и агрегации тромбоцитов и моноцитов, т.е. инициируются процессы атеросклероза и атеротромбоза [5,6]. Таким образом, дефицит NO становится проатерогенным фактором. В настоящее время ДЭ рассматривается как ранняя фаза развития атеросклероза и атеротромбоза [7,8].
К дефициту NO могут привести известные ФР атеросклероза: АГ, гиперхолестеринемия, сахарный диабет, курение. ДЭ рассматривается в качестве универсального механизма реализации атерогенного влияния различных ФР атеросклероза [9,10]. Согласно теории Dzаu и Gibbons, все перечисленные ФР ведут к повреждению эндотелия сосудов, к хроническому дефициту NO и, как следствие, запуску целого каскада явлений, ведущих к атеросклерозу, атеротромбозу и возникающих на их основе осложнений (рис. 1).
Дисфункция эндотелия при АГ у человека установлена для периферических, коронарных и почечных артерий [11,12,13].
Ряд авторов рассматривают ДЭ как основной механизм становления АГ [14].
Возникает закономерный вопрос: если существует взаимосвязь между АГ и ДЭ, то означает ли это, что коррекция АГ автоматически приведет к улучшению эндотелиальной функции? Ряд авторов считает, что антигипертензивные препараты должны не только адекватно снижать АД, но и корригировать ДЭ [7]. Тем более, что, как правило, врачи в реальной клинической практике поздно начинают корригировать ФР, когда они уже в течение длительного времени влияют на организм, когда механизм ДЭ уже запущен и, следовательно, процессы атеросклероза и атеротромбоза развиваются. Поэтому требуется коррекция не только АГ, но и ДЭ. Фактически это означает, что снижение АД без коррекции ДЭ не может считаться успешно решенной клинической задачей. Таким образом, коррекция ДЭ приобретает клиническое значение. Если препараты обладают не только антигипертензивным эффектом, но и корригируют ДЭ, восстанавливая NO, то они должны обладать дополнительным антиатерогенным действием и более эффективно предупреждать сердечно-сосудистые осложнения, чем средства, не обладающие такими свойствами. На клиническое значение ДЭ и ее коррекции впервые было указано в последних Европейских рекомендациях по контролю АГ.
Методы оценки
состояния эндотелиальной функции
На сегодняшний день существует два основных подхода к оценке эндотелиальной регуляции сосудистого тонуса: инвазивный и неинвазивный. При инвазивном способе в коронарные сосуды вводится ацетилхолин, который вызывает эндотелийзависимое расширение сосудов, однако этот способ оценки состояния эндотелия дорогостоящий и не всегда доступный. Его нецелесообразно применять для мониторинга изменений функции эндотелия под влиянием проводимого лечения. Поэтому все большее распространение получают неинвазивные методы. Эти методы относительно просты и не представляют значительного риска или дискомфорта для человека.
Celermajer и соавт. [15] была предложена модификация метода с использованием потокзависимой вазодилатации в условиях реактивной гиперемии плечевой или бедренной артерий, а при изучении эндотелийнезависимой вазодилатации - сублингвальный прием нитроглицерина. Метод основан на способности эндотелия высвобождать NO в условиях реактивной гиперемии. Дилатацию оценивали по изменению диаметра артерий с помощью ультразвука высокого разрешения. Данный метод дает возможность неинвазивной оценки эндотелийзависимой вазодилатации (ЭЗВД).
Реактивная гиперемия моделируется манжеточной окклюзией плечевой артерии на 4-5 минут. Оценка вазодилатации проводится ультразвуковым сосудистым датчиком высокого разрешения (7 МГц) по изменению диаметра сосуда. В норме плечевая артерия расширяется на 0,2-0,5 мм. По оценкам экспертов, средняя ошибка метода составила 0,04 мм, а максимальная ошибка не превышала 0,1 мм. Эти данные послужили основанием для более широкого внедрения метода.
Показано, что прирост диаметра плечевой артерии на 4-8% существенно превышает фоновую вариабельность показателя. В клинических исследованиях на больших когортах больных увеличение диаметра артерии на 2% в результате лечения является достаточным, чтобы судить об улучшении ЭФ.
В настоящее время метод нашел широкое применение не только за рубежом, но и в России.
В качестве потенциальных маркеров дисфункции эндотелия рассматривается несколько субстанций, продукция которых может отражать функцию эндотелия: тканевой активатор плазминогена и его ингибитор, тромбомодулин, фактор Виллебрандта, уровень стабильных метаболитов NO (нитратов и нитритов) в сыворотке крови или моче, а также косвенная оценка уровня и/или активности NO-образующего фермента - eNOS.
Основным недостатком оценки ЭФ являются четкие диагностические критерии ДЭ, которые не позволяют оценить степень выраженности ДЭ и динамику состояния ЭФ на фоне лечения антигипертензивными препаратами.
Однако, как подчеркивается в последних Европейских рекомендациях по контролю АГ, вскоре ожидается появление таких критериев.
Возможности коррекции ДЭ
На сегодняшний день существует множество данных свидетельствующих об улучшении ЭФ на фоне применения различных классов антигипертензивных препаратов. При этом, механизм влияния на эндотелий различен.
Исследования по изучению влияния b-блокаторов на ЭФ связано прежде всего с суперселективным b-блокатором небивололом. Этот препарат единственный из b-блокаторов обладает дополнительным вазодилатирующим эффектом за счет увеличения синтеза NO [16]. Данные зарубежных и отечественных исследований убедительно свидетельствуют об улучшении ЭФ при лечении небивололом лиц с АГ [17,18]. In vivo и in vitro было доказано, что небиволол вызывает вазодилатацию, воздействуя на систему L-аргинин - NO [19,20], так как введение ингибитора NO-синтазы - L-NMMA блокировало вазодилатирующий эффект небиволола. Более точный механизм потенцирования системы L-аргинин - NO пока неизвестен, но, как показали экспериментальные исследования, он не связан с блокадой b1-адренорецепторов.
Нами проведено собственное исследование по изучению антигипертензивной эффективности небиволола (Небилет® фармацевтической компании «Берлин-Хеми») и его влияния на ЭФ. При этом оценка ЭФ проводилась на основании изучения ЭЗВД и биохимических маркеров: активности eNOS в культуре клеток и уровня стабильных метаболитов NO в сыворотке крови.
В открытом сравнительном перекрестном рандомизированном исследовании указанные эффекты Небилета® сравнивались с одним из наиболее изученных и широко применяемых b-блокаторов - метопрололом, эффективность которого была доказана в крупномасштабных исследованиях у различных категорий больных - с АГ, ИБС, сердечной недостаточностью. В исследование было включено 30 мужчин 35-65 лет с АГ I-II степени и факторами риска, отобранных из случайной выборки неорганизованной популяции, которые попеременно в течение 12 недель получали Небилет® (5 мг в сутки) или метопролол (50-150 мг в сутки).
В ходе исследования было выявлено, что Небилет® и метопролол достоверно снижали уровень как систолического, так и диастолического АД (рис. 2).
Вместе с тем, терапия Небилетом® в отличие от лечения метопрололом приводит к улучшению ЭФ. Анализ динамики ЭЗВД показал, что на фоне терапии Небилетом® этот показатель достоверно увеличился с 10,2 до 16,5% (р
К.м.н. Е.Ю. Юпатов 1 , к.м.н. Т.Е. Курманбаев 2 , Ю.Л. Тимошкова 2
1 КГМА — филиал ФГБОУ ДПО РМАНПО Минздрава России, Казань
2 Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург
У человека и животных основную роль в поддержании нормальной жизнедеятельности организма играет уровень метаболизма в тканях, который напрямую зависит от скорости кровотока. Эндотелиальные клетки образуют внутреннюю оболочку сосудов и играют важную роль в процессе тканевого дыхания и метаболизма. Они обладают уникальной способностью к репарации и активно участвуют в процессе неоангиогенеза на протяжении всей жизни. Разные типы эндотелиальных клеток обладают метаболическими свойствами, которые определяют их функцию в ангиогенезе при стимуляции факторами роста. Гипоксия является одним из основных стимуляторов ангиогенеза, что занимает важное место в патогенезе атеросклероза и злокачественных новообразований. Чувствительность к повреждающим факторам обусловливает развитие дисфункции эндотелия с увеличением проницаемости сосудистой стенки и индукции синтеза цитокинов и молекул адгезии, созданием протромботической среды, дедифференциацией клеток, что в итоге приводит к нарушению функции органа. Дисфункция эндотелия — ключевое звено в ряде патологических состояний, например преэклампсии, атеросклероза, а также осложнений COVID-19. В обзоре приводятся современные данные об особенностях метаболизма эндотелия, участии последнего в ангиогенезе, а также роли эндотелиальной дисфункции в патогенезе COVID-19.
Ключевые слова: эндотелий, ангиогенез, дисфункция эндотелия, гипоксия, гликолиз, новая коронавирусная инфекция.
Understanding endothelial function and dysfunction: state-of-the-art (a review)
E.Yu. Yupatov 1 , T.E. Kurmanbaev 2 , Yu.L. Timoshkova 2
1 Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education, Kazan
2 S.M. Kirov Military Medical Academy, St. Petersburg
Tissue metabolism, which directly depends on blood flow velocity, is crucial for the normal functioning of human and animal organisms. Endothelial cells have an essential role in tissue respiration and metabolism. These cells are characterized by unique reparative activity extensively involved in angiogenesis throughout life. Various endothelial cells have metabolic properties that determine their functions during angiogenesis when stimulated with growth factors. Hypoxia is one of the principal stimulators of angiogenesis, thereby having a vital role in the pathogenesis of atherosclerosis and malignancies. Susceptibility to damaging factors accounts for endothelial dysfunction with increased vascular permeability, cytokine and adhesion molecule synthesis, generation of pro-thrombotic environment, and cell dedifferentiation. The result is organ dysfunction. Endothelial dysfunction is the critical element of many disorders, e.g., preeclampsia, atherosclerosis, and COVID-19 complications. This paper reviews current data on endothelial metabolism, involvement in angiogenesis, and the role of endothelial dysfunction in the COVID-19 pathogenesis.
Keywords: endothelium, angiogenesis, endothelial dysfunction, hypoxia, glycolysis, COVID-19.
For citation: Yupatov E.Yu., Kurmanbaev T.E., Timoshkova Yu.L. Understanding endothelial function and dysfunction: state-of-the-art (a review). RMJ. 2022;3:20-23.
Для цитирования: Современное понимание функции и дисфункции эндотелия сосудов. Обзор литературы. РМЖ. 2022;3:20-23.

Введение
Эндотелий сосудов играет важную роль в регуляции сосудистого тонуса в норме и при различных заболеваниях. Под термином «функция эндотелия» принято подразумевать регуляцию капиллярного кровотока, осуществляемую за счет динамической смены фаз вазоконстрикции и вазодилатации сосудов резистивного типа в соответствии с потребностями клеточного обмена веществ [1, 2], соответственно, «дисфункция эндотелия» — это нарушение регуляции динамической реакции сосудов в ответ на соответствующие раздражители. Дисфункция эндотелия лежит в основе множества патологических состояний, таких как атеросклероз, артериальная гипертензия, преэклампсия 3.
Процесс неоваскулогенеза
Сосудистая сеть раньше всех остальных органов формируется в процессе онтогенеза и впоследствии созревает в замкнутую сложную систему сосудов различного диаметра. Все органы и ткани организма, за исключением хрящевой ткани и роговицы, зависят от тока крови, необходимого для осуществления процессов жизнедеятельности [4, 7].
Процесс васкулогенеза начинается на раннем этапе развития эмбриона. Мезодермальные ангиобласты объединяются с образованием примитивных сосудистоподобных трубок, лишенных стенки, также в процессе первичного ангиогенеза принимают участие гемангиобласты, впоследствии дифференцирующиеся в эндотелиальные и гемопоэтические клетки [8, 9].
Последующее ремоделирование сосудистого русла достигается двумя механизмами: инвагинацией и прорастанием сосудов. Инвагинация приводит к расширению капиллярного русла за счет «разделения» капилляра на два соседних сосуда, при этом противоположные стенки первичного сосуда выступают в его просвет, происходит контакт ЭК друг с другом, чтобы сформировать локальный эндотелиальный бислой, с имеющимися связями между ЭК. Перициты и миофибробласты покрывают образовавшийся полый транскапиллярный столб, который увеличивается по окружности, разделяя капилляр на два параллельных сосуда [10].
Прорастание сосудов возникает в результате увеличивающейся потребности тканей в кислороде, что стимулирует выработку факторов роста эндотелия сосудов (vascular endothelial growth factor, VEGF), факторов роста фибробластов и других проангиогенных факторов. VEGF стимулируют рецепторы на поверхности эндотелия, в результате чего развивается локальная релаксация сосуда, происходит разрушение контактов между эндотелиоцитами, отделение перицитов и разрушение базальной мембраны. Далее происходит миграция клеток эндотелия и удлинение будущего сосудистого ростка. При этом дифференцируются концевые и стеблевые ЭК [11].
Несмотря на то, что процесс прорастания происходит из ЭК одного и того же сосуда, концевые и стеблевые клетки в формирующемся сосуде различаются как функционально, так и морфологически. Концевые клетки имеют многочисленные филоподии и выступы, соответствующие их высокоподвижному поведению, тогда как у стеблевых клеток относительно мало филоподий [12].
Интересно, что ЭК, являющаяся клеткой-инициатором прорастания, «навязывает» фенотип клеткам посредством экспрессии лиганда Notch Delta-like 4 (Dll4). В соседних ЭК Dll4 связывает рецепторы Notch, вызывая высвобождение внутриклеточного домена Notch и управление экспрессией рецептора VEGF1 (VEGFR1) [13], на фоне снижения экспрессии VEGFR2. Повышенное соотношение VEGFR1/VEGFR2 снижает чувствительность ЭК к VEGF и «навязывает» фенотип стеблевых клеток [14].
Особенности метаболизма эндотелиальных клеток
В метаболизме ЭК основную роль занимает процесс гликолиза, который имеет ряд преимуществ перед окислительным фосфорилированием: во-первых, высокая скорость гликолиза поддерживает продукцию лактата, который функционирует как проангиогенная сигнальная молекула [15, 16]. Во-вторых, активные формы кислорода сохраняются на минимальном уровне, тогда как количество кислорода, доступного для передачи тканям, остается на достаточном уровне [17]; в-третьих, зависимость от гликолиза создает предпосылки для прорастания ЭК в бессосудистую, гипоксическую среду, где уровни интерстициальной глюкозы не ограничивают скорость процесса [18, 19].
Активность процесса гликолиза напрямую зависит от стимуляции VEGF, которые способны повышать уровень экспрессии переносчика глюкозы 1 и гликолитических ферментов, таких как лактатдегидрогеназа (ЛДГ) A и бифункциональная 6-фосфофрукто-2-киназа/фруктозо-2,6-бисфосфатаза-3 (6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase 3, PFKFB3). Последняя является регулятором гликолиза и использует свою киназную активность (которая в 700 раз превышает фосфатазную активность) для выработки фруктозо-2,6-бисфосфата, который аллостерически активирует ограничивающий скорость гликолитический фермент фосфофруктокиназу-1. Несмотря на то, что генетически обусловленный дефицит или химическое ингибирование PFKFB3 лишь частично (на 40%) снижает гликолиз, этого достаточно, чтобы существенно нарушить прорастание ЭК in vitro, а также ветвление и разрастание сосудов in vivo 21. В зрелом эндотелии наблюдается снижение активности гликолиза и уменьшение количества митохондрий, что обусловливает функциональный покой эндотелия [23].
Следует отметить, что количество митохондрий в эндотелии составляет примерно 2-6%, при этом в гепатоцитах их содержится 28%. Однако при переходе из состояния покоя в ангиогенез потребление кислорода в ЭК усиливается в 3 раза [24]. При этом работа митохондрий эндотелия согласуется с эффектом Крэбтри, при котором более низкие уровни глюкозы (~1 ммоль/л) вызывают усиление митохондриального дыхания с противоположными эффектами (ингибирование роста и снижение дыхания) при высоких уровнях глюкозы [25].
Особенности обмена липидов в эндотелиальных клетках
Эндотелиальные клетки не только способны накапливать липиды, но также самостоятельно их синтезировать. Поскольку ферменты синтеза триглицеридов находятся в эндоплазматическом ретикулуме, образование липидных капель de novo предположительно происходит в его мембране. При необходимости липиды гидролизируются с образованием жирных кислот при участии триглицеридлипазы жировой ткани, гормоночувствительной липазы и моноглицеридлипазы [26]. Кавеолины (Cav-1-3) представляют собой белки оболочки, управляющие биогенезом кавеол, т. е. микродоменов липидных рафтов с колбообразной структурой выпячивания 60-100 нм. Потеря эндотелиального Cav-1 нарушает образование липидных капель за счет усиленного липолиза под влиянием гормоночувствительной липазы, что, возможно, объясняет, почему мыши с дефицитом Cav-1 защищены от атеросклероза [27]. Образование липидных капель в ЭК необходимо для предотвращения липотоксичности, обеспечения процесса β-окисления жирных кислот для снижения интенсивности процесса гликолиза и высвобождения жирных кислот из ЭК в соседние периваскулярные клетки [26].
Таким образом, ЭК принимают активное участие в обмене липидов: синтез липидов в ЭК необходим для их миграции, ингибирование ацетил-КоА-карбоксилазы сдвигает липидный состав мембран ЭК в сторону увеличения уровня полиненасыщенных жирных кислот, что снижает текучесть мембран, образование филоподий и миграцию ЭК [28]. Наличие липидов в ЭК способно вызвать дисфункцию эндотелия: окисленные фосфолипиды, увеличивают секрецию пуринов, при этом для поддержания клеточного уровня АТФ ЭК увеличивают синтез глицина посредством регуляции митохондриальной метилентетрагидрофолат дегидрогеназы/циклогидролазы [29]. ЭК транспортируют липиды в другие клетки. При этом важное значение в этом процессе имеет транслоказа жирных кислот FAT/CD36, отвечающая за перенос жирных кислот через клеточную мембрану. Внутри ЭК липиды находятся либо в свободном состоянии в виде жирных кислот, либо связаны с белками, связывающими жирные кислоты, которые транспортируют жирные кислоты к местам назначения [30].
Таким образом, эндотелий сосудов играет жизненно важную и повсеместную роль в сосудистом гомеостазе, регулируя транспорт клеток, питательных веществ и метаболитов между кровотоком и подлежащими тканями. Сахарный диабет, ожирение, дислипидемия, курение способны вызывать дисфункцию эндотелия, проявлением которой могут быть: повреждение и утрата целостности с увеличением проницаемости сосудистой стенки, индукция синтеза цитокинов и молекул адгезии, метаболические нарушения, создание протромботической среды, дедифференциация клеток [31].
Функционирование эндотелия в условиях гипоксии
При тканевой гипоксии увеличивается экспрессия факторов, индуцируемых гипоксией (hypoxia-inducible factors, HIF-факторы), за счет пролилгидроксилазы (prolyl hydroxylase domain, PHD). PHD необходим кислород для гидроксилирования субъединицы HIFa. Во время гипоксии PHD теряет способность гидроксилировать HIF из-за их ферментативной зависимости от кислорода, и потеря этого механизма деградации приводит к активации HIF-опосредованной программы транскрипции, которая включает в себя индукцию ангиогенеза, метаболизма глюкозы и рассматривается как важный фактор в развитии злокачественных опухолей. HIF транскрипционно функционирует как гетеродимер, состоящий из субъединиц HIFa и HIFbs, который связывается с элементом ответа на гипоксию в промоторе генов-мишеней. В большинстве типов клеток HIF-1 экспрессируется при острой гипоксии. Переход от HIF-1 к HIF-2 наблюдается в случае хронизации процесса гипоксии, несмотря на то, что большинство генов регулируется и тем и другим фактором одновременно [32]. HIF-2α увеличивает экспрессию тирозинфосфатазы, что, в свою очередь, снижает фосфорилирование V-кадерина, поддерживая целостность связи, и предотвращает потерю барьерной функции эндотелия [33]. Экспрессия HIF-1α в альвеолярных ЭК усиливает реакцию воспаления и способствует клеточноопосредованному воспалению с активацией CD4 + и CD8 + , а также увеличивает экспрессию провоспалительных цитокинов интерлейкина (ИЛ) 2 и фактора некроза опухоли-α, которые подавляют CD55, в результате чего происходит усиление комплемент-ассоциированного повреждения эндотелия [34]. Кроме того, HIF-1α миелоидных клеток является ключевым фактором активации клеток в условиях гипоксии и воспаления за счет модуляции клеточной энергетики, активации гликолитических ферментов и транспортеров глюкозы, что позволяет генерировать АТФ в условиях гипоксии и предотвращать апоптоз клеток врожденного иммунитета. Однако при хронических инфекциях HIF-1α предотвращает чрезмерное рекрутирование лимфоцитов в интерстиций легких и иммунопатологические последствия для организма хозяина [35]. Увеличение количества циркулирующих ЭК-предшественников положительно коррелирует с выживаемостью пациентов [36].
Повреждение эндотелия при COVID-19
Исходное повреждение эндотелия обнаруживается у пациентов с сахарным диабетом и ожирением за счет повышения содержания адипокинов в плазме: этот эффект связан с активацией на фоне воспаления криопирина и аутокринной продукцией ИЛ-1β [37]. Присоединение инфекции усиливает имеющееся повреждение эндотелия, что вызывает избыточное образование тромбина и снижение фибринолиза [38, 39]. Тромбин способствует дальнейшему повреждению эндотелия, которое можно предотвратить in vitro с помощью агонистов хемокинового (мотив С-Х-С) рецептора-4 (CXCR4), таких как убиквитин [40]. Более того, гипоксия может привести к увеличению экспрессии HIF-1α и гиперкоагуляции [41]. Таким образом, у пациентов с пневмонией COVID-19 регистрируется более высокая частота тромботических эпизодов, в то время как повышенная проницаемость сосудов, по-видимому, тесно связана с повышенным тромбозом. В частности, у пациентов с пневмонией и органной недостаточностью повышенная проницаемость сосудов сильно коррелировала с тяжелой лимфопенией [42].
При проведении КТ органов грудной клетки у пациентов с COVID-19 обнаружено более раннее появление интерстициального отека легких по сравнению с пациентами, имеющими острый респираторный дистресс-синдром (ОРДС), с последующим присоединением альвеолярного отека, что ставит под сомнение сходство повреждения легких при COVID-19 и ОРДС. При патогистологическом исследовании образцов легочной ткани, взятых у пациентов, умерших от COVID-19, обнаруживается диффузный микроциркуляторный и макрососудистый тромбоз, что не характерно для ОРДС [43]. При этом признаков васкулита и ДВС-синдрома не наблюдается: количество антитромбина-III, фибриногена и уровень тромбоцитов незначительно снижаются на ранних этапах заболевания, в то время как уровень D-димера прогрессивно увеличивается и является прогностическим признаком тяжелого течения COVID-19 [44].
Апоптоз клеток эндотелия сосудов легких может быть также вызван наличием хронического воспаления, например при хронической обструктивной болезни легких, или остро возникать на фоне ОРДС; в последнем случае он активируется киназой Брутона, ИЛ-17. На фоне повреждения эндотелия наблюдается выделение ЛДГ в кровь апоптозными ЭК [45]. Апоптоз клеток эндотелия также может возникать на фоне вирусных инфекций путем аутофагии, которая индуцируется НАДФН-оксидазой-2 [46]. Кроме того, эндотелий лимфатических сосудов легких наиболее чувствителен к окислительному стрессу, и при инфицировании SARS-CoV-2 именно эта популяция клеток подвергается наибольшему повреждению [47].
До настоящего времени остается спорным вопрос участия тромбоцитов в процессе повреждения эндотелия при COVID-19. Известно, что низкое количество тромбоцитов увеличивает в 5 раз смертность от COVID-19, хотя опубликованные показатели неоднородны. Чаще у пациентов с COVID-19 наблюдается увеличение уровня тромбоцитов, что, вероятно, связано с повышением содержания в сыворотке тромбопоэтина на фоне пневмонии 50.
Заключение
Пандемия COVID-19 заставила обратить более пристальное внимание на изучение свойств эндотелия и предоставить практическому здравоохранению инструменты для патогенетически обоснованной терапии заболеваний, связанных с патологией эндотелия. Представленный обзор данных литературы позволяет еще раз обозначить проблему эндотелиальной дисфункции, увидеть, что эндотелий является уникальной структурой, регулирующей деятельность всего макроорганизма, а нарушение функции ЭК является важным патогенетическим механизмом, лежащим в оcнове генеза различных заболеваний. Несмотря на то, что имеются сведения о маркерах дисфункции эндотелия, таких как HIF, VEGF, на наш взгляд, необходим дальнейший поиск новых маркеров, применимых в рутинной клинической практике. Безусловно важным направлением выступает поиск терапевтических стратегий коррекции эндотелиальной дисфункции.
Список литературы Свернуть Развернуть
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Биологическая роль эндотелия в условиях нормы
В работе предствлены современные данные отечественной и зарубежной литературы относительно биологической роли эндотелия сосудов в условиях нормы, участия эндотелия в регуляции сосудистого тонуса, коагуляционного потенциала крови, регуляции адгезии лейкоцитов, регуляции проницаемости сосудов и их реэндотелизацию за счет факторов роста
Ключевые слова
Обзор
Агабеков А.И., Рзаева Т.Ш.
Научные руководители: д.м.н., проф. Чеснокова Н.П., д.м.н., проф. Барсуков В.Ю
Кафедра патологической физиологии им. А.А. Богомольца
Введение
Эндотелиальные клетки имеют.гетерогенную структуру, обладающую многообразными функциями, а нарушение структуры и функций эндотелия является инициирующим фактором развития различных форм патологии. Эндотелиальная выстилка сосудов весьма разнообразна, в ряде органов и тканей имеет плотные межклеточные контакты, носит непрерывный характер, что свойственно для гематоэнцефалического барьера. В других органах и тканях, в частности, в почках, ряде эндокринных желез, эндотелий носит фенестрированный, синусоидальный характер, и тем самым обеспечивает селективную проницаемость для различных веществ (З. А. Лупинская, А. Г.Зарифьян, Т. Ц. Гурович, С. Г. Шлейфер 2008)
Сосудистый эндотелий, по мнению ряда авторов, является эндокринным органом, и выполняет многочисленные функции, в частности, регуляцию коагуляционного потенциала крови, а также сосудистого тонуса. Эндотелиальные клетки опосредуют воспалительные и иммунные процессы; регулируют адгезию лейкоцитов; модулируют окисление липидов; регулируют проницаемость сосудов, их реэндотелизацию за счет факторов роста.
Целью данной работы явился анализ данных литературы отечественных и зарубежных авторов относительно роли эндотелия в регуляции функциональной активности сосудистой стенки в условиях нормы.
Эндотелиальные факторы, регулирующие сосудистый тонус.
Среди эндотелиальных факторов, влияющих на сосудистый тонус, выделяют вазодилатирующие факторы, к которым относятся NO, EDHF (эндотелиальный гиперполяризующий фактор), простациклин, адреномедуллин, моноокись углерода, пуриновые основания, эндогенные каннабиоиды, Na-уретический пептид С, кинины и ряд других. К вазоконстрикторным факторам, продуцируемым эндотелиальными клетками, относятся тромбоксан А2, эндотелины, 20-HETE (20-гидрооксиэйкозотетраеновая кислота), ангиотензин II. Балланс между факторами релаксации и констрикции определяет тонус сосудов и соответственно величину местного кровотока. (Каде А.Х., Занин С.А., Губарева Е.А. и др. , 2011)
Вазодилатирующие факторы, продуцируемые эндотелием
Касаясь биологических эффектов ряда вазодилатирующих соединений, синтезируемых в эндотелиальных клетках, следует прежде всего остановиться на эффектах NO.
NО образуется в клетках эндотелия из L-аргинина под действием фермента NO-синтетазы. Имеются два уровня секреции NO — базальный и стимулированный. Тонус сосудов в покое осуществляется постоянной базальной секрецией. Некоторые химические вещества: ацетилхолин, АТФ, брадикинин, а также гипоксия или механическая деформация увеличивают синтез NO. Стимулируя гуанилатциклазу, NO увеличивает образование цГМФ в гладкомышечных клетках, тромбоцитах, что обусловливает расслабление сосудов, ингибирует пролиферацию гладкомышечных клеток и тормозит активность тромбоцитов и макрофагов. (В. Ф. Киричук, А. П. Ребров, С. И. Россошанская, 2005)
Простациклин синтезируется преимущественно в эндотелии. Основным механизмом, регулирующим его образование, является активность ферментов циклооксигиназ. Простациклин оказывает вазодилатирующее действие за счет стимуляции специфических рецепторов, локализованных на гладкомышечных клеток сосудов, что ведет к повышению активности в клетках аденилатциклазы и увеличение образования цАМФ. (Дзгоева Ф. У., Кутырина И. М. 2000)
При блокировании действия NO и простациклина вазодилатацию вызывает эндотелиальный фактор гиперполяризации (EDNF). Данный фактор выделяется только под действием некоторых стимулов: ацетилхолина, брадикинина, тромбина, гистамина, субстанции Р, АДФ, АТФ. EDNF является мощным вазодилататором, воздействующим на Cа ++ -зависимые К + -каналы гладкомышечных клеток сосудов, стимулируя выход из них ионов калия, который вызывает их гиперполяризацию и расслабление.
Пуриновые основания, эндогенными источниками которых являются тромбоциты, эндотелиоциты, нейроны и другие клетки, действуют на различные рецепторы клеток сосудистой стенки: при воздействии на рецепторы эндотелия, происходит стимуляция образования основных вазодилатирующих факторов: простациклина, оксида азота, эндотелиального гиперполяризующего фактора; при воздействии на рецепторы гладкомышечных клеток сосудов пуриновые нуклеотиды вызывают эндотелий-независимую вазодилатацию.
К эндогенным каннабиоидам относят анаидамид и 2-арахидонилглицерин, источниками которых являются клетки эндотеия, тромбоциты, лейкоциты, макрофаги, а также периваскулярные нервные окончания. Анаидамид и 2-арахидонилглицерин образуются в больших количествах при активации тромбоцитов и моноцитов и участвуют в механизмах снижения артериального давления при различных патологических состояниях. (Чурюканов М. В., Чурюканов В. В., 2004)
Известны еще два фактора, выделяемые эндотелием и вызывающие дилатацию сосудов: натрийуретический пептид С-типа (НПС) и адреномедуллин. Натрийуретический пептид С вызывает релаксацию сосудов и угнетает пролиферацию гладкомышечных клеток. Большей частью НПС синтезируется в эндотелии, воздействует на рецепторы гладкомышечных клеток, вызывая увеличение образования цГМФ, приводящего к расширению сосуда. Адреномедуллин действует как прямой вазодилататор за счет увеличения продукции цАМФ. В результате активации аденилатциклазы образуется из препроадреномедуллина в эндотелиальных и гладкомышечных клетках сосудов. Доказано. что сосудорасширяющее действие адреномедуллина связано как с эндотелий-зависимыми, так и с эндотелий-независимыми механизмами. Предполагается наличие специфических рецепторов к адреномедуллину. (Kitamura K. et al. Adrenomedullin, 1993)
Моноокись углерода образуется из гема под действием двух изоформ гемоксигеназ (НО-1 и НО2). Образуется СО в различных регионах, но преимущественно - в эндотелии сосудов мозга (Faraci F.M., Heistad D.D., 1998), где участвуют в регуляции кровотока, непосредственно вызывая расслабление мозговых сосудов. (Черток В. М., Коцюба А. Е., 2012)
Калликреин-кининовая система. Вазодилатирующий эффект кининов связан с активацией В2 рецепторов на эндотелии и образованием основных эндотелиальных вазодилатирующих факторов - NO, простациклина, EDHF.
Вазоконстрикторные факторы, продуцируемые эндотелием
Эндотелиальные факторы вызывают сужение сосудов, что связано с отсутствием высвобождения факторов релаксации и с продукцией констриктивных агентов. К вазоконстрикторам, синтезирующимся в эндотелиальных клетках относят эндотелины, тромбоксан А2, 20-HETE (20-гидрооксиэйкозотетраеновая кислота), ангиотензин II.
Эндотелины - наиболее мощные вазоактивные вещества. Самый изученный представитель данной группы - эндотелин-1. В физиологических концентрациях он действует на эндотелиальные рецепторы, вызывая высвобождение факторов релаксации, а в более высоких - активируют рецепторы на гладкомышечных клетках, стимулируя стойкую вазоконстрикцию и пролиферацию медии. (Дремина Н. Н., Шурыгин М. Г., Шурыгина И. А., 2016)
Тромбоксан А2 преимущественно синтезируется в тромбоцитах, но некоторое его количество образуется в эндотелии. Специфические рецепторы к нему расположены на гладкомышечных клетках сосудистой стенки. Сокращение гладкомышечных клеток при стимуляции тромбоксаном связано со снижением активности аденилатциклазы и повышением содержания внутриклеточного кальция. (Дзгоева Ф. У., Кутырина И. М., 2000)
Ангиотензин ||, образуется в результате активации ренин-ангиотензиновой системы и является одним из наиболее сильных вазоконстрикторов. Активация данной системы может происходить как на системном уровне при выделении ренина клетками юкстагломерулярного комплекса почек, так и локально, на уровне эндотелия, в котором образуется ренин и ангиотензин-превращающий фермент. (Бабак О. Я., Кравченко Н. А. 2005)
Вазоконстрикторную функцию выполняет 20-гидроксиэйкозотетраеновая кислота (20-НЕТЕ) - продукт обмена арахидоновой кислоты по монооксигеназному пути. 20-НЕТЕ, действуя на гладкомышечные клетки сосудов, вызывает деполяризацию клеточных мембран. Его образование увеличивается под действием ангиотензина 2 и эндотелина-1, а также при гипероксии и является одним из ведущих факторов высокого артериального давления. Увеличение его образовния сопровождается включением тормозных регуляторных механизмов активацией синтеза простациклина, т.е. сохраняется принцип антагонистической регуляции.
Роль эндотелия в регуляции коагуляционного потенциала крови
Одной из важных функций эндотелия является обеспечение тромборезистентности сосудистой стенки, а с другой стороны ее тромбогенности. К числу тромбогенных факторов, стимулирующих процессы адгезии и агрегации тромбоцитов относится vWF (фактор Виллебранда), PAF (фактор активации тромбоцитов), АДФ, тромбоксан А2 Адгезия тромбоцитов к эндотелию - это начальный этап процессов гемостаза и тромбоза, что приводит к формированию тромбоцитарного тромба, активации плазменных прокоагулянтов с последующим образованием тромбина. К ингибиторам синтеза тромбина относятся: тромбомодулин, протеогликаны, предотвращающие избыточное фибринообразование. Тромборегуляторы оказывают влияние не только на гемостаз, но и проницаемость сосудов, вазомоторные реакции, ангиогенез, клеточную пролиферацию. (Петрищев Н.Н., Власов Т.Д. 2003)
Как указывалось выше, при гипоксии и действии медиаторов, увеличивающих синтез NO, в эндотелиальных клетках, медии и адвентиции синтезируется простациклин. Простациклин активирует аденилатциклазу, следствием чего является увеличение содержания цАМФ, который, помимо выполнения вазодилатирующей функции, препятствует активации тромбоцитов и вызывает релаксацию сосудов. Нарушение синтеза простациклина или снижение его поступления в кровь создает тромбогенную опасность. NO подавляет адгезию и агрегацию тромбоцитов. Этот процесс ассоцирован с увеличением содержания в тромбоцитах цГМФ.
Тромбогенный риск повышается по мере снижения содержания в плазме крови активных антитромбинов, в первую очередь АТ III, при одновременном наличии предрасполагающих факторов — гиперлипидемии, ожирения, диабета, сердечной недостаточности. (Suck G., Traut W. 2000)
Эндотелий играет важную роль в развитии фибринолиза за счет секреции тканевого и урокиназного активаторов плазминогена и его ингибиторов, которые могут или быстро нейтрализовать плазмин, или препятствуют активации плазминогена. Под влиянием гемодинамических факторов, пристеночного напряжения сдвига, трансмурального давления и ряда других факторов возникает динамическое изменение синтеза и секреции тромбогенных и атромбогенных субстанций эндотелия. В физиологических условиях выделение атромбогенных субстанций преобладает над тромбогенными. (Петрищев Н.Н., Власов Т.Д. 2003)
Физиологический антикоагулянтный комплекс - это система протеина С (Pr C), в которую входит тромбомодулин, протеин С, протеин S, тромбин (активатор Pr C) и ингибитор Pr C. Функцией данной системы является ингибирование факторов свертывания крови Va и VIIIa, инактивация ингибитора тканевого активатора плазминогена. (Айламазян Э. К., Мозговая Е. В. 2008)
В регуляции гемостатической функции эндотелия большое значение имеют гормоны вазопрессин, эстрогены, цитокины: интерлейкин-1, TNF- α, гемодинамические факторы. К факторам эндотелиального происхождения, ингибирующим адгезию и агрегацию тромбоцитов, относят простациклины, простагландины Е2, NO.
Значение эндотелия в регуляции адгезии лейкоцитов
Исключительно важную роль играет эндотелий в развитии адгезии лейкоцитов. К адгезивным молекулам эндотелия относятся Р-селектин, GMP-140, ELAM-1, ICAM. Повышение адгезивности эндотелия имеет большое значение в патогенезе воспалительных процессов, атеросклерозе, септическом шоке. Однако до настоящего момента остается не изученным значение нарушения адгезивных свойств сосудистой стенки в патогенезе неоплазий различной локализации и развитии метастазирования малигнизированных клеток.
Значение эндотелиальных клеток в процессе ангиогенеза
Эндотелию принадлежит значительная роль в процессе ангиогенеза в условиях патологии. В стабильном состоянии эндотелиоциты пролиферируют лишь раз в 10 лет. Под действием ангиогенных факторов происходит пролиферация эндотелиоцитов, которая заканчивается их дифференцировкой и реэндотелизацией сосудов. Эндотелий активно участвует в процессе кооперации между эндотелиоцитами и окружающими клетками, выделяя факторы роста (VEGF, FGF-2), вызывая таксис и пролиферацию гладкомышечных клеток и фибробластов.
Эндотелиальная дисфункция является одним из универсальных патогенетических факторов развития таких форм патологии как атеросклероз, гипертоническая болезнь, сахарный диабет, тромбогеморрагический синдром и канцерогенез. Причинами эндотелиальной дисфункции могут быть ишемия, гипоксия тканей, свободно-радикальное повреждение, цитокины и ряд других факторов.
Заключение
В патогенезе заболеваний различного генеза большое значение имеют нарушения функциональной активности сосудистой стенки, являющейся, по существу, эндокринным органом, регулирующим состояние сосудистого тонуса, коагуляционного и тромбоцитарного-сосудистого звеньев системы гемостаза, фибринолиз, адгезивно-агрегационные способности эндотелия, процессы ангиогенеза, экспрессирующие белки МНС I и II классов, участвующих в ряде случаев в представлении антигенов-аллергенов, а также продуцирующим различные цитокины локального и системного действия. В патогенезе заболеваний различной этиологии важная роль относится эндотелиальной дисфункции, в связи с этим абсолютно необходимо знание многочисленных функций сосудистой стенки в условиях нормы и маркеров эндотелиальной дисфункции, свидетельствующих о развитии патологии.
Литература
1. Петрищев Н.Н., Власов Т.Д. Физиология и патофизиология эндотелия/Дисфункция эндотелия. Под ред. Н.Н. Петрищева. СПбГМУ 2003: стр. 4—38.
2. Киричук В. Ф., Ребров А. П., Россошанская С. И. Тромбоз. Гемостаз. Реология./Функции эндотелия сосудистой стенки 2005 №2: стр. 23
3. Каде А.Х., Занин С.А., Губарева Е.А., Туровая А.Ю., Богданова Ю.А., Апсалямова С.О., Мерзлякова С.Н. Физиологические функции сосудистого эндотелия // Фундаментальные исследования. - 2011. - № 11-3. - С. 611-617;
4. Барсуков В.Ю., Чеснокова Н.П., Агабеков А.И., Бизенкова М.Н. Показатели эндотелиальной дисфункции и состояния коагуляционного потенциала крови как объективные критерии инициации и малигнизации клеток при раке толстой кишки // Современные проблемы науки и образования. - 2015. - № 6.;
5. Агеев, Ф.Т. Роль эндотелиальной дисфункции в развитии и прогрессировании сердечно-сосудистых заболеваний / Ф.Т. Агеев // ЖСН. 2004.-Т. 4, № 1.-С. 21-22.
6. Чурюканов М. В., Чурюканов В. В. Функциональная организация и терапевтический потенциал эндогенной каннабиноидной системы //Экспериментальная и клиническая фармакология. - 2004. - Т. 67. - №. 2. - С. 70-78.
7. Воскобой И. В., Семенов А. В., Мазуров А. В. и др. Активность тромбоцитов и функциональное состояние эндотелия у больных с нестабильной стенокардией с благоприятным и неблагоприятным исходом (проспективное исследование) / // Кардиология. — 2002. — № 9. — С. 4-11
8. Бокерия, Л.А. Современное общество и сердечно-сосудистая хирургия / Л.А. Боке-рия // Тез. докл. V Всерос. съезда сердечно-сосудистых хирургов. М., 1999. - С.З-6.
9. Дзгоева Ф. У., Кутырина И. М. Тромбоксан А2 и простациклин у больных хроническим гломерулонефритом и ишемической болезнью сердца в условиях нефротоксического действия рентгеноконтрастных средств //Протективное действие антагонистов кальция. Тер. арх. - 2000. - Т. 6. - С. 42-45.
10. Айламазян Э. К., Мозговая Е. В. Гестоз: теория и практика //М.: МЕДпресс-информ. - 2008. - Т. 272.
11. Черток В. М., Коцюба А. Е. Эндотелиальный (интимальный) механизм регуляции мозговой гемодинамики: трансформация взглядов //Тихоокеанский медицинский журнал. - 2012. - №. 2 (48).
12. Бабак О. Я., Кравченко Н. А. Роль ренин-ангиотензиновой системы в ремоделировании сердца и сосудов //Укр. терапевт. журн. - 2005. - №. 2. - С. 89-96.
13. Дремина Н. Н., Шурыгин М. Г., Шурыгина И. А. Эндотелины в норме и патологии //Международный журнал прикладных и фундаментальных исследований. - 2016. - №. 10-2. - С. 210-214.
14. Kitamura K. et al. Adrenomedullin: a novel hypotensive peptide isolated from human pheochromocytoma //Biochemical and biophysical research communications. - 1993. - Т. 192. - №. 2. - С. 553-560
15. Suck G., Traut W. TROMB, a new retrotransposon of the gypsy-Ty3 group from the fly Megaselia scalaris //Gene. - 2000. - Т. 255. - №. 1. - С. 51-57.
16. Baylis C., Vallance P. Measurement of nitrite and nitrate levels in plasma and urine—what does this measure tell us about the activity of the endogenous nitric oxide system? Curr Opin Nephrol Hypertens 1998 Jan;7(l):59-62.
17. Moncada S., Vane J,R. Pharmacology and endogenous roles of prostaglandin endoperoxides, thromboxane A2 and prostacyclin. Pharmacol Rev 1979;30:293-331
18. Faraci F. M., Heistad D. D. Regulation of the cerebral circulation: role of endothelium and potassium channels //Physiological reviews. - 1998. - Т. 78. - №. 1. - С. 53-97.
Читайте также:
- КТ, МРТ при доброкачественной смешанной опухоли неба
- TNM стадии рака мочевого пузыря
- Случай успешного лечения подострого тиреоидита после короновирусной инфекции
- Перелом тела нижней челюсти. Кровотечение при переломе нижней челюсти
- Иссечение свища с зашиванием раны. Варианты иссечения свища с зашиванием раны.
