Эпигенетика и механизмы влияния задержки внутриутробного развития на нее
Добавил пользователь Skiper Обновлено: 22.01.2026
Неблагоприятные факторы не во всех случаях способны программировать развитие патологии в постнатальном периоде. Степень восприимчивости плода к этим факторам и последствия их воздействия на развивающийся организм объясняются высокой «пластичностью внутриутробного развития» плода и зависят от «критического периода», в течение которого может произойти программирование какой-либо патологии. Как правило, эти периоды совпадают с интервалами максимальной пролиферативной активности клеток различных органов и тканей. Поскольку периоды максимальной пролиферативной активности клеток разных органов и тканей существенно различаются, точно определить временны`е интервалы всех уязвимых периодов внутриутробного развития для определенных органов и тканей не представляется возможным.
«Критическими периодами» онтогенеза традиционно считаются: периоды формирования бластоцисты и дифференцировки клеток зародышевых листков, органогенез и тонкая дифференцировка клеток функциональных систем организма [28]. Полагают, что характер родоразрешения, а также развитие ребенка в первые несколько лет жизни существенным образом программируют реализацию предрасположенностей к развитию заболеваний, сформированных внутриутробно.
Механизмы фетального программирования и заболевания у взрослых
Экспериментальные исследования на животных ясно показали, что неблагоприятные условия пренатального периода вызывают стойкие изменения в развитии плода, которые в зрелые годы жизни обусловливают повышенный риск развития заболеваний. Цель современных исследований — идентификация специфических молекулярных механизмов, которые определяют взаимосвязь процессов, протекающих в пренатальном периоде развития организма (времени наибольших биологических изменений и вследствие этого — наибольшей уязвимости организма к неблагоприятным воздействиям), и рисков развития будущих взрослых заболеваний.
В настоящее время рассматриваются два важнейших механизма, объясняющих повреждающее действие неблагоприятных факторов на пренатальное развитие: собственно нарушение развития и нарушение адаптации [29, 30].
Нарушение развития — прямой тератогенный ответ на высокоинтенсивное или токсическое воздействие, проявляющийся в виде задержки или нарушения нормальных процессов развития. Следствием данного типа ответа является непосредственное развитие физических уродств или появление функциональных недостаточностей [31]. В отличие от первого механизма, нарушение адаптации — комплекс более тонких изменений, реорганизующий процесс нормального развития с целью перераспределения физиологических ресурсов плода для максимального увеличения шансов на выживание в неблагоприятных условиях окружающей среды [32]. Хотя изменения адаптации необходимы только в период внутриутробного развития, они продолжают действовать и после рождения, в дальнейшем обусловливая измененный ответ организма на различные неблагоприятные факторы во взрослом периоде жизни [29]. В свою очередь нарушение адаптации может быть обеспечено тремя различными механизмами: ремоделированием тканевого развития, изменениями эндокринной системы и стойкими повреждениями генной экспрессии [32].
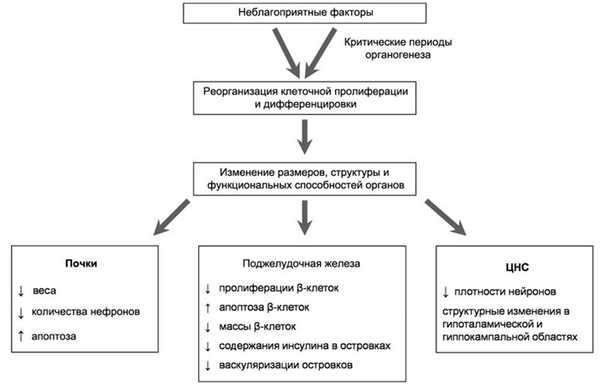
Тканевое ремоделирование. Тканевое ремоделирование — совокупность изменений (посредством количества и типа клеток) физиологических размеров и состава тканей и органов. Во время эмбрионального и фетального периодов развития большинство тканей крайне чувствительно к неблагоприятным внешним воздействиям. Участвуя в процессе органогенеза, эмбриональные клетки подвергаются координированной миграции, пролиферации и дифференцировке. Вследствие этого неблагоприятные воздействия в данные критические периоды развития организма способны вызывать необратимые структурные и функциональные повреждения тканей (рис. 1). Рисунок 1. Механизм тканевого регулирования. Данные повреждения могут быть ответом на тератогенное воздействие [31] или нарушением адаптации, сохраняющей и перераспределяющей ограниченные ресурсы в субоптимальных условиях выживания [32].
Изучение клеточного ремоделирования проводится на различных животных моделях, однако в связи с относительно коротким периодом гестации и быстрым постнатальным развитием чаще всего используются крысы. Одним из наиболее изученных примеров является ремоделирование почечной ткани.
Известно, что общее количество нефронов, характерное для взрослого человека, определяется задолго до рождения, в постнатальном периоде новые нефроны не образуются [33]. Отмечено, что у потомства крыс, родившегося от матерей, получавших во время беременности низкобелковую диету (НБД-потомство), масса почек [34] и количество нефронов уменьшены [34, 35], а процесс апоптоза ускорен [36]. Снижение питания потомства крыс во внутриутробном периоде за счет перевязки маточной артерии или снижения содержания кислорода во вдыхаемом матерью воздухе также приводило к стойкому уменьшению почечной массы и количества нефронов [33].
Другим хорошо изученным примером является клеточное ремоделирование в ткани поджелудочной железы плода, где к воздействию неблагоприятных факторов оказываются крайне чувствительными островковые клетки. У НБД-потомства крыс наблюдаются выраженные повреждения морфологической структуры поджелудочной железы, включая уменьшение количества, усиление апоптоза и снижение пролиферации β-клеток, уменьшение содержания инсулина и нарушение васкуляризации в островках Лангерганса [37]. Схожие дефекты развития поджелудочной железы вызывает у потомства и низкокалорийное питание матери во время беременности [38].
Показано, что у потомства животных, получавших низкобелковое питание, отмечалось изменение структуры и функции печени. Снижалось общее количество печеночных долек при одновременном их укрупнении. При этом наблюдались повышенная способность к глюконеогенезу [39], повышенное высвобождение жирных кислот из адипоцитов, повышенные концентрации ЛПНП и фибриногена в плазме [40, 41]. Данные особенности могут быть полезными в постнатальном периоде при дефиците питательных веществ, но способствуют развитию метаболических нарушений при благоприятных условиях [42].
Мышечная ткань — основная периферическая точка приложения действия инсулина. Считается, что если с 30-й недели плод испытывает дефицит нутриентов, то в ответ его мышцы становятся резистентными к инсулину и, возможно, частичная резистентность сохраняется на всю жизнь.
Развитие нейрональных клеток мозга также испытывает негативное влияние неблагоприятных факторов. У НБД-потомства [43] и у потомства от матерей с гестационным диабетом [44] отмечены выраженные повреждения плотности и архитектуры нейрональных гипоталамических клеток. Изменения морфологии и структуры гиппокампа наблюдаются у потомства, матери которых получали во время беременности глюкокортикоиды [45]. Показано, что длительное воздействие глюкокортикоидов вызывало не только отдаленные нарушения активности глюкокортикоидиндуцируемых ферментов, но и нарушения симпатоадреналовой функции [46]. Последнее было показано в экспериментах на крысах, когда применение глюкокортикоидов во время беременности приводило к нарушениям дифференцировки автономных нейронов и увеличению количества адренергических рецепторов, являясь примером клеточной трансформации. Таким образом, полагают, что структурная реорганизация тканевого развития является общим механизмом, посредством которого неблагоприятные факторы внутриутробного периода могут приводить к стойким повреждениям функции различных тканей во взрослой жизни. Значительные тканевые изменения таких ключевых органов, как почки и поджелудочная железа, причастны к развитию артериальной гипертензии, СД2 и сердечно-сосудистых заболеваний в будущем.
Изменения эндокринной системы. Эндокринная система играет важнейшую роль в регуляции большинства физиологических процессов. Фетальный рост и развитие являются одним из таких процессов, организованным комплексным взаимодействием между окружающей средой, материнской и фетальной сигналинговыми системами. Таким образом, повреждения материнско-фетальной эндокринной функции вследствие влияния неблагоприятных факторов — важнейший механизм, обусловливающий нарушение пренатального роста и развития. Повреждения эндокринной системы заключаются в изменении гормональной продукции, секреции и биологической активности, а также чувствительности тканей-мишеней. Следовательно, возможны повреждения на различных уровнях, следствием которых являются стойкие нарушения регуляции и активности материнской и фетальной эндокринных систем, а также их взаимодействия.
Нарушения чувствительности обнаружены в разных эндокринных системах, включая ренин-ангиотензиновую [47], гипоталамо-гипофизарно-адреналовую [48] и инсулиновую [49]. Показано, что у НБД-потомства ренин-ангиотензиновая активность снижена во время внутриутробного развития [50], но повышается после рождения, особенно во взрослые годы жизни [47]. Предполагается, что супрессия фетальной ренин-ангиотензиновой активности является следствием развивающейся в неблагоприятных условиях внутриутробного развития недостаточности нефрогенеза [50]. Повышение активности данной системы в постнатальном периоде обусловливает механизм развития гипертензии в зрелые годы [47].
Ограниченное поступление нутриентов к плоду может привести к стойкому нарушению нейроэндокринной регуляции, выражающемуся в повышении гипоталамо-гипофизарно-надпочечниковой (ГГН) и симпатоадреналовой гормональной активности и нарушениях ответа организма на стресс.
Чрезмерное воздействие глюкокортикостероидов на плод наблюдается при недостаточном питании матери, частом действии мощных стрессов и других неблагоприятных факторов, нарушающих течение беременности. В ответ на это развивается стресс-реакция с увеличением секреции глюкокортикостероидов в надпочечниках плода и в плаценте. Выраженность влияния избыточных концентраций глюкокортикостероидов на плод существенным образом зависит от характера активности 11β-гидроксистероиддегидрогеназы (11β-ГСД) [51], конвертирующей глюкокортикостероиды в неактивные 11-кето-производные. За счет этого предотвращается избыточное действие материнских глюкокортикостероидов на плод. В условиях недостаточного питания матери происходит снижение активности (до 30%) 11β-ГСД и таким образом усиливается воздействие материнских глюкокортикостероидов на плод [51]. Выяснено, что активность 11β-ГСД обратно пропорциональна размеру плаценты [52], что соответствует ранним эпидемиологическим изысканиям D. Barker, показавшего, что наибольшим риском развития сердечно-сосудистых заболеваний обладают те новорожденные с ЗВУР, у которых были большие плаценты.
Одними из важнейших следствий воздействия избытка глюкокортикостероидов на плод являются снижение пролиферативной активности клеток его внутренних органов и более ранняя дифференцировка клеток, программирование дисфункции эндотелия кровеносных сосудов.
Данные о программировании адренокортикальной активности у человека показали, что маловесные дети имеют не только повышенный уровень кортизола в пуповинной крови, но также тенденцию к более высоким значениям кортизола в более старшем возрасте. Этот эффект подтверждают исследования у мужчин 60-летнего возраста, продемонстрировавшие обратную зависимость между МТ при рождении и уровнем кортизола в плазме крови натощак [53]. Лица, имевшие низкую МТ при рождении, отличаются более высокой частотой пульса, что свидетельствует о повышенной активности симпатической нервной системы.
Инсулиноподобные факторы роста наряду с инсулином играют ключевую роль в регуляции темпов внутриутробного роста. Поэтому не случайно пристальное внимание уделяется изучению системы СТГ-ИФР-1. Показано, что у детей, родившихся с ЗВУР, на фоне нормальных базальных и стимулированных значений СТГ наблюдаются сниженные уровни ИФР-1, что, по-видимому, свидетельствует о сниженной функциональной активности рецептора СТГ. Более того, аномалии оси СТГ-ИФР могут также участвовать в программировании взрослых заболеваний [54, 55]. При изучении полиморфизма нуклеотидов гена гормона роста и плацентарного лактогена у когорты лиц от 59 до 72 лет выявлена их взаимосвязь с некоторыми фенотипическими особенностями у мужчин: низкой массой тела в возрасте 1 года, низким ростом, высоким АД, гиперинсулинемией и гипертриглицеридемией [56].
Инсулин играет центральную роль в регуляции роста плода во время пренатального развития и поддержании гомеостаза глюкозы у взрослых. Воздействия неблагоприятных факторов во время внутриутробного развития выражаются в повреждении функции поджелудочной железы и нарушении периферической инсулиновой чувствительности.
У плода инсулин играет ключевую роль в стимуляции клеточного деления посредством стимуляции секреции ИФР-1. Резистентность к инсулину в некоторых специфических тканях, таких как скелетная мускулатура, может играть роль защитного механизма, который позволяет экономнее использовать глюкозу при ее недостаточном поступлении за счет ограничения роста плода. Адаптация может выражаться и в уменьшении мышечной массы и ее гипотрофии, так как скелетная мускулатура — основная периферическая ткань, на которую действует инсулин.
Показано, что у НБД-потомства после рождения наблюдается улучшение толерантности к глюкозе и инсулиновой чувствительности. Однако в дальнейшем происходит быстрое возраст-зависимое снижение толерантности к глюкозе, что связано с истощением β-клеток в сочетании с повышением инсулиновой резистентности [14, 37]. Схожие изменения обнаружены у потомства крыс, внутриутробное развитие которых проходило в условиях перевязки маточной артерии [49].
Вместе с тем необходимо отметить, что в молодом возрасте и при нормальном индексе МТ признаков инсулинорезистентности не отмечено ни у людей, ни у крыс. Известно, что критическим периодом нарастания мышечной массы является время с 30-й недели беременности и весь первый год постнатального развития. Если в первые годы жизни ребенок быстро увеличивает МТ, это в большей степени происходит за счет увеличения жировой ткани, чем за счет нарастания мышечной массы, что также может способствовать развитию резистентности к инсулину [1].
Резистентность к инсулину может быть обусловлена и повышенной активностью ГГНС.
Кроме того, данные МР-спектроскопии показали, что взрослые люди с низкой МТ при рождении в анамнезе имеют сниженный уровень гликолиза и продукции АТФ в скелетной мускулатуре.
Таким образом, большинство примеров нарушения эндокринной системы обусловлены изменением активности эндокринных органов и тканей-мишеней. Поскольку эндокринная система участвует в регуляции тканевого роста и развития, ее повреждения могут играть определяющую роль в регуляции тканевого развития.
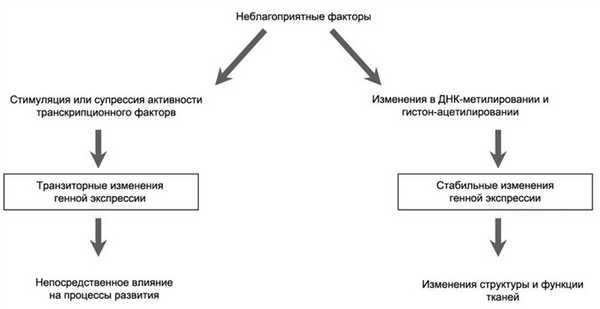
Изменения экспрессии генов. Индивидуальное генетическое наследование определяет прогноз будущего роста и развития организма. Вместе с тем неблагоприятные внутриутробные условия и уровень их интенсивности значительно снижают степень осуществления этих прогнозов. Изменение экспрессии генов является одним из фундаментальных механизмов прямого влияния неблагоприятных факторов на рост и развитие в пренатальном периоде. Эти факторы могут воздействовать на экспрессию генов по крайней мере двумя путями (рис. 2). Рисунок 2. Два возможных механизма генной экспрессии. Первый путь — генетическая экспрессия может быть транзиторно повреждена посредством нарушения активности транскрипционных факторов, промоторов и супрессоров генов.
Второй путь — повреждающие факторы могут индуцировать более устойчивые нарушения экспрессии генов в результате эпигенетической модификации ДНК. Предполагается, что эпигенетические изменения в экспрессии генов представляют центральный молекулярный механизм, посредством которого неблагоприятные факторы способны стойко повреждать будущие физиологические функции. Нарушения экспрессии генов могут быть как причиной, так и следствием ремоделирования тканей и изменений со стороны эндокринной системы.
Эпигенетическая регуляция активности генов подразумевает изменение характера их экспрессии без модификации последовательности ДНК и без изменения структуры самих генов [57].
Эпигенетические изменения экспрессии генов охватывают процессы ДНК-метилирования и гистон-ацетилирования. Метилирование ДНК включает ковалентное добавление метильных групп к гистонным остаткам ДНК. Характерным является то, что промотор гиперметилирования ассоциирован с молчащим геном, тогда как гипометилирование — с активной экспрессией гена [58]. В свою очередь ацетилирование гистона представляет собой добавление ацетил-группы к лизиновым остаткам гистона [59]. Изменения в ацетилировании гистона изменяют конформацию хроматина, которая в свою очередь нарушает экспрессию гена. Обычно ацетилирование гистона ассоциировано с транскрипционно активным генным локусом, характеризующимся обширной конформацией хроматина [59]. Эпигенетическое моделирование генной экспрессии во время гаметогенеза и раннего эмбриогенеза, являющихся критическими периодами развития, особенно чувствительно к повреждающему влиянию неблагоприятных факторов [60].
Изменения генной экспрессии как в фетальной, так и во взрослой тканях потомства, внутриутробное развитие которого проходило в неблагоприятных условиях, были обнаружены во многих исследованиях. Однако лишь недавно ученые начали исследовать эпигенетическую основу этих изменений. В исследованиях с использованием модели перевязки маточной артерии обнаружено, что фетоплацентарная недостаточность может стойко нарушать метилирование структуры ДНК [61], ацетилирование гистона и структуру хроматина [62] в тканях взрослого потомства. Фетоплацентарная недостаточность ассоциирована со специфическим гипометилированием гена р53 в почке плода, что впоследствии связано с увеличением экспрессии р53 мРНК и усилением ренального апоптоза [61]. В ЦНС плода фетоплацентарная недостаточность также ассоциирована с глобальным гипометилированием и снижением ацетилирования гистона [62].
Таким образом, в многочисленных эпидемиологических исследованиях описана сильная взаимосвязь между маркерами ЗВУР (сниженные МТ, окружность головы, окружность живота, диспропорции тела) и повышенным риском развития метаболических заболеваний в последующие взрослые годы. Предполагается, что эта взаимосвязь является следствием развивающейся адаптации плода в ответ на неблагоприятные факторы пренатального периода. Экспериментальные исследования на животных показали, что данные факторы могут индуцировать стойкие физиологические изменения, которые определяют серьезные риски развития метаболических и кардиоваскулярных аномалий во взрослой жизни. Размеры плода при рождении — не более чем косвенное отражение тех процессов, которые действительно управляют механизмами фетального программирования, а МТ при рождении является лишь неадекватным интегральным показателем внутриутробного роста.
Роль негативных факторов антенатального и интранатального периодов в формировании дезадаптации новорожденных из группы высокого риска
Изучена роль неблагоприятных материнских факторов в нарушении постнатальной адаптации новорожденных из группы высокого риска. Выявлено негативное влияние факторов анте- и интранатального периодов, в большинстве случаев сочетанных, способствовавших формиро
Meaning of adverse factors of ante-natal and intra-natal periods in formation of deconditioning of newborn children from high-risk group
Meaning of adverse maternal factors in disorder of post-natal adaptation of newborn children from high-risk group was studied. Negative effect of factors of ante-natal and intra-natal periods, combined in most cases, contributing to newborns’ deconditioning, was revealed.
На этапе внутриутробного развития происходит сложный процесс формирования будущего ребенка, в связи с чем проблемы женского здоровья в различные сроки гестации, а также состояние развивающегося плода и новорожденного занимают одно из ведущих мест в современном здравоохранении [1, 2]. Наиболее частой причиной инвалидизации детского населения являются разнообразные поражения перинатального периода 4. При нарушении функционирования различных систем материнского организма, ответственных за развитие адаптационных изменений в течение беременности, многочисленные физиологические приспособительные процессы становятся несовершенны [7, 8]. Это способствует формированию акушерской патологии (невынашивание, гестозы, анемия и др.), обострению хронических и/или манифестации латентных заболеваний (патология сердечно-сосудистой, мочевыводящей систем, сахарный диабет, нарушение функции надпочечников, щитовидной железы и др.). Риск перинатальной патологии возрастает при формировании осложнений беременности и родов 10.
Преждевременные роды остаются одной из важнейших проблем акушерства и неонатологии, так как недоношенные дети определяют уровень перинатальной заболеваемости и смертности среди новорожденных [12, 13]. Современные перинатальные технологии позволяют выхаживать недоношенных детей с очень низкой и экстремально низкой массой тела при рождении, но недоношенность рассматривается не только как маркер неблагополучного внутриутробного созревания, но и последующего постнатального развития ребенка. Снижение неонатальной смертности происходит также вследствие совершенствования акушерских оперативных технологий. Расширение показаний к проведению операции кесарева сечения (КС) позволило снизить летальность новорожденных от внутричерепной родовой травмы, синдрома респираторных расстройств [14, 15]. Однако применяемые современные методики не могут полностью нивелировать последствия воздействия патологических факторов анте- и интранатального периодов на детей из группы высокого риска (недоношенные; рожденные оперативным путем; дети, перенесшие гипоксию-ишемию и т. д.) 18. В связи с этим тенденции к детальному обследованию беременных и выявлению факторов риска имеют важнейшее значение для профилактики осложнений беременности, родов и перинатальной патологии. Целью нашего исследования была оценка значимости факторов риска анте- и интранатального периодов в развитии нарушений ранней адаптации у новорожденных из группы высокого риска по развитию патологии перинатального периода.
Материалы и методы исследования
Проведено комплексное клинико-инструментальное исследование состояния здоровья 690 новорожденных группы риска в периоде ранней адаптации, распределенных в следующие группы. Основная группа: 290 детей, рожденных путем КС и перенесших церебральную гипоксию-ишемию (ЦИ). Выделены две подгруппы: первая — доношенные новорожденные со сроком гестации 38-41 неделя (39,3 ± 0,21) и массой при рождении 2750-4550 г (3358,7 ± 41,75); вторая — недоношенные 30-37 недель (35,8 ± 0,41) и массой при рождении 860-3560 г (2169,1 ± 46,11). В группу сравнения 1 включено 150 доношенных детей после КС без клинических признаков ЦИ в периоде ранней адаптации, рожденных в сроке беременности 38-40 недель (39,1 ± 0,17), с массой при рождении 2388-4450 г (3398,6 ± 144,72). Группа сравнения 2: 250 новорожденных от естественных родов с перенесенной ЦИ и подразделением на две подгруппы: первая — доношенные со сроком гестации 38-41 неделя (39,7 ± 0,23) и массой при рождении 2330-4790 г (3371,6 ± 144,36); вторая — недоношенные, рожденные в 30-37 недель (35,1 ± 0,33) с массой 700-3210 г (2136,7 ± 54,19). Критерии исключения из исследования: дети с врожденными аномалиями развития, инфекционными процессами, гемолитической и геморрагической болезнью, синдромальной формой патологии. Контрольная группа — 57 новорожденных от физиологичных беременности и родов при сроке 39-40 недель (39,5 ± 0,16), с массой при рождении 3000-4110 г (3427,3 ± 160,52), оценкой по Апгар не менее 8/8 баллов. Для изучения зависимости нарушения процессов ранней адаптации новорожденных группы повышенного риска от характера и сочетанного воздействия патологических факторов анте- и интранатального периодов проводился анализ стационарных карт матерей в исследуемых группах с оценкой акушерско-гинекологического анамнеза, соматического статуса, изучался спектр показаний к проведению родоразрешения путем КС.
Статистическая обработка полученных данных проводилась с помощью пакета прикладных программ Statistica. Количественные показатели анализировались по критерию Стьюдента с расчетом средней арифметической (М), стандартной ошибки среднего (± m) и соответствующему уровню достоверности; для сравнения качественных переменных использован критерий χ². Корреляционный анализ проводился с использованием коэффициента ранговой корреляции Спирмена.
Результаты и обсуждение
К факторам риска развития осложненной беременности относят воспалительные заболевания внутренних половых органов, в том числе возникшие после родов и абортов [10, 12, 19]. Следствием перенесенного воспалительного процесса могут быть морфологические и функциональные изменения в маточных трубах, нарушающие транспорт и имплантацию оплодотворенной яйцеклетки. Изменения в самом эндометрии тормозят его трансформацию, необходимую для нормальной имплантации и последующего развития зародыша, провоцируя риск выкидыша, неразвивающейся беременности. Имплантация в нижнем отделе матки формирует угрозу предлежания плаценты, преждевременной ее отслойки с высоким риском развития кровотечений и вторичным нарушением гемодинамики в системе мать-плацента-плод, что, несомненно, значительно ухудшает состояние плода и новорожденного [19, 20]. В нашем исследовании у матерей, чьи дети перенесли ЦИ, значительно чаще выявлялись хронические и/или острые воспалительные заболевания женской половой сферы (у 61 (21%) и 57 (23%) в основной группе и группе сравнения 2 по отношению к 5 (9%) случаям в контроле, χ² = 3,89, р = 0,049 и χ² = 4,83, р = 0,02 соответственно). Частота патологии, связанной с невынашиванием беременности (внематочная беременность, неразвивающаяся беременность), в исследуемых группах была сопоставимой (2-9%, p > 0,05). Обращала на себя внимание достаточно высокая представленность повторных операций КС в соответствующих группах сравнения (11-32%). Кесарево сечение, а также другие операции на матке предрасполагают к формированию ее несостоятельности в дальнейшем (дистрофические процессы, фиброз, угроза спонтанного разрыва не только в родах, но и во время беременности и др.) [14, 19, 20]. Таким образом, женщин, перенесших оперативные вмешательства на матке, можно отнести к высокой группе риска по развитию и повторяемости акушерской патологии.
Отягощенный акушерско-гинекологический анамнез и соматическое неблагополучие женщин способствовали развитию различных осложнений беременности, особенно в основной группе, что имело в большинстве случаев значительные отличия от женщин контрольной группы (табл. 2). Частота формирования гестоза (в 52-58% случаях) и анемии (у 37-42% женщин) различной степени выраженности значительно отличала женщин групп сравнения от контрольной группы (р ≤ 0,05). Угроза прерывания беременности возникала у 28% женщин основной группы, а в группах сравнения в 21-23% случаев, достигая уровня статистической значимости с контролем только в основной группе. На фоне выявленных нарушений течения беременности более половины (54%) женщин основной группы имели хроническую маточно-плацентарную и плодово-плацентарную недостаточность, а в группах сравнения данная патология формировалась у 26-30% беременных. Плацентарная недостаточность, характеризующаяся нарушениями структуры и функций плаценты, ухудшает условия питания, газообмена и выведения продуктов обмена веществ из организма плода, в результате чего возникает гипоксия, задержка развития плода, склонность к асфиксии при рождении, родовым травмам и заболеваниям в периоде новорожденности [3, 6, 9, 15, 16].
Совокупность патологических факторов (ОАГА, тяжесть экстрагенитальной патологии и осложненное течение беременности) формировало у ряда беременных показания к родоразрешению путем кесарева сечения (рис. 3). Наиболее часто оперативные роды проводились при повторном КС (18-32%), дородовом излитии околоплодных вод и развитии слабости родовой деятельности (9-12%), начавшейся асфиксии плода (6-17%), преэклампсии тяжелой степени (6-14%), тяжелой соматической патологии женщин (13%). При этом сочетанные показания преобладали у женщин основной группы (у 119 (41%) против 49 (27%), χ² = 6,68, р = 0,010), особенно при недоношенной беременности (у 94 (55%) женщин; χ² = 23,18, р = 0,000). Следует отметить, что в группах сравнения по ряду показаний к проведению КС выявлены различия, не достигавшие статистического уровня значимости (рис. 3). При оценке значимости выявленных факторов риска в формировании нарушений постнатальной адаптации новорожденных, в том числе формировании церебральной ишемии, была установлена корреляция с рядом факторов антенатального периода (медабортами (r = 734, р = 0,000); воспалительными заболеваниями женской половой сферы (r = 855, р = 0,000); возрастом первородящей (rs = 0,674, р = 0,001); хронической фетоплацентарной недостаточностью (ХФПН), особенно у детей, рожденных путем КС (rs = 0,974, р = 0,000); угрозой прерывания беременности (rs = 0,812, р = 0,000) в основной группе); в интранатальном периоде при родоразрешении путем КС с ухудшением состояния женщин по экстрагенитальной патологии и преэклампсией тяжелой степени (rs = 0,718 и rs = 0,762, р = 0,001), с хронической гипоксией и/или острой асфиксией плода (rs = 0,823, р = 0,000), с начавшимся кровотечением (rs = 0,689, р = 0,001), задержкой развития плода (rs = 0,636, р = 0,002). Таким образом, при анализе анте- и интранатального периодов развития детей из группы высокого риска выявлено патологическое влияние множественных материнских факторов, в большинстве случаев сочетанных, которые играли важную роль в формировании дезадаптации новорожденных.
Выводы
Нарушение ранней постнатальной адаптации новорожденных из группы высокого риска связано с патологическим влиянием различных факторов анте- и интранатального периодов развития плода. Наибольшую значимость приобретает сочетанное влияние отягощенного акушерско-гинекологического анамнеза (медаборты, невынашиваемость беременности, воспалительные заболевания женской половой сферы, повторные операции кесарева сечения); осложненное течение беременности с развитием гестозов, анемии, угрозы преждевременных родов, нарушением маточно-плацентарного и плодово-плацентарного кровотока; соматические заболевания матерей. Тяжесть состояния беременных женщин способствует, прежде всего, нарушению родовой деятельности, возникновению угрожающих состояний плода (острой гипоксии/асфиксии) и т. д., приводящих к невозможности родоразрешения естественным путем, формированию показаний для проведения операции кесарева сечения. Изучение причин и оценка значимости факторов риска в развитии перинатальной патологии создает возможность своевременной коррекции материнских факторов, организации эффективной медицинской помощи новорожденным высокого риска, способствуя повышению качества жизни детей в последующие возрастные периоды, что носит важный медико-социальный характер.
Литература
- Володин H. H. Перинатальная медицина: проблемы, пути и условия их решения // Педиатрия. 2004. № 5. С. 18-23.
- Пономаренко И. И., Коновалова Т. М. Традиции и инновации в охране здоровья детей // Здравоохранение Российской Федерации. 2013. № 5. С. 13-16.
- Медведев М. И., Дегтярева М. Г., Горбунов А. В. и др. Последствия перинатальных гипоксически-ишемических поражений головного мозга у доношенных новорожденных: диагностика и принципы восстановительного лечения // Педиатрия. 2011. Т. 90, № 1. С. 66-70.
- Тарасова А. А., Белова Ю. Н., Острейков И. Ф., Подкопаев В. Н. Состояние сердца у новорожденных детей с постгипоксической ишемией миокарда на фоне кардиотропной терапии // Российский вестник перинатологии и педиатрии. 2013. Т. 58, № 2. С. 24-29.
- Иванов Д. О., Шабалов Н. П., Петренко Ю. В. Гипогликемия новорожденных // Акушерство и гинекология. 2014. № 5. С. 19-26.
- Kaijser M. Perinatal Risk Factors of Ishemic Disease: Disentagling Roles Birth Weight and preterm Birth // Circulation. 2008. № 117. P. 405-410.
- Гурьев Д. Л., Охапкин М. Б., Карпов Н. Ю., Блинов Д. В. Течение и исходы беременности, осложненной преэклампсией, в зависимости от типа центральной материнской гемодинамики // Акушерство и гинекология. 2011. № 7-2. С. 14-19.
- Аржанова О. Н., Капустин Р. В., Комаров Е. К. и др. Патогенетические механизмы развития акушерских осложнений при гестационном сахарном диабете // Журнал акушерства и женских болезней. 2011. № 5. С. 3-10.
- Бушуева Э. В., Денисова Т. Г., Герасимова Л. И. и др. Факторы риска рождения детей с задержкой внутриутробного развития // Саратовский научно-медицинский журнал. 2010. Т. 6, № 3. С. 528-530.
- Сухорукова О. И. Профилактика преждевременных родов // Акушерство и гинекология. 2012. № 7. С. 21-25.
- Краева О. А., Башмакова Н. В., Винокурова Е. А. Исходы беременности у женщин с преодоленным невынашиванием // Российский вестник перинатологии и педиатрии. 2013. Т. 58, № 1. С. 8-12.
- Лебедева О. В., Белопасов В. В. Факторы риска и особенности развития перинатальных повреждений головного мозга у новорожденных с экстремально низкой массой тела // Международный неврологический журнал. 2010. Т. 7, № 37. С. 5-8.
- Виноградова И. В., Краснов М. В., Иванова Н. Н. Опыт ведения глубоко недоношенных детей с персистирующим фетальным кровообращением // Практическая медицина. 2011. Т. 54, № 6. С. 69-71.
- Краснопольский В. И., Логутова Л. С., Петрухин В. А. Место абдоминального и влагалищного оперативного родоразрешения в современном акушерстве. Реальность и перспективы // Акушерство и гинекология. 2012. № 1. С. 4-8.
- Jain L., Dudell G. Respiratory transition in infants delivered by cesarean section // Seminars in perinatology. 2006. Vol. 30, № 5. Р. 296-304.
- Кулаков В. И., Барашнев Ю. И. Новорожденные высокого риска М.: ГЭОТАР-Медиа. 2006. 528 с.
- Szymankiewicz M., Matuszczak-Wleklak M., Vidyasagar D. Retrospective diagnosis of hypoxic myocardial injury in premature newborns // J. Perinat. Med. 2006. V. 34, № 3. Р. 220-225.
- Signore C., Klebanoff M. Neonatal morbidity and mortality after elective cesarean delivery // Clin Perinatol. 2008. Vol. 35, № 2. Р. 361-371.
- Савельева Г. М., Шалина Р. И., Сичинава Л. Г. и др. Акушерство. М.: ГЭОТАР-Медиа, 2010. 656 с.
- Шифман Е. М. Преэклампсия, эклампсия, HELLP-синдром. Петрозаводск, 2002. С. 142-158.
Т. С. Тумаева* , 1 , кандидат медицинских наук
Л. А. Балыкова**, доктор медицинских наук, профессор
О. А. Пиксайкина**
* ГБУЗ РМ МРКПЦ, Саранск
** ФГБОУ ВПО МГУ им. Н. П. Огарева, Саранск
Роль импринтинга генов при внутриутробной задержке роста плода
1ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва 2ФГБУ Эндокринологический научный центр Минздрава России, Москва 3Первый МГМУ им. И.М. Сеченова, кафедра эндокринологии и диабетологии (педиатрический факультет), Москва, Россия
Цель исследования. Провести анализ литературных данных о влиянии эпигенетических изменений, в частности геномного импринтинга, на развитие и функционирование плаценты и регуляцию роста и развития плода.
Материал и методы. Проведен поиск в базе данных NSBI Pub Med за последние 30 лет о влияние эпигенетических изменений на регуляцию роста плода.
Результаты. Описаны механизмы импринтинга генов, отличительной чертой, которых является их экспрессия только из одной аллели; она может наследоваться как по отцовской, так и по материнской линии.
Заключение. Предполагается, что механизм экспрессии может контролировать поток питательных веществ от матери к плоду, как увеличивая его, так и уменьшая. Такая дизрегуляция может приводить к нарушениям развития плода. Испытания репродуктивных технологий на животных показали, что изменения эпигенома зародыша на ранней стадии развития приводят к импринтингу, что может, как провоцировать, так и ограничивать внутриутробную задержку роста плода.
Эпигенетический механизм
Эпигенетический механизм относится как к наследственным, так и к потенциально обратимым механизмам генома, являясь фундаментальным аспектом генной регуляции ДНК. Существуют 2 типа данной регуляции в зависимости от действия на ДНК и хроматин: активирующие хроматин (усиливают генную экспрессию) и дезактивирующие (подавляют экспрессию). Метилирование нуклеотида с цитозином, комплементарным гуанину (ЦпГ-метилирование), и метилирование аденина (ЦпА-метилирование) являются единственными механизмами эпигенетического действия на ДНК. ЦпГ-метилирование генов-промоутеров и регуляторных элементов негативно влияют на генную экспрессию через выработку белковых репрессивных комплексов и специфических модификаций гистонов [1]. Синтезирование ковалентных модификаций к гистонам является более сложной формой эпигенетических процессов. Классифицируют данный процесс: по типу (метилирование, фосфорилирование, ацетилирование, а также убиквитинация), позиции (в том числе лизин 4, 9, 27 и 36) и числу замещений в нуклеотидах (моно-, ди- или триметилирование). Гистоновый код, отражающий последовательность гистоновых модификаций, включая тип, позицию и число, может находиться как в активном, репрессированном, так и в бивалентном состоянии хроматина, что приводит к синтезу в спирали ДНК репрессорных протеиновых комплексов [2]. Эпигенетическая регуляция играет центральную роль в геномном импринтинге и по-разному ассоциирует между собой сочетания родительских генов для их экспрессии. Таким образом, геномный импринтинг осуществляется разнообразными эпигенетическими модификациями в материнских и отцовских хромосомах. Они предопределены уникальными структурами, которые устанавливают «зародышевую линию» развития плода на всех стадиях. Гены, наиболее часто подвергающиеся импринтингу, обнаруживаются обычно в кластерах и содержат, как правило, область контроля ЦпГ (ICR), устанавливающую характер импринтинга на участке цепи. Они являются особо важными регуляторными элементами, управляющим аллельной экспрессией генов [1].
Геномный импринтинг
Открытие геномного импринтинга произошло в результате исследований, целью которых было изучить причину присутствия партеногенеза у отдельных особей. При помощи серии экспериментов с пересадкой ядер в клетки мышей было обнаружено, что зиготы, сгенерированные из хромосом, взятых у обоих родителей (материнские и отцовские хромосомы), или только из отцовского материала, не выживали [3].
Внутриутробное развитие эмбрионов с материнским набором хромосом было ограничено, их плацента была бедна сосудами, а общая масса эмбриональных тканей была снижена. Однако при отцовском наборе хромосом наблюдали трофобластическую неоплазию с низкой долей эмбрионального компонента и патологически увеличенной плацентой, что продемонстрировало отсутствие эквивалентности между материнским и отцовским генетическим материалом, уникальность обоих компонентов и невозможность их взаимозаменяемости. Дальнейшие исследования данного феномена имеют свое начало от исследований мышей с однородительской дисомией. Мыши-носители гетерозиготной транслокации были скрещены друг с другом для тестирования некомплементарности отцовских аллелей. В результате была получена первая геномная карта мышей с обозначением участков хромосом 2, 8 и 17 [1]. Были выявлены места участков импринтинга генов: материнская специфичная экспрессия гена Igf2r и Н19 на 17-й хромосоме и отцовская специфичная экспрессия гена Igf2r на 7-й хромосоме [1, 4]. Обнаруженные гены дали ключ к пониманию механизмов, регулирующих геномный импринтинг.
Интересно, что плацентарные млекопитающие и злаковые растения имеют геномный импринтинг, в то время как у рептилий и птиц он отсутствует. Даже если имеется рудиментарная плацента, как у сумчатых, это является доказательством наличия плаценты у животного [5, 6]. Такая близкая корреляция между наличием импринтинга и наличием плаценты, органа-контролера потока питательных веществ от матери к плоду, привела к появлению гипотез об импринтинге как источнике эволюции генов. Самой общепринятой гипотезой является конфликт родительских генов, согласно которой импринтинг-гены облегчают поступление веществ от матери к плоду и усиливают рост в эмбриональном и постнатальном периоде [1]. «Конфликт» родительских генов между собой приводит к нормализации экспрессии плацентарных генов, что обеспечивает нормальный рост плода. Однако внешние факторы могут нарушить баланс и вести к развитию внутриутробной задержки роста плода (ВЗРП) или микросомии плода, или к макросомии плода («крупный плод»). Даже при наличии таких убедительных гипотез в силе остаются ключевые вопросы: какие механизмы регулируют дифференциальную экспрессию отцовских и материнских аллелей и какой физиологический эффект они о.
Дегтярева Е.И. , Григорян О.Р. , Волеводз Н.Н. , Андреева Е.Н. , Клименченко Н.И. , Мельниченко Г.А. , Дедов И.И. , Сухих Г.Т.
Эпигенетика и механизмы влияния задержки внутриутробного развития на нее
История развития эпигенетических подходов к доказательству влияния образа жизни на здоровье и болезни. Работы Дэвида Баркера в 80—90-х гг. XX века заложили основу программирования риска хронических заболеваний взрослых в критический период формирования организма [2]. Д. Баркер [3] показал, что неадекватное снабжение организма ребенка питательными веществами или кислородом формирует резистентность к инсулину [3]. По мнению D. Lawlor и соавт. [4], внутриутробные воздействия определяют риск развития ишемической болезни сердца (ИБС) у взрослых, который при обратной связи с массой тела при рождении опосредуется резистентностью к инсулину. Сегодня теория «Истоки развития здоровья и болезней» (Developmental Origins of Health and Disease, DOHaD) предполагает, что экспозиция в ранний период развития организма играет решающую роль в определении риска метаболических заболеваний у взрослых, что доказано в эпигенетических исследованиях в отношении метаболических нарушений, ожирения и хронических заболеваний [5—8]. Дисрегуляция miРНК вызывает изменения в структуре генов, контролирующих воспаление, липидный обмен, резистентность к инсулину и адипогенез [9]. Современные представления о детском ожирении как составной части метаболического синдрома базируются на многофакторности его происхождения и ключевой роли эпигенетики в передаче риска ожирения потомству за счет генетического наследования однонуклеотидных полиморфизмов в локусах адипокинов и их рецепторов и влияния микробиоты кишечника, участвующей в регуляции массы тела [10].
Эпигенетические механизмы программирования состояния здоровья потомства, обусловленные питанием матери во время зачатия и беременности. Питание матери во время зачатия ребенка и в период его раннего развития может эпигенетическим путем инициировать метаболические сдвиги у потомства, известные как «программирование питанием». Драматический рост распространенности аллергических заболеваний связывают с пищевым программированием специфически уязвимой в раннем возрасте иммунной системы. Глубокое понимание эпигенетики и других биологических процессов в раннем возрасте может привести к разработке диетических стратегий, обеспечивающих более устойчивое состояние именной системы в ранний период и снижающих бремя многих воспалительных заболеваний, а не только аллергии [11].
В опытах на животных показано, что сниженная калорийность питания матери эпигенетически индуцирует усиление возрастной непереносимости глюкозы у поросят [12]; добавка бетаина беременным свиньям увеличивает содержание холестерина в печени неонатальных поросят посредством эпигенетических правил метаболических генов холестерина [13]. Долгосрочное потребление высоких доз никотинамида (витамина РР) самками крыс, в том числе при беременности, может быть фактором риска метаболических аномалий у потомства, связанных с метилированием генов и инсулинорезистентностью, а фолиевой кислоты — увеличивает опухолевый генез молочной железы, но снижает риск колоректального рака и ряда врожденных дефектов сердца у потомства [14—16]. Введение 150 мг фолиевой кислоты в яйца улучшает рост бройлеров и укрепляет взаимосвязь между иммунной функцией и эпигенетической регуляцией иммунных генов путем изменения конформации хроматина и метилирования промотеров гистонов [17]. У людей эффект воздействия фолиевой кислоты на эпигенетическую регуляцию фосфоенолпируваткарбоксикиназы — ключевого фермента в образовании глюкозы из пировиноградной кислоты и гомеостаза глюкозы зависит от периода жизненного цикла и пола [18]. Материнский статус фолата, регулируемый диетическими и генетическими факторами на ранних стадиях беременности, предположительно может влиять на риск расстройств аутистического спектра у людей, однако данные об эпигенетическом воздействии пока ограниченны [19].
Таким образом, сердечно-сосудистая патология, ожирение, аутоиммунные проявления, сахарный диабет (СД) и предположительно аутизм эпигенетически связаны с образом жизни матери, пренатальным и постнатальным периодами, относимыми к критическим в отношении здоровья в будущем, и могут регулироваться такими пищевыми компонентами, как фолаты и фолиевая кислота.
Эпигенетические механизмы старения. Старение как совокупность изменений, постепенно увеличивающих вероятность смерти, с эпигенетической точки зрения характеризуется воспроизводимым в независимых выборках гипометилированием CpG-последовательностей [20]. Возрастные изменения эпигенетических меток могут приводить к снижению иммунной функции, что способствует увеличению заболеваемости пожилых людей, для поддержания здоровья которых здоровый образ жизни (ЗОЖ) на протяжении всей жизни, учитывая пожизненную эпигеномную регуляцию во врожденных иммунных клетках, в лимфоцитах Т- и В- под действием внутренних и внешних факторов, может быть самым эффективным способом профилактики заболеваний [21, 22].
Естественные возрастные изменения, приводящие к высококонкурентной экспрессии генов с явными последствиями для клеточной дифференциации и риском начала заболевания, играют несомненную роль в формировании болезней сердечно-сосудистой системы. Модифицируемые и немодифицируемые факторы риска эпигенетически изменяют экспрессию генов в возрасте, ускоряя эпигенетические «часы», прежде избавлявшие человека от сердечно-сосудистых заболеваний. Ускоренное сосудистое старение и, как следствие, снижение возрастного порога заболевания, обусловленное эпигенетическим возрастом, не совпадающим с хронологическим, вызывает серьезную озабоченность. Вместе с тем адекватное питание и физическая активность оказывают синергическое воздействие на здоровье сердечно-сосудистой системы, представляя собой мощную потенциальную эпигенетическую точку вмешательства с целью коррекции управленческих стратегий в отношении сердечно-сосудистой системы, направленных на «хорошее старение» [23]. Детальное изучение дисрегулированных эпигенетических механизмов, связанных с СД и его сосудистыми осложнениями (кардиомиопатия, нефропатия, ретинопатия, синдром диабетической стопы), может раскрыть столь необходимые новые лекарственные мишени для профилактики сосудистых заболеваний в целом [24, 25].
Одним из примеров профилактики возрастных изменений может служить длительный прием фолиевой кислоты пожилыми здоровыми людьми, вызвавший глобальное метилирование ДНК, причем, несмотря на препозицию связи нейродеструктивных процессов с аберрантным метилированием ДНК в лейкоцитах, когнитивные способности пожилых только улучшились [26]. Однако не только внешние воздействия, но и генетические факторы влияют на эпигеномные изменения. Так, в лонгитюдном исследовании психических расстройств у пожилых жителей Австралии (n=1863) показано, что метилирование и модификация связи между депрессией и метилированием ДНК находятся под влиянием генетических вариантов ангиотензинпревращающего фермента, играющего ключевую роль в регуляции гипоталамо-гипофизарно-надпочечниковой системы [27].
Из 500 тыс. локусов, метилирование которых связано с риском смерти по причине рака, отобраны 10 участков CpG, строго коррелирующих с риском смерти [28]. Метилирование ДНК клеток крови по локусам AHRR, 6p21.33 и F2RL3 является прогностическим для развития рака легких и может быть использовано для идентификации групп риска при скрининге [29]. Идентифицированные локусы mQTLs, оказывающие влияние на метилирование участков CpG, имеют особое значение при их использовании в качестве маркеров метилирования ДНК в связанных с курением сравнительных популяционных исследованиях. H. Brenner [30] отмечает: «Неблагоприятный статус метилирования может измениться после прекращения курения, и риск смертности может значительно снизиться… Профилактика или вмешательство в состояния, связанные с курением (ДНК-метилирование), могут эффективно способствовать предупреждению преждевременной смерти, учитывая обратимость индуцированных курением метиломных аберраций». В эпигенетических исследованиях пациентов с колоректальным раком (n=1836) выявлены специфические изменения miРНК, связанные с опухолевыми проявлениями и косвенно определяющие выживаемость пациентов [31].
Таким образом, возрастные изменения связаны с активацией генов гипометилированием и иными эпигенетическими и генетическими модуляциями, что обусловливает снижение активности иммунной системы, сердечно-сосудистые болезни, СД и его сосудистые осложнения, депрессию и рак. Интервенции посредством изменения образа жизни могут снизить риск смерти и продлить здоровую жизнь пожилых людей благодаря эпигенетическим механизмам, обеспечивая популярную концепцию «хорошего старения». «Связь между диетой и эпигенетическими изменениями, с одной стороны, и между эпигенетическими изменениями и раком — с другой, подтверждается как обсервационными исследованиями на людях, так и опытами на животных. Однако вывод о том, что диета напрямую связана с эпигенетическими изменениями и что эти эпигенетические изменения непосредственно увеличивают или уменьшают риск развития рака человека, гораздо менее определен» [32].
Выявленные к 2011 г. эпигенетические механизмы, обеспечивающие влияние элементов образа жизни и среды на здоровье. К 2011 г. стало известно, что потребление фолатов, эпигаллокатехин-3-галлатов зеленого чая, селена, а также физическая активность, табакокурение, материнская диета и табакокурение матери во время беременности, вредное потребление алкоголя, воздействие поллютантов окружающей среды (мышьяк, хром, аэрозоли, бензол, полициклическихе ароматические углеводороды и стойкие органические соединения), а также старение, психологический стресс и сменная работа оказывают влияние на экспрессию генов путем изменения метилирования ДНК. Потребление полифенольных соединений и селена с пищей, а также физическая активность ведут к ковалентной модификации (ацетилированию) гистоновых белков. Физическая активность, курение сигарет и внутриутробные условия, в частности связанные с курением табака матерью во время гестации, регулируется экспрессией miРНК путем метилирования ДНК в miРНК локусах [33].
Эпигенетические механизмы воздействия питания и нутриентов на современном этапе. За прошедшие 7 лет многие эпигенетические механизмы были уточнены и расширены, в том числе в отношении питания и приема нутриентов. Так, показано, что куркумин изменяет эпигенетические маркеры, подавляя активацию ядерного транскрипционного фактора каппа-би В-клеток (NF-κB), тем самым уменьшая воспалительные реакции. Эпигаллокатехин гидрат также может снижать риск воспаления, сердечной травмы и окислительного повреждения, вызванного поллютантами окружающей среды, посредством эпигенетической регуляции генов провоспалительных мишеней NF-κB [34]. Обладающие антиоксидантной активностью полифенолы, содержащие катехины, подавляют активность ферментов и эпигенетически активируют «молчащие» гены. Некоторые нутриенты, включая фолиевую кислоту, кобаламин, рибофлавин, пиридоксин и метионин, играют решающую роль в метаболизме 1-углерода, непосредственно воздействуя на S-аденозил-L-метионин. Соевые полифенолы блокируют ДНК-метилтрансферазы и гистондеацетилазы, обеспечивая обратное аберрантное метилирование локусов CpG. Сульфорафан, обнаруженный в брокколи, нормализует метилирование ДНК и активирует экспрессию miR-140, которая в свою очередь подавляет SOX9 и ALDH1 и уменьшает рост опухолей [35]. В четырех европейских когортах (n=3096) только среди потребителей чая, но не кофе, женского пола выявлено два дифференциально метилированных CpG-сайта в составе генов DNAJC16 и TTC17, участвующих в опухолевых процессах и метаболизме эстрогенов [36]. Токоферолы — класс химических соединений, представляющих собой метилированные фенолы, многие из которых объединены названием «витамин E», — изменяя профили miРНК у пациентов, инфицированных вирусом гепатита B, проявляют антивирусную активность [37].
Эпигенетические механизмы воздействия ЗОЖ как интегрального показателя на здоровье. ЗОЖ в совокупности его элементов также может играть определенную роль в регуляции метилирования ДНК. Так, выявлены высокие уровни индекса глобального метилирования ДНК и гена TNF-α противовоспалительного цитокина в белых клетках крови в группе здоровых молодых людей (n=156) со средней нормальной массой тела, соблюдающих ЗОЖ, против контрольной группы с метаболическими нарушениями. Среди элементов ЗОЖ 1-й группы выявлены потребление рационального количества энергии и микроэлементов с пищей, большее число занимающихся спортом лиц и меньшее число курящих [38]. С другой стороны, пациенты с СД 1-го типа (Чили) без осложнений относительно контрольной группы без СД показали достоверно более высокий уровень метилирования промотора гена TNF-α [39].
Функциональная значимость эпигенетических механизмов как интерфейса между модификациями образа жизни и фенотипическими изменениями подчеркивается обширным перепрограммированием эпигенома диетой и физическими упражнениями. У мышей физические нагрузки и двигательная активность благодаря их защитным эффектам на фоне питания фастфудом, для которого характерно высокое содержание жиров, сахара и соли, предотвращали вызванное фастфудом гиперметилирование ДНК в клетках печени, особенно у промоторов и энхансеров. Вместе с тем ослабление гипометилирования в определенных участках ДНК наблюдалось только частично. Без физической нагрузки наблюдалось тотальное гиперметилирование и значительное увеличение специфических для печени энхансеров, что предполагает частичную потерю идентичности гепатоцитов, а гиперметилирование множества генных промоторов было связано с ингибированием развития ткани и промотированием канцерогенных процессов [40]. Коррелирующие со снижением массы тела изменения в эпигенетических модификациях 12 геномных локусов, из которых два расположены вблизи ассоциированных с потерей массы тела генов RUNX3 и NAMPT, выявлены у женщин 55—70 лет без инвалидности (n=20) на протяжении 6 мес, участвовавших в программе группового санитарного просвещения по вопросам значимости отказа от сидячего образа жизни для здоровья (9 занятий по 2 ч), против контрольной группы (6 занятий иной тематики по 1 ч). В виде проекта авторы предложили потенциальный эпигенетический предиктор снижения массы тела на основе базового метилирования ДНК в 5 CpG-сайтах [41].
Эпигенетические механизмы повреждающего воздействия экспозиции мелкодисперсным аэрозолем. Эпигенетические подтверждения вредного воздействия найдены в отношении вдыхания мелкодисперсных аэрозолей (взвешенные частицы), которые ВОЗ в 2005 г. отнесла к стохастическим факторам, не имеющим порога воздействия. Показано, что экспонирование аэрозолем с размером частиц не более 10 мкм (РМ10) повышает активность гистонацетилтрансферазы, катализирующей модификацию гистонов, и уровень ацетилированного гистона типа Н4 и таким образом способствует высвобождению воспалительных цитокинов [42]. Школьники (n=900) с воспалением дыхательных путей даже при кратковременном вдыхании самой мелкодисперсной пыли с размером частиц до 2,5 мкм (PM2,5) и наиболее опасной ввиду легкого проникновения сквозь биологические барьеры фракции аэрозолей проявили большую генетическую и эпигенетическую восприимчивость к этому типу аэрозолей [43]. РМ2,5 при 2-часовой экспозиции в концентрации 250 мг/м 3 индуцирует метилирование в генах, участвующих в метаболизме митохондриальной энергии реакций окисления, снижаемое под действием витаминов группы В в составе аэрозоля, что позволяет использовать данный метод для индивидуальной профилактики вредного воздействия аэрозолей в промышленных районах с частыми пиками выбросов PM2,5 [44].
Заключение
В настоящее время становится очевидным, что, несмотря на необходимость уточнения многих эпигенетических механизмов воздействия внешних и поведенческих факторов, эпигенетика обеспечивает профилактическую медицину и гигиену не только информацией о возможных эпигенетических точках вмешательства ЗОЖ в широком понимании этого термина, но и молекулярной доказательной базой профилактических мероприятий. Возможность эффективного управления здоровьем через эпигенетические механизмы в любой период жизни человека отражено в концепции развития здоровья на протяжении всего жизненного цикла (Life Сourse Health Development — LCHD), разработанной под руководством Neal Halfon, в соответствии с которой здоровье представляет собой динамический процесс, начинающийся до зачатия и продолжающийся на протяжении всей жизни, и должно развиваться (укрепляться) во всех периодах жизненного цикла человека, поскольку негативные изменения в состоянии здоровья обратимы, их можно скорректировать даже в старости. Хотя основные процессы развития человека генетически запрограммированы, экспрессия генов модифицируется предыдущей и текущей средой и поведением [45]. В 2014 г. N. Halfon и соавт. [46] ставят вопрос о необходимости реформы общественного здоровья на основе теории LCHD и вносят предложения по внедрению инноваций, которые могли бы ускорить перевод принципов развития здоровья в практику менеджмента здоровья на протяжении всей жизни, которые соответствуют прецизионной (персонифицированной) медицине. В руководстве «Handbook of Life Course Health Development» [47] обобщается и анализируется растущая база знаний о возможностях и перспективах развитии здоровья на протяжении всей жизни.
Читайте также:
