Механизм генерации силы при полимеризации актина
Добавил пользователь Skiper Обновлено: 22.01.2026
Важным свойством актина является его способность к полимеризации с образованием линейного полимера - F-актина ( Bershadsky A.D., Vasiliev J.M., 198 , Korn E.D., Carlier M.-F., 1987 ). In vitro мономерный актин может существовать в растворе с низкой ионной силой. Полимеризация индуцируется добавлением 1 mM кальция или магния или при повышении ионной силы за счет добавления 100 mM KCl ( Хайтлина С.Ю., 1985 , Pollard T.D., Craig S.W., 1982 ). Способность актина полимеризоваться in vitro позволяет детально изучить условия этого процесса.
Процесс полимеризации актина включает в себя две стадии: нуклеацию и элонгацию ( Хайтлина С.Ю., 1985 , Bershadsky A.D., Vasiliev J.M., 198 ).
На первой, более медленной стадии - нуклеации, происходит объединение небольшого числа мономеров в агрегат, называемый затравкой или зародышем. В данном случае затравками обычно служат три- или тетрамеры актина ( Barden I.A. et al., 1982 ) ( рис.1-22fr2 )
Вторая, более быстрая стадия - элонгация, заключается в присоединении новых мономеров к образовавшимся затравкам.
Полимер актина является полярной структурой, благодаря упорядоченному распределению асимметричных единиц. Два противоположных конца актинового филамента различаются по скорости присоединения к ним новых субъединиц ( Pollard T.D., Craig S.W., 1982 ) ( рис.1-20 )
Структурно различить концы актинового филамента можно с помощью субфрагментов мышечного миозина , содержащих головку миозиновой молекулы ( Ishikawa H. et al.,1969 ). Декорированный фрагментами миозина актиновый филамент как бы усеян наконечниками стрел ( рис.1-2 ) В зависимости от направления этих стрел один конец называется "острым", а другой - "оперенным". Скорость элонгации на оперенном конце актинового филамента оказалась существенно выше скорости элонгации на остром конце ( Pollard T.D., Craig S.W., 1982 ).
Полимеризация актина in vitro обычно инициируется добавлением нейтральных солей. Степень полимеризации максимальна при концентрации KCl или NaCl 0,05 - 0,15 М, минимальная концентрация KCl, достаточная для полимеризации, равна 0,015 - 0,018 М.
Эффективность катионов при полимеризации усиливается в ряду Rb+ - K+ - Na+ - Li+ - Mg++ - Ca++ . Высокие концентрации анионов (например, CNS- или I-) вызывают деполимеризацию актина. Полимеризация происходит также при понижении рН или в присутствии поликатионов, таких, как полилизин или спермин и спермидин. Все эти данные указывают на то, что для полимеризации необходима нейтрализация отрицательного заряда молекулы актина.
Однако ряд фактов противоречит "электростатической" теории полимеризации. Так, миллимолярные концентрации Са++ стимулируют полимеризацию, в то время как микромолярные ее ингибируют. Вследствие этого актин может быть заполимеризован как 1 - 2 мМ хлоридом кальция, так и 0,2 - 2,0 мМ ЭГТА . При низкой (недостаточной для полимерзации) концентрации нейтральных солей полимеризация актина индуцируется введением этанола, глицерина, полиэтиленгликоля и его производных. По-видимому, для полимеризации существенно определенное конформационное состояние мономера, которое может быть индуцировано нейтрализацией заряда молекулы или с помощью других воздействий. Полимеризация начинается при концентрации актина выше критической и сопровождается гидролизом АТР . Реакция повторно обратима изменением концентрации соли, однако ресинтез АТР при деполимеризации не наблюдается.
Механизм генерации силы при полимеризации актина
Биологическая подвижность и полимеризация актина (Клячко Н.Л. , 2000), БИОЛОГИЯ
Дана новая информация о механизме полимеризации актина, лежащей в основе многих проявлений биологической подвижности. Рассмотрен путь передачи внеклеточного сигнала на полимеризующийся актин, включающий G-белки, WASP и Arp2/3-комплекс. Приведены примеры эксплуатации подвижными патогенными бактериями механизма полимеризации актина в клетках хозяина.
И ПОЛИМЕРИЗАЦИЯ АКТИНА
Институт физиологии растений им. К.А. Тимирязева Российской академии наук, Москва
Полимеризация актина важна для многих процессов в клетке, она подвержена строгой пространственной и временной регуляции. Актиновые микрофиламенты вместе с микротрубочками и промежуточными филаментами образуют динамичную сеть в цитоплазме клеток, так называемый цитоскелет, который не только определяет форму клетки и пространственную организацию ее компонентов, но и лежит в основе разнообразных типов внутриклеточной и клеточной подвижности.
Из статей, опубликованных ранее в "Соросовском Образовательном Журнале", можно узнать об общей организации цитоскелета, его составе, основных формах движения клеток животных и работе молекулярных моторов, то есть молекул, умеющих превращать химическую энергию гидролиза АТФ в механическую работу при сокращении мышц, перемещении органелл и т.п. 2. Одним из примеров такого моторного белка, участвующего в движении по нитям полимерного актина, является миозин. Взаимодействие актина и миозина приводит к сокращению мышц. Оно также лежит в основе перемещения органелл и молекул вдоль нитей актина, который в данном случае играет роль рельсов для перемещения, в то время как моторный белок служит паровозом.
Однако некоторые формы движения осуществляются без участия специализированных моторов: они основаны на процессе полимеризации актина. Само по себе быстрое удлинение нитей актина приводит к возникновению движущей силы в направлении роста этих нитей. Быстрая полимеризация актина происходит, например, при перемещении клеток фибробластов и некоторых низших грибов с помощью специализированных выростов - псевдоподий в сторону привлекательного для них сигнала или в направлении от отталкивающего сигнала (положительный и отрицательный таксис).
До недавнего времени механизм быстрой локальной полимеризации актина в клетках оставался неясным. Еще не так давно Ю.М. Васильев писал о полимеризации актина в местах выбрасывания псевдоподий подвижными клетками животных: "Вероятно, под мембраной в этих местах концентрируются какие-то белки, вызывающие полимеризацию новых микрофиламентов, но пока природу этих белков мы еще точно не знаем" [1, с. 39]. В последние годы сделано несколько открытий, позволивших узнать больше о таких белках и заполнить брешь в цепи событий, происходящих на пути от внеклеточного сигнала до конечного результата, а именно движения. Описанию этих новых фактов и посвящена данная статья.
НОВОЕ О ПОЛИМЕРИЗАЦИИ АКТИНА
Актин: мономеры и полимеры
Актин присутствует в клетке как в форме мономерного белка с молекулярным весом 42 кД, так и в виде длинных нитей и их пучков, связанных с другими элементами цитоскелета и мембранами. Мономеры актина имеют грушевидную форму, и при их полимеризации возникает спирально закрученная полярная нить с различающимися концами: заостренным (минус) и оперенным (плюс) концом (рис. 1). Такие названия появились в связи с тем, что при взаимодействии актиновых нитей с фрагментами молекулы моторного белка миозина образуется комплекс, имеющий под электронным микроскопом стреловидную форму. При этом острие стрелы указывает на заостренный конец, а ее оперение обращено в сторону противоположного конца филамента.
Полимеризация актина происходит в две стадии. Первая стадия носит название "нуклеация", то есть создание ядра (nucleus) или затравки из первых трех мономеров актина. Димер (комплекс двух мономеров) является нестабильной структурой и легко разрушается. Именно нуклеация определяет общую скорость полимеризации. Вторая стадия, удлинение нити, протекает легче, с большей скоростью.
В пробирке мономерный актин может присоединяться и диссоциировать с обоих концов нити, но присоединение происходит быстрее к плюс-концу. Процесс непрерывного присоединения мономеров к оперенному (плюс) концу и их диссоциации с заостренного (минус) конца, то есть непрерывный круговорот мономеров (от англ. treadmilling - бесконечная, монотонная механическая работа) (см. рис. 1).
В живой клетке процесс полимеризации актина может быть не похож на treadmilling, то есть на круговорот мономеров в пробирке, поскольку полярные концы актинового филамента могут быть несвободными. В клетке присутствуют десятки так называемых актинсвязывающихся белков, которые сильно влияют на процесс полимеризации актина. Некоторые из них могут блокировать активно растущий оперенный плюс-конец, так называемые кэп-белки (от англ. cap - шапочка), прекращая таким образом полимеризацию уже существующих нитей и освобождая мономерный актин для построения новых нитей. Другие белки могут разрезать нити актина, формируя тем самым новые фрагменты с заостренными и оперенными концами. Существуют белки, связывающие мономеры актина и таким образом делающие их недоступными для полимеризации (например, профилин), белки, деполимеризующие актин, и т.п.
Актин - крайне консервативный белок, состоящий практически из одинаковых аминокислот у всех исследованных организмов. Однако помимо такого консервативного классического актина в клетках имеется много так называемых актиноподобных белков (actin-related proteins, Аrp), гомология которых с актином составляет всего от 30 до 60%. Различают несколько подсемейств таких белков: Аrp1, Аrp2, Аrp3 и др. Области гомологии этих белков с актином расположены главным образом в центральной части белковой глобулы. Поэтому долгое время считали, что эти белки неспособны к полимеризации, а также и совместной полимеризации с актином. Однако в последнее время становится ясно, что такое утверждение не вполне верно. Так, было обнаружено, что Аrp1 (центрактин) может полимеризоваться вместе с актином в составе так называемого динактинового комплекса, участвующего в перемещении органелл по микротрубочкам. Аrp2 и Аrp3 поодиночке действительно не взаимодействуют с актином. Однако недавно было показано, что эти два белка входят в состав так называемого Arp2/3-комплекса, содержащего помимо Аrp2 и Аrp3 белков еще пять или шесть (в зависимости от организма) субъединиц, не имеющих гомологии ни с одним из белков в компьютерных базах данных (рис. 2, а). Этот сложно устроенный комплекс был впервые выделен из амебы Acanthamoeba castellanii. Впоследствии было показано, что Arp2/3-комплекс очень консервативен и присутствует у всех исследованных эукариотных организмов от дрожжей до человека (для растений таких данных пока нет). В живых клетках этот комплекс накапливается в местах, где происходит быстрая полимеризация актина, например в разного рода псевдоподиях, в кортикальном слое цитоплазмы у дрожжей, в хвосте подвижных патогенных бактерий.
Оказалось, что Arp2/3-комплекс имеет повышенное сродство к минус-концам актиновых филаментов, а именно гетеродимер Arp2-Arp3 может служить матрицей, на которой происходит образование новых актиновых нитей (нуклеация) (рис. 2, а). Кроме того, комплекс может присоединяться к боковым сторонам нитей и таким образом обеспечивать их ветвление (рис. 2, б ). Интересно, что боковые нити актина отходят от основной нити строго под углом 70?, образуя жесткую сеть. Быстро растущие плюс-концы нитей актина обращены в сторону периферии клеток, например к мембране псевдоподия (рис. 2, б ). При этом создается движущая сила, толкающая мембрану вперед, в направлении перемещения клетки.
Концентрация Arp2/3-комплекса в клетках в 40-100 раз меньше, чем концентрация мономеров актина, но она достаточно велика, чтобы заблокировать все заостренные концы нитей, например у Acanthamoeba. Это, конечно, не означает, что treadmilling (круговорот мономеров) актина никогда не происходит в живых клетках. Напомним, во-первых, что комплекс характерен не для всех субпопуляций актина, и, во-вторых, возможно, что при определенных физиологических условиях он может диссоциировать от актиновых полимеров.
Сродство Arp2/3-комплекса к актину не слишком велико, и он ускоряет полимеризацию актина всего в 2-3 раза. Оказывается, для более эффективного функционирования сам комплекс должен быть активирован. Роль активаторов комплекса играют другие белки.
Движение патогенной бактерии Listeria
Первый белок, играющий роль активатора Arp2/3-комплекса, был обнаружен у патогенной бактерии Listeria monocytogenes, которая может вызывать опасные для жизни человека заболевания, такие, как энцефалит. Эта бактерия способна с большой скоростью перемещаться в цитоплазме клеток хозяина. Однако она не имеет жгутиков, и в ее клетке, как и у других прокариот, нет собственного актинового цитоскелета. Эта бактерия-паразит приспособилась использовать для перемещения актин эукариотной клетки, в которой она живет. L. monocytogenes научилась быстро полимеризовать актин хозяина вблизи одного из своих полюсов. В результате в ее кильватере образуется "хвост кометы" из непрерывно полимеризующегося актина, что и создает движущуюся силу для перемещения бактерии (рис. 3, вставка).
Оказалось, что на поверхности этой бактерии вблизи одного из ее полюсов имеется белок ActA, который умеет присоединять и активировать Arp2/3-комплекс и как следствие - во много раз ускорять полимеризацию актина. Пространственно процесс ограничен областью вблизи поверхности бактерии. Это достигается совместным действием многих актинсвязывающих белков, которые блокируют концы растущих филаментов актина, обеспечивают их ветвление, деполимеризацию и т.д. Растущие нити актина, по-видимому, направлены быстро растущими оперенными плюс-концами в сторону движения бактерии (точно так же, как это происходит при образовании псевдоподий в клетках эукариот) и толкают бактерию вперед.
Недавно M.-F. Carlier и ее сотрудники воссоздали процесс движения бактерии в системе in vitro, состоящей только из очищенных цитоскелетных белков. Ученые также определили степень необходимости каждого из белков - участников этого процесса. Помимо актина для моделирования процесса движения оказались необходимы всего три компонента: Arp2/3-комплекс, актиндеполимеризующий фактор и кэп-белки. Еще три белка были полезны, но необязательны для поддержания движения. Скорость движения бактерий составила 2-4 мкм/мин, то есть была не намного меньше, чем в клеточных экстрактах.
Таким образом, на предметном стекле был воспроизведен процесс движения патогенной бактерии Listeria и изучен его молекулярный механизм. Показано, что бактерия использует для передвижения полимеризацию актина цитоплазмы клетки-хозяина, активируя его с помощью собственного мембранного белка ActA.
РЕГУЛЯЦИЯ ПОЛИМЕРИЗАЦИИ АКТИНА
В КЛЕТКАХ ЭУКАРИОТ
Если полимеризация актина вблизи поверхности патогенной бактерии происходит конститутивно (без внешнего сигнала), то в подвижных клетках эукариот (например, в псевдоподиях фибробластов) или в зонах внутриклеточной подвижности, основанной на полимеризации актина, перестройка актинового цитоскелета обычно происходит в ответ на внеклеточный сигнал (свет, химический стимул). Уже давно известны начальные и конечные звенья в передаче этого сигнала. Внеклеточный сигнал воспринимается мембранным рецепторным белком и затем передается на так называемые G-белки, небольшие белки, способные связывать ГТФ, изменять свою конформацию и благодаря этому передавать сигналы на другую белковую молекулу. Гидролиз ГТФ до ГДФ G-белком возвращает его в неактивную конформацию. Некоторые такие G-белки (Rho, Rac и Cdc42) в итоге передают сигнал на актиновый цитоскелет, что приводит к быстрой полимеризации актина в зонах образования ламеллоподий и филоподий (разные типы псевдоподий) или волокон натяжения, пересекающих клетку пучков актиновых нитей. Промежуточные звенья в этой системе передачи сигнала до недавнего времени не были выяснены. Теперь стало очевидным, что полимеризации актина предшествует взаимодействие его мономеров с Arp2/3-комплексом, который затем должен быть активирован какими-то белками по аналогии с ActA-белком Listeria. Начались поиски таких белков в клетках животных и дрожжей, которые вскоре увенчались успехом. Было найдено несколько гомологичных белков. Первый из открытых белков получил название WASP, поскольку был найден у больных Wiscott-Aldrich-синдромом - наследуемой болезнью человека. Для этих белков характерно сложное доменное строение: они содержат домены связывания с белками и другими регуляторными молекулами (рис. 4, а). Показано, что эти белки, в частности, могут связывать Arp2/3-комплекс, мономерный актин, профилин, G-белки, сигнальную молекулу - фосфатидилинозитол-4,5-бисфосфат. Функциональное назначение разных доменов различно. Так, на С-конце WASP-белка рядом расположены домены связывания мономерного актина и Arp2/3-комплекса. Это обеспечивает их пространственное сближение и может облегчать процесс полимеризации актина. На N-конце WASP-белка расположены домены связывания G-белков и других сигнальных молекул. Благодаря этому WASP и его аналоги могут служить посредниками при действии многих факторов и участвовать в передаче сигнала (на участке между G-белками и Arp2/3-комплексом), активирующего полимеризацию актина.
Сами белки семейства WASP, по-видимому, в свою очередь, нуждаются в активации. Так, было показано, что С-концевые фрагменты этих белков более активны в стимуляции полимеризации актина, чем целые белки. Это может означать, что белки из семейства WASP могут существовать в клетке в неактивной конформации (рис. 4, б ) и только взаимодействие сигнальных молекул (G-белки, фосфоинозитолфосфатиды) с N-концевой частью этих белков переводит их в активную конформацию.
Итак, WASP-белки и Arp2/3-комплекс составляют те центральные звенья в цепи передачи внеклеточного сигнала, вызывающего полимеризацию актина, которые до недавнего времени были белыми пятнами в наших знаниях (рис. 5). Любопытно, что, если патогенная бактерия Listeria, о которой шла речь выше, сама синтезирует мембранный белок ActA (гомолог WASP), активирующий Arp2/3-комплекс эукариотной клетки, другая патогенная бактерия, возбудитель дизентерии Shigella flexneri, продвинулась еще дальше в степени эксплуатации механизма полимеризации актина клетки хозяина: ее мембрана содержит белок, который умеет присоединять WASP-белок хозяина (а не имитировать его активность), вклиниваясь в сигнальную цепь хозяина и активируя Arp2/3-комплекс с помощью Cdc42 (G-белок). Более того, если покрыть WASP-белком микроскопические стеклянные бусинки, то они тоже сумеют собирать актин вблизи своей поверхности и перемещаться в клеточных экстрактах без участия каких-либо моторных белков, только благодаря полимеризации актина.
Для выполнения актиновым цитоскелетом множества функций в клетке необходимо, чтобы сборка и организация актиновых нитей происходили в нужное время и в нужном месте. В последние десять лет шли интенсивные исследования с использованием генетических, биохимических и цитологических подходов для выяснения путей передачи внеклеточного сигнала к местам активной полимеризации актина. За это время был открыт Arp2/3-комплекс, служащий матрицей для нуклеации нитей актина и обнаружено несколько белков, регулирующих его активность. В последние годы было предпринято много усилий, чтобы понять механизм, с помощью которого G-белки семейства Rho регулируют состояние актинового цитоскелета, и практически заполнена брешь в цепи передачи внеклеточного сигнала на цитоскелет с участием G-белков. Важные для расшифровки этого пути передачи сигнала уроки были извлечены из изучения подвижности патогенных бактерий внутри эукариотической клетки и воспроизведения этого движения в модельных системах. Очевидно, что новые детали пространственной и временной регуляции сборки и организации актинового цитоскелета будут выяснены в последующие годы.
1. Васильев Ю.М. Клетка как архитектурное чудо. 1. Живые нити // Соросовский Образовательный Журнал. 1996. ╧ 2. С. 36-43.
2. Васильев Ю.М. Клетка как архитектурное чудо. 2. Цитоскелет способный чувствовать и помнить // Там же. ╧ 4. С. 4-10.
3. Тихонов А.Н. Молекулярные моторы. 2. Молекулярные основы биологической подвижности // Там же. 1999. ╧ 6. С. 17-24.
4. Welch M.D. The World According to Arp: Regulation of Actin Nucleation by the Arp2/3 Complex // Trends Cell Biol. 1999. Vol. 9. P. 423-427.
5. Machesky L.M., Cooper J.A. Bare Bones of the Cytoskeleton // Nature. 1999. Vol. 401. P. 542-543.
Рецензент статьи О.Н. Кулаева
Нелла Леопольдовна Клячко, доктор биологических наук, ведущий научный сотрудник Института физиологии растений им. К.А. Тимирязева РАН. Область научных интересов - пространственная организация белоксинтезирующего аппарата и его взаимодействие с цитоскелетом растительной клетки. Автор более 80 научных публикаций.
Актин в мышечных волокнах
Описаны основные характеристики сократительного белка актина (диаметр глобулы и молекулярная масса). Дается характеристика первичной и третичной структуры актина. Описан процесс полимеризации актина (соединения молекул глобулярного актина в фибриллу).
Основу тонкого филамента саркомера составляет сократительный белок актин, который имеет яйцевидную форму (форму глобулы). Диаметр глобулы G-актина примерно равен 55 Å[1]. Поэтому эта форма актина называется глобулярным актином (G-актин). На долю актина приходится 25% общей массы мышечного белка.
История выделения актина
Актин впервые выделен Б. Штраубом в 1948 году (Самойлов В.О., Бигдай Е.В., 2004).
Структура актина
Структура этого белка остается неизменной миллионы лет. Первичную структуру актина (полипептидную цепь) составляют 374 аминокислотных остатка. Молекулярная масса актина - 41,8 кДа.
Третичная структура актина представляет из себя глобулу с бугристой поверхностью, изрезанную щелями. Самая большая щель пролегает в середине молекулы и содержит активные центры связывания АТФ, АДФ, а также ионов кальция (Ca 2+ ) и магния (Mg 2+ ).
Полимеризация актина
На молекуле G-актина есть сайты (центры) связывания тропомиозина, тропонина и миозиновой головки. Кроме того молекула G-актина имеет две пары комплементарных (ключ-замок) сайтов прикрепления соседних молекул G-актина. Благодаря этим центрам связывания в присутствии ионов магния (Mg2+) глобулы G-актина при достаточной их концентрации самопроизвольно объединяются в фибриллы (происходит полимеризация G-актина). В результате образуется фибриллярный актин (F-актин). Контакты между глобулами G-актина обеспечиваются гидрофобными и электростатическими взаимодействиями (рис.1).
При такой спонтанной полимеризации актина на образовавшейся нити один из ее концов быстро связывается с G-актином (плюс-конец) и поэтому растет быстрее, чем противоположный (минус-конец). В результате возникает суперспираль, образованная молекулами G-актина, подобно бусинкам в ожерелье из двух ниток, закрученных одна вокруг другой.
Рис. 1. Полимеризация актина
Литература
1. Самойлов В.О., Бигдай Е.В. Клеточные и молекулярные основы биомеханики / В кн.: Математические модели и компьютерное моделирование в биомеханике: Учебное пособие.- СПб: Из-во Политехнического ун-та, 2004.- С. 29-102.
[1] Å - ангстрем устаревшая внесистемная единица измерения длины, равная 10 −10 м.
Микрофиламент - Microfilament
Микрофиламенты, также называемый актиновые нити, находятся белковые нити в цитоплазма из эукариотический клетки которые составляют часть цитоскелет. Они в основном состоят из полимеры из актин, но изменяются и взаимодействуют с множеством других белки в камере. Микрофиламентов обычно около 7 нм в диаметре и состоит из двух нитей актина. Функции микрофиламента включают цитокинез, амебовидное движение, подвижность клеток, изменение формы клеток, эндоцитоз и экзоцитоз, сократимость клеток и механическая стабильность. Микроволокна гибкие и относительно прочные, они сопротивляются короблению под действием многопиконьютонных сжимающих сил и разрушению нити под действием растягивающих усилий наноньютонов. В побуждении подвижность клеток, один конец актиновой нити удлиняется, в то время как другой конец сокращается, предположительно за счет миозин II молекулярные моторы. [1] Кроме того, они функционируют как часть актомиозин -приводимые сократительные молекулярные моторы, в которых тонкие волокна служат платформами растяжения для миозина. АТФ -зависимое тянущее действие в сокращение мышц и псевдопод продвижение. Микрофиламенты имеют прочный и гибкий каркас, который помогает клетке двигаться. [2]
Содержание
История
Актиновые и опосредованные микрофиламентами процессы давно стали предметом исследований. Американо-немецкий ботаник Джордж Энгельманн (1879) предположили, что многие виды движения, наблюдаемые у растений и простейших, таких как цитоплазматический поток и амебовидное движение на самом деле были примитивной версией движений сокращение мышц.
В 1930-е гг. Сент-Дьёрдьи и соратников, нарушив один из канонов биохимия, начал «изучать остаток вместо экстракта», то есть структурные белки и нет ферменты, что привело к множеству открытий, связанных с микрофиламентами. [3]
Организация
Актиновые филаменты собираются в два основных типа структур: пучки и сети. Жгуты могут состоять из массивов полярных волокон, в которых все зазубренные концы указывают на один и тот же конец жгута, или неполярных массивов, где зазубренные концы указывают в сторону обоих концов. Класс актин-связывающие белки, называемые перекрестно-связывающими белками, диктуют формирование этих структур. Сшивающие белки определяют ориентацию филаментов и расстояние в пучках и сетях. Эти структуры регулируются многими другими классами актин-связывающих белков, включая моторные белки, белки ветвления, разделяющие белки, промоторы полимеризации и кэпирующие белки.
В пробирке самосборка
Примерно 6 нм в диаметр, [4] микрофиламенты - самые тонкие волокна цитоскелета. Они есть полимеры из актин субъединицы (глобулярный актин или G-актин), которые как часть волокна называются нитевидным актином или F-актином. Каждая микрофиламент состоит из двух спиральный, переплетенные нити субъединиц. Так же, как микротрубочки актиновые филаменты поляризованы. Электронные микрофотографии предоставили доказательства их быстрорастущих зазубрин и медленно растущих заостренных концов. Эта полярность определяется рисунком, созданным привязка фрагментов миозина S1: они сами являются субъединицами более крупного миозина II белковый комплекс. Заостренный конец обычно называют концом с минусом (-), а конец с зазубринами называют концом с плюсом (+).
В пробирке полимеризация актина, или зарождение, начинается с самоассоциации трех мономеров G-актина с образованием тример. АТФ -связанный актин затем сам связывает зазубренный конец, и впоследствии АТФ гидролизованный. Гидролиз АТФ происходит с половина времени около 2 секунд, [5] в то время как половина времени для диссоциации неорганический фосфат около 6 минут. [5] Этот автокатализированный событие снижает силу связывания между соседними субъединицами и, таким образом, обычно дестабилизирует филамент. В естественных условиях Полимеризация актина катализируется классом молекулярных моторов, отслеживающих концы филаментов, известных как актоклампины. Последние данные свидетельствуют о том, что скорость гидролиза АТФ и скорость включения мономера сильно взаимосвязаны.
Впоследствии ADP -актин медленно диссоциирует с заостренного конца, процесс значительно ускоряется актин-связывающим белком, кофилин. АДФ-связанный кофилин разделяет богатые АДФ регионы, ближайшие к (-) - концам. После высвобождения свободный мономер актина медленно диссоциирует от АДФ, который, в свою очередь, быстро связывается со свободным АТФ. распространяющийся в цитозоль, тем самым формируя мономерные единицы АТФ-актина, необходимые для дальнейшего удлинения филаментов с зазубринами. Этот быстрый оборот важен для движения клетки. Концевые белки, такие как CapZ предотвращать добавление или потерю мономеров на конце филамента, где оборот актина неблагоприятен, например, в мышечном аппарате.
Полимеризация актина вместе с кэппирующими белками недавно была использована для контроля трехмерного роста белковой нити с целью создания трехмерных топологий, полезных в технологии и создании электрических межсоединений. Электропроводность достигается за счет металлизации трехмерной структуры белка. [6] [7]
Механизм генерации силы
В результате гидролиза АТФ нити удлиняются на своих зазубренных концах примерно в 10 раз быстрее, чем заостренные. В устойчивое состояние скорость полимеризации на заостренном конце соответствует скорости деполимеризации на заостренном конце, и микроволокна называются беговая дорожка. Беговая дорожка приводит к удлинению зазубренного конца и укорачиванию заостренного конца, так что нить полностью перемещается. Поскольку оба процесса энергетически выгодны, это означает, что генерируется сила, энергия в конечном итоге поступает от АТФ. [1]
Актин в клетках
Сборка и разборка актинового цитоскелета внутриклеточно регулируются клеточными сигнальными механизмами. Много преобразование сигнала системы используют актиновый цитоскелет в качестве каркаса, удерживая их на внутренней поверхности периферических мембрана. Это субклеточное расположение обеспечивает немедленную реакцию на действие трансмембранного рецептора и результирующий каскад ферментов обработки сигналов.
Поскольку мономеры актина должны быть переработаны для поддержания высоких показателей подвижности на основе актина во время хемотаксис Считается, что передача клеточных сигналов активирует кофилин, белок, деполимеризующий актин-филамент, который связывается с богатыми АДФ субъединицами актина, ближайшими к заостренному концу филамента, и способствует фрагментации филаментов с сопутствующей деполимеризацией для высвобождения мономеров актина. В большинстве клеток животных мономерный актин связан с профилин и тимозин бета-4, оба из которых предпочтительно связываются со стехиометрией один к одному с АТФ-содержащими мономерами. Хотя тимозин бета-4 является строго секвеструющим мономером белком, поведение профилина гораздо сложнее. Профилин усиливает способность мономеров к сборке, стимулируя обмен АДФ, связанного с актином, на АТФ в фазе раствора с образованием актин-АТФ и АДФ. Профилин переносится на переднюю кромку благодаря своей PIP2 сайт связывания, и он использует свой сайт связывания поли-L-пролина для стыковки с белками, отслеживающими концы. После связывания профилин-актин-АТФ загружается в сайт встраивания мономера в моторы актоклампина.
Еще одним важным компонентом образования филаментов является Комплекс Арп2 / 3, который прикрепляется к стороне уже существующей нити (или «материнской нити»), где он зарождается, формируя новую дочернюю нить под углом 70 градусов по отношению к материнской нити, создавая веерообразную разветвленную сеть нитей. [8]
Специализированные уникальные актиновые цитоскелетные структуры находятся рядом с плазматической мембраной. Четыре замечательных примера включают красные кровяные тельца, эмбриональные клетки почек человека, нейроны, и сперма клетки. В красных кровяных тельцах a спектрин -актин шестиугольная решетка образован соединенными между собой короткими актиновыми филаментами. [9] В эмбриональных клетках почек человека кортикальный актин образует бесчестную фрактал структура. [10] В нейронных аксоны актин образует периодические кольца, которые стабилизируются спектрином и аддуцином. [11] [12] А в сперме млекопитающих актин образует спиральная структура в средней части, т. е. в первом сегменте жгутик. [13]
Связанные белки
В немышечных клетках актиновые филаменты образуются проксимальнее поверхности мембраны. Их образование и оборот регулируются многими белками, в том числе:
- Белок, отслеживающий концы филаментов (например, Форминс, ВАСП, N-WASP )
- Нить-нуклеатор, известный как родственный актин протеин-2/3 (или Arp2 / 3 ) сложный
- Сшивающие нити (например, α-актинин, очаровывать, и фимбрин )
- Белки, связывающие мономер актина профилин и тимозин β4
- Укупорочные средства с зазубринами на концах нити, такие как Capping Protein и CapG, так далее.
- Белки, расщепляющие нити, такие как гельсолин.
- Белки, деполимеризующие актин, такие как ADF /кофилин.
Сеть актиновых филаментов в немышечных клетках очень динамична. Сеть актиновых филаментов устроена так, что зазубренный конец каждой филамента прикреплен к периферической мембране клетки с помощью электродвигателей удлинения зажатых волокон, упомянутых выше «актоклампинов», образованных из зазубренного конца волокна и прижимающего белка (формины , VASP, Mena, WASP и N-WASP). [14] Первичным субстратом для этих моторов удлинения является комплекс профилин-актин-АТФ, который непосредственно переносится на удлиняющиеся концы филаментов. [15] Заостренный конец каждой нити ориентирован внутрь клетки. В случае ламеллиподиального роста комплекс Arp2 / 3 генерирует разветвленную сеть, а в филоподиях образуется параллельный массив филаментов.
Актин действует как трек для моторики миозина
Миозин моторы - это внутриклеточные АТФ-зависимые ферменты, которые связываются с актиновыми филаментами и перемещаются по ним. Миозиновые двигатели разных классов ведут себя по-разному, включая создание напряжения в клетке и транспортировку грузовых пузырьков.
Предлагаемая модель - актоклампины отслеживать концы нити
Одна предложенная модель предполагает существование молекулярных моторов актиновых филаментов, отслеживающих зазубрины за концом, называемых «актоклампином». [16] Предлагаемые актоклампины генерируют движущие силы, необходимые для актиновой подвижности ламеллиподии, филоподия, инвадиподии, дендритные шипы, внутриклеточный пузырьки, и подвижный процессы в эндоцитоз, экзоцитоз, образование подосом и фагоцитоз. Актоклампиновые двигатели также вызывают такие внутриклеточные патогены в качестве Listeria monocytogenes, Шигелла флекснери, Вакцина и Риккетсия. При сборке в подходящих условиях эти молекулярные двигатели с отслеживанием концов также могут продвигать биомиметик частицы.
Термин актоклампин происходит от акт- чтобы указать на участие актиновой нити, как в актомиозине, и зажим для обозначения зажимного устройства, используемого для усиления гибких / движущихся объектов и для надежного крепления двух или более компонентов, за которым следует суффикс -в чтобы указать его белковое происхождение. Таким образом, белок, отслеживающий концы актинового филамента, можно назвать зажимом.
Дикинсон и Пурих признали эту подсказку Гидролиз АТФ может объяснить силы, достигаемые во время актиновой подвижности. [14] Они предложили простой механоферментный последовательность, известная как модель «Lock, Load & Fire», в которой белок слежения за концом остается плотно связанным («заблокированным» или зажатым) на конце одной субфиламента двухцепочечной актиновой нити. После связывания с Glycyl-Prolyl-Prolyl-Prolyl-Prolyl-Prolyl-регистрами на белках-трекерах, Профилин-АТФ-актин доставляется («загружается») к незажатому концу другого субфиламента, после чего АТФ внутри уже зажатой концевой субъединицы другого субфрагмента гидролизуется («запускается»), обеспечивая энергию, необходимую для высвобождения этого плеча концевого трекера, который затем может связывать другой профилин-АТФ-актин, чтобы начать новый раунд добавления мономера .
Вовлеченные шаги
Следующие шаги описывают один цикл генерации силы молекулярного мотора актоклампина:
- Кофактор полимеризации профилин и АТФ · актин объединяются с образованием комплекса профилин-АТФ-актин, который затем связывается с блоком отслеживания концов.
- Кофактор и мономер переносятся на зазубренный конец актиновой уже зажатой нити.
- Блок слежения и кофактор диссоциируют от соседнего протофиламента на стадии, которой может способствовать энергия гидролиза АТФ для модуляции сродства кофактора и / или блока слежения к нити; и этот механоферментный цикл затем повторяется, начиная на этот раз с другого участка роста субфиламентов.
При работе с преимуществом гидролиза АТФ двигатели переменного тока генерируют силы на каждую нить накала 8-9 пН, что намного больше, чем предел для каждой нити в 1-2 пН для двигателей, работающих без гидролиза АТФ. [14] [16] [17] Термин «актоклампин» является общим и применяется ко всем молекулярным моторам, отслеживающим концы актиновых филаментов, независимо от того, активно ли они управляются АТФ-активируемым механизмом или пассивно.
Некоторые актоклампины (например, те, которые включают белки Ena / VASP, WASP и N-WASP), по-видимому, требуют Arp2 / 3-опосредованной инициации филаментов для образования полимеризация актина ядро, которое затем «загружается» на конечный трекер до того, как может начаться процессивная подвижность. Для генерации нового филамента Arp2 / 3 требуется "материнский" филамент, мономерный АТФ-актин и активирующий домен из Listeria ActA или области VCA N-WASP. Комплекс Arp2 / 3 связывается со стороной материнской нити, образуя Y-образную ветвь, имеющую угол 70 градусов по отношению к продольный ось материнской нити. Затем, после активации ActA или VCA, комплекс Arp, как полагают, претерпевает серьезные конформационные изменения, в результате чего две его белковые субъединицы, связанные с актином, достаточно близко друг к другу, чтобы образовались новые ворота филамента. Вопрос о том, может ли гидролиз АТФ потребоваться для зародышеобразования и / или высвобождения Y-ветви, активно исследуется.

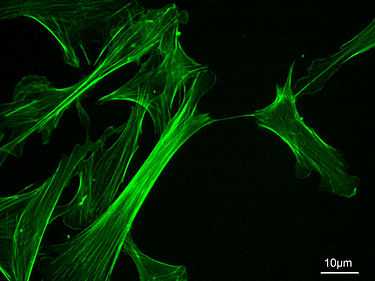
Актиновый цитоскелет мыши эмбрион фибробласты, окрашенные Флуоресцеина изотиоцианат - фаллоидин
Микрофиламенты, также называемые актиновыми нитями, представляют собой белковые нити в цитоплазме эукариотические клетки, которые составляют часть цитоскелета. Они в основном состоят из полимеров из актина, но модифицируются и взаимодействуют с многочисленными другими белками в клетке. Микрофиламенты обычно имеют диаметр около 714 нм и состоят из двух нитей актина. Функции микрофиламентов включают цитокинез, амебоидное движение, подвижность клеток, изменения формы клеток, эндоцитоз и экзоцитоз, сократимость клеток и механическая стабильность. Микроволокна гибкие и относительно прочные, они сопротивляются короблению под действием многопиконьютонных сжимающих сил и разрушению нити под действием растягивающих усилий наноньютонов. Вызывая подвижность клеток, один конец актинового филамента удлиняется, в то время как другой конец сокращается, предположительно за счет молекулярных моторов миозина II. Кроме того, они действуют как часть управляемых актомиозином сократительных молекулярных двигателей, в которых тонкие нити служат в качестве растягивающих платформ для АТФ -зависимого тянущего действия миозина при сокращении мышц и псевдопод продвижение. Микрофиламенты имеют прочный гибкий каркас, который помогает клетке двигаться.
- 1 История
- 2 Организация
- 3 Самосборка in vitro
- 4 Механизм генерации силы
- 5 Актин в клетках
- 6 Ассоциированные белки
- 7 Актин действует как трек для моторики миозина
- 8 Предлагаемая модель - актоклампины отслеживают концы нитей
- 8.1 Используемые шаги
Актин и процессы, опосредованные микрофиламентами, давно стали предметом исследований. Американско-немецкий ботаник Джордж Энгельманн (1879) предположил, что многие виды движений, наблюдаемые у растений и простейших, такие как поток цитоплазмы и амебоидное движение, на самом деле были примитивной версией. движений сокращения мышц.
В 1930-х годах Сент-Дьёрдьи и его сотрудники, нарушив один из канонов биохимии, начали «изучать остатки, а не «экстракт», то есть структурные белки, а не ферменты, что привело ко многим открытиям, связанным с микрофиламентами.
Актиновые филаменты - это собирается в два основных типа конструкций: пучки и сети. Жгуты могут состоять из массивов полярных волокон, в которых все зазубренные концы указывают на один и тот же конец жгута, или неполярных массивов, где зазубренные концы обращены к обоим концам. Класс актин-связывающих белков, называемых перекрестно-связывающими белками, определяет формирование этих структур. Сшивающие белки определяют ориентацию филаментов и расстояние в пучках и сетях. Эти структуры регулируются многими другими классами актин-связывающих белков, включая моторные белки, белки ветвления, разделяющие белки, промоторы полимеризации и кэпирующие белки.
Самосборка in vitro
Микрофиламенты размером примерно 6 нм при диаметре являются самыми тонкими волокнами цитоскелета. Они представляют собой полимеры субъединиц актина (глобулярный актин или G-актин), которые как часть волокна называются нитевидным актином или F-актином. Каждое микрофиламент состоит из двух спиральных переплетенных нитей субъединиц. Как и микротрубочки, актиновые филаменты поляризованы. Электронные микрофотографии свидетельствуют об их быстрорастущих зазубринах и медленно растущих заостренных концах. Эта полярность была определена паттерном, создаваемым связыванием фрагментов миозина S1: они сами являются субъединицами более крупного белкового комплекса миозина II . Заостренный конец обычно называют концом с минусом (-), а конец с зазубринами называют концом с плюсом (+).
Полимеризация актина in vitro или зародышеобразование начинается с самоассоциации трех мономеров G-актина с образованием тример. АТФ -связанный актин затем сам связывает зазубренный конец, и впоследствии АТФ гидролизуется. Гидролиз АТФ происходит с периодом полупериода , составляющим около 2 секунд, в то время как полупериод диссоциации неорганического фосфата составляет около 6 минут. Это автокатализируемое событие снижает силу связывания между соседними субъединицами и, таким образом, в целом дестабилизирует филамент. In vivo полимеризация актина катализируется классом молекулярных моторов, отслеживающих концы филаментов, известных как. Последние данные свидетельствуют о том, что скорость гидролиза АТФ и скорость включения мономера сильно взаимосвязаны.
Впоследствии АДФ -актин медленно диссоциирует с заостренного конца, процесс значительно ускоряется актин-связывающим белком, кофилином. АДФ-связанный кофилин разделяет богатые АДФ регионы, ближайшие к (-) - концам. После высвобождения свободный мономер актина медленно диссоциирует от АДФ, который, в свою очередь, быстро связывается со свободным АТФ , диффундирующим в цитозоле, тем самым образуя мономерные единицы АТФ-актина, необходимые для дальнейшего образования колючек. - удлинение конца филамента. Этот быстрый оборот важен для движения клетки. Концевые белки, такие как CapZ, предотвращают добавление или потерю мономеров на конце филамента, где оборот актина неблагоприятен, например, в мышечном аппарате.
Полимеризация актина вместе с кэппирующими белками недавно была использована для контроля трехмерного роста белковой нити с целью выполнения трехмерных топологий, полезных в технологии и создании электрических межсоединений. Электропроводность достигается за счет металлизации трехмерной структуры белка.
В результате гидролиза АТФ нити удлиняются примерно в 10 раз быстрее на своих заостренных концах, чем на их заостренных концах. При установившемся состоянии скорость полимеризации на зазубренном конце соответствует скорости деполимеризации на заостренном конце, и микрофиламенты называются беговой дорожкой. Беговая дорожка приводит к удлинению зазубренного конца и укорачиванию заостренного конца, так что нить полностью перемещается. Поскольку оба процесса энергетически благоприятны, это означает, что генерируется сила, энергия в конечном итоге исходит от АТФ.
Сборка и разборка цитоскелета внутриклеточного актина строго регулируются клеточными сигнальными механизмами. Многие системы передачи сигнала используют актиновый цитоскелет в качестве каркаса, удерживая их на внутренней поверхности периферической мембраны или рядом с ней. Это субклеточное расположение обеспечивает немедленную реакцию на действие трансмембранного рецептора и результирующий каскад ферментов обработки сигналов.
Поскольку мономеры актина должны рециклироваться для поддержания высоких показателей подвижности на основе актина во время хемотаксиса, считается, что передача клеточных сигналов активирует кофилин, белок деполимеризации актиновых филаментов, который связывается с АДФ-богатым субъединицы актина находятся рядом с заостренным концом филамента и способствуют фрагментации филамента с сопутствующей деполимеризацией с целью высвобождения мономеров актина. В большинстве клеток животных мономерный актин связывается с профилином и тимозином бета-4, оба из которых предпочтительно связываются со стехиометрией один к одному с АТФ-содержащими мономерами. Хотя тимозин бета-4 является строго секвеструющим мономером белком, поведение профилина гораздо сложнее. Профилин усиливает способность мономеров к сборке, стимулируя обмен АДФ, связанного с актином, на АТФ в фазе раствора с образованием актин-АТФ и АДФ. Профилин переносится на передний край благодаря своему сайту связывания PIP 2, и он использует свой сайт связывания поли-L-пролина для стыковки с белками, отслеживающими концы. После связывания профилин-актин-АТФ загружается в сайт встраивания мономера в моторы актоклампина.
Другим важным компонентом образования филаментов является комплекс Arp2 / 3, который связывается со стороной уже существующего филамента (или «материнского филамента»), где он зарождается в образовании новая дочерняя нить под углом 70 градусов по отношению к материнской нити, создавая веерообразную разветвленную сеть нитей.
Специализированные уникальные актиновые цитоскелетные структуры находятся рядом с плазматической мембраной. Четыре замечательных примера включают эритроциты, клетки эмбриональной почки человека, нейроны и клетки спермы. В эритроцитах спектрин -актин гексагональная решетка образована соединенными между собой короткими актиновыми филаментами. В эмбриональных клетках почек человека кортикальный актин образует безмасштабную фрактальную структуру. В нейронных аксонах актин образует периодические кольца, которые стабилизируются спектрином и аддуцином. А в сперматозоидах млекопитающих актин образует спиральную структуру в средней части, то есть в первом сегменте жгутика.
ассоциированных белков
В немышечных клетках актиновые филаменты формируются проксимальнее поверхности мембраны. Их образование и оборот регулируются многими белками, включая:
- белок, отслеживающий концы филаментов (например, formins, VASP, N-WASP )
- Filament- нуклеатор, известный как комплекс Actin-Related Protein-2/3 (или Arp2 / 3 )
- сшивающие нити (например, α-актинин, фасцин, и фимбрин )
- белки, связывающие мономер актина профилин и тимозин β4
- концы нити с зазубринами, такие как Capping Protein и CapG и т. д.
- Filament -разрушающие белки, такие как гельзолин.
- Белки, деполимеризующие актин, такие как ADF / кофилин.
Сеть актиновых филаментов в немышечных клетках очень динамична. Сеть актиновых филаментов расположена с зазубренным концом каждая нить прикреплена к периферической мембране клетки с помощью моторов удлинения зажатой нити, вышеупомянутых «актоклампинов», образованных из зазубренного конца нити и зажимающего белка (формины, VASP, Mena, WASP и N-WASP). Основная подложка для этих моторов удлинения. rs представляет собой комплекс профилин-актин-АТФ, который непосредственно переносится на удлиняющиеся концы филаментов. Заостренный конец каждой нити ориентирован внутрь клетки. В случае ламеллиподиального роста комплекс Arp2 / 3 генерирует разветвленную сеть, а в филоподиях образуется параллельный массив филаментов.
Актин действует как трек для моторики миозина.
Миозин моторы - это внутриклеточные АТФ-зависимые ферменты, которые связываются с актиновыми филаментами и перемещаются по ним. Различные классы миозиновых моторов ведут себя по-разному, в том числе создают напряжение в клетке и транспортируют грузовые везикулы.
Предлагаемая модель - актоклампины отслеживают концы нитей
Одна из предложенных моделей предполагает существование молекулярных моторов актиновых нитей, отслеживающих зазубрины-концы нитей, называемых «актоклампином». Предлагаемые актоклампины генерируют движущие силы, необходимые для актиновой подвижности ламеллиподий, филоподий, инвадиподий, дендритных шипов, внутриклеточных везикулы и подвижные процессы в эндоцитозе, экзоцитозе, формировании подосом и фагоцитозе. Актоклампиновые двигатели также вызывают такие внутриклеточные патогены, как Listeria monocytogenes, Shigella flexneri, Vaccinia и Rickettsia. При сборке в подходящих условиях эти отслеживающие концы молекулярные двигатели могут также перемещать биомиметические частицы.
Термин «актоклампин» происходит от слова «акто» - для обозначения вовлечения актиновой нити, как в актомиозине, и «зажим» для обозначения зажимного устройства, используемого для укрепления гибких / движущихся объектов и для надежного закрепления двух или более компонентов. за которым следует суффикс -in, чтобы указать его белковое происхождение. Таким образом, белок, отслеживающий концы актинового филамента, можно назвать зажимом.
Дикинсон и Пурих признали, что быстрый гидролиз АТФ может объяснить силы, достигаемые во время актиновой подвижности. Они предложили простую последовательность, известную как модель Lock, Load Fire, в которой белок слежения за концом остается плотно связанным («заблокированным» или зажатым) на конце одной субфиламента двухцепочечного актинового филамента. После связывания с Glycyl-Prolyl-Prolyl-Prolyl-Prolyl-Prolyl-регистрами на белках-трекерах, Профилин-АТФ-актин доставляется («загружается») к незажатому концу другого субфиламента, после чего ATP внутри уже зажатой концевой субъединицы другого субфрагмента гидролизуется ("запускается"), обеспечивая энергию, необходимую для высвобождения этого плеча концевого трекера, который затем может связывать другой профилин-АТФ-актин, чтобы начать добавление нового мономера круглый.
Используемые этапы
Следующие этапы описывают один цикл генерирования силы молекулярного двигателя акто-клампина:
- Кофактор полимеризации профилин и АТФ · актин объединяются, образуя профилин-АТФ-актин комплекс, который затем связывается с блоком отслеживания конца
- Кофактор и мономер переносятся на зазубренный конец актиновой уже зажатой нити
- Блок отслеживания и кофактор диссоциируют от соседнего протофиламента, на стадии, которой может способствовать энергия гидролиза АТФ для модуляции сродства кофактора и / или трекинговой единицы для филамента; и этот механоферментный цикл затем повторяется, начиная на этот раз с другого участка роста субфиламентов.
Некоторые актоклампины (например, те, которые включают белки Ena / VASP, WASP и N-WASP), по-видимому, требуют инициации филаментов, опосредованной Arp2 / 3, для формирования ядра, которое затем «загружается» на трекер конца перед может начаться процессивная моторика. Для создания нового филамента Arp2 / 3 требуется "материнский" филамент, мономерный АТФ-актин и активирующий домен из Listeria ActA или области VCA N-WASP. Комплекс Arp2 / 3 связывается со стороной материнской нити, образуя Y-образную ветвь, имеющую угол 70 градусов по отношению к продольной оси исходной нити. Затем после активации ActA или VCA, комплекс Arp, как полагают, претерпевает серьезные конформационные изменения, в результате чего две его белковые субъединицы, связанные с актином, достаточно близко друг к другу, чтобы образовались новые ворота филаментов. Вопрос о том, может ли гидролиз АТФ потребоваться для зародышеобразования и / или высвобождения Y-ветви, активно исследуется.
Читайте также:
