Фаза покоя миокарда. Местные различия иннервации сердца
Добавил пользователь Владимир З. Обновлено: 02.02.2026
Строение сердца у млекопитающих, имеющих 2 круга кровообращения, примерно одинаково. Сердце состоит из двух предсердий (первых камер на пути притекающей крови), двух желудочков, клапанов между этими камерами и входящих и отходящих от сердца сосудов с клапанами у их начала.
Между правым предсердием и правым желудочком находится правый клапан предсердно-желудочковый, или атрио-вентрикулярный, который состоит из 3-х створок. Поэтому его называют трехстворчатым, или трикуспидальным.
Между левым предсердием и левым желудочком находится левый предсердно-желудочковый клапан, который состоит из двух створок и называется митральным.
Клапаны, расположенные в устьях сосудов, отходящих от сердца, или магистральных сосудов, а именно - аорты и легочной артерии - соответственно носят названия «аортальный» и «легочный».
Атрио-вентрикулярные клапаны - створчатые, т.е. их устройство напоминает двери на створках: открылись и закрылись, вниз - вверх.
Клапаны аорты и легочной артерии другие по строению. Каждый из них состоит из 3-х полулунных створок, замыкающихся в центре. При открытии они прижимаются к стенке своего сосуда (аорты или легочной артерии), а закрываются, полностью замыкая просвет сосуда. При этом их вид напоминает фирменный знак компании «Мерседес».
Ткань самих створок, как атрио-вентрикулярных, так и полулунных — тонкая, у детей даже прозрачная, но поразительно эластичная и прочная, рассчитанная природой на непрекращающуюся ритмичную работу, исчисляемую миллиардами однообразных действий.
Между полостями сердца, или его камерами, расположены перегородки, разделяющие потоки венозной и артериальной крови. Это межпредсердная перегородка, т.е. между правым и левым предсердиями, и межжелудочковая перегородка - между правым и левым желудочками. В нормальном, сформированном сердце они полностью закрыты, в них нет никаких отверстий или дефектов и, таким образом, кровь из одной половины сердца в другую никогда не поступает.
Остановимся подробнее на анатомическом устройстве сердца и его камер. Ведь даже те из них, которые называются одинаково (предсердия или желудочки), устроены абсолютно по-разному и выполняют разные функции.
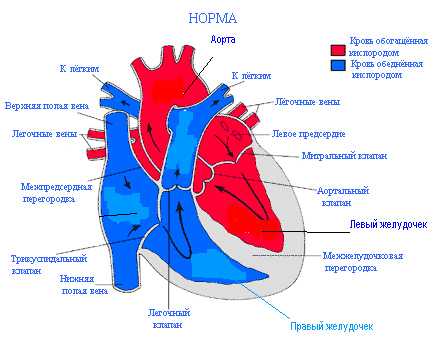
Сердце по форме напоминает грушу, лежащую несколько на боку, с верхушкой, расположенной слева и внизу, а основанием — правее и вверху. Верхушка сердца - это та его часть, движения которой можно почувствовать, если положить ладонь на грудную клетку в пятом межреберье слева от грудинной кости. Его толчок легко можно ощутить и у себя, и у ребенка. Это движения верхушки сердца при каждом сокращении. Сокращения почти синхронны с пульсом, который тоже можно легко прощупать на руке (там, где предплечье переходит в кисть) или на шейных сосудах. Пульс - это наполнение сосудов волной крови, поступающей из сердца с каждым его сокращением. Частота пульса, его ритмичность являются косвенным и легко доступным отражением деятельности самого сердца.
Верхушка — самая подвижная часть сердца, хотя и всё оно, все его отделы находятся в постоянном движении.
Работа сердца, его движение, состоит из двух чередующихся фаз — сокращения (систолы) и расслабления (диастолы).
Ритмичное, постоянное чередование этих фаз, необходимое для нормальной работы, обеспечивается возникновением и проведением электрического импульса по системе особых клеток - по узлам и волокнам проводящей системы сердца. Импульсы возникают вначале в самом верхнем, так называемом, синусовом узле, далее проходят ко второму, атрио-вентрикулярному узлу, а от него - по более тонким волокнам - к мышце правого и левого желудочков, вызывая сокращение всей их мускулатуры.
Правое предсердие принимает венозную кровь из полых вен, т.е. от всего тела и вдобавок венозную кровь самого сердца. Это - большая по объему и, пожалуй, самая растягиваемая камера сердца. При необходимости она способна вместить в несколько раз больше крови, чем в обычных условиях, т.е. обладает гигантским «запасом» объема. Стенка правого предсердия состоит из слоя тонких мышечных волокон. Помимо функции «приема» венозной крови, правое предсердие выполняет функцию водителя сердечного ритма. В его стенках залегают оба главных узла проводящей системы сердца.
Правое предсердие соединяется или, точнее, открывается в правый желудочек через предсердно-желудочковое отверстие, регулируемое трикуспидальным клапаном. Это отверстие достаточно широкое, чтобы пропустить весь объем крови из предсердия в правый желудочек в период расслабления его мышц, т.е. в фазу диастолы, и заполнить его полость.
— значительно более толстостенная, чем предсердие, мышечная структура. Это — самый передний отдел сердца, лежащий тотчас под грудинной костью. Он относительно растяжимый в случае необходимости. Форма его полости напоминает новый месяц, появившийся в небе. Если внимательно присмотреться, то видно, как светящаяся полоса месяца полукругом охватывает большой темный шар неосвещенной части Луны. Так и правый желудочек обтекает своей полостью мощный цилиндрический левый.
Внутри этот желудочек состоит из двух, продолжающихся один в другой, конусов: и . Они сходятся своими верхушками у верхушки сердца и разделены вверху мышечным валиком, так называемым .
открывается в легочную артерию, которая вместе с аортой является так называемым магистральными, или «великим», сосудом. На переходе от желудочка в легочную артерию расположен трехстворчатый, полулунный клапан легочного ствола, пропускающий кровь в одном направлении — в легкие.
— самая заднерасположенная из сердечных камер. Оно принимает окисленную, артериальную кровь из легочных вен. Вен всего четыре и они впадают в заднюю стенку левого предсердия. Камера этого предсердия значительно меньше, чем правого, и способность ее к растяжению существенно меньше.
Левое предсердие открывается через предсердно-желудочковое отверстие в левый желудочек. В этом отверстии находятся двухстворчатый — митральный — клапан, открытие и закрытие которого регулирует процесс заполнения и опорожнения желудочка в фазы систолы и диастолы.
— главный в сердце, да и во всей системе кровообращения. Это — мощная мышечная камера, стенки которой в 3-4 раза толще, чем у правого соседа. Это — компактный конус с отверстием входа (с митральным клапаном) и выхода (с трехстворчатым аортальным полулунным клапаном), лежащими рядом друг с другом и тесно взаимосвязанными.
Чтобы вся эта сложная система стройно и четко работала, она должна получать постоянное необходимое питание в виде кислорода и питательных веществ, а отработанные продукты должны удаляться. Для этого существуют артериальная и венозная системы самого сердца.
самого сердца состоит из двух — левой и правой - коронарных (венечных) артерий, которые отходят в самом начале, в устье восходящей аорты. Это ее первые ветви. Они тот час делятся на более мелкие и разносят кровь по всем участкам непрерывно двигающегося сердца. «Отработанная», отдавшая кислород, кровь втекает по многочисленным мелким венам, которые собираются в одну большую — венечный синус — и впадают в полость правого предсердия. Таким образом, сердце питает само себя, и от правильного положения и состояния венечных артерий его функция зависит напрямую.
Итак, подведем итог. Анатомически сердце — это мощный мышечный орган, имеющий четыре камеры и четыре клапана. Строение камер и клапанов отлично друг от друга, т.к. подчинено выполнению разных задач. Правые отделы сердца отделены от левых перегородками и между собой не сообщаются.
Цитируется по книге Г. Э. Фальковский, С. М. Крупянко. Сердце ребенка. Книга для родителей о врожденных пороках сердца
Особенности перфузии и симпатической иннервации миокарда по данным однофотонной эмиссионной компьютерной томографии у пациентов
Одним из важных факторов, влияющих на течение заболевания, выбор тактики лечения и прогноз пациентов с ГКМП, является нарушение кровоснабжения миокарда на уровне микроциркуляции, приводящее к развитию ишемии миокарда. Среди патофизиологических факторов этого процесса следует отнести гипертрофию ЛЖ, поражение микроциркуляторного русла, ремоделирование мелких интрамуральных сосудов, обструкцию выносящего тракта (ОВТ) ЛЖ и патологию сосудов эпикарда. Гипертрофия миокарда ЛЖ, даже в условиях анатомически неизмененных КА, увеличивает чувствительность миокарда к ишемии вследствие увеличения его потребностей в кислороде. На клеточном уровне в миокарде больных ГКМП гипертрофия кардиомиоцитов и отложение коллагена в интерстиции могут приводить к сдавлению стенки сосудов [7]. Асимметрический характер гипертрофии, часто выявляемый у больных ГКМП, может приводить к нарушению синхронности сокращения миокарда, что, в свою очередь, способствует запуску ишемического каскада. Дезорганизация мышечных волокон также увеличивает потребность миокарда в кислороде за счет снижения эффективности его сокращения. Увеличение напряжения стенки миокарда вследствие патоморфологических особенностей и ишемии приводит к дополнительному снижению коронарного кровотока, что формирует порочный круг. Развитие гипертрофии миокарда, независимо от ее этиологии, ассоциировано со значительным уменьшением плотности капиллярного русла. Параллельным усугубляющим ишемию фактором становятся перфузионные нарушения на уровне микроциркуляции, что приводит к снижению коронарного резерва и клиническим проявлениям в виде синдрома стенокардии примерно у 30% больных ГКМП. Для оценки клеточной перфузии миокарда незаменимым остается метод перфузионной сцинтиграфии и ОЭКТ миокарда с 99mTc-МИБИ, поскольку данный радиофармпрепарат (РФП) проникает через мембрану интактных кардиомиоцитов и удерживается в митохондриях. Перфузионная ОЭКТ миокарда является “золотым стандартом” в диагностике преходящей ишемии миокарда, обусловленной как коронарогенными, так и некоронарогенными причинами,
Другим фактором, играющим важную роль в развитии и прогрессировании ГКМП, могут оказаться нарушения симпатической активности (СА) миокарда. Симпатическая нервная система сердца играет важнейшую роль в регуляции функции кардиомиоцитов, проводящей системы, коронарных сосудов, сократительной функции миокарда, оказывает влияние на его электрофизиологические свойства. Изучение нейрональной функции сердца у больных кардиомиопатиями, в том числе ГКМП, вызывает особый интерес, в связи с тем, что патогенез этих заболеваний окончательно не изучен. Такие характерные клинические проявления ГКМП, как гиперконтрактильность желудочков, предрасположенность к тахиаритмиям и положительный эффект лечения β-адреноблокаторами, позволяют предполагать, что в патогенезе заболевания не последнюю роль играют нарушения СА сердца.
Для оценки симпатической активности миокарда используют радионуклидные методы исследования с нейротропными РФП. Наиболее востребованный среди них - 123I-МИБГ, являющийся структурным аналогом норадреналина. Сцинтиграфия миокарда с 123I-МИБГ позволяет количественно определить общий и региональный пресинаптический обратный захват катехоламинов, их метаболизм и, косвенно, плотность распределения нейрональных симпатических окончаний и адренорецепторов в миокарде, очаговые изменения функции симпатических окончаний.
Таким образом, с учетом современных возможностей радионуклидной диагностики в оценке клеточной перфузии и симпатической иннервации миокарда, целью нашего исследования стало изучение особенностей нарушения этих процессов у пациентов с ГКМП.
Материал и методы.
В исследование включено 36 пациентов с диагнозом ГКМП, ХСН I-III ФК NYHA, находившихся на обследовании и лечении в НИИ кардиологии им. А. Л. Мясникова ФГБУ “РКНПК” МЗ РФ. Контрольную группу составили 20 добровольцев без сердечно-сосудистых, онкологических, метаболических и других соматических заболеваний, с отрицательным результатом ВЭМ-пробы. Общая характеристика обследованных больных представлена в таблице 1.
Таблица 1. Клиническая характеристика обследованных пациентов
перебои в работе сердца
* тест Манна-Уитни, ** точный тест Фишера. н. д. - недостоверно
Диагноз ГКМП был установлен по данным клинического обследования и инструментальных методов исследования, а также подтвержден при МРТ. Количественную оценку тяжести сердечной недостаточности проводили по критериям функциональных классов Нью-Йоркской Ассоциации Сердца (NYHA), а также теста 6-ти минутной ходьбы. К моменту включения в исследование больные находились на подобранной терапии, которую принимали в течение 6-12 месяцев. Всем больным, включенным в исследование (n=36), проведена оценка клинико-функционального статуса, с определением ФК ХСН с помощью теста 6-минутной ходьбы, суточное (холтеровское) мониторирование ЭКГ (ХМЭКГ), эхокардиография (ЭхоКГ) в покое. Пациентам с ГКМП и группе здоровых добровольцев (n=20) была выполнена перфузионная ОЭКТ миокарда с 99mTc-МИБИ, в покое и после пробы с физической нагрузкой, и нейротропная ОЭКТ с 123I-МИБГ, выполненной в два этапа - через 15 минут (ранняя фаза) и 4 часа (отсроченная фаза) после введения РФП, по стандартным протоколам.
Нарушения перфузии оценивались с использованием стандартных количественных параметров: суммы баллов после нагрузки (Summed Stress Score, SSS) и разностных баллов (показателя преходящей ишемии, Summed Difference Score, SDS). Нарушения общей СА оценивались с помощью параметров соотношения накопления РФП в сердце и средостении в отсроченную фазу (delayed heart/mediastinum ratio, H/Md) и скорости вымывания РФП за 4 часа (Washout Rate, WR). Нарушения региональной СА оценивались с помощью количественного параметра SMSe (Summed MIBG Score early), отражающего объем локальных дефектов СА, измеренный в раннюю фазу исследования.
Полученные результаты сравнивали у пациентов с ГКМП в подгруппах, сформированных по основным клинико-функциональным критериям: по ФК по NYHA (I ФК: n=6, II ФК: n=20, III ФК: n=10), по наличию (n=13) или отсутствию (n=23) нарушений ритма сердца (НРС) по данным ХМЭКГ, по наличию (n=7) или отсутствию (n=29) типичной стенокардии напряжения, по наличию (n=26) или отсутствию (n=10) болей в левой половине грудной клетки по типу “кардиалгии”, по степени ГЛЖ (по данным ЭхоКГ, согласно рекомендациям ASE/EAE (2006) ): начальная/умеренная (n=6) или выраженная (n=30), по наличию (n=21) или отсутствию (n=15) ОВТЛЖ, по данным ЭхоКГ, согласно рекомендациям ESC (2014).
Результаты.
В результате ВЭМ-пробы 7 пациентов достигли субмаксимальной ЧСС (проба отрицательная), среди них 6 пациентов I ФК и 1 - II ФК. 30 пациентов жаловались на одышку в результате нагрузки, у 14 пациентов отмечалась депрессия сегмента ST. У 3-х больных с III ФК отмечался синдром стенокардии. В результате у 23 пациентов II и III ФК проба была трактована как положительная, у 6 - как недиагностическая. Частота отрицательных результатов пробы была достоверно выше у пациентов с начальной/умеренной ГЛЖ (p=0. 04) и без ОВТЛЖ (p=0. 05).
При исследовании в покое распределение РФП у всех 36 больных ГКМП было неравномерным. На сериях томографических срезов отмечалась геометрическая деформация ЛЖ. Характерным для больных ДКМП было повышенное накопление МИБИ в зонах гипертрофии ЛЖ по данным ЭхоКГ, относительно которых выявлялось относительное снижение перфузии в других сегментах ЛЖ. При этом у пациентов в группе выраженной ГЛЖ суммарные индексы нарушения перфузии были достоверно выше, чем в группе начальной/умеренной ГЛЖ (p
По результатам исследования после нагрузочной пробы, патологические перфузионные карты ЛЖ (SSS>8) отмечались у 25 пациентов ГКМП (69%). В то же время признаки достоверной преходящей ишемии (SDS>4) визуализировались лишь у 12 пациентов (33%). При анализе перфузионных полярных карт не было отмечено какой-либо преимущественной локализации преходящих дефектов перфузии, в том числе и по отношению к бассейнам коронарных артерий. Параметры SSS и SDS достоверно различались в группах нормы и ГКМП (p
Распределение МИБГ в миокарде ЛЖ у всех 36 больных ГКМП было неравномерным. Наиболее частым вариантом распределения РФП было диффузное, неравномерное снижение, с примерно равной частотой появления дефектов во всех стенках ЛЖ, несколько чаще дефекты СА отмечались по перегородочной, нижней и боковой стенке ЛЖ. Также отмечалось снижение включения РФП в верхушечных сегментах, что, однако, является вариантом нормы.
Параметр H/Md, отражающий общую СА миокарда, был ниже порогового значения нормы 1. 9 у 33 пациентов ГКМП (92%), и достоверно ниже в группе больных ГКМП по сравнению с контрольной группой (p
При сопоставлении результатов нейротропной и перфузионной ОЭКТ у больных ГКМП, отмечаются достоверно более тяжелые нарушения СА, чем нарушения перфузии (рис. 5). При анализе корреляционных связей между показателями нейротропной и перфузионной ОЭКТ, отмечается прямая корреляция между суммарными баллами SMSe и SSS (r=0. 52, p=0. 002). Каких-либо закономерностей в локализациях нарушения перфузии и иннервации выявлено не было.
Известно, что ГКМП является многосиндромным заболеванием, c разнообразной клинической симптоматикой и характером течения. Учитывая протяженную цепь патологических процессов при ГКМП, которая последовательно включает генетические, морфологические, нейрогуморальные, перфузионные, анатомические, и, наконец, функциональные и клинические факторы, особый интерес представляют исследования, которые позволили бы проследить одновременно несколько компонентов этой цепи у больных ГКМП. В нашем исследовании была произведена попытка именно такого подхода к патогенезу ГКМП, поскольку спектр диагностических исследований, выполненных у данных пациентов, включал не только оценку клинических и функциональных параметров миокарда, но и анализ более тонких процессов, происходящих на уровне клеточных элементов, а именно - клеточной перфузии и активности симпатической цепи иннервации миокарда. Анализ нарушений данных процессов у больных ГКМП, и сопоставление этих данных между собой и с данными ЭхоКГ, холтеровского мониторирования, результатов нагрузочных проб, клинических данных - в данном исследовании был рассмотрен весь спектр указанных задач, являющихся звеньями одной патологической цепи.
Результаты перфузионной ОЭКТ у пациентов ГКМП в достаточной мере отличаются от картины при других сердечно-сосудистых заболеваниях, в том числе и при ГЛЖ, возникающей при гипертонической болезни. Известно, что МИБИ накапливается в миокарде пропорционально коронарному кровотоку, и, при прочих равных, пропорционально толщине стенок миокарда ЛЖ, которая в норме приблизительно одинакова для любой стенки ЛЖ (до 1. 1 см). Таким образом, распределение перфузионного РФП в норме равномерно, и усилено в зоне гипертрофии миокарда при ее наличии. Однако при ГКМП и при ГБ локализация гипертрофированных участков различна. При ГКМП характерно изолированное утолщение перегородочной стенки (рис. 6А), или верхушки (апикальная форма, рис. 6Б), реже ГЛЖ оказывается концентрической (рис. 6В), при этом отмечается характерное “сапогообразное” изменение формы ЛЖ. При ГБ чаще возникает концентрическая ГЛЖ (рис. 6Г), реже - неравномерная с преимущественным вовлечением боковой стенки (рис. 6Д), при этом подобной деформации ЛЖ не отмечается.
При сопоставлении данных перфузионной ОЭКТ, полученных в покое и после нагрузочной пробы, у больных ГКМП в целом отмечается некоторое усугубление показателей нарушений перфузии, более выраженное в подгруппах II и III ФК, а также у пациентов с выраженной ГЛЖ. Важно отметить, что тяжесть стабильных (SRS) и преходящих (SDS) дефектов перфузии достоверно не различалась в подгруппах, сформированных по наличию НРС, ОВТЛЖ, стенокардии и кардиалгии. Следует отметить, что признаки достоверной преходящей ишемии миокарда (SDS>4) отмечались лишь у 12 пациентов (33%).
При сопоставлении данных перфузионной ОЭКТ миокарда с результатами нагрузочной пробы, наиболее выраженные преходящие нарушения перфузии отмечались у пациентов с недиагностическим результатом нагрузочной пробы, которые характеризовались более тяжелым клиническим течением заболевания. Полученные нами данные подтверждают описанный в литературе тезис о целесообразности выполнения перфузионного радионуклидного исследования даже при получении недиагностического результата стресс-ЭКГ, поскольку даже в этом случае ОЭКТ, в силу своей более высокой чувствительности, может дать ответ о наличии преходящей ишемии.
Характер преходящей ишемии у пациентов с ГКМП отличается от такового при ИБС. Зоны преходящей ишемии при ИБС, как правило, по локализации соответствуют бассейнам пораженных коронарных артерий (рис. 7А). При некоронарогенных ССЗ, в том числе и при ГКМП, такого соответствия не наблюдается (рис. 7Б). При ГКМП нами не отмечено какой-либо очаговой локализации зон преходящей ишемии и преимущественного поражения какой-либо стенки ЛЖ. Можно лишь отметить, что ухудшение перфузии миокарда при нагрузочной пробе у некоторых пациентов происходило в зоне повышенного накопления РФП в покое, то есть в гипертрофированных зонах. Механизм этого явления можно объяснить сниженным резервом кровотока той коронарной артерии, которая кровоснабжает гипертрофированные зоны ЛЖ, в то время как в остальных зонах ЛЖ происходит адекватное увеличение кровотока в ответ на нагрузку. Другими словами, если при исследовании в покое “дефекты” перфузии могут быть следствием “обкрадывания” нормальных зон гипертрофированными, то при исследовании после нагрузочной пробы распределение РФП может выравниваться за счет относительного ухудшения перфузии гипертрофированных зон. В то же время наличие мелких, диффузных зон преходящей ишемии можно объяснить нарушением микроциркуляторного звена кровоснабжения миокарда в целом, и этот процесс при ГКМП, по-видимому, является системным, не связанным с какой-либо конкретной коронарной артерией.
Кроме того, известно, что при ИБС имеется тесная корреляционная связь межу положительной пробой ВЭМ и наличием ишемии миокарда при ОЭКТ. При этом при отрицательном результате пробы преходящая ишемия миокарда скорее всего не будет обнаружена, но высокая чувствительность ОЭКТ, как и в случае с недиагностической пробой, нередко позволяет увидеть начальные нарушения перфузии, не видимые при стресс-ЭКГ. Однако при ГКМП отмечается ситуация, когда из 23 пациентов с положительной нагрузочной пробой лишь у 9 преходящая ишемия миокарда по данным ОЭКТ была достоверной. При этом из 14 пациентов, у которых критерием положительной пробы была ишемическая депрессия сегмента ST, достоверная преходящая ишемия была выявлена только у 6. Необходимо также отметить, что тяжесть нарушений перфузии и преходящей ишемии не различалась в подгруппах пациентов ГКМП по наличию стенокардии или кардиалгии, в то время как при ИБС прослеживается более четкая связь между наличием клинической симптоматики, положительным результатом нагрузочной пробы и выявлением преходящей ишемии при ОЭКТ.
Все вышесказанное указывает на то, что при ГКМП положительный результат нагрузочной пробы, в отличие от ИБС, не всегда означает наличие преходящей ишемии, а сам механизм преходящей ишемии не связан напрямую с КА, а связан с последствиями гипертрофии миокарда, что также отличает его от такового при ИБС. В случае же обнаружения у пациента с ГКМП выраженной преходящей ишемии, которая не может быть объяснена вышеописанными причинами, вероятно, стоит заподозрить присоединение коронарогенных факторов.
При анализе результатов нейротропной сцинтиграфии и ОЭКТ миокарда отмечается относительно низкое включение МИБГ в миокарда у пациентов с ГКМП (рис. 8, 9).
Показатели H/Md и WR различались в подгруппах пациентов, сформированных по различным симптомам. Значения SMSe (показателя региональных нарушений СА миокарда) не различались достоверно у больных ГКМП с различным ФК и ОВТЛЖ. При этом SMSe был достоверно выше в подгруппе пациентов с НРС, что подтверждает встречающееся в литературе мнение о том, что локальные дефекты симпатической иннервации по данным ОЭКТ с МИБГ являются потенциально аритмогенными. Это обуславливает важность нейротропной визуалиции миокарда у больных ГКМП, поскольку имеются данные, что желудочковые нарушения ритма сердца являются одной из основных причин внезапной смерти этих больных. Наблюдается положительная корреляционная связь между ИММЛЖ и H/Md, WR, SMSe, что свидетельствует о более тяжелых нарушениях общей и региональной СА у больных с выраженной ГЛЖ. Более тяжелые нарушения СА были выявлены у больных с недиагностической пробой. Как уже указывалось, это, по-видимому, связано с тем, что недиагностический результат пробы был получен у больных ГКМП с наиболее тяжелым течением заболевания.
Результаты нашего исследования указывают на то, что нарушения СА миокарда у больных ГКМП более выражены по площади и глубине, чем нарушения перфузии. Значения SMSe (сумма баллов нарушений региональной СА) были достоверно выше, чем аналогично рассчитанные значения SRS и SSS (суммы баллов нарушения перфузии в покое и после нагрузочной пробы), и кроме того, между этими показателями имеется положительная корреляционная связь (SSS: SMSe - r=0. 52, p=0. 002). Таким образом, можно высказать предположение о том, что нарушения иннервации, вероятно, предшествуют появлению нарушений перфузии миокарда и являются отражением более ранней стадии заболевания, поскольку симпатические окончания более уязвимы к гипоксии и другим патофизиологическим процессам. Однако в нашем исследовании не было выявлено корреляционной связи между тяжестью преходящей ишемии и нарушениями СА. Кроме того, нам не удалось обнаружить какой-либо связи между локализацией дефектов перфузии и иннервации (рис. 10).
Наличие ОВТЛЖ не влияло на показатели ХМ-ЭКГ, ЭхоКГ, перфузионной и неротропной ОЭКТ. Лишь по данным ВЭМ у пациентов без ОВТЛЖ результат нагрузочной пробы достоверно чаще был отрицательным. Подгруппа пациентов с НРС также не продемонстрировала худших результатов ВЭМ, ЭхоКГ (за исключением несколько большей КДО), перфузионной ОЭКТ. Однако показатель SMSe, отражающий региональные нарушения иннервации, оказался у этих пациентов достоверно выше (т. е. хуже). В подгруппах пациентов со стенокардией и кардиалгией был получен несколько парадоксальный результат: в то время как параметры перфузии миокарда не отличались у пациентов с этими симптомами и без них, показатель SMSe, отражающий тяжесть региональных нарушений СА, был в этих подгруппах достоверно ниже. Это позволяет высказать предположение о том, что наличие симптомов у пациентов ГКМП является не признаком тяжелого состояния, а скорее адекватной реакцией пока еще интактных ноцицептивных цепей, сигнализирующей об ухудшении состояния у относительно сохранных пациентов.
Подводя итог вышесказанному, результаты нашего исследования указывают на различия в механизмах развития патологических процессов нарушения иннервации и перфузии у больных ГКМП, и скорее их параллельном и взаимно-потенцирующем, нежели прямом причинно-следственном протекании. Кроме того, у этих больных нередко отмечается несоответствие между морфологическими, нейрогуморальными, перфузионными, анатомическими, и, наконец, функциональными и клиническими факторами. По нашим данным, лишь степень гипертрофии миокарда может в некоторой мере быть связующим звеном в этой цепи процессов, поскольку только тяжесть ГЛЖ у пациентов в нашем исследовании была сопоставима с тяжестью нарушений перфузии и СА миокарда. В связи с этим, возникает необходимость более обширного диагностического обследования пациентов ГКМП, что позволило бы оценить вклад большего числа патологических процессов, которые имеют место у этих пациентов.
Перфузия и иннервация миокарда при ГКМП
Цель исследования: выявление особенностей перфузии и симпатической активности (СА) миокарда с помощью метода однофотонной эмиссионной компьютерной томографии (ОЭКТ) у пациентов с гипертрофической кардиомиопатией (ГКМП).
Материал и методы: в исследование включено 36 пациентов с подтвержденным диагнозом ГКМП. Всем пациентам было выполнена оценка клинико-функционального статуса (ФК ХСН по NYHA), холтеровское мониторирование ЭКГ, эхокардиографическое исследование в покое. Всем пациентам, а также группе здоровых добровольцев (n=20), выполнена перфузионная ОЭКТ миокарда с 99mTc-МИБИ в покое и после нагрузочной пробы на велоэргометре, и нейротропная ОЭКТ миокарда с 123I-МИБГ, выполненная через 15 минут (ранняя фаза) и 4 часа (отсроченная фаза) после введения РФП. Нарушения перфузии оценивались с использованием стандартных количественных параметров: суммы баллов после нагрузки (Summed Stress Score, SSS) и разностных баллов (показателя преходящей ишемии, Summed Difference Score, SDS). Нарушения общей СА оценивались с помощью параметров соотношения накопления РФП в сердце и средостении в отсроченную фазу (delayed heart/mediastinum ratio, H/Md) и скорости вымывания РФП за 4 часа (Washout Rate, WR). Нарушения региональной СА оценивались с помощью количественного параметра SMSe (Summed MIBG Score early), отражающего объем локальных дефектов СА, измеренный в раннюю фазу исследования.
Заключение: При обследовании больных с ГКМП сочетание выполнения перфузионной и нейротропной ОЭКТ миокарда имеет определенную диагностическую ценность, поскольку выявление нарушений СА является маркером наиболее раннего повреждения миокарда.
Сердечно-сосудистая система
Основы анатомии и физиологии сердечно-сосудистой системы
Основной функцией сердечно-сосудистой системы является обеспечение постоянной циркуляции крови, играющей очень важную роль в организме. Упрощенно эту систему можно представить, как замкнутую гидравлическую систему. В этой системе преимущественно циркулирует жидкость (кровь) в замкнутой системе трубок (кровеносных сосудов), благодаря работе всасывающе-нагнетательного насоса (сердца).
Кровь
выполняет много функций. С одной стороны, она снабжает ткани и органы кислородом и энергетическим сырьем, а с другой - забирает от них двуокись углерода и продукты метаболизма. Эффективная транспортировка кислорода возможна благодаря присутствию красных кровяных телец (эритроцитов, содержащих гемоглобин - пигмент крови, основной функцией которого является перенос кислорода). Кровь также играет важную роль в процессе терморегуляции, или поддержании постоянной температуры в организме, транспортирует гормоны (например, инсулин) и другие биологически активные вещества. Благодаря содержащимся в ней клеткам иммунной системы (белые кровяные тельца - лимфоциты и лейкоциты), она защищает организм от нападений болезнетворных микробов, а благодаря кровяным пластинкам (тромбоциты - они способствуют образованию тромба в поврежденном сосуде) - от кровопотери.
Сердечно-сосудистая система состоит из:
- сердца
- сосудистой системы - кровеносных сосудов (артерий, вен, капилляров)Сердце
Центральное место по значению и положению в сердечно-сосудистой системе занимает сердце. Оно представляет собой расположенный по центру грудной клетки, за грудиной, мышечный орган, выполняющий роль всасывающе- нагнетательного насоса. Оно имеет форму конуса, своей вершиной обращенного влево и вниз, а основанием - вверх. В нормальных условиях его вес составляет около 280-340 г у мужчин и 230-280 г у женщин, а его очертания напоминают человеческий кулак.
Сердце состоит из 4 частей, так называемых, камер сердца. Камеры сердца: 2 предсердия и 2 желудочка, окружены сердечными мышцами. Сердечная мышца имеет специфическое, характерное только для неё строение, совершенно отличное от строения скелетных или гладких мышц, например, кишечника. Она окружена серозной оболочкой - перикардом. Сердечная стенка состоит из следующих трех слоев (снаружи внутрь):
- эпикард - непосредственно окружает сердечную мышцу,
- миокард - построен из особой мышечной ткани,
- эндокард - одиночный слой эндотелиальных клеток
Предсердия и желудочки сердца
Сердце состоит из двух предсердий - правого и левого, а также двух желудочков - правого и левого. Предсердия меньше желудочков, а их стенки гораздо тоньше стенок желудочков. Кровь вытекает из желудочков через артерии, а попадает в предсердия по венам.
Правая и левая половины сердца не сообщаются между собой. Предсердия разделяет межпредсердная перегородка, а желудочки - межжелудочковая перегородка. Левый желудочек длиннее, а его стенки в 3 раза толще стенок правого желудочка. Предсердия и желудочки соединены между собой предсердно-желудочковыми отверстиями.
Клапаны сердца
Крупные артерии, отводящие кровь от сердца, снабжены клапанами, которые препятствуют обратному току крови. Между левым желудочком и аортой находится трехстворчатый клапан аорты, между правым предсердием и легочным стволом находится также трехстворчатый клапан лёгочного ствола. Клапаны также располагаются в местах соединения желудочков с предсердиями - в предсердно-желудочковых отверстиях - правое предсердие соединяется с правым желудочком через трехстворчатый клапан, а левое предсердие - с левой камерой через двустворчатый клапан (так называемый, митральный).
Сердечная мышца (миокард) работает практически беспрерывно (за исключением очень коротких периодов в фазе расслабления), и в связи с этим она нуждается в отдельном, высокоэффективном снабжении кислородом и питательными веществами. Соответствующую их поставку обеспечивают сердцу коронарные артерии (правая и левая, смотри рисунок 2), берущие начало сразу над клапаном аорты. Затем они оплетаю сердечную мышцу (создавая подобие короны - отсюда их название), и, делясь на мелкие ответвления, проникаю вглубь него, поставляя питательные вещества всем клеткам сердечной мышцы. Лишенная кислорода кровь возвращается по сердечным венам в правое предсердие.
В физиологическом плане сердце образует две несимметричные функциональные части:
- правое сердце, в котором циркулирует венозная кровь, качающее кровь в легочный круг
- правое сердце, в котором циркулирует артериальная кровь, качающее кровь в системный круг
В сердечно-сосудистой системе человека кровь циркулирует по двум кругам кровообращения:
- легочный круг (малый круг) правое предсердие → правый желудочек → легочная артерия (легочный ствол) → легкие → легочные вены
- системный круг (большой круг) левое предсердие → левый желудочек → аорта → артерии и артериолы → капилляры и венулы → вены → верхняя и нижняя полая вена
Обе системы отделены одна от другой, но кровь в своем полном цикле должна сначала пройти по одной, а потом по другой системе.
В легочном (малом) круге кровообращения дезоксигенированная (бедная кислородом) кровь выталкивается из правого желудочка в легочные артерии, которые, разветвляясь, образуют сеть капилляров, оплетающих альвеолы. В альвеолах происходит газообмен, двуокись углерода, растворенная в плазме, переходит в альвеолы, а кислород из альвеол переходит в эритроциты и соединяется с гемоглобином. Затем по легочным венам насыщенная кислородом кровь возвращается в левое предсердие.
В системном (большом) круге кровообращения оксигенированная (насыщенная кислородом) кровь поступает из левого желудочка в артерии, а затем, проходя через сеть капилляров во всех органах, возвращается в виде бедной кислородом крови в правое предсердие. Задачей системного (большого) круга кровообращения является снабжение тканей кислородом и питательными веществами, а также удаление двуокиси углерода и продуктов обмена веществ.
Иннервация сердца
Сердечная мышца иннервирована так называемой автономной нервной системой, деятельность которой не зависит от нашей воли. Активация симпатической системы ведет к ускорению работы сердца, а возбуждение парасимпатической системы проявляется в замедлении его работы.
Автономная нервная система
Для поддержания организма в состоянии равновесия (гомеостаза) с окружающей его средой, необходима способность к регуляции работы всех внутренних органов. За это отвечает автономная нервная система, называемая вегетативной. В её состав входят: симпатическая часть, парасимпатическая часть, а также метасимпатическая часть (действует в значительной степени независимо от первых двух). Вегетативная система обычно обеспечивает двойную симпатически-парасимпатическую иннервацию органов, таких как сердце или кровеносные сосуды, бронхи, органы системы пищеварения - желудок, печень и другие. Нервные импульсы, поступающие в органы по симпатической системе, стимулируют, либо тормозят, их деятельность, в зависимости от преобладания рецепторов данного типа в их клеточной оболочке. Главным медиатором, действующим на рецепторы в симпатической системе, является норадреналин. Действие парасимпатической системы всегда противоположно действию симпатической системы. Проще всего охарактеризовать и запомнить симпатическую систему как систему борьбы/бегства/стресса (сердце ускоряет свой ритм, учащается дыхание, бронхи расширяются, расширяются зрачки), а парасимпатическую систему - как систему отдыха, с противоположными реакциями. Ответ в вегетативной системе возникает в результате возбуждения различных типов рецепторов, из которых лучше всего изучены: альфа-1, альфа-2, бета-1, бета-2.
Сосудистая система
Сосудистая система состоит из артерий, вен, а также капилляров, соединяющих венозную систему с артериальной. Артерии - это кровеносные сосуды, по которым кровь течет из сердца, вены же подводят кровь к сердцу.
Артерии и вены состоят из трех слоев:
- внешнего - его образует соединительная ткань
- среднего - он образован гладкими мышцами и упругих волокон, окружающих просвет сосуда
- внутреннего - он состоит из волокон коллагена и упругих волокон, а также эндотелия
Артерии
Поскольку кровь поступает из сердца в артерии под большим давлением, артерии имеют более толстые стенки и обладают большей эластичностью по сравнению с венами. Самой крупной артерией является аорта, по которой кровь вытекает из сердца. По мере удаления от сердца, аорта ветвится на все более мелкие сосуды, подводящие кровь ко всем тканям и органам, и в конце концов, образует систему капилляров. Артериальная кровь имеет ярко-красную окраску, содержит большое количество кислорода, переносимого гемоглобином, содержащимся в красных кровяных тельцах (только незначительное количество кислорода растворяется в крови), и богатые энергией вещества, необходимые для жизни клеток
Вены
Венозная система берет начало от венул, в которых кровь забирает продукты метаболизма из окружающих тканей. Затем по венам всё большего диаметра она отводится в правое предсердие сердца. Венозная кровь поступает в сердце из большого круга кровообращения по двум крупным сосудам: нижней полой вене и верхней полой вене. Поскольку кровяное давление в венах очень низкое, их стенкам не требуется такая толщина и эластичность, как стенкам артерий. Кроме того, в просвете вен имеются клапаны, предотвращающие обратный ток крови. Венозная кровь, лишенная кислорода, имеет более темную окраску, она транспортирует продукты метаболизма, а также двуокись углерода (главным образом, растворенную в крови).
Система капилляров
Образована густой сетью мельчайших сосудов между системой артериальных и венозных сосудов, которые оплетают все ткани. Их стенки состоят из одного слоя клеток. Такое строение делает возможным почти непосредственный контакт крови с клетками, газообмен, передачу клетке питательных веществ и удаление продуктов обмена веществ.
Эндотелий
Тонкий, одиночный внутренний слой кровеносных сосудов - является структурой, играющей существенную роль в кровообращении и свертывании крови, в формировании атеросклероза и развитии воспалительных процессов. Он регулирует деятельность кровеносной системы, в частности, посредством контроля проницаемости стенок сосудов, влияния на структуру и формирование новых кровеносных сосудов, а также регуляции воспалительного и иммунного ответа организма. Эти функции эндотелий выполняет при помощи многих выделяемых им биологических медиаторов. К ним относятся, в частности, окись азота (NO), простациклин, вещества, участвующие в процессах свертывания. Дисфункция эндотелия играет существенную роль в развитии многих заболеваний, причем больше всего данных касается формирования атеросклеротической бляшки, которая, в конечном итоге, служит причиной инфаркта миокарда и инсульта.
ПРОБЛЕМЫ ЭЛЕКТРОКАРДИОЛОГЧЕСКОЙ ОЦЕНКИ ВЛИЯНИЯ ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ НА СЕРДЦЕ
Annotation
The correlation of the heart rate variability indices with «sympatico-parasympathetic» balance, the role of a number of electrocardiological criteria as markers of inhomogeneity of ventricular repolarization are considered.
Широко известно, что вегетативная нервная система (ВНС) играет важную роль в патогенезе заболеваний сердца, вместе с тем возможности и преимущества электрокардиологии в плане оценки этой роли все еще остаются спорным предметом.
Структурная и функциональная гетерогенность вегетативной иннервации сердца
Парасимпатическая иннервация сердца затрагивает главным образом синоатриальный и атриовентрикулярный узлы и предсердия. В состоянии покоя симпатическая активность в них низка и преобладает парасимпатическое влияние. Некоторые парасимпатические волокна иннервируют кровеносные сосуды желудочков. Миокард желудочков весьма бедно иннервирован парасимпатическими эфферентными волокнами [1, 2], и в условиях эксперимента их стимуляция проводит к инотропному эффекту только на фоне повышенной симпатической активности, но не в условиях покоя [3]. Вагусный медиатор, ацетилхолин, весьма существенно сокращает продолжительность и изменяет форму потенциала действия кардиомиоцитов предсердий, но в миоцитах желудочков он укорачивает потенциал действия только в очень высоких концентрациях - выше физиологических значений [1]. В то время как было показано, что трансмуральная дисперсия длительности монофазного потенциала действия в «клиновидном» препарате левого желудочка собаки уменьшается при симпатической стимуляции вследствие ее укорачивающего эффекта, стимуляция блуждающего нерва оказывает лишь минимальное влияние на рефрактерность желудочков [4].
В отличие от парасимпатической иннервации, симпатические волокна распределены в изобилии во всех отделах сердца в виде терминальной сетевидной структуры, которая оплетает мышечные клетки, тесно прилегая к ним, но не проникает внутрь клетки [2]. Эффект симпатического медиатора норадреналина, также как и адреналина, высвобождающегося в кровоток из мозгового вещества надпочечников, заключается в укорочении потенциала действия, и, следовательно, изменении формы фазы 2 и 3 потенциала действия (плато и конечная реполяризация). Более быстрое восстановление потенциала является предпосылкой необходимой реактивности кардиомиоцита при увеличении частоты сокращений. Катехоламины увеличивают также медленный ток кальция внутрь клетки, действуя таким путем на механическую работу и электрические свойства клетки [1].
Было высказано предположение, что волокна миокарда, непосредственно прилежащие к окончаниям эффекторных нервов, подвергаются действию относительно больших концентраций медиатора, так что различие между эффектом стимуляции нерва и внутривенной инфузией адренергических медиаторов может быть обусловлено различиями в распространении активных агентов.
Кажущаяся противоречивость результатов вышеперечисленных экспериментальных исследований [4, 5] могла бы быть объяснена гипотезой о том, что стимуляция симпатического нерва уменьшает пространственную неоднородность, но увеличивает временную дисперсию рефрактерных периодов миоцитов желудочков.
Структурная и функциональная гетерогенность вегетативной иннервации сердца, также как и ее сложный иерархический контроль, позволяет с трудом представить, что концепция «симпатико-парасимпатического баланса» имеет физиологические основы, если рассматривать сердце как единое целое.
Вариабельность сердечного ритма и «симпатико-парасимпатический баланс»
Поскольку симпатический и парасимпатический отделы ВНС могут функционировать или независимо, или как антагонисты, или как синергисты, длительность интервала R-R не содержит какой-либо информации об уровне парасимпатического или симпатического влияния на водитель ритма. Некоторая величина этого показателя может быть результатом различных комбинаций парасимпатических и симпатических входов, невозможно установить, связано ли это только с подавлением вагусной активности или является результатом смешанного симпатического и парасимпатического влияния, или обусловлено симпатическим воздействием на водитель ритма.
Сначала полагали, что подсчет спектральных мощностей интервала R-R путем расчета соотношения между мощностями низкочастотного (около 0.1 Гц) и высокочастотного (>0.15 Гц) спектров может пролить свет на эту проблему. Предполагали, что низкочастотное колебание длительности интервала R-R происходит от колебаний мышечной симпатической активности, изменяя артериальное давление (АД) и ЧСС путем ритмического высвобождения норадреналина [6, 7]. Высокочастотный спектр колебания длительности интервала R-R представлялся опосредованным колебаниями парасимпатической активности, связанными с дыханием.
Однако, аналитический обзор физиологических основ теории симпатико-парасимпатического равновесия, предложенной Экбергом [8], показал, что эта конструкция приписывает физиологическим регуляторным механизмам такие свойства, которыми эти механизмы не обладают. Так, например, не обнаружено значимой корреляции между выбросом норадреналина и спектральной мощностью интервала R-R при частоте 0.1 Гц [9], а атропин в большой дозе ликвидировал практически всю спектральную мощность интервалов R-R в низкочастотном и высокочастотном диапазонах [10, 11]. Таким образом не существует доказательства того, что исходная мощность низкочастотного спектра интервалов R-R количественно связана с активностью симпатического сердечного нерва.
Исходно связанные с частотой дыхания колебания интервала R-R значимо, но недостаточно, связаны с уровнем активности сердечной ветви блуждающего нерва. Эти изменения, связанные с выраженными колебаниями частоты и глубины дыхания, могут быть объяснены на основе кинетики ответа синоатриального узла на введение ацетилхолина: во время медленного дыхания они выражены более полно, чем при быстром дыхании [12]. Как подчеркнуто Экбергом [8], обоснование теории симпатико-парасимпатического баланса отчасти имеет философские основы; нет никаких обязательных физиологических предпосылок того, что уровни колебаний активности симпатического и блуждающего нервов должны находиться в состоянии баланса.
Эта критика не должна отвергать возможную пользу расчета соотношения LF/HF для характеристики некого состояния регуляции сердечно-сосудистой системы без связи с «симпатико-парасимпатическим балансом». Для адекватного понимания участия ВНС в многоуровневых механизмах контроля, необходимо осознать, что их исследования должны быть физиологически осмысленными.
Электрокардиологические параметры неоднородности реполяризации желудочков как показателя влияния вегетативной нервной системы
В противоположность деполяризации, реполяризация сердца не может быть описана с точки зрения распространения фронта волны, так как в этот период центры источников и каналов мембранных токов в миокарде желудочков расположены на большом расстоянии. Их пространственное и временное распределение определяется межклеточными различиями в кинетике мембранных каналов и изменениями состава межклеточного пространства, включая действие симпатических медиаторов. В результате, сегмент ST и зубец Т находятся под влиянием одних и тех же факторов. Авторитетный обзор этой проблемы опубликован Суравичем [13].
Нижеприведенные рассуждения будут касаться некоторых редко используемых, но по-видимому перспективных показателей реполяризации желудочков. Обсуждаемые в настоящее время вопросы, например, QT-дисперсия или альтернации зубца Т, не будут рассматриваться.
Зубец Т представляет собой неисчезнувшие различия потенциалов при реполяризации желудочков. Было подсчитано, что зубец Т отражает 7-8% общего объема реполяризации, а остальное взаимно аннулируется ввиду противоположного направления волн реполяризации, так что малые локальные изменения процесса реполяризации могут оказывать драматическое влияние на форму зубца Т [14].
Ранние исследования показали изменения зубца Т при гипнотическом внушении беспокойства [15], страха предстоящего хирургического вмешательства [16], во время устного счета [17], при введении адреналина [18] и допамина [19]. Следует отметить, что при эмоциональном стрессе изменения зубца Т наблюдаются только у 40-63% людей. Амплитуда зубца Т как мера симпатических влияний на миокард была представлена и в физиологических исследованиях [20, 21].
Так как количественная обработка изменений зубца Т, неодинаковых в разных отведениях ЭКГ, сложна, в качестве удобного параметра был предложен пространственный максимальный вектор Т (sT max), регистрируемый в системе физически корригированных ортогональных отведений [22, 23]. В этом исследовании, проведенном у 21 здорового лица, 42 больных с гипертрофией желудочков и 24 пациентов с ишемической болезнью сердца 92% пациентов всей выборки реагировали на ментальный стресс (устный счет) уменьшением интервала R-R, и лишь у 65% кроме того изменялся sTmax.
Выводом вышеприведенного исследования было то, что влияние ВНС на сердце изменяется у здоровых лиц в условиях незначительного эмоционального стресса (устный счет) в два этапа: на первом происходит уменьшение доминирующего тонуса блуждающего нерва, воздействующего на синоатриальный водитель ритма, отражающееся в укорочении интервала R-R; на втором - увеличение симпатической нервной стимуляции миокарда желудочков, приводящее к изменению паттерна реполяризации желудочков и отражающееся в изменениях sT max. Так как в нашем исследовании реакция практически всех лиц выражалась в некотором увеличении ЧСС, но только у 65% из них кроме того имелось уменьшение sTmax, очевидно, что индивидуальный спектр реактивности играет в данном случае некую роль, и, что он может быть правильно оценен лишь с учетом не только вариабельности сердечного ритма, но и параметров реполяризации.
В отличие от ряда других электрокардиологических показателей, индивидуальная вариабельность sT max невелика: ее величина значимо не изменяется при глубоком вдохе [24], и на межиндивидуальную вариабельность не оказывают значимого влияния антропометрические характеристики пациента. Однако, sTmax в среднем ниже у женщин [25]. В обследованной нами группе из 135 здоровых лиц обоего пола в возрасте 10-67 лет не была показана зависимость sTmax от возраста, но была отмечена его положительная корреляция с величиной интервала R-R (r=0.412, p<0.0001); а уравнение линейной регрессии было следующим:
sT max (mV)=30+0.435хR-R (мсек.).
Интересные результаты были обнаружены в недавних исследованиях на молодых мужчинах (n=155, возраст 10-35 лет): у лиц с нормальным АД средние величины sT max выше, чем у лиц, классифицированных как имеющие высокие нормальные значения АД или гипертензию I ст. по классификации JNA VI, хотя они не отличались по значениям sQRSmax.
Угол между векторами QRS и Т
Одним из последствий различия в распространении фронта активации и восстановления желудочков является различие в ориентации векторов QRS и Т. Нормальные значения пространственного угла между «полуплощадью» QRS и максимальным вектором Т при использовании системы отведений SVEC III у 50 здоровых лиц были приведены в работе Болла и Пипбергера (в среднем 56°, стандартное отклонение 18.8, разброс значений 20-105) [27]. Полученные нами значения пространственного угла между интегральными векторами QRS и STT в отведениях системы Франка у 135 здоровых лиц были отчетливо близкими: в среднем 57.5°, стандартное отклонение 29.9, разброс значений 4-143. Известно, что этот угол увеличивается при гипертрофии желудочков и связан с соотношением величины желудочкового градиента и QRS [28]. Было обнаружено, что он также увеличивается в ортостазе, после мышечной нагрузки, и после введения адреналина [29].
Интересной особенностью является увеличение этого угла при глубоком вдохе [30,31,24], что не может быть объяснено только изменением положения сердца. Этот акт (глубокий вдох) приводит к некоторому напряжению систем сердечно-сосудистой регуляции с важным участием ВНС.
Сумма абсолютных величин максимума и минимума поверхностного интегрального QRST
Информацию о свойствах реполяризации желудочков ищут, часто с помощью сложных подходов, путем анализа изоинтегральных контурных карт, полученных путем интегрирования комплексов QRS в каждом отведении на протяжении всего интервала QRST (BSIM) [34, 35]. Были получены некоторые свидетельства того, что и простое измерение амплитуды пик-основание поверхностного интеграла QRST BSIM (AmplBSIM) может использоваться для определения нарушений реполяризации [36, 37]. Следует отметить, что величины экстремумов BSIM тесно связаны с числом используемых электродов; при увеличении числа точек регистрации возрастает возможность попасть в истинный пик распределения. Таким образом, должна соблюдаться осторожность при сравнении результатов, полученных с использованием разного числа электродов.
Корреляция между sTmax, углом QRS-STT и AmplBSIM
1. Структурная и функциональная гетерогенность регуляции сердечной деятельности со стороны ВНС не позволяет охарактеризовать это состояние как «симпатико-парасимпатический» баланс.
2. Вариабельность сердечного ритма и электрокардиологический анализ паттерна реполяризации желудочков способны отразить более физиологически значимую информацию.
3. По-видимому, известные электрокардиологические показатели восстановления потенциала желудочков отражают до некоторой степени разные стороны этого процесса.
1. Katz AM: Physiology of the Heart. Raven Press, New York, 1977, p. 450.
2. Braunwald E, Sonnenblick EH, Ross J. In: Braunwald E, ed: Heart Disease. Saunders, Philadelphia, 1980, 351-392.
3. Lewy MN: Neural control of the heart. J Cardiovasc Electrophysiol 1995; 6:283-293.
4. Takei M, Sasaki Y, Yonezawa T et al. The autonomic control of the transmural dispersion of ventricular repolarization in anesthetized dogs. J Cardiovasc Electrophysiol 1999;10:981-989.
5. Han J, de Jalon PG, Moe GK: Adrenergic effects on ventricular vulnerability. Circulation Res 1964; 14:516-524.
6. Eckberg DL, Nerhed C, Wallin BG: Respiratory modulation of muscle sympathetic and vagal cardiac outflows in man. J Physiol (Lond.) 1985; 365:181-196.
7. Wallin BG, Nerhed C: Relatioship between spontaneous variations of muscle sympathetic nerve activity and succeeding changes of blood pressure in man. J Auton Nerve Syst 1982; 6:293-302.
8. Eckberg DL: Sympathovagal balance. A critical appraisal. Circulation 1997; 96:3224-3232.
9. Kingwell BA, Thompson JM, Kaye DM et al.: Heart rate spectral analysis, cardiac norepinephrine spillover, and muscle sympathetic nerve activity during human sympathetic nervous activation and failure. Circulation 1994; 90:234-240.
10. Pomeranz B, Mackaulay RJB, Caudill MA et al.: Assessment of autonomic function in humans by heart rate spectral analysis. Am J Physiol 1985; 248:H151-H153.
11. Koh J, Brown TE, Beightol LA, Ha CY, Eckberg DL: Human autonomic rhythms: vagal cardiac mechanisms in tetraplegic subjects. J Physiol (Lond) 1994; 474:483-495.
12. Saul JP, Berger RD, Albrecht P et al.: Transfer function analysis of the circulation: unique insights into cardiovascular regulation. Am J Physiol 1991; 261:H1231-H1245.
13. Surawicz B: St-T abnormalities. In Macfarlane PW, Veitch Lawrie TD, eds: Comprehensive Electrocardiology, Volume 1. Pergamon Press, New York, 1989, 511-563.
14. Burgess MJ, Millar K, Abildskov JA: Cancellation of electrocardiographic effects during ventricular recovery. J Electrocardiol 1969; 2:101-107.
15. Berman R, Simonson E, Heron W: Electrocardiographic effects associated with hypnotic suggestion in normal and coronary sclerotic individuals. J Appl Physiol 1954; 7:89-92.
16. Mainzer F: L’influence de l’anxiete sur l’electrocardiogramme: Son importance dans l’electrocardiographie pratique. Cardiologie 1958; 32:362-374.
17. Blohmke M, Schaefer H, Stelzer O et al.: Vegetative Tonisierung des Herzens wahrend geistiger Belastung, gemessen am EKG. Int Z angew Physiol einschl Arbeitsphysiol 1967; 24:182-193.
18. Mitchell JH, Shapiro AP: The relationship of adrenalin and T wave changes in the anxiety state. Am Heart J 1954; 48:323-330.
20. Matyas TA, King MG: T-wave amplitude stability during sinus arrhythmia in resting man. Physiology and Behaviour 1976; 16:115-117.
21. Furedy JJ, Helsegrave RJ, Scher H: Psychophysiological and physiological aspects of T-wave amplitude in the objective study of behavior. Pav J Biol Sci 1984;19:182-194.
23. Ruttkay-Nedecky I: Effect of emotional stress on cardiac repolarization vectors. Adv Cardiol 1978; 21:284-285.
24. Ruttkay-Nedecky I, Regecova V: Quantitative description of the cardiac electric field in held deep inspiration. In Liebman J ed: Electrocardiology’96, World Scientific, Singapore etc. 1997, 123-126.
25. Regecova V: Comparative study of the influence of somatometric variables on vectorcardiographic and body surface mapping characteristics. In: Bacharova L, Macfarlane PW eds: Electrocardiology ’97, World Scientific, Singapore, etc., 1998,182-185.
26. Ruttkay-Nedecky I, Andrasyova D, Regecova V: Noninvasive electrocardiologic indicators of ventricular sympathetic drive. Cardiology, in press.
27. Ball MF, Pipberger H: The normal spatial QRS-T angle of the orthogonal vectorcardiogram. Am Heart J 1958; 56:611-615.
28. Mashima S: Theoretical considerations on the electrocardiogram of ventricular hypertrophy. J Electrocardiol 1976; 9:133-138.
29. Jedlicka J: Verkuzung des Ventrikelgradienten in Hyperkinetischen Zustanden. In: Kowarzyk H ed: Probleme der Raumlichen Vektorkardiographie, Publ.House of the Slovak Academy of Sci, Bratislava, 1963, 137-142.
30. Simonson E, Nakagawa K, Schmitt O: Respiratory changes of the spatial vectorcardiogram recorded with different lead systems. Am Heart J 1957; 54:919-939.
31. Ruttkay-Nedecky I: Effects of respiration and heart position on the cardiac electric field. In Nelson CV, Geselowitz DB eds: The Theoretical Basis of Electrocardiology, Clarendon Press, Oxford 1976, 120-134.
32. Andrasyova D, Cizmarova E, Ruttkay-Nedecky I: Factors affecting the spatial angle between integral QRS and T vectors. In Bacharova L, Macfarlane PW eds: Electrocardiology’97, World Scientific, Singapore etc.1998, 279-282.
33. Andrasyova D, Regecova V, Cizmarova E, Ruttkay-Nedecky I: Vectorcardiographic indication of adrenergic tonus in the working myocardium. In Preda I ed: Electrocardiology’98, World Scientific, Singapore etc. 1999, 431-434.
34. Abildskov JA, Evans AK, Lux RL, Burgess MJ: Ventricular recovery properties and QRST deflection area in cardiac electrocardiograms. Am J Physiol 1981; 239:H227-H231.
35. De Ambroggi L: Body surface potential mapping as a tool for detecting arrhythmia vulnerability. In Liebman J ed: Electrocardiology’96. World Scientific, Singapore etc, 1997, 489-495.
36. Stanley ML, Grogin HR, Chin MC et al.: Body surface mapping detects regional sympathetic imbalance in canine ventricular myocardium (abst). J Am Coll Cardiol 1993; 21:53A.
37. Goldner BG, Horwitz L, Quan W et al.: Evaluation of vasovagal syncope with body surface mapping during head-up tilt-table testing. Am J Cardiol 1994; 74:1176-1179.
38. Ruttkay-Nedecky I, Regecova V: Normal variability of the gradient between maximum and minimum of the QRS area distribution. In Preda I ed: Electrocardiology’98. World Scientific, Singapore etc. 1999, 35-38.
Читайте также:
- Брови и ресницы. Красота и уход за бровями и ресницами
- Ятрогенные осложнения искусственной вентиляции легких (ИВЛ)
- Проблемы и модификации перфузии стекловидного тела при эндофтальмите
- Диагностика кисты сосудистого сплетения головного мозга по КТ, МРТ
- Типы и классификация гипоксий. Назначение кислорода при гипоксии
