Фиброэластоз эндомиокарда у детей. Признаки и диагностика фиброэластоза эндомиокарда.
Добавил пользователь Alex Обновлено: 01.02.2026
Ильина В. А.
Научный руководитель: к.м.н., доцент Воронцова С. А.
Эндокардиальный фиброэластоз - это диффузное утолщение эндокарда одной или более сердечных камер, образуемое коллагеновой либо эластической тканью. Поражение может быть изолированным или сочетаться с другими врожденными пороками сердца. Частота встречаемости колеблется от 4 до 17%, данная патология является значимой причиной младенческой смертности.
Актуальность проблемы высока, поскольку при наличии фиброэластоза эндокарда симптомы недостаточности кровообращения возникают в первые месяцы после рождения, и большинство детей погибает до двух лет жизни.
Цель исследования: определение ранних признаков фиброэластоза эндокарда.
Материалом исследования являлся анализ доступной литературы, посвященной данной проблеме.
В результате выяснилось, что этиология фиброэластоза эндокарда неясна, но существует несколько теорий его возникновения. В возникновении данной патологии большую роль играют: внутриутробная вирусная инфекция (Коксаки), гипоксия плода, наличие аутоиммунных заболеваний у матери, отягощенная наследственность.
Фиброэластоз эндокарда возможно диагностировать начиная с 14 недели беременности. Для него характерны следующие эхокардиографические признаки: утолщенные и плотные эхосигналы от эндокарда («светящийся эндокард»), дилатация предсердий, снижение ударного выброса левого желудочка, парадоксальное движение межжелудочковой перегородки. Далее, на более поздних сроках наблюдают: увеличение сердца за счет левого желудочка, утолщение миокарда левого желудочка и сферическое расширение его полости, выпячивание межжелудочковой перегородки в полость правого желудочка, снижение фракции выброса левого желудочка.
Эффективных методов консервативного лечения нет, а выполняемые паллиативные операции сопряжены с высокой послеоперационной летальностью, поэтому при выявлении эхокардиографических признаков фиброэластоза эндокарда показано прерывание беременности.
Выводы: 1) необходимо консультирование и регулярное обследование беременных из группы риска (острая или хроническая инфекция, аутоиммунные заболевания);
2) при подозрении, по данным эхокардиографии, у плода эндокардиального фиброэластоза, необходимо выполнить повторное исследование через 4 недели, с анализом систолической и диастолической функции сердца.
Фиброэластоз эндокарда ( Эндокардиальный фиброэластоз , Эндомиокардиальный фиброз )
Фиброэластоз эндокарда - это тяжелое заболевание, характеризующееся врожденным или приобретенным диффузным утолщением эндокарда одной или более сердечных камер вследствие разрастания соединительной ткани. Клинически проявляется симптомами сердечной недостаточности (тахикардия, одышка, периферические отеки) и нарушения ритма (головокружения, предобморочные состояния). Диагноз ставится на основании данных электрокардиографии, ЭхоКГ, эндомиокардиальной биопсии. В качестве лечения используются препараты для купирования сердечной недостаточности, антикоагулянтные и антиаритмические лекарственные средства. В некоторых случаях выполняется РЧА и пересадка сердца.
МКБ-10

Общие сведения
Фиброэластоз эндокарда (ФЭ, эндомиокардиальный фиброз, эндокардиальный фиброэластоз) - врожденная или приобретенная патология сердца, при которой происходит разрастание коллагеновой и эластиновой ткани в стенках эндокарда и субэндокардиального миокарда различных отделов сердца. Эндокардиальный фиброэластоз относится к группе неклассифицируемых кардиомиопатий.
Врожденный фиброэластоз часто сочетается с врожденными пороками сердца (открытым артериальным протоком, гипоплазией правого желудочка, подклапанным аортальным стенозом). Данная патология встречается с частотой 4-17 случаев на 1000 врожденных пороков сердца. Среди больных преобладают лица женского пола. Наибольшая распространенность врожденного ФЭ наблюдается в Африке, Юго-восточной Азии и Южной Америке. Эпидемиологические данные о приобретенном фиброэластозе отсутствуют.
Причины
Врожденная форма
Точная причина врожденного фиброэластоза эндокарда неизвестна. В развитии заболевания предполагается роль внутриутробной вирусной инфекции (Коксаки В, эпидемического паротита, цитомегаловирусной инфекции). Существует теория аутоиммунной природы ФЭ. Была обнаружена взаимосвязь между наличием специфических аутоантител в крови матери (антител к цитоплазматическим компонентам SS-A и SS-B) и ФЭ у новорожденных детей. Некоторые исследователи рассматривают эндокардиальный фиброэластоз как кардиальное проявление неонатальной красной волчанки.
Возможна наследственная предрасположенность. В ходе многочисленных исследований у больных ФЭ была выявлена мутация гена G4.5, регулирующего синтез коллагена и эластина и расположенного на Х-хромосоме в области Xq28.
Приобретенная форма
Возникновению вторичного фиброэластоза эндокарда способствуют некоторые заболевания сердца, при которых в тканях органа откладываются различные метаболиты:
- инфекционный миокардит;
- дилатационная, гипертрофическая кардиомиопатии;
- болезни накопления (амилоидоз, гемохроматоз, болезнь Нимана-Пика).
Патогенез
Под влиянием нескольких провоцирующих факторов, а также вследствие неизвестных причин в тканях сердца происходят следующие патологические процессы. Эндотелиальные клетки субэндокардиального слоя миокарда и эндокарда трансформируются в мезенхимальные клетки (фибробласты) и под действием фактора роста начинают синтезировать коллагеновые и эластиновые соединительнотканные волокна. Нарушенная регуляция фактора роста фибробластов усиливает степень фиброза.
В результате этого эндокард одного или нескольких отделов сердца (предсердий, желудочков) утолщается, что приводит к повышению жесткости и снижению податливости стенок сердца. Нарушается диастолическая функция, т. е. ухудшается наполнение сердечных камер кровью в период диастолы (расслабления сердца). Возникают гемодинамические нарушения - повышается внутрипредсердное и внутрижелудочковое давление и давление в сосудах малого круга кровообращения, снижается систолическое артериальное давление. Развивается расширение полостей сердца, формируются пристеночные тромбы. Разрастание соединительной ткани в области перегородок нарушает функцию проводящей системы.
Патологоанатомические изменения включают склероз и обызвествление эндокарда, утолщение и укорочение сухожильных хорд и гипертрофию мышечных волокон, особенно выраженную в области папиллярных мышц. Характерны дегенерация атриовентрикулярного узла и диффузное скопление в миокарде иммуноглобулинов класса G и Т-клеточных инфильтратов.
Классификация
По происхождению различают первичный (врожденный) и вторичный (приобретенный) фиброэластоз эндокарда. Врожденный ФЭ подразделяется на изолированный и с сопутствующими органическими поражениями сердца (врожденными пороками). По преимущественной локализации фиброза выделяют:
- ФЭ левого желудочка. Данная форма встречается наиболее часто. Может протекать со значительным увеличением объема желудочка (дилатированный тип) или, наоборот, с его уменьшением (контрактильный тип).
- ФЭ правого желудочка. Крайне редкая разновидность фиброэластоза. Процесс может распространяться на правое предсердие.
- ФЭ в области верхушек желудочков. В этом случае ФЭ классифицируется как болезнь Девиса (гиперэозинофильная эндомиокардиальная болезнь). Типично образование пристеночных тромбов в желудочках.
Симптомы фиброэластоза эндокарда
Врожденная форма характеризуется тяжелым быстропрогрессирующим течением, манифестирует в течение первого года жизни. Родители начинают обращать внимание на вялость ребенка, плохое сосание или полный отказ от грудного кормления. Кожные покровы приобретает бледный оттенок, наблюдается низкая прибавка в весе и постоянные респираторные инфекции. Затем присоединяются признаки застойной сердечной недостаточности - увеличение частоты дыхания и сердцебиения, цианоз (синюшность) губ и кончиков пальцев, гепатомегалия.
Приобретенным ФЭ страдают, как правило, взрослые. Клиническая картина разворачивается постепенно. Вначале возникают одышка, учащение сердцебиения, повышенная утомляемость при минимальных физических нагрузках. Далее появляются отеки лодыжек и нижней части голеней, тяжесть и боли в правом подреберье из-за увеличенной печени. Симптомы нарушений ритма сердца обычно протекают в виде приступов. Они включают головокружение, потемнение в глазах и обмороки.
Осложнения
Врожденная форма ФЭ часто осложняется жизнеугрожающими состояниями, требующими немедленного медицинского вмешательства. К ним относятся тромбоэмболии головного мозга и мезентериальных сосудов, острая сердечная недостаточность (кардиогенный шок, отек легких) и остановка сердца вследствие полной атриовентрикулярной блокады.
При вторичном ФЭ фиброзный процесс распространяется на сердечные клапаны, что практически всегда приводит к формированию пороков сердца (митрального стеноза, аортальной недостаточности и др.), а в дальнейшем ‒ к легочной гипертензии. Редкими осложнениями считаются инфаркт миокарда и выпот жидкости в брюшную, перикардиальную, плевральную полости. Точные статистические данные о развитии конкретных осложнений отсутствуют.
Диагностика
Курацией пациентов с врожденным ФЭ занимаются педиатры, детские кардиологи и неонатологи. Больных вторичной формой ФЭ ведут специалисты-кардиологи. При физикальном осмотре обращают на себя внимание увеличенный живот, колбовидное утолщение концевых фаланг пальцев кисти (симптом барабанных палочек), гепатоюгулярный рефлюкс (набухание шейных вен при надавливании на правое подреберье). При аускультации сердца и легких выслушиваются глухость сердечных тонов, ритм галопа и влажные мелкопузырчатые хрипы. Решающими в диагностике ФЭ являются следующие методы:
- Электрокардиограмма. На ЭКГ наблюдаются атриовентрикулярная блокада (АВ-блокада) I, II и III степени, синдром Фредерика (сочетание полной АВ-блокады и фибрилляции предсердий). Часто обнаруживаются признаки синдрома Вольфа-Паркинсона-Уайта, или WPW (укорочение интервала P-Q, удлинение и деформация комплекса QRS, наличие дельта-волн), гипертрофии предсердий и желудочков.
- Рентгенография. На рентгенограммах ОГК отмечается кардиомегалия (увеличение размеров сердца), шаровидная форма сердца при дилатированном ФЭ и трапециевидная при контрактильном ФЭ. Типична картина легочной гипертензии - выбухание и удлинение ствола легочной артерии, расширение тени корней легких, усиление легочного рисунка.
- Эхокардиография. На ЭхоКГ видны следующие изменения - дилатация полостей сердца, выраженная эхопозитивность эндокарда (уплотнение и утолщение стенок), снижение сократительной способности миокарда. При наличии врожденных или приобретенных пороков сердца имеется повреждение клапанов и перегородок, повышение давления в системе легочной артерии. Проведение ЭхоКГ плода позволяет диагностировать фиброэластоз эндокарда еще во внутриутробном периоде с 14-й недели беременности.
- Гистологические исследования. Эндомиокардиальная биопсия выполняется крайне редко и только при сомнительных результатах предыдущих исследований. При микроскопии морфологических препаратов выявляются гипертрофия, фрагментация и вакуолизация мышечных волокон в субэндокардиальных отделах и в области сосочковых мышц. Характерны фиброз, гиалиноз эндокарда и миокарда, гибель кардиомиоцитов.
Дифференциальная диагностика
Фиброэластоз эндокарда следует дифференцировать с другими врожденными кардиальными патологиями, такими как аномальное отхождение левой венечной артерии от легочного ствола и врожденный кардит. Также ФЭ необходимо отличать от заболеваний сердца инфекционной этиологии (вирусный миокардит, инфекционный эндокардит, острая ревматическая лихорадка) и метаболических расстройств (мукополисахаридоз, гликогеноз).
Лечение фиброэластоза эндокарда
Консервативная терапия
Этиотропной терапии не существует. Все пациенты подлежат обязательной госпитализации в кардиологический стационар, а при тяжелом состоянии - в отделение реанимации и интенсивной терапии. Эффективных методов лечения врожденной формы ФЭ в настоящее время не разработано. Для патогенетического лечения приобретенного ФЭ используют лекарственные препараты, замедляющие прогрессирование сердечной недостаточности - ингибиторы АПФ (периндоприл, эналаприл), блокаторы бета-адренергических рецепторов (бисопролол, метопролол) и антагонисты минералокортикоидных рецепторов (спиронолактон). Для предотвращения тромбообразования назначаются антикоагулянты (варфарин, гепарин).
Для купирования приступов аритмии (синдрома WPW), нарушающих гемодинамику, применяют вагусные пробы (массаж каротидного синуса, проба Вальсальвы), аденозинтрифосфат, блокаторы медленных кальциевых каналов (верапамил). При неэффективности этих мер для восстановления синусового ритма прибегают к наружной электрической кардиоверсии или чреспищеводной электрокардиостимуляции. В дальнейшем пациенты должны постоянно принимать антиаритмические препараты.
Хирургическое лечение
В случае резистентности к лекарственной терапии и частого возникновения приступов проводится радиочастотная абляция. При выявлении АВ блокады II или III степени показана установка искусственного водителя ритма (электрокардиостимулятора). Единственным радикальным методом лечения считается трансплантация сердца. Она выполняется при безуспешности консервативной терапии и критическом состоянии пациента.
Прогноз и профилактика
Врожденный ФЭ является тяжелым заболеванием с крайне неблагоприятным прогнозом. Подавляющее большинство детей (более 90%), рожденных с этой патологией, погибают в течение первых двух лет жизни от явлений недостаточности кровообращения. Основная профилактика состоит в ранней пренатальной диагностике и прерывании беременности по медицинским показаниям. Приобретенный фиброэластоз, по сравнению с врожденным, имеет более доброкачественное течение. Летальный исход от сердечной недостаточности, тромбоэмболических осложнений, остановки сердца вследствие нарушений ритма наблюдается примерно в 25-30% с лучаев. Профилактика заключается в лечении основного заболевания, на фоне которого развивается ФЭ.
4. Первичное утолщение эндокарда в раннем детском возрасте/ Кнолле Х.// Архив патологической анатомии - 2010- №7.
Возможности фетальной ультразвуковой кардиологии в диагностике фиброэластоза эндокарда

Революционные изменения в экспертной диагностике. Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
Фиброэластоз эндокарда - это диффузное утолщение эндокарда одной или более сердечных камер, образуемое коллагеновой либо эластической тканью. Поражение может быть изолированным или сочетаться с другими врожденными аномалиями сердца, являясь причиной врожденных нарушений ритма сердечных сокращений. Первое описание относится к XVIII веку (Lancusi, 1740). По литературным данным, частота колеблется от 4 до 17 % (Банкл Г., 1980) [I].
Этиология патологии неясна. В настоящее время по многим гипотезам среди наиболее вероятных причин называют воспалительные процессы под воздействием вируса Коксаки - свинки. К возможным причинам также относят коллагеновые заболевания, аутоиммунность, врожденные обменные нарушения, затруднение лимфооттока (Schryer M.J., Karnauchow P.N., 1974) [2]. Наследственность также является предметом обсуждения, поскольку имеются случаи наследственной передачи заболевания по аутосомно-рецессивному типу или X-сцепленному типу наследования (Chen S. et al. 1971 [3], Westwood M. et al, 1975) [4].
Фиброэластоз эндокарда чаще поражает левые отделы сердца. В соответствии с размерами левого желудочка он подразделяется на два типа: дилатированный, наиболее частый, при котором левый желудочек увеличен в размерах и гипертрофирован, и контрактильный, при котором размеры левого желудочка нормальные или даже уменьшены. Степень фиброза миокарда бывает различна (Hastreiter A.F., 1968) [5].
Экстракардиальные аномалии редко сочетаются с фиброэластозом эндокарда.
Материалы и методы
В отделении функциональной диагностики Научного центра акушерства, гинекологии и перинатологии РАМН ежегодно проходят скрининговое исследование более 2000 беременных. Фиброэластоз эндокарда был выявлен в 3 случаях в изолированном виде (дилатированный тип - 2 пациентки и контрактильный - 1 случай) и в 7 наблюдениях в сочетании с врожденными пороками сердца. По отношению к общему числу диагностированных врожденных аномалий сердечно-сосудистой системы патология составила 2,7%.
Наиболее часто фиброэластоз наблюдался при патологии левого сердца: стенозе и коарктации аорты, синдроме гипоплазии левого желудочка, врожденном митральном стенозе и при парашутообразном митральном клапане. Кроме того, имелось сочетание стеноза легочной артерии и трикуспидальной атрезии с фиброэластозом эндокарда.
Исследования проведены на ультразвуковых приборах с высокой разрешающей способностью с использованием трансдюсеров 3,5 и 5,0 МГц. Использованы следующие модификации метода: В-сканирование, М-метод, цветное допплеровское картирование потока, допплерография.
Результаты
При скрининговом исследовании в 3 наблюдениях у молодых первобеременных при минимальном сроке гестации 24 недели выявлены одинаковые изменения сердца плода. Отмечалось значительное увеличение размеров сердца за счет левого желудочка с шарообразной его конфигурацией. Верхушка сердца полностью сформирована левым желудочком. Миокард левого желудочка утолщен и полость сферически расширена, при этом межжелудочковая перегородка выпячивается в полость правого желудочка (рис. 1).
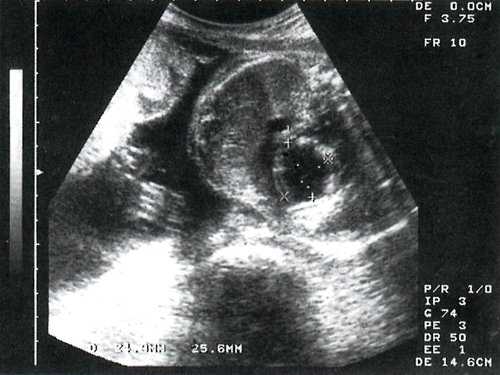
Рис. 1. Эндокардиальный фиброэластоз у плода в 26 недель гестации. Четырехкамерное сечение сердца плода.
Сосочковые мышцы также уплотнены. В качестве ультразвукового признака, который не отмечается ни при какой-либо другой аномалии сердца, было обращено внимание на признак "светящегося" эндокарда - плотного и блестящего, степень отражения от которого наблюдается и при незначительном уменьшении усиления ультразвукового луча.
Сократимость миокарда левого желудочка значительно изменена: амплитуды сокращения и диастолического расслабления представлены практически в виде прямой линии (рис. 2).
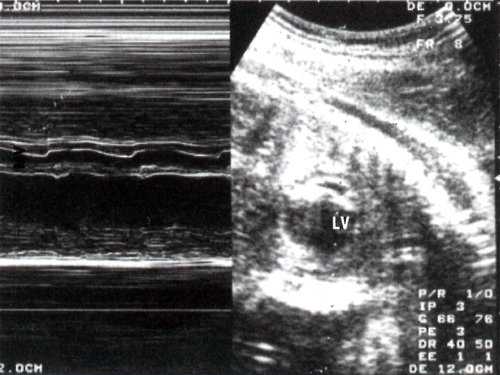
Рис. 2. В и М-сканирование на уровне поперечного сечения левого желудочка сердца плода 24 недель гестации . Отмечается значительное уменьшение амплитуды раскрытия створок митрального клапана. LV - увеличенный левый желудочек.
Степень раскрытия створок (3 мм) и кровоток через митральный клапан значительно уменьшены (рис. 3).
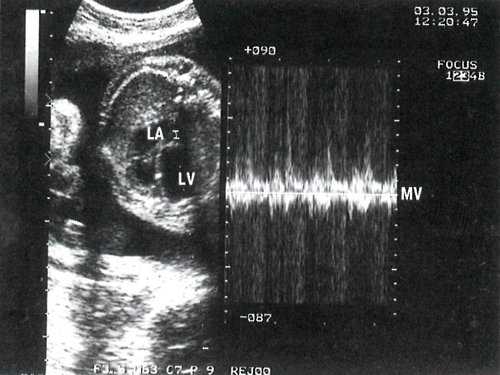
Рис. 3. В-сканирование на уровне четырехкамерного сечения и допплеркардиография потока через митральное отверстие. Контрольный объем расположен под створками митрального клапана. LA - левое предсердие.
В отличие от митрального клапана, кровоток через трикуспидальный клапан увеличен. Выявляется также трикуспидальная регургитация (рис. 4).
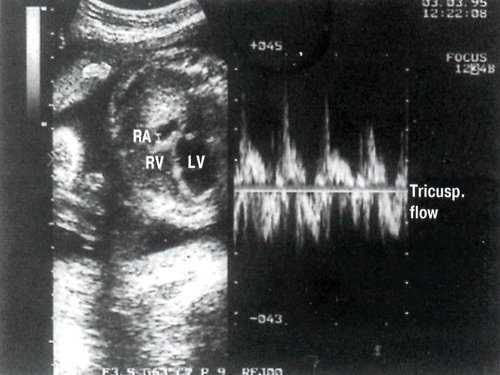
Рис. 4. В-сканирование четырехкамерного сечения сердца плода и оценка кровотока через трикуспидальный клапан. Контрольный объем в полости правого предсердия. LV - левый желудочек. RV - правый желудочек.
Следует отметить, что ни в одном из наблюдений изолированной формы фиброэластоза эндокарда сердечной недостаточности у плода не отмечалось.
На основании полученных данных, свидетельствующих о выраженных нарушениях функции сердца, резком нарушении сократимости миокарда левого желудочка, значительной ультразвуковой плотности миокарда, круглой форме увеличенного левого желудочка и прогибании его в полость правого желудочка, "светящемся" характере миокарда и уменьшении кровотока через митральное отверстие, было высказано предположение о наличии изолированной формы фиброэластоза эндокарда.
Беременность у всех пациенток была прервана. Данные аутопсии подтвердили предполагаемый диагноз антенатального ультразвукового исследования.
В литературе имеются описания единичных случаев предположительного диагноза фиброэластоза эндокарда. Диагноз был поставлен окончательно после рождения ребенка при наличии признаков застойной сердечной недостаточности (Allan L. et al., 1981) [6]. Авторы, описавшие ультразвуковые признаки фиброэластоза, обращали внимание на контрактильные способности миокарда (Bovicelli L. et al., 1984) [7], учитывали индекс укорочения передне-заднего размера желудочков по формуле, предложенной для кардиологии взрослых (Feigen-baum H., 1976) [8].
Безусловно, антенатальная диагностика фиброэластоза основывается в значительной степени на нарушении сократимости миокарда и плотности эндокарда. По нашим данным, наиболее характерным является плотность эндокарда, достигающая нескольких миллиметров, эхопозитивность структуры эндокарда и "светящийся" эндокард (см. рис. 1). В зависимости от формы полость может быть расширена и представлять классический вариант патологии - неподвижные стенки, блестящий плотный эндокард и выпячивание межжелудочковой перегородки в сторону правого желудочка, т.е. шарообразная форма левого желудочка.
Отсутствие сердечной недостаточности при столь выраженных нарушениях со стороны сердца плода можно объяснить значительной дилатацией левого желудочка, так как при любом увеличении объема крови требуется меньшая внутренняя экскурсия стенки расширенного желудочка, и нормальный ударный объем достигается меньшей силой сокращения по сравнению с нормой, тем более, что основной нагрузке антенатально подвержен правый желудочек.
Представленные наблюдения являются иллюстрацией антенатальной ультразвуковой диагностики изолированной дилатированнной формы фиброэластоза эндокарда левого желудочка.
При наличии фиброэластоза эндокарда показано прерывание беременности, поскольку симптомы недостаточности кровообращения возникают в первые месяцы после рождения и большинство детей погибает до двух лет жизни.
Таким образом результаты наблюдений подтверждают значимость ультразвуковой диагностики в выявлении таких редких врожденных аномалий сердца у плода, как фиброэластоз эндокарда, что позволяет определить акушерскую тактику ведения беременных и априори способствовать уменьшению неонатальной смертности.
Литература
- Г. Банкл. Врожденные пороки сердца и крупных сосудов. - М.: Медицина, 1980.
- Schryer M.J.P., Karnauchow P.N. Endocardial fibroelastosis. - Am. Heart J. - 1974. - v.88. - p.557.
- Chen S., Thompson M.W., Rose V. Endocardial fibroelastosis: Family studies with special reference to counselling. - J.Pediatr., 1971.-79.-385.
- Westwood M., Hariss R., Burn J. et al. Heredity in primary endocardial fibroelastosis. - Br. Heart J. 1975. - 37. - 1077.
- Hastreiter A.F. Endocardial Fibroelastosis. In: Heart Disease in Infants, Children and Adolescents. Moss-Adams,Williams and Vilkins Co., Baltimore, 1968.
- Allan L., Litlle D., Campbell S., Whitenead M. Fetal ascites associated with Congenital Heart Disease: Case Report. Brit J. of Obstetrics and Gynecology 1981. - v.88. -p.453-455.
- Bovicelli L., Picchio F.M., Piu G. et al. Prenatal diagnosis of endocardial fibroelastosis. - Pren. Diagn. - 1984. - 4.-67.
- Feigenbaum H. Echocardiography. Philadelfia, 1976.
- Rustico M.A., Benettoni A., Bussani R., Maieron A. et al. Early fetal endocardial fibroelastosis and critical aortic stenosis: A case report // Ultrasound Obstetr. Gynecol. - 1995. - v.5. - p. 202-205.
УЗИ аппарат RS85
Фиброэластоз эндокарда и перспектива его лечения
Актуальность: фиброэластоз эндокарда (ФЭ) - разновидность неинфекционной фетопатии - является достаточно тяжёлой патологией, к тому же часто сочетается с другими аномалиями ССС, диагностика которых на сегодняшний день стала более совершенной. Именно поэтому необходимо проводить скрининг и мониторинг всех новорождённых с патологиями ССС. Частота ФЭ составляет 1:70000 новорожденных.
Цель: изучить и проанализировать литературные данные для выявления методов лечения данной патологии.
Анализ позволил выявить роль воспалительного и инфекционного процессов, что приводит к нарушению развития эндокарда и недостаточности его кровоснабжения. Большое значение в нарушении тканевого морфогенеза имеет гипоксия и генетический фактор: аутоиммунные процессы и коллагеновые заболевания.
В результате нарушения тканевого морфогенеза сердце увеличивается в 2,5-4 раза по сравнению с нормой за счет значительной гипертрофии преимущественно левого желудочка (ЛЖ), эндокард его резко утолщается, беловато-желтого цвета. Однако эндокард и других отделов сердца может также поражаться. В половине случаев отмечаются утолщение и деформация митрального и аортального клапанов. Иногда ФЭ комбинируется с врождёнными пороками сосудов, чаще с коарктацией аорты. Всё указанное выше способствует снижению сократительной способности миокарда.
УЗИ позволяет диагностировать ФЭ еще у плодов в возрасте 20 недель гестации. Повторные УЗИ плодов показывают постепенную эволюцию полости ЛЖ — от ее дилатации до образования маленькой полости с очень толстой стенкой. Такие изменения подтверждаются на аутопсии при отсутствии у плодов других аномалий развития сердца.
Лечение направлено на купирование сердечной недостаточности и профилактику сопутствующих инфекций. Терапия носит симптоматический характер и зависит от степени нарушений гемодинамики. Применяется поддерживающая терапия сердечными гликозидами и диуретиками. Применение сердечных гликозидов длительное, в течение нескольких месяцев, иногда и более года, что может вести к уменьшению степени утолщения эндокарда.
Большинство новорожденных с явлениями острой застойной сердечной недостаточности при ФЭ погибают. У детей с хроническим течением ФЭ смертность составляет 30-40% вследствие рефрактерной сердечной недостаточности.
Наиболее перспективным является оперативное вмешательство по пересадке сердца. Однако законодательная база в настоящее время в этом направлении не разработана.
ЧТО СКРЫВАЕТСЯ ЗА ДИАГНОЗОМ «ФИБРОЭЛАСТОЗ» У МЛАДЕНЦЕВ?
В структуре кардио-васкулярной патологии новорожденных и грудных детей 65-70% составляют врожденные пороки сердца (ВПС). Основанием для направляющего диагноза ВПС в подавляющем большинстве случаев является выслушиваемый шум в сердце. При отсутствии отчетливых аускультативных изменений кардиомегалия, выявляемая по данным рентгенографии грудной клетки, является основанием для направления ребенка в стационар с диагнозами: «фиброэластоз» и «врожденный кардит».
Цель работы: на основании комплексного обследования 70 детей первого года жизни и анализа 52 аутопсий проведение дифференциальной диагностики и определение нозологической принадлежности поражений миокарда у детей данной возрастной группы, направляемых в Перинатальный кардиологический центр с диагнозом: «фиброэластоз».
Строение миокарда у новорожденных детей имеет свои особенности:
а) меньшее количество миофибрилл, что делает мышечное волокно тонким со слабо выраженной исчерченностью;
б) преобладание b-изомера миозина с относительно низкой АТФ-азной активностью и функцией Са-каналов;
в) меньшее количество митохондрий;
г) сниженная активность ферментов митохондрий, участвующих в метаболизме свободных жирных кислот (карнитиновая недостаточность);
д) большой объем стромы сердца с низким содержанием эластических волокон.
Вышеперечисленные особенности сократительного миокарда новорожденного ребенка обуславливает меньшую, чем в другие возрастные периоды, его инотропную активность и склонность к быстрому развитию дезадаптивного ремоделирования в виде дилатации камер сердца с формированием сферической, «шаровидной» формы миокарда, развитием эксцентрической гипертрофии левого желудочка и относительной недостаточностью атрио-вентрикулярных клапанов. Нарушенная геометрия желудочков является гемодинамически невыгодной и создает основу для быстрого развития сердечной недостаточности. Ведущее значение в формировании дезадаптивного ремоделирования с развитием фибро-склеротических процессов придается ренин-ангиотензин-альдостероновой системе (РААС), особенно ее тканевому звену (ген АПФ, ангиотензин 2 и альдостерон), а также норадреналину, запуск которых осуществляется миокардиальным стрессом любой этиологии. В стимуляции пролиферативных процессов возможно участие пептидных факторов роста, свободных радикалов; обсуждается теория экспрессии фетальных генов с подавлением функции нормальных генов, ответственных за синтез специфических белков миокарда, сопровождающаяся потерей миоцитов как путем некроза, так и путем апоптоза.
Для оценки реальной возможности участия РААС в формировании пролиферативных процессов, степени ее зрелости и вкладе в регуляцию кровообращения нами впервые предпринято исследование по определению у новорожденных и грудных детей циркулирующего звена РААС путем определения содержания ангиотензина, альдостерона и вазопрессина как в норме, так и при патологии сердечно-сосудистой системы с помощью диагностических наборов фирм DSL, Buhlmann Laboratories AG. Получены данные о высоком содержании ангиотензина 2 и альдостерона у новорожденных детей, отмечена динамика в зависимости от прогрессирования сердечной недостаточности, что свидетельствует о зрелости РААС у новорожденных и грудных детей, способной выполнять как компенсаторную, так и патологическую роль с участием в процессах дезадаптивного ремоделирования миокарда и формирования фиброэластоза у младенцев, представляющего диффузное утолщение эндокарда одной или более сердечных камер, образуемого коллагеновой или эластической тканью.
Комплекс дифференциально-диагностических мер позволил выделить следующие патологические состояния, которые приводят к морфо-функциональным изменениям миокарда у новорожденных и грудных детей, маскируясь под диагнозы кардита и фиброэластоза с назначением противовоспалительного лечения:
1. Врожденные пороки сердца, не имеющие выраженной аускультативной симптоматики. Изолированная резко выраженная коарктация аорты наиболее часто приводит к диагностическим ошибкам в связи с наличием резкой дилатации левого желудочка, снижением его контрактильности и отсутствием навыка по определению пульсации на бедренных артериях.
2. Постгипоксический синдром дисадаптации сердечно-сосудистой системы в виде транзиторной дилатации или гипертрофии миокарда. Клиническая картина характеризуется умеренной кардиомегалией, снижением сократимости и нарушением процессов реполяризации миокарда, повышением изофермента МВ-КК, неврологическими эквивалентами перенесенной гипоксии, аритмиями, иногда симптомами недостаточности кровообращения на фоне отягощенного акушерско-гинекологического анамнеза матери с частым выявлением у нее персистирующего инфекционного процесса. Вышеперечисленные симптомы часто служат основанием для диагностики врожденного кардита. Транзиторность, доброкачественность выявленных нарушений с последующим катамнестическим наблюдением за состоянием пациента способствуют правильной оценке выявленных нарушений.
3. Медикаментозно-обусловленные морфо-функциональные повреждения миокарда: а) депрессивное действие на контрактильность миокарда плода и новорожденного средств, применяемых для наркоза при родоразрешениии путем кесарева сечения; б) тахикардия плода с нарушением сократимости вследствие приема токолитиков (тербуталин, ритодрин, партусистен), применяемых при угрозе прерывания беременности; в) развитие гипертрофии сердечной мышцы на фоне антенатального приема беременной женщиной или постнатального приема новорожденными детьми глюкокортикоидов (дексаметазон), применяемых с целью коррекции гормонального дисбаланса у женщины, а также профилактики РДС-синдрома и внутрижелудочковых кровоизлияний. Процесс чаще обратим.
4. Диабетическая фетопатия с развитием симметричной гипертрофии миокарда и межжелудочковой перегородки (МЖП), либо изолированной гипертрофии последней. Генез обусловлен анаболическим эффектом инсулина, вызывающем гипертрофию и гиперплазию кардиомиоцитов путем воздействия на инсулиновые рецепторы миокарда с последующим повышением синтеза протеинов. Толщина МЖП может достигать 14 мм (при норме 3-5 мм у новорожденного ребенка). Прогноз чаще благоприятен и при уменьшении количества инсулиновых рецепторов после рождения наступает регресс гипертрофии.
5. Аномальное отхождение левой коронарной артерии (синдром Бланда-Уайта-Гарленда). Знание ЭКГ-признаков данного синдрома является опорным моментом для правильной постановки диагноза.
6. Аритмогенная дисфункция миокарда, которая у детей первого года жизни сопровождается значитель ным снижением сократимости, миоцитолизом и симптомами сердечной недостаточности. Трудности в интерпретации вызывают случаи, не связанные с ВПС, но обусловленные постгипоксическим синдромом дисадаптации, гистиоцитоидной кардиомиопатией (КМП), неонатальным волчаночным синдромом, пороками развития проводящей системы сердца.
7. Генетически обусловленная патология: а) семейные формы КМП; б) факоматозы (нейрофиброматоз, туберозный склероз Бурневиля-Прингла); в) болезни обмена веществ (митохондриальная патология, болезнь Помпе); г) врожденные миопатии и прогрессирующие мышечные дистрофии; д) четко очерченные, а также недифференцированные генетические синдромы. В частности, необходимо помнить о генетическом синдроме Беквита-Видемана, сопровождающемся достаточно выраженной гипертрофией миокарда левого желудочка и МЖП. Наличие совокупности определенных диагностических признаков позволяет правильно сориентироваться в диагнозе.
8. Рестриктивная кардиомиопатия, редко встречающаяся на Европейском континенте.
9. «Идиопатические» варианты КМП, являющиеся следствием впервые возникших генных мутаций. Идентификация генетических маркеров напрямую связана со степенью развития высоких молекулярно-генети ческих технологий. Так, в ряде работ установлена связь DD-генотипа гена АПФ с идиопатической ДКМП. Прогноз в этих случаях обуславливается степенью пенетрантности и экспрессивности патологических генов.
10. Врожденный кардит - редкий диагноз, о котором можно думать при наличии у новорожденного выраженных клинических симптомов генерализованного инфекционного процесса с тяжелым состоянием ребенка при наличии достоверного лабораторного подтверждения.
11. Перенесенное интеркуррентное заболевание может стать причиной инфекционно-токсической кардиопатии, реже - приобретенного кардита, а также явиться триггерным фактором для манифестации кардиомиопатического процесса у ребенка грудного возраста. Наличие «ножниц» между клиническим улучшением на фоне проводимой терапии и сохраняющимися изменениями на ЭКГ в виде нагрузки на предсердия, удлинение QT, косвенно указывающее на формирование фиброза, низкую фракцию выброса левого желудочка по данным ЭХОКГ будет свидетельствовать в пользу последнего.
ВЫВОДЫ
- Болезни миокарда у детей первого года жизни представляют собой гетерогенную группу, требующую для постановки правильного диагноза всестороннего обследования, тщательного анализа полученных данных и катамнестического наблюдения за пациентом.
- Отмечается преобладание вторичных форм поражения миокарда.
- Диагноз «идиопатического» поражения миокарда является вынужденным при невозможности установить причину болезни на данном этапе.
- Интерпретация результатов обследования на оппортунистические инфекции не должна строиться с акцентом на сами инфекционные агенты, а в большей степени должна учитывать аномальные ответы на них и те генетические факторы, которые реализуют эти ответы.
- Целесообразно включение в план этапного наблюдения за здоровым ребенком на первом году жизни проведение ЭКГ в возрасте трех месяцев с целью выявления скрытых морфо-функциональных изменений миокарда в максимально ранние сроки.
- Фиброэластоз эндокарда, выявленный у 53% больных, умерших на первом году жизни от различной кардио-васкулярной патологии является вторичным морфологическим понятием, формирующемся как неспецифическая реакция эндокарда в ответ на миокардиальный стресс любой этиологии, не является заболеванием и не может фигурировать в качестве направляющего диагноза. По сути дела, это финал патологического пути, проделанного генетически слабым сердцем, преодолевавшем гемодинамические, гипоксически-ишемические и инфекционные преграды. Основанием для его подтверждения при жизни ребенка может служить эндомиокардиальная биопсия.
Российский Научно-Практический
рецензируемый журнал
ISSN 1561-8641
Читайте также:
