Формирование протока поджелудочной железы. Этапы развития поджелудочной железы
Добавил пользователь Владимир З. Обновлено: 28.01.2026
, pancreas. Расположена поперечно на уровне L1 - L2. Имеет длину 13 - 15 см и лежит забрюшинно. Рис. А, Рис. Б.
Головка поджелудочной железы
Крючковидный отросток
, processus uncinatus. Часть головки, которая огибает верхние брыжеечные сосуды сзади. Рис. А, Рис. Б.
Вырезка поджелудочной железы
, incisura pancreatis. Расположена между крючковидным отростком и остальной частью головки поджелудочной железы. Рис. А, Рис. Б.
Тело поджелудочной железы
, сorpus pancreatis. Локализуется преимущественно спереди позвоночного столба. Развивается из дорсальной закладки поджелудочной железы. Рис. А, Рис. Б.
Передняя поверхность
Задняя поверхность
Нижняя поверхность
, facies inferior. Обращена вперед и вниз. Сверху ограничена корнем брыжейки поперечной ободочной кишки. Рис. А.
Верхний край
Передний край
, margo anterior. Соответствует линии прикрепления брыжейки поперечной ободочной кишки (178.5). Является нижней границей сальниковой сумки на задней стенке брюшной полости. Рис. А.
Нижний край
Сальниковый бугор
Хвост поджелудочной железы
Капсула поджелудочной железы
Экзокринная часть поджелудочной железы
Дольки поджелудочной железы
Проток поджелудочной железы
, ductus pancreaticus. Главный экскреторный проток железы, открывается отверстием на большом сосочке двенадцатиперстной кишки вместе с общим желчным протоком. Рис. Б.
Сфинктер протока поджелудочной железы
, m. sphincter ductus pancreatici. Циркулярная мышца, расположенная перед отверстием протока. См. с.135, Рис. А.
Добавочный проток поджелудочной железы
, ductus pancreaticus accessorius. Открывается на малом сосочке двенадцатиперстной кишки (124.13). Рис. Б.
Добавочная поджелудочная железа
, (pancreas accessorium). Эктопические участки ткани поджелудочной железы в стенке желудка или двенадцатиперстной кишки.
Эндокринная часть поджелудочной железы
, pars endocrina pancreatis. Представлена, примерно, 1 млн. островков Лангерганса, вырабатывающих глюкагон и инсулин.
ПЕЧЕНЬ
, hepar. На основании ветвления сосудов и желчных протоков разделена на сегменты. Международный номенклатурный комитет предлагает использовать классификацию Hjortsjo. Рис. В.
Диафрагмальная поверхность
Верхняя часть
Сердечное вдавление
Передняя часть
Правая часть
Задняя часть
Внебрюшинное поле
Борозда полой вены
Щель венозной связки
, fissura lig. venosi. Направляется от ворот печени к борозде нижней полой вены между хвостатой и левой долями печени. Рис. В.
Формирование протока поджелудочной железы. Этапы развития поджелудочной железы
Основные органо-генетические процессы, связанные с закладкой органов и дифференцировкой тканей, происходят в первом триместре внутриутробного развития. Некоторые исследователи считают, что поджелудочная железа развивается из трех зачатков: одного дорсального и двух вентральных. Другие авторы отмечают, что этот орган образуется из двух зачатков: дорсального и вентрального. На 3 неделе развития из энтодермы дорсальной стенки двенадцатиперстной кишки развивается дорсальный зачаток. Вентральный зачаток формируется на 4 неделе и растет в каудальном направлении. Эндокринные клетки в поджелудочной железе появляются в 5-6 недель развития, первые ацинусы появляются на 8-9 неделе развития. Островки обособляются на 10-12 неделе эмбрионального развития. У плодов 13 недель наблюдается процесс образования выводных протоков, формируются дольки. В 20 недель экзокринный отдел железы представляет собой развитую часть органа, в которой есть все условия для выполнения специфической секреторной функции. У новорожденных основные морфологические структуры поджелудочной железы сформированы. Эндокринный аппарат поджелудочной железы новорожденного хорошо развит. Особенностями развития поджелудочной железы в раннем постнатальном онтогенезе является относительная незрелость экзокринной части после рождения и мощное раннее развитие функционирующего эндокринного аппарата.
1. Афферентная иннервация стромы поджелудочной железы плодов человека и новорождённых / С.А. Лапутьев // Функциональная морфология человека и животных. - Симферополь, 1979. - С. 73-74.
3. Бархина Т.Г. Ультраскопические аспекты становления клеток пищеварительной системы в эмбриогенезе человека: докл. Конгр. Ассоц. морфологов, Тюмень, 1994 // Морфология. - 1993. - 105, № 9-10. - 46 с.
4. Башкин А.Д. Сенситивные периоды развития поджелудочной железы человека в пренатальном и раннем постнатальном онтогенезе // Влияние антропог. факторов на морфогенез и структур, преобраз. органов: материалы Всерос. конференции. Всерос. науч. общ-во анатомов, гистологов, эмбриологов. - Астрахань, 1991. - С. 11-12.
5. Бобрик И.И., Шевченко Е.А., Черкасов В.Г.. Закономерности дифференцировки и специализации эндотелия микрососудов функционально различных органов человека в пренатальном периоде онтогенеза // Морфология. - 1992. - Т. 102, В.2. - С. 107-115.
6. Бойко Ю.Г., Прокопчик Н.И. Возрастная морфометрическая характеристика поджелудочной железы человека // Архив анатомии, гистологии и эмбриологии. - 1987. - Т. ХСIII, № 12. - С. 79-81.
7. Волкова О.В., Пекарский М.И. Эмбриогенез и возрастная гистология внутренних органов человека. - М.: Медицина, 1976. - С. 166-192.
8. Гвоздухин А.П. Морфологические и цитохимические особенности дифференцировки соединительнотканной стромы поджелудочной железы человека в эмбриогенезе // Функциональная анатомия человека и животных. - 1979. - Т.78. - С. 63-65.
10. Глущенко Илья Леонидович. Морфометрическая характеристика поджелудочной железы человека в эмбриогенезе: автореф. дис. . канд. мед. наук. - Тюмень, 2004. - С. 3-17.
11. Гречко O.A. Морфология сосудистого русла инкреторного отдела поджелудочной железы плода человека // Закономерности морфогенеза и регенерации в норме, патологии и индивидуальном развитии. - Свердловск, 1978. - С. 150.
12. Грищенко В.И., Яковцева А.Ф. Крупный плод / В.И. Грищенко, А.Ф. Яковцева. - Киев: Здоровья, 1991. - С. 3-124.
13. Давиденко Л.М. Морфогенез поджелудочной железы человека в пренатальном периоде // Морфология. - 1993. - Т. 105, Вып. 9-10. - С. 69-70.
14. Давиденко Л.М. Последовательность дифференцировки эндокриноцитов поджелудочной железы человека в пренатальном периоде развития // Морфология. - 1996. - 109, № 2. - 47 с.
15. Каган И.И., Железнов Л.М. Поджелудочная железа: микрохирургическая и компьютерно-томографическая анатомия. - М.: Медицина, 2004. - 152 с.
16. Калигин М.С. Клетки-мишени фактора стволовых клеток во внутренних органах человека в ходе онтогенеза: автореф. дис. … канд мед. наук. - Казань, 2009.
18. Козырь Н.Н. Количественное распределение инсулярной ткани в поджелудочной железе плодов человека // Материалы 9-й научной конференции по возрастной морфологии, физиологии и биохимии. - М., 1969. - Т.1. - С. 214-215.
19. Молдавская А.А., Савищев А.В. Современные тенденции в изучении морфологии поджелудочной железы в эмбриогенезе // Фундаментальные исследования. - 2011. - № 5. - С. 211-217.
20. Пузырев А.А., Иванова В.Ф., Костюкевич С.В. Эндокринная гастроэнтеропанкреатическая система человека при патологии // Морфология. - 1996. - Т. 109, Вып. 2. - С. 82.
21. Савищев А.В. Морфогенез и функциональная анатомия поджелудочной железы в пренатальном онтогенезе человека и при экспериментальном моделировании: автореф. дис. … д-ра мед. наук. - М., 2009. - 26 с.
22. Сайфулин М.Х. Васкуляризация поджелудочной железы: варианты строения ангиоархитектоники в плодном периоде гестации // Биомедицинские и биосоциальные проблемы интегративной антропологии. - СПб.: СПбГМУ, 1998. - Вып. 2. - С. 201-204.
23. Ставрова Н.П. развитие нервных и паренхиматозных компонентов поджелудочной железы человека в эмбриогенезе: автореф. дис. … канд. мед. наук. - Ставрополь, 1972. - 20 с.
25. Цитологические аспекты морфофункциональных взаимодействий экзокринных клеток поджелудочной железы в процессе постнатального роста / Б.А. Хидоятов, Н.Ш. Шарафитдинходжаев, З.В. Маликов, Д.Х. Рахманова; под ред. Д.Х. Хамидова. - Ташкент: ФАН, 1983. - С. 188-190.
26. Шадрина Н.С. К анатомии артериального русла поджелудочной железы: автореф. дис. . канд. мед. наук. - Горький, 1961. - 15 с.
27. Шевчук И.А., Мардарь А.И. Развитие поджелудочной железы человека в эмбриональном периоде // Функциональная морфология эмбрионального развития человека и млекопитающих: Труды П МГМИ. Серия - гистология. - М., 1981. - CXIV, № 2. - С. 157-159.
28. Шмидт Г.А. Некоторые новые вопросы периодизации индивидуального развития человека // Материалы VI науч. конф. по вопросам возрастной морфологии, физиологии, биохимии. - М., 1963. - С. 241-243.
29. Beta cell proliferation and growth factors / J.H. Nielsen, C. Svensson, E.D. Galsgaard et all. // J. Molecular Medicine. - 1999. - 77, № 1. - Р. 62-66.
30. Bocian-Sobkowska J., Zabel M., Wozniak W. Polygormonal aspect of the endocrine cells of the human fetal pancreas // Histochem-Cell-Biol. - 1999. - Aug. 112 (2). - Р. 147-153.
31. Bock P. Development of pancreas / P. Bock, M. Abdel-Moneim, M. Egerbacher // Microsc. Res. and Techn. - 1997. - 37, № 5-6. - pp. 374-383.
32. Detection of proinsulin, C-peptide, insulin-A-chain, and Glicentin in pancreatic islet cells of early human fetogenesis / H.H. Dorsche, K. Fait, O. Mad- sen, et al. //Acta histochem. - 1991. - № 91, no. 1. - Р. 39-42.
33. Developmental gene expression and immunogistochemikal study of the human endocrine pancreas during fetal life / D.Sanches, C.Moriscot, S.Marchand // Horm-Res. - 1998. - 50 (5). - Р. 258-263.
34. Endocrine cells in intraductal papillaiy-mucinous neoplasms of the pancreas. A histochemical and immunohistohemical study / T. Terada, T. Ohta, Y. Kitamura, et al. // J. Virchows Archiv. - 1997. - 431, № 1. - Р. 31-36.
35. Herrera P.L., Huarte J., Zufferey R. Ablation of islet endocrine cells by targeted expression of hormone-promoter-driven toxigenes // Proc. Natl. Acad. Sci. - USA, 1994. - v. 91. - Р. 12999-13003.
36. Larsson L.I. On the development of the islets of Langergans // Microsc-Res-Tech. - 1998. - Nov. 15, 43 (4). - Р. 284-291.
37. Miralles F., Czernichow P., Scharfmann R. Follistatin regulates the relative proportions of endocrine ver¬sus exocrine tissue during pancreatic development //J. Development. - 1998. - 125, № 6. - Р. 52-59.
38. Nishimori I., Kamakura M., Fujikawa-Adachi K. Cholecystokinin A and B receptor m RNA expression in human pancreas // Pancreas. - 1999. - Aug. 19(2). - Р. 109-113.
39. Pancreatic development and maturation of the islet P-cell studies of pluri potent islet cultures / Ole D. Madsen, J. Jensen, N. Blum, et al. //Eur. J. Bio- chem. - 1996. - 242, № 3. - Р. 435-445.
40. Sander M., German S. The cell transcription factors and development of the pancreas // J. Molecular Medicine. - 1997. - 75, № 5. - Р. 327-340.
Основные органо-генетические процессы, связанные с закладкой органов и дифференцировкой тканей, происходят в первом триместре внутриутробного развития [8, 24, 28]. Этот период считается определяющим для последующего формирования и дифференцировки органов и систем человеческого организма не только во внутриутробном развитии, но и в постнатальном онтогенезе. Относительно закладки поджелудочной железы у человека нет единой точки зрения. Одни исследователи считают, что она развивается из трех зачатков: одного дорсального и двух вентральных [7, 17]. Другие отмечают, что этот орган образуется из двух зачатков: дорсального и вентрального [39, 40].
На 3-й неделе развития из энтодермы дорсальной стенки двенадцатиперстной кишки в гепатопанкреатической зоне развивается дорсальный зачаток. Вентральный зачаток формируется на 4-й неделе, в углу, образованном стенкой кишки и зачатком печени, и растет в каудальном направлении. При появлении двух вентральных зачатков возможно формирование кольцевидной поджелудочной железы [7].
В результате вращения первичной кишки и неравномерности роста кишечной стенки зачатки поджелудочной железы у эмбриона длиной 8 мм сближаются. Слияние зачатков и образование единого органа происходит у эмбриона длиной 12-16 мм [7, 24]. Проток поджелудочной железы (Вирсунгов) формируется в результате анастомоза дистальной части дорсального протока с протоком вентральной закладки, образование добавочного протока поджелудочной железы происходит из вентрального зачатка. После слияния закладок железы происходит обособление ее капсулы. Передняя часть головки, тело и хвост дефинитивной поджелудочной железы формируются из дорсального отдела, а задняя часть головки и крючковидный отросток из вентрального отдела закладки железы.
Интерес представляет развитие сложной гистологической структуры поджелудочной железы. На ранних этапах развития экзокринная часть поджелудочной железы формируется в тесном единстве с элементами мезенхимы [15, 37]. Основные процессы дифференцировки морфологических структур поджелудочной железы происходят в период от 5,5 до 12 недель внутриутробного развития. В 5,5 недель - образование зачатков железистых альвеол, в 6 недель - появление зачатков островков, в 6,5 недель - начало слияния вентрального и дорсального отделов железы, в 9 недель - формирование долек железы, в 10,5 недель - формирование крючковидного отростка железы [10]. В 7-8 недель характерной особенностью тканей фетальной железы являются секреторные гранулы, появляющиеся по периферии скопления эпителиальных клеток, что свидетельствует о начале дифференцировки поджелудочной железы на экзокринный и эндокринный отделы [21].
В начале 7 недели в закладку железы врастают нервные волокна [1, 4, 13, 14, 23], в 12 недель она богато снабжена нервами [23, 27]. В начале 3 месяца развития в междольковой соединительной ткани и между закладками железы волокна образуют довольно выраженные пучки, формируется каркас органа [8]. В начале четвертого месяца внутриутробного развития происходит коллагенизация волокнистых структур соединительной ткани, а в междольковой соединительной ткани и по ходу кровеносных сосудов образование коллагеновых волокон не происходит.
У плодов 13 недель наблюдается процесс массового образования выводных протоков, а в отдельных участках железистые структуры образуют дольки. Увеличивается количество островков Лангерганса, которые имеют различную величину: часть из них локализована обособленно, а часть еще полностью не отделена от стенки выводных протоков. Между эндокринными клетками внутри островков располагаются синусоидные кровеносные капилляры. В островковых клетках поджелудочной железы плодов человека 10-14 недель В-клетки выполняют свою биологическую функцию. В течение плодного периода у человека определяются две совокупности эндокринных клеток, одна из которых составляет островки Лангерганса, а другая - свободно рассредоточенные клетки, расположенные в стенках протоков железы. Свободные клетки полигормональны и содержат инсулин, глюкагон, соматостатин и панкреатический полипептид [32]. Некоторые авторы в своих исследованиях указывают на асинхронность появления гормонов и ферментов в развивающейся поджелудочной железе плода человека [31, 34]. В развитии островков было выявлено несколько стадий:
1) выборочная полигормональная в 9-10 недель;
2) повсеместная полигормональная в 11-15 недель;
3) моногормональная по инсулину очаговую стадию в островках 16-29 недель с зонулярными или плащевидной формы островками;
4) полиморфная островковая стадия после 30 недель, характеризующаяся наличием клеток, образующих глюкагон или соматостатин. В последнюю стадию в ткани железы обнаруживаются так называемые биполярные островки [30].
С пяти месяцев внутриутробного развития происходит активизация процессов морфофункционального становления внешнесекреторной паренхимы органа. Параллельно этому происходит оформление внутриорганных выводных протоков, дифференцировка их эпителия. В этот период наблюдается большое количество островков. В середине пятого месяца экзокринный отдел железы представляет собой развитую часть органа, в которой есть все условия для выполнения специфической секреторной функции [8]. При компьютерной трехмерной реконструкции срезов поджелудочной железы у плодов 24 недель гестации установлено наличие контактов клеток формирующихся островков с протоками железы [41].
В 24-25 недель отмечается довольно четкая дифференцировка на дольки, увеличивается количество ацинусов, возрастает число концевых отделов. Наряду со зрелыми ацинусами в составе долек железы встречаются малодифференцированные концевые элементы. Возникновение и становление ацинусов в поджелудочной железе происходит не одновременно и продолжается весь внутриутробный период [9, 12]. В период с 22 до 28 недель в дольках железы преобладают зрелые ацинусы, в которых имеются все признаки секреторного процесса. Вокруг ацинусов сформирована околоацинозная соединительная ткань. В капсуле, междолевых, междольковых прослойках происходит коллагенизация аргирофильных волокон, появляется значительное количество фиброцитов. Сосудистая система фетальной железы считается сформированной к 7 месяцу развития [11, 22, 25, 26]. В этот период в поджелудочной железе плодов содержится наибольшее количество инсулярной ткани на 1 мм2 [18]. Наиболее многочисленными у плода человека до 7 месяцев развития являются А-клетки, которые образуют глюкагон и выводят его. В период эмбриогенеза глюкагон является специфическим стимулятором секреции инсулина и выступает как местный индуктор цитодифференцировки В-клеток. Дифференцировка А- и В-эндокриноцитов характеризуется асинхронностью [5, 6].
В конце позднефетального периода на экспериментальном материале выявлены ацинарно-островковые клетки, расположенные между экзокринным и эндокринным отделами железы [3,9]. Большинство морфологов придерживаются мнения о том, что эти клетки образуются в процессе трансформации, которой обладает паренхима поджелудочной железы [21]. В возрасте 33-40 недель гестации поджелудочная железа имеет выраженное дольчатое строение. В дольках преобладают зрелые ацинусы, вокруг которых сформирована околоацинозная соединительная ткань.
Становление паренхимы железы продолжается и после рождения, что связано с изменениями условий функционирования железы, совершенствованием нейрогуморальных механизмов регуляции. Поджелудочная железа новорожденного отличается хорошо развитой междольковой соединительной тканью, богатой лимфогистиоцитарными элементами и фибробластами [1, 19, 20, 25]. На периферии долек, особенно в субкапсулярной зоне, продолжается активное новообразование островков Лангерганса, постепенно вытесняющих вместе с ацинусами нежноволокнистую соединительную ткань. Они отличаются различной величиной и формой, часть из них локализована обособленно, а некоторые из них еще полностью не отделены от стенки выводных протоков. Между эндокриноцитами внутри островков располагаются синусоидные кровеносные капилляры. Паренхима островков представлена дифференцированными В-клетками, цитоплазма которых заполнена секреторными гранулами, а также дифференцирующимися клетками, не содержащими секреторных гранул. В этот период большинство островков теряют непосредственный контакт с протоковой частью и распределяются дисперсно [21]. В поджелудочной железе новорожденного Д-клеток в 20 раз больше, чем у взрослых [2]. Механизмы высвобождения инсулина поджелудочной железой плода становятся полноценными в конце беременности или сразу после родов. Содержание инсулина в сыворотке крови плода человека повышено, но очень быстро падает после перевязки пуповины и поступления к плоду пищевых веществ. Полный ответ А-клеток на воздействие стимуляторов секреции глюкагона или угнетение его секреции инсулином и глюкозой наблюдается в конце беременности либо после рождения ребенка. Считается, что эти эндокринные изменения обусловлены активацией А-адренэргической системы новорожденного с одновременным снижением чувствительности В-клеток к инсулиногенным стимулам, а также повышение чувствительности А-клеток к аминокислотам или стимуляцией А-клеток глюкозой [2]. Только к 2 годам гистологическое строение поджелудочной железы начинает приближаться к таковому у взрослых. В-клеточная популяция и соотношение с другими типами клеток панкреатических островков устанавливается до 5 лет возраста [33]. Таким образом особенностью развития поджелудочной железы в раннем постнатальном онтогенезе является относительная незрелость экзокринной части и мощное раннее развитие функционирующего эндокринного аппарата.
Рецензенты:
Мартынова Н.А., д.м.н., профессор, заведующая кафедрой оперативной хирургии и топографической анатомии, ГБОУ ВПО СГМУ Минздрава России, г. Архангельск;
Болдуев В.А., д.м.н., доцент кафедры гистологии, цитологии и эмбриологии ГБОУ ВПО СГМУ Минздрава России, г. Архангельск.
Щербаков П.Л. К вопросу о панкреатите // Лечащий Врач. Гастроэнтерология. 2011. № 7.
Заболевания поджелудочной железы являются одними из наиболее распространенных поражений органов пищеварения. Среди больных преобладают женщины. Это, по-видимому, связано с более высокой частотой встречаемости у них желчно-каменной болезни (ЖКБ) и нарушений жирового обмена. Значительную часть больных составляют пожилые и престарелые лица, однако в последнее время поражения поджелудочной железы все чаще встречаются и у детей различного возраста. В настоящее время существуют различные рекомендации и стандарты, посвященные ведению больных с панкреатитом. Наиболее известными являются критерии Атланты 1992 г. [1] и консенсунс, принятый в 1999 г. в Сантрони [2], с пересмотром в 2003 г.
Среди воспалительных заболеваний поджелудочной железы различают острый и хронический панкреатит. Причины поражения поджелудочной железы многообразны. В частности, к ним относятся: обструкция панкреатического протока, воздействие лекарственных препаратов или токсическое отравление различными веществами, метаболические нарушения как самой поджелудочной железы, так и других органов и систем, инфекционные и паразитарные заболевания, сосудистые нарушения и травмы.
Острый панкреатит является полиэтиологическим заболеванием. В основе острых панкреатитов лежит ферментативное поражение поджелудочной железы, носящее автокаталитический характер. Выделяют две группы причин заболевания. К первой относятся факторы, вызывающие затруднение оттока панкреатического сока по протокам поджелудочной железы и приводящие вследствие этого к острому повышению давления в них, с развитием гипертензионно-протоковой формы острого панкреатита. Вторую группу составляют факторы, приводящие к первичному поражению ацинозных клеток с развитием первично-ацинарной формы заболевания.
Острое поражение поджелудочной железы может возникать при приеме различных лекарственных препаратов, таких как метилдопа, 5-аминосалицилаты, азатиоприн, циметидин, фуросемид, метронидазол, тетрациклины, при переполнении паренхимы поджелудочной железы рентгеноконтрастными препаратами во время проведения инструментальных эндоскопических исследований. Кроме того, причинами развития острого панкреатита как у взрослых, так и у детей могут явиться метаболические нарушения, в частности гипертриглицеридемия — гиперлипидемия I, IV или V типа.
Из инфекционных заболеваний наиболее частой причиной развития панкреатитов являются: вирусные заболевания (цитомегалия, герпес, гепатиты А, В, С), бактериальные (микобактериоз, лептоспироз), грибковые поражения (криптококки, кандида), а также паразитарные инвазии (аскариды, закупоривающие просвет выводного протока поджелудочной железы, или пневмоцистоз).
Хронический панкреатит представляет собой длительно текущее, как правило, прогрессирующее воспалительное заболевание поджелудочной железы. При этом развивается очаговая или диффузная деструкция ткани железы с постепенным замещением ее соединительной тканью. Основными этиологическими факторами развития хронического панкреатита являются те же, что и для острого панкреатита, которые непосредственно повреждают ацинозные элементы или способствуют повышению давления в панкреатических протоках, однако действующие более длительно и менее интенсивно.
В соответствии с Атлантскими критериями правильный диагноз острого панкреатита должен быть установлен у всех пациентов в течение 48 часов после поступления (уровень рекомендации C). Этиология острого панкреатита должна быть определена, по крайней мере, в 80% случаев и не больше чем в 20% должна быть классифицирована как идиопатическая (уровень рекомендации B) [3].
Если причину развития заболевания установить не удается, следует говорить об идиопатическом хроническом панкреатите.
По данным большинства исследований, причиной приблизительно в половине случаев острого панкреатита является ЖКБ, 20-25% связаны со злоупотреблением алкоголем. В группу «идиопатического» относят больных, у которых не выявлено никакой очевидной причины развития этого состояния [4]. Диагноз идиопатического панкреатита не может быть установлен без прицельного поиска желчных камней. Как минимум, дважды необходимо провести ультразвуковые исследования. После одного отрицательного ультразвукового исследования самый чувствительный диагностический тест на наличие желчных камней — это повторное УЗИ, которое выявляет конкременты, которые, возможно, были пропущены [5]. Появление эндоскопического УЗИ (EUS) и магнитно-резонансной холангиопанкреатографии (MRCP) расширило диапазон тестов, доступных для установления причины острого панкреатита. В таких ситуациях EUS может обнаружить микролитиаз в желчном пузыре или общем желчном протоке, а MRCP выявить большинство камней в протоке, а также аномалии самих протоков, таких, например, как раздвоение поджелудочной железы. EUS также точен и более безопасен, чем эндоскопическая ретроградная холангиопанкреатография (ERCP), для обнаружения камней общего желчного протока. Исследование желчи может быть единственным способом идентификации пациентов с повторным острым панкреатитом из-за микролитиаза. Протоковая манометрия (используемая для идентификации дисфункции сфинктера Одди) может иметь существенный риск в плане обострения острого панкреатита и должна выполняться только в специализированных отделениях. Необходим осторожный отбор пациентов для проведения манометрии [6]. Для определения природы развития панкреатита необходимо проводить исследования на содержание и уровень липидов плазмы и концентрацию кальция в крови. Ранние и реконвалесцентные титры антител к вирусам (эпидемического паротита, Коксаки B4 и других) могут также идентифицировать возможную причину острого панкреатита, хотя никакой специфической терапии при этом не назначается. Необходимо учитывать возможность существования сопутствующего новообразования или хронического панкреатита и соответствующим образом обследовать больного.
Исследования, необходимые для определения этиологических факторов, вызвавших острый панкреатит, в зависимости от стадии течения болезни, а также анамнестические данные, позволяющие исключить другие причины развития острого панкреатита, представлены в таблице.
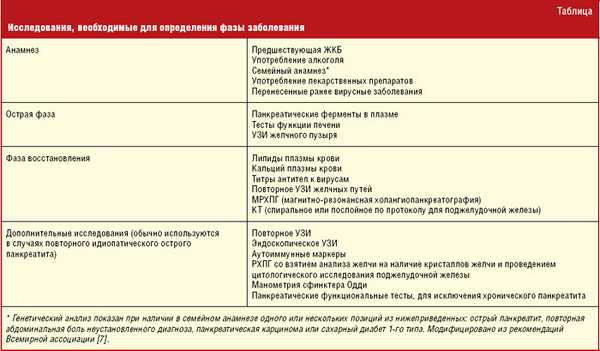
Длительные нарушения функции поджелудочной железы могут приводить к развитию хронических изменений, проявляющихся в виде хронического кальцифицирующего панкреатита, хронического воспалительного панкреатита или хронического обструктивного панкреатита.
Врожденные нарушения деятельности поджелудочной железы, которые в дальнейшем могут проявиться развитием воспалительной реакции, связаны с аутосомно-доминантными аномалиями гена или хромосомы 7G, ассоциированными с раком головки поджелудочной железы.
Нарушение деятельности поджелудочной железы, не сопровождающееся, как правило, воспалительной реакцией, однако имеющее определенную клиническую симптоматику, получило название панкреатической недостаточности.
Различают первичную и вторичную панкреатические недостаточности. Первичная панкреатическая недостаточность развивается вследствие воздействия так называемых немодифицируемых факторов, на которые человек (сам пациент или врач) воздействовать и влиять не может. К ним относятся такие заболевания, как кистозный фиброз поджелудочной железы, врожденное нарушение проходимости панкреатического протока, синдром Shwachman, изолированный дефицит липазы, изолированная недостаточность трипсина, наследственный рецидивирующий панкреатит.
В клинической практике чаще встречается вторичная или относительная недостаточность поджелудочной железы (панкреатопатия), вызываемая, как правило, приемом необычной пищи, ее избыточным количеством или временными расстройствами функционирования поджелудочной железы. Вторичная недостаточность может сопровождать различные воспалительные заболевания верхнего отдела пищеварительного тракта (ВОПТ).
Клиническими проявлениями панкреатической недостаточности являются признаки нарушения деятельности поджелудочной железы — боль в животе, изменение аппетита (уменьшение или полное исчезновение), тошнота, урчание в животе, метеоризм и флатуленция, стеаторея. Интенсивность и выраженность этих признаков зависит от степени поражения поджелудочной железы.
Диагностика вторичной панкреатической недостаточности нередко может представлять значительные трудности из-за нечеткости клинических симптомов, незначительных изменений при инструментальных методах исследования. Поэтому для правильной диагностики и своевременного назначения адекватного лечения врач должен использовать весь арсенал средств, находящийся в его распоряжении. При панкреатической недостаточности боли локализуются в эпигастрии, левом подреберье или бывают опоясывающими, иррадиируют в левое подреберье, под левую лопатку, в спину. Боли могут быть приступообразными и постоянными, они усиливаются после переедания, употребления жирной, острой и жареной пищи, алкоголя. Тепло усиливает боли, применение холода несколько уменьшает. Боли с трудом купируются лекарственными препаратами. Боли несколько ослабевают при вынужденных положениях больного — коленно-локтевом, сидя, согнувшись вперед, лежа на боку с притянутыми к груди коленями. Болевой синдром сопровождается симптомами кишечной диспепсии и нарушениями стула, при этом больные жалуются на вздутия и урчание в животе, могут быть запоры и поносы. Стул при поносах обильный, жидкий, пенистый, светло-желтого цвета из-за большого количества жира. Характерны также признаки желудочной диспепсии — тошнота и рвота, которая не приносит облегчения.
При недостаточности поджелудочной железы применяются различные лекарственные средства, содержащие ферменты. Традиционно для этого используется панкреатин — препарат, приготовленный из поджелудочной железы животных [8]. Однако в условиях интенсивного кислотообразования в желудке наступала его частичная инактивация, и препарат не оказывал ожидаемого лечебного эффекта. В дальнейшем, с развитием фармацевтической промышленности, знаний о механизме процессов пищеварения, появились новые формы препаратов, содержащих панкреатин в виде таблеток, драже, гранул с защитной оболочкой и микросфер, помещенных в капсулу. В настоящее время ферментные препараты, используемые в клинической практике, должны отвечать определенным требованиям: 1) нетоксичность; 2) хорошая переносимость; 3) отсутствие существенных побочных реакций; 4) оптимум действия в интервале рН 5-7; 5) устойчивость к действию соляной кислоты, пепсинов и других протеаз; 6) содержание достаточного количества активных пищеварительных ферментов; 7) иметь длительный срок хранения [9].
В зависимости от фазы развития патологического процесса можно выделить четыре формы острого панкреатита: острый интерстициальный, соответствующий фазе отека (серозного, геморрагического, серозно-геморрагического), острый некротический, выражающий фазу образования некроза (с геморрагическим компонентом или без него); инфильтративно-некротический и гнойно-некротический, соответствующий фазе расплавления и секвестрации некротических очагов.
Для облегчения выбора тактики лечения, объема инфузионной терапии и правильной интерпретации формы панкреатита выделяют легкую, среднюю и тяжелую степени интоксикации.
Легкая степень (встречающаяся обычно при серозном отеке поджелудочной железы) характеризуется удовлетворительным общим состоянием больного, умеренными болями в эпигастрии, тошнотой, однократной рвотой, отсутствием симптомов раздражения брюшины, неизмененным цветом кожных покровов, частотой пульса в пределах 88-90 ударов в минуту, нормальным или слегка повышенным артериальным давлением (АД), высокими цифрами уроамилазы, небольшой активностью трипсина и липазы, сохраненным или слегка сниженным объема циркулирующей крови (ОЦК) (дефицит 7-15%), умеренным лейкоцитозом, субфебрильной температурой.
Средняя степень интоксикации (наблюдается при мелкоочаговом некрозе железы) проявляется упорными болями в эпигастрии, которые не исчезают при применении спазмолитиков и анальгетиков, бледностью и цианотичностью кожных покровов, повторными рвотами, напряжением мышц в эпигастральной области, частотой пульса до 100-110 уд./мин, падением АД ниже исходного уровня, повышением периферического и снижением центрального венозного давления (ЦВД), высокими цифрами уроамилазы, ранней высокой активностью трипсина и липазы, снижением уровня Са и повышенным содержанием сиаловых кислот, уменьшением ОЦК (дефицит 16-35%), снижением диуреза, подъемом температуры тела до 38 °С.
Тяжелая степень интоксикации (возникает при распространенном некрозе железы) отличается тяжелым общим состоянием больного, жестокими болями в эпигастральной области, мучительной рвотой, резко бледными или цианотичными кожными покровами, нередко желтухой, появлением симптомов перитонита, частотой пульса свыше 120 уд./мин, падением уровня АД и ЦВД, снижением уроамилазы, активности трипсина и липазы, уровня Са, низким диурезом, вплоть до полной анурии, резким снижением ОЦК (дефицит 36-50%), высокой температурой, значительным нарушением функции сердца, печени, легких, почек.
В лечении острого панкреатита с самого начала превалировал оперативный метод, предложенный немецким хирургом Korbe в 1894 г. Однако высокая летальность (90-100%) даже в то время заставила сдержанно относиться к этому методу [10]. На 5-м Всероссийском съезде хирургов академик В. С. Савельев (1978) подчеркнул, что в настоящее время общепризнан преимущественно консервативный метод лечения острого панкреатита. Однако лечебная тактика диктуется главным образом формой заболевания. Если при интерстициальном и некротическом панкреатите решающее значение имеет своевременное проведение консервативной терапии и, в меньшей степени, операции, а при инфильтративно-некротическом — только консервативное лечение, то гнойно-некротическая форма требует обязательного оперативного вмешательства.
Современная консервативная терапия острого панкреатита решает следующие задачи:
1) ликвидация боли и спазма, улучшение микроциркуляции в железе;
2) борьба с шоком и восстановление гомеостаза;
3) подавление экзокринной секреции и активности ферментов железы;
4) борьба с токсемией;
5) нормализация деятельности легких, сердца, почек, печени;
6) профилактика и лечение осложнений.
В лечении панкреатита ведущее значение имеет обеспечение уменьшения панкреатической секреции, так как усиленная секреция богатого ферментами сока поджелудочной железы, особенно при значительной закупорке протока, приводит к прогрессированию процесса. Больные с тяжелым острым панкреатитом должны лечиться в отделении интенсивной терапии.
При любом варианте течения острого панкреатита лечение начинают с назначения голода, который в зависимости от тяжести заболевания назначают на 3-5 дней. При легком процессе спустя этот срок больные способны принимать пищу без боли, расширяют рацион питания, постепенно выздоравливают и в дальнейшем не требуют продолжения лечения. При более тяжелом заболевании в первые дни осуществляется постоянная аспирация желудочного содержимого и быстро определяется оптимальная тактика ведения больного. Необходимо отметить, что при грамотном ведении больные острым панкреатитом средней степени тяжести без развития панкреонекроза и парапанкреатической флегмоны могут быть излечены консервативными методами.
При выборе тактики лечения больных острым панкреатитом наиболее важно дифференцировать отечные и интерстициальные формы острого панкреатита. Показателями начавшегося некротического процесса являются изменения в сыворотке крови концентрации С-реактивного белка и эластазы. Пациенты с отечной формой панкреатита нуждаются в консервативной терапии и динамическом наблюдении, тогда как пациенты с панкреонекрозом в интенсивной терапии. Выбор тактики ведения больных определяется и функциональной состоятельностью органов и наличием сопутствующей патологии. Пациентов без сопутствующей органной патологии и с ограниченным некрозом можно лечить консервативно, тогда как пациенты с полиорганной недостаточностью или прогрессированием сопутствующей патологии являются кандидатами для хирургического лечения.
С целью подавления панкреатической секреции в настоящее время применяют ингибиторы протонной помпы, которые целесообразно вводить парентерально, в частности, пантопразол (Контролок®). Этот представитель ингибиторов протонной помпы имеет наибольшее время воздействия (до 48 часов), обеспечивая надежную блокировку продукции соляной кислоты в желудке и тем самым подавляя все ферментообразующие реакции в поджелудочной железе. В отличие от других представителей ингибиторов протонной помпы пантопразол (Контролок®) после введения не метаболизируется в печени с использованием цитохрома P450 и его коферментов, поэтому пантопразол не вступает во взаимодействие с лекарственными препаратами, претерпевающими метаболизм в печени, не конкурирует с ними и его можно сочетать с другими препаратами для лечения панкреатита как в острой, так и в хронической стадии. Начальная суточная доза Контролока® составляет 80 мг. При необходимости дозу можно титровать, увеличивая или уменьшая, в зависимости от показателей секреции кислоты в желудке. При дозах, превышающих 80 мг в сутки, их необходимо разделить на два ввода. Возможно временное увеличение дозы больше 160 мг пантопразола, но продолжительность применения должна ограничиваться только периодом, который необходим для адекватного контроля секреции кислоты. Порошок растворяют в 10 мл физиологического раствора хлорида натрия, который добавляется во флакон. Этот раствор можно вводить непосредственно или после смешивания с 100 мл физиологического раствора хлорида натрия, 5% или 10% раствором глюкозы. Внутривенное введение необходимо проводить в течение 2-15 мин. Использовать эти лекарственные средства в вышеуказанных дозах следует до купирования болевого синдрома и ликвидации «уклонения» ферментов в кровь, после чего необходимо продолжить их прием в половинной дозе перорально еще в течение одного месяца или заменить их антацидами, такими как Алмагель, Маалокс, Фосфалюгель и др. по 6-8 раз в сутки.
Важнейшее значение в остром периоде панкреатита придается ликвидации ведущего болевого синдрома, для чего чаще всего используют сочетание ненаркотических анальгетиков и спазмолитиков.
Азбука диетолога. Острый панкреатит

Одно из направлений развития диетологии — это разработка специализированных диет и индивидуализация лечебного питания. Особенно важно, чтобы эти два направления проводились в соответствии с физиологическими потребностями больного в пищевых веществах и энергии, клинической картиной заболевания, а также в соответствии с особенностью патофизиологических процессов, развивающихся в организме при том или ином заболевании. Важным также является понимание анатомии органа и его нормальных физиологических функций. Вооружившись этими знаниями, врач-диетолог сможет грамотно назначить основные виды нутриционной поддержки (парентеральное, энтеральное питание, лечебное питание) для каждого конкретного пациента.
Достаточно часто в профессиональной среде специалистов-диетологов возникают дискуссии на тему «Что должен в больнице делать врач-диетолог: консультировать пациентов или следить за работой пищеблока?». Ответ на данный вопрос достаточно прост. Работа пищеблока и выполнение нормативов, требований санитарно-гигиенических норм и правил и т. д. входит в экспертную работу врача-диетолога по контролю организации лечебного питания. Консультирование пациентов — это непосредственная работа врача-диетолога в соответствии с его квалификационной характеристикой, утвержденной Приказом Минздрава СССР от 21.07.1988 № 579 «Об утверждении квалификационных характеристик врачей- специалистов».
К общим умениям врача-диетолога относятся консультирование больных по вопросам рационального и лечебного питания, анализ эффективности лечебного питания и контроль деятельности врачей по назначению рационального и лечебного питания. Врач-диетолог должен уметь назначать диету, контролировать соответствие назначенной диеты нозологической форме болезни и периодам ее течения при заболеваниях.
Основа основ.Что же должен знать врач-диетолог для того, чтобы консультировать пациентов и назначать лечебное питание?
В соответствии с классификационными требованиями врач-диетолог должен знать физиологические основы диетологии, обмена веществ в организме в норме и патологии, взаимосвязи функциональных систем организма и уровни их регуляции.
Для правильного назначения лечебного питания врач-диетолог должен знать причины возникновения патологических процессов в организме, механизмы их развития и клинические проявления, а также клиническую симптоматику и патогенез основных заболеваний желудочно-кишечного тракта, обмена веществ, сердечно-сосудистой системы, почек и других заболеваний, при которых диетотерапия является ведущим лечебным фактором.
Именно поэтому мы решили уделить особое внимание анатомии внутренних органов. В этом номере рассмотрим основные особенности строения, функции одного из самых важных органов системы пищеварения человека — поджелудочной железы — и расскажем о видах нутриционной поддержки больных с острым панкреатитом — заболеванием, которое стало чаще встречаться в последние годы.
Анатомия поджелудочной железы
Поджелудочная железа — pancreas (от греч. pan — весь, creas — мясо) — представляет собой продолговатый, S-образный непарный многодольчатый орган. Она располагается перед позвоночным столбом, позади желудка в забрюшинном пространстве, от двенадцатиперстной кишки до ворот селезенки. Максимальной массы железа достигает к 25-40 годам, к старости масса снижается до 50-60 г. В поджелудочной железе условно различают головку, тело и хвост.
Паренхима поджелудочной железы состоит из двух видов ткани, которые обеспечивают внешнесекреторную и внутрисекреторную деятельность органа. Экзокринная часть поджелудочной железы сосредоточена в дольках или ацинусах, расположенных вдоль внутридольковых разветвлений панкреатических протоков, эпителий которых также выполняет секреторную функцию.
Дольки поджелудочной железы разделены прослойками рыхлой соединительной ткани, в которых проходят кровеносные и лимфатические сосуды, нервные волокна и выводные протоки. Проток поджелудочной железы (вирсунгов проток) проходит через всю длину поджелудочной железы от хвоста до головки. Он заключен полностью в ткань железы и расположен ближе к ее задней поверхности.
Вместе с дистальным отделом общего желчного протока проток поджелудочной железы впадает в большой сосочек двенадцатиперстной кишки (БСДК, papilla duodeni major), через который экскрет поджелудочной железы вместе с желчью поступает в просвет двенадцатиперстной кишки (см. рис. 1).
Рисунок 1. Поджелудочная железа, двенадцатиперстная кишка, проток поджелудочной железы
В структуре факторов, потенцирующих развитие острого отека поджелудочной железы и последующего панкреонекроза, более 40 % — это патология желчевыводящих путей и сфинктерной системы. Анатомическая и функциональная близость желчевыводящих путей и протоков системы поджелудочной железы обусловливает развитие острого панкреатита при желчнокаменной болезни, холедохолитиазе, стриктуре, спазме или воспалении большого дуоденального сосочка, дискинезии желчных путей. В условиях нарушения оттока панкреатического секрета развивается билиарно-панкреатический или дуоденально-панкреатический рефлюкс. Формирование последующей внутрипротоковой гипертензии играет основную роль в активации ферментов поджелудочной железы.
Физиология поджелудочной железы
Секрецию поджелудочной железы разделяют на две фазы: межпищеварительную и пищеварительную. В фазе межпищеварительной происходит медленное прогрессирование двигательной активности желудка и кишечника, желчевыводящих путей. Секреция и выделение желчи из печени и желчного пузыря на этом этапе практически неактивны. Учащение сокращения желчного пузыря, сопровождающееся общей миоэлектрической активностью, вызывает усиление панкреатической и билиарной секреции. В этом периоде проводится подготовка поджелудочной железы к следующей пищеварительной фазе.
Пищеварительная фаза секреции начинается со сложно-рефлекторной фазы через блуждающий нерв. Начинается эта фаза с сенсорного восприятия пищи (зрительного, осязательного, обонятельного) и вкусовой оценки продуктов питания. В этой стадии происходит активная секреция желудочного сока, что приводит к ацидификации двенадцатиперстной кишки. Эта стадия важна для активации секреции ферментов поджелудочной железы и бикарбонатов. Бикарбонаты играют роль буфера, и их выработка регулируется секретином.
Знание данных физиологии секреции необходимо для врача-диетолога. Так, наиболее важно при развитии острого панкреатита прекратить активизацию секреции поджелудочной железы. Для этого необходимы медикаментозные препараты, угнетающие секрецию поджелудочной железы, и препараты, блокирующие секрецию желудка, действие которых длится в течение суток. Важно прекратить питание как традиционными продуктами, так и энтеральными смесями. Необходимо исключить возможность влияния зрительного, осязательного и обонятельного рефлекторного стимулирования секреции поджелудочной железы.
Желудочная фаза пищеварительной секреции начинается с момента поступления пищи в желудок, при этом усиливается секреция ферментов поджелудочной железы. В это время секреция воды и бикарбонатов не происходит. Секреция в этой фазе стимулируется афферентными волокнами блуждающего нерва, реагирующими на растяжение желудка (фундального и антрального отделов). За счет этой реакции максимальной концентрации в крови достигает уровень секретина и холецистокинина, являющихся основными стимуляторами функции поджелудочной железы.
Секреция поджелудочной железы
Сок поджелудочной железы бесцветный, имеет щелочную реакцию (рН 7,3-8,7), содержит пищеварительные ферменты, расщепляющие белки, жиры и углеводы. К ферментам поджелудочной железы относятся ферменты, расщепляющие белковый компонент пищи (трипсин, химотрипсин, карбоксипептидаза и др.), расщепляющие жиры пищи (липазы) и расщепляющие углеводы (амилаза, мальтаза, лактаза, инвертаза и др.).
Поджелудочный сок выделяется рефлекторно на сигналы из слизистой оболочки ротовой полости и начинается через 2-3 минуты после начала еды. Отделение сока продолжается 6-14 часов и зависит от состава и свойств принятой пищи.
Секреция поджелудочной железы регулируется нервным и гуморальным путем. Нервные импульсы от рецепторов ротовой полости и глотки достигают продолговатого мозга. Парасимпатические нервы стимулируют секрецию железы, а симпатические — тормозят ее активность. Гуморальная регуляция осуществляется секретином, холецистокинином (панкреозимином) и другими веществами.
При диагностировании острого панкреатита больному необходимо создание функционального покоя поджелудочной железы и подавление ее секреторной активности путем раннего назначения парентерального питания при полном ограничении поступления питательных веществ через желудочно-кишечный тракт с ограничением приема воды. Вынужденное голодание может длиться до 10 суток, прекращение его определяется прежде всего клиническим вариантом и тяжестью течения острого панкреатита.
Схема 1. Процесс активации ферментов поджелудочной железы в желудочную и интерстициальную фазы пищеварения
Последняя фаза пищеварительной секреции — интерстициальная (кишечная) — завершается после поступления химуса (частично переваренной и обработанной пищи) в двенадцатиперстную кишку. В этой фазе за счет нейрогуморальной регуляции начинается максимально интенсивная секреция ферментов поджелудочной железы. Секреция ферментов в процессе интерстициальной фазы стимулируется присутствием в двенадцатиперстной кишке в первую очередь жирных кислот, моноглицеридов, затем белков и аминокислот, кальция. Значительная нагрузка этими веществами потенцирует секрецию ферментов, происходит стимуляция выделения холецистокинина в верхних отделах тонкой кишки.
Поджелудочная железа выполняет внутрисекреторную деятельность. Основным ее гормоном является инсулин. Это высокомолекулярное белковое вещество. При развитии острого панкреатита возможно изменение толерантности к глюкозе. Недостаточность инсулина приводит к увеличению концентрации сахара в крови и тканях, истощению запасов гликогена в печени, увеличению в крови жира и накоплению в организме недоокисленных продуктов жирового обмена в виде кетоновых тел. В поджелудочной железе помимо инсулина образуется также гипергликемический фактор — глюкагон, снижающий содержание гликогена в печени и мышцах, что приводит к гипергликемии.
Секреторная функция поджелудочной железы изменяется с возрастом. Активность протеаз находится на высоком уровне уже у грудного ребенка, затем она увеличивается, достигая максимума к 4-6 годам. Активность липазы возрастает к концу первого года жизни и остается высокой до 9-летнего возраста. Активность ферментов (амилазы), расщепляющих углеводы, на протяжении первого года жизни увеличивается в 3-4 раза, а максимальных значений достигает к 9 годам. К 30 годам ферментативная активность достигает максимума, затем постепенно снижается, особенно с 60 лет. К 80 годам масса поджелудочной железы уменьшается более чем на 60 %, развиваются сосудистые нарушения.
Именно с повреждением железы собственными ферментами многие ученые связывают возникновение острого панкреатита. Так, в книге «Острый панкреатит. Патофизиология и лечение» (Харьков, 2002) авторы В. В. Бойко, И. А. Криворучко, Р. С. Шевченко, Р. М. Смачило, О. Н. Песоцкий пишут: «Острый панкреатит — полиэтиологическое заболевание, в основе которого, как считают большинство отечественных и зарубежных исследователей, лежит повреждение железы собственными ферментами, в связи с чем этот процесс определяется как „самопереваривание“».
Хотите больше информации по вопросам диетологии?
Приобретите информационно-практический журнал «Практическая диетология» в электронном или печатном формате!
Читайте также:
- Рентгенограмма, КТ, МРТ, УЗИ при препателлярном и претибиальном бурситах
- Заворот кишок
- СЕЛЕКТИВНЫЙ ИНГИБИТОР ОБРАТНОГО ЗАХВАТА СЕРОТОНИНА И НОРАДРЕНАЛИНА ВЕНЛАФАКСИН ОРГАНИКА: РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ БИОЭКВИВАЛЕНТНОСТИ
- Рентгенограмма, МРТ, УЗИ при травме малоберцового нерва
- Запуск агрессивно-оборонительных реакций. Холинергическая природа триггера агрессивно-оборонительных реакций
