Фосфолипиды и их обмен. Физиология образования холестерола
Добавил пользователь Cypher Обновлено: 08.01.2026
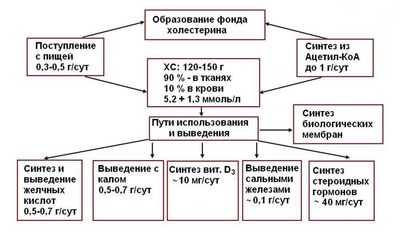
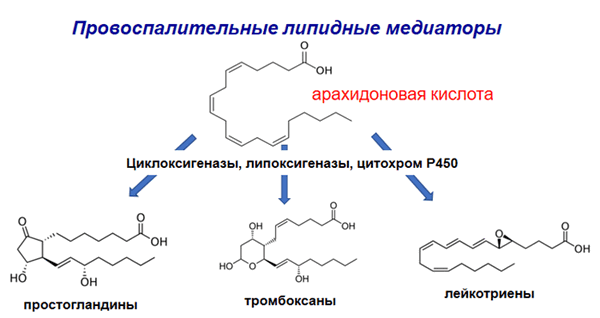
ХОЛЕСТЕРИНОВЫЙ ОБМЕН (греческий chole желчь + stereos твердый) — совокупность реакций биосинтеза холестерина (см.) и его распада в организме человека и животных. В организме человека за сутки около 500 мг холестерина окисляется в желчные кислоты, примерно такое же количество стеринов экскретируется с фекалиями, около 100 мг выделяется с кожным салом, небольшое количество холестерина (около 40 мг) используется для образования кортикоидных и половых гормонов, а также витамина D3, 1—2 мг холестерина выводится с мочой. У кормящих женщин с грудным молоком выделяется 100— 200 мг холестерина в сутки. Эти потери восполняются за счет синтеза холестерина в организме (у взрослого человека в сутки около 700—1000 мг) и поступления его с пищей (300— 500 мг). Холестерин, а также часть холестерина, поступившего в просвет кишечника с желчью, всасывается в тонкой кишке в форме жировых мицелл (см. Жировой обмен). Эфиры холестерина предварительно гидролизуются при действии холестеринэстеразы (см.) панкреатического и кишечного соков. В стенке тонкой кишки холестерин используется для образования хиломикронов (см. Липопротеиды), в составе которых он поступает сначала в лимфатическую систему, а затем в кровяное русло.
В капиллярах жировой и некоторых других тканей в результате воздействия на хиломикроны липопротеид-липазы образуются частицы, обогащенные эфирами холестерина и фосфолипидами, получившие название ремнантных (остаточных) частиц. Эти частицы задерживаются в печени, где подвергаются распаду. Освободившийся при этом холестерин наряду с холестерином, синтезированным в печени, образует так называемый общий пул печеночного холестерина, который используется по мере необходимости для образования липопротеидов (см.).
Установлено, что у человека и некоторых животных липопротеиды низкой плотности транспортируют холестерин в органы и ткани, причем захват липоиротеидных частиц клетками этих органов и тканей осуществляется при участии специфических рецепторов. Холестерин, доставленный в клетку в составе липопротеидных частиц, идет на покрытие потребностей клетки (образование мембран при делении клетки, синтез стероидных гормонов и др.). Избыточная часть неэтерифицированного (свободного) холестерина превращается в его эфиры при действии содержащегося в клетке фермента — холестеролацилтрансферазы (КФ 2.3.1.26). Обратный транспорт неэтерифицированного холестерина из различных органов и тканей в печень осуществляется липопротеидами высокой плотности, причем в кровяном русле происходит этерификация захваченного холестерина при участии лецитина и фермента холестерин-лецитин - ацилтрансферазы (КФ 2.3.1.43). Доставленный таким путем в печень холестерин идет на образование желчных кислот (см.).
Синтез холестерина
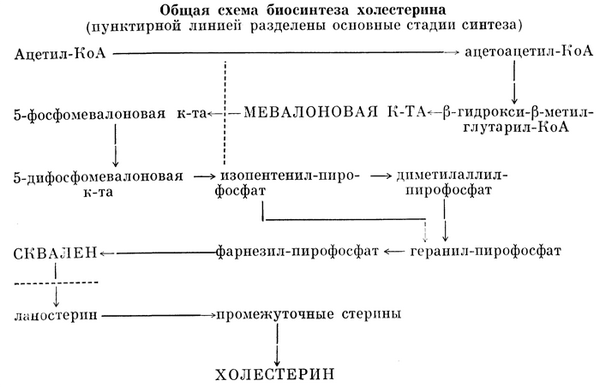
Синтез холестерина осуществляется в клетках почти всех органов и тканей, однако в значительных количествах он образуется в печени (80%), стенке тонкой кишки (10%) и коже (5%). К. Блох, Ф. Линен и др. показали основные реакции биосинтеза холестерина (их не менее 30). Сложный процесс биосинтеза холестерина можно разделить на три стадии: 1) биосинтез мевалоновой кислоты; 2) образование сквалена из мевалоновой кислоты; 3) циклизация сквалена и образование холестерина (см. схему).
Считают, что главным источником образования мевалоновой кислоты в печени является ацетил-КоА, а в мышечной ткани — лейцин. И то и другое соединения в результате ряда энзиматических реакций образуют бета-гидрокси-бета-метилглутарил-КоА (ГМГ-КоА), который затем восстанавливается в мевалоновую кислоту. В последнее время показано, что в синтез мевалоновой кислоты в печени может включаться и малонил-КоА.
Реакцией, определяющей скорость биосинтеза холестерина в целом, является восстановление ГМГ-КоА в мевалоновую кислоту; этот процесс катализирует фермент НАДФ-Н2-зависимая ГМГ-КоА-редуктаза (КФ 1.1.1.34). Именно этот фермент подвержен воздействиям со стороны ряда факторов. Так, активность ГМГ-КоА-редуктазы повышается (или содержание ее в печени возрастает) и скорость синтеза холестерина в целом увеличивается при действии ионизирующего излучения, введении тиреоидных гормонов, поверхностно-активных веществ, холестирамина, а также при гипофизэктомии. Угнетение синтеза холестерина отмечается при голодании, тиреоидэктомии и при поступлении в организм пищевого холестерина. Последний угнетает активность (или синтез) фермента ГМГ-КоА-редуктазы.
Синтез холестерина в стенке тонкой кишки регулируется исключительно концентрацией желчных кислот. Так, отсутствие их в кишечнике при наличии наружного желчного свища ведет к повышению синтеза холестерина в тонкой кишке в 5—10 раз.
На второй стадии синтеза происходит фосфорилирование мевалоновой кислоты при участии АТФ и образование нескольких фосфорилированные промежуточных продуктов (см. Фосфорилирование). При декарбоксилировании одного из них образуется изопентенил-пирофосфат, часть которого превращается в диметилаллил-пирофосфат. Взаимодействие этих двух соединений приводит к образованию димера — геранил-пирофосфата, содержащего 10 атомов углерода. Геранил-пирофосфат конденсируется с новой молекулой изопентенил-пирофосфата и образует тример — фарнезил-пирофосфат, содержащий 15 атомов углерода. Эта реакция идет с отщеплением молекулы пирофосфата. Затем две молекулы фарнезил-пирофосфата конденсируются, теряя каждая свой пирофосфат, и образуют гексамер сквален, содержащий 30 атомов углерода.
Третья стадия синтеза включает окислительную циклизацию сквалена, сопровождающуюся миграцией двойных связей и образованием первого циклического соединения — ланостерина. Ланостерин уже имеет гидроксильную группу в положении 3 и три лишние (по сравнению с холестерином) метильные группы. Дальнейшее превращение ланосте-рина может совершаться двумя путями, причем и в том и в другом случае промежуточными продуктами являются соединения стериновой природы. Более доказанным считается путь через 24, 25-дигидроланостерин и ряд других стеринов, включая 7-дигидрохолестерин, служащий непосредственным предшественником холестерина. Другой возможный путь — превращение ланостерина в зимостерин, а затем в десмостерин, из которого при восстановлении образуется холестерин.
Если суммировать общий итог всех реакций биосинтеза холестерина, то он может быть представлен в следующем виде:
18CH3CO-S-KoA + 10(H + ) + 1/2O2 —> C27H46O + 9CO2 + 18KoA-SH. Источником углерода холестерина является ацетил-КоА (им может быть также малонил-КоА и лейцин), источником водорода — вода и никотин-амида дениндинуклеотидфосфат, а источником кислорода — молекулярный кислород.
Начиная со сквалена и кончая холестерином все промежуточные продукты биосинтеза нерастворимы в водной среде, поэтому они участвуют в конечных реакциях биосинтеза холестерина в связанном со сквален или стеринпереносящими белками состоянии. Это позволяет им растворяться в цитоплазме клетки и создает условия для протекания соответствующих реакций. Холестерин-переносящий белок обеспечивает также перемещение стеринов внутри клетки, что имеет важное значение для вхождения его в мембрану клетки, а также для транспорта в клеточные системы, осуществляющие катаболизм холестерина.
Катаболизм холестерина протекает в печени (окисление его в желчные кислоты), в надпочечниках и плаценте (образование из холестерина стероидных гормонов), в тестикулярной ткани и яичниках (образование половых гормонов). При биосинтезе холестерина в коже на завершающей стадии образуется небольшое количество 7-дегидрохолестерина. Под влиянием УФ-лучей он превращается в витамин D3.
Своеобразные превращения претерпевает холестерин в толстой кишке. Речь идет о той части пищевого холестерина или холестерина, поступившего в кишечник с желчью, которая не подверглась всасыванию. Под влиянием микробной флоры толстой кишки происходит восстановление холестерина и образование так наз. нейтральных стеринов. Главным их представителем является копростерин. Экспериментальные исследования, проведенные с использованием радиоизотопных и других методов, показали, что скорость обновления холестерина в различных органах и тканях неодинакова; наиболее высока она в надпочечниках и печени и чрезвычайно низка в мозге взрослых животных.
Патология холестеринового обмена
Нарушения холестеринового обмена обычно связаны с дисбалансом между количеством синтезируемого в организме и поступающего с пищей холестерина, с одной стороны, и количеством холестерина, подвергающегося катаболизму,— с другой. Эти нарушения проявляются в изменении уровня холестерина в плазме крови, которые классифицируются как гиперхолестеринемия или гипохолестеринемия (для взрослого населения высокоразвитых стран величины выше 270 мг/100 мл и ниже 150 мг/100 мл соответственно).
Гиперхолестеринемия может быть первичной (наследственной или алиментарной) и вторичной, обусловленной различными заболеваниями. Наследственная (семейная) гиперхолестеринемия характеризуется высоким уровнем холестерина и липопротеидов низкой плотности (ЛПНГЛ в плазме крови. При гомозиготной гиперхолестеринемии уровень холестеринемии может достигать 700— 800 мг/100 мл, а при гетерозиготной — 300—500 мг/100 мл. В основе наследственной гиперхолестеринемии лежит генетически обусловленное отсутствие (у гомозигот) или недостаток (у гетерозигот) специфических рецепторов к липопротеидам низкой плотности у клеток, вследствие чего резко снижается захват и последующий катаболизм этих богатых холестерином липопротеидов клетками паренхиматозных органов и тканей. В результате пониженного захвата и снижения катаболизма липопротеидов низкой плотности развивается гиперхолестеринемия (см.). Последняя приводит к раннему развитию атеросклероза (см.) и его клинических проявлений — ишемической болезни сердца (см.), преходящей ишемии мозга (см. Инсульт) и др. Особенно тяжело протекает атеросклероз при гомозиготной форме; у таких больных часто наблюдается ксантоматоз (см.), липоидная дуга роговицы (отложение холестерина в роговицу глаз), инфаркт миокарда в юношеском возрасте.
Распространенность гомозиготной формы гиперхолестеринемии невелика (примерно один случай на 1 млн. жителей). Чаще встречается гетерозиготная форма — один случай на 500 жителей.
Алиментарная гиперхолестеринемия характеризуется повышенным уровнем холестерина в плазме крови вследствие длительного потребления больших количеств пищи, богатой холестерином (куриные желтки, икра, печень, животные жиры и др.). Алиментарная гиперхолестеринемия той или иной степени выраженности характерна для жителей высокоразвитых индустриальных стран. Согласно популяционным исследованиям имеется прямая зависимость между уровнем холестерина в крови и распространенностью ишемической болезни сердца.
В эксперименте на различных животных (кролики, морские свинки, обезьяны) показано, что введение массивных доз холестерина с пищей приводит к резко выраженной гиперхолестеринемии и быстрому развитию атеросклероза. Экспериментальные модели гиперхолестеринемии и атеросклероза, впервые предложенные H. Н. Аничковым и С. С. Халатовым (1913), широко используются в научных исследованиях.
Вторичная гиперхолестеринемия встречается при гипотиреозе (см.), сахарном диабете (см. Диабет сахарный), нефротическом синдроме (см.), подагре (см.) и др. и нередко сопровождается развитием атеросклероза (см. Гиперхолестеринемия).
Выделяют первичную и вторичную гипохолестеринемию. Первичная гипохолестеринемия характерна для наследственного заболевания — абеталипопротеинемии (см.). При этой болезни отмечается почти полное отсутствие в плазме крови липопротеидов низкой плотности (у гомозигот) или значительное их снижение (у гетерозигот). Уровень общего холестерина не превышает 75 мг/ 100 мл. Гомозиготная форма болезни протекает исключительно тяжело. В основе абеталипопротеинемии лежит генетически обусловленное нарушение синтеза апопротеина В — главного белка липопротеидов низкой плотности.
Вторичные гипохолестеринемии наблюдаются при кахексии, гипертиреоидизме, аддисоновой болезни и паренхиматозных заболеваниях печени, при ряде инфекционных болезней и интоксикациях (см. Гипохолестеринемия). При недостаточной активности в плазме крови фермента лецитин - холестерин -ацилтрансферазы, или ЛХАТ (наследственная ЛXАТ-недостаточность), ответственного за этерификацию холестерина плазмы, наблюдается накопление неэтерифицированного холестерина в мембранах эритроцитов и клетках почек, печени, селезенки, костного мозга, роговицы глаза. Резко снижается доля этерифицированного холестерина в плазме крови и одновременно повышается уровень неэтерифицированного холестерина и лецитина. У больных с наследственной ЛXAT-недостаточностыо стенки артерий и капилляров подвержены деструктивным изменениям, что связано с отложением в них липидов. Наиболее тяжелые изменения происходят в сосудах почечных клубочков, что приводит к развитию почечной недостаточности (см.).
Одним из распространенных нарушений холестериновый обмен. является образование желчных камней, основной составной частью которых является холестерин (см. Желчнокаменная болезнь). Образование желчных камней происходит вследствие выкристаллизовывания холестерина при относительно высокой его концентрации в желчи и относительно низкой концентрации в ней желчных кислот и фосфолипидов, обладающих способностью растворять холестерин. Исследования показали, что имеется прямая связь между уровнем холестерина в плазме крови и распространенностью холестероза (см.) и желчнокаменной болезни.
Библиогр.: Климов А. Н, и Н икульчева Н. Г. Липопротеиды, дислипопротеидемии и атеросклероз, Л., 1984; Полякова Э. Д. Пути биосинтеза холестерина в печени и их регуляция, в кн.: Липиды, структура,биосинтез, превращения и функции, под ред. С. Е. Северина, с. 131, М., 1977;она же, Регуляция содержания холестерина в клетке, в кн.: Биохимия липидов и их роль в обмене веществ, под ред.С. Е. Северина, с. 120, М., 1981; Финагин Л. К. Обмен холестерина и его регуляция, Киев, 1980; Lipids and lipidoses, ed. by G. Schettler, B.— Heidelberg, 1967; Sodhi H. S., Kudchod-k a r B. J. a. Mason D. T. Clinical methods in study of cholesterol metabolism, Basel a. o., 1979.
Что такое холестерин - для чего он нужен, функции, виды, где образуется
Холестерин - это органическое соединение, структура которого представляет собою жироподобный спирт. Он обеспечивает устойчивость мембран клеток, необходим для синтеза витамина D, стероидных гормонов, желчных кислот. Большинство холестерина (другое название холестерол - синоним) синтезируется самим организмом, небольшая часть поступает с пищей. Высокий уровень «плохого» стерола связан с риском развития сердечно-сосудистых заболеваний.
Норма холестерина в крови
Нормальный уровень холестерина соответствует среднему значению показателя, полученного при массовом обследовании здорового населения, который составляет:
- для здорового человека - не более 5,2 ммоль/л;
- для людей с ишемией или перенесенным ранее инфарктом или инсультом рекомендованная норма - не более 2,5 ммоль/л;
- для тех, кто не страдает сердечно-сосудистыми патологиями, но имеет как минимум два фактора риска (например, генетическая предрасположенность и неправильное питание) - не более 3,3 ммоль/л.
Если полученные результаты выше рекомендованной нормы дополнительно назначают проведение липидограммы.
Периодические изменения уровня холестерина в крови считаются нормой. Разовый анализ не всегда может отобразить присущую для конкретного человека концентрацию, поэтому иногда может потребоваться повторная сдача анализа через 2-3 месяца.
Повышению концентрации способствуют:
- беременность (исследование крови рекомендуется проводить как минимум через 1,5 месяца после родов);
- диеты, подразумевающие длительное голодание;
- применение медикаментозных препаратов с кортикостероидами и андрогенами;
- преобладание в ежедневном меню холестериновых продуктов.
Необходимо учесть, что диапазон нормы холестерина имеет разные показатели для мужчин и женщин, которые изменяются с возрастом. Более того, на концентрацию липидов может повлиять и принадлежность человека к определенной расе. Например, у европеоидной этнической группы холестериновые показатели нормы выше, чем у пакистанцев и индусов.
Виды холестерина в организме - липопротеины
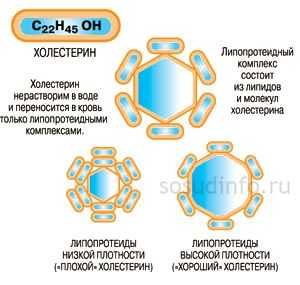
Холестерин - это жироподобный спирт. Стерол не растворятся водой, но хорошо поддается растворению жирами или органическими растворителями. Плазма крови на 90-95% состоит из воды. Поэтому если бы холестерол путешествовал по кровеносным сосудам самостоятельно, он имел вид капли жира. Такая капля способна сыграть роль тромба и перекрыть просвет небольшого сосуда. Чтобы предупредить подобную ситуацию, холестерин транспортируется белками-переносчиками - липопротеидами.
Липопротеиды - сложные структуры, состоящие из жировой, белковой части, а также фосфолипидов. Липопротеины крови зависимо от размера, функций подразделяются на 5 классов:
Высокая концентрация ЛПОНП, ЛППП, ЛПНП повышают риск развития атеросклероза, сердечно-сосудистых осложнений заболеваний, а ЛПВП - понижает. Первую группу липопротеинов называют атерогенной или плохим холестерином, вторую - антиатерогенной или хорошим холестерином. Сумму всех липопротеидов, за исключением хиломикронов называют общим холестерином.
Как образуется холестерин в организме, какие органы вырабатывают, биосинтез стерола
По своему происхождению весь стерол организма делится на две группы:
- эндогенный (80% от общего количества) - синтезируется внутренними органами;
- экзогенный (алиментарный, пищевой) - поступает вместе с едой.
Где вырабатывается холестерин в организме - стало известно относительно недавно. Секрет синтеза стерола был раскрыт в середине прошлого века двумя учеными: Теодором Линеном, Конрадом Блоком. За свое открытие биохимики получили Нобелевскую премию (1964).
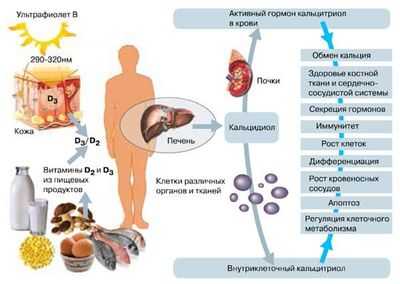
За выработку основной части холестерина в организме отвечает печень. Этот орган синтезирует около 50% стерола. Остаток холестерола вырабатывается клетками кишечника, кожи, почек, надпочечников, половых желез. Для образования холестерина организму требуется ацетат. Процесс выработки вещества довольно сложный процесс, состоящий из 5 этапов:
- синтез мевалоната на основе трех молекул ацетата;
- синтез изопентенилпирофосфата;
- образование сквалена из 6 молекул изопентенилпирофосфата;
- формирование ланостерина;
- преобразование ланостерина в холестерин.
Всего процесс биосинтеза холестерина насчитывает более 35 реакций.
Скорость синтеза стерола зависит от времени суток. Большая часть вырабатываемого холестерина образуется ночью. Поэтому лекарства, блокирующие синтез стерола (статины), принимают перед сном. Правда, последние поколения статинов обладают способностью надолго задерживаться организмом. Их прием не зависит от времени суток.
В организме человека большая часть холестерина вырабатывается для производства желчных кислот. Они синтезируются печенью. Меньшая часть расходуется на образование клеточных мембран. Совсем небольшое количество стерола организм тратит на синтез гормонов, витамина D.
Функции холестерина в организме
Холестерин жизненно необходим организму человека для нормального существования. Большую часть стерола содержат клетки головного мозга. Роль холестерола до сих пор изучена не досконально. Регулярно появляются новые публикации, заставляющие ученых по-другому взглянуть на вещество.
Функции холестерина подразделяют на 2 группы:
Структурные функции - это способность холестерина встраиваться в мембраны клеток. Стерол необходим всем клеткам организма, поскольку он придает мембранам определенную жесткость, обеспечивает устойчивость структуры к различным температурам.
Этот механизм настолько оптимален, что природа использовала его при построении клеточных оболочек практически всех живых организмов, за исключением растений, грибов, прокариотов. Также холестерин необходим клеткам для регулирования проницаемости мембраны для ионов водорода, натрия. Это позволяет поддерживать внутри структур постоянные условия.
Жироподобный спирт - компонент миелинового покрытия, защищающего отростки нервных клеток, передающих нервный импульс от нейрона к органу. Благодаря такому строению аксоны защищены от электрически заряженных атомов, молекул. Изоляция помогает нервному импульсу распространяться более правильно, эффективно.
Метаболическая функция холестерина - использование стерола как сырья для создания необходимых организму веществ: желчных кислот, стероидных гормонов, витамина D. За синтез желчных кислот отвечают клетки печени, стероидных гормонов - надпочечники, половые железы, витамина Д - кожа.
Обмен холестерина в организме человека
Метаболизм холестерина происходит двумя путями: эндогенным, экзогенный. Первый - отображает жизненный цикл стерола, вырабатываемого организмом, второй - поступающего с пищей.
Эндогенный цикл обмена холестерина в организме
- За синтез холестерина в организме отвечает преимущественно печень, меньшей мерой кожа, кишечник, надпочечники, половые органы. Для образования стерола требуется ацетил-КоА, который имеет каждая клетка. Путем сложных превращений из него получается холестерол.
- Половые железы, надпочечники сразу используют холестерол для синтеза гормонов, а кожа - на витамин Д. Печень образует из стерола желчные кислоты, часть связывает с ЛПОНП.
- ЛПОНП частично гидролизуются. Так образуются ЛПВП. Процесс гидролиза сопровождается снижением содержания триглицеридов, повышением холестерина.
- Если клетке нужен холестерол, она сигнализирует об этом синтезом ЛПНП-рецепторов. Липопротеины прилипают к ним, а затем поглощаются клеткой. Внутри происходит расщепление ЛПНП, высвобождение стерола.
Экзогенный цикл обмена холестерина в организме
- Фермент поджелудочной железы подготавливает эфиры холестерина к всасыванию.
- Клетки кишечника обрабатывают производные холестерола к дальнейшему транспорту, упаковывая молекулы в состав хиломикрона. Усвояемость алиментарного стерола составляет 30-35%.
- Хиломикроны попадают в лимфатическое русло, перемещаются к грудной протоке. Здесь липопротеиды покидают лимфатическую систему, перемещаясь в подключичную вену.
- Хиломикроны контактируют с мышечными, жировыми клетками и передают им нейтральные жиры. После чего они изымаются из кровотока клетками печени, которые извлекают из липопротеидов холестерин.
- Печень использует экзогенный стерол для синтеза ЛПОНП или желчных кислот.
Выведение холестерина
Правильный обмен холестерина предполагает баланс между количеством спирта необходимого организму и его фактическим уровнем. Излишки стерола выводятся из тканей ЛПВП. Они адсорбируют стерол клеток, транспортируют его к печени. Содержащие холестерин желчные кислоты поступают в кишечник, откуда излишки выводятся с калом. Незначительная часть жиросодержащего спирта выделяется с мочой при выведении гормонов, а также слущивании эпителия.
Регуляция холестеринового обмена
Обменом холестерина в организме управляет принцип обратной связи. Наше тело анализирует содержание холестерола крови и либо активирует фермент ГМГ-КоА-редуктазу, либо блокирует его активность. Этот энзим отвечает за прохождение одного из первых этапов синтеза стерола. Управление активностью ГМГ-КоА-редуктазы позволяет сдерживать или стимулировать образование холестерина.
Синтез стерола тормозится при связывании ЛПНП с рецепторами. Существуют доказательства влияния на активность образования спирта гормонов. Введение инсулина, тиреоидного гормона увеличивает активность ГМГ-КоА-редутазы, а глюкагона, глюкокортикоидов тормозит.
На объемы синтеза стерола оказывает влияние количество алиментарного холестерола. Чем больше наша еда содержит холестерина, тем меньше организм занимается образованием вещества. Интересно, что тормозится только печеночный цикл выработки. Активность клеток кишечника, печени, надпочечников, половых желез остается прежней.
Общая схема обмена холестерина в организме человека.
Роль холестерина в развитии атеросклероза
Взаимосвязь между уровнем отдельных фракций липидов и здоровьем известна давно. Высокий уровень атерогенных липопротеидов (ЛПОНП, ЛПНП) способствуют развитию сердечно-сосудистых заболеваний. Такая фракция белково-жировых комплексов склонна оседать на стенках сосудов. Так формируется атеросклеротическая бляшка. Если она заметно сузит или перекроет просвет сосуда, развивается ишемическая болезнь сердца, мозга, недостаточность кровообращения ног.
Самые страшные осложнения атеросклероза - инфаркт миокарда, инсульт, гангрена стоп развиваются при полном перекрытии или отрывании бляшки/тромба с последующей закупоркой сосудов. Атеросклероз аорты может закончиться расслоением или разрывом сосуда.
Мелкие ЛПВП не склонны к оседанию на стенках сосуда. Наоборот они способствуют выведению холестерина из организма. Поэтому их высокий уровень - хороший сигнал.
Зависимость риска развития атеросклероза от уровня холестерина.
| Концентрация (мг/дл) | Уровень риска |
|---|---|
| ЛПНП | |
| менее 100 | низкий |
| 100-129 | близкий к низкому |
| 130-159 | средний |
| 160-189 | высокий |
| более 190 | очень высокий |
| Общий холестерин (ОХ) | |
| менее 200 | низкий |
| 200-239 | средний |
| более 239 | высокий |
Для определения риска имеет значение соотношение между различными фракциями холестерола.
| Уровень риска | Мужчины | Женщины |
|---|---|---|
| ОХ/ЛПВП | ||
| очень низкий | менее 3,4 | менее 3,3 |
| низкий | 4,0 | 3,8 |
| средний | 5,0 | 4,5 |
| выраженный | 9,5 | 7,0 |
| высокий | более 23 | более 11 |
| ЛПНП/ЛПВП | ||
| очень низкий | 1,0 | 1,5 |
| средний | 3,6 | 3,2 |
| выраженный | 6,5 | 5,0 |
| высокий | 8,0 | 6,1 |
Производные холестерина, функции
Желчные кислоты
Каждый живой организм имеет свой видоспецифичный набор желчных кислот. Все желчные кислоты человека делятся на:
- первичные (холевая, хенодезоксихолевая) синтезируются печенью из холестерина;
- вторичные (дезоксихолевая, литохолевая, аллохолевая, урсодезоксихолевая) - образуются из первичных микрофлорой кишечника;
- третичные (урсодезоксихолевая) - синтезируется из вторичных.
Часть желчных кислот после поступления в кишечник всасывается обратно, транспортируется током крови к печени. Такой процесс получил название рециркуляции. Он дает возможность организму использовать желчные кислоты несколько раз, экономя силы на синтез новых.
Желчные кислоты необходимы, прежде всего, для усвоения пищевых жиров, выведения лишнего холестерина.
Витамин D
Витамин Д - несколько витаминов, основные из которых холекальциферол, эргокальциферол. Первый синтезируется клетками кожи на основе холестерина, второй должен поступать с едой. Основные функции витамина Д - усвоение кальция, фосфора из продуктов питания. Предполагается, что он регулирует размножение клеток, метаболизм, стимулирует синтез некоторых гормонов.
Недостаток витамина Д проявляется рахитом. Долговременный дефицит способствует развитию рака, повышает вероятность возникновения остеопороза, повышает риск сердечно-сосудистых заболеваний, ослабляет иммунитет. У людей, страдающих ожирением, часто диагностируют гиповитаминоз Д.
Недостаток витамина провоцирует развитие псориаза, витилиго, некоторых аутоиммунных заболевания. Имеются данные, подтверждающие связь дефицита с проблемами памяти, болями мышц, бессонницей.
Кортикостероиды
Кортикостероиды объединяют три основных гормона: кортизон, гидрокортизон, альдостерон. Их структура включает стероидное кольцо, донором которого является холестерин. Все кортикостероиды вырабатываются надпочечниками. Кортизол относится к глюкокортикоидам, а альдостерон - минералокортикоидам.
Глюкокортикоиды обладают разносторонним действием:
- Антистрессовое, противошоковое. Их уровень повышается при стрессе, кровопотере, шоке, травмах. Они запускают ряд реакций, помогающих организму пережить экстремальную ситуацию: повышают артериальное давление, чувствительность сердечной мышцы, стенок сосудов к адреналину, препятствуют развитию толерантности к катехоламинам. Глюкокортикоиды стимулируют синтез эритроцитов, что помогает организму быстро восполнить потерю крови.
- Метаболическое. Уровень кортизола, гидрокортизола влияет на метаболизм глюкозы. Под действием гормонов повышается ее уровень, активизируется синтез глюкозы из аминокислот, тормозится захват, использование сахара клетками органов, стимулируется синтез гликогена. Глюкокортикоиды способствуют задержке ионов натрия, хлора, воды, усиливают выделение кальция, калия. Гормоны данной группы снижают чувствительность тканей к половым гормонам, инкретам щитовидной железы, соматотропину, инсулину.
- Иммунорегулирующее. Глюкокортикоиды способны усиленно угнетать активность иммунных клеток, поэтому их используют как иммуносупрессоры при аутоиммунных заболеваниях. Также они снижают количество эозинофилов - клеток крови, ответственных за аллергию, синтез иммуноглобулинов класса Е. Благодаря чему достигается антиаллергический эффект.
- Противовоспалительное. Все глюкокортикоиды обладают мощным противовоспалительным эффектом. Поэтому они частая составляющая разнообразных противовоспалительных мазей.
Альдостерон называют антидиуретическим гормоном. Он не дает выводиться из организма ионам натрия, хлора, воды, усиливает выделение ионов кальция, повышает способность тканей удерживать воду. Конечный результат - увеличение объема крови, повышение артериального давления.
Половые стероиды
Основные половые стероиды - андрогены, эстрогены, прогестерон. По своему строению они отдаленно напоминают кортикостероиды, чем обязаны общему прародителю - холестерину.
Основные андрогены - тестостерон, андростерон стимулируют синтез белков, тормозят их распад. Вот почему мужчины обычно имеют большую мышечную массу по сравнению с женщинами. Андрогены повышают усвоение глюкозы клетками организма, снижают общее количество подкожного жира, но могут способствовать формированию типичного мужского животика. Мужские половые гормоны обладают атерогенным эффектом: снижают содержание ЛПВП, увеличивают ЛПНП.
Андрогены отвечают за половое возбуждение (обоих полов), силу эрекции. Во время полового созревания, они стимулируют появление вторичных половых признаков.
Эстрогены активируют развитие матки, маточных труб, формирование вторичных половых признаков, регулируют менструальный цикл. Обладают способностью снижать концентрацию ЛПНП, общего холестерина. Поэтому до наступления менопаузы женщины гораздо более защищены от риска развития атеросклероза, чем мужчины. Эстрогены способствуют тонусу, эластичности кожи.
Прогестерон - гормон, регулирующий менструальный цикл, способствующий сохранению беременности, контролирующий эмбриональное развитие. Вместе с эстрогенами улучшает состояние кожи, делая ее гладкой, упругой.
Липопротеины: ЛПНП, ЛПВП, ЛПОНП - нормы, повышены в крови
Липопротеины — сложные белково-липидные комплексы, входящие в состав всех живых организмов и являющиеся необходимой составной частью клеточных структур. Липопротеины выполняют транспортную функцию. Их содержание в крови - важный диагностический тест, сигнализирующий о степени развития заболеваний систем организма.
Это класс сложных молекул, в состав которых могут одновременно входить свободные триглицериды, жирные кислоты, нейтральные жиры, фосфолипиды и холестерин в различных количественных соотношениях.
Липопротеины доставляют липиды в различные ткани и органы. Они состоят из неполярных жиров, расположенных в центральной части молекулы — ядре, которое окружено оболочкой, образованной из полярных липидов и апобелков. Подобным строением липопротеинов объясняются их амфифильные свойства: одновременная гидрофильность и гидрофобность вещества.
Функции и значение
Липиды играют важную роль в организме человека. Они содержатся во всех клетках и тканях и участвуют во многих обменных процессах.
- Липопротеины - основная транспортная форма липидов в организме. Поскольку липиды являются нерастворимыми соединениями, они не могут самостоятельно выполнять свое предназначение. Липиды связываются в крови с белками - апопротеинами, становятся растворимыми и образуют новое вещество, получившее название липопротеид или липопротеин. Эти два названия являются равноценными, сокращенно — ЛП.
Липопротеины занимают ключевое положение в транспорте и метаболизме липидов. Хиломикроны транспортируют жиры, поступающие в организм вместе с пищей, ЛПОНП доставляют к месту утилизации эндогенные триглицериды, с помощью ЛПНП в клетки поступает холестерин, ЛПВП обладают антиатерогенными свойствами.
- Липопротеины повышают проницаемость клеточных мембран.
- ЛП, белковая часть которых представлена глобулинами, стимулируют иммунитет, активизируют свертывающую систему крови и доставляют железо к тканям.
Классификация
ЛП плазмы крови классифицируют по плотности (с помощью метода ультрацентрифугирования). Чем больше в молекуле ЛП содержится липидов, тем ниже их плотность. Выделяют ЛПОНП, ЛПНП, ЛПВП, хиломикроны. Это самая точная из всех существующих классификаций ЛП, которая была разработана и доказана с помощью точного и довольно кропотливого метода — ультрацентрифугирования.

По размерам ЛП также неоднородны. Самыми крупными являются молекулы хиломикронов, а затем по уменьшению размера - ЛПОНП, ЛПСП, ЛПНП, ЛПВП.
Электрофоретическая классификация ЛП пользуется большой популярностью у клиницистов. С помощью электрофореза были выделены следующие классы ЛП: хиломикроны, пре-бета-липопротеины, бета-липопротеины, альфа-липопротеины. Данный метод основан на введении в жидкую среду активного вещества с помощью гальванического тока.
Фракционирование ЛП проводят с целью определения их концентрации в плазме крови. ЛПОНП и ЛПНП осаждают гепарином, а ЛПВП остаются в надосадочной жидкости.
В настоящее время выделяют следующие виды липопротеинов:
ЛПВП (липопротеины высокой плотности)
ЛПВП обеспечивают транспорт холестерина от тканей организма к печени.
ЛПВП содержат фосфолипиды, которые поддерживают холестерин во взвешенном состоянии и предупреждают его выход из кровяного русла. ЛПВП синтезируются в печени и обеспечивают обратный транспорт холестерина из окружающих тканей к печени на утилизацию.
- Увеличение ЛПВП в крови отмечают при ожирении, жировом гепатозе и билиарном циррозе печени, алкогольной интоксикации.
- Снижение ЛПВП происходит при наследственной болезни Танжера, обусловленной скоплением холестерина в тканях. В большинстве прочих случаев снижение концентрации ЛПВП в крови — признак атеросклеротического повреждения сосудов.
Норма ЛПВП отличается у мужчин и женщин. У лиц мужского пола значение ЛП данного класса колеблется в пределах от 0,78 до 1,81 ммоль/л, норма у женщин ЛПВП — от 0,78 до 2,20, в зависимости от возраста.
ЛПНП (липопротеины низкой плотности)
ЛПНП являются переносчиками эндогенного холестерина, триглицеридов и фосфолипидов от печени к тканям.
Данный класс ЛП содержит до 45% холестерина и является его транспортной формой в крови. ЛПНП образуются в крови в результате действия на ЛПОНП фермента липопротеинлипазы. При его избытке на стенках сосудов появляются атеросклеротические бляшки.
В норме количество ЛПНП составляет 1,3-3,5 ммоль/л.
- Уровень ЛПНП в крови повышается при гиперлипидемии, гипофункции щитовидной железы, нефротическом синдроме.
- Пониженный уровень ЛПНП наблюдается при воспалении поджелудочной железы, печеночно-почечной патологии, острых инфекционных процессах, беременности.
инфографика (увеличение по клику) - холестерин и ЛП, роль в организме и нормы
ЛПОНП (липопротеины очень низкой плотности)
ЛПОНП образуются в печени. Они переносят эндогенные липиды, синтезируемый в печени из углеводов, в ткани.
Это самые крупные ЛП, уступающие по размерам лишь хиломикронам. Они более, чем на половину состоят из триглицеридов и содержат небольшое количество холестерина. При избытке ЛПОНП кровь становится мутной и приобретает молочный оттенок.
ЛПОНП — источник «плохого» холестерина, из которого на эндотелии сосудов образуются бляшки. Постепенно бляшки увеличиваются, присоединяется тромбоз с риском острой ишемии. ЛПОНП повышены у больных с сахарным диабетом и болезнями почек.
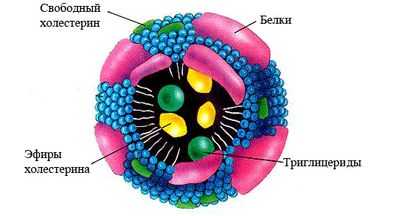
Хиломикроны
Хиломикроны отсутствуют в крови у здорового человека и появляются только при нарушении обмена липидов. Хиломикроны синтезируются в эпителиальных клетках слизистой оболочки тонкого кишечника. Они доставляют экзогенный жир из кишечника в периферические ткани и печень. Большую часть транспортируемых жиров составляют триглицериды, а также фосфолипиды и холестерин. В печени под воздействием ферментов триглицериды распадаются, и образуются жирные кислоты, часть которых транспортируется в мышцы и жировую ткань, а другая часть связывается с альбуминами крови.
как выглядят основные липопротеины
ЛПНП и ЛПОНП являются высокоатерогенными - содержащими много холестерина. Они проникают в стенку артерий и накапливаются в ней. При нарушении метаболизма уровень ЛПНП и холестерина резко повышается.
Наиболее безопасными в отношении атеросклероза являются ЛПВП. Липопротеины этого класса выводят холестерин из клеток и способствуют его поступлению в печень. Оттуда он вместе с желчью попадает в кишечник и покидает организм.
Представители всех остальных классов ЛП доставляют холестерин в клетки. Холестерин - это липопротеид, входящий в состав клеточной стенки. Он участвует в образовании половых гормонов, процессе желчеобразования, синтезе витамина Д, необходимого для усвоения кальция. Эндогенный холестерин синтезируется в печеночной ткани, клетках надпочечников, стенках кишечника и даже в коже. Экзогенный холестерин поступает в организм вместе с продуктами животного происхождения.
Дислипопротеинемия - диагноз при нарушении обмена липопротеинов
Дислипопротеинемия развивается при нарушении в организме человека двух процессов: образования ЛП и скорости их выведения из крови. Нарушение соотношения ЛП в крови - не патология, а фактор развития хронического заболевания, при котором уплотняются артериальные стенки, суживается их просвет и нарушается кровоснабжение внутренних органов.
При повышении уровня холестерина в крови и снижении уровня ЛПВП развивается атеросклероз, приводящий к развитию смертельно опасных заболеваний.
Этиология
Первичная дислипопротеинемия является генетически детерминированной.

Причинами вторичной дислипопротеинемии являются:
- Гиподинамия,
- Сахарный диабет,
- Алкоголизм,
- Дисфункция почек,
- Гипотиреоз,
- Печеночно-почечная недостаточность,
- Длительный прием некоторых лекарств.
Понятие дислипопротеинемия включает 3 процесса — гиперлипопротеинемию, гиполипопротеинемию, алипопротеинемию. Дислипопротеинемия встречается довольно часто: у каждого второго жителя планеты отмечаются подобные изменения в крови.
Гиперлипопротеинемия — повышенное содержание ЛП в крови, обусловленное экзогенными и эндогенными причинами. Вторичная форма гиперлипопротеинемии развивается на фоне основной патологии. При аутоиммунных заболеваниях ЛП воспринимаются организмом как антигены, к которым вырабатываются антитела. В результате образуются комплексы антиген — антитело, обладающие большей атерогенностью, чем сами ЛП.
- Гиперлипопротеинемия 1 типа характеризуется образованием ксантом - плотных узелков, содержащих холестерин и расположенных над поверхностью сухожилий, развитием гепатоспленомегалии, панкреатита. Больные жалуются на ухудшение общего состояния, подъем температуры, потерю аппетита, приступообразную боль в животе, усиливающуюся после приема жирной пищи.
Ксантомы (слева) и ксантелазмы (в центре и справа) - внешние проявления дислипопротеинемии
Алипопротеинемия — генетически обусловленное заболевание с аутосомно-доминантным типом наследования. Заболевание проявляется увеличением миндалин с оранжевым налетом, гепатоспленомегалией, лимфаденитом, мышечной слабостью, снижением рефлексов, гипочувствительностью.
Гиполипопротеинемия - низкое содержание в крови ЛП, часто протекающее бессимптомно. Причинами заболевания являются:
- Наследственность,
- Неправильное питание,
- Сидячий образ жизни,
- Алкоголизм,
- Патология пищеварительной системы,
- Эндокринопатия.
Дислипопротеинемии бывают: органными или регуляторными, токсигенными, базальными — исследование уровня ЛП натощак, индуцированными — исследование уровня ЛП после приема пищи, препаратов или физической нагрузки.
Диагностика
Известно, что для организма человека избыток холестерина очень вреден. Но и недостаток этого вещества может привести к дисфункции органов и систем. Проблема кроется в наследственной предрасположенности, а также в образе жизни и особенностях питания.

Диагностика дислипопротеинемии основывается на данных анамнеза болезни, жалобах больных, клинических признаках — наличии ксантом, ксантелазм, липоидной дуги роговицы.
Основным диагностическим методом дислипопротеинемии является анализ крови на липиды. Определяют коэффициент атерогенности и основные показатели липидограммы — триглицериды,общий холестерин, ЛПВП, ЛПНП.
Липидограмма - метод лабораторной диагностики, который выявляет нарушения липидного обмена, приводящие к развитию заболеваний сердца и сосудов. Липидограмма позволяет врачу оценить состояние пациента, определить риск развития атеросклероза коронарных, мозговых, почечных и печеночных сосудов, а также заболеваний внутренних органов. Кровь сдают в лаборатории строго натощак, спустя минимум 12 часов после последнего приема пищи. За сутки до анализа исключают прием алкоголя, а за час до исследования — курение. Накануне анализа желательно избегать стресса и эмоционального перенапряжения.
Ферментативный метод исследования венозной крови является основным для определения липидов. Прибор фиксирует предварительно окрашенные специальными реагентами пробы. Данный диагностический метод позволяет провести массовые обследования и получить точные результаты.
Сдавать анализы на определение липидного спектра с профилактической целью, начиная с юности необходимо 1 раз в 5 лет. Лицам, достигшим 40 лет, делать это следует ежегодно. Проводят исследование крови практически в каждой районной поликлинике. Больным, страдающим гипертонией, ожирением, заболеваниями сердца, печени и почек, назначают биохимический анализ крови и липидограмму. Отягощенная наследственность, имеющиеся факторы риска, контроль эффективности лечения — показания для назначения липидограммы.
Результаты исследования могут быть недостоверны после употребления накануне пищи, курения, перенесенного стресса, острой инфекции, при беременности, приеме некоторых лекарственных препаратов.
Диагностикой и лечение патологии занимается эндокринолог, кардиолог, терапевт, врач общей практики, семейный врач.
Лечение
Диетотерапия играет огромную роль в лечении дислипопротеинемии. Больным рекомендуют ограничить потребление животных жиров или заменить их синтетическими, принимать пищу до 5 раз в сутки небольшими порциями. Рацион необходимо обогащать витаминами и пищевыми волокнами. Следует отказаться от жирной и жареной пищи, мясо заменить морской рыбой, есть много овощей и фруктов. Общеукрепляющая терапия и достаточная физическая нагрузка улучшают общее состояние больных.
рисунок: полезная и вредная “диеты” с точки зрения баланса ЛП
Гиполипидемическая терапия и антигиперлипопротеинемические препараты предназначены для коррекции дислипопротеинемии. Они направлены на снижение уровня холестерина и ЛПНП в крови, а также на повышение уровня ЛПВП.
Из препаратов для лечения гиперлипопротеинемии больным назначают:
- Статины - «Ловастатин», «Флувастатин», «Мевакор», «Зокор», «Липитор». Эта группа препаратов уменьшает выработку холестерина печенью, снижает количество внутриклеточного холестерина, разрушает липиды и оказывает противовоспалительное действие.
- Секвестранты снижают синтез холестерина и выводят его из организма - «Холестирамин», «Колестипол», «Холестипол», «Холестан».
- Фибраты снижаю уровень триглицеридов и повышают уровень ЛПВП - «Фенофибрат», «Ципрофибрат».
- Витамины группы В.
Гиперлипопротеинемия требует лечения гиполипидемическими препаратами «Холестерамином», «Никотиновой кислотой», «Мисклероном», «Клофибратом».
Лечение вторичной формы дислипопротеинемии заключается в устранении основного заболевания. Больным сахарным диабетом рекомендуют изменить образ жизни, регулярно принимать сахаропонижающие препараты, а также статины и фибраты. В тяжелых случаях требуется проведение инсулинотерапии. При гипотиреозе необходимо нормализовать функцию щитовидной железы. Для этого больным проводят гормональную заместительную терапию.
Больным, страдающим дислипопротеинемией, рекомендуют после проведения основного лечения:
Хороший, плохой, злой холестерин

Обзор
Нарушение жирового обмена является основным фактором развития атеросклероза и связанных с ним осложнений (ишемическая болезнь сердца, инфаркт, инсульт, облитерация сосудов нижних конечностей и пр.). При этом наиболее важным фактором повышенного риска атеросклероза является повышение содержания в крови атерогенных липопротеинов.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Вряд ли сейчас найдется человек, который не слышал, что высокий холестерин — это плохо. Однако столь же мала вероятность встретить человека, который знает, ПОЧЕМУ высокий холестерин — это плохо. И чем определяется высокий холестерин. И что такое высокий холестерин. И что такое холестерин вообще, зачем он нужен и откуда берется.
Конкурс «био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Итак, история вопроса такова. Давным-давно, в одна тысяча девятьсот тринадцатом году, петербуржский физиолог Аничков Николай Александрович показал: не что иное, как холестерин, вызывает атеросклероз у экспериментальных кроликов, содержащихся на пище животного происхождения [1]. Вообще же, холестерин необходим для нормального функционирования животных клеток и является основной составляющей клеточных мембран , а также служит субстратом для синтеза стероидных гормонов и желчных кислот.
Довольно подробно о роли холестерина в работе биомембран рассказывается в статье «Липидный фундамент жизни» [12]. — Ред.
Главный липидный компонент пищевого жира и жировых отложений — это триглицериды, которые представляют собой эфиры глицерина и жирных кислот. Холестерин и триглицериды, будучи неполярными липидными веществами, транспортируются в плазме крови в составе липопротеиновых частиц. Частицы эти подразделяют по размеру, плотности, относительному содержанию холестерина, триглицеридов и белков на пять больших классов: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) [2]. Традиционно ЛПНП считается «плохим» холестерином, а ЛПВП — «хорошим» (рис. 1).
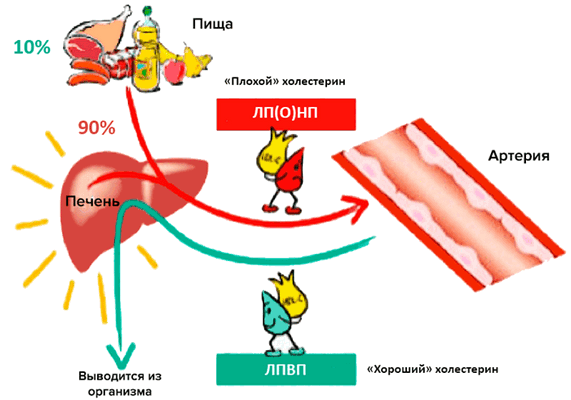
Рисунок 1. «Плохой» и «хороший» холестерины. Участие различных липопротеиновых частиц в транспорте липидов и холестерина.
Схематично структура липопротеина включает неполярное ядро, состоящее по большей части из холестерина и триглицеридов, и оболочку из фосфолипидов и апопротеинов (рис. 2). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц, а также в обмене липидными частями между различными липопротеинами [3].
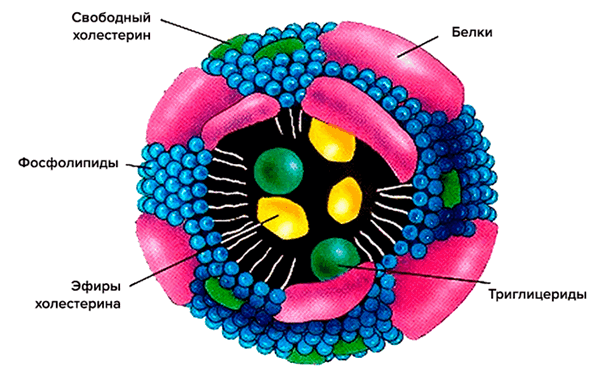
Рисунок 2. Схематическое строение липопротеиновой частицы
Баланс уровня холестерина в организме достигается следующими процессами: внутриклеточный синтез, захват из плазмы (главным образом из ЛПНП), выход из клетки в плазму (главным образом в составе ЛПВП). Предшественник синтеза стероидов — ацетил коэнзим А (CoA). Процесс синтеза включает, по крайней мере, 21 шаг, начиная с последовательного преобразования ацетоацетил CoA. Лимитирующая стадия синтеза холестерина в большой степени определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень [4]. При недостатке холестерина происходит компенсаторное усиление его захвата и синтеза.
Транспорт холестерина
Систему транспорта липидов можно разделить на две большие части: внешнюю и внутреннюю.
Внешний путь начинается с всасывания в кишечнике холестерина и триглицеридов. Его конечный результат — доставка триглицеридов в жировую ткань и мышцы, а холестерина — в печень. В кишечнике пищевой холестерин и триглицериды связываются с апопротеинами и фосфолипидами, формируя хиломикроны, которые через лимфоток попадают в плазму, мышечную и жировую ткани. Здесь хиломикроны взаимодействуют с липопротеинлипазой — ферментом, который освобождает жирные кислоты. Эти жирные кислоты поступают в жировую и мышечную ткани для накопления и окисления соответственно. После изъятия триглицеридного ядра остаточные хиломикроны содержат большое количество холестерина и апопротеина Е. Апопротеин Е специфически связывается со своим рецептором в клетках печени, после чего остаточный хиломикрон захватывается и катаболизируется в лизосомах. В результате этого процесса освобождается холестерин, который затем преобразуется в желчные кислоты и выводится или участвует в формировании новых липопротеинов, образующихся в печени (ЛПОНП). При нормальных условиях хиломикроны находятся в плазме в течение 1-5 ч. после приема пищи [2], [3].
Внутренний путь. Печень постоянно синтезирует триглицериды, утилизируя свободные жирные кислоты и углеводы. В составе липидного ядра ЛПОНП они выходят в кровь. Внутриклеточный процесс формирования этих частиц схож с таковым для хиломикронов, за исключением различия в апопротеинах. Последующее взаимодействие ЛПОНП с липопротеинлипазой в тканевых капиллярах приводит к формированию остаточных ЛПОНП, богатых холестерином (ЛППП). Примерно половина этих частиц выводится из кровотока клетками печени в течение 2-6 ч. Остальные претерпевают модификацию с замещением оставшихся триглицеридов эфирами холестерина и освобождением от всех апопротеинов, за исключением апопротеина В. В результате формируются ЛПНП, которые содержат ¾ всего плазменного холестерина. Их главная функция — доставка холестерина в клетки надпочечников, скелетных мышц, лимфоцитов, гонад и почек [3]. Модифицированные ЛПНП (окисленные продукты, количество которых возрастает при повышенном содержании в организме активных форм кислорода, так называемом окислительном стрессе) могут распознаваться иммунной системой как нежелательные элементы. Тогда макрофаги их захватывают и выводят из организма в виде ЛПВП. При чрезмерно высоком уровне ЛПНП макрофаги становятся перегруженными липидными частицами и оседают в стенках артерий, образуя атеросклеротические бляшки.
Основные транспортные функции липопротеинов приведены в таблице.
| Класс | Размеры | Функция |
|---|---|---|
| ЛПВП | 4-14 нм | Транспорт холестерина от периферийных тканей к печени |
| ЛПНП | 20-22,5 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛППП | 25-35 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛПОНП | 30-80 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75-1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Регуляция уровня холестерина
Уровень холестерина в крови в большой степени определяется диетой. Пищевые волокна снижают уровень холестерина, а пища животного происхождения повышает его содержание в крови.
Один из основных регуляторов метаболизма холестерина — рецептор LXR (рис. 3). LXR α и β принадлежат к семейству ядерных рецепторов, которые образуют гетеродимеры с ретиноидным Х рецептором и активируют гены-мишени. Их естественные лиганды — оксистерины (окисленные производные холестерина). Обе изоформы идентичны на 80% по аминокислотной последовательности. LXR-α обнаружен в печени, кишечнике, почках, селезенке, жировой ткани; LXR-β в небольшом количестве обнаруживается повсеместно [6]. Метаболический путь оксистеринов быстрее, чем у холестерина, и поэтому их концентрация лучше отражает краткосрочный баланс холестерина в организме. Существует всего три источника оксистеринов: ферментативные реакции, неферментативное окисление холестерина и поступление с пищей. Неферментативные источники оксистеринов как правило минорные, но в патологических состояниях их вклад возрастает (окислительный стресс, атеросклероз), и оксистерины могут действовать наряду с другими продуктами перекисного окисления липидов [6]. Основное влияние LXR на метаболизм холестерина: обратный захват и транспорт в печень, вывод с желчью, снижение кишечного всасывания. Уровень продукции LXR различается на протяжении аорты; в дуге, зоне турбулентности, LXR в 5 раз меньше, чем в участках со стабильным течением. В здоровых артериях повышение экспрессии LXR в зоне сильного потока оказывает антиатерогенное действие [7].
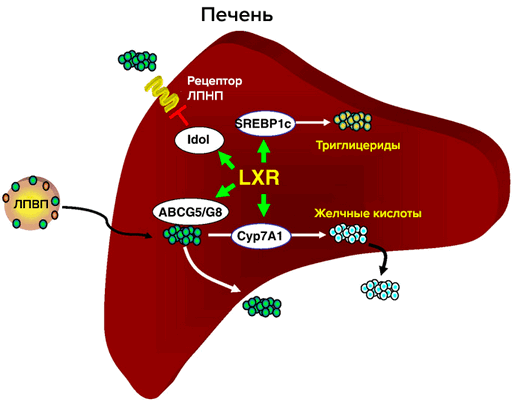
Рисунок 3. Участие рецептора LXR в метаболизме холестерина в печени
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI (рис. 4). Он был обнаружен в 1996 году как рецептор для ЛПВП [8]. В печени SR-BI отвечает за избирательный захват холестерина из ЛПВП. В надпочечниках SR-BI опосредует избирательный захват этерифицированного холестерина из ЛПВП, который необходим для синтеза глюкокортикоидов. В макрофагах SR-BI связывает холестерин, что является первым этапом в обратном транспорте холестерина. SR-BI также захватывает холестерин из плазмы и опосредует его прямой выход в кишечник [9].
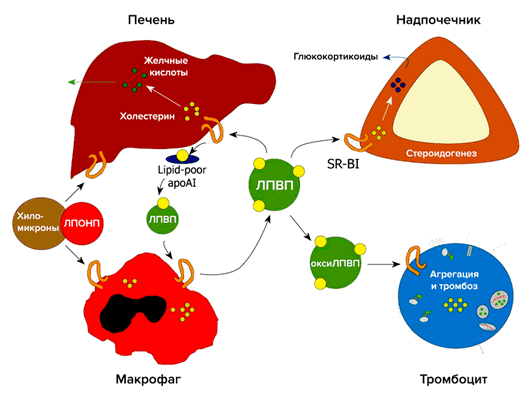
Рисунок 4. Участие рецептора SR-BI в метаболизме холестерина
Выведение холестерина из организма
Классический путь выведения холестерина: транспорт холестерина с периферии в печень (ЛПВП), захват клетками печени (SR-BI), экскреция в желчь и выведение через кишечник, где большая часть холестерина возвращается в кровь [10].
Основная функция ЛПВП — обратный транспорт холестерина в печень. Плазменные ЛПВП являются результатом комплекса различных метаболических событий. Состав ЛПВП очень различается по плотности, физико-химическим свойствам и биологической активности. Это сферические или дисковидные образования. Дисковидные ЛПВП в основном состоят из апопротеина A-I с вложенным слоем фосфолипидов и свободного холестерина. Сферические ЛПВП больше и дополнительно содержат гидрофобное ядро из эфиров холестерина и небольшого количества триглицеридов.
При метаболическом синдроме активируется обмен триглицеридов и эфиров холестерина между ЛПВП и триглицерид-богатыми липопротеинами. В результате содержание триглицеридов в ЛПВП повышается, а холестерина снижается (т.е. холестерин не выводится из организма) [11]. Отсутствие ЛПВП у людей встречается при болезни Tangier, главные клинические проявления которой — увеличенные оранжевые миндалины, роговичная дуга, инфильтрация костного мозга и мукозного слоя кишечника [3].
Если коротко обобщить, то страшен не сам холестерин, который является необходимым компонентом, обеспечивающим нормальную структуру клеточных мембран и транспорт липидов в крови, а кроме того он является сырьем для производства стероидных гормонов. Метаболические расстройства же проявляются при нарушении баланса ЛПНП и ЛПВП , что отражает нарушение системы транспорта липопротеинов, включающей работу печени, образование желчи и участие макрофагов. Поэтому любые заболевания печени, а также аутоиммунные процессы могут вызвать развитие атеросклероза даже при вегетарианской диете. Если мы вернемся к изначальным опытам Н.А. Аничкова по кормлению кроликов пищей, богатой холестерином, то увидим, что холестерин не встречается в естественном рационе кроликов и поэтому, как яд, нарушает работу печени, вызывает сильное воспаление сосудов и, как следствие, образование бляшек.
Восстановление этого баланса искусственным путем (например, на молекулярном уровне с использованием наночастиц) когда-нибудь станет основным способом лечения атеросклероза (см. «Наночастицами — по „плохому“ холестерину!» [13]). — Ред.
Читайте также:
