Гематология: Развитие Т-лимфоцитов
Добавил пользователь Дмитрий К. Обновлено: 01.02.2026
Т-лимфоциты несут на себе поражающее воображение разнообразие рецепторов, позволяющее распознавать практически любые чужеродные субстанции, с которыми может столкнуться организм. Путь от гемопоэтической стволовой клетки к 10 7 -10 9 клонов Т-лимфоцитов с уникальными антиген-связывающими последовательностями — удивительное достижение эволюции. Многостадийное развития Т-лимфоцитов может выглядеть пугающим и запутывающим со страниц учебников. Однако, если вы дадите ему второй шанс, вы увидите, что это красивый и слаженный процесс.
Как и остальные клетки крови, Т-лимфоциты берут свое начало в костном мозге от гемопоэтической стволовой клетки. Такие клетки-предшественницы имеют мало общего со зрелыми функциональными Т-лимфоцитами: они не имеют антигенных рецепторов (TCR) и не умеют узнавать чужеродные антигены. Их ждет сложный путь развития, который осилят немногие, однако те, которые выживут, создадут армию, готовую к любой угрозе. Для развития Т-лимфоцитов в нашем теле формируется специальный орган — тимус. Создав достаточный репертуар рецепторов, тимус подвергается инволюции и практически не детектируется после пубертатного периода. Численность Т-лимфоцитов во взрослом организме в основном поддерживается делением зрелых клеток.
Для миграции в тимус клетки, чья судьба — стать Т-лимфоцитом, используют хемокиновый рецептор CCR9, лиганд для которого — CCL25 — секретируют клетки тимуса. Достигнув тимуса, предшественники Т-лимфоцитов становятся тимоцитами. Первым делом они получают сигнал от эпителиальных клеток тимуса через рецептор Notch-1, который окончательно определяет их судьбу в пользу Т-лимфоцита.
Следующая задача тимоцитов — активная пролиферация. Скорость деления тимоцитов крайне высока, поскольку 95 %-98 % этих клеток погибает. Дело в том, что судьба развивающегося Т-лимфоцита по умолчанию — апоптоз, спасти от которого его может только успешное прохождение нескольких раундов отбора. Сигнал для первого раунда деления — интерлейкин 7, который выделяют эпителиальные и другие клетки тимуса. Мутации в гене ИЛ-7 или его рецептора приводят к тяжелым иммунодефицитам. Пролиферация приводит к созданию большого пула клеток, которые называют дважды негативными клетками, поскольку они не несут на себе корецепторы CD4 и CD8. Большинство из них (90 %) дадут начало αβ Т-лимфоцитам, а 10 % — γδ Т-лимфоцитам.
После этого тимоциты приступают к перестройке генов антигенных рецепторов. Это тот самый момент, когда из небольшого количества генов возникает всё разнообразие антигенных рецепторов — миллионы и миллиарды. В ходе этого процесса участки генов антигенных рецепторов перестраиваются случайным образом. Ключевое слово здесь — случайный, поскольку процесс формирования рецепторов, способных эффективно распознавать чужеродные антигены, никак не зависит от этих антигенов и происходит задолго до встречи с ними!
До сих пор тимоциты содержали гены TCR в зародышевой конфигурации, т. е. не подвергшиеся перестройке. Такие гены не могут образовать TCR. Тимоциты начинают с перестройки генов одной из двух цепей TCR — β-цепи. После этого тимоциты проходят через первую контрольную точку. В случае успешной перестройки клетка экспрессирует β-цепь, которая вместе с инвариантной α-цепью формирует на поверхности клетки pre-TCR. Такой рецептор активируется без участия лиганда и передает в клетку сигналы для дальнейшего развития. Остальные клетки не проходят отбор: в случае неудачной перестройки pre-TCR не экпрессируется и клетка подвергается апоптозу в отсутствие сигналов к выживанию.
Активация pre-TCR поставляет в клетку важные сигналы для дальнейшего развития:
- Останавливается перестройка локуса β-цепи во втором аллеле. Это называется аллельное исключение — зрелые Т-лимфоциты экспрессируют β-цепь TCR только с одного аллеля.
- Начинается экспрессия двух ко-рецепторов CD4 и CD8, теперь тимоциты называются дважды позитивными.
- Начинается второй раунд пролиферации. Через pre-TCR клетки получают мощный сигнал к делению, приводящий к еще более интенсивной экспансии, чем в первом раунде.
- После этапа деления запускается перестройка α-цепи рецептора.
В отличие от цепи-партнера, α-цепь может подвергаться многократной перестройке, и большинство тимоцитов успешно с ней справятся. После перестройки α-цепи тимоциты наконец экспрессируют на своей поверхности полный αβ TCR. Однако впереди главная проверка, пройти которую суждено немногим.
Задачи последнего этапа отбора:
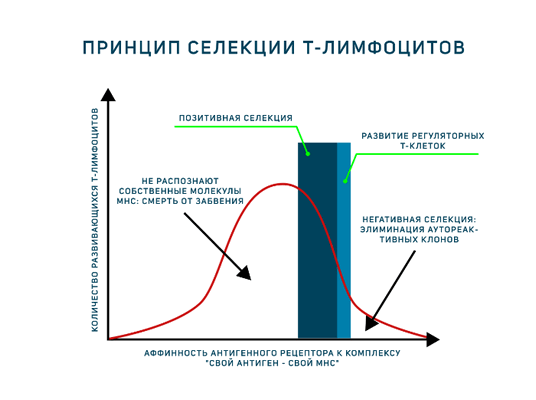
- Отобрать клетки, распознающие молекулы главного комплекса гистосовместимости (MHC) организма. Этот этап присутствует в развитии тимоцитов, поскольку зрелые Т-лимфоциты способны распознавать антигены только в составе МНС. Поэтому они должны знать МНС своего организма в лицо. Это называется позитивная селекция.
- Элиминировать клетки, распознающие собственные антигены. Это называется негативная селекция.
Однако антигенпрезентирующие клетки тимуса (эпителиальные клетки тимуса, дендритные клетки и макрофаги) располагают только комплексами «свой МНС — свой антиген». И позитивная, и негативная селекция осуществляется на основании взаимодействия TCR с такими комплексами! Для объяснения была предложена гипотеза аффинности. Тимоциты, чьи антигенные рецепторы проявят низкую аффинность к таким комплексам, продолжат развитие. Тимоциты, чьи рецепторы свяжутся с представленными антиген-МНС комплексами прочно, подвергнутся апоптозу как аутореактивные клоны (клональная делеция). Клетки, не распознающие МНС вовсе, т. е. не прошедшие позитивную селекцию, умрут особым способом, который называется смерть от забвения (death by neglect). Ещё один вариант развития — среднее связывание рецептора с антигенным комплексом, такие тимоциты могут дать начало регуляторным Т-клеткам. Таким образом, регуляторные Т-клетки — единственные лимфоциты, которые взаимодействуют со своим будущим антигеном в процессе развития! Развитию этого подтипа Т-лимфоцитов сейчас посвящено много исследований.
Особую роль в негативной селекции играет белок AIRE (аутоиммунный регулятор), который заставляет клетки тимуса экспрессировать в небольших количествах антигены, в норме присутствующие только в определенных тканях. Это позволяет сформировать толерантность к тканеспецифичным антигенам, встречающимся только за пределами тимуса. Мутация в белке AIRE приводит к развитию аутоиммунного полиэндокринного синдрома. AIRE содержится в эпителиальных клетках медуллы. При этом известно, что наиболее эффективно негативная селекция осуществляется при презентации антигена дендритными клетками и макрофагами, а не стромой тимуса. В новом исследовании был показан перенос антигенов из эпителиальных клеток тимуса в дендритные клетки, которые их и презентируют!
Одновременно с позитивной и негативной селекцией осуществляется проверка, соответствует ли корецептор распознаваемому классу МНС — т. е. происходит дифференцировка в функциональные подклассы. Выживают только клетки с правильной комбинацией: CD8 + MHC I — цитотоксические Т-лимфоциты и CD4 + MHC II — Т-хелперы.
Последнее, что должен сделать лимфоцит перед тем, как покинуть тимус — это изменить тип сигналинга через антигенный рецептор. Если незрелые Т-лимфоциты с высоким родством к антигену погибают, то зрелые — активируются (молекулярные основы такой принципиальной разницы не ясны). Теперь лимфоциты готовы заселить периферические лимфоидные органы и нести оборону. Зрелые Т-лимфоциты покидают тимус, используя градиент сфингозин-1-фосфата, — липида, присутствующего в высоких концентрациях в крови и лимфе, для хемотаксиса в кровяное русло. Для хоуминга во вторичные лимфоидные ткани они используют CD62L (L-селектин).
γδ Т-лимфоциты несут менее разнообразные антигенные рецепторы, по-видимому, не зависящие от МНС. Они не экспрессируют корецепторы CD4, CD8. γδ Т-лимфоциты выступают в роли первой линии обороны против часто встречающихся бактерий в эпителиальных и слизистых тканях и скорее относятся ко врожденной иммунной системе, чем к адаптивной.
Активация Т-лимфоцитов
Адаптивный иммунный ответ начинается с презентации антигена — встречи наивного Т-лимфоцита со своим уникальным антигеном. В результате клетка интенсивно делится — ведь в предстоящей борьбе из всех миллионов лимфоцитов будет участвовать только активированный клон (клоны), и её потомство дифференцируется в вооруженные эффекторные клетки. Однако презентации антигена недостаточно для активации Т-лимфоцита. Без дополнительной стимуляции презентация антигена приводит к апоптозу, анергии или развитию Т-регуляторных клеток. Такая реакция является защитой от аутоиммунного ответа: активация антигенного рецептора в отсутствие воспаления скорее всего означает, что клон аутореактивный. Однако такое возможно и при иммуносупрессии, например, вызванной опухолью. В таком случае иммунная толерантность играет против организма. Молекулярные механизмы тонкого контроля активации Т-лимфоцитов являются сегодня областью активного изучения.
Активация Т-клеточного рецептора
Т-клеточный рецептор (TCR), состоящий из двух цепей α и β, является тем самым рецептором, распознающим антиген и делающим каждый клон лимфоцитов уникальным. Однако сами по себе эти две цепи не активируют лимфоцит и даже не являются рецептором в строгом смысле слова, потому что не могут передавать сигнал внутрь клетки. Они являются частью рецепторного комплекса и только в сочетании с несколькими инвариантными компонентами обеспечивают сигнальную функцию. Инвариантные части рецептора: CD3 комплекс (CD3γ, CD3δ, CD3ε цепи) и ζ цепи — содержат ITAMs (immunoreceptor tyrosine-based activation motifs), фосфорилирование тирозиновых остатков в которых и инициирует весь сигнальный каскад после распознавания антигена. Наконец, еще одним необходимым компонентом являются ко-рецепторы - CD4 или CD8, которые распознают MHC II и MHC I соответственно. Они стабилизируют взаимодействие антигенного рецептора и комплекса «пептид-МНС», которое иначе может быть очень непрочным и недостаточно продолжительным для активации рецептора из-за низкой аффинности.
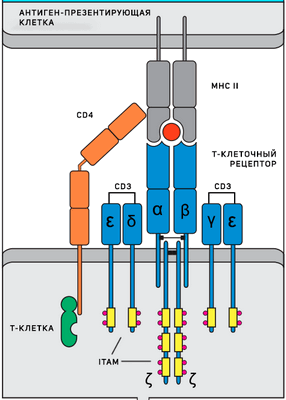
Схема Т-клеточного рецептора
Активацию Т-лимфоцита составляют несколько основных сигнальных путей:
- Активация фосфолипазы C-γ приводит к изменениям в транскрипции (экспрессия генов эффекторных клеток: гранзимы и цитокины и др.).
- Активация серин/треониновой киназы Akt активирует метаболизм (обеспечение процессов синтеза и пролиферации).
- Адапторный протеин ADAP усиливает адгезию (стабилизация контакта между Т-клеткой и антиген-презентирующей клеткой (АПК)). Клетки, лишённые ADAP активируются слабо, т.е. без без дополнительной адгезии контакт непрочный и недостаточный.
- Активация белка Vav приводит к изменениям в цитоскелете (формирование иммунного синапса — прочного контакта между Т-клеткой и АПК/В-клеткой/клеткой-мишенью).
Сигналинг от фосфолипазы С делится в свою очередь на три ветви:
- Выход кальция в цитоплазму активирует транскрипционный фактор NFAT (nuclear factor of activated T cells), который перемещается в ядро и активирует многие гены, необходимые для активации Т-лимфоцитов. NFAT настолько важен для иммунного ответа, что ингибиторы этого сигнального пути широко используются для предотвращения отторжения трансплантатов.
- Активация Ras запускает сигнальный путь MAPK и, в итоге, экспрессию транскрипционного фактора АР-1.
- Активация протеинкиназы C-θ (изоформа протеинкиназы С, встречающая только в Т-клетках и мышцах) активирует транскрипционные факторы NFκB.
- Антиапоптотический.
- Экспрессия рецепторов хоуминга и адгезии.
- Активация метаболизма, в т.ч. через активацию сигнального пути mTOR, который повышает скорость синтеза белков и липидов [1].
В активированной клетке повышается потребление железа, аминокислот и глюкозы и интенсивность гликолиза, что переводит ее в приоритетное положение для организма. Нарушение в процессах активации метаболизма приводят к дисфункции Т-лимфоцитов, например, при сепсисе. Это может быть частично компенсировано применением ИЛ-7 [2].
Ко-стимуляция
Сигналинг через TCR необходим, но недостаточен для активации Т-лимфоцита. Этот сигнал называют сигнал 1, а для активации необходимо сочетание сигнала 1 и сигнала 2. Рецепторы, в сочетании с TCR обеспечивающие активацию Т-лимфоцита, называют ко-стимулирующие рецепторы — сигнал 2. Антиген-презентирующие клетки несут на своей поверхности ко-стимулирующие лиганды. Для активации Т-клетка должна связаться с антигеном и ко-стимулирующим лигандом (сигнал 1 и сигнал 2) на одной и той же АПК. Эта мера необходима для того, чтобы активация происходила, только когда она действительно нужна. Отсутствие ко-стимуляции говорит об отсутствии воспаления, что скорее всего означает, что произошло узнавание собственного антигена, и иммунный ответ не запускается.
Главным рецептором Т-лимфоцитов является CD28, его несут все наивные Т-лимфоциты. Лигандами CD28 на АПК являются B7.1 (CD80) и B7.2 (CD86). Связывание CD28 с лигандами приводит к активации фосфолипазы С, Akt и Vav, т.е. усиливает большинство эффектов TCR сигналинга. Все они возможны только при сочетании двух сигналов. Рецепторы семейства TNF (OX40, 4-1BB, CD30, and CD27) — главные ко-стимулирующие рецепторы В-лимфоцитов - активируют Akt и NFκB. Кроме того, в качестве стимуляции может выступить непосредственное взаимодействие патогена с распознающими рецепторами такими, как TLR. Следует отметить, что концепция ко-стимуляции пересматривается и расширяется в настоящее время в связи с открытием новых ко-стимулирующих рецепторов, осуществляющих свои функции через разные механизмы. Показано, что ко-стимуляция, например через рецептор GITR, помимо помощи TCR сигналингу, участвует в определении судьбы Т-клетки [3]. Возможно, продолжающаяся стимуляция может вносить вклад в истощение Т-лимфоцитов [4].
Огромный интерес ко-стимулирующие рецепторы вызывают в области иммунотерапии рака, а именно адоптивной терапии, особенно после того, как было показано, что ко-стимуляции in vitro может быть достаточно, а значит можно избежать негативных эффектов системного применения [5]. Некоторые ко-стимулирующие рецепторы, такие как GITR, сейчас подтверждают свою эффективность в исследованиях с химерными антигенными рецепторами и могут быть в скором времени использованы в иммунотерапии в качестве дополнительного стимулирующего домена в составе химерного рецептора [6]. Кроме того, ингибиторы ко-стимулирующих рецепторов могут лечь в основу новых безопасных и эффективных методов терапии иммунных отторжений трасплантатов [7].
ICOS (inducible T-cell co-stimulator) — член семейства рецепторов CD28 — другой важный ко-стимулирующий рецептор. Сейчас он активно рассматривается в контексте лечения реакции "трансплантат-против-хозяина" [8]. А в иммунотерапии рака клинические испытания в настоящее время проходят и агонисты, и антагонисты этого рецептора [9]. Дело в том, что помимо усиления противоопухолевого Т-клеточного ответа, данный рецептор может активировать Т-регуляторные клетки и, следовательно, вносить вклад в иммуносупрессию. Ко-стимулирующий рецептор CD46 усиливает активацию CD8+ клеток и их развитие в цитотоксические Т-лимфоциты. Однако этот же рецептор угнетает продукцию IFN-γ Т-хелперами и индуцирует их развитие в регуляторные Т-клетки [10].
Ко-стимулирующие рецепторы критически важны для адекватного иммунного ответа. Так, недостаток ICOS вызывает иммунодефициты с широким спектром клинических проявлений, включая повышенную предрасположенность к инфекционным заболеваниям и злокачественным опухолям [11]. Баланс экспрессии ко-стимуляторных и ко-ингибиторных рецепторов на Т-лимфоцитах изменяется уже на ранних этапах развития опухолей, подчеркивая важность иммунного надзора и необходимость иммуносупрессии для формирования и прогрессии опухоли [12].
Ингибирование
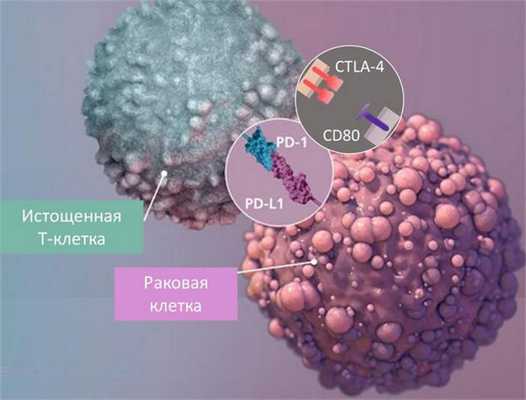
Ингибиторные рецепторы контролируют развитие иммунного ответа и являются необходимым регулятором иммунного гомеостаза. Основные ингибиторные рецепторы относятся к тому же семейству, что и CD28, наиболее изученные включают CTLA-4 (CD152), PD-1 (programmed death-1), BTLA (B and T lymphocyte attenuator), TIGIT (T cell Ig and ITIM domain), TIM-3, LAG-3, CD96, среди последних открытых — PDPN, PROCR [13].
CTLA-4 хранится на внутриклеточных мембранах и перемещается на поверхность клетки, когда активируется антигенный рецептор. CTLA-4 связывает те же лиганды, что и CD28, но с более высокой аффинностью, и ингибируют тем самым сигнал 2. Другие ингибиторные рецепторы содержат ITIMs (immunoreceptor tyrosine-based inhibitory motif) и активируют внутриклеточные фосфатазы. Поскольку значительная часть сигналинга через TCR опосредована тирозинкиназами, фосфатазы ингибируют их эффекты. К таким рецепторам традиционно относят PD-1. Однако, недавние исследования показывают, что основной механизм действия — это дефосфорилирование CD-28 и, следовательно, нарушение ко-стимуляции [14]. Лиганды PD-1 экспрессируются самыми разнообразными клетками (PD-L1) или исключительно АПК (PD-L2). PD-1 экспрессируется на активированных Т-лимфоцитах и составляет важную петлю обратной связи, контролирующую экспансию лимфоцитов.
Ингибиторные рецепторы Т-лимфоцитов привлекают огромное внимание в контексте рака. Терапия, направленная на ингибирование данных рецепторов, носит название immune checkpoint blockade. Разнообразие ингибирующих рецепторов является одной из причин ее неэффективности. Так, было показано, что экспрессия Tim-3 может вызывать резистентность к блокаде PD-L1 [15]. Важную роль в ингибировании Т-лимфоцитов сегодня отводят интерлейкину 27. Именно он может стимулировать экспрессию ко-ингибиторных рецепторов и «помечать» таким образом Т-клетки для истощения. Стимуляции трех ко-ингибиторных рецепторов достаточно для того, чтобы Т-клетка стала дисфункциональной [13].
Антитела, блокирующие ингибиторные рецепторы и их лиганды, уже получили распространение в терапии опухолей (меланома, НМРЛ и др.). Однако сейчас огромный интерес вызывает перспектива сочетания традиционных видов терапии — радио- и химиотерапии с иммунотерапевтическими подходами. С одной стороны, уже понятно, что эффекты радио- и химиотерапии во многом опосредованы иммунными процессами. С другой стороны, гибель клеток в результате применения традиционных методов может сделать опухоль «горячей» — активно инфильтрированной иммунными клетками — и повысить эффективность иммунотерапии. Эффективность полимодальной терапии подверждается все новыми доклиническими исследованиями: иммунорадиотерапия + блокада PD-L1 [16].
Таким образом, активация Т-лимфоцитов требует тонкой регуляции, которая достигается балансом ко-стимулирующих и ингибиторных рецепторов. Недостаточная активация снижает эффективность иммунного ответа против инфекционных агентов и опухолевых клеток, чрезмерная активация приводит к аутоиммунным заболеваниям. Наши представления о процессах активации и ко-стимуляции Т-лимфоцитов до сих пор активно развиваются. Открытия в этой области проложат путь к новым возможностям терапии рака, аутоиммунных заболеваний и отторжения органов в трансплантологии.
Агранулоциты: их характеристика, свойства и участие в иммунном ответе

Говоря об учёных XIX - начала XX веков, я неизменно поражаюсь тому, насколько обширны были области их исследовательских интересов и притязаний. Тем не менее каждый из великих мира сего имел определённые заслуги, благодаря которым человечество особенно выиграло и шагнуло вперёд в понимании тех или иных законов природы. И вот, когда речь заходит о великом русском физиологе (иммунологе, биологе, эмбриологе и далее по списку) Илье Мечникове, я каждый раз невольно представляю его себе воином на коне, ведущим за собой армию макрофагов, ибо именно этот человек первым осознал роль данных клеток, присущих всем организмам от эхинодермы до позвоночных. Позднее, в 1960-х годах, уже ван Фурт и Кон определили систему мононуклеарных фагоцитов как общность агранулярных миелоидных клеток, которые, как нам теперь известно, играют важнейшую роль в обновлении тканей, поддержании гомеостаза и стимуляции и регуляции как врождённого, так и приобретённого иммунитета. Вообще в систему мононуклеарных фагоцитов входят клетки трёх типов: полностью дифференцированные макрофаги и дендритные клетки (которые, в свою очередь, тоже подразделяются на множество субпопуляций), а также моноциты.
Под, собственно, моноцитами понимают циркулирующие клетки крови, составляющие около 10% всех лейкоцитов периферической крови человека. В кровеносное русло моноциты поступают из костного мозга, где и развиваются из общей для агранулоцитов и гранулоцитов миелоидной клетки-предшественницы. Не в последнюю очередь по причине непродолжительности пребывания моноцитов в циркулирующей крови (около 3-х суток у человека) данная среда считается резервуаром миелоидных предшественников, обеспечивающих постоянное обновление пула тканевых макрофагов и, в частности, короткоживущих дендритных клеток.
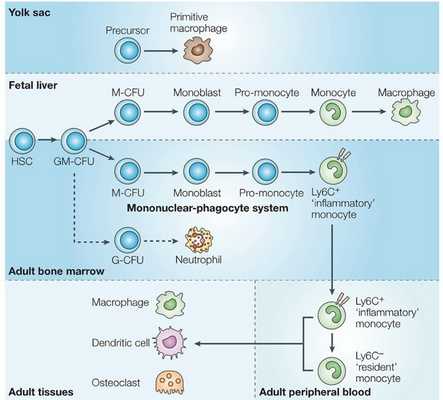
Развивающиеся макрофаги обнаруживаются в уже желточном мешке, что определяется как по морфологическим характеристикам, так и согласно экспрессии макрофагальных маркеров (например, FMS, CD11b, рецептор маннозы). Позднее, когда запускается гемопоэз в печени плода, она становится основным источником макрофагов, которые напоминают те, что наблюдаются во взрослом организме, однако количество макрофагов, заселяющих органы эмбриона, превышает таковое у взрослого человека. Моноциты могут играть роль предшественников, которые, дифференцируясь, пополняют пул тканевых макрофагов, но все же большая их часть образуется в ходе локальной пролиферации предшественников, чем в результате рекрутинга моноцитов из периферической крови.Моноциты выходят из костного мозга в кровеносное русло, имея фенотип Ly6C+, и изменяются впоследствии, давая начало еще одному фенотипически отличающемуся подтипу (Ly6C-).
Изначально моноциты, циркулирующие с кровью, пытались классифицировать, основываясь на клеточной морфологии и их удельной плотности. Однако данные характеристики довольно разнородны и не обладают должной специфичностью, поэтому различать моноциты исключительно по гистологическим признакам весьма затруднительно. Первые мысли о том, что, вероятно, моноциты могут быть подразделены на подтипы, которым присущи различные физиологические признаки, закрались тогда, когда были выявлены две первые субпопуляции моноцитов, отличающихся как по морфологии, так и по дифференциальной экспрессии антигенных маркеров - CD14 и CD16. Клетки с фенотипом CD14hi CD16 относят к классическим моноцитам, поскольку высокий уровень экспрессии CD14 и экспрессия CD16 были характерны для впервые описанных моноцитов. Второй основной подтип моноцитов характеризуется, помимо экспрессии CD14 и CD16 (обозначаются как CD14+ CD16+), повышенным уровнем молекул главного комплекса гистосовместимости II класса и CD32 (также известен как FcγRII), в связи с чем было высказано предположение, что данные клетки похожи на зрелые тканевые макрофаги. Помимо различий в степени экспрессии основных антигенных маркеров, оба вышеописанных подтипа моноцитов проявляют различия относительно экспрессии хемокиновых рецепторов (например, моноциты CD14hi CD16 экспрессируют С-С рецептор хемокина 5 (CCR5), тогда как для CD14+ CD16+ характерна экспрессия CCR2). Тем не менее при культивировании обоих подтипов моноцитов в присутствии GM-CSF и IL-4 и те, и другие дифференцируются до дендритных клеток. А в экспериментах in vitro с использованием модели трансэндотелиальной миграции мононуклеарные клетки, изолированные из периферической крови при инкубации с монослоем эндотелиальных клеток пупочной вены человека на коллагеновой матрице, мигрировали, минуя эндотелиальный барьер, и дифференцировались в макрофаги, которые оставались в субэндотелиальном матриксе либо превращались в дендритные клетки, мигрирующие обратно сквозь слой эндотелиоцитов.
Моноциты крови берут свои истоки в костном мозге, образуясь из гемопоэтических стволовых клеток путём последовательного коммитирования и дифференцировки предшественников. Первейшими клетками, с которых начинается путь дифференцировки до моноцитов, являются общая миелоидная клетка-предшественница и гранулоцитарно-макрофагальный предшественник. Кроме того, в 2006 году были описаны специфические клоногенные предшественники, обнаруженные в костном мозге, которые, в отличие от гранулоцитарно-макрофагальных предшественников, не дают начало гранулоцитарному, лимфоидному, эритроидному или мегакариоцитарному росткам, а обеспечивают прирост лишь нескольких подвидов макрофагов и резидентных дендритных клеток. Сообразно тому, каким клеткам дают начало такие предшественники, они и были названы предшественниками макрофагальных и дендритных клеток (MDP), всё просто. Микроокружение костного мозга потенцирует MDP к дифференцировке в моноциты, которые впоследствии выходят в кровь.
С точки зрения эволюции, система приобретённого иммунитета млекопитающих представляет собой венец всевозможных иммунных реакций с позиции её сложности и молекулярной специфичности. В отличие от клеток, относящихся к системе врождённого иммунитета и распознающих типичные мотивы, ассоциированные с широким спектром патогенов, за счёт рецепторов, кодируемых множественными зародышевыми генами, клетки системы приобретённого иммунитета могут быть обеспечены практически неиссякаемым разнообразием антиген-распознающих рецепторов, что происходит благодаря одному из механизмов соматической рекомбинации (V(D)J-рекомбинация), который, кроме прочего, является основой существования иммунологической памяти у клеток за счёт дифференцировки, распространения и поддержания персистенции долгоживущих антиген-специфических лимфоцитов. Являясь прямыми эффекторами системы иммунитета и реализуя цитотоксические свойства, а также продуцируя антитела, лимфоциты в то же время выполняют и роль ключевого регулятора иммунного ответа, усиливая или ослабляя его, оказывая влияние на различные типы клеток по механизму положительной или отрицательной обратной связи.
Разберём чуть подробнее механизм рекомбинации, благодаря которому становится возможным разнообразие антиген-распознающих рецепторов у лимфоцитов. V(D)J-рекомбинация служит основой разнообразия В-клеточных рецепторов вследствие того, что в формирующихся В-клетках гены, кодирующие тяжёлые и лёгкие цепи иммуноглобулинов, составляются из нескольких различных генных сегментов. Развитие В-лимфоцитов начинается в печени у плода с дифференцировки плюрипотентных гемопоэтических стволовых клеток (ГСК) и происходит впоследствии в костном мозге.
ГСК дифференцируются до прогениторных В-клеток, которые при помощи фактора транскрипции Pax5 достигают стадии зрелых В-клеток и приобретают поверхностный маркер c-kit, а также CD19, характерный для всех стадий дифференцировки В-лимфоцитов, кроме плазматических клеток. Именно на стадии прогениторных В-клеток осуществляется соматическая рекомбинация ДНК в локусе тяжёлой цепи иммуноглобулинов (IgH-локус), что заключается в образовании функционального VDJ-экзона, состоящего из V- (variable), D- (diversity) и J- (joining) сегментов. Данный экзон кодирует V-регион тяжёлой цепи иммуноглобулина и образует совместно с V-регионом лёгкой цепи антигенсвязывающий участок мембраносвязанных В-клеточных рецепторов. V(D)J-рекомбинация в IgH-локусе протекает в 2 этапа, для чего данный участок ДНК прежде претерпевает модификационные преобразования хроматина и только потом становится доступным для изменений: сначала на этапе ранних прогениторных клеток в обоих аллелях путём негомологичной рекомбинации объединяются D и JH-сегменты, а затем, уже в поздних прогениторах В-клеток, становится доступным для взаимодействия VH-сегмент, расположенный сразу после вышеупомянутых участков, и при сокращении локуса VH-сегмент присоединяется к уже реаранжированным сегментам D и J. Безусловно, сложный процесс V(D)J-рекомбинации требует участия многочисленных ферментов, среди которых стоит назвать RAG1 и RAG2 (Recombination-activating Genes 1 and 2), специфичные для лимфоцитов, а также присущие всем клеткам ферменты и системы репарации двойных разрывов ДНК, такие как Ku70, Ku80, XRCC4, ДНК-лигаза IV, ДНК-зависимые протеинкиназы (DNA-PK), Artemis.
RAG распознают специфические рекомбинационные сигнальные последовательности (RSS - recombination signal sequences), окружающие сегменты генов иммуноглобулинов, и инициируют V(D)J-рекомбинацию, разрывая обе цепочки ДНК между сегментами генов Ig и находящимися по соседству от них RSS. Свободные 3’-OH концы сегментов связываются с комплементарными цепями, образуя шпилечные структуры (их называют кодирующими соединениями, Coding Joint), а RSS соединяются своими свободными концами и формируют сигнальные соединения - Signal Joint. Получившиеся шпилечные структуры снова раскрываются с помощью эндонуклеазы Artemis за счёт разрыва одной из цепей, а после процессинга экзонуклеолитические свойства Artemis и полимераз обеспечивают соединение генных сегментов друг с другом с формированием тупых концов ДНК. Важно обратить внимание на тот момент, что шпилечные структуры не должны раскрываться в тех же самых местах (на уровне тех же оснований), где изначально произошло их объединение, а потому лежащая между ними нуклеотидная последовательность может быть отзеркалена, в результате чего образуются палиндромные нуклеотиды (Р-нуклеотиды).
Разнообразие возможных сочетаний сегментов (помимо рекомбинаторного разнообразия) увеличивается как раз за счёт Р-нуклеотидов, а также за счёт случайным образом добавляемых терминальной дезоксинуклеотидилтрансферазой нешаблонных нуклеотидов. Чтобы обеспечить непосредственно рекомбинацию V и D / D и J сегментов, RSS задействованных в рекомбинации участков различаются. Между относительно консервативными гепта- и нонамерными последовательностями (CACAGTG и ACAAAAACC соответственно), встречающимися во всех RSS, располагаются спейсерные последовательности, которые у RSS сегментов V и J составляют 23 пары оснований, а в пределах RSS, ограничивающих с двух сторон сегмент D, спейсеры охватывают 12 пар оснований. Таким образом, за счёт наличия спейсеров предотвращается прямое взаимодействие между сегментами V и J в IgH-локусе, поскольку V(D)J-рекомбинация осуществляется по большому счёту почти исключительно между RSS со спейсерами различной длины (правило 12/23).
После перестройки сегментов гена, ответственных за структуру тяжёлой цепи иммуноглобулина, происходит непосредственно её синтез. Получившиеся тяжёлые цепи связываются с суррогатными лёгкими цепями, состоящими из белков VpreB и λ-подобного белка, и сигнальными молекулами Igα и Igβ, формируя вместе рецепторный комплекс пре-В. Данный комплекс перемещается на поверхность клетки, где он способен воспринимать и проводить сигналы, способствующие дифференцировке клеток в ранние пре-В-лимфоциты и их клональной экспансии. Кроме того, сигналы, проводимые посредством пре-В комплекса, ингибируют рекомбинацию в IgH-локусе.
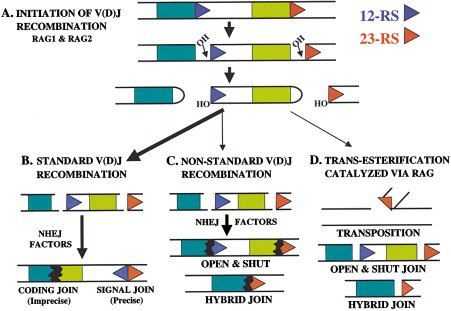
Рис. 2. RAG-опосредованные перестройки генных сегментов.
Иногда же V(D)J-рекомбинация не обходится без ошибок и бывает так, что происходит смещение рамки считывания вследствие дополнительно встроенных Р- или N-нуклеотидов или, наоборот, из-за их выпадения. В таких случаях получившийся VDJ-экзон оказывается нефункционален, и рекомбинация продолжается во втором аллеле гена. Если и вторая перестройка не удаётся, то в таком про-В-лимфоците не осуществляется проведения сигналов, позволяющих клетке жить и продолжать дифференцировку, и запускается её апоптоз.
Но вернёмся к нормальным клеткам, для которых рекомбинация в IgH-локусе завершилась образованием продуктивного VDJ-экзона и синтезом способной к связыванию тяжёлой цепи. Экспрессия рецепторного комплекса пре-В неизменно означает для такой клетки переход к стадии раннего прекурсора В-лимфоцитов, что сопровождается потерей клеткой маркера c-kit и прекращением экспрессии терминальной дезоксинуклеотидилтрансферазы. Кроме того, активность RAG1 и RAG2 временно прекращается. Вместо этого ранние пре-В-лимфоциты экспрессируют CD25 и вступают в непродолжительную пролиферационную фазу, охватывающую 4-6 циклов клеточного деления, цель которой состоит в увеличении количества пре-В-лимфоцитов, обладающих функционально активными IgH-цепями, способными формировать комплексы с IgL-цепями. Подобная селективная клональная экспансия пре-В-клеток вносит существенный вклад в расширение спектра Ig, поскольку каждая новая клеточка-предшественница будущего В-лимфоцита имеет свою собственную, не похожую на другие L-цепь, а следовательно, приобретает и Ig-рецептор с новой, характерной только данной клетке специфичностью.
Если быть совсем точным, то клональная экспансия ранних прекурсоров ведёт к их дифференцировке в мелкие покоящиеся пре-В-лимфоциты, в которых по аналогии с перестановками в IgH-локусе передислоцируются κ- и λ-локусы лёгких цепей иммуноглобулинов; после перестройки гена IgL синтезируется IgL-цепь, которая, объединяясь с IgH-цепью, становится частью В-клеточного рецептора, необходимого для перехода клетки на стадию незрелого В-лимфоцита. После того, как полный В-клеточный рецептор экспрессируется на поверхности клетки, незрелые В-лимфоциты подвергаются негативной селекции, в ходе которой их рецепторы проходят проверку на аутоагрессию. Выявленные клетки с аутоагрессивными свойствами могут быть апоптотически уничтожены, а могут и избавиться от аутореактивных рецепторов, будучи вовлечёнными в процесс вторичной перестройки Ig-локусов их рецепторов.
Итак, ткани и органы лимфатической системы, находясь в тесной взаимосвязи между собой, обеспечивают организму защиту от чужеродных агентов. Говоря непосредственно о системе приобретённого иммунитета, первое, о чём стоит упомянуть, это антигенпрезентирующие клетки, которые мигрируют из очага инфекции в ближайшие регионарные лимфоузлы, где презентируют микробные антигены интактным Т-клеткам. Сталкиваясь с «распознанным» антигенпрезентирующими клетками антигеном, интактные Т-клетки начинают активно делиться, в результате чего в течение нескольких дней происходит дифференцировка как эффекторных Т-лимфоцитов, которые направляются в очаг инфекции и занимаются элиминацией чужеродных агентов, так и Т-клеток памяти, которые, персистируя в кровеносном русле, готовы поддержать иммунный ответ на вторичную инфекцию.
Собственно, поэтому лимфоциты, как правило, рассматривают как клетки, характерные для лимфоидных органов и циркулирующие в крови, однако, не стоит забывать, что существуют также резидентные типы лимфоцитов, присутствующие в нелимфоидных тканях (особенно это касается кожи и слизистых оболочек). К специализированным резидентным тканевым лимфоцитам относятся лимфоидные клетки врождённого иммунного ответа (innate lymphoid cells; ILC), тканевые Т-клетки памяти (tissue-resident memory T cells; TRM), а также особые типы Т-лимфоцитов, такие как инвариантные естественные киллеры (iNKT), инвариантные Т-лимфоциты, ассоциированные со слизистыми (MAIT-клетки), γδ T-клетки и интраэпителиальные лимфоциты (IEL) CD8aa+.
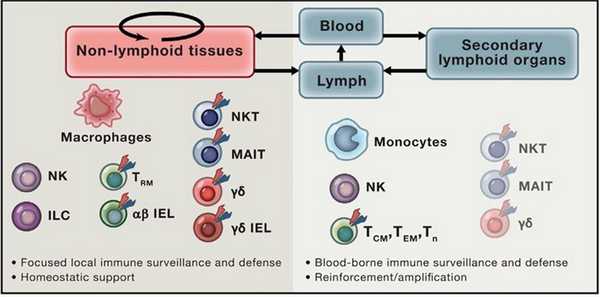
Рис. 3. Тканевые и циркулирующие лимфоциты и их функции.
Чтобы яснее представлять себе роль тканерезидентных лимфоцитов, обратимся к тому, чем же эти клетки отличны от тех, что циркулируют с током крови. Первое, что стоит упомянуть - это их способность к самообновлению вне зависимости от циркулирующих прекурсоров. Значительная часть пула тканевых лимфоцитов концентрируется в барьерных тканях. Также важным свойством данных клеток является широкий спектр микробных антигенов и сигналов от других клеток организма, которые они способны распознавать и воспринимать, получая тем самым информацию о воспалении, развитии инфекционного процесса и повреждении тканей.
Активация тканевых лимфоцитов осуществляется при помощи полуинвариантных антигенных рецепторов, NK-активирующих рецепторов и рецепторов аларминов и цитокинов. Полуинвариантные рецепторы, присущие iNKT-клеткам, напоминают паттерн-распознающие рецепторы и узнают гликолипиды, обладающие α-аномерной гликозидной связью, кои нередко характерны для патогенных бактерий и могут непосредственно запускать сигнальные внутриклеточные реакции после связывания с данными рецепторами. Тем не менее даже в отсутствие мощных микробных антигенов Т-лимфоциты могут быть активированы низкоаффинными эндогенными лигандами, конкурентно стимулируемыми цитокинами, как правило, IL-12 и IL-18. Это наталкивает на размышления о том, что активация iNKT не обязательно сопровождает инфекционные процессы, а может быть вызвана также в ответ на метаболический стресс, характеризующийся нарушением синтеза и обмена гликолипидов.
Для некоторых субпопуляций интраэпителиальных лимфоцитов также характерна реакция на эндогенные лиганды, сопряжённые с нарушением обменных процессов в тканях. И наконец, заключительной особенностью тканерезидентных лимфоцитов является их способность к быстрой реакции на активирующие сигналы, что выражается в массированной секреции антимикробных факторов (цитокинов, цитолитических молекул, факторов роста). Не меньшее значение имеет и экспрессия тканевыми лимфоцитами некоторых транскрипционных факторов, например, PLZF. В экспериментах на мышах у тех особей, у которых наблюдался дефицит экспрессии PLZF, было отмечено резкое снижение количества iNKT и MAIT-клеток, а имеющиеся клетки проявляли нарушения функций и локализации.
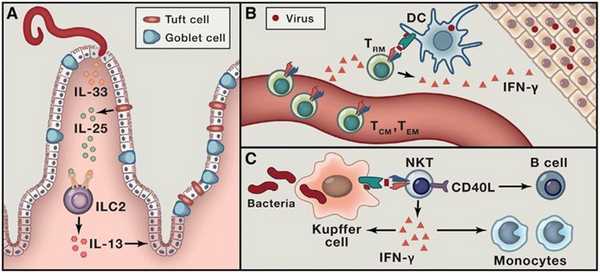
(А) Гельминтозная инфекция становится причиной высвобождения из погибающих эпителиоцитов IL-33 и IL-25 из хемочувствительных волосковых клеток. Данные цитокины побуждают лимфоидные клетки врожденного иммунного ответа (ILC2) к секреции IL-13, вызывающего гиперплазию бокаловидных и волосковых клеток.
(В) Активированные презентированным антигеном CD8+ TRM вырабатывают гамма-интерферон, который приводит клетки ткани в "состояние боевой готовности" и привлекает циркулирующие клетки памяти.
(С) NKT продуцируют цитокины и, будучи предварительно активированы клетками Купфера, сами активируют CD40L, которые, в свою очередь, презентируют CD1d-связанные гликолипиды, встречающиеся в составе бактериальных патогенов.
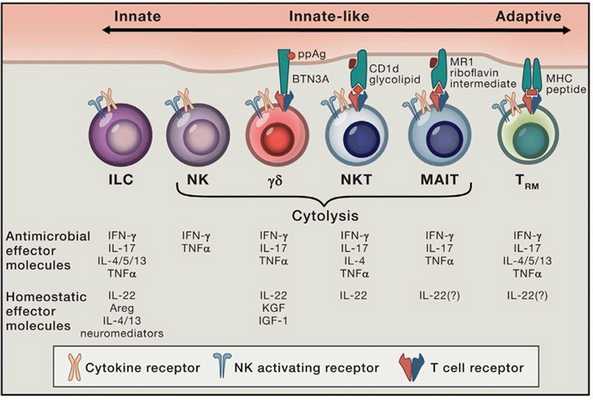
Рис. 5. Обобщенное представление об эффекторных функциях тканерезидентных лимфоцитов.
На этом завершим наш небольшой обзор агранулоцитов. Их сложные взаимоотношения и многогранный вклад в развитие иммунных реакций, разумеется, все еще вызывают у вас немало вопросов, на которые, надеюсь, вы тут же отправитесь искать ответы.
Наивные Т-клетки — ключ к долголетию
Обзор
Автор
Редактор
Статья на конкурс «био/мол/текст»: Наивные Т-лимфоциты могут поведать о том, что вы хотели бы скрыть. Впервые было осуществлено секвенирование профиля Т-клеточных рецепторов периферической крови человека. Успехи в развитии технологий секвенирования нового поколения дают возможность проследить за динамикой колебаний численности и разнообразия наивных Т-клеток по мере старения организма. Вместе с этими знаниями появляется ответ на вопрос, почему женщины живут дольше мужчин, и приходит мысль о том, что увеличить продолжительность жизни можно, используя собственные Т-клетки. «Иммунологические часы» несложно обмануть, пойдя на хитрость.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Всегда ли можно дать сорокалетнему мужчине его сорок? А пятидесятилетнему? А скольким тридцатилетним женщинам вы бы не дали двадцати? Определять возраст человека по внешней составляющей не самая лёгкая задача. Однако, людям, перешагнувшим определённый порог, различный для мужчин и женщин, когда репродуктивная функция начинает стремительно угасать, становится сложнее скрывать свой возраст.
Для внутренних процессов человеческого организма характерны совершенно иные темпы изменений. «Возрастной порог» нашей иммунной системы расположен гораздо ближе к детству, чем к старости. Уже с первого года жизни в тимусе ребёнка начинают происходить драматические изменения: функциональная ткань органа заменяется на соединительную, уменьшаясь каждый год на 3% до 35-45 лет, а после 45 — на 1% (рис. 1). В 70 лет соединительная ткань занимает 90% тимуса [1]. Наиболее активно тимус функционирует в пренатальный период и до наступления половой зрелости. За это время происходит наработка максимальных возможностей Т-клеточного иммунитета, что будет во многом определять эффективность иммунного ответа человека на протяжении всей его жизни.
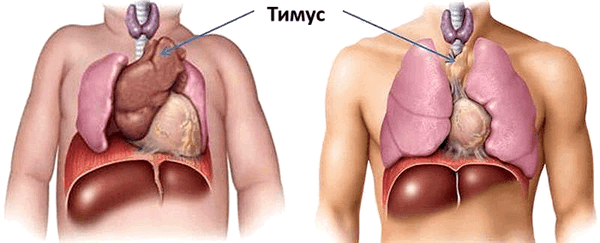
Рисунок 1. Сравнение размеров тимуса у новорождённого (а) и взрослого (б). К 50 годам тимус уменьшается в 5-7 раз по сравнению с первоначальным размером. Рисунок с сайта my.bpcc.edu.
Тимус — военная база иммунной системы
В тимусе иммунная система обучает своих «солдат». Предшественники Т-лимфоцитов размножаются в костном мозге и с кровью попадают в тимус. В нём происходит ключевое событие в жизни Т-клеток, определяющее их специфичность к антигену, с которым они никогда ещё не встречались — соматическая рекомбинация (также V(D)J-рекомбинация, рис. 2). Она заключается в перетасовке участков генов, кодирующих гипервариабельные участки α и β цепей Т-клеточного рецептора (TCR). С помощью TCR Т-клетки распознают «свой» антиген, к которому они специфичны, в составе главного комплекса гистосовместимости (MHC) антиген-презентирующих клеток (рис. 3). Благодаря этому процессу создаётся гигантское разнообразие TCR — около 6 × 10 5 возможных вариантов на каждые 10 6 Т-клеток [2]. В силу такой огромной вариабельности Т-клеточных рецепторов существует высокая вероятность того, что при проникновении в организм какого-либо чужеродного агента найдётся Т-клетка, TCR которой окажется специфичным именно ему. Соматическая рекомбинация происходит в кортикальной части тимуса, из неё клетки мигрируют в медуллярную часть и претерпевают негативный отбор: в экземплярах, реагирующих на собственные антигены, экспрессируемые организмом, запускается апоптоз.
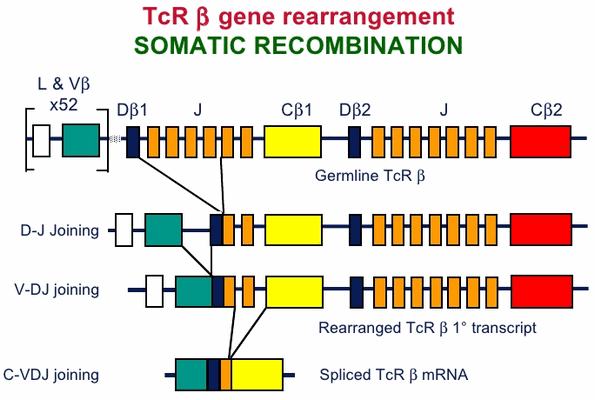
Рисунок 2. Соматическая рекомбинация на примере β цепи TCR. Исходная последовательность в гене, кодирующем β цепь TCR содержит V (variable), D (diversity), J (Joining) и C (constant) сегменты. Сначала один из двух D-сегментов соединятеся с одним из 13 J-сегментов. Получившийся DJ-сегмент присоединяется к одному из 50 V-сегментов. Сегменты выбираются случайным образом, и механизм их сшивки также предполагает случайное варьирование количества пар оснований, это обеспечивает разнообразие TCR. Аналогичный процесс происходит c последовательностью, кодирующей α-цепь только без D-сегмента. Рисунок с сайта Slideshare.
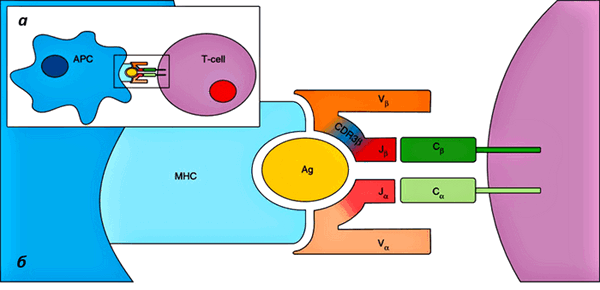
Рисунок 3. Взаимодействие TCR и антиген-презентирующей клетки. а — Т-клетка (фиолетовая) взаимодействует с антиген-презентирующей клеткой (APC, синяя). б — APC презентирует антиген в составе MHC. Гетеродимер TCR состоит из α и β цепей, охватывающих MHC с антигеном. С антигеном главным образом взаимодействуют области CDR3 — это домены, отвечающие за специфичность TCR к данному антигену. Рисунок с сайта Genomemedicine.
После наступления пубертатного периода производство тимусом наивных Т-клеток резко снижается и на протяжении всей взрослой жизни человека активность этого органа остаётся на самом базальном уровне. Чем это грозит? Созданное за такой короткий период огромное разнообразие TCR действительно обеспечивает эффективный иммунный ответ на большинство потенциальных угроз. Но это разнообразие остаётся константным только некоторое время.
Мы теряем наших бойцов!
Многие современные исследования в области иммунологии посвящены усовершенствованию подходов к вакцинации пожилых людей. Почему для людей преклонного возраста вакцинация практически неэффективна? Наивные Т-клетки стареют вместе с человеком, за всю жизнь они проходят множество делений, в результате которых неизбежно «портится» ДНК, клетки начинают хуже выполнять свои функции. Клетки памяти, произошедшие от стареющих наивных Т-клеток, при повторной встрече с антигеном секретируют скудный спектр цитокинов, их способность к пролиферации снижена [3]. Появление функциональных дефектов в пуле наивных Т-клеток с возрастом не вызывает удивления, но какой несправедливостью было бы уменьшение по мере старения человека разнообразия ТCR, созданного в результате блестящего тактического хода нашего организма ещё в детстве, мощнейшего оружия иммунной системы. Так и есть, жизнь несправедлива!
По результатам последних исследований [2], доля наивных Т-клеток как в CD4 + (Т-хелперы) так и в CD8 + (Т-киллеры) субпопуляциях периферической крови человека линейно уменьшается с возрастом. В детстве она составляет 50-80% от всего Т-клеточного пула и уменьшается на 0,75% каждый год, к 70 годам она составляет одну четверть первоначального изобилия. Авторы исследования [2] создали новый подход к использованию технологии секвенирования нового поколения компании Illumina для получения наиболее точных индивидуальных профилей репертуара TCR у людей различных возрастных групп. Было показано, что разнообразие TCR в периферической крови человека коррелирует с процентным содержанием в ней наивных Т-клеток и почти линейно уменьшается с возрастом — примерно на 5 × 10 3 вариантов TCR в год. Наивные Т-клетки сосуществуют в крови с Т-клетками памяти, клоны которых образуются в результате пролиферации наивных Т-клеток, повстречавших «свой» антиген. Размножившиеся клоны с каждым годом занимают всё большую долю доступного для пролиферации пространства в крови, это отражается на численности наивных Т-клеток, так как общее количество Т-клеток в крови человека относительно стабильно.
* — Но не стоит забывать, что кроме популяций в периферической крови, у человека есть гораздо более мощная локальная армия Т-лимфоцитов «на местах»: «Т-лимфоциты: путешественники и домоседы» [4]. — Ред.
Общее разнообразие TCR определяется количеством редких клонов в пуле Т-клеток, поэтому отсутствие возрастных изменений в разнообразии наиболее многочисленных Т-клеточных клонов указывает на то, что клоны наивных Т-клеток теряются с возрастом. Это связано с тем, что клоны наивных Т-клеток обычно малочисленны, поэтому вероятность того, что ни одна клетка данного клона не сможет поделиться или погибнет в результате каких-то случайных событий гораздо выше, чем для клонов с большим числом клеток.
Старики с высоким разнообразием TCR
Исследователи [2] сравнивали Т-клеточные профили периферической крови людей из четырех возрастных групп. Удивительным оказалось то, что люди в возрасте 71-90 лет обладали большим разнообразием TCR и большим процентным содержанием наивных Т-клеток в пуле CD4 + , чем люди возрастной категории 61-66 лет. Возможным объяснением такого отклонения от линейной зависимости стало предположение о восстановлении утраченных функций тимуса вследствие прекращения выработки половых гормонов в пожилом возрасте. Считается, что наиболее заметный спад активности тимуса происходит во время пубертатного периода, когда организм резко начинает вырабатывать большие количества половых гормонов. Вероятно, это связано с перераспределением ресурсов: приоритет в этом возрасте отдаётся развитию половой системы, а процесс созревания наивных Т-клеток в тимусе довольно энергозатратен. Смысл столь ранней инволюции органа может заключаться и в том, что в юном возрасте тимус состоит из молодых тканей, в структуре которых ещё нет дефектов, повышающих вероятность проникновения чужеродных агентов внутрь органа и использование их клетками тимуса для презентации созревающим наивным Т-клеткам как собственных антигенов, экспрессируемых организмом [5].
Другое объяснение явления увеличения разнообразия TCR после 70 лет заключается в том, что люди этой возрастной группы уже перешагнули определённый возрастной порог, пройдя в некотором смысле проверку на прочность — уникальный набор физиологических параметров, включая особенности иммунной системы, сделал их наиболее приспособленными среди всех особей популяции в данных условиях. Из этого можно заключить, что повышенное содержание наивных Т-клеток в субпопуляции CD4 + периферической крови человека коррелирует с долгожительством. Увеличение доли наивных Т-клеток в пуле CD4+, а значит и увеличение разнообразия TCR обеспечивает лучшую иммунорегуляторную функцию, что снижает общее воспаление, усиливающееся по мере старения организма из-за активации аутоиммунных процессов, увеличивает эффективность распознавания раковых клеток и обеспечивает более сбалансированный иммунный ответ [2].
Долгая, но бездетная жизнь

Рисунок 4. Придворные евнухи в Китае. Некоторые евнухи жили более ста лет. Рисунок с сайта Lacasamundo.
Исследование о придворных евнухах династии Чозунь в Корее 2012 года [6] показало, что продолжительность жизни евнухов составляла на 15-20 лет больше, чем продолжительность жизни мужчин с нормальной репродуктивной функцией, живущих в тех же условиях (рис. 4). Возможно, их продолжительность жизни увеличивалась именно благодаря отсутствию инволюции тимуса под влиянием половых гомонов, а следовательно благодаря большему разнообразию TCR наивных Т-клеток. В пользу этой гипотезы можно привести данные о том, что у женщин производство тимусом наивных Т-клеток происходит более эффективно, чем у мужчин, и уменьшение их содержания в периферической крови у женщин выражено в меньшей степени, чем у мужской части населения [7]. Возможно, лучшая работа иммунной системы у женщин связана с тем, что во время беременности иммунитет женщины необходимо «обуздать», сделав его толерантным к фактически чужеродному телу — плоду, что требует участия сложных регуляторных путей. Высокая точность регуляции иммунного ответа очень важна, так как ошибка приведёт к потере потомства. К этим рассуждениям можно прибавить и тот факт, что у женщин с наступлением менопаузы яичники перестают вырабатывать эстрогены, а у мужчин выработка половых гормонов не прекращается. Это объясняет большую продолжительность жизни у женщин, чем у мужчин, характерную для любых национальностей. В Европе и США женщины живут дольше мужчин на 4,5-5 лет, в России — на 13 [6].
Мальчик, которому сделают орхеэктомию (удаление яичек), может быть, и получит дополнительные 10-15 лет жизни, вместе с тем лишившись возможности иметь детей и получив набор других не совсем приятных последствий. Существуют менее радикальные решения, основанные на приёме определённых препаратов, способствующих восстановлению функции тимуса. Одно из таких веществ — грелин, этот гормон вырабатывается слизистой оболочкой желудка и вызывает чувство голода, действуя на центры гипоталамуса. Оказалось, что грелин участвует в Т-клеточном сигналлинге, способен снижать связанное с возрастными изменениями воспаление, способствует восстановлению структуры тимуса и стимуляции его функций. Ряд цитокинов и факторов роста (интерлейкины 7 и 22, фактор роста кератиноцитов) являются потенциальными кандидатами для решения проблемы восстановления функции тимуса у взрослых людей. Интерлейкины обеспечивают дифференцировку и выживание тимоцитов. Фактор роста кератиноцитов необходим для пролиферации и дифференцировки функциональных тканей тимуса, его использование вызывает пролиферацию тимоцитов и увеличивает размеры органа. Возможно также использование веществ, блокирующих выработку стероидных гормонов, таких как аналоги гонадотропин-релизинг гормона, например, люпрона. Люпрон действует на гипофиз, блокируя рецепторы к гонадотропин-релизинг гормону, из-за чего уменьшается выработка лютеинизирующего и фолликуло-стимулирующего гормонов, что ведёт к снижению продукции эстрогена и тестостерона. И всё же, все вышеперечисленные вещества имеют неоднозначное воздействие на организм, и пока ещё нет данных о долгосрочных последствиях их приёма, поэтому их назначают только в случае восстановления после химиотерапии или при ВИЧ-инфекции, когда стимуляция работы тимуса необходима для реконституции иммунной системы [1].
Хранение наивных Т-клеток — полезная инвестиция в будущее
Есть ли иной способ продлить мужскую жизнь? Авторов статьи [2] посетила смелая идея решения этой проблемы. Кроме того, что редко встречающиеся клоны наивных Т-клеток в результате случайных событий теряются с возрастом, они, как и все клетки организма, могут поделиться лишь ограниченное количество раз (примерно 50 — лимит Хейфлика), что обусловлено укорочением теломерных участков хромосом после каждой репликации ядерной ДНК, а делятся наивные Т-клетки раз в 1-2 года. Значит примерно к 70 годам основная часть Т-клеток выйдет из строя. Решение есть — можно запасать наивные Т-клетки! У молодых людей в возрасте до 15-20 лет, когда процессы формирования основного пула наивных Т-клеток уже заканчиваются, нужно брать образцы крови в таком объёме, чтобы количества наивных Т-клеток в них хватило для полного восстановления их пула уже в пожилом возрасте, и заморозить. Очень важно, чтобы забор произошёл именно в этот промежуток времени. Если брать кровь у более взрослых людей, количества циркулирующих наивных Т-клеток просто не хватит для полной реставрации их пула в будущем. Конечно же, такой подход будет эффективен и для женского пола. Эти образцы крови будут не только средством продления жизни, но ещё и подстраховкой в случае аутоиммунных заболеваний или рака, они помогут восстановить иммунную систему после химиотерапии. Создание подобных банков с замороженными образцами крови стало бы ключевым событием в становлении абсолютно новых подходов к лечению заболеваний иммунной системы. Например, СПИД можно было бы вылечить введением в здоровые размороженные Т-клетки заразившегося СПИДом мутации по гену мембранного рецептора CCR5 (CD195), люди с такой мутацией обладают природной резистентностью к ВИЧ [8], и их пересадкой больному, предварительно прошедшему курс химиотерапии.
Итоги
Как бы молодо не выглядел человек, параметры его иммунной системы будут объективно отражать возраст. Такие параметры как количество наивных Т-клеток и разнообразие TCR практически линейно снижаются по мере старения. Если вы являетесь счастливым обладателем повышенного разнообразия TCR, можете надеяться на несколько бонусных лет жизни. В будущем человечество ожидают новые дерзкие подходы к увеличению продолжительности жизни с использованием собственных наивных Т-лимфоцитов, собранных и замороженных много лет назад.
Читайте также:
