Гемодинамика при врожденных пороках сердца у детей.
Добавил пользователь Валентин П. Обновлено: 21.01.2026
НЦССХ имени А.Н. Бакулева РАМН, Москва
В рожденные пороки сердца (ВПС) — достаточно распространенная патология среди заболеваний сердечно-сосудистой системы, которая является основной причиной смерти детей первого года жизни. Частота ВПС составляет 30% от всех пороков развития. Лечение врожденных сердечных аномалий возможно только хирургическим путем. Благодаря успехам кардиохирургии стали возможны сложные реконструктивные операции при ранее неоперабельных ВПС. В этих уcловиях основной задачей в организации помощи детям с ВПС является своевременная диагностика и оказание квалифицированной помощи в хирургической клинике.
Основными причинами рождения детей с ВПС являются: хромосомные нарушения - 5%; мутация 1-го гена - 2-3%; влияние внешних факторов (алкоголизм родителей, прием лекарственных препаратов, перенесенные вирусные инфекции во время беременности и т.д.) - 1-2% ;полигенно-мультифокальное наследование - 90%.
Классификация
Встречается более 90 вариантов ВПС и множество их сочетаний. В Институте сердечно-сосудистой хирургии им. А.Н. Бакулева АМН СССР была разработана классификация, основанная на распределении ВПС с учетом анатомических особенностей порока и гемодинамических нарушений.
Для практикующих врачей-кардиологов удобнее пользоваться более упрощенным делением ВПС на 3 группы:
1. ВПС бледного типа с артериовенозным шунтом: дефект межжелудочковой перегородки (ДМЖП), дефект межпредсердной перегородки (ДМПП), открытый артериальный проток (ОАП); открытый атриовентрикулярный канал (АВК).
2. ВПС синего типа с веноартериальным шунтом: транспозиция магистральных сосудов (ТМС), тетрада Фалло (ТФ), триада Фалло, атрезия трикуспидального клапана (АТК) и т.д.
3. ВПС без сброса, но с препятствием на пути кровотока из желудочков (стенозы легочной артерии и аорты). Такое деление охватывает 9 наиболее распространенных ВПС.
Нарушение гемодинамики при врожденных пороках сердца
Не случайно во всех предложенных классификациях большое внимание уделено оценке нарушений гемодинамики при ВПС, так как степень этих нарушений тесно связана с анатомической тяжестью порока, от них зависит тактика медикаментозного лечения и сроки выполнения операции.
ВПС вызывает ряд изменений компенсаторного характера, которые заставляют перестраиваться весь организм ребенка, но при длительном существовании порока процессы компенсации ведут к выраженным деструктивным изменениям органов и систем, что приводит к гибели больного.
В зависимости от состояния малого круга кровообращения в организме больного с ВПС наблюдаются следующие патологические изменения:
• при наличии увеличенного кровотока в легких (пороки бледного типа с артериовенозным шунтом) развивается гиперволемия и гипертензия малого круга кровообращения;
• при наличии обедненного кровотока в легких (пороки синего типа с веноартериальным шунтом) у больного развивается гипоксемия;
• при увеличении кровотока в малом круге кровообращения развивается гиперволемия и легочная гипертензия.
Примерно 50% детей первого года жизни с большим сбросом крови в малый круг кровообращения без хирургической помощи погибают при явлениях сердечной недостаточности. Если ребенок переживает этот критический период, то к году в результате спазма легочных артериол уменьшается сброс крови в малый круг и состояние ребенка стабилизируется, однако это улучшение касается только самочувствия больного, так как одновременно начинают развиваться склеротические процессы в сосудах легких. Существует много классификаций легочной гипертензии. Для практики наиболее удобной является классификация, разработанная в ИССХ им. А. Н. Бакулева АМН СССР (В.И. Бураковский и соавт., 1975). Она основана на величине давления в легочной артерии, степени сброса крови и соотношении общелегочного сопротивления к показателям большого круга кровообращения (табл. 1).
Согласно этой классификации, больные делятся на 4 группы, где I и III стадия разделены на подгруппы А и Б. Больные IА группы имеют небольшие нарушения гемодинамики и нуждаются в наблюдении кардиолога. У больных IБ и II группы ставится вопрос об операции. Легочная гипертензия в этих группах носит функциональный характер.
У больных III группы при большом сбросе крови в малый круг изменения в легочных сосудах значительно более выражены. При IIIА гемодинамической группе возможна радикальная коррекция порока, и давление после операции снижается. В IIIБ и IV группе хирургическое лечение не показано. Дифференциальный диагноз между IIIА и Б группами сложен, и нередко для решения вопроса об операбельности порока необходимо выполнить внутрисосудистое ультразвуковое исследование и/или биопсию легкого для изучения морфологических изменений в легочных сосудах. Для оценки этих изменений наиболее часто используется классификация, предложенная Д. Хитом и Дж. Эдвардсом в 1958 г. (табл. 2).
При цианотических формах ВПС наличие сброса венозной крови в артериальную или смешение крови ведут к увеличению объема крови в большом круге кровообращения и уменьшению в малом, что приводит к снижению насыщения крови кислородом (гипоксемии) и к появлению цианоза кожи и слизистых. Для улучшения доставки кислорода к органам и повышения эффективности вентиляции происходит развитие коллатерального кровообращения между сосудами большого и малого круга кровообращения. Перестройка коллатеральной сети кровообращения происходит в сосудах всех органов. Особенно это выражено в сосудах сердца, легких и головного мозга.
Благодаря компенсаторным механизмам состояние больного с цианотическими формами ВПС, несмотря на тяжелые нарушения гемодинамики, может быть длительно удовлетворительным, но постепенно компенсаторные механизмы истощаются, длительная гиперфункция миокарда приводит к развитию тяжелых необратимых дистрофических изменений в сердечной мышце. Поэтому оперативное вмешательство при цианотических пороках (радикальное или паллиативное) показано в самом раннем детском возрасте.
Диагностика
Первичная диагностика ВПС основывается на данных неинвазивных методов исследования. Большое значение для диагностики имеет целенаправленный сбор анамнеза у родителей ребенка. При бледных пороках сердца необходимо выяснить, часто ли болеет ребенок респираторными инфекциями, были ли у него пневмонии, так как это говорит о большом сбросе крови слева-направо. С другой стороны, прекращение респираторных инфекций у больного с большим сбросом крови в малый круг говорит о начале развития легочной гипертензии. Это должно быть поводом для направления больного к кардиохирургу. Естественное течение ВПС может осложниться развитием инфекционного эндокардита, поэтому необходимо выяснить, бывают ли у ребенка подъемы температуры тела без признаков респираторной инфекции. Следует также выяснить, не было ли у больного синкопальных состояний, судорожного синдрома, которые могут быть следствием аритмий сердца.
При осмотре ребенка с подозрением на ВПС необходимо отметить цвет кожных покровов и слизистых. Цианоз может быть периферическим и генерализованным. Важно отметить наличие или отсутствие цианоза на всех 4 конечностях, так как при некоторых ВПС наблюдается дифференцированный цианоз (предуктальная коарктация аорты, транспозиции магистральных сосудов в сочетании с перерывом дуги аорты). При осмотре грудной клетки необходимо отметить деформацию грудной клетки в области сердца — появление так называемого сердечного горба (по величине и локализации которого можно косвенно судить о сложности ВПС и/или развитии легочной гипертензии).
При пальпации грудной клетки у больного с ВПС можно отметить смещение верхушечного толчка, изменение его площади, наличие “дрожания” над областью сердца. Пальпация позволяет оценить размеры печени и селезенки. Методом перкуссии определяют размеры сердца, печени и селезенки.
Аускультация является наиболее информативным методом физикального обследования больных с ВПС. При аускультации можно отметить изменение тонов сердца (усиление, ослабление или расщепление), появление шумов, а также их локализацию, иррадиацию и место максимального выслушивания. Интенсивность шума не всегда коррелирует с тяжестью порока, например, при ВПС с легочной гипертензией и синих пороках со стенозом легочной артерии эта зависимость носит обратный характер. При аускультации легких можно выявмть признаки застоя в малом круге.
Физикальное исследование дополняется проведением неинвазивного инструментального обследования, которое включает электрокардиографию (ЭКГ), фонокардиографию (ФКГ) и рентгенографию органов грудной клетки.
ЭКГ позволяет судить о гипертрофии различных отделов сердца, патологических отклонениях электрической оси, наличии нарушений ритма и проводимости. Изменения на ЭКГ не являются специфичными для какого-либо порока, но в сочетании с данными, полученными при клиническом обследовании и с помощью других неинвазивных методов, позволяют судить о тяжести порока. Разновидностью метода ЭКГ является холтеровское суточное ЭКГ-мониторирование, которое помогает выявить скрытые нарушения ритма и проводимости.
Следующим неинвазивным методом обследования кардиологических больных является ФКГ, которая воспроизводит данные аускультации сердца и позволяет более детально и количественно оценить характер, продолжительность и локализацию сердечных тонов и шумов.
Рентгенография органов грудной клетки дополняет предыдущие методы и позволяет оценить: состояние малого круга кровообращения (наличие артериального или венозного застоя, снижение наполнения сосудов легких); расположение, форму, размеры сердца и его отдельных камер; изменения со стороны других органов и систем (легкие, плевра, позвоночник, а также расположение внутренних органов).
Сочетание ЭКГ, ФКГ и рентгенография органов грудной клетки позволяет диагностировать большинство изолированных пороков и предположить наличие сложных ВПС.
Наиболее высокоинформативным неинвазивным методом исследования является эхокардиография (ЭХОКГ). С появлением данной методики, особенно двухмерной ЭХОКГ, значительно расширились возможности диагностики ВПС. Этот метод позволяет провести анатомически точную диагностику дефектов перегородок сердца, поражения атриовентрикулярных и полулунных клапанов, размеры и расположение камер сердца и магистральных сосудов, а также оценить сократительную способность миокарда. При определенных пороках (неосложненные ДМПП, ДМЖП, ОАП, частично открытый АВК, коарктация аорты) можно выполнить операцию без проведения катетеризации сердца. Однако в ряде случаев при сложных ВПС и сопутствующей легочной гипертензии необходимо провести катетеризацию сердца и ангиокардиографию, так как эти методы позволяют провести точную анатомическую и гемодинамическую диагностику ВПС. Проведение катетеризации сердца возможно только в условиях специализированной кардиохирургической клиники. В настоящее время при проведении катетеризации сердца в случае необходимости выполняется электрофизиологическое исследование для уточнения механизма аритмий сердца, оценки функции синусового и атриовентрикулярного узлов, а также проводятся различные эндоваскулярные операции: баллонная ангиопластика при стенозах легочной артерии и аорты; эмболизация небольших ОАП, коронаросердечных фистул, аортолегочных коллатералей; баллонная атриосептостомия при простой ТМС и стентирование легочных сосудов при периферических стенозах.
Тактика хирургического лечения
Тактика оказания помощи больным с ВПС строится с учетом течения порока, эффективности консервативного лечения, возможности и риска проведения хирургического лечения. После установления диагноза необходимо решить:
1. Как лечить больного (медикаментозно или хирургически)?
2. Определить сроки выполнения операции.
Ответить на эти вопросы помогает классификация, предложенная J. Kirklin и соавт. (1984).
0-я группа - больные с ВПС, с незначительными нарушениями гемодинамики, которые не нуждаются в операции.
1-я группа - больные, состояние которых позволяет провести операцию в плановом порядке ( через год и более).
2-я группа - больные, которым операция показана в ближайшие 3-6 мес.
3-я группа - больные с тяжелыми проявлениями ВПС, которых необходимо оперировать в течение нескольких недель.
4-я группа - больные, нуждающиеся в экстренной операции (в течение 48 ч после госпитализации).
Наиболее сложная проблема в кардиохирургии - операция у детей первого года жизни с ВПС. Хирургическая летальность в последние годы значительно снижена и отличается от высокой естественной смертности при ВПС. Операция у детей первого года жизни выполняется в том случае, если консервативными методами не удается достичь стабилизации состояния. Большинство неотложных операций выполняются у детей с цианотическими ВПС.
Если у новорожденного с ВПС отсутствуют признаки сердечной недостаточности, цианоз выражен умеренно, то консультация кардиохирурга может быть проведена позднее. Наблюдение за такими детьми осуществляет кардиолог по месту жительства. Такая тактика позволяет провести обследование больного в более благоприятных условиях, снизить риск проведения инвазивных методов исследования и оперативного вмешательства.
В более поздней возрастной группе хирургическая тактика при ВПС зависит от тяжести патологии, предполагаемого прогноза, возраста и массы тела больного. K.Turley и соавт. в 1980 г. предложили разделить ВПС на 3 группы, в зависимости от вида возможной операции.
К 1-й группе относятся такие наиболее часто встречающиеся пороки, как ОАП, ДМЖП, ДМПП, частично открытый АВК, коарктация аорты, стеноз и недостаточность митрального и аортального клапанов. При установлении данных пороков единственным выбором может быть операция. Она может быть отложена, если нарушения гемодинамики нерезко выражены, а возраст ребенка и масса тела слишком малы (более поздний возраст и достаточная масса тела снижают риск выполнения кардиохирургических вмешательств).
Во 2-ю группу входят сложные цианотические пороки, такие, как тетрада Фалло, стеноз легочной артерии, атрезия легочной артерии 1-го типа, транспозиция магистральных сосудов и др. Выбор между радикальной и паллиативной операцией зависит от анатомической тяжести порока, степени гипоксемии и массы тела ребенка.
К 3-й группе относятся ВПС, при которых возможна только паллиативная или гемодинамическая коррекция порока. К ней относятся различные варианты сложных пороков: атрезия трикуспидального и митрального клапанов, двухкамерное сердце, синдром гипоплазии правого и левого сердца, единственный желудочек сердца и др.
Радикальная коррекция простых неосложненных пороков не представляет технических трудностей для специализированной кардиохирургической клиники. При ДМЖП и ДМПП выполняется ушивание или пластика дефектов заплатой, при ОАП - перевязка или пересечение протока. При выраженной гипоксемии первым этапом у больного с ВПС проводится паллиативная операция - наложение различных межсистемных анастомозов. После проведения операции улучшается насыщение крови кислородом, что позволяет ребенку развиваться в более благоприятных условиях. Выполнение двухэтапных операций, по данным различных авторов, не только не увеличивает риск вмешательства, но уменьшает летальность при радикальной коррекции.
При некоторых анатомически сложных ВПС, когда отсутствуют или недоразвиты различные отделы сердца (атрезия трикуспидального и митрального клапанов, единственный желудочек сердца, двухкамерное сердце и т.д.) выполнение радикальной операции не представляется возможным и единственной операцией может быть гемодинамическая коррекция внутрисердечной гемодинамики, которая позволяет разделить артериальные и венозные потоки крови, не устраняя полностью анатомические пороки. К ним относятся различные модификации гемодинамической коррекции по методу Фонтена, Мастарда и Сенинга.
1. Бураковский В.И., Бухарин В.А. Константинов С.А. и др. Врожденные пороки сердца. В кн. Частная хирургия болезней сердца и сосудов / Под ред. В.И. Бураковского и С.А.Колесникова. М.: Медицина, 1967; 315—23.
2. Бураковский В.И., Бухарин В.А., Плотникова Л.Р. Легочная гипертензия при врожденных пороках сердца. М. Медицина, 1975; 247.
3. Амосов Н.М., Бендет Я.А. Терапевтические аспекты кардиохирургии. Киев: Здоровье, 1983; 33—96.
4. Белоконь Н.А., Кубергер М.Б. Болезни сердца и сосудов у детей. Руководство для врачей. В 2 томах. — М. Медицина, 1987; 918.
5. Бураковский В.А., Бухарин В.А., Подзолков В.П. и др. Врожденные пороки сердца. В кн. Сердечно-сосудистая хирургия / Под ред. В.И. Бураковского, Л.А. Бокерия. М. Медицина, 1989; 345—82.
6. Иваницкий А.В., Роль рентгенологического исследования в диагностике пороков сердца у детей. Педиатрия. 1985; 8 (7) 55—7.
7. Н.А.Белоконь, В.П. Подзолков. Врожденные пороки сердца. М. Медицина, 1991; 352.
Врожденные пороки сердца
Врожденные пороки сердца - группа заболеваний, объединенных наличием анатомических дефектов сердца, его клапанного аппарата или сосудов, возникших во внутриутробном периоде, приводящих к изменению внутрисердечной и системной гемодинамики. Проявления врожденного порока сердца зависят от его вида; к наиболее характерным симптомам относятся бледность или синюшность кожных покровов, шумы в сердце, отставание в физическом развитии, признаки дыхательной и сердечной недостаточности. При подозрении на врожденный порок сердца выполняется ЭКГ, ФКГ, рентгенография, ЭхоКГ, катетеризация сердца и аортография, кардиография, МРТ сердца и т. д. Чаще всего при врожденных пороках сердца прибегают к кардиохирургической операции - оперативной коррекции выявленной аномалии.
Общие сведения
Врожденные пороки сердца - весьма обширная и разнородная группа заболеваний сердца и крупных сосудов, сопровождающихся изменением кровотока, перегрузкой и недостаточностью сердца. Частота встречаемости врожденных пороков сердца высока и, по оценке различных авторов, колеблется от 0,8 до 1,2% среди всех новорожденных. Врожденные пороки сердца составляют 10-30% всех врожденных аномалий. В группу врожденных пороков сердца входят как относительно легкие нарушения развития сердца и сосудов, так и тяжелые формы патологии сердца, несовместимые с жизнью.
Многие виды врожденных пороков сердца встречаются не только изолированно, но и в различных сочетаниях друг с другом, что значительно утяжеляет структуру дефекта. Примерно в трети случаев аномалии сердца сочетаются с внесердечными врожденными пороками ЦНС, опорно-двигательного аппарата, ЖКТ, мочеполовой системы и пр.
К наиболее частым вариантам врожденных пороков сердца, встречающимся в кардиологии, относятся дефекты межжелудочковой перегородки (ДМЖП - 20%), дефекты межпредсердной перегородки (ДМПП), стеноз аорты, коарктация аорты, открытый артериальный проток (ОАП), транспозиция крупных магистральных сосудов (ТКС), стеноз легочной артерии (10-15% каждый).

Причины врожденных пороков сердца
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью (90%).
Различного рода хромосомные аберрации приводят к количественным и структурным изменениям хромосом. При хромосомных перестройках отмечаются множественные полисистемные аномалии развития, включая врожденные пороки сердца. В случае трисомии аутосом наиболее частыми пороками сердца оказываются дефекты межпредсердной или межжелудочковой перегородок, а также их сочетание; при аномалиях половых хромосом врожденные пороки сердца встречаются реже и представлены, главным образом, коарктацией аорты или дефектом межжелудочковой перегородки.
Врожденные пороки сердца, обусловленные мутациями единичных генов, также в большинстве случаев сочетаются с аномалиями других внутренних органов. В этих случаях сердечные пороки являются частью аутосомно-доминантных (синдромы Марфана, Холта-Орама, Крузона, Нунана и др.), аутосомно-рецессивных синдромов (синдром Картагенера, Карпентера, Робертса, Гурлер и др.) или синдромов, сцепленных с Х-хромосомой (синдромы Гольтца, Аазе, Гунтера и др.).
Среди повреждающих факторов внешней среды к развитию врожденных пороков сердца приводят вирусные заболевания беременной, ионизирующая радиация, некоторые лекарственные препараты, пагубные привычки матери, производственные вредности. Критическим периодом неблагоприятного воздействия на плод являются первые 3 месяца беременности, когда происходит фетальный органогенез.
Внутриутробное поражение плода вирусом краснухи наиболее часто вызывает триаду аномалий - глаукому или катаракту, глухоту, врожденные пороки сердца (тетраду Фалло, транспозицию магистральных сосудов, открытый артериальный проток, общий артериальный ствол, клапанные пороки, стеноз легочной артерии, ДМЖП и др.). Также обычно имеют место микроцефалия, нарушение развития костей черепа и скелета, отставание в умственном и физическом развитии.
В структуру эмбриофетального алкогольного синдрома обычно входят дефекты межжелудочковой и межпредсердной перегородки, открытый артериальный проток. Доказано, что тератогенное действие на сердечно-сосудистую систему плода оказывает прием амфетаминов, приводящий к транспозиции магистральных сосудов и ДМЖП; противосудорожных средств, обусловливающих развитие стеноза аорты и легочной артерии, коарктации аорты, открытого артериального протока, тетрады Фалло, гипоплазии левых отделов сердца; препаратов лития, приводящих к атрезии трехстворчатого клапана, аномалии Эбштейна, ДМПП; прогестагенов, вызывающих тетраду Фалло, другие сложные врожденные пороки сердца.
У женщин, страдающих преддиабетом или диабетом, дети с врожденными пороками сердца рождаются чаще, чем у здоровых матерей. В этом случае у плода обычно формируются ДМЖП или транспозиция крупных сосудов. Вероятность рождения ребенка с врожденным пороком сердца у женщины с ревматизмом составляет 25 %.
Кроме непосредственных причин, выделяют факторы риска формирования аномалий сердца у плода. К ним относят возраст беременной младше 15-17 лет и старше 40 лет, токсикозы I триместра, угрозу самопроизвольного прерывания беременности, эндокринные нарушения у матери, случаи мертворождения в анамнезе, наличие в семье других детей и близких родственников с врожденными пороками сердца.
Классификация врожденных пороков сердца
Существует несколько вариантов классификаций врожденных пороков сердца, в основу которых положен принцип изменения гемодинамики. С учетом влияния порока на легочный кровоток выделяют:
- врожденные пороки сердца с неизмененным (либо незначительно измененным) кровотоком в малом круге кровообращения: атрезия аортального клапана, стеноз аорты, недостаточность легочного клапана, митральные пороки (недостаточность и стеноз клапана), коарктация аорты взрослого типа, трехпредсердное сердце и др.
- врожденные пороки сердца с увеличенным кровотоком в легких: не приводящие к развитию раннего цианоза (открытый артериальный проток, ДМПП, ДМЖП, аортолегочный свищ, коарктация аорты детского типа, синдром Лютамбаше), приводящие к развитию цианоза (атрезия трехстворчатого клапана с большим ДМЖП, открытый артериальный проток с легочной гипертензией)
- врожденные пороки сердца с обедненным кровотоком в легких: не приводящие к развитию цианоза (изолированный стеноз легочной артерии), приводящие к развитию цианоза (сложные пороки сердца - болезнь Фалло, гипоплазия правого желудочка, аномалия Эбштейна)
- комбинированные врожденные пороки сердца, при которых нарушаются анатомические взаимоотношения между крупными сосудами и различными отделами сердца: транспозиция магистральных артерий, общий артериальный ствол, аномалия Тауссиг-Бинга, отхождение аорты и легочного ствола из одного желудочка и пр.
В практической кардиологии используется деление врожденных пороков сердца на 3 группы: пороки «синего» (цианотического) типа с веноартериальным шунтом (триада Фалло, тетрада Фалло, транспозиция магистральных сосудов, атрезия трехстворчатого клапана); пороки «бледного» типа с артериовенозным сбросом (септальные дефекты, открытый артериальный проток); пороки с препятствием на пути выброса крови из желудочков (стенозы аорты и легочной артерии, коарктация аорты).
Нарушения гемодинамики при врожденных пороках сердца
В результате выше названных причин у развивающего плода может нарушаться правильное формирование структур сердца, что выражается в неполном или несвоевременном закрытии перепонок между желудочками и предсердиями, неправильном образовании клапанов, недостаточном повороте первичной сердечной трубки и недоразвитии желудочков, аномальном расположении сосудов и т. д. После рождения у части детей остаются открытыми артериальный проток и овальное окно, которые во внутриутробном периоде функционируют в физиологическом порядке.
При врожденных пороках сердца бледного типа с артериовенозным сбросом вследствие гиперволемии развивается гипертензия малого круга кровообращения; при пороках синего типа с веноартериальным шунтом у больных имеет место гипоксемия.
Около 50% детей с большим сбросом крови в малый круг кровообращения погибают без кардиохирургической помощи на первом году жизни от явлений сердечной недостаточности. У детей, перешагнувших этот критический рубеж, сброс крови в малый круг уменьшается, самочувствие стабилизируется, однако постепенно прогрессируют склеротические процессы в сосудах легких, обусловливая легочную гипертензию.
При цианотических врожденных пороках сердца венозный сброс крови или ее смешение приводит к перегрузке большого и гиповолемии малого круга кровообращения, вызывая снижение насыщения крови кислородом (гипоксемию) и появление синюшности кожи и слизистых. Для улучшения вентиляции и перфузии органов развивается коллатеральная сеть кровообращения, поэтому, несмотря на выраженные нарушения гемодинамики, состояние больного может длительное время оставаться удовлетворительным. По мере истощения компенсаторных механизмов, вследствие длительной гиперфункции миокарда, развиваются тяжелые необратимые дистрофические изменения в сердечной мышце. При цианотических врожденных пороках сердца оперативное вмешательство показано уже в раннем детском возрасте.
Симптомы врожденных пороков сердца
Клинические проявления и течение врожденных пороков сердца определяется видом аномалии, характером нарушений гемодинамики и сроками развития декомпенсации кровообращения.
У новорожденных с цианотическими врожденными пороками сердца отмечается цианоз (синюшность) кожных покровов и слизистых оболочек. Синюшность усиливается при малейшем напряжении: сосании, плаче ребенка. Белые пороки сердца проявляются побледнением кожи, похолоданием конечностей.
Дети с врожденными пороками сердца обычно беспокойные, отказываются от груди, быстро устают в процессе кормления. У них появляется потливость, тахикардия, аритмии, одышка, набухание и пульсация сосудов шеи. При хроническом нарушении кровообращения дети отстают в прибавлении веса, росте и физическом развитии. При врожденных пороках сердца обычно сразу поле рождения выслушиваются сердечные шумы. В дальнейшем обнаруживаются признаки сердечной недостаточности (отеки, кардиомегалия, кардиогенная гипотрофия, гепатомегалия и др.).
Осложнениями врожденных пороков сердца могут стать бактериальный эндокардит, полицитемия, тромбозы периферических сосудов и тромбоэмболии сосудов головного мозга, застойные пневмонии, синкопальные состояния, одышечно-цианотические приступы, стенокардитический синдром или инфаркт миокарда.
Диагностика врожденных пороков сердца
Выявление врожденных пороков сердца осуществляется путем комплексного обследования. При осмотре ребенка отмечают окраску кожных покровов: наличие или отсутствие цианоза, его характер (периферический, генерализованный). При аускультации сердца нередко выявляется изменение (ослабление, усиление или расщепление) сердечных тонов, наличие шумов и пр. Физикальное обследование при подозрении на врожденный порок сердца дополняется инструментальной диагностикой - электрокардиографией (ЭКГ), фонокардиографией (ФКГ), рентгенографией органов грудной клетки, эхокардиографией (ЭхоКГ).
ЭКГ позволяет выявить гипертрофию различных отделов сердца, патологическое отклонение ЭОС, наличие аритмий и нарушений проводимости, что в совокупности с данными других методов клинического обследования позволяет судить о тяжести врожденного порока сердца. С помощью суточного холтеровского ЭКГ-мониторирования обнаруживаются скрытые нарушения ритма и проводимости. Посредством ФКГ более тщательно и детально оценивается характер, длительность и локализация сердечных тонов и шумов. Данные рентгенографии органов грудной клетки дополняют предыдущие методы за счет оценки состояния малого круга кровообращения, расположения, формы и размеров сердца, изменений со стороны других органов (легких, плевры, позвоночника). При проведении ЭхоКГ визуализируются анатомические дефекты перегородок и клапанов сердца, расположение магистральных сосудов, оценивается сократительная способность миокарда.
При сложных врожденных пороках сердца, а также сопутствующей легочной гипертензии, с целью точной анатомической и гемодинамической диагностики, возникает необходимость в выполнении зондирования полостей сердца и ангиокардиографии.
Лечение врожденных пороков сердца
Наиболее сложной проблемой в детской кардиологии является хирургическое лечение врожденных пороков сердца у детей первого года жизни. Большинство операций в раннем детском возрасте выполняется по поводу цианотических врожденных пороков сердца. При отсутствии у новорожденного признаков сердечной недостаточности, умеренной выраженности цианоза операция может быть отложена. Наблюдение за детьми с врожденными пороками сердца осуществляют кардиолог и кардиохирург.
Специфическое лечение в каждом конкретном случае зависит от разновидности и степени тяжести врожденного порока сердца. Операции при врожденных дефектах перегородок сердца (ДМЖП, ДМПП) могут включать пластику или ушивание перегородки, рентгенэндоваскулярную окклюзию дефекта. При наличии выраженной гипоксемии детям с врожденными пороками сердца первым этапом выполняется паллиативное вмешательство, предполагающее наложение различного рода межсистемных анастомозов. Подобная тактика улучшает оксигенацию крови, уменьшает риск осложнений, позволяет провести радикальную коррекцию в более благоприятных условиях. При аортальных пороках выполняется резекция или баллонная дилатация коарктации аорты, пластика аортального стеноза и др. При ОАП производится его перевязка. Лечение стеноза легочной артерии заключается в проведении открытой или эндоваскулярной вальвулопластики и т. д.
Анатомически сложные врожденные пороки сердца, при которых радикальная операция не представляется возможной, требуют выполнения гемодинамической коррекции, т. е. разделения артериального и венозного потоков крови без устранения анатомического дефекта. В этих случаях могут проводиться операции Фонтена, Сеннинга, Мастарда и др. Серьезные пороки, не поддающиеся оперативному лечению, требуют проведения пересадки сердца.
Консервативное лечение врожденных пороков сердца может включать в себя симптоматическую терапию одышечно-цианотических приступов, острой левожелудочковой недостаточности (сердечной астмы, отека легких), хронической сердечной недостаточности, ишемии миокарда, аритмий.
Прогноз и профилактика врожденных пороков сердца
В структуре смертности новорожденных врожденные пороки сердца занимают первое место. Без оказания квалифицированной кардиохирургической помощи в течение первого года жизни погибает 50-75% детей. В периоде компенсации (2-3 года) смертность снижается до 5%. Ранее выявление и коррекция врожденного порока сердца позволяет существенно улучшить прогноз.
Профилактика врожденных пороков сердца требует тщательного планирования беременности, исключения воздействия неблагоприятных факторов на плод, проведения медико-генетического консультирования и разъяснительной работы среди женщин групп риска по рождению детей с сердечной патологией, решения вопроса о пренатальной диагностике порока (УЗИ, биопсия хориона, амниоцентез) и показаниях к прерыванию беременности. Ведение беременности у женщин с врожденными пороками сердца требует повышенного внимания со стороны акушера-гинеколога и кардиолога.
Возможности эхокардиографии плода в I триместре беременности (11-14 недель)
Московский областной НИИ акушерства и гинекологии (МОНИИАГ), Россия.
Гомельский областной медико-генетический центр с консультацией "Брак и семья", Гомель, Беларусь.

УЗИ аппарат RS85
Революционные изменения в экспертной диагностике. Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): "Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга".
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира - это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки - в I триместре беременности 8. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или "белого" журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат "перу" специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды - в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.
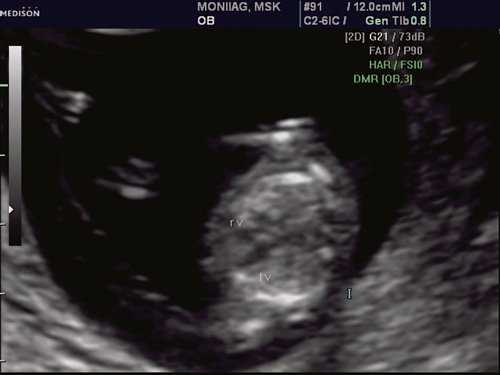
Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
Коарктация аорты у плода. Точность и ошибки диагностики
ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова" Минсоцразвития РФ, Москва.

УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Распределение диагностики ВПС в зависимости от нозологической формы значительно варьирует. Определенные ВПС пренатальная диагностика позволяет выявить в 90% случаев. Цифры статистики неумолимо показывают низкий процент выявления ВПС (30%) по результатам скринингового исследования. В специализированных учреждениях частота выявления ВПС выше и достигает 54% [1, 2].
Точность ультразвуковой диагностики патологии плода за последние годы многократно подвергается критике со стороны акушеров-гинекологов и в большей степени педиатров. Порой клинические признаки интересуют специалистов значительно меньше, чем данные ультразвукового антенатального исследования плода.
В этой работе представлен анализ возможностей ультразвукового пренатального исследования при коарктации аорты. В работе учтены данные, имеющиеся в публикациях отечественных и зарубежных авторов, а также материал отделения функциональной диагностики Центра.
Латинский термин "сoarctatius" означает "суженный, стиснутый". Впервые его описал J.F. Meckel в 1750 году. Коарктация аорты - это патологическое сужение ее просвета, которое может возникнуть в любом месте по всей ее длине. Частота порока составляет 6,3%, по данным клинических наблюдений из выборки в 2000 случаев [3], и 8,4% по результатам патологоанатомического материала [4].
У детей первого года жизни коарктация аорты занимает четвертое место cреди ВПС. Как правило, она развивается дистальнее места ответвления левой подключичной артерии вблизи артериального протока (ductus arteriosus). В зависимости от локализации сужения аорты относительно артериального протока различают два классических типа коарктации: предуктальную и постдуктальную [5].
При наличии сужения аорты клиническая картина может нарастать как шквал после закрытия артериального протока. В течение первого года погибают 56% пациентов. В основном смертельный исход бывает вызван сочетанием коарктации с другими аномалиями сердца. Изолированная форма в первые недели и дни жизни также характеризуется высоким процентом смертности (34%). Если этот период дети переживают, то продолжительность жизни в среднем составляет 30-50 лет. Причиной смерти у новорожденных является сердечно-легочная недостаточность. При артериальной высокой гипертензии, как исключение, может быть кровоизлияние в мозг.
В ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова " Минсоцразвития РФ за двухлетний период (2010-2011) родились 27 детей с аномалиями аорты, от незначительного сужения до полного перерыва. В 15 наблюдениях в отделении функциональной диагностики диагноз был поставлен антенатально. Это были беременные, обратившиеся в поздние сроки от 35 до 39 нед гестации. Во всех наблюдениях патология аорты сочеталась с гипоплазией левого желудочка. Диагноз был подтвержден во всех случаях. В изолированном виде коарктация аорты за этот период была диагностирована в 6 наблюдениях. В 3 из них диагноз был поставлен антенатально, в 2 - сужение было выявлено у новорожденных на 3-5-е сутки после закрытия артериального протока. В одном случае после рождения был поставлен диагноз кинкинг аорты. Таким образом, наши данные свидетельствуют о сложности и невысоком проценте выявления изолированной коарктации аорты. Лишь в тех наблюдениях, когда имеются выраженные гемодинамические нарушения, приводящие к значительным анатомическим изменениям в виде гипоплазии левого желудочка, диспропорции желудочков сердца, увеличения диаметра легочной артерии диагноз с большой достоверностью может быть поставлен антенатально.
Первые работы по диагностике коарктации аорты у плода относятся к 1984 г. [6, 7]. По данным литературы, трансвагинальный доступ в 12-15 нед гестации позволяет диагностировать коарктацию аорты в 21,4% случаев [1]. При трансабдоминальном доступе частота выявления коарктации аорты увеличивается: в 16-30 нед она составляет 43%, после 30 нед, по мере прогрессирования гемодинамических нарушений, не превышает 54% [8].
Согласно результатам скринингового ультразвукового обследования 20 248 плодов при сроках 19-22 нед беременности в крупном регионе Германии (1990-1994) пренатальный диагноз коарктации аорты не был установлен ни в одном из 7 случаев. Аналогичные данные были получены в Норвегии, даже в специализированном центре пренатальной диагностики. Согласно данным мультицентрового анализа, проведенного в 12 европейских странах, точный пренатальный диагноз изолированной коарктации аорты в конце 90-х гг. был установлен только в 9 (15,8%) из 57 случаев [9]. Средний срок обнаружения изолированной коарктации составил 22 нед, при этом 7 из 9 случаев было выявлено до 24 нед. При сочетании коарктации аорты с экстракардиальными пороками и хромосомными аномалиями точность ее пренатальной диагностики была существенно выше за счет выраженности гемодинамических нарушений и расширенного эхокардиографического исследования плода и составила 52%.
По данным института сердечно-сосудистой хирургии им. А.Н. Бакулева, точность диагностики не превышает 27%. Как правило, патология наиболее часто отмечается при сочетании коарктации аорты с другими кардиальными аномалиями [10].
Таким образом, обобщая статистические данные материала Центра, публикации ведущих специалистов России и зарубежных коллег, можно отметить очень низкий процент диагностики коарктации аорты у плода.
В чем же причина столь низкого процента выявления коарктации аорты антенатально?
Существует несколько факторов, затрудняющих диагностику коарктации аорты антенатально.
Первая причина не диагностированной коарктации аорты это морфогенез патологии и теория первичного нарушения развития дуги аорты. Теория была предложена в 1828 г. [11]. Автор считает, что данная патология связана с недостаточным соединением 4 и 6 дуги аорты с нисходящим ее отделом. Поэтому перешеек - это место, где наиболее часто локализуется участок сужения [12], так как оба отдела образуются из разных эмбриональных зачатков. В норме область перешейка аорты равна 2/3 диаметра восходящего отдела аорты (рис. 1).
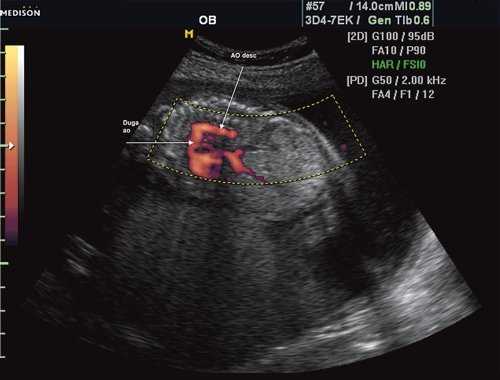
Рис. 1. Восходящий отдел, дуга и нисходящий отдел аорты плода в режиме энергетического допплера в норме.
Согласно "теории дуктальной ткани" коарктация аорты возникает в результате миграции гладких мышечных клеток протока в предуктальную аорту, с последующей констрикцией и сужением просвета аорты [4]. При формировании коарктации аорты в области перешейка сохраняется сужение различной протяженности и формы (рис. 2, 3). Наиболее часто это проявляется в виде локальной перетяжки, выше или ниже которой диаметр аорты сохраняется в норме.

Рис. 2. Ультразвуковое исследование восходящего отдела, дуги и нисходящего отдела аорты. Стрелкой указано место сужения.

Рис. 3. Трехмерное изображение сердца и аорты плода в 16 нед беременности. Стрелкой указано место сужения аорты. AO DESC - нисходящий отдел аорты, COR - сердце.
Следовательно, оценка сужения аорты в типичном месте как признак развивающейся патологии не всегда представляется возможной в ранние сроки беременности. Поскольку речь идет о предуктальной коарктации аорты (сужение аорты локализовано проксимальнее протока), то, очевидно, что в период внутриутробной жизни в более поздние сроки отмечается снижение кровотока через левые отделы сердца и перешеек аорты и развивается гипоплазия левого желудочка и аорты. Это и способствует более позднему проявлению патологии и возможности ее ультразвуковой диагностики.
Вторая причина, затрудняющая диагностику коарктации аорты - это теория постнатального развития. У плода перешеек аорты узкий и после рождения и закрытия артериального протока он должен в норме расшириться для обеспечения адекватного кровотока в нисходящий отдел аорты. Таким образом, имеющееся физиологическое сужение перешейка аорты не позволяет предположить формирование коарктации аорты после рождения.
Постдуктальная коарктация развивается уже после рождения и практически всегда представляет собой изолированный дефект. Эта аномалия, вероятнее всего, является результатом разрастания мышечной ткани артериального протока в аорту плода. Когда же проток после рождения сужается, эктопическая ткань внутри аорты также сжимается, перекрывая, как тампоном, просвет сосуда по всей его окружности. В отличие от предуктальной коарктации в данном случае гипоплазия аорты не развивается. Закрытие артериального протока у некоторых детей приводит к наличию сужения аорты и развитию коарктации через 2-3 нед после рождения [13].
Третья причина не диагностированной коарктации аорты состоит в особенностях внутрисердечной гемодинамики у плода. Кровообращение плода, так же, как и взрослого, подчиняется ряду основных закономерностей физического и биологического воздействия. Поток крови движется из зоны высокого давления в область низкого давления. При выраженном потоке размеры увеличиваются, при уменьшении объема потока уменьшаются. Так, гипоплазия левого желудочка и коарктация аорты часто сопутствуют порокам со сниженным выбросом крови в аорту (стеноз аорты, дефект межжелудочковой перегородки) и практически не встречаются при пороках с большим объемом потока через аорту (при тетраде Фалло).
Исходя из особенностей внутрисердечной гемодинамики плода, для диагностики коарктации аорты были предложены косвенные признаки патологии в антенатальном периоде: дилатация правого желудочка и его гипертрофия (см. рис. 3), дилатация легочной артерии [6, 7, 14]. Авторы считают, что это достоверные признаки и встречаются они достаточно часто (в 18 из 24 случаев верифицированных диагнозов коарктации аорты). Поэтому была предложена оценка индексов отношения полости правого желудочка к левому (в норме - 1,1) и легочной артерии к аорте (у здоровых - 1,2). Исходя из увеличения этих параметров, можно предположить наличие затрудненного выброса в аорту или гипоплазию дуги аорты. Тем не менее, по данным предложивших эти косвенные признаки авторов, такие изменения выявляются только в 30% наблюдений (рис. 4).

Рис. 4. Диспропорция размеров желудочков сердца при коарктации аорты. RV - правый желудочек; LV - левый желудочек; AO DESC - поперечное сечение нисходящего отдела аорты.
Во второй половине 90-х гг. было опубликовано несколько работ, посвященных изучению диагностической ценности увеличения правого желудочка и уменьшения левого желудочка при коарктации аорты. Авторы, опубликовавшие эти результаты [2], считают, что чем раньше проводится исследование (от 14-16 до 25 нед гестации), тем оно информативнее для диагностики коарктации аорты. Доказательством могут служить данные, полученные D. Brown и соавт. [15]. В представленных исследованиях коарктация аорты отмечена у 8 (62%) из 13 плодов с диспропорцией размеров желудочков до 34 нед и только у 6 (21%) из 29 плодов после 34 нед беременности. Несмотря на то, что более половины случаев коарктации аорты сопровождается диспропорцией размеров желудочков, что достаточно легко выявляется при изучении четырехкамерного среза сердца плода, во многих исследованиях в Норвегии она не была диагностирована, даже при обязательном скрининговом изучении размеров сердца до 18 нед беременности [9].
Такие прoтиворечивые результаты можно объяснить гемодинамической теорией [16, 17]. Внутриутробно в восходящий отдел аорты поступает 50% суммарного выброса крови, в нисходящую - 65%, а через перешеек аорты всего лишь 25%. Исходя из уменьшенного объема кровотока возникает его физиологическое сужение, которое усугубляется лишь после рождения.
Допплеркардиография, позволяющая оценить кровоток, информативна лишь при выраженном сужении аорты [18]. При этом возникает обратная зависимость максимальной скорости кровотока в восходящем и нисходящем отделах аорты. В норме скорость в восходящем отделе немного преобладает над скоростью нисходящего отдела.
При перерыве дуги аорты отмечается ретроградный кровоток заполнения участка дуги аорты после перерыва через открытый артериальный проток и отсутствие прямого кровотока на уровне перерыва.
И, наконец, последняя причина не диагностированной коарктации аорты заключается в частоте сочетания с другими аномалиями сердца. Изолированная коарктация аорты составляет всего лишь 15-18%. По данным M. Campell и P. Polani [19], процент сочетания коарктации аорты с кардиальными аномалиями колеблется от 13 до 18%. Наиболее часто (85%) коарктация аорты сочетается с двустворчатым аортальным клапаном [20], нередко сочетается с фиброэластозом эндомиокарда, распространяющимся на выходной тракт левого желудочка и на межжелудочковую перегородку. Возможно, при коарктации аорты аномальное отхождение правой подключичной артерии или обеих подключичных артерий от нисходящей аорты, дистальней коарктации (5%).
Наличие сопутствующей кардиальной патологии может нивелировать типичные для коарктации гемодинамические изменения со стороны сердца плода, на которые обязательно обращает внимание специалист при ультразвуковом исследовании.
Существует еще и понятие как псевдокоарктация, или "кинкинг" аорты - деформация аорты, аналогичная классической коарктации, но препятствие кровотоку незначительное, так как имеется простое удлинение и извилистость аорты (рис. 5).

Рис. 5. Кинкинг аорты у плода в 34 нед беременности. Исследование в энергетическом режиме.
Итак, становится очевидным, что практически ни один из ультразвуковых признаков в антенатальном периоде не имеет высокой степени диагностической точности.
Известно, что диагноз данного порока сердца опирается на прямой признак - визуализацию места сужения аорты, и, возможно, расширение проксимального отдела аорты. Однако четко визуализировать участок сужения аорты у плода достаточно трудно и удается только в единичных наблюдениях. Порок можно увидеть лишь тогда, когда имеется уменьшение диаметра перешейка аорты более чем на 1/3 по сравнению с нормой для каждого срока беременности (см. рис. 2, 3).
Ключом к пренатальной диагностике коарктации аорты является комплексный учет данных, получаемых как при изучении четырехкамерного среза сердца (дилатация правого желудочка, гипоплазия левого желудочка), так и при оценке самих главных артерий. При наличии коарктации диаметр аорты в среднем в 2 раза меньше диаметра дилатированной легочной артерии. Поэтому для диагностики коарктации аорты следует использовать визуализацию самой аорты, что наиболее целесообразно при скрининговой оценке среза через три сосуда. Помощь в диагностике может оказать измерение диаметра артериального протока, который при коарктации аорты широкий.
Окончательный диагноз коарктации аорты устанавливается при использовании среза через дугу аорты, так как чаще всего сужение аорты отмечается в области ее перешейка - на уровне впадения артериального протока. Следует отметить, что сужение может охватывать большой участок аорты вплоть до тубулярной гипоплазии. Нормальный переход дуги аорты в артериальный проток в норме гладкий и плавный. Кроме того, при исследовании аорты по длинной оси наиболее надежным признаком следует считать гипоплазию поперечной части дуги аорты. Как один из косвенных признаков коарктации аорты можно использовать извилистость дуги аорты при изучении ее по длинной оси [2].
Важное дополнительное значение имеет допплерэхокардиографическое исследование, которое при коарктации орты позволяет выявить ускорение и турбулентный характер кровотока в аорте. Однако в антенатальном периоде этот признак может не проявиться [2]. Более надежно выявление левоправого шунта через овальное окно. Предполагается, что этот шунт является компенсаторным механизмом, обеспечивающим уменьшение потока крови в левый желудочек и аорту. G. Sharland и соавт. [18] отметили левоправый шунт через овальное окно у 7 из 12 плодов с коарктацией аорты. У оставшихся 5 плодов обнаруживалось как левоправое, так и праволевое направления потоков крови через овальное окно.
В случаях резко выраженных анатомических изменений аорты и функции левого желудочка с увеличением постнагрузки может наблюдаться сердечная недостаточность [21]. Нарушения гемодинамики и сердечная недостаточность характеризуются антенатально наличием выпота в перикарде, уменьшением сердечного выброса с уменьшением размеров левого желудочка [22].
После рождения и закрытия артериального протока весь поток крови поступает в восходящий отдел аорты и перешеек расширяется до нормального уровня. После рождения, когда проток перекрывается, коарктация аорты приводит к серьезными клиническим проявлениям.
Итак, анализ возможностей и ошибок ультразвуковой диагностики коарктации аорты в пренатальном периоде показывает насколько проблематично поставить диагноз во всех случаях данного порока сердца у плода. К сожалению, все эхокардиографические антенатальные признаки патологии не обеспечивают высокий процент диагностики.
Хочется надеяться, что развитие новых технологий и накопление позитивного и анализ негативного опыта позволят в будущем повысить процент диагностики такого сложного порока сердца с высокой неонатальной смертностью.
Литература
Читайте также:
