Генетические основы рака. Геномика онкологических заболеваний
Добавил пользователь Владимир З. Обновлено: 31.01.2026
Согласно статистике, около 10% онкологических заболеваний имеют наследственный характер. По наследству передается не сама болезнь, а генные мутации, которые обуславливают предрасположенность к возникновению рака.
Механизмы реализации наследственной предрасположенности к раку
Каждый носитель мутированного гена наследственного рака - это потенциальный онкологический пациент. При формировании половых клеток человек получает 50% отцовских и 50% материнских копий гена. Таким образом поврежденный ген достается человеку или от отца, или от матери. Этот ген имеет два признака (две аллели) - один здоровый, другой раковый. Поврежденный аллель содержится только в 50% гамет, следовательно, и риск передачи по наследству дефектного гена составляет 50%. Такая же вероятность наследования мутированного гена существует у родных сестер и братьев пациента. Для отдаленных родственников опасность получения ракового гена снижается прямо пропорционально степени родства.
Человек, с 50% дефектным геном здоров и является только носителем. Чтобы запустился процесс канцерогенеза, необходима еще одна мутация - уже здоровой части гена (аллели). При этом ген полностью инактивируется и не способен выполнять свои функции по контролю и сдерживанию клеточного деления, поддержанию целостности генома - на этом фоне развивается злокачественная трансформация здоровых клеток в раковые. Эта теория получила название «двойного удара».
Рак и генетика
Наследование дефектных генов происходит несколькими путями:
- Наследуется конкретный ген, несущий код определенной формы рака.
- Передаются гены, обуславливающие предрасположенность к развитию онкологических заболеваний под воздействием неблагоприятных факторов внешней среды.
- Наследуется группа генов, склонных к мутациям, которые затем индуцируют формирование злокачественных опухолей.
Запустить процесс онкогенеза в организме способны три группы наследственных нарушений:
- При массивном воздействии средовых факторов (канцерогенов) нормальные гены мутируют в онкогены.
- Когда замедляется процесс ликвидации мутированных генов на клеточном уровне, например, неполная регенерация участков ДНК при их повреждении.
- При наследственных заболеваниях, характеризующихся иммуносупрессией.
Понятие о наследственном и спорадическом раке
Гипотеза о возможном существовании наследственных форм рака была выдвинута еще в начале XX века на примере наблюдения за четырьмя семьями, у которых рак желудка прослеживался в пяти поколениях. Но истинная роль генетических/наследственных факторов онкологических заболеваний была доказана в 60-90 годах XX века после проведения специальных генетических исследований.
Опухоли различных анатомических локализаций бывают наследственными и ненаследственными (спорадическими).
Наследственные (семейные) формы рака составляют 5-10% от всех случаев рака. В основе наследственных опухолей лежат генные мутации в половых клетках, передаваемые из поколения в поколение, они обладают тенденцией скапливаются в семье - отсюда и название «семейный рак».
Разработаны критерии, по которым возможно идентифицировать семейный рак от спорадических случаев:
- Клинические проявления злокачественных опухолей обнаруживаются в молодом возрасте.
- Одновременно поражается несколько разных органов (рак молочной железы и рак яичников).
- Онкологический процесс захватывает сразу оба парных органа (рак обеих почек).
- Тип наследования признаков по законам Менделя.
Не все эти признаки встречаются одновременно, существует много вариаций в их проявлениях даже среди членов одной семьи. Для накопления критического количества мутаций, которые могут спровоцировать развитие онкологии, необходимо время.
У пациентов с наследственными раковыми синдромами одна мутация уже получена от родителей, поэтому «путь к раку» у них занимает меньше времени. Заболевания возникают на 20-25 лет раньше, чем спорадические раки.
Передается ли рак по наследству
Многие полагают, что, если факт наследования рака установлен, то заболевание возникнет обязательно. Наследственная предрасположенность не является 100% неизбежностью заболевания раком. Присутствие одних и тех же мутаций у одних оборачивается развитием рака в молодом возрасте, а другие остаются здоровыми до преклонных лет.
Проводимые исследования не выявили решающего влияния каких-либо внешних факторов на проявления онкологического заболевания. Ученые пришли к выводу, что в развитии рака большую роль играют особенности генетического фона человека.
Выявлены многочисленные варианты последовательности расположения нуклеотидов в цепочке ДНК, которые увеличивают или уменьшают вероятность образования злокачественных опухолей.
Виды передачи наследственных форм рака
Выявлено 8 наследственных синдромов, проявляющиеся семейной предрасположенностью к раку по женской линии.
К наиболее частым формам наследственных опухолевых синдромов относятся рак молочной железы, эндометрия и яичников. На долю рака молочных желез приходится до 5% заболеваемости, на рак яичников - 15%, на рак эндометрия - 3%.
Далее по распространенности следуют злокачественные опухоли желудочно-кишечного тракта, легких, толстого кишечника.
Прохождение генетического тестирования рекомендуется лицам, у кого имеется высокий риск носительства врожденной генетической мутации, определяющий вероятность развития злокачественных новообразований.
В настоящее время невозможно определить у кого из членов семьи с повышенным риском развития злокачественных опухолей разовьется рак, а у кого нет. Поэтому в группу риска включаются все близкие кровные родственники.
- У кровных родственников рак диагностировали в возрасте до 50 лет.
- Локализация опухолей совпадает у разных членов семьи.
- У одного из представителей рода был выявлен рецидивирующий злокачественный процесс.
- Присутствие хотя бы одного из факторов в семейном анамнезе человека является основанием для проведения молекулярно-генетического анализа.
Рак по мужской линии
У мужчин - первые места по распространенности и частоте поражения занимают злокачественные опухоли легких, толстого кишечника, простаты и яичка. Эти формы рака и предшествующие им состояния наследуются по мужской линии:
- аденоматозный полипоз кишечника;
- саркоидоз легких;
- гиперплазия простаты.
Генетическое тестирование в онкологии
Точно узнать есть ли наследственные формы рака у отдельного индивидуума или у его родственников можно с помощью проведения тестов ДНК. Основной целью ДНК-тестов является выделение носителей мутации, которые нуждаются в диагностических и профилактических мерах. Существующий на сегодняшний день перечень ДНК-тестов выявляет признаки онкологической предрасположенности у 1-2% людей.
Генетический прогноз - это основа для выбора дальнейшей тактики клинико-лабораторного мониторинга.
Генетический скрининг у взрослых выявляет предрасположенность к раку следующих органов:
- молочная железа;
- яичники;
- матка;
- кишечник (тонкий, толстый);
- желудок;
- легкие;
- поджелудочная железа;
- щитовидная железа;
- простата;
- кожа.
Это не полный перечень наследственных форм рака, науке на настоящий момент известно более 50 видов.
У представителей некоторых этнических групп наследственная предрасположенность к раку встречается особенно часто, например, у евреев-ашкенази - рак молочных желез и рак яичников из-за присутствия мутаций в генах BRCA1, BRCA2.
Наиболее часто для изучения генов применяют метод полимеразной цепной реакции (ПЦР), которая не всегда обнаруживает мутации, даже при явных признаках «семейного рака». Поэтому в современных генетических лабораториях ДНК-тестирование проводят с помощью метода yRisk или биочипов, которые быстро считывают геном человека и точно выявляют гены, мутация в которых связана с повышенным риском развития рака. Но эти методики не получили широкого распространения на практике в связи с дороговизной.
Цель молекулярно-генетического исследования - это выявление геномных нарушений, определяющих развитие опухоли, степень ее злокачественности, метастатический потенциал и скорость прогрессирования заболевания. Составление карты индивидуального генетического обследования, в которой представлены сведения о конкретных геномных повреждениях, позволит проводить прицельную диагностику и профилактику у данного пациента.
Профилактика семейного рака
Профилактика наследственных форм рака включает раннюю диагностику, своевременное устранение опасных предраковых состояний, повышение устойчивости организма, следование здоровому образу жизни: сбалансированное питание, отказ от вредных привычек, занятия спортом.
Для людей с предрасположенностью к различным видам рака разработаны стандарты первичного обследования для ранней диагностики. Для каждого пациента с высоким риском по развитию онкозаболеваний составляется индивидуальная программа динамического наблюдения.
За рубежом при некоторых разновидностях наследственного рака, как к эффективному способу избежать заболевания, прибегают к превентивным мерам - удалению здорового органа. Ярким примером стала голливудская звезда Анджелина Джоли, которой удалили обе молочные железы и яичники, так как, по прогнозам, риск заболеть раком у нее составлял 87%. Такие радикальные меры профилактики болезни выполняются лишь при высоком уровне риска, который подтверждается генетическими исследованиями. У нас в стране отсутствует правовая база, разрешающая такие операции.
Генетика и онкология: главные вопросы
Что такое онкоген? Как возникают мутации в ДНК? Какие мутации провоцируют рак? Кому и чем могут помочь молекулярно-генетические исследования?
На эти и другие вопросы во Всемирный день ДНК отвечает Александр Олегович Иванцов - доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.

Александр Олегович Иванцов, доктор медицинских наук
— Александр Олегович, что такое мутация? Как возникают «поломки» в молекулах ДНК?
— Организм человека состоит из большого числа специализированных клеток, ядра которых содержат нуклеиновые кислоты: ДНК и РНК. Совокупность этих молекул содержит биологическую информацию, необходимую для построения и поддержания клеток, органов и систем органов в целом. Весь наследственный материал, заключённый в клетке, получил название - геном. У человека он представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре. ДНК является длинной полимерной молекулой, она хранит биологическую информацию в виде генетического кода, состоящего из последовательности повторяющихся блоков — нуклеотидов. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, которые необходимы для последующего биосинтеза важнейших белков. Открытие структуры ДНК в 1953 году стало поворотным моментом в развитии биологии, а исследователям Фрэнсису Крику, Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия в 1962 году. Стойкое изменение генома получило название - мутация. Эти изменения могут касаться структуры отдельных генов, хромосом и генома в целом. То есть изменение последовательности нуклеотидов приводит к нарушениям в кодировании информации - в итоге к аномалиям на уровне качества или количества соответствующих белков.
— Почему некоторые мутации приводят к развитию рака? Как устроен этот механизм? Как ученые определяют, какие именно «поломки» в ДНК приводят к развитию злокачественных опухолей?
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов - клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам - либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. - экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?
— Да, конечно, можно. Спектр генетических повреждений в опухолях характеризуется удивительным многообразием. Например: амплификации (увеличение копийности генов), делеции, инсерции, транслокации, микромутации (точковые замены, микроделеции, микроинсерции) и так далее. Кроме того, в опухоли изменяются уровни экспрессии генов в результате аномального метилирования их промоторов.
Существует много методов, используемых для выявления мутаций в опухолевой ткани, и достаточно много ситуаций, когда это требуется. Выявление определённых мутаций иногда помогает поставить диагноз, определить лечебную тактику, прогноз и так далее. Наиболее часто для молекулярного тестирования используются технологии полимеразной цепной реакции (ПЦР) и секвенирования нового поколения (NGS, next generation sequencing). Обе технологии универсальны и используются для анализа любой генетической последовательности, а также многократно превосходят все другие технологии по своей чувствительности, специфичности и не сопряжены с риском получения «промежуточных», неинтерпретируемых результатов. Секвенирование экзома позволяет выявить все мутации в кодирующих последовательностях генома в каждой конкретной опухоли. Именно полногеномное секвенирование значительно расширяет возможности персонализированного подбора препаратов, предназначенных для специфического поражения мутированных онкобелков.

— Кому и чем могут помочь генетические исследования? Верно ли, что от генетического исследования может зависеть успех лечения? Кому стоит пройти генетическое исследование на мутации?
— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
— Вообще, бывают наследственные и ненаследственные опухоли. Наследственные опухолевые синдромы составляют незначительную долю от общего числа новообразований (около 1%), хотя для определённых локализаций (молочная железа, яичник, толстая кишка) их удельный вклад достигает более высоких показателей (5-20 %). Носительство наследуемой «раковой» мутации является причиной подобного заболевания. В этих случаях, в каждой клетке организма человека есть повреждение, которое передалось ему по наследству. Лица, имеющие такой генетический дефект, остаются практически здоровыми до определенного момента. В то же время они обладают фатально высоким риском возникновения опухолей (85-100%).
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK - кризотиниба - у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF - вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— Какие исследования, связанные с мутациями ДНК, сейчас проводятся в научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»?
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.
На пути к детальному каталогу раковых генов
Создание детального каталога раковых генов — важная задача, выполнение которой позволит подбирать оптимальную терапию онкологического заболевания для каждого пациента. Чтобы составить каталог раковых генов, мутирующих с высокой (>20%) и средней (2-20%) частотой, требуется проанализировать для каждого гена в среднем 2000 пар «опухоль — норма», то есть для 50 наиболее частых типов рака это примерно 100 000 пар. Сейчас это уже не является неразрешимой проблемой, так как за последние 10 лет стоимость секвенирования ДНК уменьшилась в миллион раз и будет уменьшаться еще.
В настоящее время рак занимает второе место среди причин смерти человека, уступая лишь сердечно-сосудистым заболеваниям (ежегодно в мире от рака умирает примерно 8 миллионов человек), а в некоторых развитых странах, например в Дании, рак уже вышел на первое место.
Рак — это сложное, динамически развивающееся заболевание, представленное более чем 200 известными типами и формами. Каждая из них требует индивидуального подхода, индивидуальной стратегии лечения. На генетическом уровне различные раки характеризуются различной «архитектурой» — наборами соматических мутаций, перестроек хромосом, а также эпигенетическими аномалиями, такими как изменение профиля метилирования генов. Следствием этих событий является изменение активности генов и(или) их продуктов.
Детальные сведения об аномалиях, связанных с возникновением и развитием раковых опухолей, требуются для диагностики и результативного лечения рака, для определения оптимальной терапии, а также для разработки новых противораковых средств. Объектами исследований являются аномалии молекулярной структуры ДНК, РНК, белков и эпигенетических аномалий (в частности, метилирования). Именно такой подход принят как генеральная стратегия, реализуемая несколькими национальными и международными консорциумами, которые объединяют десятки институтов, университетов и клиник. В работах участвуют сотни исследователей. Наибольшие успехи и наиболее ценные данные получены в результате поиска генов, связанных с инициацией, развитием и поддержанием злокачественной трансформации клеток.
Онкогены и антионкогены
В организме должен поддерживаться тонкий баланс между активностью генов и их продуктов, которые, с одной стороны, обеспечивают рост и деление клеток, а с другой стороны — предотвращают неограниченные рост и деление. Излишняя активность первых или подавление функции вторых приводят к неконтролируемому росту клеток, возникновению и развитию злокачественных неоплазий — раковых опухолей.
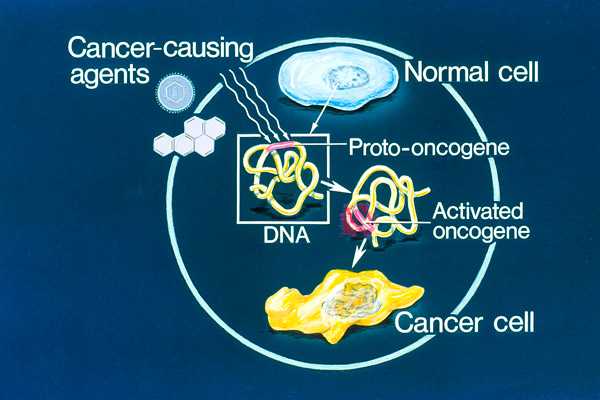
Связанные с раком гены можно разделить на два типа — онкогены и антионкогены (супрессоры опухолей), продукты которых могут, соответственно, стимулировать или подавлять образование и развитие опухолей. Особое место занимают микроРНК (miRNA) — короткие (в среднем ~22 нуклеотида) некодирующие РНК. К настоящему времени идентифицировано примерно 2000 различных микроРНК. Они способны подавлять трансляцию мРНК, считываемую с 30-60% генов человека. Некоторые микроРНК (oncomiR) способствуют злокачественной трансформации клеток, другие могут работать как антионкогены. В онкоген может превратиться нормальный ген — протоонкоген (рис. 1), который стимулирует рост клеток постоянно или на определенных стадиях развития организма. Трансформация протоонкогена в онкоген происходит в результате относительно незначительной модификации его естественной функции. Существуют следующие основные пути активации протоонкогена:
1) Мутация внутри протоонкогена или в его регуляторных элементах, которая меняет структуру белка и повышает активность кодируемого им белка (фермента) или усиливает экспрессию соответствующего гена.
2) Повышение концентрации белка из-за повышения его стабильности в клетке, увеличения периода полужизни и, соответственно, повышения активности.
3) Дупликация гена (увеличение количества копий), в результате чего повышается концентрация белка в клетке.
4) Транслокация гена, которая вызывает усиление его экспрессии или возникновение агрессивного гибридного гена.
Онкогенами являются, например, гены семейства Ras (сокр. от ‘Rat sarcoma’) — ГТФазы, участвующие в передаче сигналов, стимулирующих деление клеток.
Функция антионкогенов противоположна функции протоонкогенов. Антионкогены контролируют различные процессы, препятствующие злокачественной трансформации клеток:
1) Подавление избыточной экспрессии генов, обеспечивающих пролиферацию клеток.
2) Осуществление репарации ДНК (повреждения ДНК при подавлении репарации усиливают мутагенез и, как следствие, активацию протоонкогенов и инактивацию антионкогенов).
3) Координация пролиферации клеток с репарацией ДНК. Если репарация ДНК подавлена, они тормозят деление клетки и иницииируют апоптоз.
4) Контроль адгезии и механизмов контактного торможения делящихся клеток.
В общем, антионкогены ставят барьер неограниченному росту клеток. Утрата функции антионкогена разрушает этот барьер. Самым известным и часто мутирующим в раковых опухолях многих типов является антионкоген ТР53. Продукт ТР53 — фосфопротеин регулирующий транскрипцию ряда различных генов. В нормальной клетке он неактивен. При чрезвычайных событиях он активируется и выполняет роль «стража генома», осуществляя различные противораковые функции (рис. 2):
1) Активация системы репарации ДНК.
2) Если ДНК повреждена, ТР53 задерживает митоз делящихся клеток, блокируя переход из G1-фазы в S-фазу и предоставляя системе репарации время устранить повреждения.
3) Если устранить повреждения ДНК не удается, ТР53 включает программу гибели клеток — апоптоз.
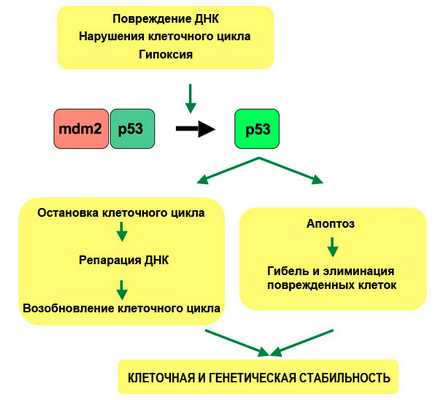
В случае, если рак вызван протоонкогеном, обычно достаточно активации этого протоонкогена на одной из двух парных клеточных хромосом. А вот если рак возник из-за утраты эффекта антионкогена, то, как правило, требуются мутации или потеря обеих его копий.
Сравнительное секвенирование
К настоящему времени идентифицировано примерно 300 онкогенов и супрессоров опухолей. Раковые гены ищут с помощью сравнительного секвенирования — то есть сравнивают последовательности нуклеотидов в ДНК опухолей и нормальных тканей и затем идентифицируют отсутствующие в ДНК нормальной ткани соматические мутации, которые встречаются чаще, чем просто случайные события.
Эта стратегия реализуется в несколько этапов. Во-первых, требуется получить образцы опухолевой ткани от пациентов с достоверно поставленным диагнозом и детально описанной картиной течения заболевания. При этом образцы должны быть, по возможности, свободны от нормальных клеток. Для сравнения используются пробы нормальной ткани или крови пациента. Из ткани опухоли и нормальной ткани выделяют ДНК и иссследуют их с помощью секвенирования. В последнее время секвенирование проводится с помощью платформ нового поколения, позволяющих быстро и сравнительно недорого полностью секвенировать геном человека. Результаты сравнительного секвенирования затем анализируются с помощью специально разработанных весьма сложных математических и биоинформатических методик (рис. 3).

Рис. 3. На целостность генома воздействуют внешние факторы, такие как ультрафиолетовое излучение, сигаретный дым или вирусные инфекции. Разные участки генома мутируют с различной частотой при различных формах рака. Результаты сравнения последовательности нуклеотидов в ДНК опухолей и нормальных тканей анализируются с помощью математических и биоинформатических методик, которые учитывают частоты и спектр мутаций, порядок, в котором происходит репликация сегментов ДНК по всей длине хромосомы, а также уровень экспрессии генов, — это позволяет найти гены, достоверно мутирующие при раке. Рисунок из статьи L. Ding и M. Wendl, 2013. Differences that matter in cancer genomics
Генеральной целью этих проектов является создание детального каталога аномалий структуры генома, связанных с инициацией, прогрессией и поддержанием онкологических новообразований. Такой каталог позволит не только получить много новых данных по молекулярной биологии рака, но и усовершенствовать методы диагностики, лечения и профилактики рака, определять новые мишени для разработки противораковых средств. Систематические исследования в этом направлении уже позволили идентифицировать много новых раковых генов и даже целые классы раковых генов.
«Атлас раковых геномов»
К настоящему времени уже проанализированы данные, полученные на больших выборках «опухоль — нормальная ткань» по более чем 30 формам рака. Наиболее заметных успехов добился реализуемый главным образом институтами и университетами США консорциум «Атлас раковых геномов» (The Cancer Genome Atlas) с многозначительной аббревиатурой TCGA — этими же буквами обозначают четыре нуклеотида, входящих в состав ДНК. Основанный в 2005 году, TCGA регулярно публикует в ведущих научных журналах результаты своих исследований. Рассказать обо всех публикациях консорциума здесь не представляется возможным. Приведем лишь результаты из последней статьи, посвященной плоскоклеточным ракам головы и шеи. Эта гетерогенная группа раков — шестая по частоте встречаемости и составляет ~5% всех случаев рака в мире.
В исследованиях участвовали 348 авторов. Было проанализировано 279 пар «опухоль — норма». Большинство опухолей, связанных с вирусами папилломы человека, имели мутации в спиральном домене онкогена PIK3CA. Обнаружены новые аномалии, включающие утрату TRAF3, амплификацию участвующего в контроле клеточного цикла гена E2F1. В опухолях, связанных с курением, почти всегда наблюдались инактивирующие мутации генов TP53 и CDKN2A, обнаруживались амплификации участков хромосом 3q26/28 и 11q13/22. Опухоли ротовой полости, сравнительно благоприятные с точки зрения возможности лечения и шансов на выздоровление, содержали активирующие мутации генов HRAS или PIK3CA в сочетании с инактивирующими мутациями генов CASP8, NOTCH1 и TP53. В случаях других подгрупп этого рака найдены инактивирующие мутации гена NSD1, продукт которого связан с перестройками хроматина, инактивирующие мутации генов AJUBA и FAT1, контролирующих ферменты сигнального пути Wnt, мутации, активирующие фактор оксидативного стресса NFE2L2.
«Умеренные» и «редкие» онкогены
Некоторые связанные с раком гены мутируют довольно часто — при многих или, по крайней мере, при нескольких типах рака. Поэтому неудивительно, что именно они (в частности, TP53) были охарактеризованы первыми. Но большинство раковых генов обнаруживаются с умеренной частотой (2-20%) или реже. Основные проблемы возникают при идентификации редких раковых генов. Так, недавнее исследование 183 аденокарцином легких показало, что у 15% пациентов не обнаруживается ни одной мутации в 10 известных для этого заболевания классах генов, а в 38% случаев идентифицировано три или менее мутаций (M. Imielinski et al., 2012. Mapping the Hallmarks of Lung Adenocarcinoma with Massively Parallel Sequencing).
Вследствие повреждения систем репарации ДНК в раковых клетках в той или иной мере усиливается мутагенез. Частота этих индуцированных опухолью соматических мутаций для различных опухолей может различаться на несколько порядков. Поэтому при идентификации «умеренных» и особенно «редких» генов возникает существенная проблема: как отличить гены и мутации, связанные с раком, от фона, от многочисленных случайных мутаций, не имеющих отношения к раку?
Гарвардская группа под руководством Г. Гетца (G. Getz) разработала программный пакет MutSig (сокр. от ‘Mutation Significance’), анализирующий частоты и спектр мутаций в различных областях генома при различных формах рака, а также ряд других факторов, и позволяющий вычленить гены, достоверно мутирующие при раке.
Мутации, достоверно связанные с раком
В двух статьях (M. S. Lawrence et al., 2013. Mutational heterogeneity in cancer and the search for new cancer-associated genes и M. S. Lawrence et al., 2014. Discovery and saturation analysis of cancer genes across 21 tumour types) авторы изучили собранные из различных баз данных результаты анализа экзомов (кодирующих областей генов — экзонов с прилежащими к ним последовательностями ДНК-некодирующих промежутков — интронов) 4742 пар «опухоль — нормальная ткань», принадлежащих к ракам 21 различных типов. Количество образцов для отдельных типов варьировало от 35 до 892.
Были обнаружены 3 078 483 единичные замены нуклеотидов в опухолях по сравнению с нормальной тканью, 77 270 единичных делеций или вставок нуклеотидов, 29 837 ди-, три- или олигонуклеотидных делеций или вставок. Из единичных замен нуклеотидов подавляющее большинство (2 294 935) не изменяло кодирующие последовательности. Из остальных единичных замен 540 831 представляли собой так называемые миссенс-мутации (приводящие к заменам аминокислот в белках), 207 144 представляли собой синонимические (не приводяшие к заменам аминокислот) замены нуклеотидов, 46 264 — нонсенс-мутации (приводящие к досрочной терминации синтеза белка), 33 673 — мутации, нарушающие сплайсинг мРНК (сборку кодирующих последовательностей мРНК из соответствующих блоков). Данные по «глубине» секвенирования и чистоте образцов опухолей позволяют оценить чувствительность анализа величиной больше 90% (рис. 4). Частоты возникновения мутаций на единицу длины генома для различных типов рака различались более чем на 5 порядков (от 0,03 до 7000 на миллион нуклеотидов ДНК), сильно различались и спектры мутаций.
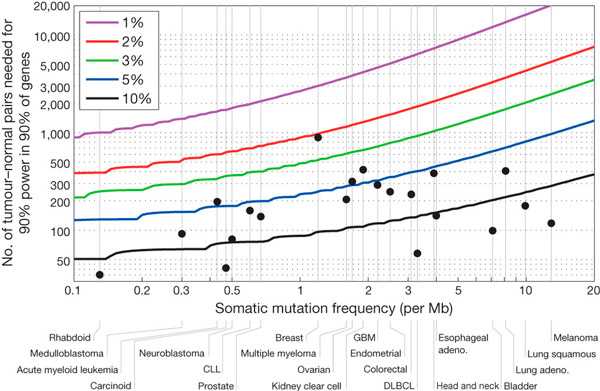
Рис. 4. Количество пар «опухоль — норма» (по оси ординат), необходимых для определения 90% генов, достоверно мутирующих при раке с вероятностью 90%. Оценки приведены в зависимости от типа опухоли, средней частоты фоновых мутаций (по оси абсцисс), превышения частоты мутаций раковых генов над фоном (цветные линии). Для большинства типов опухолей количество проанализированных проб еще недостаточно даже для того, чтобы детектировать гены, мутирующие с частотой над фоном 5% и менее. Черными точками показано количество уже проанализированных проб. Рисунок из статьи M. S. Lawrence et al., 2014. Discovery and saturation analysis of cancer genes across 21 tumour types
Мутации, достоверно связанные с раком, обнаруживались в 224 различных генах. Для различных типов рака число мутантных генов сильно варьировало (от 1 до 58). Для 7 типов оно было меньше 10, а для двух (раки молочной железы и эндометрия матки) — более 30. Только 22 гена оказались достоверно связанными с более чем тремя типами рака. Анализ позволил идентифицировать практически все ранее известные гены, связанные с канцерогенезом. Найдено также 33 гена, мутации в которых ранее не были проассоциированны с раком. Эти гены связаны с делением клеток, апоптозом, стабильностью генома, регуляцией активности хроматина, иммунным ответом, превращениями РНК и гомеостазом белков. Среди еще 81 гена также должны быть гены, связанные с раком.
На основании полученных результатов авторы произвели расчеты: сколько пар «опухоль — нормальная ткань» требуется проанализировать, чтобы найти достоверно мутирующие при раке гены в зависимости от типа рака, частоты мутаций на единицу длины генома при данном типе, частоты мутаций данного гена при данном типе рака. Расчеты показывают, что для 17 из 21 проанализированного типа рака данных еще недостаточно, чтобы выявить гены, мутирующие с частотой не выше 5% от фона. А для 7 типов — даже при частоте не выше 10%. Также определено, что для составления каталога раковых генов, перекрывающих 90% случаев заболевания, требуется проанализировать около 650 пар «опухоль — норма», если средняя частота мутаций составляет ~0,5 на миллион пар оснований ДНК (как при нейробластоме). Или даже около 5300 пар, если частота ~12,9 на миллион (как при меланоме). Всего же, чтобы для ~50 известных типов рака составить каталог соматических мутаций для генов, мутирующих с высокой (>20%) и средней (2-20%) частотой, требуется проанализировать в среднем 2000 пар «опухоль — норма», то есть всего примерно 100 000 пар.
В общем, создание детального каталога раковых генов — важная задача, выполнение которой позволит подбирать оптимальную терапию онкологического заболевания для каждого пациента: воздействия на определенные сигнальные пути или иные процессы, поврежденные в каждом конкретном случае. Такой каталог нужен также для выбора мишеней при разработке противораковых средств, создания новых экспериментальных моделей животных и линий клеток для исследования рака, испытания новых средств и методов лечения.
Источник: Cancer Genome Atlas Network. Collaborators (348). Comprehensive genomic characterization of head and neck squamous cell carcinomas // Nature. 2015. V. 517. P. 576-582.
См. также:
1) Marcin Imielinski et al. Mapping the hallmarks of lung adenocarcinoma with massively parallel sequencing // Cell. 2012. V. 150. P. 1107-1120.
2) Michael S. Lawrence et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes // Nature. 2013. V. 499. P. 214-218.
3) Li Ding & Michael C. Wendl. Differences that matter in cancer genomics // Nat Biotechnol. 2013. V. 31. P. 892-893.
4) Michael S. Lawrence et al. Discovery and saturation analysis of cancer genes across 21 tumour types // Nature. 2014. V. 505. P. 495-501.
Случайность или наследственный фактор? Онколог рассказал о причинах возникновения рака
Чем отличаются наследственные, спорадические и семейные случаи заболеваний раком? Об этом рассказал д.м.н. Александр Олегович Иванцов - старший научный сотрудник лаборатории морфологии опухолей НМИЦ онкологии им. Н.Н. Петрова.
Наш организм состоит из большого числа специализированных клеток. Например, кардиомиоциты обеспечивают сокращения миокарда, лимфоциты выполняют защитную функцию, участвуя в гуморальном и клеточном иммунитете, и т.д. Ядро каждой клетки содержит ДНК. В ней заключена вся биологическая информация, необходимая для создания и функционирования клеток, органов и систем органов в целом. Наследственный материал, заключённый в ядре, представлен 23 парами хромосом ‒ 22 пары аутосом и пара половых хромосом. ДНК представляет собой длинную полимерную молекулу, состоящую из последовательности повторяющихся блоков ‒ нуклеотидов. А последовательность нуклеотидов «кодирует» информацию о различных типах РНК, необходимых для последующего биосинтеза важнейших белков.
Что такое спорадический или случайный рак?
Под влиянием внешних мутагенных факторов, например ‒ курения, ультрафиолетового или ионизирующего излучения, ‒ или спонтанно, чаще всего в процессе удвоения ДНК, в отдельных клетках организма могут происходить мутации, т.е. «поломки» ДНК. Если постепенно в одной клетке накапливается определённое количество повреждений, затрагивающих значимые участки ДНК, то это может привести к развитию опухоли. Такие опухоли называются спорадическими.
Как правило, к злокачественной трансформации приводят мутации, нарушающие баланс клеточного деления и гибели. Известно, что для возникновения трансформированного клеточного клона, т.е. раковой клетки, необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах. Онкогеном называется ген, который в норме способствует процессам деления клеток, в случае возникновения опухоли он активируется избыточно. А антионкогены в норме подавляют процесс деления или способствуют клеточной гибели, и в случае возникновения опухоли их «сдерживающий» эффект выключается. В случаях спорадического рака процесс накопления мутаций достаточно длительный и занимает десятилетия, потому заболевание чаще развивается у людей в зрелом или пожилом возрасте.
Таким образом, спорадические опухоли возникают из-за случайных или обусловленных вредными внешними факторами генетических «поломок» в изначально здоровых клетках организма. Эта группа новообразований является самой многочисленной (до 90 %). Подобные опухоли не передаются по наследству.
Что такое наследственный рак?
С другой стороны, 5-10% случаев возникновения злокачественных опухолей предопределяет наследственность. Это означает, что заболевание возникает из-за мутаций, заложенных в наших генах с самого рождения, они унаследованы от родителей. Это требует определённого пояснения. Каждый человек формируется в результате слияния одной яйцеклетки ‒ 23 хромосомы от матери, и одного сперматозоида ‒ 23 хромосомы от отца. И если в этом наборе хромосом были мутации, то они передаются потомству. После оплодотворения зародышевые клетки быстро делятся, передавая свою мутацию всем последующим поколениям соматических специализированных клеток и клеткам-предшественницам половых клеток.

Таким образом в каждой клетке уже присутствует одна из 5-9 «необходимых» мутаций. Её присутствие обычно компенсируется, организм остаётся здоровым, но количество генетических событий, необходимых для развития рака, уменьшается на 1 - это приводит к фатальной вероятности возникновения опухоли. Новообразования, возникшие у носителей подобных мутаций, называются наследственными.
Доля наследственных форм среди опухолей разных органов неодинакова. К примеру, она достаточно высока для рака яичника, молочной железы, толстой кишки, поджелудочной железы. Носительство мутаций, повышающих риск развития опухолей определённых локализаций, может передаваться по наследству. При большинстве наследственных формах рака вероятность передачи мутации потомству составляет 50%.
Что такое семейный рак?
Термин «семейный рак» описывает ситуацию, когда в пределах одной семьи наблюдается повышенная, по сравнению с популяционной, частота какого-либо одного или нескольких типов опухолей.

Иногда термин «семейный рак» употребляется как синоним наследственного рака, что не вполне верно, так как не во всех семейных случаях удаётся выявить конкретную мутацию, вызывающую заболевание. Семейная агрегация опухолей при этом может быть связана с присутствие других, пока неизвестных генетических особенностей, с наличием общих для членов одной семьи экзогенных вредных воздействий, или же сочетанием тех и других факторов.
Что делать, чтобы не пропустить наследственный или семейный рак?
Медико-генетическое консультирование помогает предположить наследственный характер опухолевого заболевания, определить необходимость генетического тестирования и интерпретировать его результаты, оценить риск развития новообразований у родственников пациента.
Зачем нужно молекулярно-генетическое тестирование?

Молекулярно-генетическое тестирование в ряде случаев позволяет решить важные для врача и онкологического пациента задачи: подтвердить диагноз наследственного рака; оптимизировать тактику лечения пациентов с наследственной опухолью; провести молекулярную диагностику у членов семьи пациента с целью исключения высокого риска развития аналогичных злокачественных новообразований; организовать комплекс мероприятий, направленных на предупреждение и раннюю диагностику онкологической патологии у здоровых родственников пациента; планировать создание семьи и деторождение, прогнозировать здоровье потомства.


Авторская публикация:
Иванцов Александр Олегович
доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Генетик НМИЦ детской онкологии им. Дмитрия Рогачева рассказал о наследственном раке у детей
Обмен опытом между врачами - один из аспектов успешного лечения онкологических пациентов. Специалисты НМИЦ онкологии им. Н.Н. Петрова регулярно проводят научно-практические конференции и консилиумы с коллегами из разных регионов России.
В рамках сотрудничества на популярные вопросы о наследственных опухолевых синдромах у детей ответил Александр Евгеньевич Друй — к.м.н., заведующий лабораторией молекулярной онкологии НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева.

- Как часто у детей развивается наследственный рак?
- Существует два вида детских злокачественных новообразований - 85-90% опухолей развиваются спорадически, то есть случайно, и 10-15% в контексте известных наследственных опухолевых синдромов. На данный момент ученые придерживаются именно таких цифр.
Это может выглядеть несколько странно, ведь не наследственное возникновение опухоли часто можно обосновать воздействием канцерогенов и иных факторов внешней среды на организм. В отношении детей трудно это представить, ведь они прожили еще маленький отрезок времени и не подвергались воздействию мутагенных факторов. При этом, развитие молекулярно-генетических технологий, в будущем, вероятно, приведет к более глубокому пониманию причин возникновения как наследственных, так и спорадических опухолей.
- Как диагностировать у ребенка рак на ранней стадии?
У детей проводить раннюю диагностику рака достаточно трудно. Рассмотрим наиболее часто встречающуюся у детей опухоль - острый лимфобластный лейкоз. Считается, что время от появления первой лейкемической клетки до клинической манифестации опухоли измеряется всего парой недель.
- Во-первых, важно уделять внимание проявлениям и симптомам болезни. В том числе, рак может мимикрировать под неонкологическое заболевания. Например, опухоль кости по своим клиническим проявлениям может быть похожа на травматический перелом, болезни соединительной ткани, ревматоидные заболевания, остеомиелит. Но в целом - применительно к детской онкологии, клинические признаки болезни будут не специфические.
Во-вторых, имеет большое значение онкологическая настроенность педиатров. Здесь очень важно образование врачей. Но стоит отметить, что детские опухоли - это очень редкие события. Считается, что участковый педиатр встречает одну из самых частых детских опухолей - лимфобластный лейкоз - в среднем один раз за всю свою практику.
- У каких детей есть риск заболеть раком, если мы говорим о наследственности?
- В первую очередь стоит обращать внимание на семейный анамнез. Например, если в семье по женской линии встречается BRCА ассоциированный рак молочной железы в молодом возрасте, то это повод внимательнее следить за здоровьем ребенка, поскольку не только РМЖ, а, например, нейробластома, могут развиваться при наличии герминальных мутаций в генах BRCA1 и BRCA2.
В целом - как я уже говорил, наследственный рак - это редкое событие. Если у ребенка есть подозрение на опухоль определенного типа (например, опухоль сосудистого сплетения головного мозга, рак коры надпочечника, ретинобластома), и, возможно, отягощенный семейный анамнез, тогда речь с большей вероятностью идет о развитии онкозаболевания в контексте наследственного опухолевого синдрома.


Беседовала
ИОАННА ЧЕРНОВА
специалист по связям с общественностью НМИЦ онкологии им. Н. Н. Петрова
Санкт-Петербургский государственный университет
Высшая школа журналистики и массовых коммуникаций
Читайте также:
