Гигантизм: признаки, критерии, причины
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Администратор поможет вам выбрать ближайший медицинский центр нашей сети, запишет к нужному специалисту, уточнит дату и время приема.
Гигантизм - патологический рост тела и отдельных его частей в результате избыточной выработки гормона роста. Нередко сопровождается психическим расстройством.
Причины гигантизма
Гормон роста вырабатывает гипофиз. Следовательно, причиной излишней выработки гормона могут стать патологии гипофиза: опухоли, инфекции, травмы и др. Нередко рост организма продолжается низкой чувствительности эпифизарных костей к половым гормонам.
Симптомы заболевания
Гигантизм можно заподозрить уже в детстве. Симптоматика заболевания ярко выраженная.
К основным симптомам гигантизма относятся:
- быстрый рост;
- неестественно высокий рост;
- слабость, утомляемость, снижение работоспособности;
- боли в костях и суставах;
- падение зрения;
- плохая память;
- психические расстройства;
- ранний климакс у женщин;
- половые дисфункции;
- диабет.
Диагностика
Для диагностики гигантизма применяется комплекс мер от осмотра специалистами до лабораторных исследований. Главный лабораторный показатель гигантизма — уровень соматотропного гормона.
Кроме анализа крови, для диагностики назначаются следующие исследования:
- рентгенологическое
- осмотр офтальмолога
- осмотр невролога
- КТ
- МРТ
Лечение
Лечение гигантизма направлено на восстановление нормального уровня гормонов в организме. Для этого применяются половые гормоны или аналоги соматостатина. При наличии опухолей гипофиза назначается лучевая терапия или их удаление.
Гигантизм
Гигантизм - патологическая высокорослость, обусловленная чрезмерной выработкой гормона роста (соматотропного гормона) передней долей гипофиза и проявляющаяся уже в детском возрасте. Наблюдается увеличение роста свыше 2 м, непропорциональность телосложения с преимущественным удлинением конечностей, при этом голова кажется очень маленькой. У больных наблюдается расстройство физического и психического состояния, половой функции. При гигантизме трудоспособность ограничена, высок риск бесплодия. Основным диагностическим критерием гигантизма, помимо яркой клинической картины, является выявление повышения СТГ в крови.
Общие сведения
Гигантизм (или макросомия) развивается у детей с незавершенными процессами окостенения скелета, чаще встречается у подростков мужского пола, определяется уже в возрасте 9-13 лет и прогрессирует на протяжении всего периода физиологического роста. При гигантизме скорость роста ребенка и его показатели намного превышают анатомо-физиологическую норму и к концу пубертатного периода достигают более 1,9 м у женщин и 2 м у мужчин при сохранении относительно пропорционального телосложения. Частота встречаемости гигантизма составляет от 1 до 3 случаев на 1000 населения.
Родители пациентов, страдающих данной патологией, обычно нормального роста. Гигантизм следует дифференцировать с наследственной высокорослостью.
Классификация гигантизма
Современная эндокринология выделяет следующие варианты развития гигантизма:
- Акромегалический - гигантизм с признаками акромегалии;
- спланхномегалия или гигантизм внутренних органов - сопровождается увеличением размеров и массы внутренних органов;
- евнухоидный - гигантизм у пациентов с гипогонадизмом (гипофункцией или полным прекращением функций половых желез), проявляется непропорционально удлиненными конечностями, открытыми зонами роста в суставах, отсутствием вторичных половых признаков;
- истинный - характеризуется пропорциональным увеличением размеров тела и отсутствием отклонений со стороны физиологических и психических функций;
- парциальный или частичный - гигантизм с увеличением отдельных частей тела;
- половинный - гигантизм, сопровождающийся увеличением одной половины туловища;
- церебральный - гигантизм, вызванный органическим поражением головного мозга и сопровождающийся нарушением интеллекта.
Причины гигантизма
Гигантизм и акромегалия являются двумя возрастными вариациями одних и тех же патологических процессов: гиперплазии и гиперфункции клеток гипофиза, продуцирующего соматотропный гормон (гормон роста). Повышенная секреция гормона роста может наблюдаться при поражениях гипофиза в результате опухолей железы (аденомы гипофиза), интоксикации, нейроинфекций (энцефалита, менингита, менингоэнцефалита), черепно-мозговых травм.
Нередко причиной гигантизма служит понижение чувствительности эпифизарных хрящей, обеспечивающих рост костей в длину, к воздействию половых гормонов. В результате этого кости долго сохраняют способность увеличения в длину, даже в постпубертатном периоде. Гиперсекреция соматотропина после закрытия зон роста костей и завершения окостенения скелета приводит к акромегалии.
Симптомы гигантизма
Скачок увеличения длины тела при гигантизме происходит в 10-15 лет. Пациенты отличаются высоким ростом и темпами его увеличения, жалуются на быструю утомляемость и слабость, головокружения, головные боли, ухудшение зрения, боли в суставах и костях. Снижение памяти и работоспособности ведет к ухудшению успеваемости в школе. Гигантизм характеризуется гормональными нарушениями, расстройством психической и половой функции (инфантилизм). У женщин при гигантизме развивается первичная аменорея или раннее прекращение менструальной функции, бесплодие, у мужчин - гипогонадизм. Другими гормональными проявлениями гигантизма служат несахарный диабет, гипо- или гипертиреоз, сахарный диабет. Отмечается сначала увеличение мышечной силы, а затем мышечная слабость и астения.
При гигантизме возможно развитие артериальной гипертензии, миокардиодистрофии, сердечной недостаточности, эмфиземы легких, дистрофических изменений печени, бесплодия, сахарного диабета, нарушений функции щитовидной железы.
Диагностика гигантизма
Диагноз гигантизма устанавливается на основании внешнего осмотра пациента, результатов лабораторных, рентгенологических, неврологических и офтальмологических исследований. При гигантизме лабораторно определяется высокое содержание СТГ в крови.
Для выявления опухолей гипофиза проводится рентгенография черепа, КТ и МРТ головного мозга. При наличии аденомы гипофиза определяется увеличенное турецкое седло (ложе гипофиза). Рентгенограммы кистей рук показывают несоответствие между костным и паспортным возрастом. При офтальмологическом обследовании пациентов с гигантизмом выявляется ограничение зрительных полей, застойные явления в глазном дне.
Лечение гигантизма
Принципы лечения гигантизма аналогичны лечению акромегалии. Для нормализации уровня гормона роста при гигантизме применяются аналоги соматостатина, для более быстрого закрытия зон роста костей - половые гормоны. Этиологическое лечение гигантизма при аденомах гипофиза предусматривает применение лучевой терапии или их оперативное удаление в сочетании с медикаментозной поддержкой агонистами дофамина.
При евнухоидном типе гигантизма лечение направлено на устранение полового инфантилизма, ускорение окостенения скелета и прекращение его дальнейшего роста. Лечение частичного гигантизма включает ортопедическую коррекцию при помощи пластических операций. Применяемое эндокринологами комбинированное лечение гигантизма сочетает гормональную и лучевую терапию и позволяет добиться положительных результатов у значительного числа пациентов.
Прогноз и профилактика гигантизма
При адекватной терапии гигантизма прогноз для жизни относительно благоприятный. Однако, многие пациенты не доживают до старости и погибают от осложнений заболевания. Большинство пациентов, страдающих гигантизмом, бесплодны, их трудоспособность резко снижена.
Обеспокоенность родителей должно вызывать резкое, значительное увеличение роста ребенка в период полового созревания по сравнению с его сверстниками. Своевременное медицинское вмешательство позволит предотвратить осложнения.
Синдром Марфана
Синдром Марфана - дифференцированная форма врожденной соединительнотканной недостаточности, характеризующаяся разнообразными проявлениями скелетной, сердечно-сосудистой и глазной патологии. У больных с синдромом Марфана отмечаются гигантизм, долихостеномелия и арахнодактилия, аневризмы аорты, миопия, эктопия хрусталика, деформация грудины, кифосколиоз, плоскостопие, протрузия вертлужной впадины, эктазия твердой мозговой оболочки. Диагноз синдрома Марфана основан на семейном анамнезе, результатах функционального, офтальмологического, рентгенологического и генетического исследований. Лечение при синдроме Марфана включает консервативную и хирургическую коррекцию сердечно-сосудистых нарушений, поражений скелета и органа зрения.
МКБ-10
Синдром Марфана - системное недоразвитие соединительной ткани в эмбриональном и постнатальном периодах, обусловленное структурными дефектами коллагена и сопровождающееся преимущественным поражением опорно-двигательного аппарата, глаз, сердечно-сосудистой системы. Синдром Марфана - одна из наиболее распространенных наследственных коллагенопатий синдромального характера. Частота встречаемости синдрома Марфана в популяции невысока: по данным различных авторов составляет 1 случай на 10000-20000 человек, без расовой и половой детерминированности.
Причины синдрома Марфана
Синдром Марфана относится к врожденным аномалиям, наследуемым по аутосомно-доминантному типу, с выраженным плейотропизмом, варьирующей экспрессивностью и высокой пенетрантностью. В основе синдрома Марфана лежат мутации в гене FBN1, отвечающем за синтез фибриллина - важнейшего структурного белка межклеточного матрикса, придающего эластичность и сократимость соединительной ткани. Аномалия и дефицит фибриллина при синдроме Марфана приводят к нарушению формирования волокнистых структур, потере прочности и упругости соединительной ткани, невозможности выдерживать физиологические нагрузки. Гистологическим изменениям в большей степени подвержены стенки сосудов эластического типа и связочный аппарат (в первую очередь, аорта и цинновая связка глаза, содержащие наибольшее количество фибриллина).
Широкий фенотипический спектр синдрома Марфана (от легких форм, трудно отличимых от нормы до тяжелых, быстропрогрессирующих) объясняется разнообразием мутаций в гене FBN1 (более 1000 видов), а также присутствием мутаций в других генах (например, в гене трансформирующего фактора роста - TGFBR-2). При генетическом исследовании в 75% случаев синдрома Марфана выявляется семейный тип наследования, в остальных - первичная мутация. Риск рождения ребенка с синдромом Марфана возрастает с увеличением возраста отца (особенно после 35 лет).
Классификация синдрома Марфана
В зависимости от количества пораженных систем выделяют несколько форм синдрома Марфана:
- стертую - со слабо выраженными изменениями в 1-2-х системах
- выраженную - со слабо выраженными изменениями в 3-х системах; выраженными изменениями хотя бы в 1-ой системе; выраженными изменениями в 2-3-х и более системах.
Степень тяжести изменений при синдроме Марфана может быть легкой, средней и тяжелой. По характеру течения дифференцируют прогрессирующий и стабильный синдром Марфана.
Симптомы синдрома Марфана
Синдром Марфана характеризуется сочетанным поражением скелета, глаз, сердечно-сосудистой и нервной систем; многообразием проявлений, варьированием сроков появления первых признаков заболевания; хроническим прогредиентным течением.
Больные синдромом Марфана, как правило, отличаются высоким ростом, относительно коротким туловищем с непропорционально длинными тонкими конечностями (долихостеномелией) и удлиненными паукообразными пальцами (арахнодактилией); астеническим телосложением со слаборазвитой подкожной клетчаткой и мышечной гипотонией; длинным и узким лицевым скелетом (долихоцефалией); наличием высокого аркообразного неба и нарушения прикуса (прогнатии). Средняя длина тела при рождении у мальчиков с синдромом Марфана составляет 53 см, окончательный рост - 191 см; у девочек - соответственно 52,5 см и 175 см.
При синдроме Марфана отмечаются нарушение функции суставов (гипермобильность); деформация грудной клетки (воронкообразная или килевидная форма), деформация позвоночника (сколиоз, кифоз, кифосколиоз, подвывихи и вывихи шейного отдела, спондилолистез), а также плоскостопие и протрузия вертлужной впадины.
Сердечно-сосудистая патология, доминирующая в клинической картине синдрома Марфана и часто определяющая его исход, проявляется дефектами структуры стенок сосудов эластического типа, особенно аорты и крупных ветвей легочной артерии, пороками развития клапанного аппарата и перегородок сердца. Изменения аорты у больных синдромом Марфана характеризуются прогрессирующим расширением ее восходящей части и клапанного кольца (дилатацией, аннулоаортальной эктазией) и аневризмами; поражение митрального клапана - миксоматозной дегенерацией створок, патологическим удлинением и разрывом створочных хорд, обызвествлением клапанного кольца. У плода с синдромом Марфана возможно формирование врожденных пороков сердца - коарктации аорты, стеноза легочной артерии, ДМПП и ДМЖП. Органические и функциональные изменения сердца и сосудов у больных синдромом Марфана часто сопровождаются нарушением ритма (наджелудочковой и желудочковой тахикардией, фибрилляцией предсердий) и развитием инфекционного эндокардита.
Самая неблагоприятная неонатальная форма синдрома Марфана проявляется в классическом варианте уже при рождении, приводит к прогрессирующей сердечной недостаточности и летальному исходу на первом году жизни ребенка.
Для большинства случаев синдрома Марфана характерна патология органа зрения, включающая близорукость, вывих/подвывих (эктопию) хрусталика, уплощение и увеличение размера роговицы, гипоплазию радужной оболочки и цилиарной мышцы, косоглазие, изменение калибра сосудов сетчатки. Эктопия хрусталика при синдроме Марфана имеет двухсторонний характер, часто развивается в возрасте до 4-х лет и устойчиво прогрессирует, ухудшая зрительную функцию.
При синдроме Марфана наблюдается поражение других систем и органов: нервной (эктазия твердой мозговой оболочки, в т. ч. пояснично-крестцовое менингоцеле), бронхолегочной (спонтанный пневмоторакс, эмфизема легких, дыхательная недостаточность), кожи и мягких тканей (атрофические стрии), рецидивирующие паховые и бедренные грыжи, вывихи и разрывы связок, а также эктопия почек, опущение мочевого пузыря и матки, варикозное расширение вен и др.
Характерный для синдрома Марфана высокий выброс адреналина может способствовать постоянному нервному возбуждению, гиперактивности, а иногда развитию неординарных способностей и умственной одаренности.
Диагностика
Диагноз синдрома Марфана основывается на семейном анамнезе, наличии у больного типичных диагностических признаков по результатам физикального осмотра, ЭКГ и ЭхоКГ, офтальмологического и рентгенологического обследования, молекулярно-генетического анализа и лабораторных исследований.
За диагностические критерии синдрома Марфана берутся характерные изменения в различных системах и органах; главными (большими) из них считаются: дилатация корня/расслоение восходящей части аорты, эктопия хрусталика и эктазия твердой мозговой оболочки; килевидная/воронкообразная деформация грудной клетки, требующая хирургического лечения; отношение длины верхнего сегмента тела к нижнему 1,05; сколиоз (> 20˚) или спондилолистез; ограничение разгибания в локтевом суставе (
Также применяются фенотипические диагностические тесты, определяющие соотношение кисть/рост (при синдроме Марфана > 11%); длину среднего пальца (> 10 см); индекс телосложения Варги - (масса тела, г/(рост, см)x2 - возраст, годы/100, должно быть
ЭКГ при синдроме Марфана позволяет определить нарушение ритма сердца, выраженную гипертрофию миокарда; ЭхоКГ - обнаружить клапанную регургитацию, увеличение размеров левого желудочка, пролапс митрального клапана, разрывы хорд, дилатацию аорты. На рентгенографии грудной клетки можно увидеть расширение корня и дуги аорты, увеличение размеров сердца; на КТ и МРТ сердца и сосудов - выявить дилатацию и аневризмы аорты.
Аортография показана при подозрении на аневризму и расслоение аорты. Наличие эктопии хрусталика уточняют с помощью биомикроскопии и офтальмоскопии; протрузию вертлужной впадины устанавливают методом рентгенографии тазобедренных суставов; эктазию твердой мозговой оболочки - МРТ позвоночника.
При синдроме Марфана определяется возрастание (в 2 раза и более) почечной экскреции метаболитов соединительной ткани: глюкозоаминогликанов и их фракций. Метод прямого автоматического секвенирования ДНК позволяет провести генетическую идентификацию мутаций в гене FBN1.
Необходима дифференциальная диагностика с заболеваниями, внешне напоминающими синдром Марфана: гомоцистинурией, врожденной контрактурной арахнодактилией (синдромом Билса), наследственной артроофтальмопатией (синдромом Стиклера), MASS-синдромом, синдромами Элерса-Данлоса, Лойса-Дитца, Шпринцена-Голдберга, семейной эктопией хрусталика и др.
Лечение синдрома Марфана
Лечение и дальнейшее наблюдение пациентов с синдромом Марфана должно осуществляться группой специалистов: офтальмологом, кардиологом, кардиохирургом, ортопедом, генетиком, терапевтом.
Лечение больных с синдромом Марфана направлено на профилактику прогрессирования заболевания и развития осложнений, в первую очередь в сердечно-сосудистой системе. При диаметре аорты до 4 см назначаются β-адреноблокаторы, антагонисты кальция или ингибиторы АПФ. Хирургическое лечение проводится при недостаточности клапанов сердца, пролапсе митрального клапана, значительном расширении (>5 см) восходящей части и расслоении аорты. Реконструктивные операции на аорте при синдроме Марфана, имеют высокий процент послеоперационной 5-ти и 10-ти летней выживаемости. При необходимости выполняют протезирование митрального клапана. У беременных с синдромом Марфана и выраженной сердечно-сосудистой патологией проводят досрочное оперативное родоразрешение путем кесарева сечения. С целью профилактика инфекционного эндокардита и тромбозов после операционных вмешательств назначаются антибиотики и антикоагулянты.
При синдроме Марфана проводится коррекция зрения с помощью подбора очков и контактных линз, при необходимости - лазерное или хирургическое лечение катаракты, глаукомы, удаление смещенного хрусталика с имплантацией искусственного. При выраженных скелетных нарушениях может потребоваться хирургическая стабилизация позвоночника, торакопластика, эндопротезирование тазобедренных суставов. Применяются также патогенетическая коллагеннормализующая терапия, метаболическая и витаминотерапия.
Прогноз
Прогноз жизни больных с синдромом Марфана определяется, в первую очередь, степенью сердечно-сосудистых изменений, а также поражений скелета и глаз. Имеется высокий риск осложненного течения, снижения продолжительности жизни (90-95% не доживают до 40-50 лет) и внезапной смерти. Своевременная кардиохирургическая коррекция при синдроме Марфана позволяет значительно увеличить продолжительность (до 60-70 лет) и улучшить качество жизни больных.
Больные синдромом Марфана должны находиться под постоянным врачебным наблюдением и регулярно проходить диагностическое обследование. При синдроме Марфана показан низкий или средний уровень физической активности, исключающий занятия контактными видами спорта, спортивные соревнования, изометрические нагрузки, подводное плавание. Женщинам детородного возраста с синдромом Марфана необходимо пройти медико-генетическое консультирование.
Гигантомастия - симптомы и лечение
Что такое гигантомастия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Астаховой Марии Андреевны, уролога со стажем в 9 лет.
Над статьей доктора Астаховой Марии Андреевны работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Гигантомастия (макромастия, гипермастия) — это редкое заболевание, связанное с чрезмерной гипертрофией соединительной ткани молочной железы у женщин [1] .
Гестационная гигантомастия — это разновидность заболевания, наиболее часто встречающийся тип. Развивается во время беременности под действием гормональных всплесков прогестерона, пролактина, эстрадиола. Остальные виды (ювенильная, медикаментозная и идиопатическая) встречаются реже. Зачастую авторы в статьях описывают гигантомастию на примере гестационного типа.
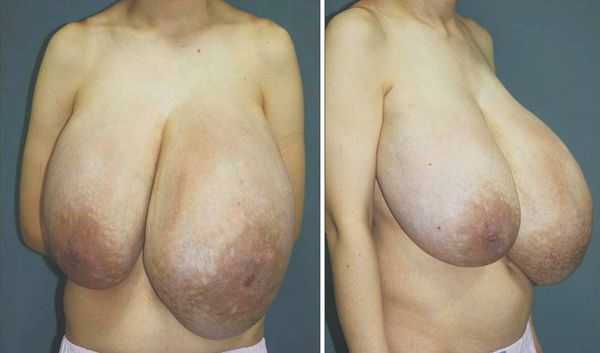
Впервые гестационную гигантомастию описали в 1648 году. Заболевание встречается в одном случае на 28 000—100 000 беременностей. Как правило, состояние развиваться в первом триместре под действием гормонов плаценты. Последствия заболевания чаще наблюдаются у женщин с многоплодными беременностями [3]
Несмотря на доброкачественный характер гигантомастии, она может вызывать опасное состояние и даже смерть от тяжёлой инфекции и сердечно-лёгочной недостаточности [1] .
Причины гигантомастии:
- Нарушение гормонального фона. .
- Половое созревание.
- Чрезмерная чувствительность рецепторов к гормонам — эстрогену, прогестерону и пролактину [9] .
- Повышение при беременности пролактина, прогестерона, эстрогена, тироксина, гормона роста, кортизола, инсулина и человеческого плацентарного лактогена.
- Наследственная предрасположенность.
- Побочный эффект лечения у пациентов с ревматоидным артритом препаратами — D-пеницилламином, циклоспорином и буцилламином. Эти медикаменты изменяют уровень циркулирующего пролактина в крови, что приводит к увеличению молочных желёз [10] .
- Инфекционное поражение груди.
- Аутоиммунные заболевания, такие как миастения, хронический артрит и тиреоидит Хашимото[3] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гигантомастии
Симптомы гигантомастии:
- Быстрый рост груди в период полового созревания (12-18 лет), при беременности или спонтанно. Гипертрофия при беременности обычно начинается в первом триместре или в начале второго и прогрессирует до родов. Чёткое определение, какой объём груди считается гигантомастией, отсутствует. Из обзора медицинской литературы следует, что это увеличение груди, требующее уменьшения более чем 0,8 - 2 кг [11] .
- Ткань молочной железы может разрастаться в одной (односторонняя) или обеих грудях (двухсторонняя).
- Масталгия — боль и дискомфорт в молочных железах.
- Покраснение, зуд, локальное повышение температуры.
- Бесцветные или белесые выделения из молочных желёз.
- Выраженные подкожные вены в области груди.
- Нарушение осанки.
- Боль в шее, плечах, спине [5] .
- Увеличение и смещение сосково-ареолярного комплекса, приводящее к потере ощущения соска из-за хронического вытяжения четвёртого, пятого или шестого межреберных нервов [1] .
- Затруднение движения.
- Подавленная лактация из-за защемления протоков. Это приводит к маститу и нарушению грудного вскармливания [1] .
Патогенез гигантомастии
Факторы, контролирующие рост груди, сложны и не до конца понятны, хотя роль влияния гормонов изучена, и патогенез, по-видимому, связан с чрезмерной выработкой эстрогена и пролактина. Нарушение баланса гормонов приводит к развитию большой и болезненной молочной железы. Это состояние называется гестационной гигантомастией — гиперплазией груди во время беременности. Другая разновидность заболевания — девственная гиперплазия — возникает в период полового созревания на фоне повышения эстрадиола.
Известно, что гормон роста и стероиды также играют роль в развитии заболевания. Но эта причина ещё находится в стадии изучения.
Классификация и стадии развития гигантомастии
Гигантомастию можно разделить на несколько подтипов в зависимости от вызвавшего её события:
Авторы исследования считают, что сверхэкспрессия этих факторов является причиной возникновения идиопатической гигантомастии. В будущем открытие может иметь терапевтическое значение для пациентов.
Осложнения гигантомастии
Пациентки с гигантомастией испытывают социальные и психологические проблемы, а также сложности с движением и дыханием, вплоть до развития дыхательной и сердечной недостаточности. Из-за большой массы молочных желёз женщине тяжело дышать, особенно лёжа на спине. В результате возникает нехватка кислорода. Дефицит кислорода в тяжёлых случаях приводит к гипоксии всех органов, в том числе сердечно-сосудистой системы.
Массивное увеличение груди может сопровождаться истончением кожи, некрозом тканей, инфекцией и кровоизлиянием. Возникают эмоциональные, социальные и психологические проблемы — депрессия и низкая самооценка [13] .
В 2010 — 2013 гг было проведено исследование по изучение образцов ткани молочной железы у пациенток с макромастией. Образцы получили путём редукционной маммопластики. Всего обследовали 198 пациенток, образцы ткани молочных желёз окрасили и изучили под микроскопом. На основании результатов микроскопического наблюдения было выявлено:
- нормальная ткань присутствовала в 98 случаях (49,5 %), в остальных отмечено повышенное содержание жира;
- в 47,5 % случаев наблюдалось доброкачественное фиброзно-кистозное изменение;
- в двух случаях (1 %) обнаружена внутрипротоковая папиллома;
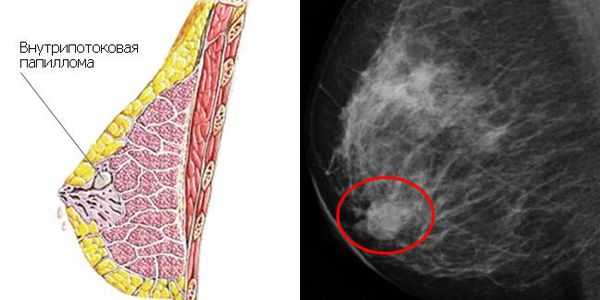
- в четырёх случаях (2 %) — злокачественные образования, в том числе два случая (1 %) с инвазивным протоковым раком (возраст 22 и 31 год) и два случая (1 %) с лобулярной карциномой — предраковым поражением долек молочной железы (возраст 21 и 35 лет);
- с учётом внутрипротоковой папилломы как предракового состояния, общая частота злокачественных образований достигла 3 %.
Таким образом, макромастия может рассматриваться как фактор риска злокачественных новообразований молочной железы. По этой причине после проведения операции по уменьшению или удалению груди крайне важно проводить гистопатологическое исследование [12] .
Диагностика гигантомастии
Диагностика включает осмотр, сбор анамнеза, лабораторные и инструментальные методы.
Медицинский осмотр и сбор анамнеза состоят из определения:
- размера груди;
- роста, веса и индекса массы тела;
- наличия деформации грудной стенки или молочных желёз;
- даты первой менструации и начала роста груди;
- лекарств, которые женщина принимала в течение жизни;
- семейного анамнеза относительно болезней молочной железы — гипертрофии и рака;
- беременности [5] .
При ювенильной гигантомастии диагноз ставится, если грудь быстро выросла вскоре после первой менструации. В большинстве случаев дополнительные диагностические тесты не нужны, если только нет подозрения на другое основное заболевание.
Физическое обследование пациентов с макромастией обычно выявляет нормальное половое развитие с непропорционально увеличенной грудью. Грудь большая, тяжёлая с расширенными ареолами. При осмотре тщательно оценивают качество кожи на наличие бороздок, опрелостей и прощупывают все квадранты груди, выявляя неровности. Во время обследования важно оценить степень птоза (опущения) молочной железы, поскольку это влияет на проведение хирургического лечения [5] .
Лабораторная диагностика включает:
- полное гематологическое и биохимическое исследование, включая уровень кальция и определение уровня гормонов щитовидной и паращитовидной желёз для исключения либо коррекции аутоиммунных заболеваний;
- определение уровня пролактина, прогестерона и эстрогена;
- скрининг антиядерных антител (АNА) для выявления аутоиммунных заболеваний.
Инструментальная диагностика:
- УЗИ молочных желёз. Визуализация с помощью ультразвука или маммографии может быть сложной или технически невозможной. В случаях, когда исследование может быть выполнено, определяются диффузные гипоэхогенные (с меньшей плотностью, чем у соседних тканей) участки с повышенным кровоснабжением [3] .
- При гистологическом исследовании диагностируется значительная долевая гипертрофия, пролиферация протоков и перидуктальный фиброз — образование коллагеновых волокон вокруг млечных протоков. Кроме того, гестационная гигантомастия может сопровождаться обширной дольчатой гиперплазией, расширенными млечными протоками и псевдоангиоматозной гиперплазией — разрастанием ткани молочной железы. [3] . Результаты иммуногистохимического окрашивания для экспрессии рецепторов эстрогена и прогестерона были положительными в более чем 50 % эпителиальных клеток [4] .

Лечение гигантомастии
Лечение гигантомастии бывает консервативным и хирургическим.
Консервативное лечение
После прекращения предполагаемого причинного фактора, такого как медикаменты или беременность, грудь может уменьшиться самостоятельно. В этот период важно использовать удобные поддерживающие бюстгальтеры. Тем не менее, значительная гипертрофия (более 0,6 кг - 2 кг) не регрессирует.
Если есть инфекции и изъязвления, назначают антибиотики и перевязки. Медикаментозное лечение включает терапию даназолом в условиях приёма d-пеницилламина. При гиперпролактинемии применяют агонисты дофаминового рецептора (D2) — бромокриптин или менее токсичный каберголин. Препараты останавливают рост молочных желёз, однако не уменьшают размер груди. Результаты лечения бромокриптином противоречивы, врач может предложить такую терапию, только оценив все риски. Если принимать бромокриптин во время беременности, следует внимательно следить за ростом плода из-за риска задержки внутриутробного развития. При лечении гигантомастии неэффективными оказались диуретики и андрогены [1] .
Оперативное лечение
Хирургическое лечение — это основной метод при гигантомастии.
Предоперационное консультирование включает:
- тщательное обсуждение отдалённых результатов уменьшения груди, включая возможную повторную операцию после беременности или при изменении веса;
- нарушение или невозможность грудного вскармливания после операции [5] .
Оптимальные условия для операции — возраст, когда у пациентки уже сформирован скелет, она не курит и не имеет психологических или физических противопоказаний. Междисциплинарная команда комплексно оценит состояние больной, выявит расстройства пищевого поведения, нестабильные психологические состояния, а также при необходимости предложит консультации и поддержку для снижения веса [5] . Операцию желательно отложить до завершения беременности или до момента достижения плодом жизнеспособности.
Размер груди до операции должен быть одинаковым в течение 6-12 месяцев. Это поможет добиться оптимальных результатов. При ювенильной гипертрофии молочных желёз операцию не следует проводить до тех пор, пока размер груди не станет стабильным. Если до маммопластики стабильность размера груди не достигнута, высока вероятность рецидива.
Варианты лечения включают редукционую маммопластику или мастэктомию с реконструкцией или без неё.
Редукционная маммопластика рекомендована в качестве первой линии лечения макромастии. Операция успешно уменьшает грудь и помогает устранить повреждения кожи и инфекции, связанные с гипертрофией молочной железы.
Мастэктомия — хирургическая операция по удалению молочной железы, предназначена при рецидивах после редукционной маммопластики. Мастэктомия необходима при угрожающих жизни осложнениях гигантомастии, таких как инфекция, кровоизлияние, сердечная недостаточность, массивное кровотечение, изъязвление или некроз молочной железы [1] .
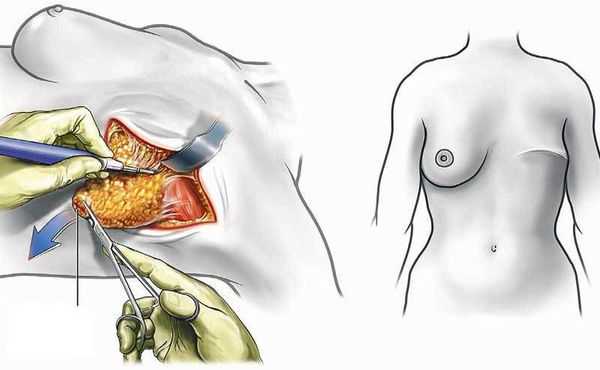
Гестационная гигантомастия может начаться при любой беременности и повториться во время следующих. Крайне важно рассказать пациенткам о рисках рецидивов, особенно при дальнейшей беременности. При массивной гигантомастии может потребоваться свободная трансплантация соска, но она приводит к нарушению лактации. Об этом следует тщательно проинформировать пациентку [1] .
Гиперпролактинемия (повышенный уровень пролактина) является распространённым заболеванием у больных с гестационной гигантомастией. Наилучший вариант лечения — полная мастэктомия. Возможные осложнения во время операции заключаются в тяжёлой анемии и кровотечении.
Мастэктомия с реконструкцией имплантатом — предпочтительный метод лечения. Однако протезы молочной железы ещё не достаточно широко распространены в развивающихся странах, и имплантаты могут приводить к осложнениям.
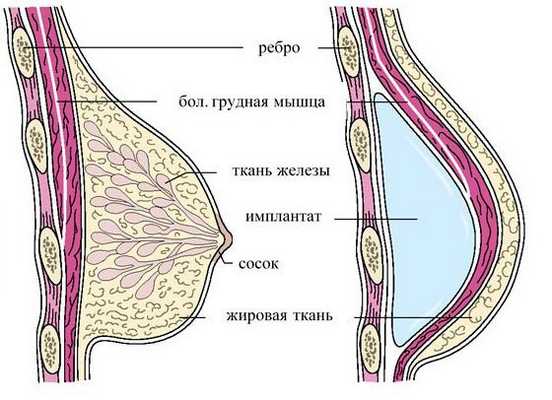
Прогноз. Профилактика
Гипертрофия молочных желёз у подростков может иметь значительные долгосрочные медицинские и психологические последствия. Редукционная маммопластика — безопасный и эффективный метод лечения. Операция может быть единственным способом облегчить социальное, психологическое и физическое напряжение, вызванное макромастией у подростков [5] .
У взрослых женщин косметический дефект также приводит к эмоциональным и психологическим нарушениям — депрессии и социофобии [4] . Пациентки с макромастией сообщают, что грудь препятствует занятиям спортом и вызывает проблемы с движением и дыханием [3] . Многие из этих проблем можно решить с помощью операции по уменьшению груди [5] . Однако несмотря на то, что редукционная маммопластика одна из самых щадящих пластических операций, после неё возможны рецидивы. Для женщин, планирующих беременность, может быть рекомендована полная мастэктомия, поскольку высок риск рецидива после уменьшающей маммопластики.
К мерам профилактики гигантомастиии относится предупреждение ожирения — правильное питание и занятия спортом, а также контроль гормонального фона и приём гормональных препаратов только по назначению врача.
Диагностика и лечение акромегалии и гигантизма
Акромегалия - нейроэндокринное заболевание, вызванное хронической избыточной секрецией гормона роста (СТГ) у лиц с законченным физиологическим ростом и характеризующееся патологическим диспропорциональным периостальным ростом костей, хрящей, мягких тканей, внутренних органов, а также нарушением функционального состояния сердечно-сосудистой, легочной системы, периферических эндокринных желез, различных видов метаболизма) [1].
Гигантизм - нейроэндокринное заболевание, вызванное хронической избыточной секрецией гормона роста, возникающее у детей и подростков с незаконченным физиологическим ростом, характеризующееся пропорциональным ростом костей скелета в длину, приводящее к значительному увеличению роста субъекта [1].
I. ВВОДНАЯ ЧАСТЬ
Название протокола: Диагностика и лечение акромегалии и гигантизма
Код протокола:
Код МКБ-10: Е-22
Сокращения, используемые в протоколе:
СТГ - соматотропный гормон
ИФР-1 - инсулиноподобный фактор роста
МРТ - магнитно-резонансная томография
КТ - компьютерная томография
ОГТТ - оральный глюкозотолерантный тест
Дата разработки протокола: апрель 2013.
Категория пациентов: больные акромегалией и гигантизмом
Пользователи протокола: врачи-эндокринологи поликлиник и стационаров, нейрохирурги, врачи ПМСП, невропатологи, окулисты, врачи других специальностей, выявившие акромегалию впервые.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Классификация
По этиологическому принципу
Спорадическая опухоль гипофиза (соматотропинома)
Эктопическая секреция гормона роста:
- эндокраниальная (опухоль глоточного кольца и сфеноидального синуса)
- экстракраниальная (опухоли поджелудочной железы, легких и средостения)
Эктопическая секреция соматолиберина:
- эндокраниальная (гамартромы, ганглиоцитомы)
- экстракраниальная (карциноид поджелудочной железы, бронхов, ЖКТ)
Синдромы генетических нарушений:
- синдром Мак-Кьюна-Олбрайта
- синдром МЭН-1 (синдром Вермера)
- комплекс Карни
- изолированная семейная низкорослость
Классификация соматотропином по морфофункциональным характеристикам
Моногормональная опухоль гипофиза (соматотропинома):
- плотногранулированная
- редкогранулированная
Плюригормональная опухоль гипофиза:
- продуцирующая СТГ и пролактин (соматопролактинома)
- продуцирующая СТГ и другие гормоны аденогипофиза (смешанные опухоли гипофиза) (1)
По размеру
- микроаденомы (менее 10 мм.) и макроаденомы (более 10 мм.).
По характеру роста
- эндоселлярная,
- экстраселлярная с пара- или супраселлярным ростом (без зрительных нарушений или со зрительными нарушениями),
- инфраселлярная,
- гигантская.
В клинике акромегалии различают: активную стадию и стадию ремиссии, прогрессирующее и торпидное течение [1,2,3].
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ ЛЕЧЕНИЯ
Перечень основных и дополнительных диагностических мероприятий
Основные диагностические мероприятия
Амбулаторно:
- Определение базального уровня СТГ в сыворотке крови 2-3 раза
- Определение в крови уровня пролактина.
- Определение в крови уровня ИРФ-1 (соматомедина-С)
- Компьютерная, либо магнитно-резонансная томография области турецкого седла с контрастированием.
- Оценка состояния глазного дна, области перекреста зрительных нервов, периметрия Голдмана.
В стационаре:
- ОГТТ с 75 г глюкозы с определением СТГ на 0, 30, 60, 90, 120 мин (проводится только у пациентов, не страдающих сахарным диабетом!).
- МРТ или КТ органов грудной клетки и брюшной полости для выявления эктопированной опухоли (при наличии показаний)
Дополнительные диагностические мероприятия
Амбулаторно:
- Определение в крови уровня ТТГ, св. Т4
- Гликемия натощак
- Коагулограмма
- Время свертывания крови
- Кровь на ВИЧ
- Кровь на гепатит «В», «С»
- Кровь на RW
- Липидный спектр крови (холестерин, триглицериды, ЛПНП, ЛПВП)
- Креатинин крови
- АЛТ, АСТ крови
- УЗИ органов брюшной полости и малого таза
- Рентгенография органов грудной клетки
- Определение величины толщины мягких тканей стопы в области пяточной кости. Норма у мужчин до 21 мм, у женщин до 20 мм.
- ЭКГ
В стационаре
- Определение в крови уровня АКТГ, кортизола, ФСГ, ЛГ
- ОГТТ
- ЭХО-кардиография
- Колоноскопия (при наличии показаний)
Диагностические критерии
Жалобы и анамнез:
- укрупнение черт лица, кистей и стоп,
- длительные головные боли,
- ночные апноэ.
Анамнез, как правило, длительный. От момента появления первых симптомов заболевания до постановки диагноза акромегалии проходит от 5 до 15 лет) [1,2].
Физикальное обследование:
Основные клинические проявления [1,2,3]:
- Изменение внешности (укрупнение носа, губ, языка, утолщение кожи, увеличение надбровных дуг), увеличение верхней и нижней челюсти, прогнатия, расширение межзубных промежутков - диастема, увеличение конечностей.
- Увеличение внутренних органов - спланхномегалия
- Себорея, гипергидроз, акне
- Признаки объем ного образования хиазмально-селлярной области: головная боль, нарушения полей зрения, парезы черепно-мозговых нервов, гиперпитуитаризм, гиперпролактинемия
- Парестезии, артралгии, корешковые и туннельные синдромы
- Артериальная гипертензия, кардиомегалия
- Нарушение менструального цикла, галакторея, снихение либидо, потенции
- Нарушение толерантности к глюкозе, сахарный диабет
- Гиперхолестеринемия, гипрертриглицеридемия
- Склонность к новообразованиям (полипы ЖКТ, узловой зоб, миома матки)
Лабораторные методы исследования [1,2,3]:
- Повышение базального уровня СТГ в сыворотке крови в 2-3 и более раз
- Через 2 часа на фоне ОГТТ с 75 г глюкозы уровень СТГ >1 нг/мл (проводится только у пациентов, не страдающих сахарным диабетом!)
- Повышение уровня ИРФ-1 (соматомедина-С) в крови
- Повышение уровня пролактина в сыворотке крови при соматомамматропиномах
Инструментальные методы исследования:
- Наличие аденомы гипофиза при проведении компьютерной, либо магнитно-резонансной томографии с контрастированием.
- Наличие эктопированной опухоли, секретирующей СТГ или соматолиберин
- Увеличение толщины мягких тканей стопы в области пяточной кости. Норма у мужчин до 21 мм, у женщин до 20 мм.
- Изменения на глазном дне и гемианопсия, выявляемые при оценке состояния глазного дна, области перекреста зрительных нервов, периметрии Голдмана.
Показания для консультации специалистов:
- Окулист - оценка состояния глазного дна, полей зрения, зрительных нервов
- Консультация нейрохирурга для решения вопроса об оперативном лечении
- Консультация онколога для исключения новообразований прямой кишки
Дифференциальный диагноз
Дифференциальный диагноз акромегалии [1,2]
| Заболевания | Клиническме проявления акромегалии или гигантизм | Секреция СТГ и ИФР 1 ↑ | Аденома гипофиза | Секреция других гормонов |
| Гипофизарная акромегалия | + | + | + | _ |
| Внегипофизарная акромегалия | + | + | _ | _ |
| Акромегалоидизм | +_ | | - | |
| Гипотиреоз | +_ | _ | _ | ТТГ ↑ Т4↓ |
| Пахидермопериостоз | Изменения кожи, суставов | _ | _ | _ |
| Болезнь Педжета | Изменения костей и суставов | _ | _ | _ |
| Синдром Мак-Кьюна- Олбрайта | Костно-фиброзная дисплазия, локальная дерматопатия, изменения внешности | Повышена у 20% | Аденомы редко | _ |
Лечение
Цели лечения:
- ликвидация (или блокирование) источника гиперсекреции СТГ
- нормализация или снижение до безопасного уровня секреции СТГ и ИФР-1
- устранение клинических симптомов заболевания
- улучшение качества жизни пациентов
Тактика лечения
В настоящее время применяются хирургический, медикаментозный и реже - лучевой методы лечения акромегалии.
Основные факторы, определяющие выбор метода лечения:
- Состояние зрения
- Размеры и характер роста аденомы
- Степень функциональной активности аденомы
- Возраст больного
- Наличие тяжелых сопутствующих соматических нарушений
- Желание больного [2,3,4,5]
При больших размерах аденом гипофиза используется комплексное многоэтапное лечение.
Немедикаментозная терапия:
Стол 9.
Режим щадящий, противопоказан тяжелый труд и пребывание на солнце.
Медикаментозная терапия
В качестве медикаментозной терапии используются два класса препаратов - аналоги соматостатина и агонисты дофамина.
Препараты первого ряда - аналоги соматостатина длительного действия
Ланреотид длительного действия 60 - 120 мг 1 раз в 28 дней, п/к (6,7,8)
Октреотид длительного действия 10-30 мг 1 раз в 28 дней в/м(9,10)
Аналог соматостатина короткого действия октреотид в дозе 100 мкг 3 раза в день п/к используется редко (для непродолжительного лечения).
Показания к терапии аналогами соматостатина длительного действия (1,4,5,7)
1. При неэффективности хирургического лечения
2. После хирургического лечения и (или) лучевой терапии до реализации эффекта от облучения
3. Как монотерапия при наличии противопоказаний или отказе больного от оперативного лечения
4. Для предоперационной подготовки с целью улучшения состояния больного и уменьшения размеров опухоли в течение 6 и более месяцев
Аналоги соматостатина длительного действия нормализуют СТГ и ИФР-1 у 60 -70% больных [2,,4,5,6]. Эффективность действия препаратов нарастает по мере увеличения срока применения.
Побочные эффекты: покраснение и болезненность в месте инъекции, повторный жидкий стул в первые 2-3 дня после введения препарата, встречаются редко и по мере увеличения срока терапии проходят. У части пациентов отмечается застой желчи и камнеобразование.
Препараты 2 ряда - агонисты дофамина
Агонисты дофамина показаны при относительно невысокой активности заболевания и обязательно назначаются при сопутствующей гиперсекреции пролактина [2,3,4,5].
В РК применяются агонисты дофамина:
Бромкриптин от 10 до 20 мг/сут в 2-4 приема, эффективно снижает секрецию СТГ только 10% пациентов.
Каберголин в дозе от 0,5 мг 3 раза в неделю до 0,5 мг ежедневно, нормализует секрецию СТГ только у 30% [4,5]
Консервативная терапия чаще применяется как дополнительная к хирургическому и (или) лучевому лечению. Проводится длительно, часто пожизненно.
Другие виды лечения
Лучевая терапия
В последние годы показания к лучевой терапии сузились, применяется только при неудовлетворительном эффекте от хирургического и медикаментозного лечения [2,3,4,5]
Стереотоксическая гамматерапия - гамма-нож,* облучение одномоментное в дозе до 90 грей.
Протонотерапия *- одномоментное облучение области гипофиза потоком тяжелых протонных частиц в дозе 50-70 Грей, применяется при опухолях размером не более 1,5 см и позволяет достичь ремиссии заболевания у 39-46 % больных в сроки от 1 до 5 лет.
Возможно повторное проведение облучения (не ранее, чем через 1 год) при наличии роста аденомы гипофиза.
Осложнения лучевой терапии: гипопитуитаризм, постлучевая энцефалопатия, неврологические нарушения, постлучевые некрозы, снижение качества жизни [2,3,4,5]
Эффект от лучевой терапии наступает через 5-10 лет у 60-70% больных [3,4].
Хирургическое лечение - метод первого выбора в терапии акромегалии.
Преимущество этого метода - быстрота наступления эффекта: уже в раннем послеоперационном периоде в случае полного удаления аденомы отмечается нормализация секреции гомона роста.
В подавляющем большинстве случаев применяется транссфеноидальная аденомэктомия под контролем нейронавигации. Транскраниальный доступ применяется редко.
Выбор метода определяется размером аденомы и степенью экстраселлярного распространения. При необходимости последовательно применяются оба метода. Хирургический метод позволяет достичь ремиссии заболевания в 30-50% случаев удаления макроаденомы, и в 70-80% - в случае удаления микроаденом гипофиза [1,2,3].
АЛГОРИТМ ЛЕЧЕНИЯ АКРОМЕГАЛИИ
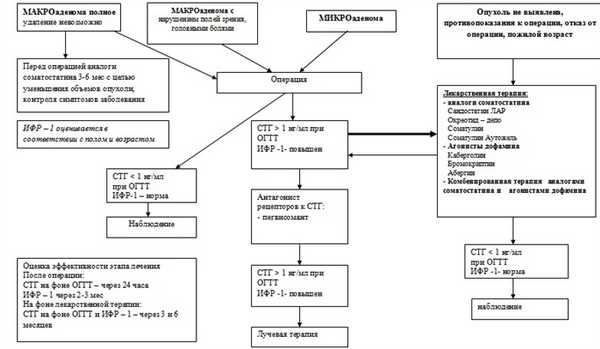
Профилактические мероприятия:
Методы первичной профилактики акромегалии неизвестны.
Дальнейшее ведение:
После оперативного лечения и лучевой терапии пациент наблюдается и при необходимости получает медикаментозную терапию у эндокринолога по месту жительства.
Эффективность хирургического вмешательства контролируется определением ИРФ-1 или проведением ОГТТ с определением СТГ в раннем послеоперационном периоде - на 5-8 сутки и через 3, 6 и 12 месяцев.
Один раз в год проводится определение ТТГ, свТ4, кортизола, половых гормонов.
Эффективность лучевой терапии с исследованием ИРФ-1 или проведением ОГТТ с определением СТГ оценивается не ранее, чем через 6 месяцев.
Эффективность лечения аналогами соматостатина должна контролироваться каждые 3-4 месяца (ИФР-1 или ОГТТ с определением СТГ).
У пациентов с медикаментозной ремиссией для определения остаточной функции гипофиза через 1-2 года после начала терапии необходимо прервать лечение на 1 - 2 месяца с контролем ИФР-1. При сохранении нормального уровня ИФР-1 лечение прекращают.
Наблюдение нейрохирурга, КТ и МРТ через 6-12 месяцев. Осмотр окулиста 1 раз в год.
Критерии ремиссии акромегалии [1,2,,4,5]
Полная ремиссия
- Отсутствие клинических признаков активности
- СТГ базальный < 0,4 нг/мл
- Минимальный уровень СТГ на фоне ОГТТ < 1 нг/мл (< 2,7 мЕд/л).
- Нормальный уровень ИРФ-1 соответственно полу и возрасту
Неполная ремиссия
- Отсутствие клинических признаков активности.
- СТГ базальный > 0,4 нг/мл
- Минимальный уровень СТГ на фоне ОГТТ > 1 нг/мл (> 2,7 мЕд/л).
- Повышенный уровень ИРФ-1 соответственно полу и возрасту.
Отсутствие ремиссии
- Имеются клинические признаки активности.
- Минимальный уровень СТГ на фоне ОГТТ > 1 нг/мл (> 2,7 мЕд/л).
- Повышенный уровень ИРФ-1.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе
- Увеличение процента больных, выявленных на ранних стадиях акромегалии
- Увеличение количества больных, достигших ремиссии и неполной ремиссии.
- Уменьшение количества больных с осложнениями после оперативного лечения
Препараты (действующие вещества), применяющиеся при лечении
| Бромокриптин (Bromocriptine) |
| Каберголин (Cabergoline) |
| Ланреотид (Lanreotide) |
| Октреотид (Octreotide) |
Госпитализация
Показания для госпитализации с указанием типа госпитализации
1. Необходимость верификации диагноза акромегалии и определения тактики ведения - плановая госпитализация в региональное специализированное эндокринологическое отделение (7 - 14 дней)*
2. Оперативное лечение в условиях оказания ВСМП, трансназальная аденомэктомия под контролем нейронавигации, - плановая госпитализация в профильные нейрохирургические отделения. Сроки госпитализации от 14 до 21 дня.
3. Динамическое наблюдение и лечение осложнений акромегалии - плановая госпитализация в региональное специализированное эндокринологическое отделение (5-14 дней)*
4. Проведение больному курса гамма-терапии - плановая госпитализация в специализированное радиологическое отделение НИИ онкологии или региональные онкоцентры (6-7 недель)
*Для пациентов, проживающих в региональных центрах, где имеются оснащенные медицинские диагностические центры, возможно амбулаторное обследование и лечение.
Информация
Источники и литература
- Протоколы заседаний Экспертной комиссии по вопросам развития здравоохранения МЗ РК, 2013
- 1. Дедов И.И., Мельниченко Г.А., Акромегалия, М., 2009, 117. 2. Дедов И.И., Мельниченко Г.А., Эндокринология национальное руководство, Под. Ред. Дедова И.И., Мельниченко Г.А.,Москва, «ГЭОТАР - Медиа», 2012, 633 - 646., 3. Генри М. Кроненберг, Шломо Мелмед, Кеннет С., Полонски К., П.Рид Ларсен. Эндокринология по Вильямсу. Нейроэндокринология,Москва, Рид Элсивер, 2010, 277 - 311. 4. Melmed S, Colao A, Barkan A et al (2009) Guidelines for Acromegaly Management: An Update. J Clin Endocrinol Metab 94:1509-1517 5. Laurence Katznelson, John L.D. Atkinson, David M. Cook, Shereer Z. Ezzat, Amir H. Hamrahium, Karen K. Miller. Medical Guidelines for clinical practice for the diagnosis and treatment of acromegaly - 2011 UPDATE. Endocrine Practice. Vol 17 (Suppl 4), July/ august, 2011. 6. Maiza JC, Vezzosi D, Matta M, Donadille F, Loubes-Lacroix F, Cournot M, Bennet A, Caron P (2007) Долговременное (вплоть до 18 лет) воздействие на гиперсекрецию ГР/ ИФР-1 и величина новообразования при первичном приеме аналога соматостатина (SSTa) у пациентов с ГР. Clin Endocrinol (Oxf) 67:282-288 7. Cozzi R, Montini M, Attanasio R, Albizzi M, Lasio G, Lodrini S, Doneda P, Cortesi L, Pagani G (2006) Первичное лечение акромегалии с применением октреотида LAR: длительное (до девяти лет) перспективное исследование эффективности препарата в регуляции активности заболевания и уменьшения новообразования. J Clin Endocrinol Metab 91:1397-1403
Информация
III. ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков протокола
1. Базарбекова Р.Б. - д.м.н., профессор, зав. кафедрой эндокринологии РГКП «Алматинский государственный институт усовершенствования врачей»
2. Косенко Т.Ф. - к.м.н., доцент кафедры эндокринологии РГКП «Алматинский государственный институт усовершенствования врачей»
3. Досанова А.К. - к.м.н., ассистент кафедры эндокринологии РГКП «Алматинский государственный институт усовершенствования врачей»Рецензенты: д.м.н., профессор кафедры эндокринологии КазНМУ имени С.Д. Асфендиярова Нурбекова А.А.
Указание на отсутствие конфликта интересов - отсутствует
Указание условий пересмотра протокола: данный протокол подлежит пересмотру каждые три года, либо при появлении новых доказанных данных по проведению процедуры реабилитации.
Читайте также:
